Method Article
Silenciamiento de genes mediado por Lentiviral en pseudoislet humano preparado en placas de baja fijación
En este artículo
Resumen
Se presenta un protocolo para crear pseudoislotes humanos modificados genéticamente a partir de células de islotes humanos dispersas que son transducidas por lentivirus que transportan ARN de horquilla corta (ARN de shRNA). Este protocolo utiliza enzimas y vasos de cultivo fácilmente disponibles, se puede realizar fácilmente y produce pseudoislotes humanos modificados genéticamente adecuados para estudios funcionales y morfológicos.
Resumen
Hay varias herramientas genéticas disponibles para modular genes en islotes pancreáticos de roedores para diseccionar la función de los genes de los islotes para la investigación de la diabetes. Sin embargo, los datos obtenidos de los islotes de roedores a menudo no se reproducen completamente en o son aplicables a los islotes humanos debido a diferencias bien conocidas en la estructura y función de las islotes entre las especies. Actualmente, las técnicas que están disponibles para manipular la expresión génica de los islotes humanos son muy limitadas. Introducción de transgén en islotes intactos por adenovirus, plásmido, y oligonucleótidos a menudo sufre de baja eficiencia y alta toxicidad. La baja eficiencia es especialmente problemática en los estudios de regulación genética en islotes intactos, que requieren una alta eficiencia. Se ha sabido que las células de los islotes dispersos enzimáticamente se reagregan en cultivo formando esferoides llamados pseudoislotes. La reagregación controlada por tamaño de las células de los islotes humanos crea pseudoislotes que mantienen la secreción dinámica de insulina en primera fase después de un cultivo prolongado y proporcionan una ventana para introducir eficientemente ARN de horquilla corta lentiviral (ARN) con baja toxicidad. Aquí, se describe un protocolo detallado para la creación de pseudoislotes humanos después de la transducción lentiviral utilizando dos placas multipocillos disponibles comercialmente. El protocolo se puede realizar fácilmente y permite una regulación eficiente de los genes y la evaluación del dinamismo de la secreción de insulina utilizando células de isla humana. Por lo tanto, los pseudoislotes humanos con modulación génica mediada lentiviral proporcionan un modelo potente y versátil para evaluar la función génica dentro de las células de los islotes humanos.
Introducción
La pérdida de masa beta celular funcional es la patologíacentral de la diabetes tipo 1 y tipo 2 1. Si bien las células beta son los productores de insulina en los islotes pancreáticos, lacomunicación entre las células beta y las células no beta desempeña un papel crítico en la regulación de la secreción de insulina 2. Además, la desregulación de la secreción de glucagón contribuye a la hiperglucemia en la diabetes3. Por lo tanto, existe un gran interés en modular la expresión génica de las células dentro de los islotes pancreáticos para abordar el mecanismo detrás del desarrollo de la disfunción de los islotes en la diabetes. Una variedad de enfoques, incluyendo ratones transgénicos están disponibles para modular la expresión génica de islotes de ratón. Sin embargo, los islotes humanos y de ratón muestran una inervación distinta, distribución celular, relación de células beta a alfa y respuesta a secretagogos4. Por lo tanto, la evaluación directa de la función génica en los islotes humanos es extremadamente importante para entender la fisiopatología de los islotes pancreáticos humanos.
El vector adenoviral es el vector viral más utilizado para transducir islotes pancreáticos in vitro debido a la alta eficiencia de la transducción en células no divisorias. Sin embargo, el adenovirus no penetra en el núcleode los islotes de manera eficiente, especialmente en los islotes humanos 5, y es citotóxico a dosis altas6. Comparativamente, el vector lentiviral es menos citotóxico y suministra genes exógenos permanentemente en el cromosoma de lascélulas postmitoticas, lo que lo convierte en un vehículo ampliamente probado para la terapia génica 7. Sin embargo, la capacidad del lentivirus para penetrar en el núcleo de los islotes humanos intactos también es limitada, por lo que requiere la dispersión parcial por digestión enzimática para aumentar la eficiencia de transducción8. La salvedad con la dispersión de islotes humanos intactos es la interrupción de la comunicación célula-célula y célula-matriz, que compromete la regulación dinámica de la secreción de insulina crítica para el mantenimiento de la homeostasis de glucosa en humanos9. Por lo tanto, ha sido difícil evaluar el impacto de la modulación génica en la regulación dinámica de la función de los islotes en un modelo de islotes humanos.
Se ha sabido que las células de los islotes dispersos de los islotes humanos y roedores se reagregan de forma autónoma en estructuras similares a islotes llamadas "pseudoislotes". Los pseudoislotes muestran una distribución de células beta y no beta similar a los islotes nativos10,11. Además, después de un cultivo a largo plazo,los islotes nativos pierden progresivamente la secreción de insulina robusta de primera fase 5,10,11,12. Sin embargo, los pseudoislotes demostraron una mejor preservación de la secreción de insulina de primera fase en respuesta a la glucosa en comparación con los islotes nativos después del mismo período de cultivo5. Además de tener una mejor preservación de la secreción de insulina, la reagregación controlada por tamaño de las células de los islote humanos en placas de baja fijación11 proporciona una ventana de oportunidad para introducir vectores de lentivirus antes de su reagregación en pseudoislatas. Varios estudios han demostrado la utilidad de los pseudoislotes combinados con la transducción mediada lentiviral. 13 informaron que la introducción de la proteína fluorescente verde (GFP) que expresaba el lentivirus tenía poco efecto sobre la secreción de insulina mientras se logralaba la expresión homogénea de GFP en pseudoislotes de rata en comparación con el control no infectado. También demostraron el efecto específico de las diferentes conexiones en la secreción de insulina al sobreexpresar las connexinas 32, 36 y 43 a través de lentivirus13. Los pseudoislotes humanos preparados con una placa de fijación ultrabaja de 96 pocillos disponible comercialmente demostraron que la sobreexpresión mediada por lentiviral del factor de transcripción SIX3 mejora la secreción de insulina evaluada por incubación estática14. Recientemente, los pseudoislotes humanos preparados con una placa de unión ultrabaja de 96 pocillos se utilizaron para regular la glucoquinasa a través de ARN de horquilla corta lentiviral (shRNA) como prueba de principio para demostrar que la secreción de insulina estimulada por la glucosa se reduce, mientras que La secreción de insulina estimulada por KCl se conservó5. El estudio también demostró que los pseudoislotes humanos son similares a los islotes nativos en la expresión génica y los perfiles secretores, apoyando aún más la utilidad de los pseudoislotes humanos para diseccionar la regulación de la función de islotes5. Aunque no se realizó la perifusión, también se informó que una placa de cultivo de micropocillos bioingeniería que recientemente estuvo disponible comercialmente, también era compatible para la transducción lentiviral y producía pseudoislotes humanos que mostraban una excelente insulina secreción in vitro e in vivo después del trasplante11. Colectivamente, la formación de pseudoislotes humanos combinados con la transducción lentiviral es un enfoque simple y eficiente para investigar la fisiopatología de los islotes humanos, proporcionando una valiosa herramienta para realizar estudios mecánicos en islotes humanos.
En el informe actual, se presenta un protocolo para formar pseudoislotes humanos transducidos con lentivirus utilizando dos plataformas disponibles comercialmente, una placa de fijación ultrabaja de 96 pocillos y una placa de cultivo de micropocillos. Ambos logran una modulación eficiente de la expresión génica y crean pseudoislotes humanos que son compatibles con las evaluaciones posteriores, incluida la incubación estática y la perifusión.
Protocolo
Antes del inicio de los estudios, la Junta de Revisión Institucional de la Universidad de Iowa hizo una determinación de investigación de sujetos humanos, que determinó que el estudio no cumplía con los criterios para la investigación de sujetos humanos. Consulte a la junta de revisión local antes del inicio del estudio para determinar si la fuente de los islotes y el estudio planificado requiere aprobación previa.
NOTA: Típicamente, 1,200-1,400 islotes equivalentes (IEQ) de islotes humanos son necesarios para la formación de 192 pseudoislotes en el tamaño de 3.000 células/pseudoislotes en una placa de unión ultra baja de 96 pocillos o 1.200 pseudoislotes del tamaño de 500 células/pseudoisquimos en un placa de cultivo de micropocillos. IEQ de islotes requeridos varía entre diferentes preparaciones de islotes humanos como factores de donante (edad, salud, peso), eficiencia de aislamiento, y condiciones de cultivo afectan el rendimiento de la suspensión de una sola célula. En este protocolo, se utiliza el lentivirus que contiene shRNA dirigido a un gen de interés. Los vectores lentivirales basados en el promotor del citomegalovirus (CMV) y el fosfoglicuro humano quinasa (hPGK) se notifican para regular el gen de manera eficiente en pseudoislotes humanos5,15. El uso de lentivirus requiere precaución como riesgo biológico16. Póngase en contacto con el comité local de bioseguridad antes del inicio del uso de lentivirus.
1. Cultura de la noche de los islotes humanos para la recuperación después del envío
- Preparar los laboratorios de investigación médica Connaught 1066 (CMRL-1066) medio complementado con 1% de albúmina sérica humana (HSA) mediante la combinación de 50 mL de CMRL-1066, 0,5 g de HSA, 0,5 ml de penicilina-estreptomicina, y 0,5 ml de CML de 100 mg/ml de glutarlámina biológica (1% HSA) gabinete de seguridad (BSC) y pasar a través de un filtro de 0,2 m para la esterilización.
- Gire suavemente la botella de envío para mantener los islotes en suspensión. Transfiera el medio de envío que contiene islotes a un tubo centrífugo cónico de 50 ml. Deje que el tubo se siente en BSC durante 15 minutos para que los islotes se asienten en la parte inferior del tubo.
- Retire el medio de envío suavemente sin molestar el pellet de isla utilizando una pipeta de 10 ml. Vuelva a suspender el pellet de islet en 1% HSA CMRL a una concentración de 400 IEQ/mL.
- Transfiera los islotes a un plato tratado con cultivos no tisulares. Si los islotes se dividen en varios platos, mantenga los islotes uniformemente suspendidos en medio girando suavemente antes de dividirlos. Islotes de cultivo a 37oC en una incubadora de CO2 al 5% durante la noche.
NOTA: Se requiere el uso de un plato tratado con cultivo no tisular para evitar la unión de islotes a la placa.
2. Preparación de la suspensión de una sola célula a partir de islotes humanos
- Prepare lo siguiente: CMRL-1066 medio con suero bovino fetal 10% inactivado por calor (HiFBS), penicilina-estreptomicina y glutamina (10% HiFBS CRML) a temperatura ambiente (RT), un colador de 40 m, una placa Petri de 35 mm, una jeringa de tuberculina de 1 ml y un hemocitómetro.
- Transfiera los islotes humanos después del cultivo nocturno en un tubo centrífugo cónico de 15 ml. Centrífuga a 190 x g durante 5 min en un rotor de cucharón oscilante. Medio aspirado con una pipeta de 5 ml sin molestar el pellet de isla.
- Lavar el pellet añadiendo 10 ml de solución salina con fosfato (PBS) en el tubo, mezclar suavemente y centrifugar a 190 x g durante 5 min. Aspirar PBS sin alterar el pellet de isla.
- Vuelva a suspender el pellet de islotes en 0,5 ml de una mezcla de enzimas proteolíticas y collagenolíticas precalentadas y pipetas 5x utilizando una pipeta P1000 para mezclar islotes. Incubar a 37oC durante 5 min. Mezclar pipeteando hacia arriba y hacia abajo suavemente 1 x 5 veces.
NOTA: El pipeteo agresivo aumentará la pérdida celular. - Compruebe si hay nubosidad (células únicas) y el número de escamas (islotes no digeridos). Añadir 2 x 3 min a 37 oC de incubación dependiendo de la extensión de la digestión juzgada por la nubosidad y el número de escamas. Detener la digestión cuando las escamas se reducen a un 10 % de predigestión y la solución está turbia.
NOTA: El tiempo requerido para la digestión varía dependiendo de la distribución del tamaño del islote de cada preparación de islote humano. - Coloque un colador de 40 mm en una placa Petri de 35 mm y moje el colador añadiendo 1 ml de 10% de CMRL HiFBS 10% y presionando con un émbolo de jeringa de 1 ml. Transfiera toda la suspensión celular en la parte superior del colador y recoja el paso en un tubo fresco de 15 ml.
- Lavar el tubo utilizado para la digestión de los isla con 0,5 ml de medio CMRL fresco para recoger las células sobrante sobras y pasar el lavado a través del colador. Combine el paso en un tubo de 15 ml. Repita una vez.
- A continuación, disocia los islotes no digeridos que permanecen en el colador presionando el colador colocado en un plato de 35 mm con un émbolo de jeringa de 1 ml. Recoger el paso de nuevo y lavar el colador con CMRL-1066 fresco para eliminar todos los islotes digeridos restantes del colador y el plato. Un total de 3 ml de suspensión de una sola célula ahora estará en el tubo de 15 ml.
- Registre el volumen total de la suspensión celular y tome una alícuota de 10 l de células para contar el número de célula en un hemocitómetro.
- Centrifugar la suspensión celular durante 5 min a 200 x g. Retire el medio sin molestar el pellet. Continúe con el paso 3.1.1 si utiliza una placa de fijación ultrabaja de 96 pocillos o el paso 3.2.1 si utiliza una placa de cultivo de micropocillos de 24 pocillos para volver a agregar las células.
3. Formación y Transducción de Pseudoislet por Lentivirus
- Protocolo con una placa de fijación ultrabaja de 96 pocillos
- Determine el número deseado de celdas por pseudoislet y el número de pseudoislotes que se va a crear. Típicamente, 1,000-3,000 células se utilizan para cada pseudoislet para una placa de fijación ultrabaja de 96 pocillos. Para 3.000 células por pseudoislet, ajuste la suspensión celular a 1 x 105 células/ml resuponiendo el pellet de isla del paso 2.10 en 10% HiFBS CMRL de modo que 30 l de suspensión celular tenga 3.000 células. Calcule el volumen total de 1 x 105 celdas/ml de suspensión de una sola celda (ml) requerida utilizando la siguiente ecuación:
El volumen total de 1 x 105 celdas/ml de suspensión de una sola celda (mL) á (número de celdas por pseudoislet) x (número de pseudoislotes que se están haciendo) / 1 x 105.
NOTA: Ajustar la concentración de la suspensión celular en función del número deseado de células por pseudoislet de modo que 30 l de suspensión celular haga un pseudoislet. - Transfiera el volumen requerido (30 l x número de pseudoislotes que se están realizando) de suspensión de una sola célula a un tubo nuevo de 15 ml. Añadir 250 unidades de transducción (TU)/célula de lentivirus que contengan ARNh dirigido a un gen de interés o control.
PRECAUCION: El lentivirus se clasifica como nivel de bioseguridad 2 y puede integrarse en el ADN de las células infectadas.
NOTA: Utilice lentivirus concentrado para que el volumen de lentivirus añadido sea mínimo. El valor requerido por célula para el silenciamiento eficiente del gen puede diferir dependiendo de la construcción lentiviral. - Mezclar la suspensión celular con el virus pipeteando suavemente 5 veces con una pipeta P1000. Transfiera las células mixtas a un depósito de reactivo estéril de 50 ml si utiliza una pipeta de 8 canales.
- Dispensar 30 l por pozo de suspensión de una sola célula mezclado con lentivirus en cada poca utilizando una pipeta de 8 canales o una pipeta P200 dependiendo del número de pozos.
- Centrifugar la placa de 96 pocillos en una centrífuga de placa oscilante a 270 x g a RT durante 7 minutos. Compruebe si las células están recogidas en el centro de cada poca. Si no, centrifugar de nuevo como la recolección de todas las células en el centro del pozo es fundamental para la formación de pseudoiselismos. Cultivo a 37oC en una incubadora humidificada de CO2 al 5% durante la noche.
- Añadir 100 l de CMRL HiFBS 10% precalentado por pozo a la mañana siguiente para evitar el secado de las células durante el cultivo posterior. Centrífuga a 270 x g, RT para 7 min. Cultivo a 37oC en una incubadora de CO2 al 5%. Los pseudoisleguillos completarán la formación en 5 o 7 días.
- Al cosechar pseudoislotes, precaliente el volumen deseado de 10% HiFBS CMRL (100 ol por islotes), prepare un depósito estéril de 50 ml, una placa estéril de 10 cm Petri y una pipeta de 8 canales en BSC.
- Retire la placa de 96 pocillos de la incubadora y colóquela en BSC. Pipeta de 100 l por isla de 10% HiFBS CMRL en un depósito.
- Pipetear 100 l por pozo de 10% HiFBS CMRL desde un depósito a pseudoislotes y pipeta arriba y abajo 2 x 3 veces suavemente en el pozo para levantar los islotes. Luego, aspirar el medio en el pozo que contiene un pseudoislet y expulsar en una placa Petri de 10 cm. El uso de una pipeta de 8 canales permite la transferencia de 8 pseudoisleguillos a la vez.
- Compruebe la placa bajo un microscopio de luz para asegurar la eliminación completa de todos los pseudoislotes. Los pseudoislotes forman agregados firmes y permanecen agregados después de la elevación. Los pseudoislotes ya están listos para experimentos posteriores.
- Determine el número deseado de celdas por pseudoislet y el número de pseudoislotes que se va a crear. Típicamente, 1,000-3,000 células se utilizan para cada pseudoislet para una placa de fijación ultrabaja de 96 pocillos. Para 3.000 células por pseudoislet, ajuste la suspensión celular a 1 x 105 células/ml resuponiendo el pellet de isla del paso 2.10 en 10% HiFBS CMRL de modo que 30 l de suspensión celular tenga 3.000 células. Calcule el volumen total de 1 x 105 celdas/ml de suspensión de una sola celda (ml) requerida utilizando la siguiente ecuación:
- Protocolo utilizando una placa de cultivo de micropocillos de 24 pocillos
- Caliente la solución de enjuague anti-adherencia (Tablade Materiales)a RT para una formación eficiente de esferoides. También, pre-cálido simple CMRL-1066 y 10% HiFBS CMRL.
- Añadir 500 ml por pozo de la solución de unión antiadherencia a cada pocal de la placa de cultivo de micropocillos de 24 pocillos que se utilizará para pseudoislotes. Centrífuga a 1.300 x g durante 5 min en una centrífuga de placa oscilante.
- Observe la placa bajo un microscopio para asegurarse de que las burbujas de aire se eliminan de los micropocillos. Si las burbujas de aire están atrapadas en micropozos, centrífuga a 1.300 x g durante 5 minutos de nuevo.
- Aspirar la solución de unión antiadherencia de los pozos en un BSC. Enjuague cada pozo con 2 ml de CMRL-1066 liso caliente una vez. Aspirar CMRL-1066. Añadir 0,5 ml/pozo de calor 10% HiFBS CMRL a cada pozo planificado para su uso. Los pozos ya están listos para cargar células de islet humano dispersas preparadas en el paso 2.10.
- Determine el número total de celdas necesarias para cada pocto. Un pozo de placa de cultivo de micropocillos de 24 pocillos contiene 1.200 micropocillos y forma 1.200 pseudoislotes. 500 células por pseudoislet x 1200 micropozos a 6 x 105 células. Resuspenda las células individuales de las células del paso 2.10 a 6 x 105 en 0.8 mL de 10% HiFBS CMRL en un tubo estéril de 1.5 ml.
NOTA: El volumen máximo por pozo es de 2 ml. El volumen de la suspensión celular no debe exceder 1,5 ml. El protocolo describe los pasos para crear un pozo de pseudoislet transducido por lentivirus. Escalar hacia arriba dependiendo del número de pozos a hacer para cada lentivirus. - Para la transducción viral, agregue 125 TU/célula a la suspensión de una sola célula. Mantenga el volumen de virus por debajo de 0,2 ml. Incubar la mezcla celular y de virus a 37oC con mezcla suave ocasional durante 1 h para permitir el contacto de las células con el virus antes de la condensación de las células en el paso 3.2.8.
NOTA: Utilice lentivirus concentrado para que el volumen de lentivirus añadido sea mínimo. El número más bajo de TU por célula se utiliza para el Protocolo 2 en comparación con el Protocolo 1 como el volumen total del medio por número de celda es menor. Sin embargo, el diezmo requerido por célula para el silenciamiento eficiente del gen puede diferir dependiendo de la construcción lentiviral y necesita optimización.
PRECAUCION: El lentivirus se clasifica como nivel de bioseguridad 2 y puede integrarse en el ADN de las células infectadas. - Después de 1 h, ajuste el volumen total de la célula del islet y la mezcla de virus a 1 ml agregando 10% HiFBS CMRL. Si las células se forman abultadas después de 1 h de incubación, disperse en suspensión de una sola célula mediante un pipeteo suave y rápido de 2 a 3 veces. El pipeteo es muy importante para la distribución uniforme de las células a través de micropozos. Transfiera la suspensión celular a un pozo de la placa de cultivo de micropocillos de 24 pocillos.
- Inmediatamente después del pipeteo, centrífuga a 100 x g durante 3 minutos a RT para capturar las células en todos los micropozos. Observe bajo un microscopio para verificar que las células se distribuyen uniformemente en todos los micropozos.
- Cultivo de la placa de cultivo de micropocillos a 37oC en una incubadora deCO2 al 5%. Los pseudoislotes se formarán en 24-48 h. Los pseudoislets se pueden cultivar sin cambio medio durante un máximo de 7 días.
- Al cambiar el medio por cultivo más allá de 7 días, reemplace el 50% y el 75% del medio por cada cambio medio de la siguiente manera. Retire lentamente 0,5 x 1 ml de medio con una pipeta P1000 de cada pocal. Añadir 0,5 x 1 ml de CMRL hiFBS fresco sin espacio libre colocando una punta en la pared del pozo para evitar desalojar pseudoislotes de la placa de cultivo de micropocillos.
- Para prepararse para la cosecha de pseudoislotes, caliente el medio 10% HiFBS CMRL. Los pseudoislotes tienden a flotar en CMRL-1066 libre de suero, lo que dificulta su selección.
- Aspirar 0,5 ml de medio del pozo utilizando una pipeta de 1 ml y dispensar medios de medición con fuerza de vuelta a la superficie de la placa para levantar pseudoisleguillos de la placa de cultivo de micropocillos.
- Aspirar suavemente pseudoislotes desalojados utilizando la pipeta de 1 ml y transfiera los islotes a una placa de 6 pocillos tratada con cultivo no tisular. Pasar a través de un pequeño colador reversible de 37 m colocado en un tubo cónico de 15 ml. Los pseudoisleguillos permanecerán en el filtro; cualquier célula única no incorporada fluirá a través de.
NOTA: Para evitar la pérdida de pseudoislotes de menor tamaño a través del colador, se puede omitir el colador. - Dispensar 1 ml de 10% HiFBS CMRL a través de toda la superficie del pozo para desalojar los pseudoislotes restantes, aspirar pseudoislotes desalojados y pasar a través del colador. Repita 3x para asegurar la colección completa de todos los pseudoisleguillos de los pozos.
- Observe la placa de cultivo de micropocillos bajo un microscopio invertido para asegurarse de que se recogen todos los pseudoislotes. Repita el lavado como en el paso 3.2.14 si quedan pseudoispiés.
4. Extracción de ARN para la evaluación de la eficiencia del silenciamiento genético
- Escoja los pseudoislotes en el PBS libre de RNase en un tubo de microcentrífuga de 1,5 ml y centrífuga a 300 x g durante 3 min a 4 oC. Retire el PBS sin perturbar el pellet de isla y lave una vez con PBS seguido de centrifugación a 300 x g durante 3 min a 4 oC.
- Aspirar la mayor parte de PBS usando una pipeta P1000. A continuación, cambie a una pipeta P10 para eliminar el resto de PBS sin molestar el pellet de isla.
- Añadir 0,5 ml de reactivo de extracción de ARN de guanidinio tiocianato (Tablade materiales)por tubo. Homogeneizar los pseudoislotes utilizando un pestillo motorizado durante 2 a 3 veces. El homogeneato en el reactivo de extracción de ARN de tiocianato de guanidinio ahora se puede almacenar a -80 oC o procesarse para la purificación del ARN.
NOTA: 24 de los 3.000 pseudoislotes celulares formados en una placa de 96 pocillos o 48 de los 500 pseudoislotes celulares formados en una placa de cultivo de micropocillos son suficientes para obtener 0,5 x 1 g de ARN.
Resultados
La Figura 1 ilustra los pasos clave en la producción de pseudoislotes utilizando una placa de fijación ultrabaja de 96 pocillos y una placa de cultivo de micropocillos. La Figura 2a muestra cambios secuenciales en la morfología durante la formación de pseudoislotes de 3 x 103 células de islotes humanos en una placa de unión ultra baja de 96 pocillos. Los grupos monocapa o sueltos de células observadas en el día 1 cambiaron a agregados sólidos con un borde suave y redondo para el día 5 a 7 (Figura2a). En una placa de cultivo de micropocillos, la formación de pseudoislotes sólidos suele ser visible en un plazo de 4 días (Figura2b). Cuando 600 células/micropocillos estaban chapadas en la placa de cultivo de micropocillos, las células de los islote humanos se condensaban en esferoides de tamaño uniforme. Se observa que una placa de cultivo de micropocillos permite la formación exitosa de pseudoisleguillos a partir de un pequeño número de células en comparación con una placa de unión ultrabaja de 96 pocillos. Típicamente, más de 1.500 células/pseudoislet son necesarios para una placa de unión ultra baja de 96 pocillos, mientras que 500 celdas/pseudoislet son suficientes para una placa de cultivo de micropocillos de 24 pocillos. Los pseudoislotes formados con éxito permanecen como esferoides después de la recuperación de una placa de unión ultrabaja 96 o una placa de cultivo de micropocillos y son compatibles para aplicaciones posteriores, incluida la incubación estática (Figura3a)y la perifusión(Figura 3b). El tamaño uniforme de los pseudoislotes reduce la variación dentro de un grupo de prueba y permite la incubación estática utilizando tan solo 5 pseudoislotes por medida (Figura3a). Además, los pseudoislotes humanos mantuvieron una secreción robusta de insulina de primera fase en respuesta a la glucosa después de 7 días de cultivo cuando los islotes humanos originales cultivados durante un período de tiempo similar mostraron una secreción de insulina estimulada por la primera fase con telundencia ( Figura 3b)5. La introducción de lentivirus en una suspensión de una sola célula garantiza la transducción eficiente y homogénea de las células de los isletes y logra una regulación descendente altamente eficiente de los genes como se muestra en la Figura 3c. Todos los resultados mostrados se obtuvieron utilizando islotes humanos de donantes no diabéticos.

Figura 1: Proceso de preparación de pseudoislet humanos. (a) La suspensión que contiene 4.000 IEQ de islotes humanos se vuelve turbia después de la digestión por una mezcla de enzimas proteolíticas y collagenolíticas y un pipeteo suave. (b) Los islotes humanos después de la dispersión se pasan a través de un colador. Los islotes no digeridos que permanecen en la parte superior del colador se dispersan con un émbolo de jeringa de 1 ml. (c,d) Imágenes del microscopio de la suspensión de una sola célula que contiene 3.000 células/pozo en una placa de unión ultra baja de 96 pocillos antes (c) y después (d) centrifugación. (e,f) Imágenes del microscopio de la suspensión de una sola célula que contiene 500 células/micropocillos en una placa de cultivo de micropocillos de 24 pocillos antes (e) y después (f) centrifugación. Barra de escala de 250 m. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Morfología de los pseudoislotes humanos. Cambios secuenciales en la morfología de los pseudoislotes humanos creados (a) en una placa de unión ultrabaja de 96 pocillos a partir de 3.000 células y (b) en una placa de cultivo de micropocillos de 24 pocillos a partir de 500 células. Barra de escala a 100 m. Por favor, haga clic aquí para ver una versión más grande de esta figura.
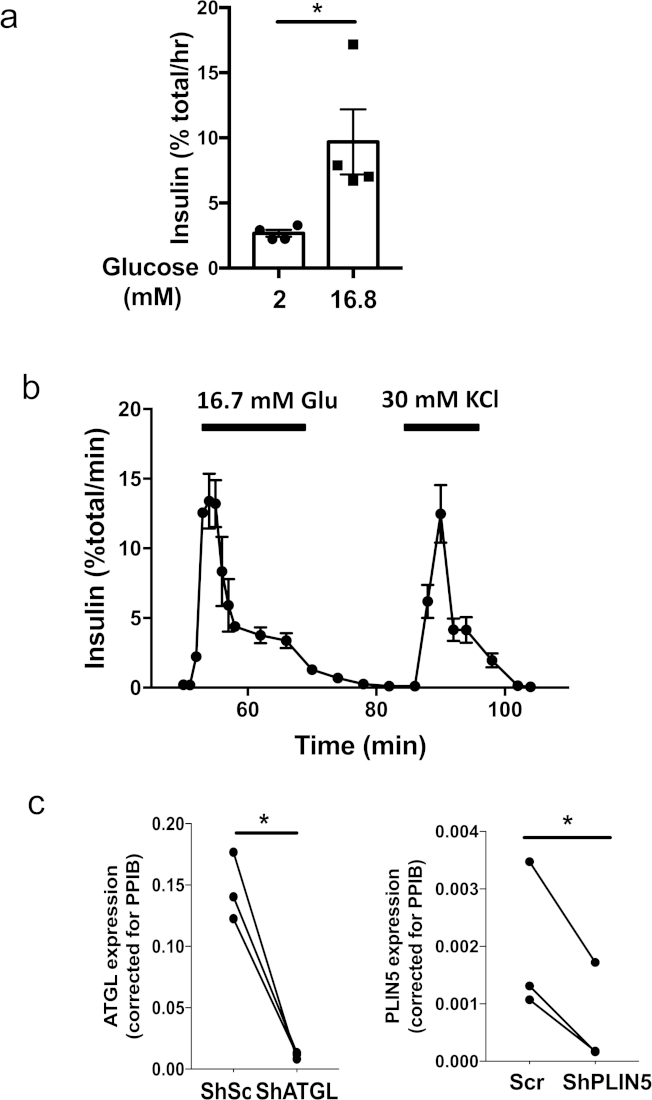
Figura 3: Ejemplos de ensayos funcionales utilizando pseudoislotes humanos. (a) Incubación estática representativa realizada utilizando pseudoislotes humanos creados en una placa de cultivo de micropocillos a partir de un solo donante del tamaño de 500 células de islotes humanos por pseudoislote. Se incubaron cuatro juegos de 5 pseudoislotes durante 1 h en el tampón de bicarbonato Krebs-ringer complementado con glucosa de 2 mM o 16,8 mM. Cada símbolo representa la secreción de insulina de un conjunto de 5 pseudoislotes. Se muestra el error medio (SEM) de media. *, p < 0.05 por la prueba t del estudiante. Resultados representativos de tres donantes. (b) Pruebas representativas de la perfusión de la secreción de insulina a partir de pseudoislotes humanos creados en una placa de cultivo de micropocillos en respuesta a 16,7 mM de glucosa y 30 mM de KCl. El método de perifusión se publicó previamente5. Se muestra la media de sem de secreción de insulina a partir de dos conjuntos de 40 pseudoislotes creados en una placa de cultivo de micropocillos a partir de un solo donante del tamaño de 500 células de islotes humanos por placa de pseudoislet. Datos representativos de seis donantes. (c) Se crearon pseudoislotes con lentivirus portadores de shRNA dirigidos a ATGL humano (dirigido según CCTGCCACTCTATGAGCTTAA, izquierda) o PLIN5 (dirigido según GACAAGCTGGAAGAGAAGCTT, derecha). Los pseudoislotes de control fueron transducidos con lentivirus que expresaban la secuencia codificada (Scr) publicada previamente5. La expresión de ARNm de cada gen se determinó por reacción en cadena de la polimerasa en tiempo real (PCR) como se publicó anteriormente5. Los datos se expresaron utilizando 2-DDCT tomando peptidylprolyl Isomerase B (PPIB) como control interno17. Cada punto representa los datos de cada donante para una imprimación indicada y un conjunto de datos del mismo donante está conectado por una línea. N 3 donantes. *; p < 0.05 por la prueba t del estudiante. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Aquí, se presenta un protocolo detallado para generar pseudoislotes humanos que son transducidos por lentivirus usando una placa de fijación ultrabaja de 96 pocillos o una placa de cultivo de micropocillos. Se ha informado que los pseudoislotes demuestran morfología y funciones secretoras similaresa los islotes humanos nativos y pueden ser cultivados durante un tiempo prolongado in vitro 5,11,18. A diferencia de los islotes humanos nativos que muestran una amplia variación enel tamaño, los pseudoislotes son relativamente uniformes en tamaño, reduciendo la variación entre donantes y las réplicas experimentales 5,11. La regulación descendente de genes que requieren una alta eficiencia de transducción se puede realizar fácilmente antes de la formación de pseudoislotes en suspensión de una sola célula. Este método evita la dificultad de la penetración viral a través de capas de células en islotes intactos. Por lo tanto, este protocolo simple, altamente eficiente y reproducible para la creación de pseudoislotes humanos tiene amplias aplicaciones.
Mientras que se han reportado varias plataformas diferentes para la formación de pseudoislotes12,14,19,20, tanto una placa de fijación ultrabaja de 96 pocillos y una placa de cultivo de micropocillos son comercialmente disponible, permitiendo que esta técnica sea adoptada por cualquier laboratorio. Aunque el método de gota colgante12 también permite la formación de pseudoislotes humanos utilizando labware común, las limitaciones potenciales incluyen la dificultad para controlar el tamaño y la duración de la reagregación de los pseudoislotes. Estas limitaciones se debieron al volumen limitado por gota de pseudoislet y a la evaporación continua durante el cultivo de 5 a 7 días necesario para la formación de pseudoislet. Además, es más fácil contener lentivirus con el uso de una placa de fijación ultrabaja de 96 pozos o una placa de cultivo de micropocillos en comparación con el método de gota colgante.
Varios pasos dentro del protocolo requieren mucha atención. Optimizar la digestión de los islotes intactos con la mezcla de enzimas proteolíticas y collagenolíticas es fundamental, ya que tanto la subdigestión como la sobredigestión reducirán el rendimiento de la suspensión de una sola célula y posteriormente afectarán a la agregación de pseudoislotes. Durante la digestión, es importante vigilar de cerca los islotes para la desaparición de los grumos y el aumento de la nubosidad a medida que los islotes se disocian en células individuales. Es importante tener en cuenta que el tiempo óptimo para la digestión varía entre los islotes de diferentes donantes. El tiempo óptimo depende de varios factores, incluyendo la historia clínica y la edad de cada donante, la duración del tiempo de isquemia, el procedimiento de aislamiento de islote utilizado, el tamaño del islote, la pureza del islote, la viabilidad del islote y las condiciones de envío. Típicamente, se utilizan islotes humanos con viabilidad y pureza superiores al 80% y dentro de los 5 días de aislamiento. El pipeteo cuidadoso y suave durante la dispersión también es importante para mantener la viabilidad y recuperación celular que en última instancia afectará a la agregación celular y el tamaño final de los pseudoislotes que se están formando. Al dispensar la suspensión de células de islotes a pozos (pasos 3.1.4 y 3.2.7), la mezcla suave y completa de células es importante para lograr una distribución uniforme de células individuales en micropozos. Si las células forman grumos después de 1 h de incubación con lentivirus, requiere un suave pipeteo para romper los grumos en suspensión de una sola célula antes de la centrifugación final.
Hemos tenido un éxito similar en la creación de pseudoislotes humanos después de la transducción lentiviral utilizando una placa de 96 pocillos y una placa de cultivo de micropocillos. La elección entre las dos plataformas depende del tamaño y el número de pseudoislets deseados. Una placa de cultivo de micropocillos tiene pequeños fondos en forma de pirámide que permiten la condensación de un número menor de células en comparación con una placa inferior de 96 pocillos. Por lo tanto, el número de células por pseudoislet se puede reducir para una placa de cultivo de micropocillos. Además, un solo paso de centrifugación crea todos los pseudoislotes simultáneamente en una placa de cultivo de micropocillos, mientras que se requiere un pipeteo múltiple para crear pseudoislotes en una placa de 96 pocillos. Por lo tanto, escalar la creación de pseudoisleguillos es más fácil en una placa de cultivo de micropocillos. Sin embargo, la placa de cultivo de micropocillos actualmente disponible no ofrece flexibilidad en el número de pseudoislets que se están creando. Actualmente, el número mínimo de pseudoislotes creados con una placa de cultivo de micropocillos es de 1.200 y solo puede aumentarse por el factor de 1.200. Por lo tanto, normalmente utilizamos una placa de 96 pocillos para experimentos piloto a pequeña escala y para un experimento en el que una pequeña cantidad de muestras es suficiente, como un ensayo de secreción de insulina y la extracción de ARN para la expresión génica. Hemos utilizado pseudoislotes de una placa de cultivo de micropocillos para ensayos que requieren un gran número de células como Western blot, determinación de la tasa de consumo de oxígeno por un analizador metabólico y extracción de triglicéridos.
El principal factor limitante para la generación de pseudoislotes humanos es la pérdida de células durante la preparación de la suspensión de una sola célula. Mientras que 1 IEQ de isla humana se considera que contiene alrededor de 2,000 células, la recuperación de la suspensión de una sola célula es típicamente 30% o inferior debido a lavado múltiple y pasar a través de un colador. La heterogeneidad del tamaño del islote también hace que sea difícil disociar todos los islotes simultáneamente. Mientras que el pipeteo suave y el uso de la mezcla de enzimas proteolíticas y collagenolíticas en el protocolo son esfuerzos para combinar fuerzas mecánicas y enzimáticas para la máxima recuperación de células individuales, todavía hay una pérdida inevitable de células. Por lo tanto, la aplicación de pseudoislotes requiere una justificación clara sobre el estudio de los islotes humanos intactos. También hay que recordar que la secreción de insulina de pseudoislotes es más robusta que los islotes cultivadosdurante el mismo período de la época, pero tiende a ser menor en comparación con los islotes recién aislados 5,11.
Aunque existen limitaciones, el silenciamiento de genes estable y altamente eficiente combinado con una mejor preservación de la secreción de insulina estimulada por glucosa durante un tiempo prolongado en cultivo permiten la evaluación de la función génica en las células de los islote seres humanos. Además, se propone que la compleja comunicación intercelular entre las células beta-beta y beta-non tenga un papel regulador en la función de islet. Sin embargo, actualmente hay información limitada sobre la comunicación intercelular dentro de los islotes humanos. Con una mayor disponibilidad de marcadores específicos de celda21,es factible crear pseudoislotes humanos con composición celular definida, como se informó recientemente en las células de los islotes del ratón22,lo que facilitará una mejor comprensión de la célula celular comunicación entre las células islelas humanas. El avance reciente de la imagen de tejidos tridimensionales también aumenta potencialmente la utilidad de los pseudoislotes humanos como modelo para desenmascarar cómo se regulan la polaridad celular y la comunicación intercelular en los islotes humanos. Por lo tanto, los pseudoislotes humanos proporcionan un modelo útil para diseccionar las funciones de los genes de interés y otras cuestiones en el campo de la biología de los islotes.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado financieramente por los Institutos Nacionales de Salud a Y.I. (R01-DK090490) y la Asociación Americana de la Diabetes a Y.I. (1-17-IBS-132). J.A. e Y.I. cuentan con el apoyo del Centro de Investigación de la Diabetes de la Orden Fraternal de águilas. A.B. cuenta con el apoyo de una beca de capacitación de los Institutos Nacionales de Salud (T32NS45549). Los autores utilizaron islotes pancreáticos humanos proporcionados por el Programa Integrado de Distribución de Islotes (IIDP) financiado por NIDDK en City of Hope (2UC4DK098085).
Materiales
| Name | Company | Catalog Number | Comments |
| Anti-adherence rinsing solution | Stemcell technologies | 7919 | |
| Biological safety cabinet | Thermo Scientific | 1300 Series Type A2 | |
| Cell strainer, 40 micrometer | Corning | 431750 | |
| CMRL-1066 | ThermoFisher | 11530037 | |
| CO2 incubator | Thermo Scientific | Heracell VIOS 160i | |
| Conical centrifuge tube, 15 mL | VWR | 89039-666 | |
| Conical centrifuge tube, 50 mL | VWR | 89039-658 | |
| Fetal bovine serum | ThermoFisher | 26140079 | |
| Guanidinium thiocyanate RNA extraction reagent | ThermoFisher | 15596026 | Trizol |
| Glutamine | ThermoFisher | 25030164 | |
| Hemocytometer | Marien Feld | Neubauer-Improved Bright line | |
| Human serum albumin | Sigma | A1653 | |
| Inverted microscope | Fisher brand | 11-350-119 | |
| Microcentrifuge | Beckman Coulter | Microfuge 20 | |
| Microcentrifuge tube, 1.5 mL | USA Scientific | 1615-5500 | |
| Microwell culture plate | Stemcell technologies | 34411 | Aggrewell 400, 24 well |
| Motor-driven pestle | GAMUT | #399X644 | |
| Non-tissue culture treated dish, 10 cm | Fisher Scientific | FB0875713 | |
| PBS | ThermoFisher | 14190250 | |
| Penicillin-streptomycin | ThermoFisher | 10378016 | |
| Petri dish, 35 mm | Celltreat | 229638 | |
| Pipette, 5 mL | DOT Scientific, | 667205B | |
| Pipette, 8-channel | VWR | #613-5253 | |
| Pipette, 10 mL | VWR | 667210B | |
| Pipette, P10 | Denville | UEZ-P-10 | |
| Pipette, P200 | Denville | UEZ-P-200 | |
| Pipette, P1000 | Denville | UEZ-P-1000 | |
| Proteolytic and collagenolytic enzyme mixture | Sigma | A6965 | Accutase |
| Reagent reservoir, 50 mL | VWR | 89094-680 | |
| Reversible strainer, 37 micrometer | Stemcell technologies | 27251 | |
| Swing bucket plate centrifuge | Beckman Coulter | Allegra X-14R | |
| Swing bucket rotor | Beckman Coulter | SX4750A | |
| Tuberculin syringe, 1 mL | BD | 309659 | |
| Ultra low attachment microplate, 96 well | Corning | 4515 |
Referencias
- Chen, C., Cohrs, C. M., Stertmann, J., Bozsak, R., Speier, S. Human beta cell mass and function in diabetes: Recent advances in knowledge and technologies to understand disease pathogenesis. Molecular Metabolism. 6 (9), 943-957 (2017).
- Hong, H., Jo, J., Sin, S. J. Stable and flexible system for glucose homeostasis. Physiological Review E covering statistical, nonlinear, biological, and soft matter physic. 88 (3), 032711 (2013).
- Cryer, P. E. Minireview: Glucagon in the pathogenesis of hypoglycemia and hyperglycemia in diabetes. Endocrinology. 153 (3), 1039-1048 (2012).
- Arrojo e Drigo, R., et al. New insights into the architecture of the islet of Langerhans: a focused cross-species assessment. Diabetologia. 58 (10), 2218-2228 (2015).
- Harata, M., et al. Delivery of shRNA via lentivirus in human pseudoislets provides a model to test dynamic regulation of insulin secretion and gene function in human islets. Physiological Reports. 6 (20), e13907 (2018).
- Barbu, A. R., Akusjarvi, G., Welsh, N. Adenoviral-mediated transduction of human pancreatic islets: importance of adenoviral genome for cell viability and association with a deficient antiviral response. Endocrinology. 146 (5), 2406-2414 (2005).
- Hughes, A., et al. Gene therapy to improve pancreatic islet transplantation for Type 1 diabetes mellitus. Current Diabetes Reviews. 6 (5), 274-284 (2010).
- Jimenez-Moreno, C. M., et al. A Simple High Efficiency Intra-Islet Transduction Protocol Using Lentiviral Vectors. Current Gene Therapy. 15 (4), 436-446 (2015).
- Bonora, E., et al. Prevalence and correlates of post-prandial hyperglycaemia in a large sample of patients with type 2 diabetes mellitus. Diabetologia. 49 (5), 846-854 (2006).
- Halban, P. A., Powers, S. L., George, K. L., Bonner-Weir, S. Spontaneous reassociation of dispersed adult rat pancreatic islet cells into aggregates with three-dimensional architecture typical of native islets. Diabetes. 36 (7), 783-790 (1987).
- Yu, Y., et al. Bioengineered human pseudoislets form efficiently from donated tissue, compare favourably with native islets in vitro and restore normoglycaemia in mice. Diabetologia. 61 (9), 2016-2029 (2018).
- Zuellig, R. A., et al. Improved physiological properties of gravity-enforced reassembled rat and human pancreatic pseudo-islets. Journal of Tissue Engineering and Regenerative Medicine. 11 (1), 109-120 (2017).
- Caton, D., et al. Lentivirus-mediated transduction of connexin cDNAs shows level- and isoform-specific alterations in insulin secretion of primary pancreatic beta-cells. Journal of Cell Science. 116 (Pt 11), 2285-2294 (2003).
- Arda, H. E., et al. Age-Dependent Pancreatic Gene Regulation Reveals Mechanisms Governing Human beta Cell Function. Cell Metabolism. 23 (5), 909-920 (2016).
- Peiris, H., et al. Discovering human diabetes-risk gene function with genetics and physiological assays. Nature Communications. 9 (1), 3855 (2018).
- Schlimgen, R., et al. Risks Associated With Lentiviral Vector Exposures and Prevention Strategies. Journal of Occupational and Environmental Medicine. 58 (12), 1159-1166 (2016).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 25 (4), 402-408 (2001).
- Li, N., et al. Engineering islet for improved performance by optimized reaggregation in alginate gel beads. Biotechnology and Applied Biochemistry. 64 (3), 400-405 (2017).
- Ramachandran, K., Peng, X., Bokvist, K., Stehno-Bittel, L. Assessment of re-aggregated human pancreatic islets for secondary drug screening. British Journal of Pharmacology. 171 (12), 3010-3022 (2014).
- Hilderink, J., et al. Controlled aggregation of primary human pancreatic islet cells leads to glucose-responsive pseudoislets comparable to native islets. Journal of Cellular and Molecular Medicine. 19 (8), 1836-1846 (2015).
- Saunders, D. C., et al. Ectonucleoside Triphosphate Diphosphohydrolase-3 Antibody Targets Adult Human Pancreatic beta Cells for In Vitro and In Vivo Analysis. Cell Metabolism. (18), (2018).
- Reissaus, C. A., Piston, D. W. Reestablishment of Glucose Inhibition of Glucagon Secretion in Small Pseudoislets. Diabetes. 66 (4), 960-969 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados