Method Article
Функциональная магнитно-резонансная спектроскопия в 7 T в коре ствола крыс во время активации ограничитель выбросов
В этой статье
Резюме
После проверки по крови кислород уровня зависимой функциональной магнитно-резонансной томографии (жирный МР-томографию), соответствующий соматосенсорные баррель коры площади поля (называемый S1BF) правильно активирован, Главная цель этого исследования заключается в количественном определении содержания лактата колебания в активированных крыса мозги на локализованных протонного магнитного резонанса спектроскопии (1H-MRS) в 7 т.
Аннотация
Спектроскопия ядерного магнитного резонанса (ЯМР) предлагает возможность измерения мозгового метаболит содержимое в естественных условиях и неинвазивно. Благодаря технологических разработок последнего десятилетия и увеличение прочности магнитного поля это теперь возможно получить хорошее разрешение спектров в естественных условиях в мозге крыс. Neuroenergetics (т.е., исследование метаболизма мозга) и, особенно, метаболического взаимодействия различных типов клеток привлекают все больше и больше интереса в последние годы. Среди этих метаболического взаимодействия существование лактат Трансфер между нейронами и астроциты все еще обсуждается. Это, таким образом, большой интерес для выполнения функциональных протонного магнитного резонанса спектроскопии (1H-MRS) в мышиной модели активации и монитор лактат мозга. Однако метил лактат пик перекрывается резонанс пиков липидов и трудно поддаются количественной оценке. Описанные ниже протокол позволяет метаболических и лактата колебания контролироваться в районе активированного мозга. Церебральный активации получается путем стимуляции нитевидные и 1H-MRS выполняется в соответствующего активированного баррель коры, чьи области обнаруживается с помощью крови кислород уровня зависимой функционального магнитного резонанса (жирный МР-томографию). Подробно описаны все шаги: выбор анестетиков, катушек и последовательности, достижение эффективного нитевидные стимуляции непосредственно в магнит и обработки данных.
Введение
Мозг обладает встроенные механизмы, которые позволяют регуляции ее основных субстрата (то есть, глюкозы), и за его вклад и его использования, в зависимости от различий в местных мозговой деятельности. Хотя глюкозы является главным энергетическим субстратом для мозга, эксперименты, проведенные в последние годы показали, что лактат, который производится путем астроциты, может быть эффективной энергии субстрат для нейронов. Это поднимает гипотеза лактат Трансфер между астроциты и нейроны1. Известный как ANLS, экзоцитоз нейрон лактат Трансфер2, теория обсуждается до сих пор высоко но привело к предложению что глюкоза, вместо того, чтобы идти прямо в нейроны, могут ввести астроциты, где он метаболизируется в лактат, метаболита , затем переданы нейронов, которые используют его как энергии эффективным субстрат. Если в естественных условияхсуществует такой трансфер, он будет иметь несколько важных последствия, как для понимания основных методов в функциональной мозгового томографии (позитронно-эмиссионная томография [PET]), так и для расшифровки метаболических изменений наблюдается в патологии мозга.
Для изучения метаболизма мозга и, особенно, метаболические взаимодействия между нейронами и астроциты, четыре основные методы доступны (не включая микро-/ Наносенсоры): авторадиографии, PET, два Фотон флуоресцентные confocal микроскопии и миссис. Авторадиографии был одним из первых предлагаемых методов и предоставляет образы региональных накопления радиоактивного 14C-2-deoxyglucose в срезах головного мозга, а PET урожайности в vivo изображения регионального поглощение радиоактивных 18 F-deoxyglucose. Они оба имеют недостаток использования irradiative молекул при производстве низким пространственное разрешение изображений. Двух Фотон микроскопии обеспечивает сотовой резолюции флуоресцентных зондов, но рассеяния света в ткани ограничивает глубину визуализации. Эти три технологии ранее использовались для изучения neuroenergetics грызунов в столбик стимуляции3,4,5,6. В естественных условиях Миссис имеет двойное преимущество неинвазивной и нерадиоактивных, и любой структуры мозга могут быть изучены. Кроме того миссис может быть выполнена во время активации нейронов, называемый функциональный миссис (ОФМ), которая была разработана совсем недавно в грызунов7. Таким образом протокол для мониторинга метаболизм мозга во время мозговой активности 1H-MRS в естественных условиях и неинвазивно предлагается. Процедура описана в взрослых здоровых крыс с активации мозга, полученных путем стимуляции нитевидные воздуха слоеное, выполняются непосредственно в 7 тепловизор магнитный резонанс (МР) T, но могут быть адаптированы в генетически модифицированных животных, а также в любые патологические состояния .
протокол
Все животные процедуры проводились в соответствии с руководящими принципами экспериментов животных директиву Совета европейских сообществ от 24 ноября 1986 (86/609/ЕЕС). Протокол встретился этические принципы французского министерства сельского хозяйства и лесов и был одобрен комитетов местных этики (Comité d «этики pour L» исследования Animale Бордо n ° 50112090-A).
Примечание: Во время измерений MR, адекватный уровень анестезии и физиологического мониторинга (температура тела, частота дыхания) являются необходимым требованиям.
1. Животные
- Использование самцов крыс Wistar, весом от 350 до 450 g.
- Держите их на 12:12 ч света: темные цикла и предоставления продовольствия и воды ad libitum.
2. анестезия
- Подготовка оборудования, необходимого для анестезии (рис. 1A, B, смотрите Таблицу материалы): шприц 5 мл, содержащие medetomidine в растворе физиологического раствора (240 мкг/кг/ч, с частотой перфузии 20 мкл/мин), 0,5 мл шприц содержащие Атипамезола (20 мкл, в 0,5 мл физиологического раствора) и глазную мазь.
Примечание: Сохраняйте все оборудование под вытяжкой, за исключением шприц 5 мл, содержащие medetomidine, который находится в шприцевой насос рядом магнит для анестезии во время приобретения MR. - Место крыса в зале индукции, запустите анестезии, обеспечивая 4% изофлюрановая и отрегулировать скорость потока кислорода до 1,5 Л/мин.
- Оценка глубины анестезии путем оценки вывод лапы рефлексов.
- Когда крыса не реагирует на стимуляцию, взять его из коробки анестезии, поместите его на скамейке с его носом в изофлюрановая маске и поддержания анестезии, обеспечивая 2,5% кислорода в 1,5 Л/мин.
- Мягко массаж хвост и место жгут (рис. 1 c).
Примечание: Массаж может выполняться в теплой воде при температуре между 38 и 42 ° C, чтобы получить лучше вазодилатация вен. - Вставьте периферического внутривенного катетера (22 G), ранее гепаринизированным, в духе левый или правый хвост. Обратите внимание, что наблюдается венозный возврат (капля крови виден на дистальной части иглы) когда катетер правильно вставлен (рис. 1 d).
- Задуть воздушные пузыри в том катетер Мертвое пространство, используя шприц 2 мл, содержащих физиологического раствора раствор и гепарина.
- Примените Глазную мазь и подготовки шприц, содержащие Атипамезола (17 мкг/мл) чтобы пробудить крыса в конце эксперимента.
3. крыса размещение в магнит для стимуляции столбик
- Поместите датчик дыхание на кровати магнит и затем передать крысы из скамейке магнит кровати. Поместите его в лежачем положении с его носом в изофлюрановая маске, с датчиком дыхания, расположенный между грудной клетки и магнит кровати.
Примечание: Все оборудование, которое входит в комнату МРТ должна быть МРТ Сейф. - Уменьшение изофлюрановая (от 4% до 1,5%-2%), во время размещения Крыса и переключитесь анестезии medetomidine в конце этой процедуры. Убедитесь, что правый усы свободны, нарезав правый край в передней части крыса МРТ кровати заранее, чтобы позволить движение усы.
- Держите крыса в положении с лентой и контролировать свое дыхание, которая должна быть между 60 и 80 дыханий в минуту.
- Сделайте парус, который перехватывает все права усы в бумажной ленты (рис. 2). Совместите гибкие трубы системы воздуха слоеного вдоль крыса МРТ кровати так, что часть, выход из трубки перпендикулярна и около 1,5 см от паруса. Исправить это с бумажной ленты.
4. нитевидные стимуляции
- Подключите гибкий впускной трубы из источника сжатого воздуха (1 бар) электромагнитный клапан входа и сливную трубу к выходу Клапан электромагнитный контроль (рис. 3). Убедитесь, что электромагнитный клапан управления остается за пределами комнаты магнит.
- Подключите устройство пульсирующей электромагнитный клапан и в магнит, используя Транзисторно транзисторная логика (ТТЛ)-порт. Настроить его так, что пульсирующий частота = 8 Гц, пульсирующая время = 20 s и время отдыха = 10 s.
Примечание: Эти параметры, визуализируется на небольшой жидкокристаллический экран (LCD), являются регулируемыми через три выделенных аналогическое потенциометры. Электронные пульсирующей устройство, которое контролирует парадигмы, должны состоять из высокого качества электронных компонентов, чтобы избежать любых дрейф в параметры времени (для правильного постобработка).
5. смелые МР-томографию приобретения
- Место мозга крысы, чтобы он был в вертикальном положении и использовать ухо баров для его поддержания. Место объем массива катушки над головой крыса (рис. 4A) и исправить ее с помощью липкой ленты. Проверьте, что парус движется правильно (переднезаднем движения, без вращения и без трения парус) когда система воздуха слоеное это оказалось на; затем выключите его.
- Вставьте кровати и катушка в центре магнита. Проверьте, что парус еще движется правильно, когда кровать находится внутри магнита, когда воздух слоеного система находится на; затем выключите его. Полностью переход от изофлюрановая к medetomidine (скорость перфузии: 20 мкл/мин).
- Проверьте что крысы хорошо расположен с помощью последовательности локализации (TE = 2,5 мс; TR = 100 мс; Средний = 1; повторение = 1; ломтик = 1 мм; Размер изображения = 256 x 256; поле зрения (FOV) = 50 x 50 мм; время сканирования = 12 s 800 мс). Перетащите вкладку последовательность локализатор в инструкции имя и нажмите кнопку продолжить.
- Перетащите вкладку последовательность T2_Star_FID_EPI в инструкции имя, центр ПЗ на середине мозга и перейдите на вкладку Настройка платформы чтобы открыть инструкцию отредактированный сканирования. Записать карту0 B и приступить к сканирования ШИМ.
Примечание: Для карты B0 , используйте следующие параметры: впервые эхо = 1.65 мс; TR = 20 мс, средний = 1; флип угол = 30°; Эхо интервал = 3.805 МС; ломтик = 58 мм; Размер изображения = 64 x 64 x 64; ПЗ = 58 х 58 х 58 мм; время сканирования = 1 м 24 s 920 г-жа для сканирования ШИМ, используйте следующие параметры: voxel селективного возбуждения = паровой Гаусса импульса; TE = 5 мс; время смешивания = 10 мс; приобретение длительность = 204.8 мс; пропускная способность = 10000 Гц; время нахождения = 50 μs). - Начало последовательности T2 Star_FID_EPI (TE = 16.096 МС; TR = 500 мс; Средний = 1; повторение = 600; ломтик = 1 мм; четыре последовательных фрагментов; Размер изображения = 128 x 128; ПЗ = 20 x 20 мм; пропускная способность = 333,333.3 Гц; время сканирования = 5 мин 00 s).
Примечание: Из-за порт ТТЛ, внешний сигнал начнет воздуха слоеного системы в то же время. Парадигма = [20 s активации + 10 s отдых] x 10, для общей продолжительностью 600 сканов, 500 мс за сканирования. Ломтики сосредоточены на середине площади поля баррель. - Приобрести другой последовательности локализации (же, как описано в разделе Шаг 5.3), чтобы сравнить с первой и проверить ли крыса перешла во время последовательности T2_Star_FID_EPI.
- Принести кровать в его начальное положение, удалить катушка массива тома и подключить поверхности катушки.
6. смелые обработка
- Откройте файл T2 Star_FID_EPI и читать T2 Star_FID_EPI изображения в Изображение. Откройте окно Запуск функционального контроллера, называется FunController.
- В этой вкладке, Обработка , выберите функциональные визуализации окна и определить протокол стимуляции (продолжительность и чередование на/Off периоды, соответствующие парадигме используется).
- Выберите окно протокола (dataset с 600 кадров) и вставьте значение 40 в закладке На период и 20 в Off период tab. Нажмите на вкладке Инвертировать атрибуции и перетащите Стимуляции государств ползунок влево, чтобы выбрать значение 1.
- В окне предварительной обработки нажмите на медиана-фильтр в плоскости для предварительной обработки и фильтра Median (2D, 3D) для последующей обработки.
- На вкладке выполнение нажмите кнопку и перетащите курсоры для настройки оверлея таблицы подстановки. Визуализируйте области активированного мозга (рис. 4В).
7. Протон миссис приобретений
- Чтобы правильно расположить поверхности катушки, измените положение головы крысы. Поворот головы (примерно 30° по часовой стрелке), так что поверхности катушки (рис. 5А) могут находиться чуть выше левый ствол мозга во время горизонтального и расположен в центре магнита внутри магнита.
- Место поверхности катушки, исправить ее на мозг крыс с помощью ленты (Рисунок 5B) и проверьте, что парус движется правильно (переднезаднем движения, без вращения и без трения паруса) когда система воздуха слоеное это оказалось на; затем он в Выключите главный выключатель.
- Проверьте, что парус движется правильно после кровати находится внутри магнита, когда воздух слоеного система находится на. Затем выключите его.
- Проверьте крыса позиционируется правильно с помощью последовательности локализации. Установите параметры следующим образом: TE = 2,5 мс; TR = 100 мс; Средний = 1; повторение = 1; ломтик = 1 мм; Размер изображения = 256 x 256; ПЗ = 50 x 50 мм; время сканирования = 12 s 800 мс.
- Перетащите вкладку последовательность локализатор в окно имени инструкции и нажмите на вкладку Continue , чтобы выполнить программу сканирования.
- Когда мозг локализации является правильным, перетащите вкладку последовательность T2_TurboRARE в окне инструкции имя и нажмите на продолжить , чтобы запустить программу сканирования. Эти анатомические изображения, вместе с предыдущих приобретения смелые МР-томографию, позволит правильно локализации voxel в S1BF для миссис.
Примечание: Параметры T2_TurboRARE являются 14 срезов, 2 мм на срез, ПЗ = 2,5 х 2,5 см, TE = 100 мс, TR = 5000 мс, матрица = 128 x 128, последовательность время = 2 мин 40 с. - Перетащите вкладку последовательность лазера в окно имени инструкции , место voxel (2 мм, длиной 2,5 мм, глубиной 3 мм) в центре области S1BF.
- Используйте Атлас мозга крыс и смелые МР-томографию повышение локализовать зоны на T2 изображения (рис. 6). Перейдите на вкладку Настройка платформы чтобы открыть инструкцию отредактированный сканирования. Нажмите на вкладку раскачиваться и изменить сопротивление (электронная загрузка) катушка получения слегка, чтобы настроить его. Щелкните на вкладке Применить по завершении настройки чтобы закрыть редактор Инструкция и применить изменения в отредактированных инструкции.
- Записать карту0 B и приступить к сканирования ШИМ и, затем, выполнять местные ШИМ.
Примечание: Для карты B0 , используйте следующие параметры: впервые эхо = 1.65 мс; TR = 20 мс, средний = 1; флип угол = 30°; Эхо интервал = 3.805 МС; ломтик = 58 мм; Размер изображения = 64 x 64 x 64; ПЗ = 58 х 58 х 58 мм; время сканирования = 1 м 24 s 920 г-жа для сканирования ШИМ, используйте следующие параметры: voxel селективного возбуждения паровой Гаусса импульса; TE = 5 мс; время смешивания = 10 мс; приобретение длительность = 204.8 мс; пропускная способность = 10000 Гц; время нахождения = 50 МКС. Для местных ШИМ, используйте следующие параметры: вода подавления, пара приобретение длительность = 1,363.15 мс; очки = 4096; пропускная способность в Гц = 3,004.81 Гц; пропускная способность в ppm = 10 ppm; время нахождения = 166.40 μs; спектральное разрешение = 0,37 Гц/очков. Параметры лазера: эхо время = 19.26 МС; TR = 2500 МС; в среднем = 128 или 32; время сканирования = 5 мин 20 s или 1 мин 20 сек; приобретение очков = 4096. - Выполните 1H-MRS.
- Начало 1H-MRS приобретение сначала в период покоя (4 x 32 лазерное сканирование + 128 Лазер сканирует; 2500 ms за сканирования).
- Приобрести другой последовательности локализации (же, как описано в разделе Шаг 5.3) для сравнения с Первая записанная и убедитесь, что крысы не переехал во время приобретения лазера.
- Выполнить 1H-MRS во время активации столбик с помощью лазера последовательности (4 x 32 лазерное сканирование + 128 Лазер сканирует; 2500 ms за сканирование) с системой воздуха слоеное (парадигмы = 20 s активации и 10 s отдыха).
- Еще раз выполните последовательность локализации, чтобы проверить ли крыса переехал.
Примечание: Количество сканов и периодов отдыха/активации могут быть адаптированы и изменение, но всегда убедитесь, что крысы не движется, регулярно выполняя последовательность локализации.
- Принести кровать в его начальное положение, удалить поверхности катушки и переместить крысы обратно на скамейке. Inject Атипамезола в складку кожи, сделанные в крыса обратно вспять анестезии и пробудить его.
8. Протон миссис обработка
- Откройте программное обеспечение LCModel и нажмите на соответствующую вкладку для выбора типа данных справа ( Бесплатные спад индукции файл) и выбрать нужный файл. Нажмите кнопку ОК , когда это делается.
- Оптимизируйте параметры контроля количественной оценки шаг за шагом.
- В разделе название введите название и вручную определить адекватные ppm диапазона (например, 0,2 до 4,0 ppm), вручную введя необходимые значения в соответствующих полях.
- В разделе основы файлов , выберите и скачать нужный файл правильно подогнать макромолекулы базовый (он может быть предоставлен поставщиком программного обеспечения).
- Определить и загрузить элемент управления для ввода параметров. Подготовьте сохранить процесс всех типов полезных файлов заранее (таблица = компактных таблиц; PS = необходимости вывода PostScript; CSV = формат для таблиц; COORD = координаты для участков). Нажмите на вкладку RunLCModel , чтобы начать количественной оценки LCModel.
- Определение отдельных метаболитов для создания статистики.
Примечание: LCModel обеспечивает метаболит количественного определения и оценки ошибок значение называют Cramér-РАО Нижняя граница (CRLB). Значение с CRLB < 15 рассматривается как оптимальная количественной оценки. CRLB > 25 указывает значение ненадежны.
Результаты
Этот протокол позволяет количественная оценка метаболит колебаний во время активации мозга, который получается путем стимуляции правой нитевидные непосредственно в магнит.
В этом исследовании Общая цель смелые МР-томографию было проверить, что столбик стимуляции был эффективным, чтобы визуализировать области активированного S1BF и правильно найти voxel для 1H-ОФМ. Устройство для активации столбик является эффективным. Действительно, когда правый усы были стимулируется с помощью системы домашней воздуха слоеное, позитивный сигнал смелые был обнаружен в левый ствол коры (рис. 4B), также называется S1BF, для поля соматосенсорные баррель (n = 8). Повышение позитивный сигнал был обнаружен в левый ствол коры в восьми из восьми крыс, тогда как только фон был обнаружен в правом полушариях. Когда смелые МР-томографию была выполнена без стимуляции нитевидные, нет сигнала повышение было отмечено в левой или правой S1BF.
В сравнение анатомических изображения МРТ и крыса мозга Атлас схем8области активированного мозга, визуализированное смелые МР-томографию позволяет voxel быть помещены в районе S1BF, который активируется во время стимуляции нитевидные. Этот voxel расположен на трех последовательных слайды (толщиной 1 мм), поскольку коры ствола составляет 3 мм в длину. Когда мозг слайд практически разделены на четыре четверти, voxel расположен в верхней левой четверти на примерно под углом 45° (рис. 6).
При включении парадигмы для стимуляции нитевидные, увеличение содержания лактата было отмечено в левой S1BF (рис. 6, типичный спектров, полученных в одной крысы). Лучше визуализировать метаболических колебания между покоя и активированные периодов, спектральные вычитание была выполнена (рис. 6). От этого вычитается спектра, увеличение содержания лактата с активация мозга был визуализирован гораздо более легко, в эту крысу, N-acetylaspartate (NAA) сигнал был несколько снизилось. Повышение лактата при нейронной стимуляции было также отмечено на спектральном деконволюции (рис. 7AB). Хотя вряд ли лактат пик был обнаружен на спектра в естественных условиях в состоянии покоя, LCModel смогла количественно его (рис. 7A) с точностью и хорошие CRLB значения. Действительно из 23 крыс, только один спектр имели значение CRLB для квантификации лактат равным 24. Ни одна были > 25. Для всех других спектров значения варьировались между 3 и 19.
Вариации содержания лактата во всех 23 крыс представлены на рисунке 8. Из 23 крыс только в одной крысы наблюдалось уменьшение содержания лактата. Было статистически значимой разницы в лактат контента между отдыха и активированные периодов (0,132 ± ± 0,012 и 0.163 0,011, соответственно, значения родственников ПЦР + Cr контента, паре t-теста, p = 0.0005 [параметрический, двустороннее] n = 23). Таким образом была измерена на 31,6% ± 7,8% увеличение содержания лактата при нейронной стимуляции.
Небольшое снижение NAA содержание может наблюдаться в Рисунок 6, который представляет собой типичный спектров в одно животное. Однако, этот вариант NAA не был значительным (1,2% ± 1,2% снижение было измерено, n = 23).
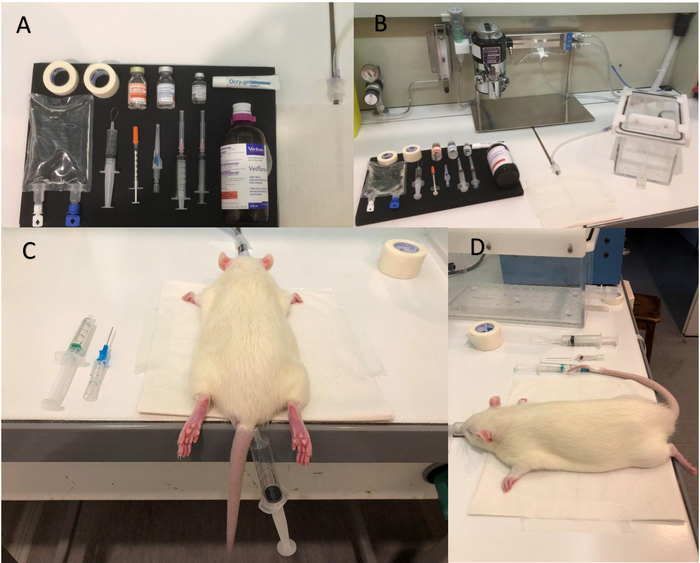
Рисунок 1: оборудование и шаги для анестезии. (A) фотография оборудования должен быть подготовлен до начала наркоза. (B) изофлюрановая насос и индукции камеры. (C) жгут размещения. (D) картина показывает, что правильно введен катетер; Обратите внимание, капля крови в иглы катетера, который является позитивным признаком правильное расположение в Вену. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2: стимуляция нитевидные. Все права усы оказались в ловушке в парус с бумажной ленты. Парус позволяет все права усы следует стимулировать в то же время с системой воздуха слоеного и, таким образом, максимально активации нейронов коры ствола. На выходе из системы воздух слоеное (черная трубка) должен быть расположен около 1,5 см и перпендикулярно парус. Проверка вне магнита чтобы убедиться, что парус движется правильно при включении системы воздуха слоеное. Парус должен двигаться на 8 Гц в переднезаднем направлении (без поворота). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3: системы Air Пуф для стимуляции нитевидные. Гибкая труба (A) A соединяет сжатого воздуха (B) электромагнитный клапан управления. Второй гибкой трубы приносит импульсного воздуха от вывода Клапан электромагнитный контроль парус. Электромагнитный клапан управления подключен к пульсирующей устройство, которое контролирует парадигмы. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4: смелый ФМРТ. (A) объем массива размещение катушки. Крыса голова в горизонтальном положении и Заблокированные уха баров. Проверьте, что парус движется свободно и не блокируется катушки или МРТ кровати. (B) типичный смелейшее сигнал в коре активированные левый ствол (красная стрелка). Сигнал не обнаружен в контралатеральной правого полушария (синяя стрелка). Порог устанавливается в 76,5% от максимального значения интенсивности. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 5: поверхности катушки. (A) изображение поверхности катушки, используемые в данном исследовании. (B) поверхности катушки размещение. Так что левый ствол мозга и, следовательно, поверхности катушки расположены в центре МРТ кровати (голова обратился на угол около 30°, хороший компромисс между правильное расположение коры левой ствол для поверхнос необходимо слегка повернул голову крыса CE катушки и свободные движения парус право усы, которые не должны быть заблокированы МРТ кровать). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
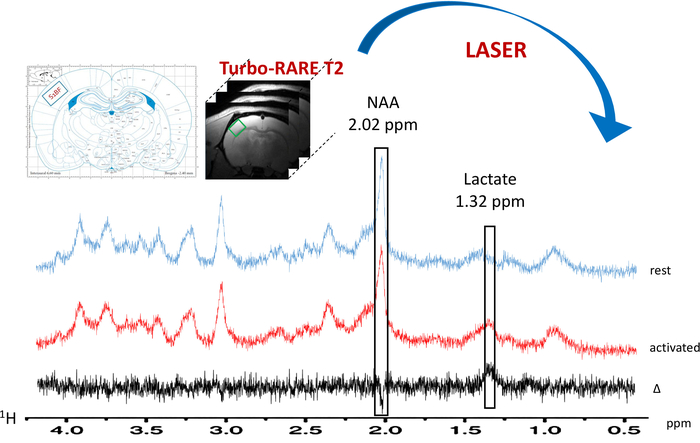
Рисунок 6: типичная локализация 1H-MRS в покое (синий спектр) и во время активации столбик (красный спектр). Voxel (зеленый квадрат) расположен в левой S1BF на анатомический T2_TurboRARE изображения, используя крыса мозга Атлас схем и повышение сигнала на смелые МР-томографию изображений. Спектральная вычитание заговор в черном. Лактат и вершины N-acetylaspartate (NAA) указаны на 1,32 и 2,02 ppm, соответственно. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
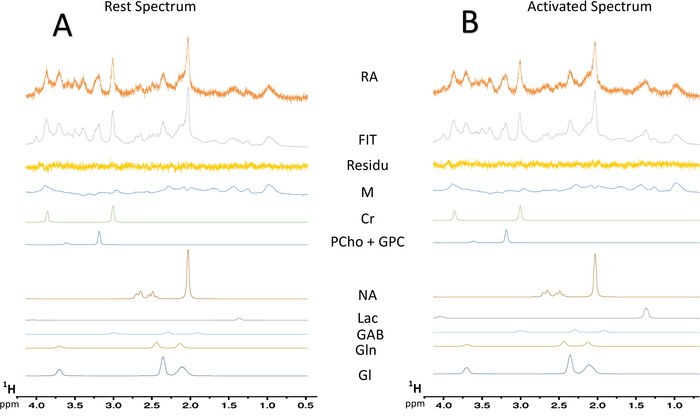
Рисунок 7: типичный спектральном деконволюции миссис спектров. (A) деконволюция отдыха 128-сканирования спектра. (B) деконволюция активированные спектра 128-сканирования. Остаток, вычитания между экспериментальной спектра (исходных данных) и LCModel нужным; MM = макромолекулы; CR = креатин + Креатинфосфорная кислота; PCho + GPC = фосфохолин + glycerophosphocholine; NAA = N-acetylaspartate; Лак = лактата; GABA = γ-аминомасляная кислота; GLN = глютамин; Glu = глутамата. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 8: изменения в лактат содержание во время стимуляции мозга. Синяя точка: лактат содержание в состоянии покоя, определяется LCModel и относительно креатин + фосфокреатина контента. Красная точка: лактат содержание во время стимуляции нитевидные, определяется LCModel и относительно креатин + фосфокреатина контента. Разница между активирована и отдых, p = 0.0005, паре t-тест (параметрический, двустороннее), n = 23. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Ствол коры, также называется S1BF соматосенсорной коры или ствол поля, — регион в пределах коркового слоя IV, который можно наблюдать с помощью цитохрома с-оксидазы пятнать9, и ее организация хорошо известно, так как он был во многом описанные 10,11. Один пришла связан с одного ствола, в котором около 19000 нейронов организованы в колонке12. Столбик баррель коры путь имеет несколько преимуществ. Во-первых оно может быть активировано внутри магнита с помощью МРТ совместимых воздуха слоеного системы, которая может быть легко домашнее (чтобы убедиться, что в самой большой частью района S1BF, который приблизительно соответствует размер voxel, в котором выполняется служба MRS, все усы сжаты в парус, который позволяет стимуляции максимум пришла). Во-вторых, право нитевидные Активация приводит к активации коры левого ствол, и эта область мозга расположен в соматосенсорной коры, которая позволяет использовать высокочувствительный поверхности катушки. В-третьих этот метод активации соматосенсорной коры неинвазивной по сравнению с электрической лапы стимуляции, последний имея недостаток стимулирования других структур мозга, включая некоторые в правом полушарии13. Таким образом протокол, используемый здесь является наиболее подходящим для выполнения в естественных условиях, неинвазивный и продольные исследования метаболизма мозга при церебральной активации.
Выбор анестезии важно, как многие из анестетики вызывают изменения в нервно-сосудистого муфта, метаболизм мозга и/или мозг деятельности14,15. Например изофлюрановая, наиболее распространенных анестезии используется для МРТ, приводит к трех-шестикратное увеличение мозга лактат содержание15,16 и, таким образом, не должны использоваться в метаболических исследования мозга. Medetomidine является агонистом α2-адренорецепторов, который индуцирует надежный седации, обезболивание, расслабление мышц и anxiolysis17. Эти эффекты могут быть быстро отменены с помощью Атипамезола, антагонист α2. Medetomidine является лучшим кандидатом для выполнения функциональных исследований в грызунов18 , поскольку он имеет очень низкое воздействие на смелый сигнал и низкие изменения в мозге метаболит содержимое.
Важно также правильно следовать парадигме активации нитевидные. Так как ЯМР приобретений длиться несколько минут, использование периодов последовательных активации/остальные необходимо ограничить десенсибилизации нейронов в районе активированного мозга. Параметры этой парадигмы (20 s активации последовал период отдыха продолжительностью 10 s) были выбраны для получения высоких смелые МР-томографию сигнал в соответствующих коре ствола. Много осторожность необходимо соблюдать эти время windows, поскольку крайне важно для определения периода активации отдыха для смелых лечения, даже если она контролируется порт ТТЛ. Для получения высокого уровня активации коры ствола, парус, группы усы вместе также важно так как он позволяет большую часть области S1BF, чтобы стимулировать. Много должно быть позаботиться место воздушной трубки розетки перед этот парус так, что он может двигаться на плоскости переднезаднем. Частоты должен быть тщательно калиброванные, поскольку было доказано, что нейроны в коре ствола активируются, когда столбик стимуляции частота находится между 5 и 15 Гц19. Использование более низких или более высоких частот не приведет к активации области S1BF.
Протокол, используемый в данном исследовании делает его возможным для сравнения спектров, приобретенных в той же области мозга в состоянии покоя и во время стимуляции мозга и, таким образом, для мониторинга метаболические изменения связаны с церебральной активации. Это важно для выполнения локализации последовательность в начале и в конце протокола спектроскопии ЯМР, обеспечить, что животное не сдвинулась и что различия в метаболических содержимое измеряется между покоя и активированные государствами из-за мозга стимуляция и не движение артефакты.
Используя протокол, описанные здесь, увеличение содержания лактата было измерено между отдыха и активирован периодов. В организме человека в начале 90-х годов20,21впервые наблюдался рост лактата, используя в vivo ЯМР спектроскопии во время активации мозга. Однако большинство измерения проводились в людей, а не грызунов, в которых отношение сигнал шум намного ниже. Рат, ex vivo ЯМР количественное определение лактата во время активации мозга крыс была выполнена Mazuel и др. 22, который отметил увеличение мозга лактата содержание с активации нейронов. Представленные здесь результаты показывают, что лактат была увеличена во время активации нитевидные. Однако так как локализованные миссис не позволяют сотовой резолюции, до сих пор неизвестно, от которого сотовой отсека лактат приходит (нейроны или астроциты). Чтобы идти дальше в понимании церебрального метаболизма обменов, такие, как все еще обсуждается ANLSH (экзоцитоз нейрон лактат Трансфер гипотеза), этот протокол должен применяться к генетически модифицированных животных для ключевых компонентов в трансфер, такие как monocarboxylate транспортер.
В исследовании, в описанный здесь было отмечено статистически значимой разницы в содержании NAA. Уменьшение содержания NAA во время визуальной стимуляции был ранее найденных в людей23,24,25, но не подтверждена Mangia и Ткач26. В текущем исследовании мы наблюдали увеличение NAA контента во время активации мозга крыс в 50% и уменьшение на другой половине. Таким образом следует избегать NAA как внутреннюю ссылку для количественной оценки во время функционального миссис нет, другие изменения в содержание метаболит был обнаружен.
Оба лактата и NAA вариации во время активации нейронов привели к полемики23,26,27,,2829. Для дальнейшего нашего понимания этих метаболических колебаний, связаны с деятельностью головного мозга, было бы интересно применять этот протокол к трансгенных животных. Это было бы представить дополнительную информацию о процессе базовой. В целом, локализованные 1H-MRS во время задачи, или функциональные миссис29, является новой техникой в грызунов, отношение к изучению региональных динамических изменений метаболитов, в нормальных и патологических мозги.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Эта работа была поддержана тропа LabEx Грант, ссылка АНР-10-LABX-57 и Французск-Швейцарца АНР-ФНС предоставить ссылку АНР-15-CE37-0012. Авторы благодарят Орельен Тротье за его техническую поддержку.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.5 mL syringe with needle | Becton, Dickinson and Company, USA | 2020-10 | 0.33 mm (29 G) x 12.7 mm |
| 1H spectroscopy surface coil | Bruker, Ettlingen, Germany | T116344 | |
| 7T Bruker Biospec system | Bruker, Ettlingen, Germany | 70/20 USR | |
| Arduino Uno based pulsing device | custom made | ||
| Atipamezole | Vétoquinol, S.A., France | V8335602 | Antisedan, 4.28 mg |
| Breathing mask | custom made | ||
| Eye ointment | TVM laboratoire, France | 40365 | Ocry gel 10 g |
| Induction chamber | custom made | 30x17x15 cm | |
| Inlet flexible pipe | Gardena, Germany | 1348-20 | 4.6-mm diameter, 3m long |
| Isoflurane pump, Model 100 series vaporizer, classic T3 | Surgivet, Harvard Apparatus | WWV90TT | from OH 43017, U.S.A |
| Isoflurane, liquid for inhalation | Vertflurane, Virbac, France | QN01AB06 | 1000 mg/mL |
| KD Scientific syringe pump | KD sientific, Holliston, USA | Legato 110 | |
| LCModel software | LCModel Inc., Ontario, Canada | 6.2 | |
| Medetomidine hydrochloride | Vétoquinol, S.A., France | QN05CM91 | Domitor, 1 mg/mL |
| Micropore roll of adhesive plaster | 3M micropore, Minnesota, United States | MI912 | |
| Micropore roll of adhesive plaster | 3M micropore, Minnesota, United States | MI925 | |
| Monitoring system of physiologic parameter | SA Instruments, Inc, Stony Brook, NY, USA | Model 1025 | |
| NaCl | Fresenius Kabi, Germany | B05XA03 | 0.9 % 250 mL |
| Outlet flexible pipe | Gardena, Germany | 1348-20 | 4.6-mm diameter, 4m long |
| Paravision software | Bruker, Ettlingen, Germany | 6.0.1 | |
| Peripheral intravenous catheter | Terumo, Shibuya, Tokyo, Japon | SP500930S | 22 G x 1", 0.85x25 mm, 35 mL/min |
| Rat head coil | Bruker, Ettlingen, Germany | ||
| Sodic heparin, injectable solution | Choai, Sanofi, Paris, France | B01AB01 | 5000 IU/mL |
| Solenoid control valves, plunger valve 2/2 way direct-acting | Burkert, Germany | 3099939 | Model type 6013 |
| Terumo 2 ml syringe | Terumo, Shibuya, Tokyo, Japon | SY243 | with 21 g x 5/8" needle |
| Terumo 5 mL syringe | Terumo, Shibuya, Tokyo, Japon | 05SE1 | |
| Wistar RJ-Han rats | Janvier Laboratories, France |
Ссылки
- Pellerin, L., et al. Activity-dependent regulation of energy metabolism by astrocytes: an update. Glia. 55, 1251-1262 (2007).
- Pellerin, L., Magistretti, P. J. Glutamate uptake into astrocytes stimulates aerobic glycolysis: a mechanism coupling neuronal activity to glucose utilization. Proceedings of the National Academy of Sciences of the United States of America. 91, 10625-10629 (1994).
- Cholet, N., et al. Local injection of antisense oligonucleotides targeted to the glial glutamate transporter GLAST decreases the metabolic response to somatosensory activation. Journal of Cerebral Blood Flow & Metabolism. 21, 404-412 (2001).
- Voutsinos-Porche, B., et al. Glial Glutamate Transporters Mediate a Functional Metabolic Crosstalk between Neurons and Astrocytes in the Mouse Developing Cortex. Neuron. 37, 275-286 (2003).
- Zimmer, E. R., et al. [18F]FDG PET signal is driven by astroglial glutamate transport. Nature Neuroscience. 20 (3), 393-395 (2017).
- Haiss, F., et al. Improved in vivo two-photon imaging after blood replacement by perfluorocarbon. The Journal of Physiology. , (2009).
- Mullins, P. G. Towards a theory of functional magnetic resonance spectroscopy (fMRS): A meta-analysis and discussion of using MRS to measure changes in neurotransmitters in real time. Scandinvian Journal of Psychology. 59, 91-103 (2018).
- Wong-Riley, M. T., Welt, C. Histochemical changes in cytochrome oxidase of cortical barrels after vibrissal removal in neonatal and adult mice. Proceedings of the National Academy of Sciences of the United States of America. 77, 2333-2337 (1980).
- Petersen, C. C. The functional organization of the barrel cortex. Neuron. 56, 339-355 (2007).
- Cox, S. B., Woolsey, T. A., Rovainen, C. M. Localized dynamic changes in cortical blood flow with whisker stimulation corresponds to matched vascular and neuronal architecture of rat barrels. Journal of Cerebral Blood Flow & Metabolism. 13, 899-913 (1993).
- Feldmeyer, D. Excitatory neuronal connectivity in the barrel cortex. Frontiers in Neuroanatomy. 6, 24 (2012).
- Boussida, S., Traore, A. S., Durif, F. Mapping of the brain hemodynamic responses to sensorimotor stimulation in a rodent model: A BOLD fMRI study. PLoS One. 12, e0176512 (2017).
- Heinke, W., Koelsch, S. The effects of anesthetics on brain activity and cognitive function. Current Opinion in Anesthesiology. 18, 625-631 (2005).
- Horn, T., Klein, J. Lactate levels in the brain are elevated upon exposure to volatile anesthetics: a microdialysis study. Neurochemistry International. 57, 940-947 (2010).
- Boretius, S., et al. Halogenated volatile anesthetics alter brain metabolism as revealed by proton magnetic resonance spectroscopy of mice in vivo. Neuroimage. 69, 244-255 (2013).
- Sinclair, M. D. A review of the physiological effects of alpha2-agonists related to the clinical use of medetomidine in small animal practice. Canadian Veterinary Journal. 44, 885-897 (2003).
- Weber, R., et al. A fully noninvasive and robust experimental protocol for longitudinal fMRI studies in the rat. Neuroimage. 29, 1303-1310 (2006).
- Hartmann, M. J., Johnson, N. J., Towal, R. B., Assad, C. Mechanical characteristics of rat vibrissae: resonant frequencies and damping in isolated whiskers and in the awake behaving animal. The Journal of Neuroscience. 23, 6510-6519 (2003).
- Prichard, J., et al. Lactate rise detected by 1H NMR in human visual cortex during physiologic stimulation. Proceedings of the National Academy of Sciences of the United States of America. 88, 5829-5831 (1991).
- Sappey-Marinier, D., et al. Effect of photic stimulation on human visual cortex lactate and phosphates using 1H and 31P magnetic resonance spectroscopy. Journal of Cerebral Blood Flow & Metabolism. 12, 584-592 (1992).
- Mazuel, L., et al. A neuronal MCT2 knockdown in the rat somatosensory cortex reduces both the NMR lactate signal and the BOLD response during whisker stimulation. PLoS One. 12, e0174990 (2017).
- Castellano, G., et al. NAA and NAAG variation in neuronal activation during visual stimulation. Brazilian Journal of Medical and Biological Research. 45, 1031-1036 (2012).
- Sarchielli, P., et al. Functional 1H-MRS findings in migraine patients with and without aura assessed interictally. Neuroimage. 24, 1025-1031 (2005).
- Baslow, M. H., Hrabe, J., Guilfoyle, D. N. Dynamic relationship between neurostimulation and N-acetylaspartate metabolism in the human visual cortex: evidence that NAA functions as a molecular water pump during visual stimulation. Journal of Molecular Neuroscience. 32, 235-245 (2007).
- Mangia, S., Tkac, I. Dynamic relationship between neurostimulation and N-acetylaspartate metabolism in the human visual cortex: evidence that NAA functions as a molecular water pump during visual stimulation. Journal of Molecular Neuroscience. 35, 245-248 (2008).
- Baslow, M. H., Hrabal, R., Guilfoyle, D. N. Response of the authors to the Letter by Silvia Mangia and Ivan Tkac. Journal of Molecular Neuroscience. 35, 247-248 (2008).
- Barros, L. F., Weber, B. CrossTalk proposal: an important astrocyte-to-neuron lactate shuttle couples neuronal activity to glucose utilisation in the brain. The Journal of Physiology. 596, 347-350 (2018).
- Bak, L. K., Walls, A. B. CrossTalk opposing view: lack of evidence supporting an astrocyte-to-neuron lactate shuttle coupling neuronal activity to glucose utilisation in the brain. The Journal of Physiology. 596, 351-353 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены