Method Article
Spettroscopia di risonanza magnetica funzionale a 7 T nella corteccia di canna del ratto durante l'attivazione Whisker
In questo articolo
Riepilogo
Dopo aver controllato di sangue-ossigeno-livello-dipendente funzionale imaging a risonanza magnetica (fMRI grassetto) che la corrispondente zona della corteccia somatosensoriale barile campo (chiamata S1BF) è correttamente attivato, il principale obiettivo di questo studio è quello di quantificare il contenuto del lattato fluttuazioni nei cervelli del ratto attivati dalla spettroscopia di risonanza magnetica del protone localizzata (1H-MRS) a 7 T.
Abstract
Spettroscopia di risonanza magnetica nucleare (NMR) offre l'opportunità di misurare cerebrale metabolita contenuto in vivo e non invadente. Grazie agli sviluppi tecnologici nel corso dell'ultimo decennio e l'aumento della resistenza del campo magnetico, è ora possibile ottenere buona risoluzione spettri in vivo nel cervello del ratto. Neuroenergetics (cioè, lo studio del metabolismo del cervello) e, soprattutto, le interazioni metaboliche tra i diversi tipi cellulari hanno attirato sempre più interesse negli ultimi anni. Tra queste interazioni metaboliche, l'esistenza di una navetta di lattato tra neuroni e astrociti è ancora dibattuta. È, quindi, di grande interesse per eseguire spettroscopia di risonanza magnetica funzionale protone (1H-MRS) in un modello del ratto del lattato del monitor e l'attivazione del cervello. Tuttavia, il picco di lattato di metile si sovrappone a picchi di risonanza del lipido ed è difficile da quantificare. Il protocollo descritto di seguito permette metabolico e del lattato di fluttuazioni da monitorare in una zona del cervello attivato. Attivazione cerebrale è ottenuto da stimolo whisker e 1H-MRS è eseguita nella corteccia barile attivato corrispondente, cui area è rilevato usando sangue-ossigeno-livello-dipendente risonanza magnetica funzionale (fMRI grassetto). Tutti i passaggi sono descritti: la scelta di anestetici, bobine e sequenze, raggiungere whisker efficiente stimolazione direttamente nel magnete ed elaborazione dei dati.
Introduzione
Il cervello possiede meccanismi intrinseci che consentono la regolazione del suo substrato principale (cioè, glucosio), sia per il suo contributo e il suo utilizzo, a seconda delle variazioni nell'attività cerebrale locale. Anche se il glucosio è il substrato principale di energia per il cervello, gli esperimenti condotti negli ultimi anni hanno indicato quello lattato, che viene prodotta dai astrocytes, potrebbe essere un substrato energetico efficiente per i neuroni. Ciò solleva l'ipotesi di una spola di lattato tra astrociti e neuroni1. Conosciuto come ANLS, per astrociti lattato navetta2, la teoria è ancora altamente dibattuta ma ha portato la proposta che il glucosio, piuttosto che andare direttamente in neuroni, può immettere gli astrociti, dove viene metabolizzato in lattato, un metabolita che è , poi, trasferiti ai neuroni, che lo utilizzano come substrato energetico efficiente. Se una tale navetta esiste in vivo, avrebbe parecchie conseguenze importanti sia per la comprensione di base tecniche di imaging cerebrale funzionale (tomografia a emissione di positroni [PET]) per decifrare le alterazioni metaboliche osservate nelle patologie cerebrali.
Per studiare il metabolismo del cervello e, in particolare, le interazioni metaboliche tra neuroni e astrociti, quattro principali tecniche sono disponibili (non compresi micro-/ nanosensori): autoradiografia, PET, microscopia confocale fluorescente del due-fotone e la signora. Autoradiografia è stato uno dei primi metodi proposti e fornisce immagini dell'accumulo regionale di radioattivo 14C-2-deossiglucosio nelle fette del cervello, mentre rese in vivo immagini PET dell'assorbimento regionale di radioattivo 18 F-deossiglucosio. Entrambi hanno lo svantaggio di utilizzare molecole irradiative, producendo immagini di risoluzione bassa-spaziale. Microscopia del due-fotone fornisce una risoluzione cellulare sonde fluorescenti, ma dispersione della luce dal tessuto limita la profondità di imaging. Queste tre tecniche sono state utilizzate in precedenza per studiare neuroenergetics in roditori durante whisker stimolazione3,4,5,6. In vivo MRS ha il duplice vantaggio di essere non invadente e non radioattivi, e qualsiasi struttura del cervello possa essere esplorato. Inoltre, MRS può essere eseguita durante l'attivazione neuronale, una tecnica chiamata MRS funzionale (fMRS), che è stato sviluppato molto recentemente in roditori7. Pertanto, si propone un protocollo per il monitoraggio del metabolismo cerebrale durante l'attività cerebrale di 1H-MRS in vivo e non invadente. La procedura è descritta in ratti adulti sani con l'attivazione del cervello ottenuto da un soffio di aria whisker stimolo eseguita direttamente in un imager di risonanza magnetica (RM) T 7 ma può essere adattata in animali geneticamente modificati, nonché in qualsiasi condizione patologica .
Protocollo
Tutte le procedure di animali sono stati condotti in conformità degli orientamenti di sperimentazione animale della direttiva del Consiglio delle Comunità europee del 24 novembre 1986 (86/609/CEE). Il protocollo ha incontrato le linee guida etiche del Ministero francese dell'agricoltura e foreste ed è stato approvato dai comitati etici locali (Comité d 'éthique pour L' expérimentation Animale Bordeaux n ° 50112090-A).
Nota: Durante le misurazioni di MR, un adeguato livello di anestesia e monitoraggio fisiologico (temperatura corporea, frequenza respiratoria) sono requisiti indispensabili.
1. gli animali
- Utilizzare i ratti maschii di Wistar peso compreso tra 350 e 450 g.
- Tenerli su un 12:12 h chiaro: scuro ciclo e fornire cibo e acqua ad libitum.
2. anestesia
- Preparare l'attrezzatura necessaria per l'anestesia (Figura 1A, B, Vedi Tabella materiali): una siringa da 5 mL contenente medetomidina in soluzione fisiologica (240 µ g/kg/h, con un tasso di aspersione di 20 µ l/min), una siringa da 0,5 mL contenenti atipamezolo (20 μL, in 0,5 mL di soluzione salina) e unguento oculare.
Nota: Tenere tutte le attrezzature sotto la cappa di aspirazione, tranne la siringa da 5 mL contenente medetomidina, che viene inserito nella pompa a siringa vicino al magnete per anestesia durante acquisizioni di MR. - Posizionare il ratto nella camera di induzione, iniziare l'anestesia fornendo 4% isoflurane e regolare la portata di ossigeno a 1,5 L/min.
- Valutare la profondità dell'anestesia valutando il ritiro dei riflessi di zampa.
- Quando il topo non risponde alla stimolazione, portarlo fuori dalla scatola di anestesia, posizionarlo sulla panchina con il suo naso nella maschera di isoflurano e mantenere l'anestesia fornendo 2,5% in ossigeno a 1,5 L/min.
- Delicatamente la coda di massaggio e posizionare il laccio emostatico (Figura 1).
Nota: Il massaggio può essere eseguito in acqua calda, con una temperatura compresa tra 38 e 42 ° C, per ottenere migliore vasodilatazione delle vene. - Inserire il catetere endovenoso periferico (22 G), precedentemente eparinizzato, nella vena caudale sinistro o destro. Nota che si osserva un ritorno venoso (una goccia di sangue è visibile alla parte distale dell'ago) quando il catetere è correttamente inserita (Figura 1).
- Far fuoriuscire eventuali bolle d'aria presenti nel volume di spazio morto del catetere usando la siringa da 2 mL contenente eparina e soluzione fisiologica.
- Applicare l'unguento dell'occhio e preparare la siringa contenente atipamezolo (17 µ g/mL) per risvegliare il topo alla fine dell'esperimento.
3. ratto posizionamento nel magnete per stimolazione Whisker
- Posto un sensore di respirazione sul letto magnete e quindi trasferire il ratto dalla panchina per il letto di magnete. Collocarlo in posizione prona con il suo naso nella maschera di isoflurano, con il sensore di respirazione che si trova tra la gabbia toracica e il letto di magnete.
Nota: Tutte le attrezzature che entra nella stanza di MRI dovrebbero essere MRI-cassetta di sicurezza. - Diminuire l'isoflurano (dal 4% al 1,5%-2%) durante il posizionamento del ratto e passare l'anestesia alla medetomidina alla fine di questa procedura. Garantire che i baffi di destro sono gratuiti, dopo aver tagliato il bordo destro nella parte anteriore del ratto letto MRI in anticipo per permettere il movimento dei baffi.
- Tenere il ratto in posizione con nastro e monitorare la respirazione che deve essere compreso tra 60 e 80 respiri al minuto.
- Fare una vela che intrappola tutto bene baffi nel nastro di carta (Figura 2). Allineare il tubo di scarico flessibile del sistema aria-soffio lungo il ratto letto MRI affinché la parte usciti dal tunnel è perpendicolare e a circa 1,5 cm dalla vela. Fissarlo con nastro di carta.
4. whisker stimolazione
- Collegare il tubo flessibile d'entrata da una sorgente di aria compressa (1 bar) per un input di solenoide controllo valvola e il tubo di mandata all'output del solenoide controllo valvola (Figura 3). Assicurarsi che la valvola di controllo del solenoide rimane fuori dalla stanza del magnete.
- Collegare il dispositivo pulsa l'elettrovalvola e al magnete utilizzando la logica del transistore-transistore (TTL)-porto. Configurarlo in modo che la frequenza di pulsazione = 8 Hz, tempo di pulsazione = 20 s e il periodo di riposo = 10 s.
Nota: Questi parametri, visualizzati sul piccolo schermo a cristalli liquidi (LCD) schermo di visualizzazione, sono regolabili tramite i tre potenziometri analogici dedicati. Il pulsa dispositivo elettronico, che controlla il paradigma, deve essere composto di componenti elettronici di alta qualità per evitare qualsiasi deriva nei parametri di tempo (per post-elaborazione corretta).
5. BOLD fMRI acquisizione
- Mettere il cervello di ratto, in modo che è in posizione verticale e utilizzare le barre di orecchio per mantenerla. Posizionare la bobina di matrice volume sopra la testa del ratto (Figura 4A) e fissarlo con del nastro. Controllare che la vela si muova correttamente (movimento antero-posteriore, senza rotazione e senza attrito di vela) quando il sistema di aria-puff è girato su; quindi, spegnere.
- Inserire il letto e la bobina al centro del magnete. Verifica che la vela è ancora in movimento correttamente una volta che il letto è all'interno del magnete quando il sistema di aria-puff è su; quindi, spegnere. Passare completamente da isoflurane medetomidina (tasso di perfusione: 20 µ l/min).
- Controllare che il ratto è ben situato utilizzando una sequenza di localizzazione (TE = 2,5 ms; TR = 100 ms; medio = 1; ripetizione = 1; affettare = 1 mm; dimensione della battuta = 256 x 256; campo visivo (FOV) = 50 x 50 mm; tempo di scansione = 12 s 800 ms). Trascinare la scheda di sequenza Localizer nel nome di istruzioni e fare clic su continua.
- Trascinare la scheda di sequenza di T2_Star_FID_EPI nel nome di istruzione, centro il FOV al centro del cervello e fare clic sulla scheda piattaforma di aggiustamento per aprire le istruzioni di scansione modificato. Registrare una B0 mappa e procedere alla scansione shim.
Nota: Per una mappa di0 B, utilizzare i seguenti parametri: primo tempo eco = 1,65 ms; TR = 20 ms, medio = 1; angolo di vibrazione = 30°; Eco spaziatura = 3,805 ms; affettare = 58 mm; dimensione della battuta = 64 x 64 x 64; FOV = 58 x 58 x 58 mm; tempo di scansione = 1 m 24 ms. s 920 per scansione shim, utilizzare i seguenti parametri: eccitazione selettiva voxel = impulso gaussiano di vapore; TE = 5 ms; tempo di miscelazione = 10 ms; Durata acquisizione = 204,8 ms; larghezza di banda = 10.000 Hz; tempo di permanenza = 50 μs). - Avviare la sequenza di T2 Star_FID_EPI (TE = 16,096 ms; TR = 500 ms; medio = 1; ripetizione = 600; affettare = 1 mm; quattro fette consecutivi; dimensione della battuta = 128 x 128; FOV = 20 x 20 mm; larghezza di banda = 333.333,3 Hz; tempo di scansione = 5 min 00 s).
Nota: A causa del porto TTL, un segnale di trigger esterno inizierà il sistema aria-soffio allo stesso tempo. Il paradigma = [attivazione s 20 + 10 s resto] x 10, per la durata totale delle 600 scansioni, 500 ms per ogni scansione. Le fette sono allineate al centro della zona di campo di canna. - Acquisire un'altra sequenza di localizzazione (identico a quello descritto nel passo 5.3) per confrontare con il primo e controllare se il topo è stato spostato durante la sequenza di T2_Star_FID_EPI.
- Riportare il letto in posizione iniziale, rimuovere la bobina di matrice di volume e collegare la bobina di superficie.
6. elaborazione di grassetto
- Aprire il file T2 Star_FID_EPI e leggere l'immagine T2 Star_FID_EPI nella Visualizzazione delle immagini. Aprire la finestra di avvio del controller funzionale, chiamato FunController.
- In questa scheda di elaborazione , selezionare la finestra di imaging funzionale e definire il protocollo di stimolazione (durata e alternanza di On/Off periodi, corrispondente al paradigma utilizzato).
- Selezionare la finestra di protocollo (dataset con 600 fotogrammi) e inserire il valore di 40 nella scheda Il periodo e 20 nella scheda fuori periodo fare clic sulla scheda Attribuzione invertire e trascina il cursore di Stimolazione stati verso sinistra per selezionare il valore 1.
- Nella finestra di pre-elaborazione, fare clic sul filtro mediano in aereo per la pre-elaborazione e il filtro mediano (2D, 3D) per post-elaborazione.
- Fare clic sulla scheda Execute e trascinare i cursori per regolare la tabella di ricerca di sovrapposizione. Visualizzare l'area del cervello attivato (Figura 4B).
7. proton MRS acquisizioni
- Per posizionare correttamente la bobina di superficie, modificare la posizione della testa del ratto. Ruotare la testa (circa 30° in senso orario) in modo che la bobina di superficie (Figura 5A) può essere posizionata appena sopra la corteccia sinistra barile pur essendo orizzontale e si trova al centro del magnete all'interno del magnete.
- Posizionare la bobina di superficie, risolvere il problema il cervello del ratto usando del nastro (figura 5B) e controllare che la vela si muova correttamente (movimento antero-posteriore, senza rotazione e senza attriti della vela) quando il sistema di aria-puff è girato su; quindi, spegnere l'interruttore generale.
- Controllare che la vela si muova correttamente una volta che il letto è all'interno del magnete quando il sistema di aria-soffio è il. Quindi, spegnere.
- Verificare che il ratto sia posizionato correttamente utilizzando una sequenza di localizzazione. Impostare i parametri come segue: TE = 2,5 ms; TR = 100 ms; medio = 1; ripetizione = 1; affettare = 1 mm; dimensione della battuta = 256 x 256; FOV = 50 x 50 mm; tempo di scansione = 12 s 800 ms.
- Trascinare la scheda sequenza Localizer nella finestra nome istruzioni e fare clic sulla scheda continua a eseguire il programma di scansione.
- Quando la localizzazione cerebrale è corretta, trascinare la scheda di sequenza di T2_TurboRARE nella finestra nome istruzione e clicca su continua per eseguire il programma di scansione. Queste immagini anatomiche, insieme con l'acquisizione di fMRI grassetto precedente, consentirà la corretta localizzazione del voxel nella S1BF MRS.
Nota: I parametri T2_TurboRARE sono 14 sezioni, 2 mm per ogni fetta, FOV = 2,5 x 2,5 cm, TE = 100 ms, TR = 5.000 ms, matrice = 128 x 128, tempo di sequenza = 2 min 40 s. - Trascinare la scheda sequenza LASER nella finestra nome istruzione , posto il voxel (2 mm di altezza, lungo 2,5 mm, 3 mm di profondità) al centro della zona di S1BF.
- Utilizzare un Atlante del cervello del ratto e la valorizzazione di fMRI grassetto per localizzare la zona sulle immagini T2 (Figura 6). Fare clic sulla scheda piattaforma di aggiustamento per aprire le istruzioni di scansione modificato. Fare clic sulla scheda Wobble e modificare l'impedenza (caricamento elettronico) della bobina leggermente per sintonizzare in ricezione. Fare clic sulla scheda applica quando l'accordatura è finito per chiudere l'editor di istruzioni e applicare le modifiche nell'istruzione modificato.
- Registrare una B0 mappa e procedere alla scansione shim e, quindi, eseguire uno spessore locale.
Nota: Per la mappa di0 B, utilizzare i seguenti parametri: primo tempo eco = 1,65 ms; TR = 20 ms, medio = 1; angolo di vibrazione = 30°; Eco spaziatura = 3,805 ms; affettare = 58 mm; dimensione della battuta = 64 x 64 x 64; FOV = 58 x 58 x 58 mm; tempo di scansione = 1 m 24 ms. s 920 per lo spessore di scansione, utilizzare i seguenti parametri: impulso gaussiano di voxel eccitazione selettiva di vapore; TE = 5 ms; tempo di miscelazione = 10 ms; Durata acquisizione = 204,8 ms; larghezza di banda = 10.000 Hz; tempo di permanenza = 50 μs. Per lo spessore locale, utilizzare i seguenti parametri: soppressione di acqua, vapore Durata acquisizione = 1.363,15 ms; punti = 4.096; larghezza di banda in Hz = 3.004,81 Hz; larghezza di banda in ppm = 10 ppm; tempo di permanenza = 166,40 μs; risoluzione spettrale = 0,37 Hz/punti. I parametri LASER sono: echo tempo = ms 19,26; TR = 2.500 ms; Media = 128 o 32; tempo di scansione = 5 min 20 s o 1 min 20 s; punti di acquisizione = 4.096. - Eseguire 1H-MRS.
- Avviare 1H-MRS acquisizione prima durante un periodo di riposo (scansioni LASER 4x32 + 128 LASER scansiona; 2.500 ms per ogni scansione).
- Acquisire un'altra sequenza di localizzazione (identico a quello descritto nel passo 5.3) per confrontare con il primo registrato e garantire che il topo non è spostato durante l'acquisizione di LASER.
- Eseguire 1H-MRS durante l'attivazione di whisker utilizzando la sequenza LASER (scansioni LASER 4x32 + 128 LASER scansiona; 2.500 ms per ogni scansione) con il sistema di aria-puff (paradigma = 20 s di attivazione e 10 s di riposo).
- Ancora una volta, eseguire una sequenza di localizzazione per controllare se il topo è stato spostato.
Nota: Il numero di scansioni e periodi di riposo/attivato può essere adattato e modificato, ma sempre in modo che il topo non è commovente eseguendo regolarmente una sequenza di localizzazione.
- Riportare il letto in posizione iniziale, rimuovere la bobina di superficie e fai avanzare il ratto torna in panchina. Iniettare atipamezolo in una piega di pelle fatta nella parte posteriore del ratto di invertire l'anestesia e risvegliare.
8. proton MRS elaborazione
- Aprire il software di LCModel e fare clic sulla scheda appropriata per selezionare il tipo di dati corretto (file Free Induction Decay ) e scegliere il file giusto. Fare clic sulla scheda OK quando questo è fatto.
- Ottimizzare i parametri di controllo di quantificazione passo dopo passo.
- Nella sezione del titolo , immettere un titolo e definire un intervallo di ppm adeguata (ad es., 0.2-4,0 ppm) digitando manualmente il valore necessario nei rispettivi campi manualmente.
- Nella sezione del file di base , selezionare e scaricare il file necessario per adattarla correttamente la linea di base della macromolecola (può essere fornito dal fornitore del software).
- Definire e caricare i parametri di controllo di input. Preparare il salvataggio processo di tutti i tipi di file utili in anticipo (tabella = tavole compatte; PS = output PostScript necessarie; CSV = formato per fogli di calcolo; COORD = Coordinate piazzole). Fare clic sulla scheda RunLCModel per avviare la quantificazione di LCModel.
- Definire metaboliti selezionati per generare le statistiche.
Nota: LCModel fornisce quantificazione metabolita ed errori di stima di un valore definito limite inferiore di Cramér-Rao (CRLB). Un valore con un CRLB < 15 è considerato come una quantificazione ottima. Un CRLB > 25 indica un valore inaffidabile.
Risultati
Questo protocollo permette la quantificazione delle fluttuazioni di metabolita durante l'attivazione cerebrale, che si ottiene dalla stimolazione destra whisker direttamente nel magnete.
In questo studio, l'obiettivo generale di fMRI grassetto era per controllare che la stimolazione di baffo era efficiente, per visualizzare l'area di S1BF attivata e per individuare correttamente i voxel per 1H-fMRS. Il dispositivo costruito per l'attivazione di Baffo è efficiente. Infatti, quando giusti baffi sono state stimolate utilizzando il sistema di aria-pasta fatta in casa, un segnale BOLD positivo è stato rilevato nella corteccia sinistra barile (Figura 4B), chiamata anche S1BF, per il campo di canna somatosensoriali (n = 8). Un aumento del segnale positivo è stato rilevato nella corteccia sinistra barile in otto su otto ratti, mentre solo sfondo è stata rilevata negli emisferi destro. Quando fMRI grassetto è stato effettuato senza stimolazione whisker, nessun potenziamento del segnale è stato osservato in S1BF a destra o sinistra.
In un confronto tra immagini anatomiche di MR e ratto cervello Atlante schemi8, zona del cervello attivato visualizzata tramite fMRI grassetto permette il voxel essere collocato nel quartiere di S1BF, che viene attivato durante la stimolazione whisker. Questo voxel è situato su tre diapositive consecutive (1 mm di spessore) poiché la corteccia di canna è lungo 3 mm. Quando la diapositiva di cervello è praticamente separata in quattro quarti, il voxel si trova in alto a sinistra trimestre a un angolo di circa 45° (Figura 6).
Quando è stato acceso il paradigma per la stimolazione di baffo, un aumento nel contenuto del lattato è stato osservato nella S1BF sinistra (Figura 6, spettri tipici ottenuti in un topo). Per visualizzare meglio metaboliche fluttuazioni tra riposo o attivati periodi, è stata eseguita una sottrazione spettrale (Figura 6). Da questo spettro sottratto, l'aumento nel contenuto di lattato con l'attivazione del cervello è stata visualizzata molto più facilmente, mentre in questo ratto, il segnale di N-acetilaspartato (NAA) è stata leggermente diminuito. Aumento del lattato durante la stimolazione di un neurone è stata anche osservata la deconvoluzione spettrale (figura 7AB). Mentre il picco di lattato è stato appena rilevato sullo spettro in vivo a riposo, LCModel era in grado di quantificarlo (figura 7A) con precisione e buona CRLB valori. Infatti, da 23 ratti, un solo spettro hanno avuti un valore CRLB per la quantificazione di lattato uguale a 24. Nessuno erano > 25. Per tutti gli altri spettri, i valori compresi tra 3 e 19.
Le variazioni nel contenuto del lattato in 23 tutti i ratti sono presentate nella Figura 8. Fuori 23 ratti, una diminuzione nel contenuto del lattato è stata osservata solo in un ratto. C'era una differenza statisticamente significativa in lattato contenuto tra riposo e attivato periodi (0,132 ± 0,012 e 0,163 ± 0,011, rispettivamente, valori parenti per PCr + Cr contenuto, accoppiato t-test, p = 0,0005 [parametrica, a due code] n = 23). Di conseguenza, un incremento del 7,8% 31,6% ± nel contenuto del lattato è stato misurato durante la stimolazione di un neurone.
Una lieve diminuzione nel contenuto NAA può essere osservata nella Figura 6, che rappresenta il tipici spettri ottenuti in un animale. Tuttavia, questa variazione di NAA non era significativa (è stata misurata una diminuzione di 1,2% ± 1,2%, n = 23).
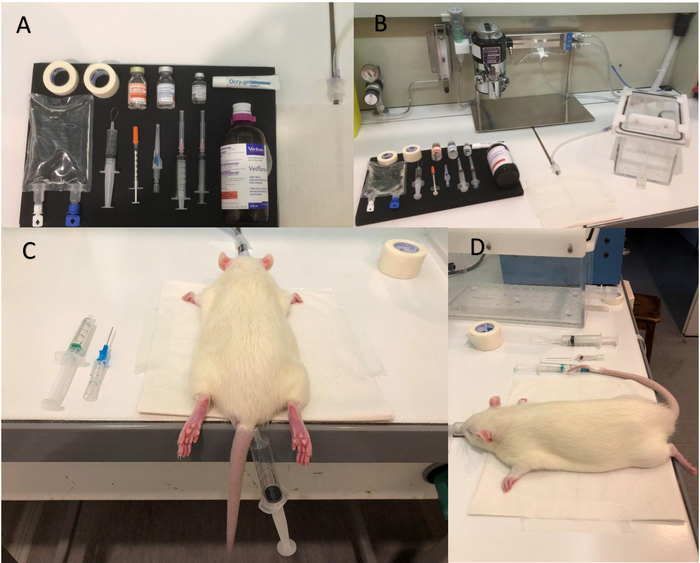
Figura 1: attrezzature e passaggi per l'anestesia. Foto di (A) delle apparecchiature per essere preparati prima di iniziare l'anestesia. (B) Isoflurane alloggiamento pompa e induzione. (C) posizionamento del laccio emostatico. (D) l'immagine mostra che il catetere è stato inserito correttamente; Si noti la goccia di sangue nell'ago catetere, che è un segno positivo di una posizione corretta nella vena. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: stimolazione Whisker. Va bene baffi sono intrappolati in una vela fatta con nastro di carta. La vela consente whiskers va bene per essere stimolato allo stesso tempo con il sistema di aria-puff e, pertanto, massimizza l'attivazione neuronale della corteccia barile. L'uscita del sistema aria-puff (tubo nero) dovrebbe trovarsi intorno a 1,5 cm e perpendicolare alla vela. Controllo fuori il magnete per assicurarsi che la vela si muove correttamente accendendo il sistema aria-puff. La vela deve spostare a 8 Hz in senso antero-posteriore (nessuna rotazione). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: sistema di aria-puff per stimolazione whisker. (A) A tubo flessibile si collega al aria compressa (B) la valvola di controllo del solenoide. Un secondo tubo flessibile porta aria pulsata dall'output di valvola solenoide controllo alla vela. L'elettrovalvola di controllo è collegato il dispositivo lampeggiante, che controlla il paradigma. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: BOLD fMRI. Disposizione della bobina di matrice (A) Volume. La testa del ratto è in posizione orizzontale e bloccato da bar di orecchio. Verifica che la vela si muove liberamente e non è bloccata dalla bobina o dal letto MRI. (B) un grassetto tipico segnale nella corteccia attivato canna sinistra (freccia rossa). Nessun segnale viene rilevato nel giusto emisfero controlaterale (freccia blu). La soglia è fissata a 76,5% del massimo di valore dell'intensità. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: bobina di superficie. (A) immagine della bobina di superficie utilizzata in questo studio. (B) posizionamento bobina di superficie. La testa del ratto deve essere ruotata leggermente così che la corteccia sinistra barile e, quindi, la bobina di superficie sono situati al centro del letto MRI (la testa è girata ad un angolo di circa 30°, un buon compromesso tra la posizione corretta della corteccia sinistra barile per la surfa bobina di CE e liberi movimenti della vela dei baffi giusti, che non devono essere bloccati dal letto MRI). Clicca qui per visualizzare una versione più grande di questa figura.
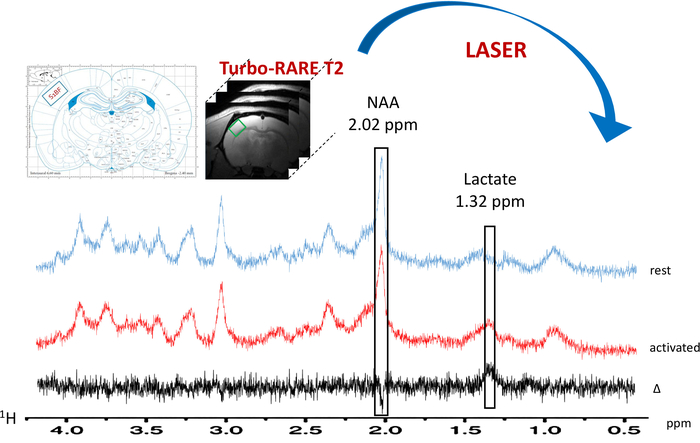
Figura 6: 1H-MRS a riposo (spettro blu) e durante l'attivazione whisker (spettro rosso) localizzato tipico. I voxel (quadrato verde) si trova alla sinistra S1BF sulle immagini anatomiche T2_TurboRARE utilizzando schemi di Atlante del cervello del ratto e potenziamento del segnale sulle immagini di fMRI grassetto. La sottrazione spettrale è tracciata in nero. Lattato e picchi di N-acetilaspartato (NAA) sono indicati a 1,32 e 2.02 ppm, rispettivamente. Clicca qui per visualizzare una versione più grande di questa figura.
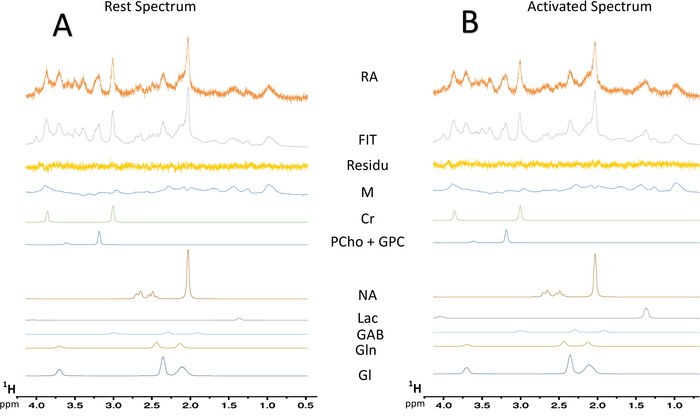
Figura 7: tipico deconvoluzione spettrale degli spettri di MRS. (A) deconvoluzione di uno spettro di resto 128-scansione. (B) deconvoluzione di una 128-scansione attivato spettro. Residuo, sottrazione tra spettro sperimentale (dati grezzi) e la misura di LCModel; MM = macromolecola; CR = creatina + fosfocreatina; PCho + GPC = fosfocolina + glycerophosphocholine; NAA = N-acetilaspartato; Lac = lattato; GABA = acido γ-aminobutirrico; GLN = glutamina; Glu = glutammato. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 8: variazioni in lattato del contenuto durante la stimolazione del cervello. Punto blu: lattato contenuto a riposo, determinata dalla LCModel e rispetto la creatina + fosfocreatina contenuto. Puntino rosso: contenuto di lattato durante la stimolazione whisker, determinata dalla LCModel e rispetto la creatina + fosfocreatina contenuto. La differenza tra attivato e riposare, p = 0,0005, accoppiato t-test (parametrica, a due code), n = 23. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
La corteccia di canna, chiamata anche S1BF per la corteccia somatosensoriale o un campo di canna, è una regione all'interno dello strato corticale IV che possono essere osservate utilizzando ossidasi del citocromo c colorazione9, e la sua organizzazione è ben nota, poiché è stato ampiamente descritto 10,11. Una vibrissa è connesso a un barile, in cui circa 19.000 neuroni sono organizzati in una colonna12. Il pathway di baffo per barile corteccia presenta parecchi vantaggi. In primo luogo, può essere attivato all'interno del magnete utilizzando un sistema di aria-soffio di MRI-compatibile, che può essere facilmente fatto in casa (per assicurare che nella più grande parte della zona di S1BF, che corrisponde approssimativamente alla dimensione del voxel in cui MRS è effettuato, tutti i baffi sono infilati in una vela che permette la stimolazione di un massimo di vibrissa). In secondo luogo, a destra whisker attivazione porta alla attivazione della corteccia sinistra barile, e questa zona del cervello si trova nella corteccia somatosensoriale, che consente l'utilizzo di una bobina di superficie ad alta sensibilità. In terzo luogo, questo metodo di attivazione della corteccia somatosensoriale è non invadente rispetto alla stimolazione elettrica zampa, questi ultimi hanno lo svantaggio di stimolare altre strutture cerebrali, tra cui alcuni nel giusto emisfero13. Di conseguenza, il protocollo utilizzato qui è il più adatto eseguire un in vivo, non invadente e longitudinale lo studio del metabolismo del cervello sotto attivazione cerebrale.
La scelta di anestetico è fondamentale, come molti degli anestetici indurre cambiamenti neurovascular accoppiamento, metabolismo del cervello e/o cervello attività14,15. Ad esempio, isoflurano, l'anestetico più comune utilizzati per MRI, conduce ad una tre-per aumento sestuplo nel cervello del lattato contenuto15,16 e, pertanto, non deve essere usato in studi metabolici cerebrali. Medetomidina è un agonista di α2-adrenergici, che induce affidabile sedazione, analgesia, rilassamento muscolare e ansiolisi17. Questi effetti possono essere invertiti rapidamente utilizzando atipamezolo, α2-antagonista. Medetomidina è il miglior candidato per eseguire studi funzionali in roditori18 dal momento che ha un impatto bassissimo segnale BOLD positivo e il più basso contenuto di metabolita del cervello.
È anche importante seguire il paradigma di attivazione whisker correttamente. Poiché acquisizioni NMR durano diversi minuti, l'uso dei periodi successivi attivazione/riposo è essenziale per limitare la desensibilizzazione dei neuroni nell'area cerebrale attivato. I parametri di questo paradigma (20 s di attivazione seguita da un periodo di riposo di 10 s) sono stati scelti per ottenere il più alto segnale fMRI grassetto nella corteccia canna corrispondente. Molta cura deve essere presa per rispettare queste finestre di tempo dal momento che è cruciale per determinare il periodo di riposo/attivato per trattamento grassetto, anche se è controllato dalla porta TTL. Per ottenere un elevato livello di attivazione della corteccia di canna, la vela che raggruppa i baffi insieme è anche importante poiché permette la più grande parte della zona S1BF di essere stimolato. Molta cura deve essere presa per posizionare il tubo di scarico aria davanti a questa vela in modo che può muoversi su un piano antero-posteriore. La frequenza deve essere attentamente calibrato poiché è stato dimostrato che i neuroni nella corteccia barile vengono attivati quando la frequenza di stimolazione di Baffo è tra 5 e 15 Hz19. Utilizzando una frequenza inferiore o superiore non comporterà l'attivazione della zona di S1BF.
Il protocollo utilizzato in questo studio permette di confrontare gli spettri acquisiti nella stessa area del cervello a riposo e durante la stimolazione cerebrale e, di conseguenza, per il monitoraggio metabolico cambia attivazione collegato a cerebrale. È importante eseguire una sequenza di localizzazione all'inizio e alla fine del protocollo spettroscopia NMR, per garantire che l'animale non è spostato e che le differenze nel contenuto metabolico misurato tra gli Stati di riposo o attivati sono a causa del cervello stimolazione e non artefatti di movimento.
Mediante il protocollo descritto nel presente documento, un aumento nel contenuto del lattato è stato misurato tra riposo e periodi di attivato. Aumento del lattato utilizzando in vivo NMR spettroscopia durante l'attivazione del cervello in primo luogo è stata osservata in esseri umani nei primi anni 199020,21. Tuttavia, la maggior parte delle misure sono state realizzate in esseri umani piuttosto che roditori, in cui il rapporto segnale-rumore è molto più basso. Nel ratto, ex vivo NMR quantificazione del lattato durante l'attivazione del cervello del ratto è stata eseguita da Mazuel et al. 22, che hanno osservato un aumento nel cervello lattato contenuto con attivazione neuronale. I risultati presentati qui dimostrano che lattato è stata aumentata durante l'attivazione whisker. Tuttavia, poiché MRS localizzata non consente cellulare ad alta risoluzione, è ancora sconosciuto dal lattato quale compartimento cellulare sta arrivando (neuroni o astrociti). Per andare oltre nella comprensione degli scambi metabolici cerebrali, come l'ancora dibattuto ANLSH (ipotesi di navetta del lattato di astrociti), questo protocollo deve essere applicato agli animali geneticamente modificati per componenti chiave in questa navetta, come il monocarboxylate trasportatori.
Nello studio descritto qui, è stata osservata nessuna differenza statisticamente significativa nel contenuto NAA. Una diminuzione nel contenuto NAA durante stimolazione visiva era precedentemente trovata in esseri umani23,24,25, ma non confermata da Mangia e Tkac26. Nello studio corrente, abbiamo osservato un aumento in NAA contenuto durante l'attivazione del cervello nel 50% dei ratti e una diminuzione in altra metà. Di conseguenza, NAA dovrebbe essere evitato come il riferimento interno per la quantificazione durante funzionale la signora No, altra variazione nel contenuto di metabolita è stata rilevata.
Entrambi lattato e variazioni di NAA durante l'attivazione neuronale hanno portato a controversie23,26,27,28,29. Per avanzare la nostra comprensione di queste fluttuazioni metaboliche legate all'attività del cervello, sarebbe interessante a questo protocollo si applica agli animali transgenici. Ciò fornirebbe ulteriori informazioni sul processo sottostante. Nel complesso, localizzato 1H-MRS durante un'attività, o funzionale MRS29, è una tecnica emergente nei roditori, pertinenti per lo studio della dinamiche regionale cambiamenti in metaboliti, nei cervelli normali o patologici.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Questo lavoro è stato supportato dalla concessione LabEx TRAIL, riferimento ANR-10-LABX-57 e un francese-svizzero ANR-FNS concedere riferimento ANR-15-CE37-0012. Gli autori ringraziano Aurélien Trotier per il suo supporto tecnico.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.5 mL syringe with needle | Becton, Dickinson and Company, USA | 2020-10 | 0.33 mm (29 G) x 12.7 mm |
| 1H spectroscopy surface coil | Bruker, Ettlingen, Germany | T116344 | |
| 7T Bruker Biospec system | Bruker, Ettlingen, Germany | 70/20 USR | |
| Arduino Uno based pulsing device | custom made | ||
| Atipamezole | Vétoquinol, S.A., France | V8335602 | Antisedan, 4.28 mg |
| Breathing mask | custom made | ||
| Eye ointment | TVM laboratoire, France | 40365 | Ocry gel 10 g |
| Induction chamber | custom made | 30x17x15 cm | |
| Inlet flexible pipe | Gardena, Germany | 1348-20 | 4.6-mm diameter, 3m long |
| Isoflurane pump, Model 100 series vaporizer, classic T3 | Surgivet, Harvard Apparatus | WWV90TT | from OH 43017, U.S.A |
| Isoflurane, liquid for inhalation | Vertflurane, Virbac, France | QN01AB06 | 1000 mg/mL |
| KD Scientific syringe pump | KD sientific, Holliston, USA | Legato 110 | |
| LCModel software | LCModel Inc., Ontario, Canada | 6.2 | |
| Medetomidine hydrochloride | Vétoquinol, S.A., France | QN05CM91 | Domitor, 1 mg/mL |
| Micropore roll of adhesive plaster | 3M micropore, Minnesota, United States | MI912 | |
| Micropore roll of adhesive plaster | 3M micropore, Minnesota, United States | MI925 | |
| Monitoring system of physiologic parameter | SA Instruments, Inc, Stony Brook, NY, USA | Model 1025 | |
| NaCl | Fresenius Kabi, Germany | B05XA03 | 0.9 % 250 mL |
| Outlet flexible pipe | Gardena, Germany | 1348-20 | 4.6-mm diameter, 4m long |
| Paravision software | Bruker, Ettlingen, Germany | 6.0.1 | |
| Peripheral intravenous catheter | Terumo, Shibuya, Tokyo, Japon | SP500930S | 22 G x 1", 0.85x25 mm, 35 mL/min |
| Rat head coil | Bruker, Ettlingen, Germany | ||
| Sodic heparin, injectable solution | Choai, Sanofi, Paris, France | B01AB01 | 5000 IU/mL |
| Solenoid control valves, plunger valve 2/2 way direct-acting | Burkert, Germany | 3099939 | Model type 6013 |
| Terumo 2 ml syringe | Terumo, Shibuya, Tokyo, Japon | SY243 | with 21 g x 5/8" needle |
| Terumo 5 mL syringe | Terumo, Shibuya, Tokyo, Japon | 05SE1 | |
| Wistar RJ-Han rats | Janvier Laboratories, France |
Riferimenti
- Pellerin, L., et al. Activity-dependent regulation of energy metabolism by astrocytes: an update. Glia. 55, 1251-1262 (2007).
- Pellerin, L., Magistretti, P. J. Glutamate uptake into astrocytes stimulates aerobic glycolysis: a mechanism coupling neuronal activity to glucose utilization. Proceedings of the National Academy of Sciences of the United States of America. 91, 10625-10629 (1994).
- Cholet, N., et al. Local injection of antisense oligonucleotides targeted to the glial glutamate transporter GLAST decreases the metabolic response to somatosensory activation. Journal of Cerebral Blood Flow & Metabolism. 21, 404-412 (2001).
- Voutsinos-Porche, B., et al. Glial Glutamate Transporters Mediate a Functional Metabolic Crosstalk between Neurons and Astrocytes in the Mouse Developing Cortex. Neuron. 37, 275-286 (2003).
- Zimmer, E. R., et al. [18F]FDG PET signal is driven by astroglial glutamate transport. Nature Neuroscience. 20 (3), 393-395 (2017).
- Haiss, F., et al. Improved in vivo two-photon imaging after blood replacement by perfluorocarbon. The Journal of Physiology. , (2009).
- Mullins, P. G. Towards a theory of functional magnetic resonance spectroscopy (fMRS): A meta-analysis and discussion of using MRS to measure changes in neurotransmitters in real time. Scandinvian Journal of Psychology. 59, 91-103 (2018).
- Wong-Riley, M. T., Welt, C. Histochemical changes in cytochrome oxidase of cortical barrels after vibrissal removal in neonatal and adult mice. Proceedings of the National Academy of Sciences of the United States of America. 77, 2333-2337 (1980).
- Petersen, C. C. The functional organization of the barrel cortex. Neuron. 56, 339-355 (2007).
- Cox, S. B., Woolsey, T. A., Rovainen, C. M. Localized dynamic changes in cortical blood flow with whisker stimulation corresponds to matched vascular and neuronal architecture of rat barrels. Journal of Cerebral Blood Flow & Metabolism. 13, 899-913 (1993).
- Feldmeyer, D. Excitatory neuronal connectivity in the barrel cortex. Frontiers in Neuroanatomy. 6, 24 (2012).
- Boussida, S., Traore, A. S., Durif, F. Mapping of the brain hemodynamic responses to sensorimotor stimulation in a rodent model: A BOLD fMRI study. PLoS One. 12, e0176512 (2017).
- Heinke, W., Koelsch, S. The effects of anesthetics on brain activity and cognitive function. Current Opinion in Anesthesiology. 18, 625-631 (2005).
- Horn, T., Klein, J. Lactate levels in the brain are elevated upon exposure to volatile anesthetics: a microdialysis study. Neurochemistry International. 57, 940-947 (2010).
- Boretius, S., et al. Halogenated volatile anesthetics alter brain metabolism as revealed by proton magnetic resonance spectroscopy of mice in vivo. Neuroimage. 69, 244-255 (2013).
- Sinclair, M. D. A review of the physiological effects of alpha2-agonists related to the clinical use of medetomidine in small animal practice. Canadian Veterinary Journal. 44, 885-897 (2003).
- Weber, R., et al. A fully noninvasive and robust experimental protocol for longitudinal fMRI studies in the rat. Neuroimage. 29, 1303-1310 (2006).
- Hartmann, M. J., Johnson, N. J., Towal, R. B., Assad, C. Mechanical characteristics of rat vibrissae: resonant frequencies and damping in isolated whiskers and in the awake behaving animal. The Journal of Neuroscience. 23, 6510-6519 (2003).
- Prichard, J., et al. Lactate rise detected by 1H NMR in human visual cortex during physiologic stimulation. Proceedings of the National Academy of Sciences of the United States of America. 88, 5829-5831 (1991).
- Sappey-Marinier, D., et al. Effect of photic stimulation on human visual cortex lactate and phosphates using 1H and 31P magnetic resonance spectroscopy. Journal of Cerebral Blood Flow & Metabolism. 12, 584-592 (1992).
- Mazuel, L., et al. A neuronal MCT2 knockdown in the rat somatosensory cortex reduces both the NMR lactate signal and the BOLD response during whisker stimulation. PLoS One. 12, e0174990 (2017).
- Castellano, G., et al. NAA and NAAG variation in neuronal activation during visual stimulation. Brazilian Journal of Medical and Biological Research. 45, 1031-1036 (2012).
- Sarchielli, P., et al. Functional 1H-MRS findings in migraine patients with and without aura assessed interictally. Neuroimage. 24, 1025-1031 (2005).
- Baslow, M. H., Hrabe, J., Guilfoyle, D. N. Dynamic relationship between neurostimulation and N-acetylaspartate metabolism in the human visual cortex: evidence that NAA functions as a molecular water pump during visual stimulation. Journal of Molecular Neuroscience. 32, 235-245 (2007).
- Mangia, S., Tkac, I. Dynamic relationship between neurostimulation and N-acetylaspartate metabolism in the human visual cortex: evidence that NAA functions as a molecular water pump during visual stimulation. Journal of Molecular Neuroscience. 35, 245-248 (2008).
- Baslow, M. H., Hrabal, R., Guilfoyle, D. N. Response of the authors to the Letter by Silvia Mangia and Ivan Tkac. Journal of Molecular Neuroscience. 35, 247-248 (2008).
- Barros, L. F., Weber, B. CrossTalk proposal: an important astrocyte-to-neuron lactate shuttle couples neuronal activity to glucose utilisation in the brain. The Journal of Physiology. 596, 347-350 (2018).
- Bak, L. K., Walls, A. B. CrossTalk opposing view: lack of evidence supporting an astrocyte-to-neuron lactate shuttle coupling neuronal activity to glucose utilisation in the brain. The Journal of Physiology. 596, 351-353 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon