Method Article
Funktionelle Magnet-Resonanz-Spektroskopie bei 7 T in der Ratte Barrel Cortex während der Whisker-Aktivierung
In diesem Artikel
Zusammenfassung
Nach der Überprüfung durch Blut-Sauerstoff-Niveau-abhängigen funktionelle Magnetresonanztomographie (BOLD fMRT), die der entsprechenden somatosensorischen Fass Feld Kortex Bereich (genannt S1BF) korrekt aktiviert, die wichtigsten Ziel dieser Studie ist es, Laktat Inhalt zu quantifizieren Schwankungen in den aktivierten Ratte Gehirnen von lokalisierten Proton Magnetische Resonanzspektroskopie (1H-MRS) bei 7 T.
Zusammenfassung
Kernresonanzspektroskopie (NMR) bietet die Möglichkeit, zerebrale Metabolit Inhalt in Vivo zu messen und nicht-invasiv. Dank der technologischen Entwicklungen des letzten Jahrzehnts und die Erhöhung der Magnetfeldstärke ist es jetzt möglich, gute Auflösung Spektren in Vivo in der Rattengehirn zu erhalten. Neuroenergetics (d.h. das Studium der Stoffwechsel im Gehirn) und vor allem, metabolische Interaktionen zwischen den verschiedenen Zelltypen haben immer mehr Interesse in den letzten Jahren angezogen. Unter dieser metabolischen Wechselwirkungen ist die Existenz eines Laktat-Shuttle zwischen Neuronen und Astrozyten noch umstritten. Es ist daher von großem Interesse für funktionale Proton Magnetische Resonanzspektroskopie (1H-Frau) in einem Rattenmodell des Gehirns Aktivierung und Monitor Laktat durchführen. Jedoch die Methyl-Laktat-Spitze überlappt Lipid Resonanz Gipfeln und ist schwer zu quantifizieren. Die nachfolgend beschriebene Protokoll ermöglicht metabolische und Laktat-Schwankungen in einem aktivierten Hirnareal überwacht werden. Zerebrale Aktivierung erhält man durch Whisker Stimulation und 1H-MRS erfolgt in der entsprechenden aktivierten Fass Kortex, deren Gebiet mit Blut-Sauerstoff-Niveau-abhängigen funktionelle Magnetresonanztomographie (fMRT Fett) nachgewiesen ist. Alle Schritte sind ausführlich beschrieben: die Wahl von Anästhetika, Spulen und Sequenzen, effiziente Whisker Stimulation direkt in den Magneten und Datenverarbeitung zu erreichen.
Einleitung
Das Gehirn besitzt innere Mechanismen, mit denen die Regulierung von seinem großen Substrat (d.h., Glukose), sowohl für ihren Beitrag und dessen Nutzung, je nach Variationen in lokalen zerebralen Aktivität. Obwohl Glukose die wichtigsten Energie-Substrat für das Gehirn ist, haben in den letzten Jahren durchgeführten Experimente gezeigt, dass Laktat, die von den Astrozyten produziert wird, könnte eine effiziente Energie-Substrat für die Neuronen. Dies wirft die Hypothese eines Laktat-Shuttle zwischen Astrozyten und Neuronen1. Bekannt als ANLS, für Astrozyten-Neuron Laktat Shuttle2, die Theorie ist immer noch sehr umstritten, aber hat dazu geführt, den Vorschlag, dass Glukose, anstatt gehen direkt in Neuronen, gestattet die Astrocyten, wo es in verstoffwechselt wird Laktat, ein Stoffwechselprodukt, das ist , dann übertragen auf die Neuronen, die es als effiziente Energie-Substrat verwenden. Wenn solch ein Shuttle in Vivovorhanden ist, müsste es mehrere wichtige Konsequenzen für das Verständnis der grundlegenden Techniken in funktionelle zerebrale Bildgebung (Positronen-Emissions-Tomographie [PET]) und für die Entschlüsselung der Stoffwechselveränderungen beobachtet im Gehirn Pathologien.
Stoffwechsel im Gehirn zu studieren, und besonders, metabolische Interaktionen zwischen Neuronen und Astrozyten, vier Haupttechniken zur Verfügung (nicht einschließlich Mikro-/ Nanosensoren): Autoradiographie, PET, zwei-Photon fluoreszierende konfokalen Mikroskopie und Frau. Autoradiographie war eines der ersten Verfahren vorgeschlagen und liefert Bilder der regionalen Anhäufung von radioaktiven 14C-2-Deoxyglucose in Hirnschnitten, während PET Erträge in Vivo Bilder der regionalen Aufnahme von radioaktiven 18 F-Deoxyglucose. Beide haben den Nachteil der Verwendung von irradiative Molekülen beim produzieren niedrige räumliche Auflösung. Zwei-Photonen-Mikroskopie bietet zellulären Auflösung von fluoreszierenden Sonden, aber Lichtstreuung durch Gewebe begrenzt die bildgebende Tiefe. Diese drei Techniken haben früher, während Whisker Stimulation3,4,5,6Neuroenergetics bei Nagetieren zu studieren. In vivo MRS hat den doppelten Vorteil, nicht-invasive und nicht radioaktiven und jede Gehirnstruktur erkundet werden. Darüber hinaus kann MRS durchgeführt werden, während der neuronalen Aktivierung, eine Technik namens funktionale MRS (fMRS), die vor kurzem in Nagetieren7entwickelt wurde. Daher wird vorgeschlagen, ein Protokoll zum Stoffwechsel im Gehirn während der zerebralen Aktivität von 1H-Frau in Vivo und nicht-invasiv zu überwachen. Das Verfahren kann wird bei Erwachsenen gesunden Ratten mit Gehirn-Aktivierung erhalten durch einen Luftstoß Whisker Stimulation durchgeführt direkt in einen 7 T Magnetresonanz (MR) Imager beschrieben jedoch bei genetisch veränderten Tieren, sowie in einem pathologischen Zustand angepasst .
Protokoll
Alle tierische Verfahren wurden nach den Tier Experimente Vorgaben der Richtlinie der Europäischen Gemeinschaften der 24. November 1986 (86/609/EWG) durchgeführt. Das Protokoll erfüllt die ethischen Richtlinien des französischen Landwirtschaftsministeriums und Wäldern und von den lokalen Ethikkommissionen genehmigt wurde (Comité d 'Éthique pour L' Expérimentation Animale Bordeaux n ° 50112090-A).
Hinweis: Während der Herr Messungen, ein angemessenes Schutzniveau Anästhesie und physiologisches monitoring (Körpertemperatur, Atemfrequenz) sind unabdingbare Voraussetzungen.
(1) Tiere
- Verwenden Sie männliche Wistar-Ratten mit einem Gewicht zwischen 350 und 450 g.
- Halten Sie sie auf einem 12:12 h hell: Dunkel-Zyklus und liefern Nahrung und Wasser Ad Libitum.
(2) Anästhesie
- Bereiten Sie die notwendige Ausrüstung für Anästhesie (Abb. 1A, B, siehe Tabelle of Materials): eine 5 mL Spritze mit Medetomidine in physiologischer Kochsalzlösung (240 µg/kg/h, mit einer Perfusion Rate von 20 µL/min), eine 0,5 mL Spritze mit Atipamezol (20 μl in 0,5 mL Kochsalzlösung) und Augensalbe.
Hinweis: Halten Sie alle Geräte unter der Dunstabzugshaube, mit Ausnahme der 5 mL-Spritze mit Medetomidine, die in der Spritzenpumpe in der Nähe der Magnet für Anästhesie bei Herrn Akquisitionen gelegt wird. - Legen Sie die Ratte in der Induktion Kammer und starten Sie die Narkose durch die Bereitstellung von 4 % Isofluran passen Sie die Sauerstoff-Durchflussmenge bis 1,5 L/min.
- Bewerten Sie die Tiefe der Narkose durch die Beurteilung des Rückzug der Pfote Reflexe.
- Wenn die Ratte nicht auf Reize reagiert, nehmen Sie es aus der Narkose-Box, legen Sie es auf der Bank mit der Nase in der Isofluran-Maske und erhalten Sie Anästhesie durch die Bereitstellung von 2,5 % Sauerstoff bei 1,5 L/min zu.
- Sanft massieren Sie das Heck und legen Sie die Blutsperre (Abbildung 1).
Hinweis: Die Massage kann in warmem Wasser mit einer Temperatur zwischen 38 und 42 ° C, um bessere Vasodilatation der Venen zu erhalten durchgeführt werden. - Legen Sie die periphere intravenöse Katheter (22 G), zuvor heparinisierten, in der linken oder rechten Rute Ader. Beachten Sie, dass eine venöse Rückkehr beobachtet wird (ein Tropfen Blut ist sichtbar auf den distalen Teil der Nadel) wenn der Katheter ist korrekt eingefügt (Abbildung 1).
- Eventuelle Luftblasen vorhanden in den Katheter Totraum Volumen mit der 2 mL Spritze mit physiologischer Kochsalzlösung und Heparin ausblasen.
- Auftragen Sie der Augensalbe und bereiten Sie die Spritze mit Atipamezol (17 µg/mL) um die Ratte am Ende des Experiments zu wecken.
(3) Ratte Platzierung im Magnet für Whisker Stimulation
- Legen Sie einen Atem-Sensor auf dem Magnet-Bett und übertragen Sie dann die Ratte von der Bank auf dem Magnet-Bett. Legen Sie es in Bauchlage mit seiner Nase in der Isofluran-Maske mit der Atmung-Sensor befindet sich zwischen dem Brustkorb und dem Magnet-Bett.
Hinweis: Alle Geräte, der den MRT-Raum betritt sollte MRT-sicher sein. - Verringern Sie Isofluran (von 4 % auf 1,5 %-2 %) zu, während der Ratte Platzierung und wechseln Sie die Narkose zu Medetomidine am Ende dieses Verfahrens. Sicherstellen Sie, dass die richtige Schnurrhaare kostenlos sind, haben am rechten Rand an der Vorderseite der Ratte MRI Bett vorher für eine Bewegung der die Barthaare schneiden.
- Halten Sie die Ratte in Position mit Klebeband und überwachen Sie ihre Atmung, die zwischen 60 und 80 Atemzüge pro Minute liegen muss.
- Machen Sie ein Segel, das alles in Ordnung Schnurrhaare in den Papierstreifen (Abbildung 2) fallen. Richten Sie das flexible Auslaufrohr der Luftstoß Anlage entlang der Ratte MRI Bett, so dass das Teil beenden das Rohr senkrecht steht und ca. 1,5 cm aus dem Segel. Mit Papier-Klebeband befestigen.
4. Whisker Stimulation
- Verbinden Sie die flexible Zuleitung eine Druckluftquelle (1 Bar) mit einem Magnetventil Ventil Steuereingang und das Abzugsrohr an der Magnetspule Regelausgang Ventil (Abbildung 3). Sicherstellen Sie, dass das Magnetventil Kontrolle außerhalb des Magnet-Raumes bleibt.
- Stecken Sie das pulsierende Gerät in das Magnetventil und in den Magneten mit der Transistor-Transistor-Logik (TTL)-Port. Konfigurieren Sie es so, dass die pulsierenden Frequenz = 8 Hz, der Impuls-Zeit = 20 s und die Ruhezeit = 10 s.
Hinweis: Diese Parameter visualisiert auf den kleinen Flüssigkristall Bildschirm (LCD), sind die drei engagierten analoge Potentiometer einstellbar über . Das elektronische pulsierende Gerät, das welches das Paradigma steuert, muss qualitativ hochwertige Elektronikbauteile vermeide jegliche Drift in Zeitparameter (für die richtige Nachbearbeitung) zusammengesetzt sein.
(5) BOLD fMRT Erwerb
- Platzieren Sie die Rattengehirn zu, so dass es in einer aufrechten Position und verwenden Sie die Ohr-Balken, um sie aufrecht zu erhalten. Legen Sie die Lautstärke Array Spule über die Ratte Kopf (Abb. 4A) und mit Klebeband fixieren. Überprüfen Sie, ob das Segel richtig bewegt (Anteroposterior Bewegung, keine Rotation und keine Reibung des Segels) wenn der Luftstoß System ist gedreht auf; dann schalten Sie es aus.
- Legen Sie das Bett und die Spule in der Mitte des Magneten. Überprüfen Sie, ob das Segel richtig noch in Bewegung ist, sobald das Bett innerhalb der Magnet ist, wenn der Luftstoß System eingeschaltetist; dann schalten Sie es aus. Wechseln Sie komplett von Isofluran in Medetomidine (Perfusion Rate: 20 µL/min).
- Überprüfen Sie, dass die Ratte gut gelegen unter Verwendung einer Lokalisierung-Sequenz (TE = 2,5 ms; TR = 100 ms; Durchschnitt = 1; Wiederholung = 1; Stück = 1 mm; Bildgröße = 256 x 256; Sichtfeld (FOV) = 50 x 50 mm; Scan-Zeit = 12 s 800 ms). Ziehen Sie der Localizer -Sequenz-Registerkarte in der Anweisung Namen und klicken Sie auf weiter.
- Ziehen Sie die T2_Star_FID_EPI -Sequenz-Registerkarte in der Anweisung Name, Zentrum der FOV auf der Mitte des Gehirns, und klicken Sie auf der Registerkarte " Einstellung Plattform ", die bearbeitete Scan-Anweisung zu öffnen. Zeichnen Sie eine B-0 -Karte und fahren Sie mit einem Scan-Shim.
Hinweis: Für eine B-0 -Karte, verwenden Sie die folgenden Parameter: Echo erstmals = 1,65 ms; TR = 20 ms, durchschnittliche = 1; Flip-Winkel = 30°; Echo Abstand = 3,805 ms; Scheibe = 58 mm; Bildgröße = 64 x 64 x 64; FOV = 58 x 58 x 58 mm; Scan-Zeit = 1 m 24 s 920 Frau für Scan Shim, verwenden Sie die folgenden Parameter: Voxel selektive Anregung = Dampf "glockenförmig" Puls; TE = 5 ms; Mischzeit = 10 ms; Übernahme Dauer = 204,8 ms; Bandbreite = 10.000 Hz; Verweilzeit = 50 μs). - Starten Sie die Sequenz T2 Star_FID_EPI (TE = 16,096 ms; TR = 500 ms; Durchschnitt = 1; Wiederholung = 600; Stück = 1 mm; vier aufeinanderfolgende Scheiben; Bildgröße = 128 x 128; FOV = 20 x 20 mm; Bandbreite = 333.333,3 Hz; Scan-Zeit = 5 min 00 s).
Hinweis: Aufgrund der TTL-Port, ein externes Triggersignal Luftstoß System zur gleichen Zeit startet. Das Paradigma = [20 s Aktivierung + 10 s Rest] X 10 für die gesamte Dauer der 600 Scans, 500 ms pro Scan. Die Scheiben sind in der Mitte des Bereichs Fass Bereich zentriert. - Erwerben Sie eine andere Lokalisierung-Sequenz (gleiche wie eine beschriebene in Schritt 5.3), um mit dem ersten zu vergleichen und prüfen, ob die Ratte ist während der T2_Star_FID_EPI Sequenz umgezogen.
- Das Bett in die Ausgangsposition zu bringen, entfernen Sie die Volumen-Array-Spule und die Oberfläche Spule zu verbinden.
6. Fett Verarbeitung
- Öffnen Sie die T2-Star_FID_EPI-Datei und lesen Sie das T2 Star_FID_EPI Bild in Bild-Anzeige. Öffnen Sie das Start-up-Fenster der funktionale Steuerung, genannt FunController.
- In dieser Registerkarte " Bearbeiten " wählen Sie das funktionelle Bildgebung Fenster und definieren Sie die Stimulation-Protokoll (Dauer und Wechsel von On/Off Perioden, entspricht das Paradigma verwendet).
- Wählen Sie das Protokoll-Fenster (Dataset mit 600 Frames) und legen Sie den Wert von 40 in der Registerkarte " Auf Zeit " und 20 in die Widerrufsfrist Registerkarte klicken Sie auf die Registerkarte " Attribution invertieren " und ziehen Sie den Schieberegler Stimulation Staaten auf der linken Seite, wählen die Wert 1.
- Klicken Sie im Fenster Vorverarbeitung auf dem Median-Filter im Flugzeug für die Vorverarbeitung und auf dem Median-Filter (2D, 3D) für die Nachbearbeitung.
- Klicken Sie auf die Registerkarte " Execute " und ziehen Sie den Cursor um die Overlay-Lookup-Tabelle anzupassen. Visualisieren Sie die aktivierte Hirnareal (Abbildung 4 b).
(7) Proton Frau Akquisitionen
- Um die Oberfläche Spule richtig zu positionieren, ändern Sie die Position des Kopfes Ratte. Drehen Sie den Kopf (ca. 30° im Uhrzeigersinn), so dass die Oberfläche Spule (Abb. 5A) oberhalb des linken Fasses Kortex dabei horizontal und befindet sich im Zentrum innerhalb der Magnet Magnet platziert werden kann.
- Legen Sie die Oberfläche Spule, befestigen Sie es an die Rattengehirn mit Klebeband (Abb. 5 b) und überprüfen Sie, ob das Segel richtig bewegt (Anteroposterior Bewegung, keine Rotation und keine Reibung des Segels) wenn der Luftstoß System ist gedreht auf; dann schalten Sie es aus mit dem Hauptschalter.
- Überprüfen Sie, dass das Segel richtig bewegt, sobald das Bett innerhalb der Magnet ist, wenn der Luftstoß System eingeschaltetist. Dann schalten Sie es aus.
- Überprüfen Sie, dass die Ratte sitzt korrekt verwenden eine Folge von Lokalisierung. Legen Sie die Parameter wie folgt: TE = 2,5 ms; TR = 100 ms; Durchschnitt = 1; Wiederholung = 1; Stück = 1 mm; Bildgröße = 256 x 256; FOV = 50 x 50 mm; Scan-Zeit = 12 s 800 ms.
- Ziehen Sie der Localizer -Sequenz-Registerkarte in der Anweisung Name Fenster und klicken Sie auf die Registerkarte " weiter ", um das Scan-Programm auszuführen.
- Wenn die Gehirn Lokalisierung korrekt ist, ziehen Sie die T2_TurboRARE -Sequenz-Registerkarte im Fenster Befehl Name und klicken Sie auf weiter , um das Scan-Programm ausführen. Diese anatomische Bilder, zusammen mit der früheren BOLD fMRT-Übernahme ermöglicht die korrekte Lokalisierung der Voxel in der S1BF für MRS.
Hinweis: Die T2_TurboRARE-Parameter sind 14 Scheiben, 2 mm pro Scheibe, FOV = 2,5 x 2,5 cm, TE = 100 ms, TR = 5.000 ms Matrix = 128 x 128, Sequenz-Zeit = 2 min 40 s. - Ziehen Sie LASER -Sequenz-Registerkarte in der Anweisung Name -Fenster, stellen Sie die Voxel (Höhe 2 mm, 2,5 mm lang, 3 mm tief) in den Mittelpunkt des Gebiets S1BF.
- Verwenden Sie eine Ratte Gehirn-Atlas und die BOLD fMRT-Verbesserung die Zone auf die T2-Bilder (Abbildung 6) zu lokalisieren. Klicken Sie auf der Registerkarte " Einstellung Plattform ", die bearbeitete Scan-Anweisung zu öffnen. Klicken Sie auf die Registerkarte " wackeln " und ändern Sie die Impedanz (elektronische laden) der Spule empfangen es leicht Tune. Klicken Sie auf die Registerkarte " anwenden ", wenn die Abstimmung abgeschlossen ist, schließen Sie den Editor Anleitung und übernehmen Sie die Änderungen in der bearbeiteten Anweisung.
- Aufzeichnen einer B-0 -Karte und fahren Sie mit Shim zu scannen, und führen Sie dann einen lokalen Shim.
Hinweis: Für die B-0 -Karte, verwenden Sie die folgenden Parameter: Echo erstmals = 1,65 ms; TR = 20 ms, durchschnittliche = 1; Flip-Winkel = 30°; Echo Abstand = 3,805 ms; Scheibe = 58 mm; Bildgröße = 64 x 64 x 64; FOV = 58 x 58 x 58 mm; Scan-Zeit = 1 m 24 s 920 Frau für die Scan-Shim, verwenden Sie die folgenden Parameter: Voxel selektive Anregung Dampf "glockenförmig" Puls; TE = 5 ms; Mischzeit = 10 ms; Übernahme Dauer = 204,8 ms; Bandbreite = 10.000 Hz; Verweilzeit = 50 μs. Für die lokalen Shim, verwenden Sie die folgenden Parameter: Wasser-Unterdrückung, Dampf Übernahme Dauer = 1.363,15 ms; Punkte = 4.096; Bandbreite in Hz = 3.004,81 Hz; Bandbreite in ppm = 10 ppm; Verweilzeit = 166,40 μs; spektrale Auflösung = 0,37 Hz/Punkte. Die LASER-Parameter sind: echo der Zeit = 19,26 ms; TR = 2.500 ms; Durchschnitt = 128 oder 32; Scan-Zeit = 5 min 20 s oder 1 min 20 s; Erwerb Punkte = 4.096. - Führen Sie 1H-Frau.
- Start der 1H-MRS Erwerb zunächst während einer Ruhephase (Laserscans 4 x 32 + 128 LASER scannt; 2.500 ms pro scan).
- Erwerben Sie eine andere Lokalisierung-Sequenz (gleiche wie eine beschriebene in Schritt 5.3) zu vergleichen mit dem ersten aufgenommen und sorgen dafür, dass die Ratte nicht schon beim Erwerb der LASER bewegt hat.
- 1H-MRS während Whisker Aktivierung unter Verwendung des LASER-Sequenz durchführen (Laserscans 4 x 32 + 128 LASER scannt; 2.500 ms pro scan) mit dem Luftstoß System (Paradigma = 20 s der Aktivierung und 10 s Rest).
- Wieder einmal führen Sie eine Lokalisierung Abfolge zu prüfen, ob die Ratte ist umgezogen.
Hinweis: Die Anzahl der Scans und ruhen/aktiviert Perioden kann angepasst und geändert werden, aber darauf achten, dass die Ratte nicht bewegt wird, durch eine Lokalisierung Sequenz regelmäßig durchführen.
- Bringen Sie das Bett in die Ausgangsposition zu, entfernen Sie die Oberfläche Spule zu und verschieben Sie die Ratte zurück auf die Bank. Injizieren Sie Atipamezol in eine Hautfalte gemacht in der Ratte zurück zum Umkehren der Narkose und wecken sie.
(8) Proton Frau Verarbeitung
- Öffnen Sie die LCModel-Software, und klicken Sie auf die entsprechende Registerkarte, wählen den richtigen Datentyp ( Free Induction Decay -Datei) und wählen die richtige Datei. Klicken Sie auf die Registerkarte " OK ", wenn dies geschehen ist.
- Die Quantifizierung Steuerungsparameter Schritt für Schritt zu optimieren.
- Im Abschnitt Titel manuell geben Sie einen Titel und definieren Sie eine angemessene ppm-Bereich (z.B. 0,2 bis 4,0 ppm) durch manuelle Eingabe in den benötigten Wert in die entsprechenden Felder.
- Im Abschnitt Basis-Datei wählen Sie und laden Sie die gewünschte Datei korrekt angepasst Makromolekül Baseline (es kann durch die Software-Anbieter bereitgestellt werden).
- Definieren und die input-Regler-Parameter zu laden. Bereiten Sie den Speichervorgang Prozess aller nützlichen Dateitypen im Voraus (Tabelle = kompakte Tabellen; PS = notwendig PostScript-Ausgabe; CSV = Format für Arbeitsblätter; KOORD = Koordinaten für Grundstücke). Klicken Sie auf die Registerkarte " RunLCModel ", um die Quantifizierung von LCModel zu starten.
- Definieren Sie ausgewählte Metaboliten um Statistiken zu generieren.
Hinweis: LCModel bietet Metabolit Quantifizierung und schätzt Fehler durch einen Wert Cramér-Rao Untergrenze (CRLB) bezeichnet. Ein Wert mit einem CRLB < 15 gilt als eine optimale Quantifizierung. Ein CRLB > 25 zeigt einen unzuverlässigen Wert.
Ergebnisse
Dieses Protokoll ermöglicht die Quantifizierung der Metabolit Schwankungen während der zerebrale Aktivierung, die durch richtige Whisker Stimulation direkt im Magneten erzielt wird.
In dieser Studie wurde das Gesamtziel der BOLD fMRT zu prüfen, ob die Whisker Stimulation effizient war, aktivierte S1BF Bereich zu visualisieren und die Voxel für 1H-fMRS richtig lokalisieren. Das Gerät gebaut für Whisker Aktivierung ist effizient. In der Tat, wenn Sie richtige Schnurrhaare angeregt wurden mit dem hausgemachten Luftstoß System, ein positives Signal Fett wurde erkannt im linken Fass Kortex (Abbildung 4 b), auch genannt die S1BF für das somatosensorische Fass-Feld (n = 8). Eine positives Signal-Verbesserung wurde im linken Fass Kortex in acht von acht Ratten festgestellt, während nur Hintergrund in der rechten Hemisphäre nachgewiesen wurde. Als BOLD fMRT ohne Whisker Stimulation durchgeführt wurde, wurde kein Signal Erweiterung entweder links oder rechts S1BF beobachtet.
Im Vergleich zwischen anatomischen MRT-Bilder und Ratte Gehirn Atlas Systeme8ermöglicht dem aktivierten Hirnareal von BOLD fMRT visualisiert die Voxel im Bereich S1BF platziert werden, die während der Whisker Stimulation aktiviert wird. Dieses Voxel befindet sich auf drei aufeinander folgenden Folien (1 mm dick), da der Lauf Kortex 3 mm lang ist. Wenn die Gehirn-Folie praktisch in vier Viertel aufgeteilt wird, die Voxel befindet sich in der oberen linken Viertel in einem Winkel von ca. 45° (Abbildung 6).
Wenn das Paradigma für die Whisker Stimulation aktiviert wurde, wurde ein Anstieg der Laktat-Inhalte in der linken S1BF beobachtet (Abbildung 6, typische Spektren erwarb eine Ratte). Besser visualisieren metabolische Schwankungen zwischen Ruhe- und aktivierten Perioden, eine spektrale Subtraktion durchgeführt wurde (Abbildung 6). Aus diesem subtrahiert Spektrum, die Erhöhung des Anteils von Laktat mit Gehirn-Aktivierung wurde viel leichter, visualisiert in diese Ratte N-Acetylaspartat (NAA) Signal wurde leicht verringert. Laktat-Anstieg während der neuronalen Stimulation wurde auch auf die spektrale Dekonvolution (Abbildung 7AB) beobachtet. Während die Laktat-Spitze auf die in-Vivo -Spektrum in Ruhe kaum erkannt wurde, konnte LCModel es (Abb. 7A) mit Genauigkeit und gute CRLB Werte quantifizieren. In der Tat, hatte nur ein Spektrum aus 23 Ratten einen CRLB-Wert für Laktat Quantifizierung gleich 24. Keiner war > 25. Für alle anderen Spektren, die Werte lagen zwischen 3 und 19.
Die Variationen in Laktat Inhalt in alle 23 Ratten sind in Abbildung 8dargestellt. Aus 23 Ratten wurde eine Abnahme der Laktat-Inhalt nur in eine Ratte beobachtet. Gab es ein statistisch signifikanter Unterschied in Laktat Inhalte zwischen Ruhe und aktivierten Perioden (0.132 ± 0,012 und 0,163 ± 0,011, Werte bzw. Verwandten gekoppelt, um PCr + Cr Content, t-test, p = 0,0005 [parametrische, zweiseitige] n = 23). Daher wurde eine 31,6 % ± 7.8 % Zunahme der Laktat-Inhalt während der neuronalen Stimulation gemessen.
Ein leichter Rückgang der NAA-Inhalt kann in Abbildung 6, beobachtet werden, die typische Spektren erwarb ein Tier darstellt. Diese NAA-Variante war jedoch nicht signifikant (ein Rückgang um 1,2 % ± 1,2 % gemessen wurde, n = 23).
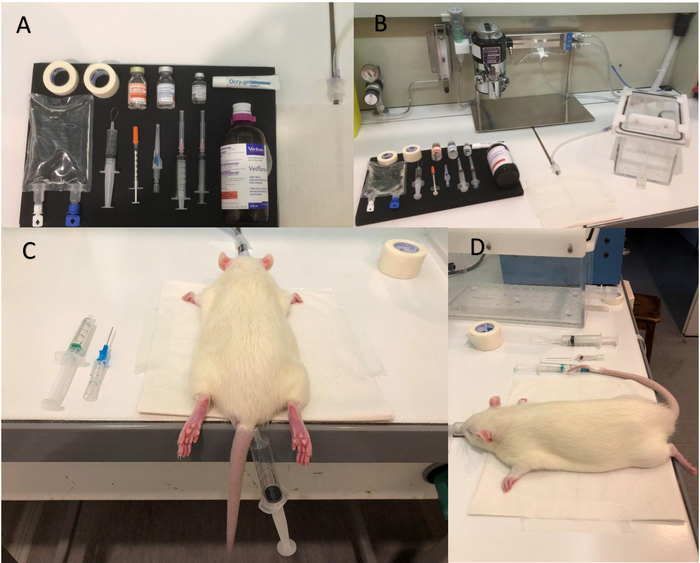
Abbildung 1: Ausrüstung und Schritte für die Anästhesie. (A) Bild der Ausrüstung vor Beginn der Narkose vorbereitet werden. (B) Isofluran Pumpe und Induktion Kammer. (C) Tourniquet-Platzierung. (D) Bild zeigt, dass der Katheter korrekt eingesetzt wurde; Beachten Sie die Tropfen Blut in den Katheter Nadel, die ein positiven Zeichen für eine korrekte Lage in die Vene ist. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: Whisker Stimulation. Alle richtigen Schnurrhaare sind in ein Segel aus mit Papier-Klebeband gefangen. Das Segel ermöglicht alle richtigen Backenbart, gleichzeitig mit dem Luftstoß System stimuliert werden und daher maximiert der neuronale Aktivierung des Fasses Kortex. Die Steckdose des Luftstoß Systems (schwarze Röhre) sollte um 1,5 cm und senkrecht auf das Segel befinden. Check-außerhalb der Magnet um sicherzustellen, dass das Segel bewegt sich richtig durch den Luftstoß System einschalten. Das Segel muss bei 8 Hz in Richtung Anteroposterior (keine Rotation) bewegen. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3: Luftstoß System für die Whisker Stimulation. (A) A flexible Rohr verbindet der Druckluft (B) das Magnetventil Steuerung. Ein zweite flexibles Rohr bringt gepulste Luft aus den Steuerausgang Ventil Magnetventil am Segel. Das Magnetventil Steuerung ist am pulsierenden Gerät angeschlossen, das Paradigma steuert. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4: BOLD fMRT. (A) Volumen array Spule Platzierung. Die Ratte-Kopf ist in eine horizontale Position und vom Ohr Bars blockiert. Überprüfen Sie, dass das Segel sich frei bewegt und nicht, durch die Spule oder die MRI-Bett blockiert wird. (B) eine typische kühn Signal im aktivierten linken Fass Kortex (roter Pfeil). Kein Signal erkannt wird in die kontralaterale rechte Hemisphäre (blauer Pfeil). Die Schwelle liegt bei 76,5 % der maximal den Intensitätswert. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 5: Oberfläche Spule. (A) Bild der Oberfläche Spule in dieser Studie verwendet. (B) Oberfläche Spule Platzierung. Die Ratte Kopf muss leicht gedreht werden, sodass das linke Fass Kortex und somit die Oberfläche Spule in der Mitte des Bettes MRI befinden (der Kopf ist in einem Winkel von etwa 30°, ein guter Kompromiss zwischen der korrekten Position des linken Fasses Cortex für die Vertikalfilter gedreht CE-Spule und freien Bewegungen des Segels die richtige Schnurrhaare, welche nicht durch das MRI Bett geblockt werden sollte). Bitte klicken Sie hier für eine größere Version dieser Figur.
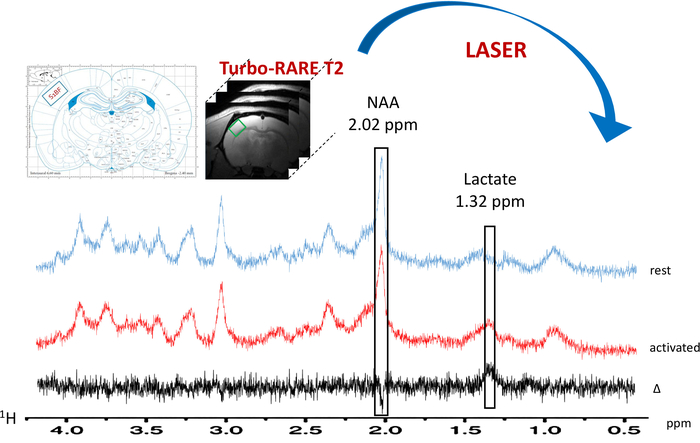
Abbildung 6: typische lokalisiert 1H-Frau in Ruhe (blaue Spektrum) und während der Whisker Aktivierung (rotes Spektrum). Die Voxel (grünes Quadrat) befindet sich in der linken S1BF auf die anatomischen T2_TurboRARE Bilder mit Ratte Gehirn Atlas Schemata und Signal-Verbesserung auf BOLD fMRT-Bilder. Die spektrale Subtraktion wird in schwarz gezeichnet. Laktat und N-Acetylaspartat (NAA) Gipfeln sind bei 1,32 und 2,02 ppm angegeben. Bitte klicken Sie hier für eine größere Version dieser Figur.
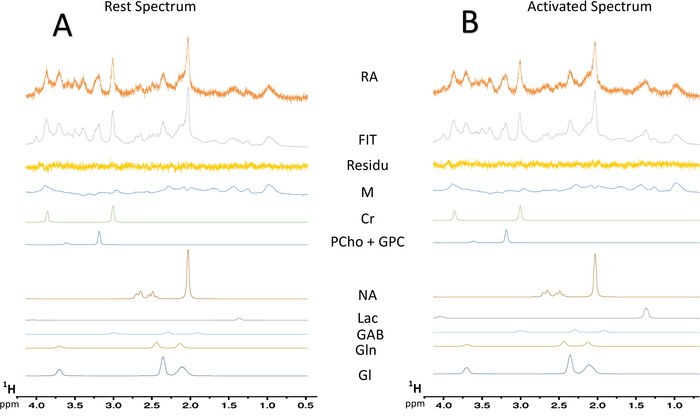
Abbildung 7: typische spektrale Dekonvolution Spektren von MRS. (A) Entfaltung eines 128-Scan Rest-Spektrums. (B) Entfaltung eines 128-Scans aktiviert Spektrum. Rückstände, Subtraktion zwischen experimentellen Spektrum (Rohdaten) und die LCModel passen; MM = Makromolekül; CR = Creatin + Phosphokreatin; PCho + GPC = Phosphocholin + Glycerophosphocholine; NAA = N-Acetylaspartat; Lac = Laktat; GABA = γ-Aminobuttersäure; GLN = Glutamin; Glu = Glutamat. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 8: Variationen in Laktat Inhalt während Hirnstimulation. Blauer Punkt: Laktat-Inhalt in Ruhe, durch LCModel und im Verhältnis zu der Creatin + Phosphokreatin Inhalt bestimmt. Roter Punkt: Laktat-Inhalt während der Whisker Stimulation, durch LCModel und im Verhältnis zu der Creatin + Phosphokreatin Inhalt bestimmt. Der Unterschied zwischen aktiviert und ruhen, p = 0,0005, gepaart t-Test (parametrische, zweiseitige), n = 23. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Der Lauf Kortex, auch als S1BF für die somatosensorischen Cortex oder Fass Feld ist eine Region innerhalb der kortikalen Schicht IV, die Cytochrom C Oxidase9Färbung beobachtet werden kann, und seiner Organisation ist bekannt, seit es weitgehend beschrieben 10,11. Ein Vibrissa ist mit einem Fass, verbunden in dem rund 19.000 Neuronen in einer Spalte12organisiert sind. Die Whisker-Fass Kortex Weg hat mehrere Vorteile. Erstens kann es aktiviert werden innerhalb des Magneten mit einem MRI-kompatiblen Luftstoß System, die sind einfach hausgemachte (um sicherzustellen, dass im größten Teil des Gebiets S1BF, die etwa die Größe der Voxel in der MRS ausgeführt wird, alle Barthaare entspricht werden in einem Segel, die ermöglicht die Stimulation von maximal Vibrissa gequetscht). Zweitens: gerade Whisker Aktivierung führt zur Aktivierung des linken Fasses Kortex, und dieser Bereich des Gehirns liegt im somatosensorischen Cortex, was den Einsatz einer hoch-Sensitive Oberfläche Spule ermöglicht. Drittens ist diese Methode zur Aktivierung des somatosensorischen Kortex nicht-invasive im Vergleich zu elektrischen Pfote Stimulation, die letzteren haben des Nachteil stimulieren andere Hirnstrukturen, darunter auch einige in der rechten Hemisphäre13. Daher ist das hier verwendete Protokoll, die am besten geeignete durchführen einer in-vivo, nicht-invasive und längs der Stoffwechsel im Gehirn unter zerebrale Aktivierung studieren.
Die Wahl der Narkose ist entscheidend, da viele der Anästhetika Veränderungen in neurovaskuläre Kopplung, Stoffwechsel im Gehirn und/oder Gehirn-Aktivität14,15 induzieren. Z. B. Isofluran, das am häufigsten verwendete Anästhetikum für MRI verwendet, führt zu einem drei-bis sechsfache Steigerung im Gehirn Laktat Inhalt15,16 und sollte daher nicht im Gehirn metabolische Studien verwendet werden. Medetomidine ist ein α2-Adrenoreceptor-Agonist, die zuverlässige Sedierung, Analgesie und Muskelrelaxation Anxiolytika17induziert. Diese Effekte können mit Atipamezol, α2-Antagonist schnell rückgängig gemacht werden. Medetomidine ist der beste Kandidat in Nagetieren18 funktionelle Studien durchführen, da es einen sehr geringen Einfluss auf das Fett-Signal und die geringsten Änderungen im Gehirn Metabolit Inhalt hat.
Es ist auch wichtig, die Whisker Aktivierung Paradigma korrekt zu folgen. Da NMR übernahmen mehrere Minuten dauern, ist die Verwendung der nachfolgenden Aktivierung/Ruhezeiten für die Desensibilisierung von Neuronen in den aktivierten Hirnareal zu begrenzen. Die Parameter dieses Paradigmas (20 s der Aktivierung folgt eine Ruhezeit von 10 s) wurden ausgewählt, um die höchsten BOLD fMRT-Signal in den entsprechenden Lauf Kortex zu erhalten. Viel Vorsicht ist geboten, diese Zeitfenster zu respektieren, da es die aktiviert/Ruhezeit für mutige Behandlung bestimmen entscheidend, auch wenn es durch die TTL-Port gesteuert wird. Um ein hohes Maß an Fass Aktivierung des Kortex, das Segel zu erhalten, die Gruppen die Barthaare zusammen ist auch wichtig da es den größten Teil des Gebiets S1BF stimuliert werden kann. Viel Vorsicht ist geboten, um Luft Auslaufrohr vor dieses Segel zu platzieren, so dass es auf einer Anteroposterior Ebene bewegen kann. Die Frequenz muss sorgfältig kalibriert werden, da sich gezeigt hat, dass Neuronen im Fass Kortex aktiviert werden, wenn Whisker Stimulationsfrequenz zwischen 5 und 15 Hz19ist. Eine niedrigere oder höhere Frequenz führt nicht zur Aktivierung der S1BF Gegend.
In dieser Studie verwendete Protokoll ermöglicht es, erworbene in den gleichen Bereich des Gehirns im Ruhezustand und während Hirnstimulation Spektren vergleichen und daher zur Überwachung der metabolischen Veränderungen mit zerebraler Aktivierung. Es ist wichtig, dass eine Lokalisierung-Sequenz am Anfang und am Ende des Protokolls NMR-Spektroskopie, um sicherzustellen, dass das Tier nicht bewegt hat und dass die Unterschiede im metabolischen Inhalt zwischen den ruhenden und aktivierten Staaten gemessen durch Gehirn Stimulation und nicht um Bewegungsartefakte.
Hierin beschriebene Protokoll verwenden, wurde eine Erhöhung Laktat-Gehalt zwischen Ruhe gemessen und Perioden aktiviert. Laktat-Erhöhung mit in Vivo NMR-Spektroskopie bei der Aktivierung des Gehirns wurde erstmals beim Menschen in den frühen 1990er Jahren20,21beobachtet. Jedoch wurden die meisten Messungen durchgeführt, in Menschen, anstatt Nagetiere, in denen das Signal-Rausch-Verhältnis wesentlich geringer ist. Bei der Ratte wurde ex-Vivo NMR Quantifizierung von Laktat bei der Ratte Gehirn Aktivierung von Mazuel Et Al. durchgeführt. 22die Inhalte mit der neuronalen Aktivierung Laktat Zunahme Gehirn beobachtet. Die hier vorgestellten Ergebnisse zeigen, dass Laktat während der Whisker Aktivierung erhöht wurde. Da jedoch lokalisierte MRS zellulären Auflösung nicht zulässt, ist es noch unbekannt, welche zellulären Fach Laktat (Neuronen und Astrozyten) kommen wird. Um das Verständnis der zerebralen metabolischen Austausch weiter wie die noch ANLSH (Astrozyten-Neuron Laktat Shuttle Hypothese) diskutiert, hat dieses Protokoll auf gentechnisch veränderte Tiere für die Schlüsselkomponenten in diesem Shuttle angewendet werden, wie z. B. die Monocarboxylate Transporter.
In der hier beschriebenen Studie wurde kein statistisch signifikanter Unterschied im NAA Inhalt beobachtet. Eine Abnahme der NAA Inhalte während der visuellen Stimulation war zuvor gefundenen Menschen23,24,25, aber nicht durch Mangia und Tkac26bestätigt. In der aktuellen Studie beobachteten wir eine Zunahme der NAA Inhalte im Gehirn Aktivierung in 50 % der Ratten und eine Abnahme in der anderen Hälfte. Daher sollten NAA als interne Referenz zur Quantifizierung während funktionale Mrs Nr. vermieden werden, die andere Variante in Metabolit Inhalt erkannt wurde.
Beide Laktat und NAA Variationen bei der neuronalen Aktivierung führten zu Kontroversen23,26,27,28,29. Um unser Verständnis dieser metabolischen Schwankungen verbunden mit Aktivität des Gehirns zu fördern, wäre es interessant, dieses Protokoll für transgene Tiere gelten. Dies würde weitere Informationen über den zugrunde liegenden Prozess liefern. Insgesamt, lokalisierte 1H-Frau während einer Aufgabe oder funktionelle MRS29, ist eine neue Technik bei Nagetieren, relevant für das Studium der regionalen dynamische Veränderungen der Metaboliten, in normalen oder pathologischen Gehirn.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Diese Arbeit wurde durch den Zuschuss LabEx TRAIL unterstützt Referenz ANR-10-LABX-57 und eine Französisch-Schweizerische ANR-FNS gewähren Referenz ANR-15-CE37-0012. Die Autoren danken Aurélien Trotier für seine technische Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.5 mL syringe with needle | Becton, Dickinson and Company, USA | 2020-10 | 0.33 mm (29 G) x 12.7 mm |
| 1H spectroscopy surface coil | Bruker, Ettlingen, Germany | T116344 | |
| 7T Bruker Biospec system | Bruker, Ettlingen, Germany | 70/20 USR | |
| Arduino Uno based pulsing device | custom made | ||
| Atipamezole | Vétoquinol, S.A., France | V8335602 | Antisedan, 4.28 mg |
| Breathing mask | custom made | ||
| Eye ointment | TVM laboratoire, France | 40365 | Ocry gel 10 g |
| Induction chamber | custom made | 30x17x15 cm | |
| Inlet flexible pipe | Gardena, Germany | 1348-20 | 4.6-mm diameter, 3m long |
| Isoflurane pump, Model 100 series vaporizer, classic T3 | Surgivet, Harvard Apparatus | WWV90TT | from OH 43017, U.S.A |
| Isoflurane, liquid for inhalation | Vertflurane, Virbac, France | QN01AB06 | 1000 mg/mL |
| KD Scientific syringe pump | KD sientific, Holliston, USA | Legato 110 | |
| LCModel software | LCModel Inc., Ontario, Canada | 6.2 | |
| Medetomidine hydrochloride | Vétoquinol, S.A., France | QN05CM91 | Domitor, 1 mg/mL |
| Micropore roll of adhesive plaster | 3M micropore, Minnesota, United States | MI912 | |
| Micropore roll of adhesive plaster | 3M micropore, Minnesota, United States | MI925 | |
| Monitoring system of physiologic parameter | SA Instruments, Inc, Stony Brook, NY, USA | Model 1025 | |
| NaCl | Fresenius Kabi, Germany | B05XA03 | 0.9 % 250 mL |
| Outlet flexible pipe | Gardena, Germany | 1348-20 | 4.6-mm diameter, 4m long |
| Paravision software | Bruker, Ettlingen, Germany | 6.0.1 | |
| Peripheral intravenous catheter | Terumo, Shibuya, Tokyo, Japon | SP500930S | 22 G x 1", 0.85x25 mm, 35 mL/min |
| Rat head coil | Bruker, Ettlingen, Germany | ||
| Sodic heparin, injectable solution | Choai, Sanofi, Paris, France | B01AB01 | 5000 IU/mL |
| Solenoid control valves, plunger valve 2/2 way direct-acting | Burkert, Germany | 3099939 | Model type 6013 |
| Terumo 2 ml syringe | Terumo, Shibuya, Tokyo, Japon | SY243 | with 21 g x 5/8" needle |
| Terumo 5 mL syringe | Terumo, Shibuya, Tokyo, Japon | 05SE1 | |
| Wistar RJ-Han rats | Janvier Laboratories, France |
Referenzen
- Pellerin, L., et al. Activity-dependent regulation of energy metabolism by astrocytes: an update. Glia. 55, 1251-1262 (2007).
- Pellerin, L., Magistretti, P. J. Glutamate uptake into astrocytes stimulates aerobic glycolysis: a mechanism coupling neuronal activity to glucose utilization. Proceedings of the National Academy of Sciences of the United States of America. 91, 10625-10629 (1994).
- Cholet, N., et al. Local injection of antisense oligonucleotides targeted to the glial glutamate transporter GLAST decreases the metabolic response to somatosensory activation. Journal of Cerebral Blood Flow & Metabolism. 21, 404-412 (2001).
- Voutsinos-Porche, B., et al. Glial Glutamate Transporters Mediate a Functional Metabolic Crosstalk between Neurons and Astrocytes in the Mouse Developing Cortex. Neuron. 37, 275-286 (2003).
- Zimmer, E. R., et al. [18F]FDG PET signal is driven by astroglial glutamate transport. Nature Neuroscience. 20 (3), 393-395 (2017).
- Haiss, F., et al. Improved in vivo two-photon imaging after blood replacement by perfluorocarbon. The Journal of Physiology. , (2009).
- Mullins, P. G. Towards a theory of functional magnetic resonance spectroscopy (fMRS): A meta-analysis and discussion of using MRS to measure changes in neurotransmitters in real time. Scandinvian Journal of Psychology. 59, 91-103 (2018).
- Wong-Riley, M. T., Welt, C. Histochemical changes in cytochrome oxidase of cortical barrels after vibrissal removal in neonatal and adult mice. Proceedings of the National Academy of Sciences of the United States of America. 77, 2333-2337 (1980).
- Petersen, C. C. The functional organization of the barrel cortex. Neuron. 56, 339-355 (2007).
- Cox, S. B., Woolsey, T. A., Rovainen, C. M. Localized dynamic changes in cortical blood flow with whisker stimulation corresponds to matched vascular and neuronal architecture of rat barrels. Journal of Cerebral Blood Flow & Metabolism. 13, 899-913 (1993).
- Feldmeyer, D. Excitatory neuronal connectivity in the barrel cortex. Frontiers in Neuroanatomy. 6, 24 (2012).
- Boussida, S., Traore, A. S., Durif, F. Mapping of the brain hemodynamic responses to sensorimotor stimulation in a rodent model: A BOLD fMRI study. PLoS One. 12, e0176512 (2017).
- Heinke, W., Koelsch, S. The effects of anesthetics on brain activity and cognitive function. Current Opinion in Anesthesiology. 18, 625-631 (2005).
- Horn, T., Klein, J. Lactate levels in the brain are elevated upon exposure to volatile anesthetics: a microdialysis study. Neurochemistry International. 57, 940-947 (2010).
- Boretius, S., et al. Halogenated volatile anesthetics alter brain metabolism as revealed by proton magnetic resonance spectroscopy of mice in vivo. Neuroimage. 69, 244-255 (2013).
- Sinclair, M. D. A review of the physiological effects of alpha2-agonists related to the clinical use of medetomidine in small animal practice. Canadian Veterinary Journal. 44, 885-897 (2003).
- Weber, R., et al. A fully noninvasive and robust experimental protocol for longitudinal fMRI studies in the rat. Neuroimage. 29, 1303-1310 (2006).
- Hartmann, M. J., Johnson, N. J., Towal, R. B., Assad, C. Mechanical characteristics of rat vibrissae: resonant frequencies and damping in isolated whiskers and in the awake behaving animal. The Journal of Neuroscience. 23, 6510-6519 (2003).
- Prichard, J., et al. Lactate rise detected by 1H NMR in human visual cortex during physiologic stimulation. Proceedings of the National Academy of Sciences of the United States of America. 88, 5829-5831 (1991).
- Sappey-Marinier, D., et al. Effect of photic stimulation on human visual cortex lactate and phosphates using 1H and 31P magnetic resonance spectroscopy. Journal of Cerebral Blood Flow & Metabolism. 12, 584-592 (1992).
- Mazuel, L., et al. A neuronal MCT2 knockdown in the rat somatosensory cortex reduces both the NMR lactate signal and the BOLD response during whisker stimulation. PLoS One. 12, e0174990 (2017).
- Castellano, G., et al. NAA and NAAG variation in neuronal activation during visual stimulation. Brazilian Journal of Medical and Biological Research. 45, 1031-1036 (2012).
- Sarchielli, P., et al. Functional 1H-MRS findings in migraine patients with and without aura assessed interictally. Neuroimage. 24, 1025-1031 (2005).
- Baslow, M. H., Hrabe, J., Guilfoyle, D. N. Dynamic relationship between neurostimulation and N-acetylaspartate metabolism in the human visual cortex: evidence that NAA functions as a molecular water pump during visual stimulation. Journal of Molecular Neuroscience. 32, 235-245 (2007).
- Mangia, S., Tkac, I. Dynamic relationship between neurostimulation and N-acetylaspartate metabolism in the human visual cortex: evidence that NAA functions as a molecular water pump during visual stimulation. Journal of Molecular Neuroscience. 35, 245-248 (2008).
- Baslow, M. H., Hrabal, R., Guilfoyle, D. N. Response of the authors to the Letter by Silvia Mangia and Ivan Tkac. Journal of Molecular Neuroscience. 35, 247-248 (2008).
- Barros, L. F., Weber, B. CrossTalk proposal: an important astrocyte-to-neuron lactate shuttle couples neuronal activity to glucose utilisation in the brain. The Journal of Physiology. 596, 347-350 (2018).
- Bak, L. K., Walls, A. B. CrossTalk opposing view: lack of evidence supporting an astrocyte-to-neuron lactate shuttle coupling neuronal activity to glucose utilisation in the brain. The Journal of Physiology. 596, 351-353 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten