Method Article
Espectroscopia de resonancia magnética funcional en 7 T en la corteza del cañón de rata durante la activación de la barba
En este artículo
Resumen
Después de comprobar por sangre oxígeno-nivel-dependiente funcional resonancia magnética (fMRI en negrilla) que el correspondiente barril somatosensorial corteza área (llamado S1BF) está correctamente activado, el principal objetivo de este estudio es cuantificar el contenido de lactato fluctuaciones en los cerebros de rata activado por espectroscopia de resonancia magnética localizada del protón (1H-MRS) en el T. 7
Resumen
Espectroscopia de resonancia magnética nuclear (RMN) ofrece la oportunidad de medir el contenido de metabolitos cerebrales en vivo y no invasor. Gracias a avances tecnológicos durante la última década y el aumento de fuerza del campo magnético, ahora es posible obtener buena resolución espectros en vivo en el cerebro de la rata. Neuroenergetics (es decir, el estudio del metabolismo cerebral) y, especialmente, interacciones metabólicas entre los diferentes tipos de células han atraído cada vez más interés en los últimos años. Entre estas interacciones metabólicas, todavía se discute la existencia de un servicio de transporte de lactato entre neuronas y astrocitos. Por lo tanto, resulta de gran interés para realizar espectroscopia de resonancia magnética funcional del protón (1H-MRS) en un modelo de rata de cerebro activación y monitor de lactato. Sin embargo, el pico de lactato de metilo superpone picos de resonancia de lípidos y es difícil de cuantificar. El protocolo que se describe a continuación permite metabólico y lactato fluctuaciones monitorizada en un área cerebral activada. Activación cerebral se obtiene por la estimulación de la barba y 1H-MRS se realiza en la corteza activada cañón correspondiente, cuya área se detecta usando sangre oxígeno-nivel-dependiente de resonancia magnética funcional (fMRI en negrilla). Describen detalladamente todos los pasos: la elección de los anestésicos, bobinas y secuencias, alcanzar barba eficiente estimulación directamente en el imán y procesamiento de datos.
Introducción
El cerebro posee mecanismos intrínsecos que permiten la regulación de su sustrato principal (por ejemplo, glucosa), tanto por su contribución y su utilización, dependiendo de las variaciones en la actividad cerebral local. Aunque la glucosa es el sustrato principal de energía para el cerebro, experimentos llevados a cabo en los últimos años han demostrado que lactato, que es producido por los astrocitos, podría ser un sustrato eficiente de la energía para las neuronas. Esto plantea la hipótesis de una lanzadera de lactato entre astrocitos y neuronas1. ANLS, astrositos neurona lactato transporte2, la teoría es todavía muy debatida pero ha llevado a la propuesta de la glucosa, en lugar de ir directamente a las neuronas, pueden entrar en los astrocitos, donde es metabolizado a lactato, un metabolito que es , entonces, transferido a las neuronas, que utilizan como sustrato energético eficiente. Existir un servicio de transporte en vivo, tendría varias consecuencias importantes tanto para descifrar las alteraciones metabólicas observadas para la comprensión de las técnicas básicas de proyección de imagen cerebral funcional (tomografía por emisión de positrones [PET]) en patologías del cerebro.
Para estudiar el metabolismo del cerebro y, particularmente, las interacciones metabólicas entre neuronas y astrocitos, cuatro técnicas principales están disponibles (no incluye micro-/ nanosensores): autorradiografía, animal doméstico, dos fotones fluorescente microscopia confocal y a la señora. Autorradiografía fue uno de los primeros métodos propuestos y proporciona imágenes de la acumulación regional de radioactivo 14C-2-deoxyglucose en rebanadas de cerebro, mientras PET rendimientos en vivo imágenes de la captación regional de radiactivo 18 F-desoxiglucosa. Ambos tienen la desventaja de la utilización de moléculas de irradiative mientras que la producción de imágenes de resolución espacial baja. Microscopía de dos fotones proporciona resolución celular de sondas fluorescentes, sino dispersión de la luz por tejido limita la profundidad de la proyección de imagen. Estas tres técnicas se han utilizado previamente para estudiar neuroenergetics en roedores durante barba estimulación3,4,5,6. En vivo MRS tiene la doble ventaja de ser no invasivo y no radiactivo, y se puede explorar cualquier estructura cerebral. Por otra parte, MRS puede ser realizado durante la activación neuronal, una técnica llamada a MRS funcional (fMRS), que se ha desarrollado muy recientemente en roedores7. Por lo tanto, se propone un protocolo para monitorizar el metabolismo cerebral durante la actividad cerebral por 1H-MRS en vivo y no invasor. El procedimiento se describe en ratas adultas saludables con la activación del cerebro obtenida por una soplo de aire barba estimulación realizada directamente en un reproductor de imágenes de resonancia magnética (de Sr.) T 7 pero se puede adaptar en animales genéticamente modificados, así como en cualquier condición patológica .
Protocolo
Animales todos los procedimientos se llevaron a cabo siguiendo las directrices de Experimentación Animal de la Directiva Europea del Consejo de las comunidades de 24 de noviembre de 1986 (86/609/CEE). El protocolo se reunieron las directrices éticas del Ministerio francés de agricultura y bosques y fue aprobado por los comités de ética locales (Comité d 'éthique pour L' expérimentation Animale Burdeos n ° 50112090-A).
Nota: Durante las mediciones de Señor, un nivel adecuado de anestesia y monitoreo fisiológico (temperatura corporal, frecuencia respiratoria) son requisitos imprescindibles.
1. los animales
- Utilizar ratas Wistar macho pesa entre 350 y 450 g.
- Mantenerlos en una 12:12 h luz: oscuridad ciclo y proporcionar alimento y agua ad libitum.
2. anestesia
- Preparar el equipo necesario para la anestesia (figura 1A, B, véase Tabla de materiales): una jeringa de 5 mL con medetomidina en solución salina fisiológica (240 μg/kg/h, con una tasa de perfusión de 20 μl/min), una jeringa de 0.5 mL que contiene atipamezole (20 μL, en 0,5 mL de solución salina) y ungüento oftálmico.
Nota: Guarde todo el equipo bajo la campana, excepto la jeringa de 5 mL que contiene medetomidina, que se coloca en la bomba de jeringa cerca del imán para la anestesia durante la adquisición del Señor. - Colocar la rata en la cámara de inducción, empezar la anestesia mediante la entrega de 4% de isoflurano y ajustar el flujo de oxígeno a 1,5 L/min.
- Evaluar la profundidad de la anestesia mediante la evaluación de la retirada de los reflejos de la pata.
- Cuando la rata no responde a la estimulación, saque de la caja de la anestesia, colocar en el Banco con su nariz en la máscara del isoflurano y mantener anestesia mediante la entrega de 2,5% en oxígeno a 1,5 L/min.
- Suavemente masaje la cola y colocar el torniquete (figura 1).
Nota: El masaje puede realizarse con agua tibia, con una temperatura entre 38 y 42 ° C, para obtener mejor vasodilatación de las venas. - Inserte el catéter intravenoso periférico (22 G), previamente heparinizado, en la vena de la cola izquierda o derecha. Tenga en cuenta que se observa un retorno venoso (es visible en la parte distal de la aguja una gota de sangre) cuando el catéter está correctamente insertado (figura 1).
- Sople burbujas de aire presentes en el volumen de espacio muerto del catéter usando la jeringa de 2 mL que contiene solución salina y heparina.
- Aplicar el ungüento oftálmico y prepare la jeringa que contiene atipamezole (17 μg/mL) para despertar la rata al final del experimento.
3. rata colocación en imán para la estimulación de la barba
- Coloque un sensor de respiración en la cama de imán y luego transferir la rata del Banco a la cama de imán. Coloque en la posición propensa con su nariz en la máscara del isoflurano, con el sensor de respiración situado entre la caja torácica y el imán.
Nota: Todo el equipo que entra en la habitación de MRI debe ser seguro para MRI. - Disminuir el isoflurano (del 4% al 1.5%-2%) durante la colocación del rata y cambie la anestesia a la medetomidina en el final de este procedimiento. Que sean los bigotes derecha libres, después de haber cortado el borde derecho en la parte delantera de la cama de MRI antes para permitir el movimiento de los bigotes de rata.
- Sostener la rata en su posición con cinta adhesiva y controlar su respiración, que debe estar entre 60 y 80 respiraciones por minuto.
- Hacer una vela que atrapa bien bigotes en la cinta de papel (figura 2). Alinee el tubo de salida flexible del sistema de soplo de aire a lo largo de la rata cama de MRI de modo que la parte que sale del tubo quede perpendicular y alrededor de 1,5 cm de la vela. Fijar con cinta de papel.
4. barba estimulación
- Conectar el tubo flexible de entrada de una fuente de aire comprimido (1 bar) a una solenoide control válvula de entrada y el tubo de salida a la salida de la válvula de control solenoide (figura 3). Asegúrese que la válvula de control solenoide se queda fuera de la sala del imán.
- Conecte el dispositivo de pulsación en la válvula de solenoide y el imán con la lógica del transistor-transistor (TTL)-Puerto. Configurarlo para que la frecuencia de la pulsación = 8 Hz, el tiempo de pulsación = 20 s y el tiempo de descanso = 10 s.
Nota: Estos parámetros, visualizados en el pequeño cristal líquido (LCD) pantalla de visualización, son ajustables mediante los potenciómetros analógicos dedicados tres. El dispositivo electrónico de pulso, que controla el paradigma, debe estar compuesto de componentes electrónicos de alta calidad para evitar cualquier deriva en parámetros de tiempo (para postproceso correcto).
5. negrita fMRI adquisición
- Colocar el cerebro de la rata está en una posición vertical y utilice las barras de oído para mantenerlo. Coloque la bobina de serie de volumen por encima de la cabeza de la rata (Figura 4A) y fijarlo con cinta. Compruebe que la vela mueva correctamente (movimiento anteroposterior, sin rotación y sin fricción de la vela) cuando el sistema de soplo de aire es convertido en; a continuación, apáguelo.
- Inserte la cama y la bobina en el centro del imán. Compruebe que la vela está todavía avanzando correctamente una vez que la cama está dentro del imán cuando el sistema de aire-puff está en; a continuación, apáguelo. Cambiar totalmente de isoflurano a medetomidina (tasa de perfusión: 20 μl/min).
- Compruebe que la rata está bien situado con una secuencia de localización (TE = 2,5 ms; TR = 100 ms; promedio = 1; repetición = 1; rodaja = 1 mm; tamaño de imagen = 256 x 256; campo de visión (FOV) = 50 x 50 mm; tiempo de exploración = 12 s 800 ms). Arrastre la ficha secuencia de localizador en el nombre de la instrucción y haga clic en continuar.
- Arrastre la ficha secuencia de T2_Star_FID_EPI en el nombre de instrucción, centro del campo visual en el centro del cerebro y haga clic en la ficha de la plataforma de ajuste para abrir la instrucción exploración editado. Registrar un mapa de0 B y proceder a una cuña de exploración.
Nota: Para ver un mapa de0 B, utilice los siguientes parámetros: primera vez de echo = 1,65 ms; TR = 20 ms, promedio = 1; tapa ángulo = 30°; espaciamiento del eco = 3,805 ms; rodaja = 58 mm; tamaño de imagen = 64 x 64 x 64; Campo de visión = 58 x 58 x 58 mm; tiempo de exploración = 1 m 24 s 920 Sra. para calce de exploración, utilice los siguientes parámetros: excitación selectiva de voxel = pulso gaussiano de vapor; TE = 5 ms; tiempo de mezcla = 10 ms; duración de adquisición = 204,8 ms; ancho de banda = 10.000 Hz; tiempo de permanencia = 50 μs). - Iniciar la secuencia de Star_FID_EPI T2 (TE = 16,096 ms; TR = 500 ms; promedio = 1; repetición = 600; rodaja = 1 mm; cuatro sectores consecutivos; tamaño de imagen = 128 x 128; Campo de visión = 20 x 20 mm; ancho de banda = 333.333,3 Hz; tiempo de exploración = 5 min 00 s).
Nota: Por el puerto TTL, una señal de disparo externa comenzará el sistema de soplo de aire al mismo tiempo. El paradigma = [activación s 20 + 10 resto s] x 10, de la duración total de los 600 escaneos, 500 ms por escaneo. Las láminas están centradas en el centro de la zona de campo de barril. - Adquirir otra secuencia de localización (igual que el paso descrito en 5.3) para comparar con la primera de ellas y comprobar si la rata ha trasladado durante la secuencia de T2_Star_FID_EPI.
- Llevar la cama a su posición inicial, retirar la bobina de la gama de volumen y conectar la bobina de superficie.
6. procesamiento en negrilla
- Abra el archivo Star_FID_EPI T2 y leer la imagen T2 Star_FID_EPI en Pantalla de imagen. Abra la ventana de arranque del regulador funcional, llamado FunController.
- En esta ficha proceso , seleccione la ventana de proyección de imagen funcional y definir el protocolo de estimulación (duración y alternancia de On/Off períodos, correspondientes al paradigma utilizan).
- Seleccione la ventana de protocolo (conjunto de datos con 600 Marcos), introduzca el valor de 40 en la pestaña De período y 20 en el período la ficha haga clic en la ficha Reconocimiento de invertir y arrastre el regulador de Estados de estimulación a la izquierda para seleccionar el valor de 1.
- En la ventana de preprocesamiento, haga clic en el filtro de la mediana en plano para el proceso previo y en el filtro de la mediana (2D, 3D) para postproceso.
- Haga clic en la pestaña Execute y arrastre los cursores para ajustar la tabla de búsqueda de recubrimiento. Visualizar el área cerebral activada (Figura 4B).
7. protón señora adquisiciones
- Para colocar correctamente la bobina de superficie, modificar la posición de la cabeza de la rata. Gire la cabeza (aproximadamente 30° en sentido horario) para que la bobina de superficie (figura 5A) se puede colocar justo por encima de la corteza del cañón izquierdo estando horizontal y situado en el centro del imán dentro del imán.
- Coloque la bobina de superficie, fijar en el cerebro de la rata usando cinta adhesiva (figura 5B) y compruebe que la vela mueva correctamente (movimiento anteroposterior, sin rotación y sin fricción de la vela) cuando el sistema de soplo de aire es convertido en; luego, apagar el interruptor general.
- Compruebe que la vela se mueva correctamente una vez que la cama está dentro del imán cuando el sistema de soplo de aire. A continuación, apáguelo.
- Compruebe la rata se coloca correctamente utilizando una secuencia de localización. Definir los parámetros como sigue: TE = 2,5 ms; TR = 100 ms; promedio = 1; repetición = 1; rodaja = 1 mm; tamaño de imagen = 256 x 256; Campo de visión = 50 x 50 mm; tiempo de exploración = 12 s ms 800.
- Arrastre la ficha secuencia de localizador en la ventana nombre de instrucciones y haz clic en la ficha continuar para ejecutar el programa de exploración.
- Cuando la localización cerebral es correcta, arrastre la ficha secuencia de T2_TurboRARE en la ventana nombre de instrucciones y haga clic en continuar para ejecutar el programa de exploración. Estas imágenes anatómicas, junto con la anterior adquisición de fMRI audaz, permitirá la correcta localización de lo voxel en el S1BF MRS.
Nota: Los parámetros de la T2_TurboRARE son 14 rebanadas, 2 mm por rebanada, FOV = 2,5 x 2,5 cm, TE = 100 ms, TR = 5.000 ms, matriz = 128 x 128, tiempo de secuencia = 2 min 40 s. - Arrastre la ficha secuencia de láser en la ventana nombre de instrucción , lugar de voxel (alto 2 mm, 2,5 mm de largo, 3 mm de profundidad) en el centro de la zona de S1BF.
- Utilizar un atlas del cerebro de rata y la mejora del BOLD fMRI para localizar la zona en las imágenes T2 (figura 6). Haga clic en la ficha de la plataforma de ajuste para abrir la instrucción exploración editado. Haga clic en la ficha de tambalearse y cambiar la impedancia (carga electrónica) de la bobina de recepción un poco a sintonizarla. Haga clic en la ficha aplicar terminado la puesta a punto para cerrar el editor de instrucciones y aplicar los cambios en la instrucción editado.
- Registrar un mapa de0 B y proceder a escanear calza y, luego, realizar una cuña de local.
Nota: Para ver el mapa de0 B, utilice los siguientes parámetros: primera vez de echo = 1,65 ms; TR = 20 ms, promedio = 1; tapa ángulo = 30°; espaciamiento del eco = 3,805 ms; rodaja = 58 mm; tamaño de imagen = 64 x 64 x 64; Campo de visión = 58 x 58 x 58 mm; tiempo de exploración = 1 m 24 s 920 Sra. para el calce de la exploración, utilice los siguientes parámetros: pulso gaussiano del vapor de la excitación selectiva de voxel; TE = 5 ms; tiempo de mezcla = 10 ms; duración de adquisición = 204,8 ms; ancho de banda = 10.000 Hz; tiempo de permanencia = 50 μs. Para el calce local, utilice los siguientes parámetros: supresión del agua, duración de la adquisición del VAPOR = 1.363,15 ms; puntos = 4.096; ancho de banda en Hz = 3.004,81 Hz; ancho de banda en ppm = 10 ppm; tiempo de permanencia = 166,40 μs; resolución espectral = 0,37 puntos Hz. Los parámetros del láser son: Eco tiempo = ms 19,26; TR = 2.500 ms; promedio = 128 o 32; tiempo de exploración = 5 min 20 s o 1 min 20 s; puntos de adquisición = 4.096. - Realizar a 1H-MRS.
- Empezar a la 1H-MRS adquisición primero durante un período de descanso (exploraciones LASER de 4 x 32 + 128 láser escanea; 2.500 ms por scan).
- Adquirir otra secuencia de localización (igual que el paso descrito en 5.3) para comparar con el primero de ellos grabado y asegurar que la rata no se ha movido durante la adquisición de láser.
- Realizar 1H-MRS durante la activación de barba utilizando la secuencia de láser (exploraciones LASER de 4 x 32 + 128 láser escanea; 2.500 ms por scan) con el sistema de aire-puff (paradigma = 20 s de activación y 10 s de descanso).
- Una vez más, realizar una secuencia de localización para verificar si la rata se ha movido.
Nota: El número de exploraciones y periodos de reposo/activación puede ser adaptado y modificado, pero siempre asegúrese de que la rata no está moviendo realizando periódicamente una secuencia de localización.
- Llevar la cama a su posición inicial, quitar la bobina de superficie y retroceder a la rata a la banca. Inyectar el atipamezole en un pliegue de piel en la parte posterior de la rata para revertir la anestesia y despertarlo.
8. procesamiento de la señora del protón
- Abra el software de LCModel y haga clic en la pestaña correspondiente para seleccionar el tipo de datos adecuado ( Decadencia de inducción libre archivo) y elegir el archivo correcto. Haga clic en la ficha OK cuando se hace.
- Optimizar los parámetros de control de cuantificación paso a paso.
- En la sección título , manualmente Introduzca un título y definir una gama adecuada de ppm (p. ej., 0,2 a 4,0 ppm) escribiendo manualmente en el valor necesario en los campos correspondientes.
- En la sección de archivo de base , seleccione y descargue el archivo para colocar correctamente la base de la macromolécula (puede ser proporcionado por el proveedor del software).
- Definir y cargar los parámetros de control de entrada. Preparar la operación de guardar proceso de todo tipo de archivos útiles previamente (tabla = mesas compactas; PS = salida de PostScript necesario; CSV = formato para hojas de cálculo; COORD = coordenadas de parcelas). Haga clic en la ficha de RunLCModel para iniciar la cuantificación de LCModel.
- Definir metabolitos seleccionadas para generar estadísticas.
Nota: LCModel ofrece cuantificación de metabolitos y estimaciones de errores por un valor que se llama cota inferior de Cramér-Rao (CRLB). Un valor con un CRLB < 15 se considera como una cuantificación óptima. Un CRLB > 25 indica un valor poco fiable.
Resultados
Este protocolo permite la cuantificación de las fluctuaciones de metabolitos durante la activación cerebral, que se obtiene por la estimulación de la barba derecha directamente en el imán.
En este estudio, el objetivo general del fMRI audaz era comprobar que la estimulación de la barba era eficiente, visualizar la zona de S1BF activada y para ubicar correctamente el voxel 1H-fMRS. El dispositivo incorporado para la activación de la barba es eficiente. De hecho, cuando bigotes derecho se estimularon mediante el sistema de aire casero-puff, una señal positiva de la negrita fue detectada en la corteza del cañón izquierdo (Figura 4B), también llamada el S1BF, para el campo cañón somatosensoriales (n = 8). Un realce de señal positiva fue detectado en la corteza del cañón izquierdo en ocho de ocho ratas, mientras que el fondo sólo se detectó en los hemisferios derecho. Cuando audaz fMRI se realizó sin estimulación de la barba, no mejora señal fue observado en la izquierda o en el derecho S1BF.
En una comparación entre imágenes anatómicas y rata cerebro atlas planes8, el área cerebral activada visualizado por fMRI BOLD permite el voxel a colocarse en la zona de S1BF, que se activa durante la estimulación de la barba. Este voxel se encuentra en tres diapositivas consecutivas (1 mm de espesor) ya que la corteza del cañón es de 3 mm de largo. Cuando la diapositiva cerebro prácticamente se separa en cuatro cuartos, el voxel está situado en la parte superior izquierda cuarto en un ángulo aproximado de 45° (figura 6).
Cuando se enciende el paradigma para la estimulación de la barba, se observó un aumento en el lactato contenido en el S1BF izquierdo (figura 6, espectros típicos obtenidos en una rata). Para visualizar mejor las fluctuaciones metabólicas entre reposo y activado períodos, se realizó una sustracción espectral (figura 6). De este espectro de resta, el aumento en el contenido de lactato con la activación del cerebro fue visualizar mucho más fácilmente, mientras que en esta rata, la señal del N-acetilaspartato (NAA) fue disminuida levemente. También se observó aumento de lactato durante la estimulación neuronal en la deconvolución espectral (Figura 7AB). Mientras que el pico de lactato apenas fue detectado en el espectro en vivo en el resto, LCModel podido cuantificar (Figura 7A) con exactitud y valores CRLB. De hecho, fuera 23 ratas, sólo un espectro tenía un valor CRLB para la cuantificación del lactato igual a 24. Ninguno fue > 25. Para todos los otros espectros, los valores oscilaron entre 3 y 19.
Las variaciones en el contenido de lactato en todas las 23 ratas se presentan en la figura 8. Fuera ratas de 23, se observó una disminución en el contenido de lactato solamente en una rata. Hubo una diferencia estadísticamente significativa en el lactato contenido entre el reposo y activado períodos (0.132 0.012 y 0.163 ± 0.011, respectivamente, los valores familiares al PCr + Cr contenido, asociado a t-test, p = 0.0005 [paramétrico, dos colas] n = 23). Por lo tanto, un aumento de 31,6% ± 7.8% en el contenido de lactato se midió durante la estimulación neuronal.
Una ligera disminución en el contenido de NAA puede observarse en la figura 6, que representa espectros típicos obtenidos en un animal. Sin embargo, esta variación de NAA no fue significativa (se midió una disminución de 1.2% ± 1,2%, n = 23).
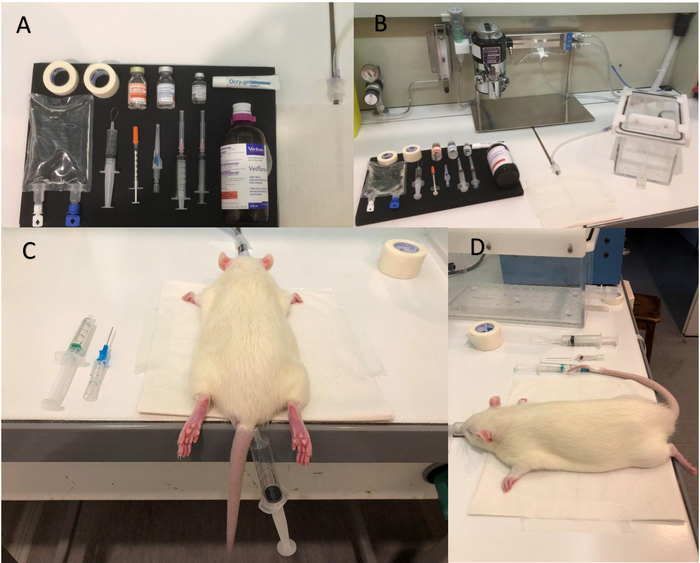
Figura 1: pasos para la anestesia y equipos de. (A) fotografía del equipo para estar preparado antes de comenzar la anestesia. Isoflurano (B) cámara de bomba y la inducción. (C) colocación del torniquete. (D) la figura muestra que el catéter se insertó correctamente; Observe la gota de sangre en la aguja del catéter, que es un signo positivo de una ubicación correcta en la vena. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: estimulación de la barba. Bigotes bien quedan atrapados en una vela hecha con cinta de papel. La vela permite bigotes todo derechos a ser estimulados al mismo tiempo con el sistema de soplo de aire y, por lo tanto, maximiza la activación neuronal de la corteza del cañón. La salida del sistema aire-puff (tubo negro) debe ubicarse alrededor de 1,5 cm y perpendicular a la vela. Cheque fuera el imán para asegurarse de que la vela va correctamente al encender el sistema de soplo de aire. La vela debe mover a 8 Hz en una dirección anteroposterior (sin rotación). Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: sistema de aire-puff para la estimulación de la barba. (A) A tubo flexible conecta el aire comprimido (B) la válvula de control solenoide. Un segundo tubo flexible trae aire pulsado de la salida de la válvula de control solenoide a la vela. La válvula de solenoide se conecta en el dispositivo de pulsación, que controla el paradigma. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: fMRI negrita. Volumen (A) matriz de colocación de la bobina. La cabeza de la rata está en una posición horizontal y bloqueado por bares de oído. Compruebe que la vela se mueve libremente y no está bloqueada por la bobina o por la cama de MRI. (B) un BOLD típica señal en la corteza activada barril izquierdo (flecha roja). Se detecte ninguna señal en el hemisferio derecho contralateral (flecha azul). El umbral se establece en el 76.5% del máximo del valor de intensidad. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: bobina de superficie. Imagen de (A) de la bobina de superficie utilizada en este estudio. (B) colocación de bobina de superficie. La cabeza de la rata debe girarse ligeramente para que la corteza del cañón izquierdo y, por tanto, la bobina de superficie se encuentran en el centro de la cama de MRI (la cabeza está girada en un ángulo de alrededor de 30°, un buen compromiso entre la correcta ubicación de la corteza del cañón izquierdo para la elaboración bobina del CE y libre movimiento de la vela de las derecha bigotes, que no deben ser bloqueados por la cama de MRI). Haga clic aquí para ver una versión más grande de esta figura.
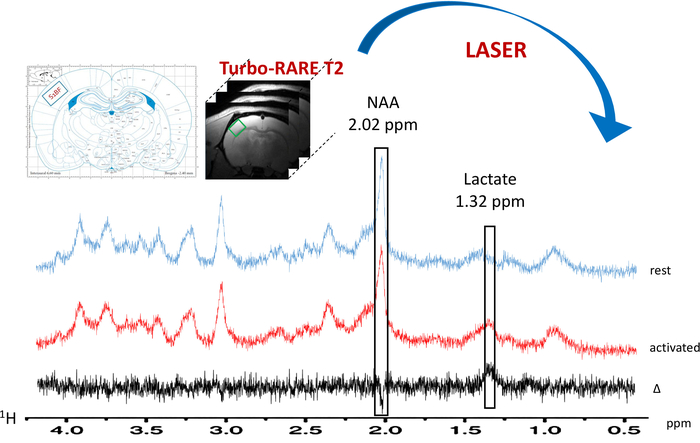
Figura 6: típica localizada 1H-MRS en reposo (espectro azul) y durante la activación de la barba (gama roja). El voxel (cuadrado verde) se encuentra en el S1BF izquierdo en las imagenes de T2_TurboRARE anatómicas usando esquemas de atlas de cerebro de rata y el realce de la señal en imágenes de fMRI audaz. La substracción espectral es trazada en negro. Picos de N-acetilaspartato (NAA) y lactato se indican en el 2.02 y 1.32 ppm, respectivamente. Haga clic aquí para ver una versión más grande de esta figura.
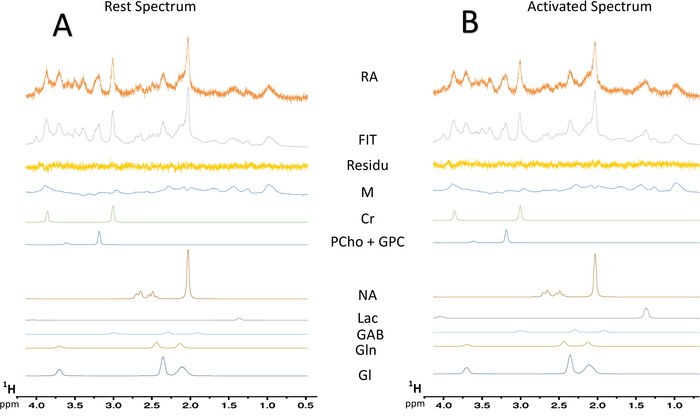
Figura 7: deconvolución espectral típica de espectros de MRS. (A) la deconvolución de un espectro de resto 128-scan. (B) la deconvolución de un espectro activado 128-scan. Residuo, resta entre espectro experimental (datos brutos) y el ajuste de LCModel; MM = macromolécula; CR = creatina + fosfocreatina; PCho + GPC = fosfocolina + glycerophosphocholine; NAA = N-acetylaspartate; Lac = lactato; GABA = ácido γ-aminobutírico; Gln = glutamina; Glu = glutamato. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8: variaciones en el lactato contenido durante la estimulación del cerebro. Punto azul: el lactato contenido en el resto, determinado por LCModel y en relación con la creatina + contenido de fosfocreatina. Punto rojo: contenido del lactato durante la estimulación de la barba, determinada por LCModel y en relación con la creatina + contenido de fosfocreatina. La diferencia entre activa y descansar, p = 0,0005, junto t-test (paramétrico, dos colas), n = 23. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La corteza del cañón, también llamada S1BF de la corteza somatosensorial o campo de barril, es una región dentro de la capa cortical IV que se puede observar mediante citocromo c oxidasa tinción9, y su organización es conocida ya que ha sido descrito en gran parte 10,11. Uno vibrisas está conectado a un barril, en que unos 19.000 neuronas se organizan en una columna12. La vía de la barba a barril corteza tiene varias ventajas. En primer lugar, puede ser activado dentro del imán por usar un sistema de aire-puff MRI-compatible, que puede ser fácilmente hechos en casa (para asegurar que en la mayor parte de la zona de S1BF, que corresponde aproximadamente al tamaño de lo voxel en que MRS es realizado, los bigotes se exprimen en una vela que permite la estimulación de un máximo de vibrisas). En segundo lugar, la derecha barba activación conduce a la activación de la corteza de cañón izquierdo, y esta área del cerebro se encuentra en la corteza somatosensorial, que permite el uso de una bobina de superficie de alta sensibilidad. En tercer lugar, este método de activación de la corteza somatosensorial es no invasiva comparado con estimulación eléctrica pata, el último tiene la desventaja de estimular otras estructuras cerebrales, incluyendo algunos en el hemisferio derecho13. Por lo tanto, el protocolo utilizado aquí es el más adecuado para llevar a cabo un vivo, no invasivo y longitudinal estudio del metabolismo cerebral en la activación cerebral.
La elección del anestésico es crucial, pues muchos de los anestésicos inducen cambios neurovasculares acoplamiento, metabolismo cerebral, o cerebro actividad14,15. Por ejemplo, isoflurano, el anestésico más comun usados para MRI, conduce a tres-al aumento del sixfold en cerebro lactato contenido15,16 y, por lo tanto, no debe ser utilizado en estudios metabólicos del cerebro. Medetomidina es un agonista α2-adrenorreceptores α, que induce confiable sedación, analgesia, relajación muscular y ansiolisis17. Estos efectos pueden invertirse rápidamente con atipamezole, un antagonista α2. Medetomidina es el mejor candidato para realizar estudios funcionales en roedores18 ya que tiene un impacto muy bajo en la señal en negrilla y las modificaciones más bajo en contenido de metabolitos cerebrales.
También es importante seguir el paradigma de la activación de la barba correctamente. Desde adquisiciones NMR duran varios minutos, el uso de sucesivos activación/descanso es esencial para limitar la desensibilización de las neuronas en el área cerebral activada. Los parámetros de este paradigma (20 s de activación seguido por un período de descanso de 10 s) fueron elegidos para obtener la mayor señal de fMRI audaz en la corteza de cañón correspondiente. Debe tener mucho cuidado de respetar estas ventanas de tiempo, es decisiva determinar el período de activación/reposo para tratamiento audaz, incluso si es controlado por el puerto TTL. Para obtener un alto nivel de activación de la corteza del barril, la vela que agrupa los bigotes juntos también es importante ya que permite la mayor parte de la zona de S1BF a estimular. Debe tener mucho cuidado al colocar el tubo de aire de salida frente a esta vela para que pueda moverse en un plano anteroposterior. La frecuencia debe ser cuidadosamente calibrado ya que se ha demostrado que las neuronas en la corteza del cañón se activan cuando la frecuencia de estimulación de la barba es entre 5 y 15 Hz19. Con una frecuencia menor o mayor no dará lugar a la activación de la zona de S1BF.
El protocolo utilizado en este estudio, es posible comparar espectros adquiridos en la misma zona del cerebro en reposo y durante la estimulación cerebral y, por lo tanto controlar metabólica cambia de activación ligada a cerebral. Es importante realizar una secuencia de localización al principio y al final del Protocolo de espectroscopia NMR, para asegurar que el animal no se ha movido y que las diferencias en el contenido metabólico medido entre los Estados de reposo y activados son debido al cerebro estímulo y no a los artefactos de movimiento.
Utilizando el protocolo descrito en el presente, un aumento en el contenido de lactato se midió entre reposo y períodos. Primero se observó aumento de lactato usando en vivo NMR espectroscopia durante la activación del cerebro en los seres humanos en los principios del decenio de 199020,21. Sin embargo, la mayoría de las mediciones se realizaron en los seres humanos en lugar de roedores, en los que la relación señal a ruido es mucho menor. En la rata ex vivo NMR cuantificación del lactato durante la activación del cerebro de rata se realizó por Mazuel et al. 22, que observó un aumento de cerebro lactato contenido con activación neuronal. Los resultados aquí presentados muestran que lactato aumentaba durante la activación de la barba. Sin embargo, puesto que MRS localizada no permite resolución celular, se desconoce de que lactato compartimiento celular viene (neuronas o astrocitos). Para ir más lejos en la comprensión de los intercambios metabólicos cerebrales, como el aún discutido ANLSH (hipótesis de lanzadera de lactato astrositos neurona), este protocolo debe aplicarse a los animales genéticamente modificados para los componentes claves en este enlace, tales como la transportadores del monocarboxylate.
En el estudio aquí descrito, no se observó ninguna diferencia estadísticamente significativa en el contenido de NAA. Una disminución en el contenido de NAA durante estimulación visual fue encontrada en los seres humanos23,24,25, pero no confirmada por Mangia y Tkac26. En el presente estudio, observamos un aumento en NAA contenido durante la activación cerebral en 50% de las ratas y una disminución en la otra mitad. Por lo tanto, debe evitarse NAA como la referencia interna para la cuantificación durante funcional No Sra. fue detectada otra variación en el contenido de metabolitos.
Tanto el lactato y las variaciones NAA durante la activación neuronal han dado lugar a controversias23,26,27,28,29. Para mejorar nuestra comprensión de estas fluctuaciones metabólicas vinculadas a la actividad cerebral, sería interesante aplicar este protocolo en animales transgénicos. Esto daría más información sobre el proceso subyacente. En general, localizada 1H-MRS durante una tarea, o funcional MRS29, es una técnica emergente en roedores, relevantes para el estudio de cambios de dinámica regionales en metabolitos en el cerebro normal o patológica.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por la concesión del rastro de la empresa LabEx, referencia ANR-10-LABX-57 y un Francés-Suiza ANR-FNS otorga referencia ANR-15-CE37-0012. Los autores agradecen Aurélien Trotier por su apoyo técnico.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.5 mL syringe with needle | Becton, Dickinson and Company, USA | 2020-10 | 0.33 mm (29 G) x 12.7 mm |
| 1H spectroscopy surface coil | Bruker, Ettlingen, Germany | T116344 | |
| 7T Bruker Biospec system | Bruker, Ettlingen, Germany | 70/20 USR | |
| Arduino Uno based pulsing device | custom made | ||
| Atipamezole | Vétoquinol, S.A., France | V8335602 | Antisedan, 4.28 mg |
| Breathing mask | custom made | ||
| Eye ointment | TVM laboratoire, France | 40365 | Ocry gel 10 g |
| Induction chamber | custom made | 30x17x15 cm | |
| Inlet flexible pipe | Gardena, Germany | 1348-20 | 4.6-mm diameter, 3m long |
| Isoflurane pump, Model 100 series vaporizer, classic T3 | Surgivet, Harvard Apparatus | WWV90TT | from OH 43017, U.S.A |
| Isoflurane, liquid for inhalation | Vertflurane, Virbac, France | QN01AB06 | 1000 mg/mL |
| KD Scientific syringe pump | KD sientific, Holliston, USA | Legato 110 | |
| LCModel software | LCModel Inc., Ontario, Canada | 6.2 | |
| Medetomidine hydrochloride | Vétoquinol, S.A., France | QN05CM91 | Domitor, 1 mg/mL |
| Micropore roll of adhesive plaster | 3M micropore, Minnesota, United States | MI912 | |
| Micropore roll of adhesive plaster | 3M micropore, Minnesota, United States | MI925 | |
| Monitoring system of physiologic parameter | SA Instruments, Inc, Stony Brook, NY, USA | Model 1025 | |
| NaCl | Fresenius Kabi, Germany | B05XA03 | 0.9 % 250 mL |
| Outlet flexible pipe | Gardena, Germany | 1348-20 | 4.6-mm diameter, 4m long |
| Paravision software | Bruker, Ettlingen, Germany | 6.0.1 | |
| Peripheral intravenous catheter | Terumo, Shibuya, Tokyo, Japon | SP500930S | 22 G x 1", 0.85x25 mm, 35 mL/min |
| Rat head coil | Bruker, Ettlingen, Germany | ||
| Sodic heparin, injectable solution | Choai, Sanofi, Paris, France | B01AB01 | 5000 IU/mL |
| Solenoid control valves, plunger valve 2/2 way direct-acting | Burkert, Germany | 3099939 | Model type 6013 |
| Terumo 2 ml syringe | Terumo, Shibuya, Tokyo, Japon | SY243 | with 21 g x 5/8" needle |
| Terumo 5 mL syringe | Terumo, Shibuya, Tokyo, Japon | 05SE1 | |
| Wistar RJ-Han rats | Janvier Laboratories, France |
Referencias
- Pellerin, L., et al. Activity-dependent regulation of energy metabolism by astrocytes: an update. Glia. 55, 1251-1262 (2007).
- Pellerin, L., Magistretti, P. J. Glutamate uptake into astrocytes stimulates aerobic glycolysis: a mechanism coupling neuronal activity to glucose utilization. Proceedings of the National Academy of Sciences of the United States of America. 91, 10625-10629 (1994).
- Cholet, N., et al. Local injection of antisense oligonucleotides targeted to the glial glutamate transporter GLAST decreases the metabolic response to somatosensory activation. Journal of Cerebral Blood Flow & Metabolism. 21, 404-412 (2001).
- Voutsinos-Porche, B., et al. Glial Glutamate Transporters Mediate a Functional Metabolic Crosstalk between Neurons and Astrocytes in the Mouse Developing Cortex. Neuron. 37, 275-286 (2003).
- Zimmer, E. R., et al. [18F]FDG PET signal is driven by astroglial glutamate transport. Nature Neuroscience. 20 (3), 393-395 (2017).
- Haiss, F., et al. Improved in vivo two-photon imaging after blood replacement by perfluorocarbon. The Journal of Physiology. , (2009).
- Mullins, P. G. Towards a theory of functional magnetic resonance spectroscopy (fMRS): A meta-analysis and discussion of using MRS to measure changes in neurotransmitters in real time. Scandinvian Journal of Psychology. 59, 91-103 (2018).
- Wong-Riley, M. T., Welt, C. Histochemical changes in cytochrome oxidase of cortical barrels after vibrissal removal in neonatal and adult mice. Proceedings of the National Academy of Sciences of the United States of America. 77, 2333-2337 (1980).
- Petersen, C. C. The functional organization of the barrel cortex. Neuron. 56, 339-355 (2007).
- Cox, S. B., Woolsey, T. A., Rovainen, C. M. Localized dynamic changes in cortical blood flow with whisker stimulation corresponds to matched vascular and neuronal architecture of rat barrels. Journal of Cerebral Blood Flow & Metabolism. 13, 899-913 (1993).
- Feldmeyer, D. Excitatory neuronal connectivity in the barrel cortex. Frontiers in Neuroanatomy. 6, 24 (2012).
- Boussida, S., Traore, A. S., Durif, F. Mapping of the brain hemodynamic responses to sensorimotor stimulation in a rodent model: A BOLD fMRI study. PLoS One. 12, e0176512 (2017).
- Heinke, W., Koelsch, S. The effects of anesthetics on brain activity and cognitive function. Current Opinion in Anesthesiology. 18, 625-631 (2005).
- Horn, T., Klein, J. Lactate levels in the brain are elevated upon exposure to volatile anesthetics: a microdialysis study. Neurochemistry International. 57, 940-947 (2010).
- Boretius, S., et al. Halogenated volatile anesthetics alter brain metabolism as revealed by proton magnetic resonance spectroscopy of mice in vivo. Neuroimage. 69, 244-255 (2013).
- Sinclair, M. D. A review of the physiological effects of alpha2-agonists related to the clinical use of medetomidine in small animal practice. Canadian Veterinary Journal. 44, 885-897 (2003).
- Weber, R., et al. A fully noninvasive and robust experimental protocol for longitudinal fMRI studies in the rat. Neuroimage. 29, 1303-1310 (2006).
- Hartmann, M. J., Johnson, N. J., Towal, R. B., Assad, C. Mechanical characteristics of rat vibrissae: resonant frequencies and damping in isolated whiskers and in the awake behaving animal. The Journal of Neuroscience. 23, 6510-6519 (2003).
- Prichard, J., et al. Lactate rise detected by 1H NMR in human visual cortex during physiologic stimulation. Proceedings of the National Academy of Sciences of the United States of America. 88, 5829-5831 (1991).
- Sappey-Marinier, D., et al. Effect of photic stimulation on human visual cortex lactate and phosphates using 1H and 31P magnetic resonance spectroscopy. Journal of Cerebral Blood Flow & Metabolism. 12, 584-592 (1992).
- Mazuel, L., et al. A neuronal MCT2 knockdown in the rat somatosensory cortex reduces both the NMR lactate signal and the BOLD response during whisker stimulation. PLoS One. 12, e0174990 (2017).
- Castellano, G., et al. NAA and NAAG variation in neuronal activation during visual stimulation. Brazilian Journal of Medical and Biological Research. 45, 1031-1036 (2012).
- Sarchielli, P., et al. Functional 1H-MRS findings in migraine patients with and without aura assessed interictally. Neuroimage. 24, 1025-1031 (2005).
- Baslow, M. H., Hrabe, J., Guilfoyle, D. N. Dynamic relationship between neurostimulation and N-acetylaspartate metabolism in the human visual cortex: evidence that NAA functions as a molecular water pump during visual stimulation. Journal of Molecular Neuroscience. 32, 235-245 (2007).
- Mangia, S., Tkac, I. Dynamic relationship between neurostimulation and N-acetylaspartate metabolism in the human visual cortex: evidence that NAA functions as a molecular water pump during visual stimulation. Journal of Molecular Neuroscience. 35, 245-248 (2008).
- Baslow, M. H., Hrabal, R., Guilfoyle, D. N. Response of the authors to the Letter by Silvia Mangia and Ivan Tkac. Journal of Molecular Neuroscience. 35, 247-248 (2008).
- Barros, L. F., Weber, B. CrossTalk proposal: an important astrocyte-to-neuron lactate shuttle couples neuronal activity to glucose utilisation in the brain. The Journal of Physiology. 596, 347-350 (2018).
- Bak, L. K., Walls, A. B. CrossTalk opposing view: lack of evidence supporting an astrocyte-to-neuron lactate shuttle coupling neuronal activity to glucose utilisation in the brain. The Journal of Physiology. 596, 351-353 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados