Method Article
La spectroscopie par résonance magnétique fonctionnelle à 7 T dans le Cortex de baril de Rat pendant l’Activation de Whisker
Dans cet article
Résumé
Après avoir vérifié par sang-oxygène-dépendante du niveau fonctionnel de l’imagerie par résonance magnétique (IRMf BOLD) que la superficie correspondante de cortex champ de baril somatosensoriel (appelée S1BF) est bien activée, le principal objectif de cette étude est de quantifier la teneur en lactates fluctuations dans le cerveau de rat activés par spectroscopie de résonance magnétique de proton localisé (1H-MRS) à 7 T.
Résumé
Spectroscopie de résonance magnétique nucléaire (RMN) offre la possibilité de mesurer le métabolite cérébral contenu in vivo et non invasive. Grâce aux développements technologiques au cours de la dernière décennie et l’augmentation de l’intensité du champ magnétique, il est maintenant possible d’obtenir bonne résolution spectres in vivo dans le cerveau de rat. Neuroenergetics (c'est-à-dire, l’étude du métabolisme cérébral) et, surtout, les interactions métaboliques entre les différents types de cellules ont suscité un intérêt de plus en plus ces dernières années. Parmi ces interactions métaboliques, l’existence d’une navette de lactate entre les neurones et les astrocytes est encore discutée. Il est, donc, d’un grand intérêt à effectuer la spectroscopie de résonance magnétique de proton fonctionnelle (1H-MRS) dans un modèle de rat de lactate de moniteur et d’activation cérébrale. Toutefois, le pic de lactate de méthyle chevauche les pointes de résonance des lipides et est difficile à quantifier. Le protocole décrit ci-dessous permet métabolique et les fluctuations à surveiller dans une zone du cerveau activées du lactate. Activation cérébrale est obtenue par la stimulation de la moustache et 1H-MRS est exécuté dans le cortex de baril activés correspondantes, dont la superficie est détectée à l’aide de l’oxygène-sang-dépendante du niveau fonctionnel résonance magnétique (IRMf BOLD). Toutes les étapes sont décrites en détail : le choix des anesthésiques, bobines et séquences, réaliser une stimulation efficace whisker directement dans l’aimant et le traitement des données.
Introduction
Le cerveau possède des mécanismes intrinsèques qui permettent la régulation de son principal substrat (c.-à-d., glucose), tant pour sa contribution et son utilisation, selon les variations de l’activité cérébrale locale. Bien que le glucose est le substrat de l’énergie principale pour le cerveau, les expériences réalisées ces dernières années ont montré que lactate, qui est produite par les astrocytes, pourrait être un substrat d’efficacité énergétique pour les neurones. Cela soulève l’hypothèse d’une navette de lactate entre les neurones et les astrocytes1. Connu comme ANLS, astrocyte-neurone lactate navette2, la théorie est encore très débattue mais a conduit à proposer ce glucose, plutôt que d’entrer directement dans les neurones, peut entrer les astrocytes, où il est métabolisé en lactate, un métabolite qui est , puis, transférée aux neurones, qui sert de substrat énergétique efficace. Si telle une navette existe en vivo, cela aurait plusieurs conséquences importantes, tant pour la compréhension des techniques de base en imagerie cérébrale fonctionnelle (tomographie par émission de positons [PET]) que pour déchiffrer les altérations métaboliques observées dans les pathologies cérébrales.
Pour étudier le métabolisme cérébral et, particulièrement, les interactions métaboliques entre les neurones et les astrocytes, les quatre principales techniques sont disponibles (non compris les micro / nano-capteurs) : autoradiographie, PET, microscopie confocal fluorescence biphotonique et Mme. Autoradiographie était l’une des premières méthodes proposées et fournit des images de l’accumulation régionale de radioactif 14C-2-désoxyglucose dans des tranches de cerveau, tout en PET rendements in vivo des images de la capture régionale de radioactifs 18 F-désoxyglucose. Les deux ont l’inconvénient de l’utilisation de molécules irradiative tout en produisant des images à résolution spatiale faible. Microscopie biphotonique offre une résolution cellulaire des sondes fluorescentes, mais la diffusion de la lumière par le tissu limite la profondeur d’imagerie. Ces trois techniques ont servi auparavant à étudier les neuroenergetics chez les rongeurs pendant whisker stimulation3,4,5,6. In vivo MRS a le double avantage d’être non invasive et non radioactif, et toute la structure du cerveau peut être explorée. En outre, MRS peut être effectuée au cours de l’activation neuronale, une technique appelée MRS fonctionnelle (rapports de gestion financière), qui a été développé très récemment dans les rongeurs7. Par conséquent, un protocole pour contrôler le métabolisme cérébral au cours de l’activité cérébrale par 1H-MRS in vivo et de façon non invasive est proposé. La procédure est décrite chez des rats adultes en bonne santé avec activation du cerveau obtenue par une stimulation de moustaches air-pouf effectuée directement dans un imageur par résonance magnétique (RM) de T à l’adresse 7 mais peut être adaptée chez les animaux génétiquement modifiés, ainsi que dans un état pathologique .
Protocole
Toutes les procédures d’animaux ont été effectuées conformément aux directives expérimentation animale européenne communautés la directive du Conseil du 24 novembre 1986 (86/609/CEE). Le protocole a rencontré les directives éthiques du Ministère Français de l’Agriculture et des forêts et a été approuvé par les comités d’éthique locaux (Comité d « éthique versez L » expérimentation Animale Bordeaux n ° 50112090-A).
NOTE : Lors de la mesure de Monsieur, un niveau adéquat d’anesthésie et en surveillance physiologique (température corporelle, la fréquence respiratoire) sont des exigences indispensables.
1. les animaux
- Utiliser des rats Wistar mâles pesant entre 350 et 450 g.
- Conservez-les sur un 12:12 h de lumière : obscurité cycle et fournir de la nourriture et l’eau ad libitum.
2. anesthésie
- Préparer le matériel nécessaire pour l’anesthésie (Figure 1 a, B, voir la Table des matières) : une seringue de 5 mL contenant médétomidine en solution saline physiologique (240 µg/kg/h, avec un taux de perfusion de 20 µL/min), une seringue de 0,5 mL contenant atipamézole (20 μL, dans 0,5 mL de solution saline) et pommade ophtalmique.
Remarque : Conservez tout le matériel sous la hotte aspirante, sauf la seringue de 5 mL contenant médétomidine, qui est placé dans le pousse-seringue autour de l’aimant pour l’anesthésie au cours de l’acquisition de Monsieur. - Placez le rat dans la chambre de l’induction, démarrer l’anesthésie en livrant 4 % isoflurane et régler le débit d’oxygène à 1,5 L/min.
- Évaluer la profondeur de l’anesthésie en évaluant le retrait des réflexes de la patte.
- Lorsque le rat ne répond pas à la stimulation, sortir de la boîte de l’anesthésie, placez-le sur le banc avec son nez dans le masque de l’isoflurane et maintenir l’anesthésie en livrant de 2,5 % dans l’oxygène à 1,5 L/min.
- Doucement masser la queue et placer le tourniquet (Figure 1).
NOTE : Le massage peut être effectué dans l’eau tiède, avec une température entre 38 et 42 ° C, pour obtenir une meilleure vasodilatation des veines. - Insérer le cathéter intraveineux périphérique (22 G), précédemment hépariné, dans la veine caudale gauche ou à droite. Notez qu’on observe un retour veineux (une goutte de sang est visible à la partie distale de l’aiguille) lorsque le cathéter est correctement inséré (Figure 1).
- Souffler les bulles d’air présentes dans le volume d’espace mort de cathéter à l’aide de la seringue de 2 mL contenant de l’héparine et solution de sérum physiologique.
- Appliquer la pommade oculaire et préparer la seringue contenant atipamézole (17 µg/mL) pour réveiller le rat à la fin de l’expérience.
3. rat Placement dans Magnet pour la Stimulation Whisker
- Placer un capteur de respiration sur le lit de l’aimant et ensuite transférer le rat sur le banc pour le lit de l’aimant. Placez-le en position couchée avec son nez dans le masque de l’isoflurane, avec le capteur de respiration situé entre la cage thoracique et le lit de l’aimant.
Remarque : Tout le matériel qui entre dans la salle de MRI devrait être MRI-safe. - Diminuer l’isoflurane (de 4 % à 1,5 %-2 %) pendant le placement de rat et basculez l’anesthésie médétomidine à la fin de cette procédure. Veiller à ce que les moustaches de droite sont libres, ayant coupé le bord droit à l’avant du rat lit MRI au préalable pour permettre le mouvement des moustaches.
- Tenez le rat en place avec du ruban adhésif et surveiller sa respiration qui doit être comprise entre 60 et 80 respirations / minute.
- Faire une voile qui intercepte les moustaches tout droits dans la bande de papier (Figure 2). Aligner le tuyau d’évacuation flexible du système air-souffle le long de la rat lit MRI afin que la partie sortant du tube est perpendiculaire et à environ 1,5 cm de la voile. Fixez-le avec du ruban de papier.
4. whisker Stimulation
- Connectez le tuyau flexible d’arrivée d’une source d’air comprimé (1 bar) à une entrée de soupape de commande de solénoïde et le tuyau d’évacuation à la sortie de vanne de contrôle solénoïde (Figure 3). S’assurer que l’électrovanne de contrôle reste à l’extérieur de la salle de l’aimant.
- Branchez le périphérique "pulsé" de l’électrovanne et à l’aimant à l’aide de la logique de transistor-transistor (TTL)-port. Configurez-le afin que la fréquence de pulsation = 8 Hz, le temps de "pulsé" = 20 s et le temps de repos = 10 s.
Remarque : Ces paramètres, visualisées sur le petit cristaux liquides (LCD) écran de visualisation, sont réglable via les potentiomètres analogiques dédiés trois. Le dispositif électronique "pulsé", qui contrôle le paradigme, doit être composé de composants électroniques de haute qualité afin d’éviter toute dérive dans les paramètres de temps (pour le post-traitement correcte).
5. "BOLD" IRMf Acquisition
- Placer le cerveau du rat pour qu’il soit en position verticale et utilisez les barres de l’oreille de le pour entretenir. Placer la bobine de tableau volume dessus de tête de rat (Figure 4 a) et fixez-le à l’aide de ruban adhésif. Vérifier que la voile se déplace correctement (mouvement antéro-postérieur, sans rotation et sans frottement de voile) lorsque le système air-puff est tourné sur; puis, éteignez-le.
- Insérer le lit et la bobine dans le centre de l’aimant. Vérifier que la voile se déplace encore correctement une fois que le lit est à l’intérieur de l’aimant lorsque le système air-puff est sur; puis, éteignez-le. Passer complètement d’isoflurane à médétomidine (taux de perfusion : 20 µL/min).
- Vérifiez que le rat est bien situé à l’aide d’une séquence de localisation (TE = 2,5 ms ; TR = 100 ms ; moyenne = 1 ; répétition = 1 ; tranche = 1 mm ; taille de l’image = 256 x 256 ; champ de vision (FOV) = 50 x 50 mm ; temps de scan = 12 s 800 ms). Faites glisser l’onglet de séquence d’alignement de piste dans le nom de l’Instruction et cliquez sur continuer.
- Faites glisser l’onglet séquence de T2_Star_FID_EPI dans le nom de l’Instruction, centre du champ de vision sur le milieu du cerveau et cliquez sur l’onglet de la plate-forme d’ajustement pour ouvrir l’instruction scan édité. Enregistrer une carte de0 B et procéder à un balayage de cale.
Remarque : Pour une carte de0 B, utilisez les paramètres suivants : première fois écho = 1,65 ms ; TR = 20 ms, moyennes = 1 ; Flip angle = 30° ; écho d’espacement = 3,805 ms ; tranche = 58 mm ; taille de l’image = 64 x 64 x 64 ; FOV = 58 x 58 x 58 mm ; temps de scan = 1 m 24 s 920 Mme pour scan shim, utilisez les paramètres suivants : voxel excitation sélective = impulsion gaussienne de vapeur ; TE = 5 ms ; temps de mélange = 10 ms ; durée d’acquisition = 204,8 ms ; bande passante maximale = 10 000 Hz ; temps de pause = 50 μs). - Démarrer la séquence T2 Star_FID_EPI (TE = 16,096 ms ; TR = 500 ms ; moyenne = 1 ; répétition = 600 ; tranche = 1 mm ; quatre coupes consécutives ; taille de l’image = 128 x 128 ; FOV = 20 x 20 mm ; bande passante maximale = 333 333,3 Hz ; temps de scan = 5 min 00 s).
Remarque : En raison du port TTL, déclenchant un signal extérieur démarre le système air-pouf en même temps. Le paradigme = [20 s activation + 10 reste s] x 10, pour toute la durée des 600 scannes, 500 ms par balayage. Les tranches sont centrées sur le milieu de la zone de champ de baril. - Acquérir une autre séquence de localisation (identique à l’étape décrite dans un 5.3) permettant de comparer avec le premier et vérifiez si le rat se déplace au cours de la séquence T2_Star_FID_EPI.
- Mettre le lit dans sa position initiale, retirer la bobine de tableau de volume et raccorder la bobine de surface.
6. "BOLD" traitement
- Ouvrez le fichier Star_FID_EPI T2 et lire l’image T2 Star_FID_EPI dans l’Affichage des images. Ouvrez la fenêtre de démarrage du contrôleur fonctionnel, appelé FunController.
- Dans cet onglet traitement , sélectionnez la fenêtre d’imagerie fonctionnelle et de définir le protocole de stimulation (durée et alternance de On/Off périodes, correspondant au paradigme utilisé).
- Sélectionnez la fenêtre protocole (dataset à l’aide de 600 cadres) et insérer la valeur de 40 dans l’onglet Sur la période et 20 dans l’onglet période , cliquez sur l’onglet Attribution d’inverser et faites glisser le curseur de Stimulation États vers la gauche pour sélectionner le valeur 1.
- Dans la fenêtre de prétraitement, cliquez sur le filtre médian dans l’avion pour le prétraitement et le filtre médian (2D, 3D) pour le post-traitement.
- Cliquez sur l’onglet Execute et faites glisser les curseurs pour ajuster la table de choix de superposition. Visualiser la zone du cerveau activées (Figure 4 b).
7. proton Mme Acquisitions
- Positionner correctement la bobine de surface, modifier la position de la tête de rat. Rotation de la tête (dans le sens horaire d’environ 30°) pour que la bobine de surface (Figure 5 a) peut être placée juste au-dessus du cortex de baril gauche tout en étant horizontale et située au centre aimant quand à l’intérieur de l’aimant.
- Placer la bobine de surface, fixez-le sur le cerveau du rat à l’aide de ruban adhésif (Figure 5 b) et vérifier que la voile se déplace correctement (mouvement antéro-postérieur, sans rotation et sans frottement de la voile) lorsque le système air-puff est tourné sur; ensuite, il éteindre à l’interrupteur principal.
- Vérifier que la voile se déplace correctement une fois que le lit est à l’intérieur de l’aimant lorsque le système air-pouf est activé. Puis, éteignez-le.
- Vérifier que le rat est positionné correctement en utilisant une séquence de localisation. Réglez les paramètres comme suit : TE = 2,5 ms ; TR = 100 ms ; moyenne = 1 ; répétition = 1 ; tranche = 1 mm ; taille de l’image = 256 x 256 ; FOV = 50 x 50 mm ; temps de scan = 12 s 800 ms.
- Faites glisser l’onglet de séquence d’alignement de piste dans la fenêtre nom d’Instruction et cliquez sur l’onglet de continuer d’exécuter le programme de numérisation.
- Lorsque la localisation cérébrale est correcte, faites glisser l’onglet de séquence T2_TurboRARE dans la fenêtre nom d’Instruction et cliquez sur continuer pour exécuter le programme de numérisation. Ces images anatomiques, ainsi que de l’acquisition d’IRMf BOLD précédente, permettra la localisation correcte du voxel dans la S1BF profit de Mme.
Remarque : Les paramètres T2_TurboRARE sont 14 tranches, 2 mm par tranche, FOV = 2,5 x 2,5 cm, TE = 100 ms, TR = 5 000 ms, matrice = 128 x 128, temps de séquence = 2 min 40 s. - Faites glisser l’onglet séquence LASER dans la fenêtre nom d’Instruction , placer le voxel (hauteur 2 mm, 2,5 mm de long, 3 mm de profondeur) au centre de la zone de S1BF.
- Utiliser un atlas de cerveau de rat et de l’amélioration de l’IRMf BOLD pour localiser la zone sur des images de T2 (Figure 6). Cliquez sur l’onglet de la plate-forme d’ajustement pour ouvrir l’instruction scan édité. Cliquez sur l’onglet Wobble et changement de l’impédance (chargement électronique) de la bobine de réception légèrement à tune. Cliquez sur l’onglet appliquer lorsque le réglage est terminé pour fermer l’éditeur de l’enseignement et appliquer les modifications dans l’instruction de modification.
- Enregistrer une carte de0 B et procéder au balayage shim et, ensuite, effectuer une cale locale.
Remarque : Pour consulter la carte de0 B, utilisez les paramètres suivants : première fois écho = 1,65 ms ; TR = 20 ms, moyennes = 1 ; Flip angle = 30° ; écho d’espacement = 3,805 ms ; tranche = 58 mm ; taille de l’image = 64 x 64 x 64 ; FOV = 58 x 58 x 58 mm ; temps de scan = 1 m 24 s 920 Mme pour la cale de balayage, utilisez les paramètres suivants : voxel pulsion gaussienne de le vapeur d’excitation sélective ; TE = 5 ms ; temps de mélange = 10 ms ; durée d’acquisition = 204,8 ms ; bande passante maximale = 10 000 Hz ; temps de pause = 50 μs. Pour la cale locale, utilisez les paramètres suivants : suppression de l’eau, durée d’acquisition de vapeur = 1 363,15 ms ; points = 4 096 ; bande passante en Hz = 3 004,81 Hz ; bande passante en ppm = 10 ppm ; temps de pause = 166,40 μs ; résolution spectrale = 0,37 Hz/points. Les paramètres LASER sont : temps d’écho = 19,26 ms ; TR = 2 500 ms ; moyenne = 128 ou 32 ; temps de scan = 5 min 20 s ou 1 min 20 s ; points d’achat = 4 096. - Effectuer 1H-MRS.
- Le départ de la 1H-MRS acquisition tout d’abord pendant une période de repos (scans LASER 4 x 32 + LASER 128 scans ; 2 500 ms par scan).
- Acquérir une autre séquence de localisation (identique à l’étape décrite dans un 5.3) pour comparer avec le premier enregistré et veiller à ce que le rat n’a pas bougé lors de l’acquisition du LASER.
- Effectuer 1H-MRS lors de l’activation de moustaches à l’aide de la séquence LASER (scans LASER 4 x 32 + LASER 128 scans ; 2 500 ms par scan) avec le système air-pouf (paradigme = 20 s d’activation et 10 s de repos).
- Encore une fois, exécuter une séquence de localisation pour vérifier si le rat a déménagé.
Remarque : Le nombre de scans et de périodes de repos/activé peut être adapté et modifié, mais toujours veiller à ce que le rat n’est pas en mouvement en effectuant régulièrement une séquence de localisation.
- Mettre le lit dans sa position initiale, retirer la bobine de surface et reculer le rat à la magistrature. Injecter atipamézole dans un pli de peau fait en arrière du rat pour inverser l’anesthésie et réveiller il.
8. proton Mme traitement
- Ouvrez le logiciel LCModel et cliquez sur l’onglet approprié pour sélectionner le type de données appropriée (fichier Free Induction Decay ) et sélectionnez le fichier. Cliquez sur l’onglet OK quand ce sera fait.
- Optimiser les paramètres de contrôle de quantification étape par étape.
- Dans la section titre , entrez un titre et manuellement définir une gamme adéquate ppm (p. ex., 0,2 à 4,0 ppm) en tapant manuellement la valeur nécessaire dans leurs champs respectifs.
- Dans la section du fichier de base , sélectionnez et téléchargez le fichier requis pour s’adapter correctement à la base de la macromolécule (elle peut être fournie par le fournisseur du logiciel).
- Définir et charger les paramètres de contrôle d’entrée. Préparer l’enregistrement de tous les types de fichiers utiles au préalable (TABLE = tables compactes ; PS = nécessaire sortie PostScript ; CSV = format de feuilles de calcul ; COORD = coordonnées des emplacements). Cliquez sur l’onglet RunLCModel pour commencer la quantification LCModel.
- Définir des métabolites sélectionnés pour produire des statistiques.
NOTE : LCModel permet la quantification de métabolite et estimations des erreurs par une valeur appelée (CRLB) de Cramér-Rao lower bound. Une valeur avec un CRLB < 15 est considéré comme une quantification optimale. Un CRLB > 25 indique une valeur non fiable.
Résultats
Ce protocole permet la quantification des fluctuations de métabolite lors de l’activation cérébrale, qui est obtenue par la stimulation de la moustache droite directement dans l’aimant.
Dans cette étude, l’objectif global de l’IRMf BOLD était de vérifier que la stimulation de la moustache était efficace, pour visualiser la zone de S1BF activée et localiser correctement le voxel pour 1H-rapports de gestion financière. Le dispositif construit pour l’activation de la moustache est efficace. En effet, lorsque moustaches droite sont stimulées en utilisant le système air-feuilletée faite maison, un signal positif "BOLD" a été détecté dans le cortex de baril gauche (Figure 4 b), aussi appelé le S1BF, pour le champ canon somatosensoriel (n = 8). Une amélioration du signal positif a été détectée dans le cortex de baril gauche chez les huit sur huit, alors que seulement l’arrière-plan a été détectée dans les hémisphères droit. Lorsque l’IRMf BOLD a été effectuée sans stimulation de moustaches, aucune amélioration du signal a été observée la gauche ou la droite S1BF.
Dans une comparaison entre des images anatomiques de résonance et rat brain atlas régimes8, la zone du cerveau activées visualisée par IRMf BOLD permet le voxel être placé dans la zone de S1BF, qui est activée au cours de la stimulation de la moustache. Ce voxel est situé sur trois diapositives consécutives (1 mm d’épaisseur) puisque le cortex de baril est de 3 mm de long. Lorsque la diapositive du cerveau est pratiquement séparée en quatre quartiers, le voxel est situé dans le coin supérieur gauche trimestre à un angle d’environ 45° (Figure 6).
Lorsque le paradigme pour la stimulation de la moustache est allumé, une augmentation de la teneur en lactates a été observée dans le S1BF gauche (Figure 6, les spectres typiques obtenus chez un rat). Pour mieux visualiser les variations métaboliques entre repos et activés périodes, une soustraction spectrale a été accomplie (Figure 6). De ce spectre soustraite, l’augmentation de la teneur en lactates avec activation cérébrale a été visualisée beaucoup plus facilement, alors que dans ce rat, le signal du N-acétylaspartate (NAA) a été légèrement diminué. Augmentation de lactate au cours de la stimulation neuronale a été également observée sur la déconvolution spectrale (Figure 7 aB). Alors que le pic de lactate a été difficilement détecté sur le spectre en vivo au repos, LCModel a pu quantifier (Figure 7 a) avec précision et de bonnes valeurs CRLB. En effet, 23 rats, qu’un spectre avait une valeur de la CRLB pour dosage de lactate égale à 24. Aucun n’est > 25. Pour tous les autres spectres, les valeurs variaient entre 3 et 19.
Les variations de la teneur en lactates chez tous les 23 rats sont présentées dans la Figure 8. Hors 23 rats, une diminution de la teneur en lactates a été observée que dans un seul rat. Il n’y avait aucune différence statistiquement significative en lactate contenu entre repos et activés périodes (0,132 ± 0,012 et 0,163 ± 0,011, respectivement, des valeurs proches de PCr + Cr contenu, jumelé t-test, p = 0,0005 [paramétrique, bilatéral] n = 23). Par conséquent, une augmentation de 7,8 % ± de 31,6 % en teneur en lactates a été mesurée pendant la stimulation neuronale.
Une légère diminution de la teneur en NAA peut être observée dans la Figure 6, qui représente les spectres typiques obtenus chez un animal. Cependant, cette variation de NAA n’était pas significative (une diminution de 1,2 % 1,2 % ± a été mesurée, n = 23).
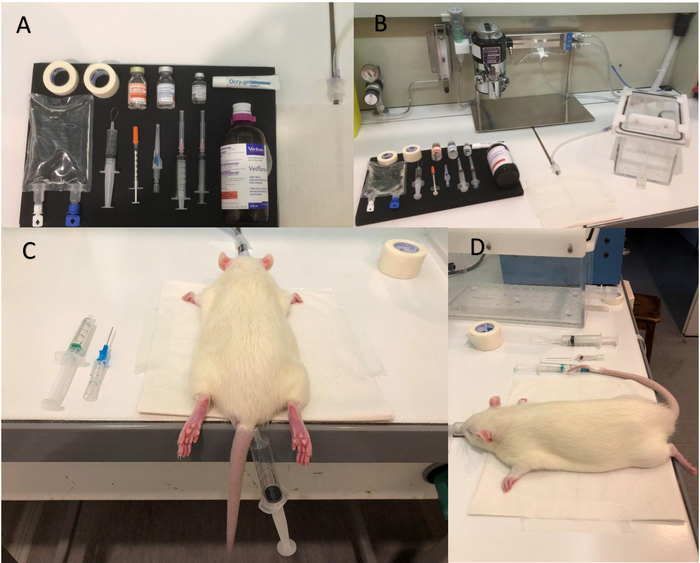
Figure 1 : équipement et étapes pour anesthésie. (A) image de l’équipement à être préparé avant le début de l’anesthésie. (B) Isoflurane chambre de pompe et l’induction. (C) placement Tourniquet. (D) photo montre que le cathéter a été inséré correctement ; Notez la goutte de sang dans l’aiguille cathéter, qui est un signe positif d’un emplacement correct dans la veine. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : stimulation Whisker. Moustaches tous les droits sont pris au piège dans une voile avec bande de papier. La voile permet les moustaches tous les droits doivent être stimulées en même temps avec le système air-pouf et, donc, maximise l’activation neuronale du cortex baril. La sortie du système air-pouf (tuyau noir) doit être située autour de 1,5 cm et perpendiculaire à la voile. Vérification à l’extérieur de l’aimant pour s’assurer que la voile se déplace correctement en activant le système air-pouf. La voile doit se déplacer à 8 Hz dans une direction antéro-postérieure (sans rotation). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : système Air-pouf pour une stimulation whisker. (A) A tuyau flexible relie l’air comprimé (B), l’électrovanne de commande. Un deuxième tuyau flexible apporte de l’air pulsé de la sortie de vanne de contrôle solénoïde à la voile. L’électrovanne de contrôle est branché sur le dispositif "pulsé", qui commande le paradigme. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : IRMf BOLD. (A) Volume array placement de bobine. La tête de rat est en position horizontale et bloqué par des barres d’oreilles. Vérifiez que la voile se déplace librement et n’est pas bloquée par la bobine ou le lit de MRI. (B) un typique "BOLD" signal du cortex activée baril gauche (flèche rouge). Aucun signal n’est détecté dans l’hémisphère controlatéral droit (flèche bleue). Le seuil est fixé à 76,5 % du maximum de la valeur de l’intensité. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 5 : bobine Surface. Photo (A) de la bobine de surface utilisée dans cette étude. Placement de bobine de Surface (B). La tête de rat doit être légèrement tournée afin que le cortex gauche baril et, par conséquent, la bobine de surface sont situés dans le centre du lit MRI (la tête est tournée à un angle d’environ 30°, un bon compromis entre l’emplacement correct du cortex gauche baril pour la surfa ce bobine et mouvements libres de la voile des droite favoris, qui ne devraient pas être bloqués par le lit de MRI). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
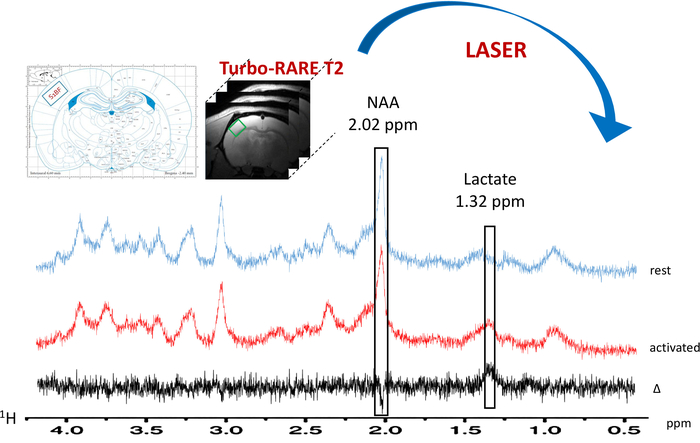
Figure 6 : typique localisé 1H-MRS au repos (spectre bleu) et lors de l’activation de moustaches (spectre rouge). Le voxel (carré vert) se trouve dans le S1BF gauche sur les images T2_TurboRARE anatomiques, à l’aide de schémas de rat brain atlas et amélioration du signal sur les images de l’IRMf BOLD. La soustraction spectrale est tracée en noir. Lactate et du N-acétylaspartate (NAA) pics sont indiqués à 1,32 et 2,02 ppm, respectivement. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
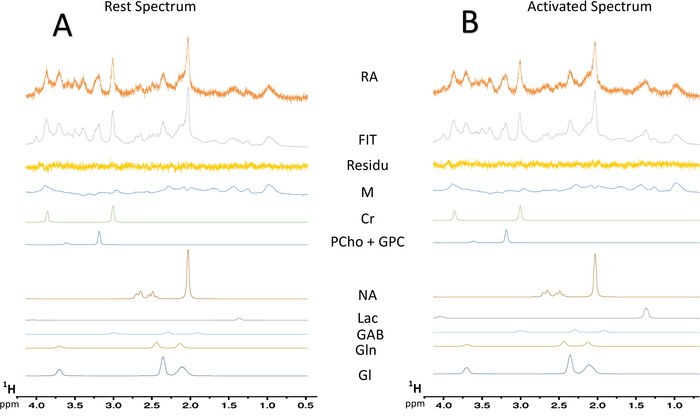
Figure 7 : déconvolution spectrale typique des spectres de MRS. Déconvolution (A) d’un spectre reste 128-scan. Déconvolution (B) d’un spectre activé 128-scan. Résidus, soustraction entre le spectre expérimental (données brutes) et la fit LCModel ; MM = macromolécule ; CR = créatine + phosphocréatine ; PCho + PDC = phosphocholine + glycérophosphocholine ; NAA = N-acétylaspartate ; Lac = lactate ; GABA acide γ-aminobutyrique ; GLN = glutamine ; Glu = glutamate. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 8 : Variations lactate de contenu au cours de la stimulation cérébrale. Point bleu : lactate de contenu au repos, déterminé par LCModel ainsi que par rapport à la créatine + contenu de phosphocréatine. Point rouge : lactate de contenu pendant la stimulation de moustaches, déterminée par LCModel ainsi que par rapport à la créatine + contenu de phosphocréatine. La différence entre les deux activés et se reposer, p = 0,0005, jumelé t-test (paramétrique, à deux points), n = 23. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Le cortex de baril, également appelé S1BF pour le cortex somatosensoriel ou champ de canon, est une région au sein de la couche corticale IV que l'on peut observer à l’aide de la cytochrome c oxydase coloration9, et son organisation est bien connue car elle a été largement décrit 10,11. Un vibrissa est connecté à un tonneau, dans lequel environ 19 000 neurones sont organisés en une colonne12. La voie de moustaches-au-baril cortex présente plusieurs avantages. Tout d’abord, il peut être activé à l’intérieur de l’aimant à l’aide d’un système d’air-pouf MRI-compatible, qui peut être facilement fait maison (à faire en sorte que la plus grande partie de la zone de S1BF, ce qui correspond approximativement à la taille de la voxel dans laquelle MRS est exécutée, toutes les moustaches serrés dans un voile qui permet la stimulation d’un maximum de vibrissa). En second lieu, droit activation whisker mène à l’activation des cortex gauche baril, et cette région du cerveau est situé dans le cortex somatosensoriel, qui permet l’utilisation d’une bobine de surface de haute sensibilité. Troisièmement, cette méthode d’activation du cortex somatosensoriel est non invasive par rapport à la stimulation électrique patte, la dernière ayant l’inconvénient de stimuler les autres structures du cerveau, y compris dans l' hémisphère droit13. Par conséquent, le protocole utilisé ici est le plus adapté pour effectuer un in vivo, non invasive et longitudinales étude du métabolisme cérébral sous activation cérébrale.
Le choix de l’anesthésique est crucial, comme bon nombre des anesthésiques induisent des changements dans le couplage neurovasculaire, métabolisme cérébral, et/ou de l’activité de cerveau14,15. Par exemple, isoflurane, l’anesthésie plus commun utilisé pour l’IRM, conduit à une trois-augmentation sextuple cerveau lactate contenu15,16 et, donc déconseillé dans les études de métabolisme de cerveau. Médétomidine est un agoniste α2-adrénergiques, qui induit fiable sédation, analgésie, relaxation musculaire et l’Anxiolyse17. Ces effets peuvent être inversés rapidement à l’aide d’atipamézole, un antagoniste α2. Médétomidine est le candidat le mieux placé pour effectuer des études fonctionnelles dans rongeurs18 car il a un impact très faible sur le signal "BOLD" et les modifications plus faible en matières de métabolite de cerveau.
Il est également important de suivre le paradigme d’activation whisker correctement. Étant donné que les acquisitions de NMR durent plusieurs minutes, l’utilisation de périodes successives d’activation/repos est essentielle pour limiter la désensibilisation des neurones de la région du cerveau activées. Les paramètres de ce paradigme (20 s d’activation suivie d’une période de repos de 10 s) ont été choisis pour obtenir le plus haut signal IRMf BOLD dans le cortex de baril correspondante. Bien veiller à respecter ces fenêtres de temps puisqu’il est essentielle pour déterminer la période d’activé/repos pour traitement "BOLD", même si elle est contrôlée par le port TTL. Pour obtenir un niveau élevé de baril, activation du cortex, la voile qui regroupe les moustaches ensemble est également important car il permet la plus grande partie de la zone de S1BF d’être stimulé. Bien veiller à placer le tuyau d’air de sortie devant cette voile afin qu’il peut se déplacer sur un plan antéro-postérieur. La fréquence doit être étalonné avec soin puisqu’il a été démontré que les neurones dans le cortex de baril sont activés lorsque la fréquence de stimulation moustaches est entre 5 et 15 Hz19. En utilisant une fréquence inférieure ou supérieure ne conduira pas à l’activation de la zone de S1BF.
Le protocole utilisé dans cette étude permet de comparer les spectres acquis dans la même région du cerveau au repos et au cours de la stimulation cérébrale et, par conséquent, pour surveiller les métabolique remplace activation liée à cérébrale. Il est important d’effectuer une séquence de localisation au début et à la fin du protocole NMR spectroscopy, pour s’assurer que l’animal n’a pas bougé et que les différences de contenu métabolique mesurée entre les États au repos et activés sont dus à cerveau stimulation et non aux artefacts de mouvement.
En utilisant le protocole décrit dans les présentes, une augmentation de la teneur en lactates a été mesurée entre repos et activé les périodes. Augmentation de lactate par in vivo RMN spectroscopie lors de l’activation du cerveau fut observée chez l’homme dans le début des années 199020,21. Cependant, la plupart des mesures ont été effectuées dans les humains plutôt que des rongeurs, dans lequel le rapport signal-bruit est beaucoup plus faible. Chez le rat, ex vivo NMR dosage du lactate au cours de l’activation de cerveau de rat a été réalisée par Mazuel et al. 22, qui a observé une augmentation de cerveau contenu avec activation neuronale du lactate. Les résultats présentés ici montrent que lactate a augmenté au cours de l’activation de la moustache. Cependant, MRS localisées ne permettant pas de résolution cellulaire, il est encore inconnu de laquelle lactate compartiment cellulaire est à venir (les neurones et les astrocytes). Pour aller plus loin dans la compréhension des échanges métaboliques cérébraux, tels que l’encore débattu ANLSH (hypothèse de navette astrocyte-neurone lactate), ce protocole doit être appliqué à des animaux génétiquement modifiés pour les composants clés de cette navette, tels que la monocarboxylate transporteurs.
Dans l’étude décrite ici, a observé aucune différence statistiquement significative dans le contenu de la NAA. Une diminution du NAA contenu au cours de la stimulation visuelle en était précédemment trouvée dans les humains23,24,25, mais pas confirmée par Mangia et Tkac /26. Dans la présente étude, nous avons observé une augmentation de NAA contenu pendant l’activation cérébrale dans 50 % des rats et une diminution dans l’autre moitié. Par conséquent, NAA devrait être évitée comme référence interne pour la quantification lors fonctionnel Mme No autre variation de teneur en métabolite a été détectée.
Les deux lactate et les variations au cours de l’activation neuronale NAA ont donné lieu à controverses23,26,27,28,29. Pour approfondir notre compréhension de ces fluctuations métaboliques lié à l’activité cérébrale, il serait intéressant d’appliquer ce protocole à des animaux transgéniques. Cela fournirait davantage d’informations sur le processus sous-jacent. Dans l’ensemble, localisée 1H-MRS au cours d’une tâche ou fonctionnelle MRS29, est une technique émergente chez les rongeurs, pertinentes à l’étude des variations dynamiques régionales de métabolites, dans le cerveau normal ou pathologique.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par l’octroi de LabEx TRAIL, référence ANR-10-LABX-57 et un Français-Swiss ANR-FNS accorde référence ANR-15-CE37-0012. Les auteurs remercient Aurélien Trotier pour son soutien technique.
matériels
| Name | Company | Catalog Number | Comments |
| 0.5 mL syringe with needle | Becton, Dickinson and Company, USA | 2020-10 | 0.33 mm (29 G) x 12.7 mm |
| 1H spectroscopy surface coil | Bruker, Ettlingen, Germany | T116344 | |
| 7T Bruker Biospec system | Bruker, Ettlingen, Germany | 70/20 USR | |
| Arduino Uno based pulsing device | custom made | ||
| Atipamezole | Vétoquinol, S.A., France | V8335602 | Antisedan, 4.28 mg |
| Breathing mask | custom made | ||
| Eye ointment | TVM laboratoire, France | 40365 | Ocry gel 10 g |
| Induction chamber | custom made | 30x17x15 cm | |
| Inlet flexible pipe | Gardena, Germany | 1348-20 | 4.6-mm diameter, 3m long |
| Isoflurane pump, Model 100 series vaporizer, classic T3 | Surgivet, Harvard Apparatus | WWV90TT | from OH 43017, U.S.A |
| Isoflurane, liquid for inhalation | Vertflurane, Virbac, France | QN01AB06 | 1000 mg/mL |
| KD Scientific syringe pump | KD sientific, Holliston, USA | Legato 110 | |
| LCModel software | LCModel Inc., Ontario, Canada | 6.2 | |
| Medetomidine hydrochloride | Vétoquinol, S.A., France | QN05CM91 | Domitor, 1 mg/mL |
| Micropore roll of adhesive plaster | 3M micropore, Minnesota, United States | MI912 | |
| Micropore roll of adhesive plaster | 3M micropore, Minnesota, United States | MI925 | |
| Monitoring system of physiologic parameter | SA Instruments, Inc, Stony Brook, NY, USA | Model 1025 | |
| NaCl | Fresenius Kabi, Germany | B05XA03 | 0.9 % 250 mL |
| Outlet flexible pipe | Gardena, Germany | 1348-20 | 4.6-mm diameter, 4m long |
| Paravision software | Bruker, Ettlingen, Germany | 6.0.1 | |
| Peripheral intravenous catheter | Terumo, Shibuya, Tokyo, Japon | SP500930S | 22 G x 1", 0.85x25 mm, 35 mL/min |
| Rat head coil | Bruker, Ettlingen, Germany | ||
| Sodic heparin, injectable solution | Choai, Sanofi, Paris, France | B01AB01 | 5000 IU/mL |
| Solenoid control valves, plunger valve 2/2 way direct-acting | Burkert, Germany | 3099939 | Model type 6013 |
| Terumo 2 ml syringe | Terumo, Shibuya, Tokyo, Japon | SY243 | with 21 g x 5/8" needle |
| Terumo 5 mL syringe | Terumo, Shibuya, Tokyo, Japon | 05SE1 | |
| Wistar RJ-Han rats | Janvier Laboratories, France |
Références
- Pellerin, L., et al. Activity-dependent regulation of energy metabolism by astrocytes: an update. Glia. 55, 1251-1262 (2007).
- Pellerin, L., Magistretti, P. J. Glutamate uptake into astrocytes stimulates aerobic glycolysis: a mechanism coupling neuronal activity to glucose utilization. Proceedings of the National Academy of Sciences of the United States of America. 91, 10625-10629 (1994).
- Cholet, N., et al. Local injection of antisense oligonucleotides targeted to the glial glutamate transporter GLAST decreases the metabolic response to somatosensory activation. Journal of Cerebral Blood Flow & Metabolism. 21, 404-412 (2001).
- Voutsinos-Porche, B., et al. Glial Glutamate Transporters Mediate a Functional Metabolic Crosstalk between Neurons and Astrocytes in the Mouse Developing Cortex. Neuron. 37, 275-286 (2003).
- Zimmer, E. R., et al. [18F]FDG PET signal is driven by astroglial glutamate transport. Nature Neuroscience. 20 (3), 393-395 (2017).
- Haiss, F., et al. Improved in vivo two-photon imaging after blood replacement by perfluorocarbon. The Journal of Physiology. , (2009).
- Mullins, P. G. Towards a theory of functional magnetic resonance spectroscopy (fMRS): A meta-analysis and discussion of using MRS to measure changes in neurotransmitters in real time. Scandinvian Journal of Psychology. 59, 91-103 (2018).
- Wong-Riley, M. T., Welt, C. Histochemical changes in cytochrome oxidase of cortical barrels after vibrissal removal in neonatal and adult mice. Proceedings of the National Academy of Sciences of the United States of America. 77, 2333-2337 (1980).
- Petersen, C. C. The functional organization of the barrel cortex. Neuron. 56, 339-355 (2007).
- Cox, S. B., Woolsey, T. A., Rovainen, C. M. Localized dynamic changes in cortical blood flow with whisker stimulation corresponds to matched vascular and neuronal architecture of rat barrels. Journal of Cerebral Blood Flow & Metabolism. 13, 899-913 (1993).
- Feldmeyer, D. Excitatory neuronal connectivity in the barrel cortex. Frontiers in Neuroanatomy. 6, 24 (2012).
- Boussida, S., Traore, A. S., Durif, F. Mapping of the brain hemodynamic responses to sensorimotor stimulation in a rodent model: A BOLD fMRI study. PLoS One. 12, e0176512 (2017).
- Heinke, W., Koelsch, S. The effects of anesthetics on brain activity and cognitive function. Current Opinion in Anesthesiology. 18, 625-631 (2005).
- Horn, T., Klein, J. Lactate levels in the brain are elevated upon exposure to volatile anesthetics: a microdialysis study. Neurochemistry International. 57, 940-947 (2010).
- Boretius, S., et al. Halogenated volatile anesthetics alter brain metabolism as revealed by proton magnetic resonance spectroscopy of mice in vivo. Neuroimage. 69, 244-255 (2013).
- Sinclair, M. D. A review of the physiological effects of alpha2-agonists related to the clinical use of medetomidine in small animal practice. Canadian Veterinary Journal. 44, 885-897 (2003).
- Weber, R., et al. A fully noninvasive and robust experimental protocol for longitudinal fMRI studies in the rat. Neuroimage. 29, 1303-1310 (2006).
- Hartmann, M. J., Johnson, N. J., Towal, R. B., Assad, C. Mechanical characteristics of rat vibrissae: resonant frequencies and damping in isolated whiskers and in the awake behaving animal. The Journal of Neuroscience. 23, 6510-6519 (2003).
- Prichard, J., et al. Lactate rise detected by 1H NMR in human visual cortex during physiologic stimulation. Proceedings of the National Academy of Sciences of the United States of America. 88, 5829-5831 (1991).
- Sappey-Marinier, D., et al. Effect of photic stimulation on human visual cortex lactate and phosphates using 1H and 31P magnetic resonance spectroscopy. Journal of Cerebral Blood Flow & Metabolism. 12, 584-592 (1992).
- Mazuel, L., et al. A neuronal MCT2 knockdown in the rat somatosensory cortex reduces both the NMR lactate signal and the BOLD response during whisker stimulation. PLoS One. 12, e0174990 (2017).
- Castellano, G., et al. NAA and NAAG variation in neuronal activation during visual stimulation. Brazilian Journal of Medical and Biological Research. 45, 1031-1036 (2012).
- Sarchielli, P., et al. Functional 1H-MRS findings in migraine patients with and without aura assessed interictally. Neuroimage. 24, 1025-1031 (2005).
- Baslow, M. H., Hrabe, J., Guilfoyle, D. N. Dynamic relationship between neurostimulation and N-acetylaspartate metabolism in the human visual cortex: evidence that NAA functions as a molecular water pump during visual stimulation. Journal of Molecular Neuroscience. 32, 235-245 (2007).
- Mangia, S., Tkac, I. Dynamic relationship between neurostimulation and N-acetylaspartate metabolism in the human visual cortex: evidence that NAA functions as a molecular water pump during visual stimulation. Journal of Molecular Neuroscience. 35, 245-248 (2008).
- Baslow, M. H., Hrabal, R., Guilfoyle, D. N. Response of the authors to the Letter by Silvia Mangia and Ivan Tkac. Journal of Molecular Neuroscience. 35, 247-248 (2008).
- Barros, L. F., Weber, B. CrossTalk proposal: an important astrocyte-to-neuron lactate shuttle couples neuronal activity to glucose utilisation in the brain. The Journal of Physiology. 596, 347-350 (2018).
- Bak, L. K., Walls, A. B. CrossTalk opposing view: lack of evidence supporting an astrocyte-to-neuron lactate shuttle coupling neuronal activity to glucose utilisation in the brain. The Journal of Physiology. 596, 351-353 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon