Method Article
Funcionais de ressonância magnética espectroscopia em 7 T no córtex de barril de rato durante a ativação dos whiskers
Neste Artigo
Resumo
Após a verificação pelo sangue-oxigénio-dependente de nível funcional de ressonância magnética (fMRI bold (realce)) que a área correspondente do córtex campo barril somatossensorial (chamada S1BF) corretamente é ativado, o principal objetivo deste estudo é quantificar o teor de lactato flutuações nos cérebros rato ativado por espectroscopia de ressonância magnética de prótons localizados (1H-MRS) em 7 T.
Resumo
Espectroscopia de ressonância magnética nuclear (NMR) oferece a oportunidade de medir metabólito cerebral conteúdo em vivo e de forma não invasiva. Graças a evolução tecnológica ao longo da última década e o aumento da intensidade do campo magnético, é agora possível obter boa resolução espectros na vivo no cérebro de ratos. Neuroenergetics (ou seja, o estudo do metabolismo cerebral) e, especialmente, metabólicas interações entre os diferentes tipos de células têm atraído cada vez mais interesse nos últimos anos. Entre estas interações metabólicas, a existência de um serviço de transporte de lactato entre neurônios e astrócitos ainda é debatida. É, assim, de grande interesse para realizar espectroscopia de ressonância magnética funcional próton (1H-MRS) em um modelo do rato de lactato de monitor e ativação do cérebro. No entanto, o pico de lactato de metila sobrepõe-se picos de ressonância de lipídios e é difícil de quantificar. O protocolo descrito abaixo permite metabólico e lactato flutuações para ser monitorado em uma área do cérebro ativada. Ativação cerebral é obtida pela estimulação dos whiskers e 1H-MRS é executada no córtex ativado barril correspondente, cuja área é detectada usando sangue-oxigénio-dependente de nível ressonância magnética funcional (fMRI bold (realce)). Todas as etapas são descritas: a escolha dos anestésicos, bobinas e sequências, alcançar a estimulação eficiente whisker diretamente no ímã e processamento de dados.
Introdução
O cérebro possui mecanismos intrínsecos que permitem a regulação do seu principal substrato (ou seja, glicose), tanto por sua contribuição e sua utilização, dependendo de variações na atividade cerebral local. Embora a glicose é o substrato principal energia para o cérebro, experimentos realizados nos últimos anos têm mostrado que lactato, que é produzido pelos astrócitos, poderia ser um substrato de energia eficiente para os neurônios. Isto levanta a hipótese de uma nave de lactato entre astrócitos e neurônios1. Conhecido como ANLS, para transporte de lactato neurônio astrocyte2, a teoria é ainda altamente controversa, mas levou a proposta a glicose, ao invés de ir diretamente para os neurônios, podem entrar os astrócitos, onde é metabolizado em lactato, um metabólito que é , em seguida, transferido para os neurônios, que usá-lo como substrato de energia eficiente. Se um serviço de transporte existe na vivo, ele teria várias consequências importantes, tanto para a compreensão das técnicas básicas em funcionais de imagem cerebral (tomografia por emissão de pósitrons [PET]) e para decifrar as alterações metabólicas observadas em patologias do cérebro.
Para estudar o metabolismo cerebral e, particularmente, metabólicas interações entre neurônios e astrócitos, quatro principais técnicas estão disponíveis (não incluindo micro-/ nanosensors): autoradiografia, PET, microscopia confocal fluorescente de dois fotões e MRS. Autoradiografia foi um dos primeiros métodos propostos e fornece imagens da acumulação regional de radioactivo 14C-2-deoxyglucose em fatias do cérebro, enquanto PET rendimentos na vivo imagens de captação regional de radioativo 18 F-deoxyglucose. Ambos têm a desvantagem de usar as moléculas ao produzir imagens de baixa-resolução. Microscopia de dois fotões fornece celular resolução de sondas fluorescentes, mas espalhamento de luz por tecido limita a profundidade de imagem. Estas três técnicas foram usadas anteriormente para estudar neuroenergetics em roedores durante estimulação Suiça3,4,5,de6. Na vivo MRS tem a dupla vantagem de ser não-invasiva e nonradioactive, e qualquer estrutura cerebral pode ser explorada. Além disso, a MRS pode ser executada durante a ativação neuronal, uma técnica chamada MRS funcional (fMRS), que tem sido desenvolvido muito recentemente em roedores7. Portanto, propõe-se um protocolo para monitorar o metabolismo do cérebro durante a atividade cerebral por 1H-MRS na vivo e de forma não invasiva. O procedimento é descrito em ratos adultos saudáveis com ativação cerebral obtida por uma estimulação de whisker ar-sopro executada diretamente em uma imagem de ressonância magnética (RM) T 7, mas pode ser adaptado em animais geneticamente modificados, assim como em qualquer condição patológica .
Protocolo
Todos os procedimentos de animais foram conduzidos em conformidade com as diretrizes de Experimentação Animal da Directiva do Conselho das Comunidades Europeias de 24 de novembro de 1986 (86/609/CEE). O protocolo conheceu as diretrizes éticas do Ministério francês de agricultura e florestas e foi aprovado pelas comissões de ética locais (Comitê d 'éthique pour l'' expérimentation Animale Bordeaux n ° 50112090-A).
Nota: Durante as medições do senhor, um nível adequado de anestesia e monitorização fisiológica (temperatura corporal, frequência respiratória) são requisitos indispensáveis.
1. os animais
- Use ratos Wistar machos, pesando entre 350 e 450 g.
- Mantê-los em um 12:12 h luz: escuro ciclo e providenciar comida e água ad libitum.
2. anestesia
- Preparar o equipamento necessário para anestesia (figura 1A, B, consulte Tabela de materiais): uma seringa de 5 mL contendo medetomidina em solução salina fisiológica (240 µ g/kg/h, com uma taxa de perfusão de 20 µ l/min), contendo uma seringa de 0,5 mL atipamezole (20 μL, em 0,5 mL de solução salina) e pomada.
Nota: Manter todos os equipamentos sob o exaustor, exceto a seringa de 5 mL contendo medetomidina, que é colocada na bomba de seringa perto o ímã para anestesia durante aquisições do senhor. - Colocar o rato na câmara de indução, iniciar a anestesia, entregando a 4% de isoflurano e ajustar a taxa de fluxo de oxigênio a 1,5 L/min.
- Avalie a profundidade da anestesia, avaliando a retirada da pata reflexos.
- Quando o rato não responde à estimulação, tirá-lo da caixa de anestesia, colocá-lo no banco com seu nariz da máscara de isoflurano e manter anestesia entregando 2,5% em oxigênio a 1,5 L/min.
- Suavemente a cauda de massagem e coloque o torniquete (Figura 1).
Nota: A massagem pode ser executada em água morna, com uma temperatura entre 38 e 42 ° C, para obter melhor vasodilatação das veias. - Inserir o cateter intravenoso periférico (22 G), anteriormente heparinizado, na veia de cauda esquerda ou direita. Observe que um retorno venoso é observado (uma gota de sangue é visível na parte distal da agulha) quando o cateter está correctamente inserido (Figura 1).
- Apague quaisquer bolhas de ar presentes no volume de espaço morto cateter utilizando a seringa de 2 mL contendo heparina e soro fisiológico.
- Aplicar a pomada e preparar a seringa contendo atipamezole (17 µ g/mL) para despertar o rato no final do experimento.
3. rato colocação em ímã para estimulação dos whiskers
- Coloque um sensor de respiração na cama ímã e depois transferir o rato do banco para a cama do ímã. Coloque-a na posição de bruços com seu nariz da máscara de isoflurano, com o sensor de respiração, localizado entre as costelas e a cama do ímã.
Nota: Todos os equipamentos que entra no quarto de MRI devem ser MRI-seguro. - Diminuir o isoflurano (de 4% a 1,5%-2%) durante a colocação do rato e alternar a anestesia para medetomidina no final deste procedimento. Certifique-se de que os bigodes são livres, ter cortado a borda direita na frente do rato cama MRI previamente para permitir o movimento dos bigodes.
- Mantenha o rato em posição com fita e monitorar sua respiração, que deve estar entre 60 e 80 respirações por minuto.
- Fazer uma vela que intercepta bigodes bem a fita de papel (Figura 2). Alinhe o tubo de saída flexível do sistema de sopro de ar ao longo do rato cama de MRI para que a parte, saindo do tubo perpendicular e em cerca de 1,5 cm da vela. Corrigi-lo com fita de papel.
4. whisker estimulação
- Conecte a tubulação de entrada flexível de uma fonte de ar comprimido (1 bar) para uma entrada de válvula de controle do solenoide e o tubo de saída para a saída de válvula de controle do solenoide (Figura 3). Certifique-se de que a válvula de controle do solenoide permanece fora da sala de ímã.
- Ligue o dispositivo de pulsação na válvula de solenoide e do ímã usando a lógica transistor-transistor (TTL)-port. Configurá-lo para que a frequência de pulsação = 8 Hz, tempo de pulsante = 20 s e o tempo de descanso = 10 s.
Nota: Estes parâmetros, visualizados no cristal líquido pequeno visor (LCD), são ajustável através os três potenciômetros analógicos dedicados. O dispositivo eletrônico de pulsação, que controla o paradigma, deve ser composto de componentes eletrônicos de alta qualidade para evitar qualquer desvio em parâmetros de tempo (de pós-processamento correto).
5. BOLD fMRI aquisição
- Coloque o cérebro de rato, para que fique em uma posição ereta e use as barras de orelha para mantê-la. Coloque a bobina de matriz de volume acima da cabeça do rato (Figura 4A) e fixe-o com a fita. Verificar que a vela está se movendo corretamente (movimento ântero-posterior, sem rotação e sem atrito da vela) quando o sistema de ar-sopro é ativada em; em seguida, desligá-lo.
- Insira a bobina e a cama no centro do ímã. Verifique se a vela está ainda em movimento corretamente uma vez que a cama está no interior do íman, quando o sistema de ar-sopro é em; em seguida, desligá-lo. Mudar completamente de isoflurano a medetomidina (taxa de perfusão: 20 µ l/min).
- Verifique que o rato está bem localizado usando uma sequência de localização (TE = 2,5 ms; TR = 100 ms; média = 1; repetição = 1; fatia = 1 mm; tamanho da imagem = 256 x 256; campo de visão (FOV) = 50 x 50 mm; tempo de varredura = 12 s 800 ms). Arraste a guia sequência de localizador para o nome de instrução e clique em continuar.
- Arraste a guia sequência de T2_Star_FID_EPI para o nome da instrução, centro o FOV no meio do cérebro e clique na guia de plataforma de ajuste para abrir a instrução de varredura editado. Gravar o mapa B0 e avançar para um calço de varredura.
Nota: Para um mapa de0 B, use os seguintes parâmetros: primeira vez Eco = 1,65 ms; TR = 20 ms, médias = 1; ângulo da aleta = 30°; espaçamento de eco = 3,805 ms; fatia = 58 mm; tamanho da imagem = 64 x 64 x 64; FOV = 58 x 58 x 58 mm; tempo de varredura = 1 m 24 s 920 MS. para digitalizar shim, use os seguintes parâmetros: excitação seletiva voxel = pulso gaussiano de vapor; TE = 5 ms; tempo de mistura = 10 ms; duração de aquisição = 204,8 ms; largura de banda = 10.000 Hz; tempo de interrupção = 50 μs). - Iniciar a sequência de Star_FID_EPI T2 (TE = 16,096 ms; TR = 500 ms; média = 1; repetição = 600; fatia = 1 mm; quatro fatias consecutivas; tamanho da imagem = 128 x 128; FOV = 20 x 20 mm; largura de banda = 333.333,3 Hz; tempo de varredura = 5 min 00 s).
Nota: Devido a porta TTL, um sinal do disparador externo iniciará o sistema de ar-puff ao mesmo tempo. O paradigma = [20 s ativação + 10 resto s] x 10, para a duração total dos 600 exames, 500 ms por varredura. As fatias são centradas no meio da área de campo de barril. - Adquira outra sequência de localização (igual o um passo descrito em 5.3) para comparar com o primeiro e verifique se o rato foi movido durante a sequência de T2_Star_FID_EPI.
- Trazer a cama para a posição inicial, retire a bobina de matriz de volume e conectar a bobina de superfície.
6. processamento de negrito
- Abra o arquivo Star_FID_EPI T2 e ler a imagem de Star_FID_EPI T2 na Exibição de imagens. Abra a janela de start-up do controlador funcional, chamada FunController.
- Nesta guia de processamento , selecione a janela da imagem latente funcional e definir o protocolo de estimulação (duração e alternância de On/Off períodos, correspondentes ao paradigma usado).
- Selecione a janela de protocolo (dataset com 600 frames) e inserir o valor de 40 na aba No período e 20 na guia período clique na guia Atribuição de inverter e arraste o controle deslizante de Estados de estimulação para a esquerda para selecionar o valor 1.
- Na janela de pré-processamento, clique no filtro de mediana no avião para pré-processamento e no filtro de mediana (2D, 3D) para pós-processamento.
- Clique na aba executar e arraste o cursor para ajustar a tabela de pesquisa de sobreposição. Visualize a área cerebral ativada (Figura 4B).
7. protão MRS aquisições
- Para posicionar corretamente a bobina de superfície, modifica a posição da cabeça do rato. Gire a cabeça (cerca de 30° no sentido horário) para que a bobina de superfície (Figura 5A) pode ser colocada logo acima do córtex esquerdo barril sendo horizontal e localizado no centro de ímã, quando no interior do íman.
- Coloque a bobina de superfície, corrigi-lo em cérebro de ratos utilizando fita (Figura 5B) e verificar que a vela está se movendo corretamente (movimento ântero-posterior, sem rotação e sem atrito da vela) quando o sistema de ar-sopro é ativada em; em seguida, desligue o interruptor principal.
- Verifique se a vela está se movendo corretamente uma vez que a cama está no interior do íman quando o sistema de ar-sopro é em. Em seguida, desligá-lo.
- Verifique se que o rato está posicionado corretamente, usando uma sequência de localização. Definir parâmetros da seguinte forma: TE = 2,5 ms; TR = 100 ms; média = 1; repetição = 1; fatia = 1 mm; tamanho da imagem = 256 x 256; FOV = 50 x 50 mm; tempo de varredura = 12 s 800 ms.
- Arraste a guia sequência de localizador para a janela de nome de instrução e clique em continuar para executar o programa de digitalização.
- Quando a localização do cérebro está correta, arraste a aba de sequência de T2_TurboRARE na janela nome da instrução e clique em continuar para executar o programa de digitalização. Estas imagens anatômicas, juntamente com a aquisição de BOLD fMRI anterior, permitirá a localização correta do voxel no S1BF para a Sra.
Nota: Os parâmetros de T2_TurboRARE são 14 fatias, 2 mm por fatia, FOV = 2.5 x 2.5 cm, TE = 100 ms, TR = 5.000 ms, matriz = 128 x 128, tempo de sequência = 2 min 40 s. - Arraste a guia sequência LASER para a janela de nome de instrução , coloque o voxel (2 mm de altura, 2,5 mm de comprimento, 3 mm de profundidade) no centro da área de S1BF.
- Use um atlas de cérebro de rato e o reforço de fMRI bold (realce) para localizar a zona nas imagens T2 (Figura 6). Clique na guia de plataforma de ajuste para abrir a instrução de varredura editado. Clique na guia Wobble e alterar a impedância (carregamento electrónico) da bobina de recebimento ligeiramente para ajustá-lo. Clique na guia aplicar quando o ajuste é concluído para fechar o editor de instrução e aplicar as alterações na instrução editada.
- Gravar o mapa B0 e proceder a varredura shim e, em seguida, executar uma correção local.
Nota: Para ver o mapa de0 B, use os seguintes parâmetros: primeira vez Eco = 1,65 ms; TR = 20 ms, médias = 1; ângulo da aleta = 30°; espaçamento de eco = 3,805 ms; fatia = 58 mm; tamanho da imagem = 64 x 64 x 64; FOV = 58 x 58 x 58 mm; tempo de varredura = 1 m 24 s 920 MS. para a correção de varredura, use os seguintes parâmetros: voxel excitação seletiva vapor Gaussian o pulso; TE = 5 ms; tempo de mistura = 10 ms; duração de aquisição = 204,8 ms; largura de banda = 10.000 Hz; tempo de interrupção = 50 μs. Para a correção de local, use os seguintes parâmetros: supressão de água, VAPOR de duração de aquisição = 1.363,15 ms; pontos = 4.096; largura de banda em Hz = 3.004,81 Hz; largura de banda em ppm = 10 ppm; tempo de interrupção = 166,40 μs; resolução espectral = 0,37 Hz/pontos. Os parâmetros do LASER são: tempo de eco = ms 19,26; TR = 2.500 ms; média = 128 ou 32; tempo de varredura = 5 min 20 s ou 1 min 20 s; pontos de aquisição = 4.096. - Execute 1H-Sra.
- Iniciar a 1H-MRS aquisição primeiro durante um período de descanso (varreduras LASER 4 x 32 + 128 LASER scans; 2.500 ms por varredura).
- Adquira outra sequência de localização (igual o um passo descrito em 5.3) para comparar com o primeiro gravado e certifique-se de que o rato não mudou durante a aquisição de LASER.
- Executar 1H-MRS durante a ativação dos whiskers, usando a sequência LASER (varreduras LASER 4 x 32 + 128 LASER scans; 2.500 ms por varredura) com o sistema de ar-sopro (paradigma = 20 s de ativação e 10 s de descanso).
- Mais uma vez, execute uma sequência de localização para verificar se o rato foi movido.
Nota: O número de varreduras e períodos de repouso/ativado pode ser adaptado e modificado, mas certifique-se sempre que o rato não está se movendo, regularmente, realizando uma sequência de localização.
- Trazer a cama para a posição inicial, retire a bobina de superfície e mover o rato de volta para o banco. Atipamezole Injete uma prega de pele em volta do rato para inverter a anestesia e despertá-lo.
8. protão MRS processamento
- Abra o software LCModel e clique na guia apropriado para selecionar o tipo de dados corretos (arquivo de Decaimento livre de indução ) e escolher o arquivo certo. Clique na guia Okey , quando isso é feito.
- Otimize os parâmetros de controle de quantificação passo a passo.
- Na seção de título , manualmente Insira um título e definir um intervalo adequado ppm (por exemplo, 0,2 a 4.0 ppm) digitando manualmente o valor necessário nos respectivos campos.
- Na seção de arquivo de base , selecionar e baixar o arquivo necessário para ajustar a linha de base da macromolécula corretamente (pode ser fornecida pelo provedor do software).
- Definir e carregar os parâmetros de controle de entrada. Preparar a salvar processo de antemão todos os tipos de arquivo útil (tabela = quadros compacto; PS = necessária saída PostScript; CSV = formato para planilhas; COORD = coordenadas para parcelas). Clique na guia RunLCModel para iniciar a quantificação de LCModel.
- Defina metabolitos selecionados para gerar estatísticas.
Nota: LCModel fornece quantificação metabólito e estimativas de erros por um valor denominado limite inferior de Cramér-Rao (nenhuma). Um valor com uma casa < 15 é considerado como uma quantificação ideal. Uma casa > 25 indica um valor não-confiável.
Resultados
Este protocolo permite a quantificação das flutuações do metabólito durante a ativação cerebral, que é obtida pela estimulação dos whiskers certo diretamente no imã.
Neste estudo, o objetivo geral de fMRI bold (realce) foi verificar que a estimulação dos whiskers era eficiente, para visualizar a área de S1BF registrada e para localizar corretamente o voxel para 1H-fMRS. O dispositivo construído para ativação whisker é eficiente. Com efeito, quando certo bigodes foram estimulados usando o sistema caseiro de sopro de ar, um sinal positivo de bold (realce) foi detectado no córtex esquerdo barril (Figura 4B), também chamado o S1BF, para o campo de barril somatossensorial (n = 8). Um reforço de sinal positivo foi detectado no córtex esquerdo barril em oito de oito ratos, Considerando que apenas o fundo foi detectado em hemisférios. Quando fMRI bold (realce) foi realizada sem estimulação dos whiskers, sem reforço de sinal foi observado na esquerda ou na direita S1BF.
Em uma comparação entre imagens anatômicas do senhor e cérebro de rato a atlas esquemas8, a área do cérebro ativada visualizada pela BOLD fMRI permite o voxel ser colocado na área de S1BF, que é ativada durante a estimulação dos whiskers. Este voxel situa-se nos três slides consecutivos (1 mm de espessura), desde o córtex do barril é de 3 mm de comprimento. Quando o slide do cérebro é praticamente separado em quatro trimestres, o voxel situa-se na superior esquerda quarto em um ângulo de aproximadamente 45° (Figura 6).
Quando o paradigma para a estimulação dos whiskers foi ativado, um aumento no teor de lactato foi observado na S1BF esquerda (Figura 6, espectros típicos obtidos em um rato). Para visualizar melhor as flutuações metabólicas entre descanso e registrados períodos, uma subtração espectral foi realizada (Figura 6). Partir deste espectro subtraído, o aumento no conteúdo de lactato com ativação cerebral foi visualizado muito mais facilmente, enquanto nesse rato, o sinal de N-acetylaspartate (NAA) diminuiu ligeiramente. Também observou-se aumento de lactato durante a estimulação neuronal sobre a deconvolução espectral (Figura 7AB). Enquanto que o pico de lactato dificilmente foi detectado no espectro na vivo em repouso, LCModel era capaz de quantificá-lo (Figura 7A) com precisão e bons valores de nenhuma. Com efeito, fora 23 ratos, apenas um espectro tinha um valor de casa para quantificação de lactato igual a 24. Não eram > 25. Para todos os outros espectros, os valores variaram entre 3 e 19.
As variações no conteúdo de lactato em todos os 23 ratos são apresentadas na Figura 8. Fora 23 ratos, foi observada uma diminuição no conteúdo de lactato apenas em um rato. Houve diferença estatisticamente significativa em lactato de conteúdo entre descansando e registrados períodos (0.132 ± ± 0,012 e 0.163 0.011, respectivamente, os valores familiares para PCr + Cr conteúdo, emparelhado t-teste, p = 0,0005 [paramétrico, bicaudal] n = 23). Portanto, um aumento de 7,8% ± 31,6% no teor de lactato foi medido durante a estimulação neuronal.
Um ligeiro decréscimo no conteúdo NAA pode ser observado na Figura 6, que representa o típicos espectros obtidos em um animal. No entanto, esta variação de NAA não foi significativa (foi medido um decréscimo de 1,2% ± 1,2%, n = 23).
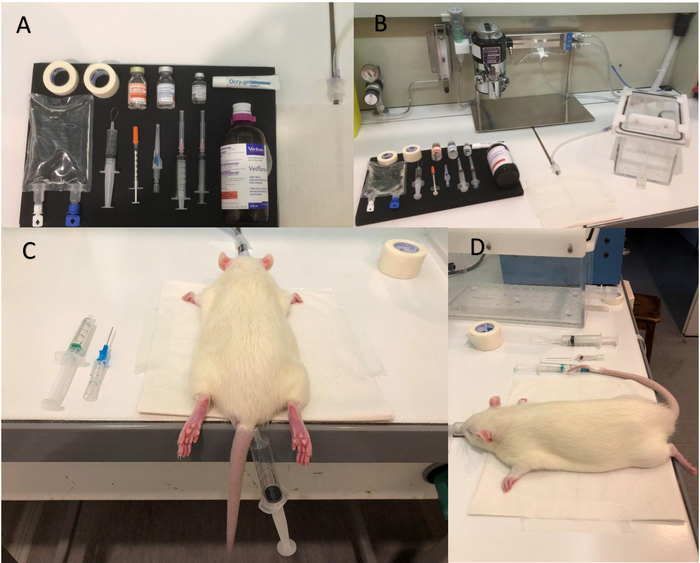
Figura 1: equipamentos e passos para a anestesia. Imagens do (A) do equipamento de ser preparados antes de iniciar a anestesia. Isoflurano (B) câmara da bomba e indução. (C) colocação de torniquete. (D) imagem mostra que o cateter foi inserido corretamente; Observe a gota de sangue na agulha do cateter, que é um sinal positivo de um local correto na veia. Clique aqui para ver uma versão maior desta figura.

Figura 2: estimulação dos whiskers. Tudo bem bigodes estão presos em uma vela feita com fita de papel. A vela permite bigodes bem ser estimulado ao mesmo tempo com o sistema de sopro de ar e, portanto, maximiza a ativação neuronal do córtex de barril. A saída do sistema de sopro de ar (tubo preto) deve estar localizada em torno de 1,5 cm e perpendicularmente a vela. Cheque na frente do ímã para certificar-se a vela está se movendo corretamente ao ligar o sistema de ar-sopro. A vela deve mover a 8 Hz no sentido ântero-posterior (sem rotação). Clique aqui para ver uma versão maior desta figura.

Figura 3: sistema de sopro de ar para a estimulação dos whiskers. Tubo flexível (A), A liga o ar comprimido para (B), a válvula de controle do solenoide. Um segundo tubo flexível traz ar pulsado da saída de válvula de controle do solenoide para a vela. A válvula de controle do solenoide é ligada ao dispositivo de pulsação, que controla o paradigma. Clique aqui para ver uma versão maior desta figura.

Figura 4: BOLD fMRI. (A) Volume de matriz colocação da bobina. A cabeça de rato é na posição horizontal e bloqueado por barras de orelha. Verifique se a vela está movendo-se livremente e não é bloqueada pela bobina ou na cama de MRI. (B), um típico bold (realce) sinal no córtex ativado barril à esquerda (seta vermelha). Nenhum sinal for detectado no hemisfério direito contralateral (seta azul). O limiar é fixado em 76,5% do máximo de valor de intensidade. Clique aqui para ver uma versão maior desta figura.

Figura 5: bobina de superfície. Imagens do (A) da superfície da bobina utilizada neste estudo. (B) colocação de bobina de superfície. A cabeça de rato deve ser girada ligeiramente para que o córtex esquerdo barril e, portanto, a bobina de superfície estão localizados no centro da cama MRI (a cabeça é virada em um ângulo de cerca de 30°, um bom compromisso entre o local correto do córtex esquerdo barril para o surfa bobina de CE e livre circulação da vela dos bigodes certo, que não devem ser bloqueados ao lado da cama de MRI). Clique aqui para ver uma versão maior desta figura.
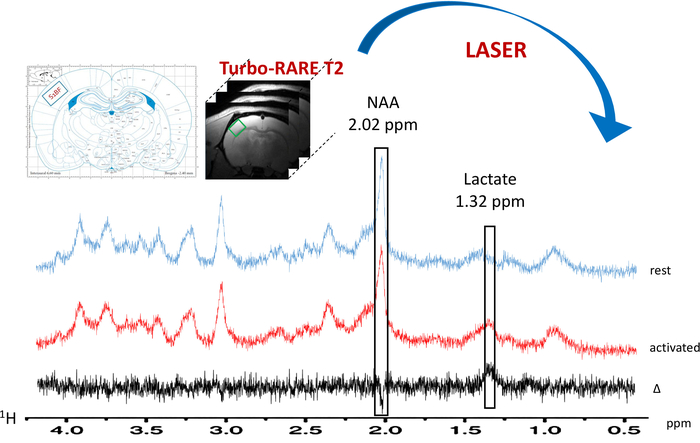
Figura 6: típico localizado 1H-MRS em repouso (espectro azul) e durante a ativação dos whiskers (espectro vermelho). O voxel (quadrado verde) situa-se no S1BF esquerdo nas imagens anatômicas T2_TurboRARE usando esquemas de atlas de cérebro de rato e reforço de sinal em imagens BOLD fMRI. A subtração espectral é plotada em preto. Lactato e picos de N-acetylaspartate (NAA) são indicados em 1,32 e 2.02 ppm, respectivamente. Clique aqui para ver uma versão maior desta figura.
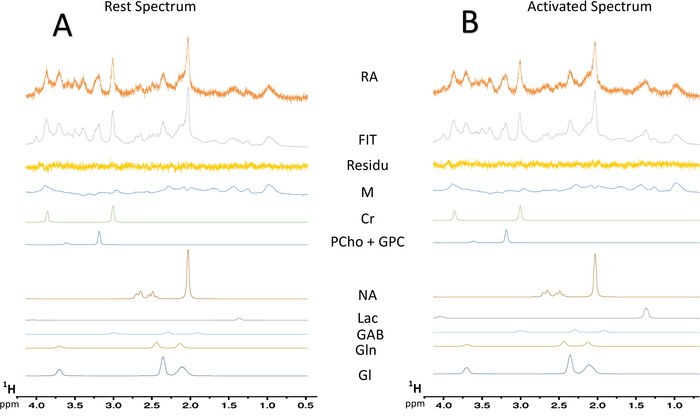
Figura 7: deconvolução espectral típica dos espectros de MRS. (A) deconvolução de um espectro de resto 128-scan. (B) deconvolução de um 128-scan ativado espectro. Resíduo, subtração entre o espectro experimental (dados brutos) e o ajuste de LCModel; MM = macromolécula; CR = creatina + fosfocreatina; PCho + GPC = fosfocolina + glicerofosfocolina; NAA = N-acetylaspartate; ALC = lactato; GABA = ácido γ-aminobutírico; GLN = glutamina; Glu = glutamato. Clique aqui para ver uma versão maior desta figura.

Figura 8: variações em lactato de conteúdo durante estimulação cerebral. Ponto azul: lactato conteúdo em repouso, determinado pelo LCModel e em relação a creatina + conteúdo de fosfocreatina. Ponto vermelho: conteúdo de lactato durante a estimulação dos whiskers, determinada pelo LCModel e em relação a creatina + conteúdo de fosfocreatina. A diferença entre ativado e descansar, p = 0,0005, emparelhado t-teste (paramétrico, bicaudal), n = 23. Clique aqui para ver uma versão maior desta figura.
Discussão
O córtex de tambor, também chamado S1BF para o córtex somatossensorial ou barril de campo, é uma região dentro da camada cortical IV que pode ser observada usando o citocromo c oxidase coloração9, e sua organização é bem conhecida, uma vez que foi amplamente descrito 10,11. Um vibrissa é conectado a um barril, no qual cerca de 19.000 neurônios organizam-se em uma coluna de12. O caminho do córtex whisker-para-barril tem várias vantagens. Primeiro, ele poderá ser ativado no interior do íman, usando um sistema de ar-sopro compatível com MRI, que pode ser facilmente feito em casa (para garantir que, na maior parte da área de S1BF, que corresponde aproximadamente ao tamanho do voxel na qual MRS é realizada, todos os bigodes são espremidos em uma vela, que permite a estimulação de um máximo de vibrissa). Em segundo lugar, direito ativação whisker leva à ativação do córtex esquerdo barril, e nesta área do cérebro está localizada no córtex somatossensorial, que permite o uso de uma bobina de superfície elevado-sensível. Em terceiro lugar, esse método de ativação do córtex somatossensorial é não-invasivo em relação à estimulação elétrica de pata, o último tendo a desvantagem de estimular outras estruturas do cérebro, incluindo alguns no hemisfério direito13. Portanto, o protocolo usado aqui é o mais adequado realizar um in vivo não-invasiva e longitudinal estudo do metabolismo cerebral sob ativação cerebral.
A escolha do anestésico é crucial, como muitos dos anestésicos induzem mudanças no acoplamento neurovascular, metabolismo cerebral e/ou atividade de cérebro14,15. Por exemplo, isoflurano, a anestesia mais comum usado para RM, leva a um três-sêxtupla aumento cerebral lactato conteúdo15,16 e, portanto, não deve ser usada em estudos metabólicos do cérebro. Medetomidina é um agonista α2-adrenoreceptor, que induz confiança sedação, analgesia, relaxamento muscular e anxiolysis17. Estes efeitos podem ser revertidos rapidamente usando atipamezole, um antagonista α2. Medetomidina é o melhor candidato para realizar estudos funcionais em roedores18 uma vez que tem um impacto muito reduzido sobre o sinal bold (realce) e as modificações menores em conteúdo de metabólito do cérebro.
Também é importante seguir o paradigma de ativação dos whiskers corretamente. Desde aquisições NMR duram vários minutos, o uso de períodos sucessivos de ativação/descanso é essencial para limitar a dessensibilização de neurônios na área do cérebro ativada. Os parâmetros deste paradigma (20 s de ativação seguido por um período de repouso de 10 s) foram escolhidos para obter o maior sinal BOLD fMRI no córtex barril correspondente. Muito cuidado deve ser para respeitar estas janelas de tempo, uma vez que é crucial determinar o período de descanso/ativado para tratamento bold (realce), mesmo se é controlado por porta TTL. Para obter um elevado nível de ativação do córtex de barril, a vela que grupos os bigodes juntos também é importante uma vez que permite a maior parte da área de S1BF a ser estimulado. Muito cuidado deve ser para colocar o tubo de ar de saída na frente esta vela para que pode mover-se em um avião ântero-posterior. A frequência deve ser cuidadosamente calibrado desde que tem sido demonstrado que os neurônios no córtex de barril são ativados quando a frequência de estimulação whisker é entre 5 e 15 Hz19. Usar uma frequência inferior ou superior, não conduzirá a ativação da área S1BF.
O protocolo utilizado neste estudo torna possível comparar espectros adquiridos na mesma área do cérebro em repouso e durante a estimulação do cérebro e, portanto monitorar metabólica alterações ativação vinculada a cerebral. É importante executar uma sequência de localização no início e no final do protocolo de espectroscopia NMR, para garantir que o animal não mudou e que as diferenças no conteúdo metabólico medido entre os Estados de repouso e ativados são devido ao cérebro estimulação e não a artefatos de movimento.
Usando o protocolo descrito neste documento, um aumento no teor de lactato foi medido entre repouso e ativado períodos. Aumento de lactato usando espectroscopia na vivo NMR durante a ativação do cérebro foi observado pela primeira vez em seres humanos no início da década de 199020,21. No entanto, a maioria das medições foram realizadas em seres humanos, ao invés de roedores, em que a relação sinal-ruído é muito menor. No rato, quantificação ex vivo NMR de lactato durante a ativação do cérebro de rato foi realizada por Mazuel et al . 22, que observaram um aumento no cérebro de conteúdo com ativação neuronal de lactato. Os resultados aqui apresentados mostram que lactato foi aumentado durante a ativação dos whiskers. No entanto, desde que localizadas MRS não permite resolução de celular, é ainda desconhecido de lactato qual compartimento celular está chegando (neurônios ou astrócitos). Para ir mais longe na compreensão das trocas metabólicas cerebrais, tais como o ainda debatida ANLSH (hipótese de transporte de lactato astrocyte-neurônio), este protocolo deve ser aplicado para animais geneticamente modificados para os componentes chaves neste serviço de transporte, tais como o monocarboxylate transportes.
No estudo aqui descrito, não observou-se nenhuma diferença estatisticamente significante no conteúdo NAA. Uma diminuição no conteúdo NAA durante estimulação visual foi anteriormente encontrada em seres humanos23,24,25, mas não confirmada por Mangia e Tkac26. No estudo atual, observamos um aumento no NAA conteúdo durante a ativação cerebral em 50% dos ratos e uma diminuição na outra metade. Portanto, NAA deve ser evitado como a referência interna para quantificação durante funcional não Sra., outra variação no conteúdo de metabólito foi detectada.
Ambos lactato e variações de NAA durante a ativação neuronal levou a controvérsias23,26,,27,28,29. Para continuar a nossa compreensão destas flutuações metabólicas ligadas à atividade do cérebro, seria interessante aplicar este protocolo para animais transgénicos. Isto iria fornecer mais informações sobre o processo subjacente. Em geral, localizadas 1H-MRS durante uma tarefa, ou funcional MRS29, é uma técnica emergente em roedores, relevantes para o estudo das mudanças dinâmicas regionais em metabólitos, em cérebros normais ou patológicos.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este trabalho foi financiado pela subvenção LabEx trilha, referência ANR-10-LABX-57 e um franco-suíço ANR-FNS concede referência ANR-15-CE37-0012. Os autores Aurélien Trotier agradecer seu suporte técnico.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.5 mL syringe with needle | Becton, Dickinson and Company, USA | 2020-10 | 0.33 mm (29 G) x 12.7 mm |
| 1H spectroscopy surface coil | Bruker, Ettlingen, Germany | T116344 | |
| 7T Bruker Biospec system | Bruker, Ettlingen, Germany | 70/20 USR | |
| Arduino Uno based pulsing device | custom made | ||
| Atipamezole | Vétoquinol, S.A., France | V8335602 | Antisedan, 4.28 mg |
| Breathing mask | custom made | ||
| Eye ointment | TVM laboratoire, France | 40365 | Ocry gel 10 g |
| Induction chamber | custom made | 30x17x15 cm | |
| Inlet flexible pipe | Gardena, Germany | 1348-20 | 4.6-mm diameter, 3m long |
| Isoflurane pump, Model 100 series vaporizer, classic T3 | Surgivet, Harvard Apparatus | WWV90TT | from OH 43017, U.S.A |
| Isoflurane, liquid for inhalation | Vertflurane, Virbac, France | QN01AB06 | 1000 mg/mL |
| KD Scientific syringe pump | KD sientific, Holliston, USA | Legato 110 | |
| LCModel software | LCModel Inc., Ontario, Canada | 6.2 | |
| Medetomidine hydrochloride | Vétoquinol, S.A., France | QN05CM91 | Domitor, 1 mg/mL |
| Micropore roll of adhesive plaster | 3M micropore, Minnesota, United States | MI912 | |
| Micropore roll of adhesive plaster | 3M micropore, Minnesota, United States | MI925 | |
| Monitoring system of physiologic parameter | SA Instruments, Inc, Stony Brook, NY, USA | Model 1025 | |
| NaCl | Fresenius Kabi, Germany | B05XA03 | 0.9 % 250 mL |
| Outlet flexible pipe | Gardena, Germany | 1348-20 | 4.6-mm diameter, 4m long |
| Paravision software | Bruker, Ettlingen, Germany | 6.0.1 | |
| Peripheral intravenous catheter | Terumo, Shibuya, Tokyo, Japon | SP500930S | 22 G x 1", 0.85x25 mm, 35 mL/min |
| Rat head coil | Bruker, Ettlingen, Germany | ||
| Sodic heparin, injectable solution | Choai, Sanofi, Paris, France | B01AB01 | 5000 IU/mL |
| Solenoid control valves, plunger valve 2/2 way direct-acting | Burkert, Germany | 3099939 | Model type 6013 |
| Terumo 2 ml syringe | Terumo, Shibuya, Tokyo, Japon | SY243 | with 21 g x 5/8" needle |
| Terumo 5 mL syringe | Terumo, Shibuya, Tokyo, Japon | 05SE1 | |
| Wistar RJ-Han rats | Janvier Laboratories, France |
Referências
- Pellerin, L., et al. Activity-dependent regulation of energy metabolism by astrocytes: an update. Glia. 55, 1251-1262 (2007).
- Pellerin, L., Magistretti, P. J. Glutamate uptake into astrocytes stimulates aerobic glycolysis: a mechanism coupling neuronal activity to glucose utilization. Proceedings of the National Academy of Sciences of the United States of America. 91, 10625-10629 (1994).
- Cholet, N., et al. Local injection of antisense oligonucleotides targeted to the glial glutamate transporter GLAST decreases the metabolic response to somatosensory activation. Journal of Cerebral Blood Flow & Metabolism. 21, 404-412 (2001).
- Voutsinos-Porche, B., et al. Glial Glutamate Transporters Mediate a Functional Metabolic Crosstalk between Neurons and Astrocytes in the Mouse Developing Cortex. Neuron. 37, 275-286 (2003).
- Zimmer, E. R., et al. [18F]FDG PET signal is driven by astroglial glutamate transport. Nature Neuroscience. 20 (3), 393-395 (2017).
- Haiss, F., et al. Improved in vivo two-photon imaging after blood replacement by perfluorocarbon. The Journal of Physiology. , (2009).
- Mullins, P. G. Towards a theory of functional magnetic resonance spectroscopy (fMRS): A meta-analysis and discussion of using MRS to measure changes in neurotransmitters in real time. Scandinvian Journal of Psychology. 59, 91-103 (2018).
- Wong-Riley, M. T., Welt, C. Histochemical changes in cytochrome oxidase of cortical barrels after vibrissal removal in neonatal and adult mice. Proceedings of the National Academy of Sciences of the United States of America. 77, 2333-2337 (1980).
- Petersen, C. C. The functional organization of the barrel cortex. Neuron. 56, 339-355 (2007).
- Cox, S. B., Woolsey, T. A., Rovainen, C. M. Localized dynamic changes in cortical blood flow with whisker stimulation corresponds to matched vascular and neuronal architecture of rat barrels. Journal of Cerebral Blood Flow & Metabolism. 13, 899-913 (1993).
- Feldmeyer, D. Excitatory neuronal connectivity in the barrel cortex. Frontiers in Neuroanatomy. 6, 24 (2012).
- Boussida, S., Traore, A. S., Durif, F. Mapping of the brain hemodynamic responses to sensorimotor stimulation in a rodent model: A BOLD fMRI study. PLoS One. 12, e0176512 (2017).
- Heinke, W., Koelsch, S. The effects of anesthetics on brain activity and cognitive function. Current Opinion in Anesthesiology. 18, 625-631 (2005).
- Horn, T., Klein, J. Lactate levels in the brain are elevated upon exposure to volatile anesthetics: a microdialysis study. Neurochemistry International. 57, 940-947 (2010).
- Boretius, S., et al. Halogenated volatile anesthetics alter brain metabolism as revealed by proton magnetic resonance spectroscopy of mice in vivo. Neuroimage. 69, 244-255 (2013).
- Sinclair, M. D. A review of the physiological effects of alpha2-agonists related to the clinical use of medetomidine in small animal practice. Canadian Veterinary Journal. 44, 885-897 (2003).
- Weber, R., et al. A fully noninvasive and robust experimental protocol for longitudinal fMRI studies in the rat. Neuroimage. 29, 1303-1310 (2006).
- Hartmann, M. J., Johnson, N. J., Towal, R. B., Assad, C. Mechanical characteristics of rat vibrissae: resonant frequencies and damping in isolated whiskers and in the awake behaving animal. The Journal of Neuroscience. 23, 6510-6519 (2003).
- Prichard, J., et al. Lactate rise detected by 1H NMR in human visual cortex during physiologic stimulation. Proceedings of the National Academy of Sciences of the United States of America. 88, 5829-5831 (1991).
- Sappey-Marinier, D., et al. Effect of photic stimulation on human visual cortex lactate and phosphates using 1H and 31P magnetic resonance spectroscopy. Journal of Cerebral Blood Flow & Metabolism. 12, 584-592 (1992).
- Mazuel, L., et al. A neuronal MCT2 knockdown in the rat somatosensory cortex reduces both the NMR lactate signal and the BOLD response during whisker stimulation. PLoS One. 12, e0174990 (2017).
- Castellano, G., et al. NAA and NAAG variation in neuronal activation during visual stimulation. Brazilian Journal of Medical and Biological Research. 45, 1031-1036 (2012).
- Sarchielli, P., et al. Functional 1H-MRS findings in migraine patients with and without aura assessed interictally. Neuroimage. 24, 1025-1031 (2005).
- Baslow, M. H., Hrabe, J., Guilfoyle, D. N. Dynamic relationship between neurostimulation and N-acetylaspartate metabolism in the human visual cortex: evidence that NAA functions as a molecular water pump during visual stimulation. Journal of Molecular Neuroscience. 32, 235-245 (2007).
- Mangia, S., Tkac, I. Dynamic relationship between neurostimulation and N-acetylaspartate metabolism in the human visual cortex: evidence that NAA functions as a molecular water pump during visual stimulation. Journal of Molecular Neuroscience. 35, 245-248 (2008).
- Baslow, M. H., Hrabal, R., Guilfoyle, D. N. Response of the authors to the Letter by Silvia Mangia and Ivan Tkac. Journal of Molecular Neuroscience. 35, 247-248 (2008).
- Barros, L. F., Weber, B. CrossTalk proposal: an important astrocyte-to-neuron lactate shuttle couples neuronal activity to glucose utilisation in the brain. The Journal of Physiology. 596, 347-350 (2018).
- Bak, L. K., Walls, A. B. CrossTalk opposing view: lack of evidence supporting an astrocyte-to-neuron lactate shuttle coupling neuronal activity to glucose utilisation in the brain. The Journal of Physiology. 596, 351-353 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados