Method Article
مطيافية الرنين المغناطيسي الوظيفية في 7 ر في قشرة البرميل الجرذ أثناء تنشيط الخط الطولي
In This Article
Summary
بعد التحقق من الدم الأكسجين-المستوى-تعتمد على الوظيفية تنشيط التصوير بالرنين المغناطيسي (جريئة الرنين المغناطيسي الوظيفي) أن البرميل somatosensory المقابلة الميدانية المنطقة اللحاء (تسمى S1BF) بشكل صحيح، الرئيسي والهدف من هذه الدراسة تحديد محتوى لاكتات التقلبات في أدمغة الفئران المنشط بالتحليل الطيفي الرنين المغناطيسي بروتون المترجمة (1ح-السيدة) في 7 ت.
Abstract
مطيافية الرنين المغناطيسي النووي (الرنين المغناطيسي النووي) يتيح الفرصة لقياس المستقلب الدماغي المحتويات في فيفو ونونينفاسيفيلي. وبفضل التطورات التكنولوجية على مدى العقد الماضي، وزيادة قوة الحقل المغناطيسي، من الممكن الآن الحصول على قرار جيد الأطياف في فيفو في الدماغ الفئران. نيورونيرجيتيكس (أي، دراسة الأيض الدماغ)، وخاصة، الأيضية التفاعلات بين أنواع مختلفة من الخلية وقد اجتذبت اهتمام أكثر وأكثر في السنوات الأخيرة. بين هذه التفاعلات الأيضية، لا تزال تجري مناقشة وجود لاكتات مكوكية بين الخلايا العصبية وأستروسيتيس. وهكذا، أنها ذات أهمية كبيرة لأداء وظيفي بروتون الرنين المغناطيسي الطيفي (1ح-السيدة) في نموذج الفئران من لاكتات التنشيط ومراقبة المخ. ومع ذلك، ذروة لاكتات الميثيل يتداخل الدهن صدى القمم ويصعب قياسها كمياً. البروتوكول هو موضح أدناه يسمح الأيضية ولاكتات التقلبات التي يتعين رصدها في مجال تنشيط الدماغ. يتم الحصول على التنشيط الدماغي بتحفيز الخط الطولي وتتم 1ح-السيدة في قشرة البرميل المنشط المقابلة، المجال الذي تم الكشف عن استخدام تعتمد الدم الأوكسجين على مستوى وظيفي التصوير بالرنين المغناطيسي (جريئة الرنين المغناطيسي الوظيفي). ويرد وصف كامل جميع الخطوات: اختيار المسكنات والملفوف، وتسلسل، تحقيق كفاءة الخط الطولي التحفيز مباشرة في المغناطيس، وتجهيز البيانات.
Introduction
الدماغ يمتلك الجوهرية آليات تسمح بتنظيم الركيزة الرئيسية (أيالسكر)، لمساهمته والانتفاع بها، تبعاً للتغيرات في النشاط الدماغي المحلية على حد سواء. ورغم أن السكر هو الركيزة الرئيسية للطاقة للدماغ، أظهرت التجارب التي أجريت في السنوات الأخيرة أن اللاكتات، التي ينتجها أستروسيتيس، يمكن أن يكون الركيزة كفاءة الطاقة للخلايا العصبية. وهذا يطرح فرضية لاكتات مكوكية بين أستروسيتيس والخلايا العصبية1. يعرف باسم أنلس، أستروسيتي-العصبية لاكتات المكوك2، النظرية هو مناقشة لا يزال عاليا، بل أدى إلى الاقتراح أن الجلوكوز، بدلاً من الدخول مباشرة في الخلايا العصبية، قد أدخل أستروسيتيس، حيث أنه يتم استقلاب إلى لاكتات، المستقلب هو ، ثم نقل إلى الخلايا العصبية، واستخدامه بمثابة الركيزة كفاءة الطاقة. في حالة وجود مثل هذا مكوك في فيفو، عليها عدة نتائج هامة، سواء لفهم التقنيات الأساسية في مجال التصوير الدماغي الوظيفي (بوزيترون التصوير المقطعي [أليف]) أو لفك رموز التعديلات الأيضية ولاحظ في أمراض المخ.
دراسة الأيض الدماغ، وخاصة، تتوفر التفاعلات الأيضية بين الخلايا العصبية و astrocytes، التقنيات الرئيسية الأربعة (لا بما في ذلك المشاريع المتناهية الصغر/nanosensors): أوتوراديوجرافي والحيوانات الأليفة واثنين-فوتون مجهرية [كنفوكل] الفلورسنت والسيدة. أوتوراديوجرافي كان واحداً من أول الأساليب المقترحة ويقدم صوراً للتراكم الإقليمي المشعة 14ج-2-ديوكسيجلوكوسي في شرائح المخ، بينما الحيوانات الأليفة الغلال في فيفو الصور لاستيعاب الإقليمية المشعة 18 وديوكسيجلوكوسي. وكلاهما قد سيئات استخدام جزيئات إيرادياتيفي أثناء إنتاج الصور ذات الدقة المنخفضة المكانية. اثنين-فوتون الفحص المجهري يوفر القرار الخلوية من المسابر الفلورسنت، ولكن تشتت الضوء بالانسجة يحد عمق التصوير. وقد استخدمت هذه التقنيات الثلاثة سابقا لدراسة نيورونيرجيتيكس في القوارض من خلال الخط الطولي التحفيز3،4،،من56. في فيفو السيدة ميزة مزدوجة موسع ونونراديواكتيفي، ويمكن أن تستكشف أي بنية الدماغ. وعلاوة على ذلك، يمكن أن يؤديها السيدة أثناء تنشيط الخلايا العصبية، تقنية تسمى السيدة الوظيفية (فمرس)، الذي تم تطويره مؤخرا جداً في القوارض7. ولهذا، يقترح وضع بروتوكول لمراقبة الأيض المخ أثناء النشاط الدماغي قبل 1ح-السيدة في فيفو ونونينفاسيفيلي. الإجراء هو وصف في الفئران صحية الكبار مع تنشيط الدماغ التي حصل عليها تحفيز الخط الطولي جوية-نفخة القيام بها مباشرة في تصوير رنين المغناطيسي (السيد) تي 7، لكن قد تكون مناسبة في الحيوانات المحورة وراثيا، وكذلك في أي حالة مرضية .
Protocol
وقد أجريت جميع الإجراءات الحيوانية وفقا للمبادئ "التوجيهية التجارب الحيوانية" "توجيهات مجلس الجماعات الأوروبية" من 24 نوفمبر 1986 (86/609/EEC). البروتوكول التقى المبادئ التوجيهية الأخلاقية الفرنسية من وزارة الزراعة والغابات، ووافقت عليه لجان الأخلاقيات المحلية (د اللجنة 'الأخلاق صب L' ° expérimentation ن بوردو أنيمالي 50112090-أ).
ملاحظة: خلال القياسات السيد، مستوى كاف من التخدير والمراقبة الفسيولوجية (درجة حرارة الجسم، ومعدل التنفس) شروط لا غنى عنها.
1-الحيوانات
- استخدام الذكور ويستار وزنها بين 350 و 450 g.
- الاحتفاظ بها في 12:12 دورة وتوفير الغذاء والمياه libitum الإعلانيةح الضوء: الظلام.
2-التخدير
- إعداد المعدات اللازمة للتخدير (الشكل 1 أ، ب، انظر الجدول للمواد): 5 مل حقنه تحتوي على ميديتوميديني في حل المحلول الملحي الفسيولوجي (240 ميكروغرام/كغ/ساعة، بمعدل التروية 20 ميليلتر/دقيقة)، 0.5 مل حقنه تحتوي على أتيباميزولي (20 ميكروليتر، في 0.5 مل المحلول الملحي)، ومرهم العين.
ملاحظة: الاحتفاظ بجميع المعدات تحت غطاء النازع، ما عدا حقنه 5 مل تحتوي على ميديتوميديني، التي وضعت في ضخ حقنه قرب المغناطيس للتخدير أثناء الشراء السيد. - وضع الفئران في قاعة التوجيهي، تبدأ التخدير بتسليم isoflurane 4%، وضبط معدل تدفق الأوكسجين إلى 1.5 لتر في الدقيقة.
- تقييم عمق التخدير عن طريق تقييم انسحاب مخلب ردود الفعل.
- عندما لا يستجيب للتحفيز الفئران، اعتبر من خارج منطقة الجزاء التخدير ووضعه على مقاعد البدلاء مع انفها في قناع isoflurane والمحافظة على التخدير بتقديم 2.5% في الأوكسجين في 1.5 لتر في الدقيقة.
- بلطف تدليك الذيل ومكان عاصبة (الشكل 1).
ملاحظة: يمكن إجراء التدليك في الماء الدافئ، مع درجة حرارة تتراوح بين 38 و 42 درجة مئوية، للحصول على أفضل توسع الأوعية الأوردة. - أدخل القسطرة الوريدية الطرفية (22 ز)، هيبارينيزيد سابقا، في هذا السياق ذيل الأيمن أو الأيسر. لاحظ عودة وريدية (قطره دم مرئياً في الجزء القاصي من الإبرة) بشكل صحيح عند القسطرة إدراج (الشكل 1).
- تفجير أي فقاعات الهواء الموجودة في وحدة التخزين الميت الفضاء القسطرة استخدام المحاقن 2 مل تحتوي على الهيبارين والحل المحلول الملحي الفسيولوجي.
- تطبيق مرهم العين وإعداد حقنه تحتوي على أتيباميزولي (17 ميكروغرام/مل) توقظ الفئران في نهاية التجربة.
3-فأر التنسيب في المغناطيس لتنشيط الخط الطولي
- ضع جهاز استشعار التنفس على السرير المغناطيس وثم نقل الفئران من مقاعد البدلاء إلى السرير المغناطيس. وضعه في موقف المعرضة بأنفها في قناع إيسوفلوراني، مع استشعار التنفس يقع بين في القفص الصدري والسرير المغناطيس.
ملاحظة: يجب أن تكون جميع المعدات التي يدخل غرفة التصوير بالرنين المغناطيسي آمنة للتصوير بالرنين المغناطيسي. - إنقاص isoflurane (من 4% إلى 1.5%-2%) خلال التنسيب الفئران وتبديل التخدير ميديتوميديني في نهاية هذا الإجراء. ضمان حرية، بعد قطع الحافة اليمنى في الجزء الأمامي الفئران سرير الرنين المغناطيسي مسبقاً للسماح للحركة شعرات شعرات الصحيح.
- عقد الفئران في الموقف مع الشريط ومراقبة التنفس، التي يجب أن تكون بين 60 و 80 نفسا في الدقيقة.
- جعل الإبحار التي يعوض شعرات كل الحق في الشريط ورقة (الشكل 2). محاذاة الأنابيب منفذ مرونة النظام نفخة الهواء على طول الفئران سرير التصوير بالرنين المغناطيسي حيث يكون الجزء تغادر الأنبوب عمودي وفي حوالي 1.5 سم من الشراع. الإصلاح مع شريط ورقي.
4-الخط الطولي التحفيز
- الاتصال مدخل مرنة الأنبوب من مصدر هواء المضغوط (1 بار) إدخال صمام تحكم لولبي والأنابيب منفذ الإخراج صمام التحكم اللولبي (الشكل 3). ضمان أن يبقى صمام الملف اللولبي التحكم خارج الغرفة المغناطيس.
- قم بتوصيل جهاز النبض في صمام الملف اللولبي والمغناطيس باستخدام منطق الترانزستور الترانزستور (TTL)-الميناء. تكوين فإنه حيث أن تواتر النبض = 8 هرتز، الوقت النبض = 20 s، ووقت الراحة = 10 s.
ملاحظة: هذه المعلمات، تصور على الكريستال السائل الصغيرة عرض شاشة (LCD)، هي القابلة للتعديل عن طريق المقاومات هاته مكرسة الثلاثة. الجهاز النبض الإلكتروني، وعناصر التحكم في النموذج، يجب أن تتألف من المكونات الإلكترونية عالية الجودة لتجنب أي الانجراف في معلمات الوقت (لتحليل نتائج العمل الصحيح).
5-جريئة الرنين المغناطيسي الوظيفي اقتناء
- ضع الدماغ الفئران حيث يكون في وضع رأسي، واستخدام أشرطة الإذن للحفاظ عليه. وضع اللولب حجم الصفيف فوق رأسه في الفئران (الشكل 4A) وإصلاحه باستخدام الشريط. تحقق من أن يتحرك الشراع بشكل صحيح (حركة الصورة، لا تناوب، ولا احتكاك من الشراع) عندما يكون نظام نفخة الهواء تحول المعني؛ ثم أغلقه.
- إدراج السرير واللولب في مركز المغناطيس. تحقق من أن الشراع لا تزال تتحرك بشكل صحيح مرة واحدة السرير داخل المغناطيس عندما يكون النظام نفخة الهواء على؛ ثم أغلقه. التبديل تماما من إيسوفلوراني إلى ميديتوميديني (معدل التروية: 20 ميليلتر/دقيقة).
- تحقق أن الفئران جيدا يقع استخدام تسلسل تعريب (TE = 2.5 مللي ثانية؛ TR = 100 مللي ثانية؛ متوسط = 1؛ التكرار = 1؛ شريحة = 1 مم؛ حجم الصورة = 256 × 256؛ مجال الرؤية (FOV) = 50 × 50 مم؛ المسح الضوئي الوقت = 12 s 800 مللي ثانية). اسحب علامة التبويب تسلسل المترجم إلى اسم التعليمات ، ثم انقر فوق متابعة.
- اسحب علامة التبويب تسلسل T2_Star_FID_EPI إلى اسم التعليمات، مركز فوف في منتصف الدماغ، وانقر فوق علامة التبويب برنامج التكيف لفتح تعليمات المسح تم تحريرها. تسجيل خارطة0 ب والشروع في مسح رقاقة.
ملاحظة: للحصول على خريطة ب0 ، استخدم المعلمات التالية: المرة الأولى صدى = 1.65 مرض التصلب العصبي المتعدد؛ TR = 20 مللي ثانية، متوسط = 1؛ الوجه زاوية = 30°؛ صدى تباعد = ms 3.805؛ شريحة = 58 مم؛ حجم الصورة = 64 × 64 × 64؛ فوف = 58 × 58 × 58 مم؛ المسح الضوئي الوقت = 1 م 24 السيدة s 920 لمسح الرقاقة، استخدم المعلمات التالية: الإثارة انتقائية فوكسل = نبض غاوسي البخار؛ TE = 5 مللي ثانية؛ خلط الوقت = 10 مللي ثانية؛ مدة اقتناء = ms 204.8؛ عرض النطاق الترددي = 10,000 هرتز؛ الوقت يسكن = 50 ميكروثانية). - بدء تسلسل T2 Star_FID_EPI (TE = ms 16.096؛ TR = 500 مللي ثانية؛ متوسط = 1؛ التكرار = 600؛ شريحة = 1 مم؛ أربعة شرائح متتالية؛ حجم الصورة = 128 × 128؛ فوف = 20 x 20 مم؛ عرض النطاق الترددي = هرتز 333,333.3؛ المسح الضوئي الوقت = 5 دقيقة 00 ثانية).
ملاحظة: بسبب المنفذ TTL، إشارة مشغل خارجي سيبدأ النظام نفخة الهواء في الوقت نفسه. النموذج = [20 ق التنشيط + 10 ق بقية] x 10، للمدة الإجمالية لمسح 600، 500 مللي للمسح الضوئي. يتم توسيط الشرائح في منتصف منطقة حقل للبرميل. - الحصول على آخر تسلسل التعريب (كما هو موضح في خطوة واحدة من 5.3) مقارنة مع أول واحد والتحقق من ما إذا كان قد نقل الفئران أثناء تسلسل T2_Star_FID_EPI.
- إحضار السرير لموقفها المبدئي وإزالة اللولب صفيف التخزين والاتصال اللولب السطحية.
6-معالجة جريئة
- افتح الملف T2 Star_FID_EPI وقراءة الصورة T2 Star_FID_EPI في عرض الصور. فتح نافذة بدء التشغيل لوحدة وظيفية، تسمى فونكونترولير.
- في علامة التبويب هذه المعالجة ، حدد الإطار التصوير الوظيفي وتعريف البروتوكول التحفيز (المدة والتناوب علىإيقاف فترات، المقابلة للنموذج المستخدمة).
- حدد إطار بروتوكول (dataset مع إطارات 600) وإدراج قيمة 40 في علامة التبويب في الفترة و 20 في إيقاف الفترة التبويب انقر فوق علامة التبويب عكس الإسناد واسحب مربع التمرير إلى اليسار لتحديد تحفيز الدول القيمة 1.
- في إطار تجهيزها، انقر على تصفية الوسيط في الطائرة لتجهيزها وعلى متوسط عامل تصفية (2D, 3D) لتحليل نتائج العمل.
- انقر فوق علامة التبويب التنفيذ واسحب في المؤشرات لتعديل جدول البحث تراكب. تصور في مجال تنشيط الدماغ (الشكل 4 باء).
7-بروتون السيدة المقتنيات
- لتحديد موضع اللولب السطحية بشكل صحيح، قم بتعديل لمنصب رئيس الفئران. استدارة الرأس (حوالي 30° عكس اتجاه عقارب الساعة) حيث أنه يمكن وضع اللولب السطحية (الشكل 5A) فقط فوق قشرة الأيسر للبرميل بينما يجري الأفقي ويقع في مركز المغناطيس عندما داخل المغناطيس.
- وضع اللولب السطحية وإصلاحه على الدماغ الفئران باستخدام الشريط (الشكل 5B)، والتحقق من أن يتحرك الشراع بشكل صحيح (حركة الصورة، لا تناوب، ولا احتكاك من الشراع) عندما يكون نظام نفخة الهواء تحول المعني؛ ثم اطفائه في المفتاح الرئيسي.
- تحقق من أن يتحرك الشراع بشكل صحيح مرة واحدة السرير داخل المغناطيس عندما يكون النظام نفخة الهواء على. ثم أغلقه.
- التحقق من وضع الفئران بشكل صحيح باستخدام تسلسل تعريب. تعيين المعلمات على النحو التالي: TE = 2.5 مللي ثانية؛ TR = 100 مللي ثانية؛ متوسط = 1؛ التكرار = 1؛ شريحة = 1 مم؛ حجم الصورة = 256 × 256؛ فوف = 50 × 50 مم؛ المسح الضوئي الوقت = 12 s 800 مرض التصلب العصبي المتعدد.
- اسحب علامة التبويب تسلسل المترجم في إطار تعليمات الاسم وانقر فوق علامة التبويب متابعة تنفيذ برنامج المسح الضوئي.
- عند الترجمة الدماغ الصحيح، اسحب علامة التبويب تسلسل T2_TurboRARE في نافذة التعليمات الاسم وانقر على متابعة تنفيذ برنامج المسح الضوئي. سوف تسمح هذه الصور التشريحية، جنبا إلى جنب مع اكتساب جريئة الرنين المغناطيسي الوظيفي السابق، التعريب الصحيح فوكسل في S1BF للسيدة.
ملاحظة: تكون معلمات T2_TurboRARE 14 شرائح، 2 مم في الشريحة، فوف = 2.5 x 2.5 سم، الشركة المصرية للاتصالات = 100 مللي ثانية، TR = 5,000 مرض التصلب العصبي المتعدد، مصفوفة = 128 × 128، تسلسل الوقت = 2 دقيقة 40 ثانية. - اسحب علامة التبويب تسلسل الليزر في إطار تعليمات اسم ، مكان فوكسل (ارتفاع 2 مم، طويلة 2.5 مم، عمق 3 مم) في وسط منطقة S1BF.
- استخدام أطلس الدماغ الفئران وتعزيز جريئة الرنين المغناطيسي الوظيفي لتعريب المنطقة على الصور T2 (الشكل 6). انقر على علامة التبويب برنامج التكيف لفتح تعليمات المسح تم تحريرها. انقر فوق علامة التبويب تمايل وتغيير المقاومة (تحميل الإلكترونية) من اللولب تلقي قليلاً لضبط ذلك. انقر فوق علامة التبويب تطبيق عند ضبط الانتهاء من إغلاق محرر التعليمات وتطبيق التغييرات في تعليمات المحرر.
- تسجيل خارطة0 ب والشروع في مسح الرقاقة، وثم تنفيذ الرقائق محلية.
ملاحظة: للخريطة ب0 ، استخدم المعلمات التالية: المرة الأولى صدى = 1.65 مرض التصلب العصبي المتعدد؛ TR = 20 مللي ثانية، متوسط = 1؛ الوجه زاوية = 30°؛ صدى تباعد = ms 3.805؛ شريحة = 58 مم؛ حجم الصورة = 64 × 64 × 64؛ فوف = 58 × 58 × 58 مم؛ المسح الضوئي الوقت = 1 م 24 السيدة s 920 للرقائق المسح الضوئي، استخدم المعلمات التالية: فوكسل الإثارة انتقائية نبض غاوسي البخار؛ TE = 5 مللي ثانية؛ خلط الوقت = 10 مللي ثانية؛ مدة اقتناء = ms 204.8؛ عرض النطاق الترددي = 10,000 هرتز؛ الوقت يسكن = 50 ميكروثانية. للرقائق محلي، استخدم المعلمات التالية: المياه قمع، بخار مدة اقتناء = ms 1,363.15؛ النقاط = 4,096؛ عرض النطاق الترددي في هرتز = هرتز 3,004.81؛ عرض النطاق الترددي في جزء في المليون = 10 جزء في المليون؛ الوقت يسكن = ميكروثانية 166.40؛ القرار الطيفية = 0.37 هرتز/نقطة. المعلمات الليزر: صدى الوقت = 19.26 مرض التصلب العصبي المتعدد؛ TR = ms 2,500؛ المتوسطات = 128 أو 32؛ المسح الضوئي الوقت = 5 دقيقة 20 s أو 1 دقيقة 20 ثانية؛ اكتساب النقاط = 4,096. - أداء ح 1-السيدة.
- بدء 1اقتناء ح-السيدة الأولى أثناء فترة راحة (يمسح مسح ليزر 4 × 32 + ليزر 128؛ مسح ms 2,500 الواحد).
- الحصول على آخر تسلسل التعريب (كما هو موضح في خطوة واحدة من 5.3) مقارنة مع أول واحد مسجل وضمان أن الفئران لم يتحرك خلال اقتناء الليزر.
- تنفيذ 1ح-السيدة أثناء تنشيط الخط الطولي استخدام تسلسل الليزر (مسح مسح ليزر 4 × 32 + ليزر 128؛ مسح ms 2,500 الواحد) مع نظام نفخة الهواء في (نموذج = 20 s للتنشيط و 10 s بقية).
- مرة أخرى، إجراء تسلسل تعريب للتحقق من ما إذا كان قد نقل الفئران.
ملاحظة: عدد عمليات التفحص وفترات الراحة/المنشط يمكن تكييفها وتعديلها، ولكن تأكد دائماً أن الفئران لا تتحرك بانتظام إجراء تسلسل تعريب.
- إحضار السرير لموقفها المبدئي وإزالة اللولب السطحية، ونقل الفئران العودة إلى مقاعد البدلاء. حقن أتيباميزولي في حظيرة جلد في الفئران العودة إلى عكس التخدير وتوقظ.
8-تجهيز السيدة بروتون
- فتح برنامج لكموديل، وانقر فوق علامة التبويب المناسبة لتحديد نوع البيانات الصحيح (ملف مجاناً التعريفي تسوس ) واختر الملف الصحيح. انقر فوق علامة التبويب "موافق" عندما يتم ذلك.
- تحسين المعلمات التحكم الكمي خطوة بخطوة.
- في المقطع العنوان ، أدخل عنوان يدوياً وتحديد مجموعة كافية جزء في المليون (مثلاً، 0.2 إلى 4.0 جزء في المليون) بكتابة يدوياً في القيمة اللازمة في الميادين ذات الصلة.
- في المقطع الملفات كل على حدة ، تحديد وتحميل الملف المطلوب لاحتواء خط الأساس جزيء ضخم بشكل صحيح (يمكن توفيرها قبل موفر البرمجيات).
- تعريف وتحميل معلمات عنصر تحكم الإدخال. إعداد الحفظ العملية لكافة أنواع الملفات مفيدة مسبقاً (الجدول = الجداول المدمجة؛ ملاحظة: = إخراج بوستسكريبت الضرورية؛ CSV = تنسيق جداول البيانات؛ COORD = الإحداثيات لقطع الأراضي). انقر فوق علامة التبويب رونلكموديل لبدء التحديد الكمي لكموديل.
- تعريف والايضات المحدد لتوليد الإحصاءات.
ملاحظة: لكموديل يوفر المستقلب الكمي وتقديرات الأخطاء حسب قيمة وصف راو بير الحد الأدنى (كرلب). قيمة مع كرلب < 15 يعتبر القياس الكمي أمثل. كرلب > 25 يشير إلى قيمة غير موثوق بها.
النتائج
ويسمح هذا البروتوكول التحديد الكمي لتقلبات المستقلب أثناء التنشيط الدماغي، الذي يتم الحصول عليه بتحفيز الخط الطولي الأيمن مباشرة في المغناطيس.
وكان الهدف العام المتمثل في الرنين المغناطيسي الوظيفي جريئة في هذه الدراسة، للتحقق من أن تنشيط الخط الطولي كانت تتسم بالكفاءة، لتصور منطقة S1BF المنشط، وتحديد فوكسل ل 1ح-فمرس بشكل صحيح. الجهاز بنيت لتفعيل الخط الطولي الكفاءة. في الواقع، عندما حفز شعرات الصحيح باستخدام نظام نفخة الهواء محلية الصنع، تم اكتشاف إشارة إيجابية جريئة في قشرة البرميل اليسرى (الشكل 4 باء)، S1BF، دعت أيضا إلى ميدان البرميل somatosensory (n = 8). تم الكشف عن تعزيز إشارة إيجابية في قشرة البرميل الأيسر في ثمانية من أصل ثمانية الفئران، حين تم الكشف عن الخلفية فقط في نصفي الكرة اليمين. عندما تم إجراء الرنين المغناطيسي الوظيفي جريئة دون تنشيط الخط الطولي، لوحظ تعزيز لا إشارة في اليسار أو في حق S1BF.
في مقارنة بين الصور السيد التشريحية والفئران الدماغ أطلس مخططات8، يسمح مجال تنشيط الدماغ تصور بالرنين المغناطيسي الوظيفي جريئة فوكسل لتوضع في منطقة S1BF، والتي يتم تفعيلها من خلال تحفيز الخط الطولي. هذا فوكسل يقع على ثلاث شرائح متتالية (1 مم) منذ قشرة البرميل الواحد 3 مم في الطول. عندما يتم فصل الشريحة الدماغ تقريبا إلى أربعة أرباع، فوكسل يقع في أعلى اليسار الربع في ما يقارب 45° زاوية (الشكل 6).
عند تشغيل النموذج لتنشيط الخط الطولي، لوحظت زيادة في محتوى لاكتات في S1BF اليسرى (الشكل 6، أطياف النموذجية التي تم الحصول عليها في أحد الفئران). أفضل تصور تقلبات الأيضية بين المنشط فترات، ويستريح طرح طيفي أنجز (الشكل 6). من هذا الطيف المطروحة، كان تصور الزيادة في محتوى لاكتات مع تنشيط الدماغ أكثر سهولة، بينما في هذه الفئران، إشارة N-أسيتيلاسبارتاتي (ناه) انخفض قليلاً. كما لوحظت زيادة لاكتات أثناء تنشيط الخلايا العصبية في deconvolution الطيفية (الشكل 7 أ، ب). في حين تم الكشف عن ذروة لاكتات نادراً في الطيف في فيفو في بقية، لكموديل كان قادراً على قياس ذلك (الشكل 7 أ) بدقة وحسن كرلب القيم. في الواقع، كان طيف واحد فقط من أصل 23 الفئران، قيمة كرلب للقياس الكمي لاكتات يساوي 24. أيا كانت > 25. لكافة الأطياف الأخرى، والقيم تراوحت بين 3 و 19.
التغيرات في محتوى لاكتات في جميع الفئران 23 ترد في الشكل 8. من أصل 23 الفئران، لوحظ انخفاض في محتوى لاكتات في فأر واحد فقط. كان هناك اختلاف مهم إحصائيا في لاكتات المحتوى بين الراحة والمنشط فترات (± ± 0.012 و 0.163 0.132 0.011، على التوالي، قيم أقارب PCr + Cr المحتوى، إقران تي-اختبار، ف = 0.0005 [حدودي، ثنائي الطرف] ، n = 23). ولذلك، تم قياس نسبة 7.8% ± 31.6% في محتوى لاكتات خلال تحفيز الخلايا العصبية.
ويمكن ملاحظة حدوث انخفاض طفيف في محتوى ناه في الشكل 6، الذي يمثل أطياف النموذجية التي تم الحصول عليها في الحيوان واحدة. ولكن هذا الاختلاف ناه لم يكن كبيرا (وتم قياس انخفاض 1.2% ± 1.2%، n = 23).
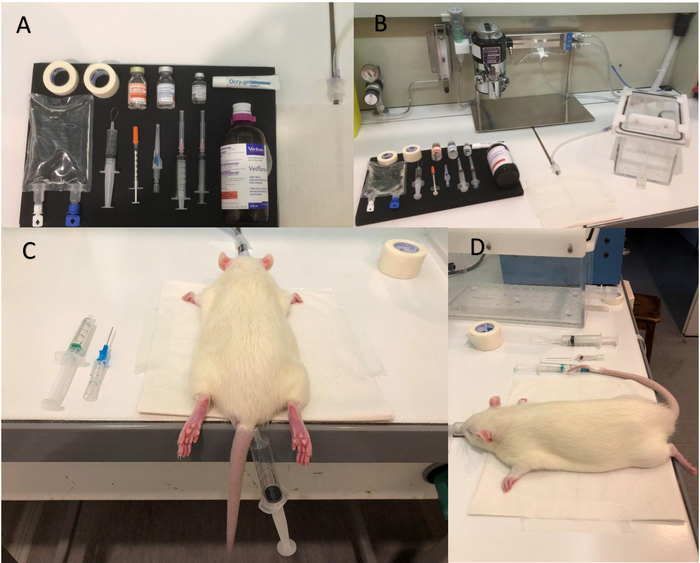
رقم 1: المعدات والخطوات للتخدير. (أ) صورة للمعدات أن يكون مستعدا قبل البدء بالتخدير. (ب) Isoflurane الدائرة مضخة والاستقراء. (ج) وضع عاصبة. (د) الصورة توضح القسطرة قد تم إدراجها بشكل صحيح؛ ملاحظة قطره الدم في الإبرة القسطرة، وعلامة إيجابية على الموقع الصحيح في هذا السياق. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

رقم 2: تنشيط الخط الطولي. حق كل شعرات محاصرون في شراع مع شريط ورقي. الشراع يسمح شعرات كل الحق حفز في نفس الوقت مع نظام نفخة الهواء، وذلك، يزيد من تنشيط الخلايا العصبية للقشرة للبرميل. يجب أن يكون موجوداً مأخذ النظام نفخة الهواء (أنبوب أسود) حوالي 1.5 سم وخط عمودي للشراع. الاختيار خارج المغناطيس للتأكد من الشراع تسير بشكل صحيح عن طريق تشغيل النظام نفخة الهواء. يجب نقل الشراع في 8 هرتز في اتجاه الصورة (لا التناوب). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

رقم 3: نظام نفخة الهواء لتنشيط الخط الطولي. يربط أنابيب مرنة (A) بالهواء المضغوط إلى (ب) صمام التحكم اللولبي. أنبوب مرن ثاني يجلب الهواء نابض من إخراج صمام التحكم اللولبي للشراع. صمام الملف اللولبي التحكم توصيل الجهاز النبض، والذي يتحكم في النموذج. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 4: جريئة الرنين المغناطيسي الوظيفي- (أ) حجم الصفيف وضع اللولب. رأس فأر في وضع أفقي وحظرها بواسطة أشرطة الإذن. تحقق من أن الشراع تتحرك بحرية وغير محظور باللولب أو بواسطة التصوير بالرنين المغناطيسي السرير. (ب) غامق نموذجي إشارة في قشرة المنشط للبرميل الأيسر (السهم الأحمر). يتم الكشف عن لا إشارة في نصف الكرة الأيمن كونترالاتيرال (السهم الأزرق). يتم تعيين العتبة نسبة 76.5 في المائة من الحد الأقصى لقيمة الكثافة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الرقم 5: لفائف السطح. (أ) صورة من اللولب السطحية المستخدمة في هذه الدراسة. (ب) وضع لفائف السطحية. يجب تشغيل رأس الجرذ قليلاً حيث أن اللحاء الأيسر للبرميل، ومن ثم اللولب السطحية تقع في وسط السرير التصوير بالرنين المغناطيسي (الرأس هو تحول بزاوية مقدارها حوالي 30°، حلاً وسطا جيدا بين الموقع الصحيح من اللحاء الأيسر للبرميل للسطوح لفائف ce وحركات حرة من الإبحار شعيرات الحق، الذي يجب أن لا يتم حظر بالسرير التصوير بالرنين المغناطيسي). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
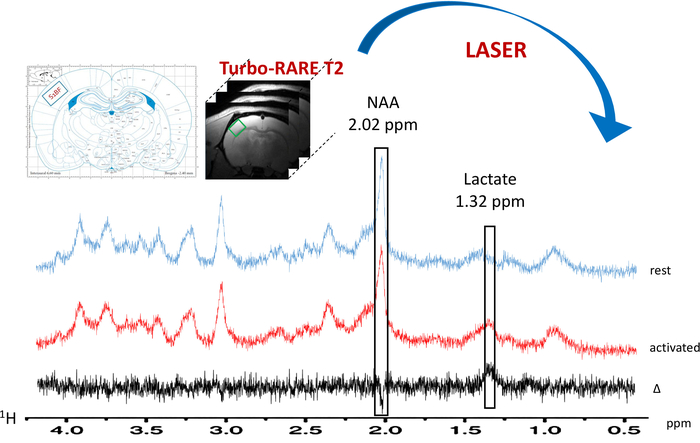
رقم 6: النمطية المترجمة 1ح-السيدة في بقية (الطيف الأزرق) وأثناء تنشيط الخط الطولي (الطيف الأحمر)- فوكسل (الساحة الخضراء) يقع في S1BF اليسرى على الصور التشريحية T2_TurboRARE باستخدام مخططات أطلس الدماغ الفئران وتعزيز الإشارات على صور الرنين المغناطيسي الوظيفي جريئة. الطرح الطيفي المرسومة باللون الأسود. لاكتات وقمم N-أسيتيلاسبارتاتي (ناه) ترد في جزء في المليون 1.32 و 2.02، على التوالي. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
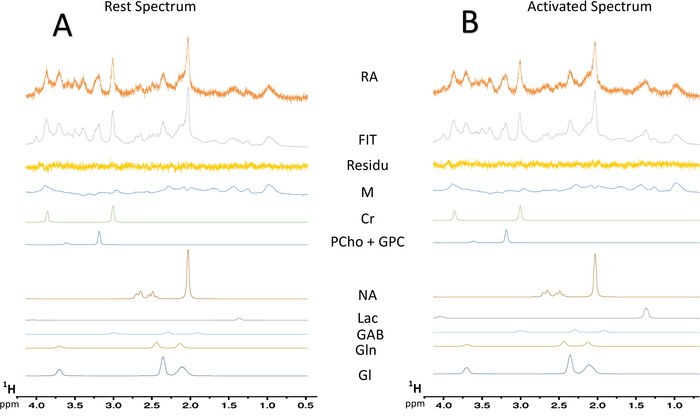
رقم 7: deconvolution الطيفية النموذجية للسيدة الأطياف. (أ) Deconvolution طائفة بقية 128-المسح الضوئي. (ب) Deconvolution طائفة المنشط 128-المسح الضوئي. بقايا، والطرح بين الطيف التجريبية (البيانات الخام)، وتناسب لكموديل؛ مم = جزيء ضخم؛ Cr = الكرياتين + phosphocreatine؛ بتشو + المؤتمر الشعبي العام = phosphocholine + جليسيروفوسفوتشوليني؛ ناه = N-أسيتيلاسبارتاتي؛ أمريكا اللاتينية والكاريبي = لاكتات؛ GABA = حمض أمينوبوتيريك γ؛ جلن = الجلوتامين؛ غلو = الغلوتامات. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 8: الاختلافات في لاكتات المحتوى من خلال تحفيز المخ. النقطة الزرقاء: لاكتات المحتوى في الراحة، وتقرر لكموديل ونسبة الكرياتين + phosphocreatine المحتوى. نقطة حمراء: لاكتات المحتوى أثناء تنشيط الخط الطولي، يحدد لكموديل ونسبة الكرياتين + phosphocreatine المحتوى. الفرق بين المنشط والراحة، ف = 0.0005، إقران تي-اختبار (حدودي، ثنائي الطرف)، n = 23. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Discussion
قشرة البرميل، كما دعا S1BF لقشرة سوماتوسينسوري أو الحقل للبرميل، وهي منطقة داخل الطبقة القشرية الرابع التي يمكن ملاحظتها باستخدام الفسفرة التأكسدية تلطيخ9، والتنظيم معروف جيدا نظراً لأنه قد تم إلى حد كبير وصف 10،11. فيبريسا واحد متصل واحد للبرميل، التي تنظم بها حوالي 19,000 من الخلايا العصبية في عمود12. مسار الخط الطولي للبرميل اللحاء له العديد من المزايا. أولاً، أنه يمكن تفعيلها داخل المغناطيس باستخدام نظام هواء-نفخة متوافقة مع التصوير بالرنين المغناطيسي، التي يمكن أن تكون محلية الصنع بسهولة (للتأكد من أن الجزء الأكبر من منطقة S1BF، التي تتطابق مع تقريبا حجم فوكسل الذي يتم تنفيذ السيدة، شعرات جميع وتقلص في شراع الذي يسمح للحث على أقصى قدر فيبريسا). ثانيا، حق تفعيل الخط الطولي ويؤدي إلى تنشيط اللحاء الأيسر للبرميل، ويقع هذا المجال المخ في القشرة سوماتوسينسوري، الذي يسمح باستخدام لفائف السطحية العالية الحساسة. ثالثا، هذا الأسلوب من تفعيل قشرة somatosensory موسع مقارنة بتحفيز مخلب الكهربائية، وجود العيب من تنشيط الهياكل الدماغ الأخرى، بما في ذلك بعض في نصف الكرة الأيمن13. ولذلك، البروتوكول المستخدم هنا الأنسب لأداء المجراة، موسع، والطولية دراسة الأيض الدماغ تحت التنشيط الدماغي.
اختيار مخدر حاسم، كما العديد من المسكنات تحدث تغييرات في اقتران neurovascular واستقلاب الدماغ الدماغ النشاط14،15. على سبيل المثال، إيسوفلوراني، المخدر الأكثر شيوعاً المستخدمة للتصوير بالرنين المغناطيسي، ويؤدي إلى ثلاثة إلى ستة أمثال في الدماغ لاكتات المحتوى15،16 و، ولذلك ينبغي أن لا تستخدم في الدراسات الاستقلابية الدماغ. ميديتوميديني هو مؤثر α2-أدرينوريسيبتور، الذي يدفع موثوقة التخدير والتسكين واسترخاء العضلات وأنكسيوليسيس17. يمكن عكس هذه الآثار بسرعة باستخدام أتيباميزولي، α2-خصم. ميديتوميديني هو أفضل مرشح لإجراء الدراسات الفنية في القوارض18 حيث له تأثير منخفض جداً في إشارة جريئة والتعديلات أدنى في محتويات المستقلب الدماغ.
من المهم أيضا اتباع نموذج الخط الطولي التنشيط بشكل صحيح. المقتنيات الرنين المغناطيسي تستمر لعدة دقائق، استخدام فترات متعاقبة التنشيط/الراحة ضروري للحد من الحساسية من الخلايا العصبية في منطقة الدماغ المنشط. المعلمات من هذا النموذج (20 ثانية للتنشيط تليها فترة راحة من 10 s) تم اختيارها للحصول على إشارة جريئة الرنين المغناطيسي الوظيفي أعلى في القشرة البرميل المقابلة. يجب أن يكون كثير الحرص على احترام هذه النوافذ الزمنية حيث أنها حاسمة لتحديد فترة تنشيط بقية لمعالجة جريئة، حتى ولو أنه يتم التحكم بواسطة منفذ TTL. للحصول على مستوى عال للبرميل اللحاء التنشيط، الشراع تلك الجماعات شعيرات معا المهم أيضا أنه يسمح للجزء الأكبر من منطقة S1BF أن تحفز. يجب أن يكون كثير الحرص على وضع أنبوب الهواء منفذاً أمام هذا الشراع بحيث أنه يمكن نقل على متن طائرة الصورة. وقد التردد تكون محسوبة بدقة نظراً لأنه قد ثبت أن الخلايا العصبية في قشرة البرميل يتم تنشيطها عندما يكون الخط الطولي التحفيز التردد بين 5 و 15 هرتز19. استخدام تردد أدنى أو أعلى لن يؤدي إلى تنشيط منطقة S1BF.
البروتوكول المستخدم في هذه الدراسة يجعل من الممكن مقارنة أطياف المكتسبة في نفس مجال الدماغ في الراحة وخلال تحفيز المخ، وذلك، لرصد الأيضية التغيرات التنشيط مرتبطة بالمخ. من المهم إجراء تسلسل تعريب في البداية ونهاية البروتوكول مطيافية الرنين المغناطيسي النووي، التأكد من أن الحيوان لم يتحرك، وأن الاختلافات في محتويات الأيضية يقاس بين الدول يستريح وتفعيلها سبب الدماغ التحفيز وليس إلى حركة القطع الأثرية.
استخدام بروتوكول وصف هذه الوثيقة، وتم قياس زيادة في محتوى لاكتات بين يستريح وتنشيط فترات. أولاً، لوحظت زيادة لاكتات استخدام في فيفو الرنين المغناطيسي الطيفي أثناء تنشيط الدماغ في البشر في أوائل التسعينات20،21. ومع ذلك، أجريت قياسات معظم البشر بدلاً من القوارض، التي أقل بكثير من نسبة الإشارة إلى الضوضاء. في الفئران، وكان يؤديها السابقين فيفو الرنين الكمي من لاكتات أثناء تنشيط الدماغ الفئران مازويل et al. 22، الذي لاحظ زيادة لاكتات المحتوى مع تنشيط الخلايا العصبية في الدماغ. وتبين النتائج المعروضة هنا زاد ذلك اللاكتات أثناء تنشيط الخط الطولي. بيد السيدة المترجمة يجيز القرار الخلوية، أنها لا تزال غير معروفة من لاكتات حجرة الهاتف الخلوي الذي يأتي (الخلايا العصبية أو أستروسيتيس). على المضي قدما في فهم عمليات التبادل الأيضي الدماغي، مثل ما زالت تناقش أنلش (أستروسيتي-العصبية لاكتات المكوك الفرضية)، هذا البروتوكول له ليتم تطبيقها على الحيوانات المحورة وراثيا للمكونات الرئيسية في هذا المكوك، مثل مونوكاربوكسيلاتي الناقلين.
ولوحظ في الدراسة المذكورة هنا، لا يوجد اختلاف مهم إحصائيا في محتوى ناه. كان انخفاض في محتوى ناه خلال التحفيز البصري سبق العثور عليها في البشر23،،من2425، ولكن لم تؤكدها مانجايا و Tkac26. في الدراسة الحالية، لاحظنا زيادة في ناه المحتوى أثناء تنشيط الدماغ في 50% الفئران، وانخفاضا في النصف الآخر. ولذلك، ينبغي تجنب ناه كمرجع داخلي للقياس الكمي خلال الوظيفية "لا السيدة" الأخرى الاختلاف في محتوى المستقلب تم الكشف عن.
لاكتات على حد سواء وأدت الاختلافات ناه أثناء تنشيط الخلايا العصبية للجدل23،،من2627،،من2829. لزيادة فهمنا لهذه التقلبات ايضية مرتبطة بنشاط الدماغ، سيكون من المثير للاهتمام أن تطبيق هذا البروتوكول على الحيوانات المحورة وراثيا. وهذا سيكون تقديم مزيد من المعلومات حول العملية الأساسية. عموما، ومترجمة 1ح-السيدة أثناء إحدى مهام، أو وظيفية السيدة29، أسلوب ناشئة في القوارض، ذات الصلة بدراسة التغيرات الدينامية الإقليمية في نواتج الأيض، في العقول العادية أو المرضية.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
وأيد هذا العمل منح درب لابيكس، مرجع ANR-10-لابكس-57، والفرنسية-السويسرية ANR-فنس منح إشارة ANR-15-CE37-0012. يشكر المؤلفون تروتييه اوريليان لدعمه التقني.
Materials
| Name | Company | Catalog Number | Comments |
| 0.5 mL syringe with needle | Becton, Dickinson and Company, USA | 2020-10 | 0.33 mm (29 G) x 12.7 mm |
| 1H spectroscopy surface coil | Bruker, Ettlingen, Germany | T116344 | |
| 7T Bruker Biospec system | Bruker, Ettlingen, Germany | 70/20 USR | |
| Arduino Uno based pulsing device | custom made | ||
| Atipamezole | Vétoquinol, S.A., France | V8335602 | Antisedan, 4.28 mg |
| Breathing mask | custom made | ||
| Eye ointment | TVM laboratoire, France | 40365 | Ocry gel 10 g |
| Induction chamber | custom made | 30x17x15 cm | |
| Inlet flexible pipe | Gardena, Germany | 1348-20 | 4.6-mm diameter, 3m long |
| Isoflurane pump, Model 100 series vaporizer, classic T3 | Surgivet, Harvard Apparatus | WWV90TT | from OH 43017, U.S.A |
| Isoflurane, liquid for inhalation | Vertflurane, Virbac, France | QN01AB06 | 1000 mg/mL |
| KD Scientific syringe pump | KD sientific, Holliston, USA | Legato 110 | |
| LCModel software | LCModel Inc., Ontario, Canada | 6.2 | |
| Medetomidine hydrochloride | Vétoquinol, S.A., France | QN05CM91 | Domitor, 1 mg/mL |
| Micropore roll of adhesive plaster | 3M micropore, Minnesota, United States | MI912 | |
| Micropore roll of adhesive plaster | 3M micropore, Minnesota, United States | MI925 | |
| Monitoring system of physiologic parameter | SA Instruments, Inc, Stony Brook, NY, USA | Model 1025 | |
| NaCl | Fresenius Kabi, Germany | B05XA03 | 0.9 % 250 mL |
| Outlet flexible pipe | Gardena, Germany | 1348-20 | 4.6-mm diameter, 4m long |
| Paravision software | Bruker, Ettlingen, Germany | 6.0.1 | |
| Peripheral intravenous catheter | Terumo, Shibuya, Tokyo, Japon | SP500930S | 22 G x 1", 0.85x25 mm, 35 mL/min |
| Rat head coil | Bruker, Ettlingen, Germany | ||
| Sodic heparin, injectable solution | Choai, Sanofi, Paris, France | B01AB01 | 5000 IU/mL |
| Solenoid control valves, plunger valve 2/2 way direct-acting | Burkert, Germany | 3099939 | Model type 6013 |
| Terumo 2 ml syringe | Terumo, Shibuya, Tokyo, Japon | SY243 | with 21 g x 5/8" needle |
| Terumo 5 mL syringe | Terumo, Shibuya, Tokyo, Japon | 05SE1 | |
| Wistar RJ-Han rats | Janvier Laboratories, France |
References
- Pellerin, L., et al. Activity-dependent regulation of energy metabolism by astrocytes: an update. Glia. 55, 1251-1262 (2007).
- Pellerin, L., Magistretti, P. J. Glutamate uptake into astrocytes stimulates aerobic glycolysis: a mechanism coupling neuronal activity to glucose utilization. Proceedings of the National Academy of Sciences of the United States of America. 91, 10625-10629 (1994).
- Cholet, N., et al. Local injection of antisense oligonucleotides targeted to the glial glutamate transporter GLAST decreases the metabolic response to somatosensory activation. Journal of Cerebral Blood Flow & Metabolism. 21, 404-412 (2001).
- Voutsinos-Porche, B., et al. Glial Glutamate Transporters Mediate a Functional Metabolic Crosstalk between Neurons and Astrocytes in the Mouse Developing Cortex. Neuron. 37, 275-286 (2003).
- Zimmer, E. R., et al. [18F]FDG PET signal is driven by astroglial glutamate transport. Nature Neuroscience. 20 (3), 393-395 (2017).
- Haiss, F., et al. Improved in vivo two-photon imaging after blood replacement by perfluorocarbon. The Journal of Physiology. , (2009).
- Mullins, P. G. Towards a theory of functional magnetic resonance spectroscopy (fMRS): A meta-analysis and discussion of using MRS to measure changes in neurotransmitters in real time. Scandinvian Journal of Psychology. 59, 91-103 (2018).
- Rat Brain Atlas. , Available from: http://Labs.gaidi.ca/rat-brain-atlas/ (2018).
- Wong-Riley, M. T., Welt, C. Histochemical changes in cytochrome oxidase of cortical barrels after vibrissal removal in neonatal and adult mice. Proceedings of the National Academy of Sciences of the United States of America. 77, 2333-2337 (1980).
- Petersen, C. C. The functional organization of the barrel cortex. Neuron. 56, 339-355 (2007).
- Cox, S. B., Woolsey, T. A., Rovainen, C. M. Localized dynamic changes in cortical blood flow with whisker stimulation corresponds to matched vascular and neuronal architecture of rat barrels. Journal of Cerebral Blood Flow & Metabolism. 13, 899-913 (1993).
- Feldmeyer, D. Excitatory neuronal connectivity in the barrel cortex. Frontiers in Neuroanatomy. 6, 24(2012).
- Boussida, S., Traore, A. S., Durif, F. Mapping of the brain hemodynamic responses to sensorimotor stimulation in a rodent model: A BOLD fMRI study. PLoS One. 12, e0176512(2017).
- Heinke, W., Koelsch, S. The effects of anesthetics on brain activity and cognitive function. Current Opinion in Anesthesiology. 18, 625-631 (2005).
- Horn, T., Klein, J. Lactate levels in the brain are elevated upon exposure to volatile anesthetics: a microdialysis study. Neurochemistry International. 57, 940-947 (2010).
- Boretius, S., et al. Halogenated volatile anesthetics alter brain metabolism as revealed by proton magnetic resonance spectroscopy of mice in vivo. Neuroimage. 69, 244-255 (2013).
- Sinclair, M. D. A review of the physiological effects of alpha2-agonists related to the clinical use of medetomidine in small animal practice. Canadian Veterinary Journal. 44, 885-897 (2003).
- Weber, R., et al. A fully noninvasive and robust experimental protocol for longitudinal fMRI studies in the rat. Neuroimage. 29, 1303-1310 (2006).
- Hartmann, M. J., Johnson, N. J., Towal, R. B., Assad, C. Mechanical characteristics of rat vibrissae: resonant frequencies and damping in isolated whiskers and in the awake behaving animal. The Journal of Neuroscience. 23, 6510-6519 (2003).
- Prichard, J., et al. Lactate rise detected by 1H NMR in human visual cortex during physiologic stimulation. Proceedings of the National Academy of Sciences of the United States of America. 88, 5829-5831 (1991).
- Sappey-Marinier, D., et al. Effect of photic stimulation on human visual cortex lactate and phosphates using 1H and 31P magnetic resonance spectroscopy. Journal of Cerebral Blood Flow & Metabolism. 12, 584-592 (1992).
- Mazuel, L., et al. A neuronal MCT2 knockdown in the rat somatosensory cortex reduces both the NMR lactate signal and the BOLD response during whisker stimulation. PLoS One. 12, e0174990(2017).
- Castellano, G., et al. NAA and NAAG variation in neuronal activation during visual stimulation. Brazilian Journal of Medical and Biological Research. 45, 1031-1036 (2012).
- Sarchielli, P., et al. Functional 1H-MRS findings in migraine patients with and without aura assessed interictally. Neuroimage. 24, 1025-1031 (2005).
- Baslow, M. H., Hrabe, J., Guilfoyle, D. N. Dynamic relationship between neurostimulation and N-acetylaspartate metabolism in the human visual cortex: evidence that NAA functions as a molecular water pump during visual stimulation. Journal of Molecular Neuroscience. 32, 235-245 (2007).
- Mangia, S., Tkac, I. Dynamic relationship between neurostimulation and N-acetylaspartate metabolism in the human visual cortex: evidence that NAA functions as a molecular water pump during visual stimulation. Journal of Molecular Neuroscience. 35, 245-248 (2008).
- Baslow, M. H., Hrabal, R., Guilfoyle, D. N. Response of the authors to the Letter by Silvia Mangia and Ivan Tkac. Journal of Molecular Neuroscience. 35, 247-248 (2008).
- Barros, L. F., Weber, B. CrossTalk proposal: an important astrocyte-to-neuron lactate shuttle couples neuronal activity to glucose utilisation in the brain. The Journal of Physiology. 596, 347-350 (2018).
- Bak, L. K., Walls, A. B. CrossTalk opposing view: lack of evidence supporting an astrocyte-to-neuron lactate shuttle coupling neuronal activity to glucose utilisation in the brain. The Journal of Physiology. 596, 351-353 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ISSN 1940-087X
Copyright © 2025 MyJoVE Corporation. All rights reserved
We use cookies to enhance your experience on our website.
By continuing to use our website or clicking “Continue”, you are agreeing to accept our cookies.