Method Article
Определение события гомологичная рекомбинация в мышиных эмбриональных стволовых клеток с использованием южный Blotting и цепной реакции полимеразы
* Эти авторы внесли равный вклад
В этой статье
Резюме
Здесь мы представляем подробный протокол для выявления гомологичная рекомбинация события, которые произошли в мышиных эмбриональных стволовых клеток с использованием Южный blotting или ПЦР. Этот метод является примером поколения nonmuscle миозин II генетических замена мыши модели с использованием традиционных эмбриональных стволовых клеток-технологию на основе гомологичных рекомбинации опосредованной таргетинга.
Аннотация
Относительно вопросов пробить эффектов и сложности вставке длинный фрагмент ДНК в применение конструктора nucleases для редактирования, эмбриональных стволовых генома технологии гена таргетинг на основе клеток (ES) не имеют таких недостатков и широко используется для изменения генома животных/мыши от большого удаления/вставки до единичных нуклеотидных замен. Особенно выявления сравнительно мало гомологичная рекомбинация (HR) события, необходимые для получения желаемого ES клонов является ключевым шагом, который требует точных и надежных методов. Южный blotting или обычных PCR часто используются для этой цели. Здесь мы описываем подробные процедуры использования этих двух методов для идентификации HR события, которые произошли в мыши ES клеток, в которых эндогенного ген Myh9 предназначен для быть нарушена и заменены cDNAs кодирования другие nonmuscle тяжелой цепи миозина IIs (IIs НЦПЗ). Вся процедура Южный blotting включает строительство ориентации vector(s), электропорация, выбор наркотиков, расширения и хранения клеток ES/клоны, подготовка, пищеварение и промокательной геномной ДНК (геномная ДНК), гибридизации и Мойка кислородных и заключительный шаг авторадиографии на рентгеновских пленок. ПЦР могут быть выполнены непосредственно с подготовленной и разбавленных геномная ДНК. Для получения идеальных результатов, следует тщательно планировать зонды и энзима ограничения (пере) вырубки для Южный blotting и грунты для ПЦР. Хотя выполнение Южный blotting является длительным и трудоемким и ПЦР результаты ложных срабатываний, правильной идентификации, Южный blotting и быстрого скрининга методом ПЦР позволяют единственным или комбинированного применения этих методов, описанных в настоящем документе, широко используется и консультации, большинство лабораторий в идентификации генотипов ES клеток и генетически изменены животных.
Введение
Технология гена, ориентирование по HR в мышиных клетки ES обеспечивает мощный инструмент для рассечения сотовой последствия конкретных генетических мутаций1,2. Важность и значение этой технологии отражаются в его признании 2007 Нобелевской премии по физиологии и медицине3,4; Тем временем он представляет собой наступление современной эры гена инженерных5. Джин, ориентация через HR могут быть использованы для инженер практически любые изменения от точечные мутации до больших хромосомных перестроек в геноме мыши ES клеток6,7. Хорошо известно, что, перед появлением так называемых генома инструменты редактирования, поколения мыши Нокаут гена требуется применение технологии гена ориентация в ES клеток8,9,10. В течение последних двух десятилетий более чем 5000 целевых генов мышей были произведены этот подход для моделирования заболеваний человека или изучении генной функции11. Геном общесистемной нокаут усилий была создана для распространения ген ориентации векторов, целенаправленных клоны клеток ES и живой мышей, чтобы научное сообщество2,12,13,14 , 15. несомненно, ES клеток HR-опосредованной ген ориентация технологии значительно расширенный нашего понимания функций генов играл в физиологических и патологических контексте.
Потому что HR является сравнительно редким событием в млекопитающих клетки16,17, является важным и следующий шаг после гена ориентации в мышиных ES клеток заключается в анализе многочисленных колоний ES для выявления несколько клонов с результатом мутации HR с ориентации вектора18. Золотые методы для выявления HR события включают Южный blotting и ПЦР19,20. Преимущества подходов включают что Южный blotting может определить правильно целевых ES клоны и позволяет исследователям анализировать структуру гена целевой события, например проверку одной копии вставки конструкции, тогда как Стратегия на основе ПЦР позволяет более быстрого скрининга для HR события21,22. Хотя эти методы имеют свои недостатки, такие как что они много времени и может иметь ложных срабатываний, комбинационный использование их является широко приняты и применяются организациями большинство лабораторий в определении события HR, особенно в ES клеток, для генерации генетически измененными животных.
Три изоформ nonmuscle миозин II (Нм II) млекопитающих, каждая из которых состоит из двух идентичных NMHC IIs, которые кодируются с трех различных генов (именованные Myh9, Myh10 и Myh14) и две пары легких цепей, называются Нм II-A, II-B и II-C23. Предыдущие исследования показали, что по крайней мере изоформ Нм II-A и II-B важны для развития мыши, потому что в vivo абляции этих изоформ приводит к эмбриональной летальность24,25,26. Чтобы обойти эту проблему и получить новые идеи в изоформы специфичные функции Нм II-A и II-B на более поздних этапах развития мыши, генетических замена была принята стратегия, с использованием ES клеток HR-опосредованной ген ориентация технологии для генерировать серию мыши модели27. В ходе определения желаемого ES клоны, Южный blotting и ПЦР методы были использованы, и они оказались эффективной и надежной в27,28.
Этот документ намеревается представить подробное описание Южный blotting и ПЦР, включая разработку ориентированных на vector(s), кислородных и грунтовки и выполнения экспериментов, а также анализ полученных результатов свидетельствует выявление событий HR вхождение в клетки ES для создания генетических замена Нм II мыши модели и репрезентативных данных. Протоколы этих двух методов, представленные здесь также могут быть приняты для идентификации генотипов генетически модифицированные клетки или животных.
протокол
1. дизайн ориентации на Construct(s), зонды для Южная помарка и грунты для ПЦР
- Выберите первый кодирования экзона (экзона 2) Myh9 гена для нарушения или вставки в применении нокаут/запрессовка сообщили здесь.
- Получить 5-КБ вверх и 5-КБ течению последовательностей ДНК окружающих Myh9 экзона 2 на веб-сайте genome.ucsc.edu .
- Анализ моделей пищеварение ограничения ферментов (REs) с 1 – 2 сокращений в этом регионе 10-КБ с использованием программного обеспечения pDRAW для определения подходящего RE(s) переваривать геномной ДНК для Южный blotting.
Примечание: Dra я встречает это требование и выбран для этой цели. - Выберите фрагмент 4 КБ немедленно вверх по течению от Myh9 экзона 2 как рукой левой гомологии (LHA) и 1.7 kb немедленного вниз по течению последовательность фрагмент как руку правой гомологии (АРЗ); Выберите фрагмент 1 КБ 5' вверх по течению по LHA как левой зонд (LP) для Южный blotting и фрагмент 1.2 kb 3' вниз по течению от RHA как правый зонд (RP), на основе приведенного выше анализа.
- Используйте программу primer3 для разработки прямого и обратного Праймеры для усиления этих четырех фрагментов ДНК методом ПЦР. Дизайн пары праймеров с вперед грунт, проживали вблизи терминала 3' Выбор маркера neomyocin сопротивления гена (P1) и обратный грунт недалеко RHA (P2).
Примечание: Эта пара грунтовка будет использоваться для выявления целевых ES клоны ПЦР29. - Найти клонов BAC 129Sv, покрытие мыши Myh9 Локус гена, посетив веб-сайт bacpac.chori.org (Примечание: isogenic ДНК является предпочтительным). Изолируйте дна BAC, используя комплект для очистки больших кусков ДНК, следуя инструкциям производителя.
Примечание: Очищенная ДНК BAC будет использоваться в качестве шаблона для амплификации PCR. - Нарисуйте схематическое представление таргетинга конструкций, зонды и грунты для обобщения этой информации.
2. поколение ориентации на Construct(s) и Щупы для Южная помарка и подготовка праймеры PCR
- Заказать праймеры PCR, описанных выше и распустить их в концентрации 20 мкм.
- Усилить гомологии оружия и зонды методом ПЦР в реакции решения, в том числе 1 мкл вперед и 1 мкл обратный грунтовки, 1 мкл BAC ДНК (50 нг) как шаблон, 5 мкл буфера для ОРП и 1 мкл ультра Pfu ДНК полимеразы как , и H2O до 50 мкл. выполнять ПЦР в машину ПЦР при следующих условиях: 95 ° C 3 мин; 95 ° C за 30 сек; 60 ° C за 30 сек; 72 ° C и 1 КБ/мин; 30 циклов; Наконец 72 ° C для 10 мин.
- Очищают с помощью ПЦР комплект очистки согласно протоколу, предоставляемых производителем продуктов ПЦР и элюировать ДНК фрагментов с 40 мкл H2O. дайджест очищенных продуктов ПЦР с готовых ВИЭ в реакции раствор, содержащий 5 мкл 10 x буфер для REs , 2,5 мкл RE1 и 2,5 мкл RE2, и eluted ДНК, при 37 ° C на 2 ч запустить ДНК гель 1% для отдельных целевых групп ДНК, акцизный гель, содержащий целевую ДНК под УФ светом, очищают целевых фрагментов ДНК от геля с помощью ДНК гель добыча комплект согласно к протоколу, предоставляемых производителем, а элюировать ДНК фрагментов с 40 мкл H2O.
- Клонировать гомологии оружия и замены выражения cassette(s) в mpNTKV-LoxP вектор согласно приказу усиливается и очищенный АРЗ, LHA и замена выражение cassette(s) освобожден от других векторов для получения окончательного ориентации Construct(s). Клонировать фрагментов ДНК усиливается и очищенный зондов в T-легко вектор.
- Подтвердите нуклеотидные последовательности всех клонированных фрагментов ДНК последовательности27,28.
3. подготовка ориентированных на Construct(s), Electroporation клетки ES и усиления ES клонов
- Подготовка каждого таргетинга конструкцию с использованием плазмида maxiprep комплекта согласно протоколу, предоставляемых производителем. Линеаризации каждой конструкции плазмида, переваривание с не я в 400 мкл реакции, включая 40 мкл 10 x буфер не я, не я 10 мкл, 100 мкг ДНК и H2O до 400 мкл, при 37 ° C ночь.
- Очищайте линеаризованного ориентации construct(s).
- Экстракт переваривается реакция решение 1 x с равным объемом фенола: хлороформ: изоамиловый спирт (25:24:1) и центрифуги в силу 2000 x g за 10 мин.
- Супернатант передать новый 1,5 мл, осадок ДНК, используя 2.5 x этанола и 0,1 x 3M ацетат натрия (рН 5.2) (объемная доля) и центрифуги на силы g 2000 x 10 мин.
- Удалите супернатант, мыть ДНК гранул 1 x 1 мл 75% этанола и центрифуги в силу 2000 x g за 5 мин.
- Удалить супернатант и просушите ДНК Пелле за 5 мин.
- Растворите линеаризованного Пелле ДНК в стерильных буфера Tris-ЭДТА (TE) в конечной концентрации 1 мкг/мкл.
- Смешайте 50 мкг каждой линеаризованного таргетинга конструкции с 0,5 x 107 ES клеток. Выполните электропорации в 320 V и 250 МКФ. тарелка electroporated ES клеток на блюда с нео устойчивостью MEF кормушки.
- После 24 часов переключитесь на средний клеток ES с 400 мкг/мл G418 и 200 мкм ганцикловир и продолжать культуры для 4-5 дней с ежедневной среднего изменения. Подберите лекарственно-ES клоны в 48-ну пластины.
Примечание: Как правило, четыре 48-ну плиты используются в конструкции. - Дублировать 48-ну пластины.
Примечание: Один набор пластин замораживают, и другой набор используется для приготовления геномной ДНК.
4. Подготовка геномной ДНК и пищеварение с Restriction Enzyme(s)
- Подготовка gDNAs от ES клеток с использованием коммерческих комплект (геномной ДНК очистки) с незначительными изменениями.
- Извлеките из культуры клеток ES и 500 мкл раствора лизис ядер, включая RNaseA, непосредственно к скважинам для Лизируйте клетки.
Примечание: Lysate клетки могут храниться при температуре-80 ° C или лечить немедленно. - Накапайте вверх и вниз несколько раз, чтобы лизировать клетки полностью и передавать их на чистой 1,5 мл.
- Добавить одну треть объема решение осадков белок 1,5 мл, вихревой энергично для 20 s, chill образцы на льду на 5 минут и затем, центрифуги в силу 2000 x g 5 мин супернатант передать другой чистый 1,5 мл трубки Контаи Нин равным объемом изопропиловый спирт; Аккуратно перемешайте раствор. (Обратите внимание, что в этот момент можно увидеть белые пряди нитевидные.) Центрифуга в силу 2000 x g 1 мин; затем удалить супернатант.
- Помыть лепешка геномная ДНК с 1 мл 70% этанола при комнатной температуре, центрифуги в силу 2000 x g за 1 мин, тщательно удалить супернатант, а затем просушите геномная ДНК Пелле за 3 мин.
- Распустить gDNAs с 100 мкл раствора регидратации ДНК и, затем, инкубировать на 65 ° C за 1 ч или 4 ° C на ночь.
- Магазин gDNAs в 2-8 ° C.
- Извлеките из культуры клеток ES и 500 мкл раствора лизис ядер, включая RNaseA, непосредственно к скважинам для Лизируйте клетки.
- Дайджест gDNAs с подготовлены RE Dra I. Установите вверх 30-мкл пищеварение реакции, смешивая 3 мкл 10 x буфер для Dra I, 3 мкл Dra я, 10 мкг gDNAs/образца, и H2O до 30 мкл и инкубировать при 37 ° C на ночь.
- Проверьте полноту пищеварение ДНК гель, анализируя 5 мкл переваривается реакции и затем добавьте 3 мкл 10 x буфер ДНК загрузки для последующего шага.
5. южный Blotting и ПЦР идентификации
- Южный blotting скрининг
- Отдельные усваивается gDNAs электрофореза и передачи мембраны.
- Подготовить электрофореза геля агарозы 1% бромидом ethidium (EB), загрузить образцы из шаг 4.3 и лестница 1 КБ и Побегите гель с низким напряжением (30-40 V) на ночь.
- Взять из геля и сфотографироваться на память с системой гель изображения ДНК после электрофореза. Проверьте ли перевариваются и раздельный gDNAs мазка как изображение.
- Замочите геля в поднос с 0,2 N HCl решение и встряхните его мягко в течение 20 минут при комнатной температуре.
- Передача гель для ДНК денатурации раствора и встряхните его мягко в течение 20 минут при комнатной температуре.
- Переключить гель в ДНК нейтрализации раствора и встряхните его мягко в течение 20 минут при комнатной температуре.
Примечание: Гель подвержены поломки после этого шага, поэтому она должна обрабатываться тщательно. - Используйте систему быстрой нисходящей передачи передать мембраны DNAs от геля. Соберите TurboBlotter и blotting стека в соответствии с инструкциями производителя.
Примечание: 10 x или 20 x раствор солевой раствор натрия цитрата (SSC) используется в качестве буфера передачи. В общем 3 h передачи является достаточно передать 95% gDNAs от геля мембраны; Однако больше времени передачи безобидным. - Вынуть мембраны и мыть его с 2 x SSC за 1 мин, впитывают жидкость с тканей и затем перекрестные ссылки ДНК с мембраной с помощью УФ сшивателя.
Примечание: Мембрана может храниться при температуре 4 ° C на одну неделю.
- Ярлык ДНК-зондов с радиоактивностью.
- Очищения плазмиды зонд, с помощью комплекта алкалический согласно протоколу, предоставляемых производителем.
- Релиз ДНК фрагментов зондов от вектор плазмиды путем EcoR пищеварение в растворе реакции, включая 5 мкл буфера для EcoR I, 2 мкл EcoR я фермента, 20 мкг плазмидной ДНК и H2O до 50 мкл , 2 ч.
- Запустить % 1, ДНК гель для разделения фрагментов ДНК зонд из вектора и очистить фрагментов ДНК зондов с комплектом экстракции ДНК гель согласно протоколу, предоставляемых производителем.
- С помощью 1 мкл раствора ДНК, измерения концентрации ДНК фрагментов ДНК зонд с спектрофотометре при длине волны 260/280 Нм.
- Подготовить 40-нг зонд ННО в 1,5 мл трубку с 45 мкл буфера TE, кипятить 3 мин, спина кратко и затем поместите трубки на льду на 2 мин.
- Добавить тепла денатурированный зонд ННО в пробирку, содержащую ДНК маркировки бисер готов к идти (-дЦТФ), накапайте вверх и вниз для микширования, 5 мкл дЦТФ [α32P] и затем Инкубируйте на 37 ° C в течение 15 мин.
- Очистить помеченные зонды с помощью G-50 microcolumns соответствии с инструкциями, предоставленными производителем и, затем, измерения радиоактивности, сцинтилляционный счетчик (необязательно).
- Гибридизируйте membrane(s) с метками зондами.
- Prehybridize мембраны.
- Prewarm гибридизации решение при 42 ° C за 30 мин микс 20 мл раствора подогретую гибридизации с 200 мкг кипяченой лосось спермы ДНК в 50-мл.
- Место мембраны в гибридизации трубку. Добавьте смешанные prehybridization решение в гибридизации трубки. Поместите его в печь гибридизации (набор прокатки и температуры при 42 ° C) и пусть prehybridization перейти на 30 мин.
- С меткой кислородных гибридизируйте мембраны.
- Вынуть трубку гибридизации и залейте раствор prehybridization в 50 мл трубки; Добавьте денатурированного зонд (нагревают при 100 ° C в течение 3 мин) с шагом 5.1.2.7 этой трубки и перемешать осторожно.
Примечание: Уменьшите любые заставить пузыри. - Вернуться гибридизации трубки смешанного решения и выполнять гибридизации при 42 ° C на ночь.
- Вынуть трубку гибридизации и залейте раствор prehybridization в 50 мл трубки; Добавьте денатурированного зонд (нагревают при 100 ° C в течение 3 мин) с шагом 5.1.2.7 этой трубки и перемешать осторожно.
- Prehybridize мембраны.
- Мыть membrane(s) для удаления nonhybridized зонды.
- Поместите membrane(s) в лоток с 1 x SSC + 0.1% SDS и поколебать мягко на 55-60 ° С за 10 мин.
- Передача membrane(s) к лотку с 0.5 x SSC + 0.1% SDS и нежно погрозит 55 – 60 ° С за 10 мин.
- Проверьте радиоактивности на membrane(s) с помощью портативный Счетчик Geiger решить, требуется ли третьей стирки.
- Разоблачить радиоактивности на мембраны для рентгеновских пленок.
- Удалите жидкость из промытого membrane(s).
- Обнять membrane(s) с полиэтиленовой пленкой и исправить его в экспозиции кассету.
- Разоблачить мембраны для двух листов рентгеновской пленки в темной комнате.
- Место кассеты воздействия при температуре-80 ° C на ночь или дольше.
- Разрабатывают фильмах для визуализации результатов. Оцените, может ли соответствующий клон ES нужную с рекомбинацией целевых или нет, в соответствии с размерами полос ДНК, обнаруженная зондов.
- Rehybridize же мембрана другой зонд после зачистки от используемого ПЭП согласно следующей процедуре: вывезти используется мембрана, мыть 1 x с чистой H2O, а затем, инкубировать в растворе чередование (55% формамида, 2% ГНПП, 1% SDS, H 2 O) при 65 ° C с нежным встряхивания в течение 1 – 2 ч.
- Отдельные усваивается gDNAs электрофореза и передачи мембраны.
-
Идентификация PCR
- Выполнять ПЦР идентификации нужного ES клонов в 50 мкл реакции решения, в том числе 5 мкл 10 x PCR буфера, 2 мкл 50 мм MgSO4, 1 мкл dNTP 10 мм, 1 мкл вперед грунтовка 20 мкм, 1 мкл 20 мкм обратный грунтовка , 1 мкл высокой верности Платиновый Taq, gDNAs (~ 100 нг) и H2O до 50 мкл.
- Используйте следующие условия реакции PCR: первоначальный денатурации на 94° C на 3 мин, 30 циклов денатурации на 94° C за 30 сек, отжиг при 60° C за 30 s и расширение на 68° C для 132 s и последний шаг 68° C в течение 10 мин.
- Анализ продуктов ПЦР электрофорезом в 1,0% агарозы.
- Клонировать ПЦР фрагментов с их ожидаемого размера в T-легко вектор и последовательности, чтобы подтвердить наличие частичной последовательности целевого объекта vector.
Результаты
В этом документе описан подробный протокол Южный blotting и ПЦР, которая используется для идентификации HR события, которые произошли в ES клеток мыши для поколения Нм II генетических замена мыши модели, используя ES клеток-технологии на основе HR-опосредованной таргетинга. Хотя Южный blotting и ПЦР, а также традиционной ориентации гена технологии, широко использовались на протяжении нескольких десятилетий, успешное применение их необходимо тщательно планировать. По крайней мере эти аспекты должны быть рассмотрены: длина оружия длинные и короткие, позиции и длины зондов, REs подходит для резки геномной ДНК и праймеры для ПЦР, приводится на рисунке 1, который является полезным для последующий анализ. Как важный шаг, Южный blotting, подготовленные и переваривается геномной ДНК должны быть разделены на ДНК гель для обнаружения зондом. Потому что геномной ДНК вырезаются в много фрагментов с разной длины, они отображают статус мазок как на ДНК гель, предлагая полный пищеварение геномной ДНК, как указано на рисунке 2. В качестве последнего шага в Южный blotting сигналы радиоактивности меченых зонд гибридизировать с целевой фрагмент ДНК показаны на фильм, которые отражают события HR в ES клоны, тем самым, указывающее, является ли клон ES нужную. Согласно эскизный проект в этом исследовании ES клоны с мутировал аллеля имеют два различных размер полосы, в то время как одичал типа ES клонов есть только одна группа, предлагая желаемого ES клоны являются гетерозиготной (рис. 3). Относительно процедуры и результатов Южный blotting, операции и результаты ПЦР простой и прямой. После реакции PCR, продукты PCR может быть проанализирован на геле ДНК. Если диапазоны PCR являются конкретными и секвенирования клонированные продукты PCR подтверждает наличие частичной последовательности целевых вектора как нео сопротивление ген, а также геномной регионы, которые являются просто вне гомологии руку, может быть возникновение события HR ожидается и проверки (рис. 4).
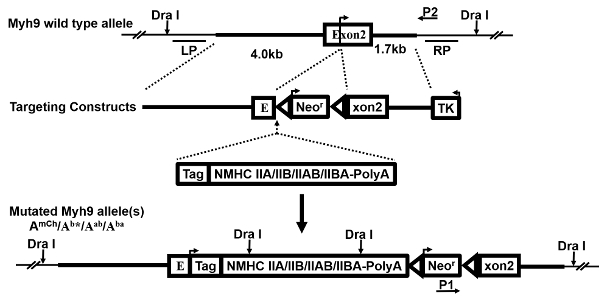
Рисунок 1 : Ориентация конструкций. Это схема, демонстрируя поколения нескольких таргетинга конструкций. Аллель гена Myh9 (WT) одичал тип, ген ориентация вектора, замена экзогенных выражение cassette(s) и результирующая мутировавших allele(s), а также датчики (LP, RP) для Южная помарка и грунтовки (P1, P2) для ПЦР, показано и описано ранее 27. стрелка на экзона 2 указывает сайт трансляционная посвящения. После успешного наступления HR, кассета выражение замены и сопротивления гена неомицина (Neor) вставляются только 5' о вызывающей кодон ГПТ. Таким образом нарушается эндогенного аллеля Myh9 и постучал в gene(s) является/выражаются в мутантные клетки и мышей. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2 : Переваривается геномной ДНК с Dra I. Геномная ДНК от ES клоны с конструкцией, заменив NMHC II-A II-B, переваривается с Dra я и, затем, разделенных электрофорез на геле агарозы. Мазок как усваивается геномная ДНК наблюдается. C1 - C8 изображают индивидуальных клонов ES. Полное усвоение геномная ДНК производит много фрагментов ДНК с разной длины, тем самым показ мазок как изображения. Этот результат отражает хорошее качество подготовленных gDNAs и полноты пищеварение. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3 : Представитель результаты Южный blotting. Эти панели показывают Южный blotting показ геномной ДНК от ES клоны ориентированы с помощью конструкции замены NMHC II-A II-AB, с помощью левой и правой зондов. Мутировавших аллеля показывает группу 12.1 или 6 КБ используется зонд левой или правой зонд, соответственно, в то время как WT показывает полосу 9.7 КБ. M: маркер; PC1-PC5: позитивные клоны; NC: отрицательные клон. Также указаны размеры Южный blotting полос. Строго выполняются все процедуры Южный blotting и специфика зонды вполне достаточно; Там должно быть без неспецифические предпологаете полос для ожидаемого полос. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
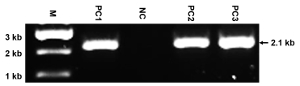
Рисунок 4 : Представитель результаты ПЦР. Эта панель показывает ПЦР выявления геномной ДНК от ES клоны ориентированы с помощью конструкции замены NMHC II-A II-BA с помощью пары праймера P1 + P2. Мутировавших аллеля дает группе 2.1 КБ, в то время как аллель WT дает не группы. M: маркер; PC1-PC3: позитивные клоны; NC: отрицательные клон. Также указывается размер группы ПЦР. Так как праймеры предназначены только обнаружить мутировавших аллеля, внешний вид одного и ожидаемые группы отражает специфику праймеры и высокое качество подготовленных gDNAs. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
В настоящее время дизайнер nucleases для изменения генома до сих пор не может заменить ES клеток ген ориентация технологии из-за своих проблем-целевого воздействия, и трудности в вставке длинный ДНК фрагмента30,31. Как Золотой методы для выявления HR события, которые произошли в клетки мыши ES этот доклад содержит подробный протокол Южный blotting и ПЦР для поля. Мы проверить надежность этих методов путем анализа индивидуальных клонов из клеток ES мыши с ряда конструкций. Желаемого ES клоны, выявленных этими методами успешно использовался для создания соответствующего мыши модели27.
Хотя другие методы для отбора целевых ES клонов были описаны19,32, Южный blotting методы и ПЦР нельзя полностью заменить те впоследствии установлены32, потому что эти первоначальные методы имеют более прикладной историю и широко признается и подтверждается научного общества, осуществляется большинство биологических лабораторий и происхождения других технологий. Важно отметить, что хорошую производительность Южный blotting и ПЦР в определении событий HR хорошо проявляется в предыдущей работе29. Результаты от Южный blotting показывают несколько уникальных особенностей: среди случайно отобранных ES клонов, свыше 90% из них являются нужные, обнаруживаются не неспецифических полос и HR произошло преимущественно на один аллель гена Myh9. Тем временем данные PCR, вместе с последовательности, подтверждают, что возникновение событий HR участкам и матч хорошо с теми, от Южный blotting.
Согласно нашей практике следует учитывать несколько факторов при Южный blotting и ПЦР-анализа используются для идентификации события HR в ES клеток, тем самым получать хорошие и ожидаемые результаты. Первый из них — длина гомологии оружия; в целом увеличение длины рукоятки гомологии позволит повысить эффективность HR33. Однако это не всегда так. С одной стороны больше оружия увеличить сложность манипуляции; с другой стороны длина оружия гомологии (4 КБ для левой руки и 1.7 kb для правую руку) сообщили здесь привело к высокой частотой HR, полученные до настоящего времени среди подобных экспериментов. Кроме того разумной продолжительности гомологии оружия содействует выявлению методом ПЦР. Вторым является использование isogenic ДНК для подготовки гомологии оружия и Южный blotting зонды34. Это могут быть удовлетворены, заказав клонов BAC, содержащий области гена интереса или с использованием геномной ДНК из клеток, намеревался быть ориентированы. В-третьих, выбор подходящего REs для переваривания геномной ДНК. В общем один RE или комбинация двух REs, которые сократить одичал тип или Мутантный аллель только один или два раза вокруг ориентации региона являются предпочтительными; Кроме того результирующий фрагмент ДНК больше не должен превышать 15 КБ и размер отдельных фрагментов ДНК отличается от более чем 2 КБ. Эти требования могут облегчить разделения и идентификации ожидаемых полос, Южный blotting. Четвертый — длина зондов и наименее сходство с другими последовательностями в геноме. Как правило длина зондов составляет 500 – 1000 bp. Сходство с другими последовательностями в геноме могут быть проанализированы с программой NCBI взрыва. Кроме того программное обеспечение для проектирования, зонды для Южный blotting был описан35. Пятый фактор, чтобы рассмотреть является использовать обычные методы для подготовки геномной ДНК для повышения урожайности. Геномной ДНК, приготовленных из вырожденная хорошо 48-ну пластины, как правило, достаточно, по крайней мере двух раундов Южный blotting анализов. А проектирование праймеры PCR, лучшая стратегия заключается в использовании одного праймера настоящего на маркер выделения в сочетании с грунтом вне нацеленности оружия. Кроме того последовательность продуктов PCR имеет важное значение для доказательства HR события20,36. Примечательно на основе ПЦР скрининг не может полностью заменить информацию, полученную через Южный blotting, хотя она может эффективно уменьшить количество клонов оцениваться.
В заключение Южный blotting и ПЦР являются четко продемонстрировали методы для отбора клонов ES для выявления HR-опосредованной ген таргетинг события в ES клеток. Хотя подробный протокол, описанные здесь главным образом сосредоточены на скрининг желаемого Нм II генетических замена ES клонов, он может использоваться для генотипирования мышей, которые впоследствии создаются с использованием позитивного клонов ES. Она может быть легко адаптирована к идентификации события HR в других типах клеток, таких как клетки iPS или соматические клетки.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Эта работа получила поддержку Генеральной программы национального фонда естественных наук Китая (гранты № 31571432), человека провинциальных фонд Китая по естественным наукам (Грант № 2015JC3097) и исследовательский фонд образования бюро Хунань Провинция, Китай (Грант № 15 K 054).
Материалы
| Name | Company | Catalog Number | Comments |
| BAC CLONE | BACPAC Resources Center (BPRC) | bMQ-330E21 | |
| QIAGEN Large-Construct Kit | QIAGEN | 12462 | |
| QIAquick Gel Extraction Kit | QIAGEN | 28704 | |
| QIAquick PCR Purification Kit | QIAGEN | 28104 | |
| QIAprep Spin Miniprep Kit | QIAGEN | 27104 | |
| QIAGEN Plasmid Plus Maxi Kit | QIAGEN | 12963 | |
| PfuUltra High-Fidelity DNA Polymerase | Agilent | 600382 | |
| T-easy vector | Promega | A1360 | |
| Nuclei Lysis Solution | Promega | A7941 | |
| Protein Precipitation Solution | Promega | A7951 | |
| DNA Denaturing Solution | VWR | 351-013-131 | |
| DNA Neutralizing Solution | VWR | 351-014-131 | |
| Ready-To-Go DNA Labeling Beads (-dCTP) | VWR | 27-9240-01 | |
| UltraPure SSC, 20x | Thermo Fisher | 15557036 | |
| UltraPur Phenol:Chloroform:Isoamyl Alcohol (25:24:1, v/v) | Thermo Fisher | 15593031 | |
| G418 | Thermo Fisher | 10131035 | |
| Salmon Sperm DNA Solution | Thermo Fisher | 15632011 | |
| Platinu Taq DNA Polymerase High Fidelity | Thermo Fisher | 11304029 | |
| Not I | Thermo Scientific | ER0592 | |
| Dra I | Thermo Scientific | ER0221 | |
| EcoR I | Thermo Scientific | ER0271 | |
| Ganciclovir | Sigma | G2536 | |
| Whatman TurboBlotter Transfer System, Large Kits | Fisher Scientific | 09-301-188 | |
| [α32P]dCTP | PerkinElmer | NEG013H100UC | |
| ProbeQuan G-50 Micro Columns | GE Healthcare | 28-9034-08 | |
| Hybrisol I Hybridization Solution | Millipore | S4040 | |
| Kodak X-Ray Film | Z&Z Medical | 844 5702 |
Ссылки
- Gao, G., McMahon, C., Chen, J., Rong, Y. A powerful method combining homologous recombination and site-specific recombination for targeted mutagenesis in Drosophila. Proceedings of the National Academy of Sciences of the United States of America. 105 (37), 13999-14004 (2008).
- Skarnes, W., et al. A conditional knockout resource for the genome-wide study of mouse gene function. Nature. 474 (7351), 337-342 (2011).
- Vogel, G. Nobel Prizes. A knockout award in medicine. Science. 318 (5848), 178-179 (2007).
- Salsman, J., Dellaire, G. Precision genome editing in the CRISPR era. Biochemistry. Cell Biology. 95 (2), 187-201 (2017).
- Capecchi, M. Gene targeting in mice: functional analysis of the mammalian genome for the twenty-first century. Nature Reviews Genetics. 6 (6), 507-512 (2005).
- Van, d. W. L., Adams, D. J., Bradley, A. Tools for targeted manipulation of the mouse genome. Physiological Genomics. 11 (3), 133-164 (2002).
- Glaser, S., Anastassiadis, K., Stewart, A. F. Current issues in mouse genome engineering. Nature Genetics. 37 (11), 1187 (2005).
- Bradley, A., Evans, M., Kaufman, M. H., Robertson, E. Formation of germ-line chimaeras from embryo-derived teratocarcinoma cell lines. Nature. 309 (5965), 255-256 (1984).
- Robertson, E., Bradley, A., Kuehn, M., Evans, M. Germ-line transmission of genes introduced into cultured pluripotential cells by retroviral vector. Nature. 323 (6087), 445-448 (1986).
- Thomas, K. R., Capecchi, M. R. Site-directed mutagenesis by gene targeting in mouse embryo-derived stem cells. Cell. 51 (3), 503-512 (1987).
- Skarnes, W. C., et al. A conditional knockout resource for the genome-wide study of mouse gene function. Nature. 474 (7351), 337 (2011).
- Collins, F. S., Rossant, J., Wurst, W. A mouse for all reasons. Cell. 128 (1), 9-13 (2007).
- Poueymirou, W. T., et al. F0 generation mice fully derived from gene-targeted embryonic stem cells allowing immediate phenotypic analyses. Nature Biotechnology. 25 (1), 91-99 (2007).
- Pettitt, S. J., et al. Agouti C57BL/6N embryonic stem cells for mouse genetic resources. Nature Methods. 6 (7), 493-495 (2009).
- Gertsenstein, M., et al. Efficient Generation of Germ Line Transmitting Chimeras from C57BL/6N ES Cells by Aggregation with Outbred Host Embryos. PLoS One. 5 (6), 11260 (2012).
- Smithies, O., Gregg, R. G., Boggs, S. S., Koralewski, M. A., Kucherlapati, R. S. Insertion of DNA sequences into the human chromosomal |[beta]|-globin locus by homologous recombination. Nature. 317 (6034), 230-234 (1985).
- Deng, C., Capecchi, M. R. Reexamination of gene targeting frequency as a function of the extent of homology between the targeting vector and the target locus. Molecular & Cellular Biology. 12 (8), 3365 (1992).
- Lay, J. M., Friishansen, L., Gillespie, P. J., Samuelson, L. C. Rapid confirmation of gene targeting in embryonic stem cells using two long-range PCR techniques. Transgenic Research. 7 (2), 135-140 (1998).
- Langerak, P., Nygren, A. O. H., Schouten, J. P., Jacobs, H. Rapid and quantitative detection of homologous and non-homologous recombination events using three oligonucleotide MLPA. Nucleic Acids Research. 33 (22), 188 (2005).
- Gómezrodríguez, J., et al. Advantages of q-PCR as a method of screening for gene targeting in mammalian cells using conventional and whole BAC-based constructs. Nucleic Acids Research. 36 (18), 117 (2008).
- Kim, H. S., Smithies, O. Recombinant fragment assay for gene targeting based on the polymerase chain reaction. Nucleic Acids Research. 16 (18), 8887-8903 (1988).
- Joyner, A. L., Skarnes, W. C., Rossant, J. Production of a mutation in mouse En-2 gene by homologous recombination in embryonic stem cells. Nature. 338 (6211), 153-156 (1989).
- Ma, X., Adelstein, R. S. The role of vertebrate nonmuscle Myosin II in development and human disease. Bioarchitecture. 4 (3), 88-102 (2014).
- Malonek, D. Relationships between the dynamics of cortical blood flow, oxygenation, and volume changes following sensory stimulation. Proceedings of the National Academy of Sciences of the United States of America. 94, (1997).
- Takeda, K., Kishi, H., Ma, X., Yu, Z. X., Adelstein, R. S. Ablation and mutation of nonmuscle myosin heavy chain II-B results in a defect in cardiac myocyte cytokinesis. Circulation Research. 93 (4), 330-337 (2003).
- Conti, M. A., Evenram, S., Liu, C., Yamada, K. M., Adelstein, R. S. Defects in cell adhesion and the visceral endoderm following ablation of nonmuscle myosin heavy chain II-A in mice. Journal of Biological Chemistry. 279 (40), 41263-41266 (2004).
- Wang, A., et al. Nonmuscle myosin II isoform and domain specificity during early mouse development. Proceedings of the National Academy of Sciences of the United States of America. 107 (33), 14645-14650 (2010).
- Zhang, Y., et al. Mouse models of MYH9-related disease: mutations in nonmuscle myosin II-A. Blood. 119 (1), 238 (2012).
- Liu, T., et al. Identification and characterization of MYH9 locus for high efficient gene knock-in and stable expression in mouse embryonic stem cells. PLoS One. 13 (2), 0192641 (2018).
- Saito, S., Adachi, N. Advances in the Development of Gene-Targeting Vectors to Increase the Efficiency of Genetic Modification. Biological & Pharmaceutical Bulletin. 39 (1), 25-32 (2016).
- Langerak, P., Nygren, A., Schouten, J., Jacobs, H. Rapid and quantitative detection of homologous and non-homologous recombination events using three oligonucleotide MLPA. Nucleic Acids Research. 33 (22), 188 (2005).
- Martin, S. L., et al. A single amino acid substitution in ORF1 dramatically decreases L1 retrotransposition and provides insight into nucleic acid chaperone activity. Nucleic Acids Research. 36 (18), 5845-5854 (2008).
- Kamisugi, Y., Cuming, A. C., Cove, D. J. Parameters determining the efficiency of gene targeting in the moss Physcomitrella patens. Nucleic Acids Research. 33 (19), 173 (2005).
- Luo, Y., Bolund, L., Sørensen, C. B. Pig gene knockout by rAAV-mediated homologous recombination: comparison of BRCA1 gene knockout efficiency in Yucatan and Göttingen fibroblasts with slightly different target sequences. Transgenic Research. 21 (3), 671-676 (2012).
- Croning, M. D., Fricker, D. G., Komiyama, N. H., Grant, S. G. Automated design of genomic Southern blot probes. BMC Genomics. 11 (1), 74 (2010).
- Zimmer, A., Gruss, P. Production of chimaeric mice containing embryonic stem (ES) cells carrying a homoeobox Hox 1.1 allele mutated by homologous recombination. Nature. 338 (6211), 150-153 (1989).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены