Method Article
Следственный млекопитающих Axon регенерации: В Vivo электропорации взрослых мыши Спинной корень ганглия
В этой статье
Резюме
Электропорация является эффективным подходом для доставки генов интересов в клетки. Применяя этот подход в естественных условиях на нейроны взрослых мыши корневой спинной ганглий (DRG), мы описываем модель для изучения регенерации аксона в естественных условиях.
Аннотация
Электропорация является основных не вирусных генов трансфекции подход к внедрению ДНК плазмиды или малых молекул РНК в клетки. Сенсорного нейрона в корень спинной ганглий (ДРГ) расширяет один Аксон с двумя ответвлениями. Одна ветвь идет к периферической нерв (периферийные отделения) и другие отрасли входит спинного мозга через спинной корень (Центральный сектор). После нейронных травмы периферийное отделение надежно восстанавливает в то время как Центральный филиал не регенерировать. Из-за высокой регенеративной способностью сенсорные аксона регенерации широко использовался как модель системы для изучения млекопитающих аксона регенерации в периферической нервной системы (ПНС) и центральной нервной системы (ЦНС). Здесь мы описываем ранее установленных подход протокол манипулировать экспрессии генов в зрелых сенсорных нейронов в естественных условиях через электропорации. Основываясь на трансфекции плазмид или малых РНК oligos (малые интерферирующие РНК или микроРНК), подход позволяет для обоих - и получить из функция потерь экспериментов для изучения роли генов интересов или микроРНК в регуляции регенерации аксона в естественных условиях. Кроме того манипуляции ген выражение в естественных условиях может управляться в пространственном и временном отношении в течение относительно короткого времени курс. Эта модель система обеспечивает уникальный инструмент для изучения молекулярных механизмов, которыми регенерации аксона млекопитающих является регулируемой в естественных условиях.
Введение
Травмы в нервной системе, вызванные нейронных травмы или различных нейродегенеративные заболевания обычно приводят в дефекты в моторные, сенсорные и когнитивные функции. Недавно много усилий была посвящена регенеративных потенции воссоздания в взрослых нейронов для восстановления физиологической functionsof ранения нейронов1,2,3. Сенсорные нейроны в DRG-группа нервных клеток, которые передают разные сенсорные стимулы, такие как боль, температура, touch или позы тела, мозг. Каждый из этих нейронов псевдо-однополярного и содержит один Аксон, который может разветвлять каждой присваивать с одной ветви, расширение к периферии и другая ветвь, направляясь в спинном4. Среди нескольких зрелых млекопитающих нейронов, известный регенерировать их аксоны активно после травмы взрослых сенсорных нейронов в ГДК. Следовательно травм сенсорные аксоны широко применялись как ключевую модель для изучения механизмов аксональное регенерации в vivo.
В естественных условиях Гене transfection методов, которые обычно меньше времени настроить и более гибким, чем при использовании трансгенных животных, играют важную роль в изучении функций генов и сигнальные пути в нервной системе. Основные методы могут быть разделены на два подхода: на основе документа и вирус5. Вирусные основанный в vivo гена доставки в взрослых нейронов может предоставить точные пространственно-временных манипуляции ген выражение6. Однако трудоемкие процессы участвуют в Вирусный на основе методов, например производства и очистки вирусных частиц, содержащий нужный ген. Кроме того многие вирусных векторов может активировать иммунную систему хозяина, который может повлиять на сбор данных, анализ данных и возможно заблуждение интерпретации экспериментальных результатов. Электропорация, типичный инструмент основе трансфекции подход, использует электрического импульса увеличить проницаемость клеток и ядерной мембраны временно, что способствует приток гена векторов или малых РНК oligos из пространства вне клетки7 . В vitro электропорации широко признается как временной, но весьма эффективные стратегии для манипулирования целевых генов выражение во многих типах клеток. Хотя в vivo электропорации приводит лишь к экспрессии генов переходные с низкой transfecting эффективности по сравнению с вирусных векторов, он имеет различные преимущества над вирусные подходы. Например он может применяться для почти всех тканей и клеток,7,8,9. Кроме того, либо плазмид, кодирование генов интерес или малые РНК oligos (например, малые интерферирующие РНК, микроРНК) против некоторых стенограммы можно непосредственно впрыскивается в ткани-мишени и затем электрически пульсирующий, которые делают процедуру меньше труда - и время - потребителями. Кроме того transfecting несколько плазмидов и РНК oligos одновременно с одной электропорации Возможен экспорт.
Мы создали в vivo электропорации подход к манипулировать экспрессии генов в взрослых мыши сенсорных нейронов и успешно применяется и проверки такой подход в многочисленных пионер исследований1,2,3 ,8,10. Здесь мы представляем подробный протокол для облегчения использования данного подхода для будущих исследований млекопитающих аксона регенерации.
протокол
Все эксперименты на животных были проведены в соответствии с животных протоколом, утвержденным Джонса Хопкинса институциональных животное уход и использование Комитетом.
1. материалы и реагенты
-
Животные
- Используйте шесть week-old мышей женского CF1 весом 30-35 g для экспериментов.
Примечание: Мышей были размещены группа (5 мышей в клетке) в отдельности вентилируемых стерилизованные клетки с 1/4" кукурузного початка кроватей и 2» квадратных nestlets для гнездования. Клетки были сохранены в цикле свето тени управляемой 12-h и комнатной температуре между 19,4 ° C и 25 ° C. Мышей кормили с глобальной грызунов диеты и автоматические системы водоснабжения.
- Используйте шесть week-old мышей женского CF1 весом 30-35 g для экспериментов.
-
Инструменты
- Используйте следующие хирургические инструменты эффективно проводить операции: шприцы (27 G, 1.0 мл) для внутрибрюшинной инъекции, мех машинку, рассечение стерео Микроскоп, щипцы микро хирургия, микрохирургия ножницы и мелких костей rongeurs и стерилизовать нетканый губки.
Примечание: Все документы и материалы газобетона до операции или предварительно стерилизованные производителями. Во время операции инструменты распыляется с 75% спирта для поддержания стерилизации.
- Используйте следующие хирургические инструменты эффективно проводить операции: шприцы (27 G, 1.0 мл) для внутрибрюшинной инъекции, мех машинку, рассечение стерео Микроскоп, щипцы микро хирургия, микрохирургия ножницы и мелких костей rongeurs и стерилизовать нетканый губки.
-
Цистит решения
- Используйте анестезирующий раствор #1 чтобы побудить анестезии и использовать решение #2 анестезии перед инъекцией DRG для поддержания анестезии.
- Чтобы сделать анестезирующий раствор #1, разбавляют кетамина и ксилазина в стерильного физиологического раствора в конечной концентрации 10 мг/мл и 1,2 мг/мл.
- Чтобы сделать анестезирующий раствор #2, разбавляют Авертен стерильного физиологического раствора в конечной концентрации 20 мг/мл.
- Используйте анестезирующий раствор #1 чтобы побудить анестезии и использовать решение #2 анестезии перед инъекцией DRG для поддержания анестезии.
-
Плазмида ДНК и РНК Oligos
- Подготовьте плазмид, с использованием коммерческих комплект соответственно следующие протоколы производителя. Разбавьте плазмида ДНК в стерильных деионизированной воды до концентрации 2,0 мкг/мкл.
- Добавить быстро зеленый краситель решение для достижения конечной концентрации 0,005-0,01% (v/v) для лучшей визуализации набросков DRG во время инъекции.
- Растворите siRNA и микроРНК oligos в соответствующие буферы, предоставляемые производителями для достижения конечной концентрации на 50 мкм.
-
Микро инъекции пипетки
- Вытяните капиллярного стекла с помощью съемника микропипеткой и отрезать кончик вытащил капиллярные стеклянные пипетки с ножницами микрохирургии для создания отверстие с наружным диаметром приблизительно 50 мкм. Затем примерно стерилизации стеклянной пипетки под УФ светом на лавочке чистой для 20-30 мин.
- Гора, стерилизованные стеклянные пипетки на держателе пипеткой подключен к внутриклеточной микроинъекции отказаться от системы. Задайте параметры системы микроинъекции на 30 psi давления и 8 МС продолжительность.
-
Электропорация системы
- Подключить электроды к системе электропорации квадратные волны и установите следующие параметры: 15 мс импульсов на 35 V с 950 мс интервалами для электропорации в естественных условиях .
-
Перфузии и исправление решения
- Растворите порошок параформальдегида (PFA) в однократном ПБС в концентрации 4% (w/v). Магазин PFA решение при 4 ° C.
2. экспериментальные методы
-
Хирургическое воздействие L4 и L5 ГДК
- Анестезировать мыши, с помощью внутрибрюшинного введения анестезирующий раствор #1 подготовлен ранее (с кетамина 100 мг/кг веса тела и ксилазина 12 мг/кг веса тела).
- Бритье хирургические области с мехом машинку.
Примечание: Поскольку там будет другой хирургии для левой седалищного нерва раздавить, мех левый задний приколенный набедренный может быть выбрит одновременно. - Поместите курсор мыши на подогревом одеяло (35,0 ° C) и контролировать ректальной температуры с датчика температуры.
- Чтобы проверить анестезии, щепотку пальцев и хвост мыши и наблюдать поведенческих реакций.
- Лента четыре конечности мыши на пробковой доске.
- Протрите области хирургического раствором йодофора, а затем с 75% алкоголя, чтобы удалить йодофора до резки кожи.
- Примените глазная мазь на глаза, чтобы предотвратить сухость под наркозом.
- Перед разрез Марк обе стороны подвздошные гребни с тонкой маркер. Нарисуйте линию, соединяющую две точки подвздошные гребни для облегчения выявления позиций L5 ГДК.
- Сделайте 3 см разрез вдоль средней линии нижней части спины с микро ножницы. Кроме того отсоединить paraspinous мышц, таких как musculus multifidus и musculus длиннейшая мышца поясницы, от L3 для S1 остистых отростков и разоблачить фасеточных суставов L4-5 и L5-6.
- Использование микро rongeur для удаления фасеточных суставов L4-5 и L5-6. Кроме того удалите левой арки нейронные L4 и L5 подвергать спинной стороне ГДК.
-
DRG инъекций
- Придать анестезирующий раствор #2 (с Авертен 200 мг/кг веса тела) внутрибрюшинно для поддержания анестезии перед инъекцией DRG.
- Загрузите ДНК плазмиды или РНК oligos (1 мкл на DRG) в стеклянные капиллярные пипетки.
- Вставьте наконечник пипетки стеклянные капиллярные тщательно DRG.
- Постепенно внедрить 1.0 мкл раствора ДНК плазмиды или oligos РНК в DRG, используя внутриклеточных микроинъекции обойтись системы (30 psi, 8 мс).
Примечание: Продолжительность впрыска должно продолжаться не менее 5 минут.
-
Электропорация
- Падение PBS на советы электродов.
- Очистьте вверх кровотечение с стерилизованные квадратных хлопчатобумажной марли.
- Сожмите целевой DRG с электродами мягко и применить 5 квадратная электрических импульсов с системой электропорации.
- Закройте мышцы и кожу слои соответственно с 5-0 нейлон швами.
- Поместите курсор мыши на подогревом одеяло (35,0 ° C) под пристальное внимание до тех пор, пока он полностью сознание достаточно для поддержания грудной recumbency. Мышь можно вернуться домой клетку после того, как он полностью оправился от анестезии.
Примечание: Занимает около 60 минут для мыши, чтобы полностью оправиться от анестезии на 37 ° C одеяло. Растворите один ибупрофен таблетки (200 мг) в 1000 мл воды (0,2 мг/мл) для ежедневного кормления для облегчения послеоперационные боли.
-
Crush седалищного нерва
- Два или три дня (в зависимости от экспериментальный дизайн) после DRG электропорация, анестезировать мыши внутрибрюшинно с анестезирующий раствор #2 (с Авертен 400 мг/кг веса тела).
- Лента четыре конечности мыши на пробковой доске.
- Сделать разрез 1 см 0,5 см с левой стороны вдоль средней линии. Сокращение мышц, таких как большая ягодичная мышца и грушевидной мышцы, продольно. Разоблачить сегмент седалищного нерва между большей седалищного отверстия и седалищного нерва паз.
- Раздавить нерва с щипцами микрохирургии для 12 s и Марк раздавить сайт с 10-0 нейлон epineural швом. Сделайте узел на дурального мембраны для обозначения сайта поклонников.
- Закройте слои мышц и кожи с швом нейлона 5-0.
- Поместите курсор мыши на подогревом одеяло (35,0 ° C) с уделением пристального внимания до тех пор, пока он полностью сознание достаточно для поддержания грудной recumbency. Мышь можно вернуться домой клетку после того, как он полностью оправился от анестезии.
Примечание: Занимает около 60 минут для мыши, чтобы полностью оправиться от анестезии на 37 ° C одеяло. Растворите один ибупрофен таблетки (200 мг) в 1000 мл воды (0,2 мг/мл) для ежедневного кормления для облегчения послеоперационные боли.
-
Мышь перфузии, DRG и урожай седалищного нерва
- Два или три дня после раздавить седалищного нерва (в зависимости от экспериментальный дизайн), анестезировать мыши внутрибрюшинно с анестезирующий раствор #2.
- Perfuse transcardially мыши с PBS (рН 7,4) следуют ледяной параформальдегида 4% (PFA) (рН 7,5) в PBS.
- После перфузии отдельные ДРГ вместе с нервных корешков и седалищного нерва до колена тщательно с микро ножницы и микро щипцы под микроскопом рассечение. Место седалищного нерва непосредственно в 4%, PFA на ночь при 4 ° C.
-
Изображений и измерение флуоресцировани обозначенного сенсорные аксоны
- Сдирать прилагаемый ткань и мембраны на фиксированной седалищного нерва с микро ножницы и микро пинцет тщательно под микроскопом рассечение. Затем, Обмен 4% PFA с PBS и мыть нерва три раза.
- Поместите седалищного нерва на слайде и держите прямо. 80 мкл раствора antifade вокруг нерва, потом лежали coverslip на нем. Свести все смонтированные ткани с давлением.
- Место flattened тканей на Перевернутый epifluorescent микроскоп оснащен аксессуар для приобретения мозаика и обработки изображений.
Примечание: Длина возбуждения и выбросов являются 488 нм и 509 Нм. Это также возможно взять несколько перекрывающихся изображений вручную и стежка фотографии вместе с помощью ImageJ с мозаика плагина. - При измерении длины регенерированный аксонов, проследить все безликим fluorescently меченых аксоны в седалищный нерв от раздавить сайта (отмечены 10-0 epineural швом) в дистальной аксона концы.
Результаты
Для количественного определения цитотоксичность текущего протокола и проверить что трансфекции в vivo DRG электропорации высок процент достаточно, мы вводили и electroporated дневно тегами микроРНК или малых интерферирующих РНК в L4 и L5 ГДК. Отдельностоящий ДРГ были обработаны через крио резании и иммуногистохимии (рис. 1A-B). При оценке выживаемость клеток после инъекции и электропорация, нетронутыми ДРГ L4 и L5 были собирают и обрабатываются через крио резании и иммуногистохимии. Нейрон плотности, отражение с Tuj1 окрашивание, не показали значительные различия по сравнению с плотностями нейрон нетронутыми ДРГ, который указывает, что электропорации не вызывают гибель нейронов клеток (рис. 1C). Трансфекция ставка была рассчитана как соотношение между числом нейронов тегами oligo РНК и количество нейронов Tuj1-положительных. Средняя трансфекции Мирна составляет 80,7% 4,3 ± и siRNA 94,2 ± 0,3% (рис. 1D). При применении для изучения регенерации аксона текущий метод электропорации в естественных условиях , седалищный нерв был плоский и образы. Каждый регенерации аксона с отличительной траектории и узнаваемым дистальной аксона конец можно проследить от раздавить сайта указывается узел шов (рис. 2). Кроме того, мы electroporated ДРГ с EGFP плазмидов и собирают спинного T7 для L2 вместе с корнями спинной L4 и L5 после 7 дней. Мы использовали прочные ткани, очистка протокол — uDISCO для очистки спинного11. Аксоны EGFP-меченых спинной столбца спинного мозга были образы с помощью конфокального микроскопа и идентифицированы в продольном и сагиттальной проецировать изображения (рис. 3). Кроме того конфокальная изображения могут быть обработаны с программного обеспечения для визуализации микроскопии реконструировать трехмерное изображение (фильм 1).

Рисунок 1 : Иммуногистохимия DRG крио-секции после электропорации дневно тегами неспецифической siRNA и микроРНК в vivo. (A) представитель cryo-Секция DRG ткани вводят и electroporated с дневно тегами микроРНК непромысловых (Dy547). Левое изображение: изображение флуоресцентного сигнала (красный цвет) дневно тегами микроРНК непромысловых (Dy547). Средний изображение: иммуно окрашивание (зеленый цвет) Tuj1 с Alexa488 Флюорофор на вторичное антитело. Правое изображение: объединенное изображение предыдущих двух каналов. Шкалы бар = 100 µm.()B) представитель cryo-Секция DRG ткани вводят и electroporated с дневно тегами (Cy3) непромысловых малые интерферирующие РНК. Левое изображение: изображение флуоресцентного сигнала (красный цвет) дневно тегами (Cy3) непромысловых малые интерферирующие РНК. Средний изображение: иммуно окрашивание (зеленый цвет) Tuj1 с Alexa488 Флюорофор на вторичное антитело. Правое изображение: объединенное изображение предыдущих двух каналов. Шкалы и представляет 100 µm. (C) плотность нейрон нетронутыми DRG крио-секции является 809.6 ± 14.2 клеток/мм2 (N = 6) и крио раздел вводят DRG 801.6 ± 27,4 клеток/мм2 (N = 6), означает ± SEM, студента t-теста, NS: нет значение. Три мышей были выполненных в vivo помощью электропорации DRG на левом L4 и L5 ДРГ с тегами siRNA. Левый и правый L4 и L5 ДРГ собирают после 48 ч и обрабатываются через крио секции и иммуногистохимии. Каждый DRG был секционного приблизительный 60 ломтиками и толщина среза составляет 10 мкм. Три ломтика каждого DRG отобраны 200 мкм и среднем. (D) скорость трансфекции тегами Мирна является 80.7 ± 4,3% (N = 4) и тегами siRNA 94,2 ± 0,3% (N = 6), означает ± SEM. Три мышей были выполненных в vivo помощью электропорации DRG на левом L4 и L5 ДРГ с тегами siRNA и двух мышей с тегами Мирна. КЗГ собирают после 48 ч и обрабатываются через крио секции и иммуногистохимии. Каждый DRG был секционного приблизительный 60 ломтиками и толщина среза составляет 10 мкм. Три ломтика каждого DRG отобраны 200 мкм и среднем. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2 : Ectopically выраженной EGFP отображает заново нейрональные аксоны в седалищного нерва после дробления травмы. Аксоны в плоский седалищного нерва, страдает от травмы раздавить помечены с EGFP (зеленая Флуоресценция) перевезены из СОСМ аксоны. Красная линия показывает положение непосильное травмы сайта, который ознаменовался первоначально хирургическим путем сшивания узел. Белая стрелка, стрелка и звезда указывают три отличительные аксона заканчивается, все из которых простираются от сайта поклонников. Шкалы бар = 500 мкм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
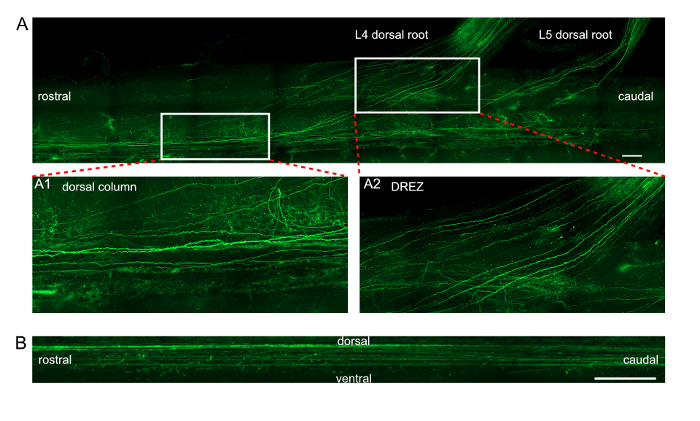
Рисунок 3 : Проекция изображения EGFP-выражая аксоны в спинном мозге после в vivo электропорации ДРГ. (A) продольной проекция EGFP-меченых аксоны в столбце спинной и L4/L5 спинной корни. Вставка изображения А1 и А2 Показать увеличенное представления двух прямоугольных областей, отмеченные в панель (A). A1 экспонаты для детального просмотра аксоны в столбце спинной. A2 экспонаты для детального просмотра аксоны в зоне входа Спинной корень (DREZ). Шкалы бар = 200 µm. (B) сагиттальной проекции EGFP-меченых аксоны в столбце спинной. Шкалы бар = 50 µm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Фильм 1: 3D реконструкция EGFP-выражая аксоны в спинном мозге после в vivo электропорации ДРГ. Пожалуйста нажмите здесь, чтобы посмотреть это видео. (Правой кнопкой мыши для загрузки.)
Обсуждение
Несколько хирургических шаги требуют особого внимания. L4 и L5 ГДК (местоположение СОСМ), которые доминируют седалищного нерва, должны быть правильно определены и вводят с Джин конструкции. В противном случае, будет отсутствовать GFP-маркировки в аксонов седалищного нерва. Подвздошные гребни может рассматриваться как полезные анатомические ориентиры для точного определения L4 и L5 ГДК. В большинстве мышей приуроченный к подвздошные гребни12аспект совместной между L5 и L6 позвонков. Кроме того L3 DRG может быть выбран вместо L5, особенно для анализов, например иммуногистохимия или западную помарку13, как хирургическое воздействие L5 DRG обычно встречается большие трудности из-за глубокой местоположение и богатые кровоснабжение. Кроме того весь операции следует избегать повреждения DRG окружающих структур, в том числе спинного мозга и нервных корешков. Второй важнейший шаг оперативной отметить является инъекции. Быстрая зеленая краска была смешана с решения гена конструкций для визуализации решение выбрасывается из иглы и диффузной в DRG. Успешный инъекции следует показать ясно раунд форма DRG, изложенные Люминесцентную краску. Если решение с Люминесцентная краска просачивается от DRG во время инъекций, back-and-forth доработки на глубине кончик микро иглы могут обеспечить полный инъекции все решения в капсуле DRG. Избегайте, пронзающий DRG на более чем трех разных объектах. Кроме того, мягкий кровотечение обычно неизбежным после инъекции DRG, как ДРГ жестко инкапсулированы с rete venosum13. Важно остановить кровотечение, так что не будет крови, изолирующие поверхности DRG от электродов во время электропорации. Успешное электропорации зависит от электрического текущего трансдукции, и PBS решение может применяться на электроде. Наконец, сайт на седалищный нерв где измельчается с щипцами должны быть помечены микро сшивания, потому что места повреждения невидим под микроскопом и должна быть указана как отправной точкой регенерации аксона для анализа изображения позже. Если узел шовный материал epineural на сайте поклонников падает после животных перфузии и рассечение, важно вновь ярлык на одном сайте с швом сразу на нерв PFA-Исправлена когда раздавить индуцированной отступы до сих пор идентифицировать.
Среди методов трансфекции электропорация имеет более высокий уровень transfection. По данным нашего исследования transfection DRG нейрон для микроРНК или малые интерферирующие РНК после электропорации в естественных условиях составляет около 90%. Что еще более важно в естественных условиях электропорации гораздо меньше времени, чем методы, основанные на вирус, которые требуют вирус упаковки нужного гена конструкций. Насколько мы знаем, даже несмотря на то, что transfection lipofectamine основанный в естественных условиях имеет меньше токсичность чем электропорация, lipofectamine не работает на DRG нейронов особенно, ни в vivo ни в пробирке. Примечательно, нынешняя методология имеет ряд технических ограничений. Во-первых продолжительности siRNA эффективности для стучать вниз гена интереса короче чем доставки на основе вирус плазмид. Таким образом вся процедура от электропорации в жертву животное должно быть завершено в течение 4 – 6 дней14. Кроме того операции выполняются под микроскопом требует практики и некоторые ручной dexterity. Для начинающих продолжительность операции часто больше времени, чем ожидалось. Анестезии дозы, администрируемых мыши должен тщательно контролироваться, чтобы предотвратить нежелательные смертности. Наконец уплощение седалищного нерва вызывает перекрывающихся аксонов, при проведении epifluorescent изображений. Imaging несведенные нервов с конфокального микроскопа является альтернативным вариантом.
Анатомически DRG Сенсорные нейроны имеют два аксональное филиалы - периферической нисходящая ветвь и возрастания Центральный филиал, выходящий в столбце спинной спинного10. Нынешняя методология также показывает, отличительной маркировки спинной столбца спинного мозга. Таким образом Аналогичная методология может использоваться как модель расследовать сенсорные аксона регенерации после травмы спинного мозга. В сочетании с ткани очистка методов11, обычных confocal микроскопии или свет лист микроскопии могут использоваться на образце очищается спинного строить 3D реконструированный изображения сенсорные аксонов внутри спинной столбца спинного мозга.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Это исследование финансировалось (вручается F-Q. З.), низ (R01NS064288, R01NS085176, R01GM111514, R01EY027347), Крейг H. Neilsen фонд и Фонд BrightFocus.
Материалы
| Name | Company | Catalog Number | Comments |
| ECM 830 Square wave electroporation system | BTX Harvard Apparatus | 45-0052 | For in vivo electroporation |
| Tweezertrodes electrodes | BTX Harvard Apparatus | 45-0524 | For in vivo electroporation, 1 mm flat |
| Picospritzer III | Parker Instrumentation | 1096 | Intracellular Microinjection Dispense Systems |
| Glass Capillary Puller | NARISHIGE | PC-10 | |
| Borosilicate Glass Capillaries | World Precision Instruments, Inc. | 1902328 | |
| Stereo Dissection Microscope | Leica | M80 | |
| Microsurgery Rongeur | F.S.T | 16221-14 | |
| Microsurgery Forceps | FST by DUMONT, Switzerland | 11255-20 | Only for sciatic nerve crush |
| Glass Capillary | World Precision Instruments, Inc. | TW100-4 | 10 cm, standard wall |
| Tape | Fisherbrand | 15-901-30 | For fixing the mouse on the corkboard |
| 2, 2, 2-Tribromoethanol (Avertin) | Sigma-Aldrich | T48402 | Avertin stock solution |
| 2-methyl-2-butanol | Sigma-Aldrich | 152463 | Avertin stock solution |
| siRNA Fluorescent Universal Negative Control #1 | Sigma-Aldrich | SIC003 | Non-target siRNA with fluorescence |
| microRNA Mimic Transfection Control with Dy547 | Dharmacon | CP-004500-01-05 | Non-target microRNA with fluorescence |
| Plasmids preparation kit | Invitrogen Purelink | K210016 | GFP-coding plasmid preparation |
| Fast Green Dye | Millipore-Sigma | F7252 | For better visualization of the DRG outline during injection |
| Ketamine | Putney, Inc | NDC 26637-731-51 | Anesthesia induction |
| Xylazine | AnaSed | NDC 59399-110-20 | Anesthesia induction |
| Acetaminophen | McNeil Consumer Healthcare | NDC 50580-449-36 | Post-surgical pain relief |
Ссылки
- Saijilafu, , et al. PI3K-GSK3 signalling regulates mammalian axon regeneration by inducing the expression of Smad1. Nature Communications. 4, 2690 (2013).
- Zhang, B. Y., et al. Akt-independent GSK3 inactivation downstream of PI3K signaling regulates mammalian axon regeneration. Biochemical and Biophysical Research Communications. 443 (2), 743-748 (2014).
- Jiang, J. J., et al. MicroRNA-26a supports mammalian axon regeneration in vivo by suppressing GSK3beta expression. Cell Death & Disease. 6, 1865 (2015).
- Krames, E. S. The role of the dorsal root ganglion in the development of neuropathic pain. Pain Medicine. 15 (10), 1669-1685 (2014).
- Salimzadeh, L., Jaberipour, M., Hosseini, A., Ghaderi, A. Non-viral transfection methods optimized for gene delivery to a lung cancer cell line. Avicenna Journal of Medical Biotechnology. 5 (2), 68-77 (2013).
- Keeler, A. M., ElMallah, M. K., Flotte, T. R. Gene Therapy 2017: Progress and Future Directions. Clinical and Translational Science. 10 (4), 242-248 (2017).
- Neumann, E., Schaeferridder, M., Wang, Y., Hofschneider, P. H. Gene-Transfer into Mouse Lyoma Cells by Electroporation in High Electric-Fields. The EMBO Journal. 1 (7), 841-845 (1982).
- Liu, C. M., et al. MicroRNA-138 and SIRT1 form a mutual negative feedback loop to regulate mammalian axon regeneration. Genes & Development. 27 (13), 1473-1483 (2013).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240 (1), 237-246 (2001).
- Saijilafu, E. M., Hur, F. Q., Zhou, Genetic dissection of axon regeneration via in vivo electroporation of adult mouse sensory neurons. Nature Communications. 2, 543 (2011).
- Pan, C., et al. Shrinkage-mediated imaging of entire organs and organisms using uDISCO. Nature Methods. 13, 859 (2016).
- Rao, R. D., Bagaria, V. B., Cooley, B. C. Posterolateral intertransverse lumbar fusion in a mouse model: surgical anatomy and operative technique. Spine Journal. 7 (1), 61-67 (2007).
- Dommisse, G. F. The blood supply of the spinal cord. A critical vascular zone in spinal surgery. The Journal of Bone and Joint Surgery. British Volume. 56 (2), 225-235 (1974).
- Sorensen, D. R., Leirdal, M., Sioud, M. Gene Silencing by Systemic Delivery of Synthetic siRNAs in Adult Mice. Journal of Molecular Biology. 327 (4), 761-766 (2003).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены