Method Article
哺乳动物轴突再生: 成年小鼠背根神经节体内电穿孔的研究
摘要
电穿孔是一种有效的方法, 将兴趣基因传递给细胞。本文应用这种方法对成年小鼠背根神经节的神经元进行了研究, 并对其在体内的轴突再生模型进行了描述。
摘要
电穿孔是一种重要的非病毒基因转染方法, 将 DNA 质粒或小 RNA 分子引入细胞。背根神经节 (DRGs) 中的感觉神经元延伸一个单轴突, 两个分支。一个分支转到外围神经 (外围分支), 另一个分支进入脊髓通过背根 (中央分支)。神经损伤后, 外围分支恢复强劲, 而中心分支不再生。随着再生能力的提高, 感觉轴突再生已被广泛应用于研究哺乳动物轴突再生在周围神经系统 (三七) 和中枢神经系统 (CNS) 中的模型系统。在这里, 我们描述了一个以前建立的方法协议来操纵成熟的感官神经元在体内通过电穿孔的基因表达。在转染质粒或小 RNA 寡核苷酸 (siRNAs 或 microRNAs) 的基础上, 该方法既允许损失和增益功能的实验, 以研究基因利益或 microRNAs 的作用, 调节轴突再生在体内。此外,体内基因表达的操纵在相对较短的时间内可以在空间上和世俗地控制。该模型系统为研究哺乳动物轴突再生在体内调节的分子机制提供了一个独特的工具。
引言
神经损伤或各种神经退行性疾病引起的神经系统损伤通常导致运动、感官和认知功能的缺陷。最近, 大量的努力已经致力于再生效能重建的成人神经元, 以恢复生理 functionsof 受损神经元1,2,3。神经节中的感觉神经元是一群神经细胞, 它传达不同的感官刺激, 如疼痛, 体温, 触觉, 或身体姿势, 对大脑。这些神经元都是伪单极, 包含一个单轴突, 分叉一个分支向周围延伸, 另一个分支朝向脊髓4。DRGs 中的成年感觉神经元是少数成熟的哺乳动物神经元, 在受伤后能积极地再生它们的轴突。因此, 感觉轴突损伤作为研究脑轴突再生机制的重要模型被广泛应用.
在体内基因转染技术的建立和灵活性比使用转基因动物的时间要少, 在研究神经系统的基因功能和信号通路方面起着至关重要的作用。主要技术可以分为两种方法: 基于仪器的和基于病毒的5。以病毒为基础的成体神经元体内基因传递可以提供精确的时空操纵基因表达6。然而, 劳动密集型过程涉及基于病毒的方法, 如生产和纯化含有所需基因的病毒微粒。此外, 许多病毒载体可以激活宿主的免疫系统, 这可能会干扰数据的采集、数据分析, 并可能误导实验结果的解释。电穿孔是一种典型的以仪器为基础的转染方法, 使用电子脉冲增加细胞和核膜的通透性, 这有利于基因载体或小 RNA 寡核苷酸从细胞外的空间流入7.体外电穿孔被广泛认为是一种瞬态但高效的策略, 用于操纵多种细胞类型的靶向基因表达。虽然在体内电穿孔只会导致短暂的基因表达与病毒载体相比, 转染效率低, 它具有不同的病毒方法的优势。例如, 它可以应用到几乎所有的组织和细胞7,8,9。此外, 对某些转录蛋白编码的基因或小 RNA 寡核苷酸 (例如, siRNAs, microRNAs) 的质粒可以直接注入靶组织, 然后电脉冲, 这使得程序减少了劳动, 并耗时。此外, 转染多质粒和 RNA 寡核苷酸同时进行单电穿孔是可能的。
我们建立了体内电穿孔的方法来操纵成年小鼠感觉神经元中的基因表达, 并成功地应用和验证这种方法在许多先驱研究1,2,3 ,8,10。在这里, 我们提出了一个详细的协议, 以促进使用这种方法, 未来的研究哺乳动物轴突再生。
研究方案
所有动物实验都是按照约翰霍普金斯机构动物保育和使用委员会批准的动物协议进行的。
1. 材料和试剂
-
动物
- 用六周大的雌性 CF1 小鼠称量 30–35 g 进行实验。
注: 在单独通风灭菌笼中, 小鼠组内 (每笼5只小鼠), 1/4 "玉米芯寝具和 2" 方形 nestlets 用于筑巢。笼保持在一个控制的12小时的光暗循环和室温是介于19.4 摄氏度和25摄氏度之间。用全球啮齿动物饮食和自动供水系统喂养小鼠。
- 用六周大的雌性 CF1 小鼠称量 30–35 g 进行实验。
-
仪器
- 使用下列外科器械有效地进行手术: 一次性注射器 (27 克, 1.0 毫升) 腹腔注射, 毛皮剪, 立体解剖显微镜, 显微手术钳, 显微手术剪刀, 小骨 rongeurs和灭菌的无纺布海绵。
注: 所有仪器和材料均在手术前蒸压, 或由生产者预先消毒。在手术过程中, 这些仪器用75% 酒精喷洒来维持灭菌。
- 使用下列外科器械有效地进行手术: 一次性注射器 (27 克, 1.0 毫升) 腹腔注射, 毛皮剪, 立体解剖显微镜, 显微手术钳, 显微手术剪刀, 小骨 rongeurs和灭菌的无纺布海绵。
-
麻醉解决方案
- 使用麻醉液 #1 诱发麻醉, 并在根背根注射前使用麻醉液 #2 维持麻醉。
- 为使麻醉溶液 #1, 稀释氯胺酮和甲苯噻嗪在无菌盐水中的最终浓度为10毫克/毫升和1.2 毫克/毫升。
- 为使麻醉溶液 #2, 在20毫克/毫升的最终浓度下, 稀释 avertin 在无菌盐水中。
- 使用麻醉液 #1 诱发麻醉, 并在根背根注射前使用麻醉液 #2 维持麻醉。
-
DNA 质粒与 RNA 寡核苷酸
- 根据制造商的协议, 使用商业工具包准备质粒。将无菌去离子水中的质粒在2.0 µg/µL 浓度上稀释。
- 添加快速绿色染料溶液达到最终浓度的 0.005–0.01% (v/v), 以更好地可视化背节轮廓在注射过程中。
- 在制造商提供的相应缓冲器中溶解 siRNA 或 microRNA 寡核苷酸, 以达到50µM 的最终浓度。
-
微注射吸管
- 用微拉拔毛细管, 用显微外科剪刀剪下拉毛毛细管玻璃吸管的尖端, 产生一个大约50µm 外径的开口。然后在紫外线照射下将玻璃吸管消毒在干净的长凳上, 20–30分钟。
- 将灭菌过的玻璃吸管安装在与细胞内微量注射分配系统相连的吸管支架上。将微注射系统的参数设置在压力的 30 psi 和8毫秒的时间内。
-
电穿孔系统
- 将电极连接到方波电穿孔系统, 并设置以下参数:15 毫秒脉冲在 35 V, 950 毫秒间隔用于体内电穿孔。
-
灌注和固定液
- 将多聚甲醛 (粉煤灰) 粉溶于 1x PBS 中, 浓度为 4% (瓦特/v)。将粉煤灰溶液贮存在摄氏4摄氏度。
2. 实验程序
-
L4 和 L5 DRGs 的手术暴露
- 麻醉使用腹腔注射麻醉溶液 #1 前准备 (与氯胺酮100毫克/千克体重和甲苯噻嗪12毫克/千克体重)。
- 用毛皮剪刀把手术部位剃掉。
注: 由于左坐骨神经粉碎还会有另一项手术, 左后大腿的皮毛可以同时剃光。 - 将鼠标放在加热毯上 (35.0 °c), 用温度探头监视直肠温度。
- 检查麻醉, 捏住老鼠的脚趾和尾巴, 观察行为反应。
- 把老鼠的四只四肢贴在软木砖上。
- 用碘伏溶液擦拭手术部位, 然后用75% 乙醇清除碘伏, 然后再切开皮肤。
- 在麻醉时, 眼睛涂抹眼膏以防止干燥。
- 切口前, 用细标记笔标记髂嵴两侧。画一条连接髂嵴两点的线, 以方便辨认 L5 DRGs 的位置。
- 用微剪刀在低背中线上做一个3厘米的切口。此外, 分离的 paraspinous 肌肉, 如小 multifidus 和 longissimus 肌, 从 L3 到 S1 棘突过程, 并暴露了 L4-5 和 L5-6 的小关节。
- 使用微钳去除 L4-5 和 L5-6 的小关节。此外, 移除 L4 和 L5 的左神经弓, 以暴露 DRGs 的背侧。
-
根背根注射液
- 注射麻醉液 #2 (用 avertin 200 毫克/千克体重) 腹腔维持麻醉前根节注射。
- 将 DNA 质粒或 RNA 寡核苷酸 (每根背节的1µL) 加载到玻璃毛细管吸管中。
- 小心地将毛细管玻璃吸管的尖端插入背节。
- 用细胞内微量注射分配系统 (30 psi, 8 ms) 逐步注入1.0 µL 溶液的 DNA 质粒或 RNA 寡核苷酸进入背节。
注: 注射时间应持续不少于5分钟。
-
穿孔
- 将 PBS 放在电极的尖端上。
- 用消毒的方棉纱布清理出血。
- 用电极轻轻捏住靶背节, 并将5平方电脉冲与电击系统结合使用。
- 用5-0 尼龙缝线分别关闭肌肉和皮肤层。
- 把鼠标放在加热的毯子上 (35.0 °c), 直到它完全恢复足够的意识来维持胸骨卧床。从麻醉中完全恢复后, 将鼠标返回到主笼子。
注: 在37°c 毯上, 鼠标从麻醉中完全恢复需要大约60分钟。将一丸 (200 毫克) 布洛芬溶入1000毫升水 (0.2 毫克/毫升), 用于每日喂养, 以减轻术后疼痛。
-
坐骨神经粉碎
- 三天 (根据实验设计) 后背节电穿孔, 麻醉鼠标腹腔与麻醉解决方案 #2 (与 avertin 400 毫克/千克体重)。
- 把老鼠的四只四肢贴在软木砖上。
- 沿中线向左侧1厘米的切口0.5 厘米。切开肌肉, 如臀肌和梨肌, 纵向。揭示大坐骨神经孔与坐骨神经切口之间的坐骨神经段。
- 十二年代用显微外科钳粉碎神经, 用10-0 尼龙 epineural 缝合标记粉碎部位。在硬脑膜膜上打个结来标记粉碎部位。
- 用5-0 尼龙缝线闭合肌肉和皮肤层。
- 把鼠标放在加热的毯子上 (35.0 °c), 直到它完全恢复足够的意识来维持胸骨卧床。从麻醉中完全恢复后, 将鼠标返回到主笼子。
注: 在37°c 毯上, 鼠标从麻醉中完全恢复需要大约60分钟。将一丸 (200 毫克) 布洛芬溶入1000毫升水 (0.2 毫克/毫升), 用于每日喂养, 以减轻术后疼痛。
-
小鼠灌注、根神经节和坐骨神经收获
- 三天后坐骨神经粉碎 (根据实验设计), 麻醉鼠标腹腔与麻醉解决方案 #2。
- 灌注小鼠 transcardially 与 pbs (ph 7.4) 其次是冰冷4% 多聚甲醛 (煤灰) (ph 7.5) 在 pbs。
- 灌注后, 在解剖显微镜下用微剪刀和微钳将 DRGs 与神经根和坐骨神经在膝前仔细分离。将坐骨神经直接放置在4% 的粉煤灰中过夜4摄氏度。
-
荧光标记感觉神经轴突的成像与测量
- 在解剖显微镜下, 用微剪刀和微钳剥去固定坐骨神经上的附着组织和膜。然后, 用 PBS 交换4% 的煤灰, 然后洗三次神经。
- 把坐骨神经放在滑梯上, 保持笔直。在神经周围添加80µL antifade 溶液, 然后在它上放置一个盖玻片。压扁整个安装的组织。
- 将flattened 组织放在倒置 epifluorescent 显微镜上, 配有用于马赛克采集和图像处理的附件。
注: 激发和发射长度为 488 nm 和 509 nm。还可以手动拍摄多个重叠图像, 并使用 ImageJ 与马赛克插件一起缝合图像。 - 在测量再生轴突的长度时, 从粉碎部位 (标记为 10-0 epineural 缝合) 到远端轴突末端, 追踪坐骨神经中所有 identifiable fluorescently 标记的轴突。
结果
为了量化当前协议的细胞毒性, 并验证体内根节电穿孔的转染率是否足够高, 我们注射并转荧光标记的 microRNA 或 siRNA L4 和 L5 DRGs。分离 DRGs 经低温切片和免疫组化处理 (图 1A B)。在估计注射和电穿孔后的细胞存活率时, L4 和 L5 的完整 DRGs 通过冷冻切片和免疫组化进行了采集和处理。与完整 DRGs 的神经元密度相比, 神经元密度与 Tuj1 染色反应没有显著性差异, 这表明电穿孔没有诱发神经细胞死亡 (图 1C)。将转染率计算为标记 RNA 寡核苷酸神经元数与 Tuj1-positive 神经元数目的比值。miRNA 的平均转染率为 80.7 4.3%, siRNA 94.2, 0.3% (图 1D)。应用目前体内电穿孔法研究轴突再生时, 坐骨神经被扁平化和成像。每个再生轴突具有独特的轨迹和可辨认的远端轴突末端可以追溯到挤压部位所示的缝合结 (图 2)。此外, 我们转 DRGs 与 EGFP 质粒, 并从 T7 到 L2, 并在7天后, L4 和 L5 的背根收获脊髓。我们使用了一个建立良好的组织清除协议-uDISCO 清除脊髓11。脊髓内 EGFP 标记的背柱轴突是用共焦显微镜成像的, 然后在纵向和矢状投射图像中进行识别 (图 3)。另外, 共焦图像可以用显微可视化软件处理, 以重建3D 图像 (影片 1)。

图 1: 荧光标记的非特异 microRNA 或 siRNA在体内进行电穿孔后节段冷冻切片的免疫组化.(A) 以荧光标记 (Dy547) 非靶向 microRNAs 注射和转的典型的背根节组织冷冻切片。左图: 图像的荧光信号 (红色) 的荧光标记 (Dy547) 非目标 microRNAs。中间图像: 免疫染色 (绿色色) 的 Tuj1 与 Alexa488 荧光的二级抗体。右图像: 前两个通道的合并图像。刻度条 = 100 µm.(B) 有代表性的低温切片根背节组织注射和转与荧光标记 (Cy3) 非靶 siRNAs。左图: 图像的荧光信号 (红色) 的荧光标记 (Cy3) 非目标 siRNAs。中间图像: 免疫染色 (绿色色) 的 Tuj1 与 Alexa488 荧光的二级抗体。右图像: 前两个通道的合并图像。刻度条代表100µm. (C) 完整的背根节段低温切片的神经元密度为 809.6, 14.2 细胞/毫米2 (N = 6), 注射后的节段为 801.6, 27.4 细胞/毫米2 (N = 6), 意思是 "电子扫描", 学生的t测试, NS: 否意义。三只小鼠在左 L4 和 L5 DRGs 的活体根节电穿孔中进行标记 siRNA。左、右 L4 和 L5 DRGs 在48小时后收获, 经低温切片和免疫组化处理。每根背根都被切片成大约60片, 切片的厚度为10微米。每根背根的三片被选择200微米和平均。(D) 标记的 miRNA 的转染率为 80.7, 4.3% (n = 4), 标记的 siRNA 为 94.2 @ 0.3% (n = 6), 平均值为 SEM。三只小鼠在左 L4 和 L5 DRGs 的活体背根电穿孔中进行标记 siRNA 和两只带标记 miRNA 的小鼠。DRGs 在48小时后收获, 经低温切片和免疫组化处理。每根背根都被切片成大约60片, 切片的厚度为10微米。每根背根的三片被选择200微米和平均。请单击此处查看此图的较大版本.

图 2: Ectopically 表达 EGFP 在坐骨神经粉碎损伤后, 显示再生神经轴突.扁平坐骨神经受挤压伤后的轴突由 somas 到轴突的 EGFP (绿色荧光) 标记。红线表示破碎损伤部位的位置, 最初是用缝合结进行手术标记的。白色箭头, 箭头和星表明三独特的轴突末端, 所有这些延伸从粉碎地点。刻度条 = 500 µm.请点击这里查看这个数字的大版本.
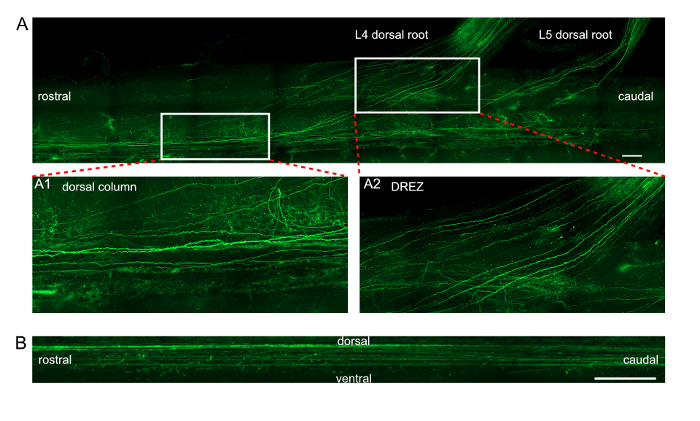
图 3: DRGs 体外电穿孔后脊髓 EGFP 表达轴突的投影图像.(A) 背柱和 L4/L5 背根内 EGFP 标记的轴突的纵向投射。嵌入图像 A1 和 A2 显示在面板 (A) 中标记的两个矩形区域的放大视图。A1 在背柱上展示了轴突的详细观点。A2 展示了背根进入区 (DREZ) 的轴突的详细观点。刻度条 = 200 µm (B) 背柱内 EGFP 标记轴突的矢状投射。刻度条 = 50 µm.请点击这里查看这个数字的大版本.
电影 1: 3D DRGs 体外电穿孔后脊髓 EGFP 表达轴突的重建。请单击此处查看此视频。(右键单击可下载.
讨论
一些手术步骤需要特别注意。L4 和 L5 DRGs (somas 的位置), 控制坐骨神经, 需要正确识别和注射的基因结构。否则, 在坐骨神经轴突中, GFP 标记将消失。髂嵴可以被视为有用的解剖标志, 以确定 L4 和 L5 DRGs。在大多数小鼠中, L5 和 L6 椎骨之间的关节与髂嵴12相近。另外, L3 根背根可以选择代替 L5, 特别是对免疫组化或西方印迹13的化验, 因为 L5 背节的手术暴露通常会遇到很大的困难, 由于深的位置和丰富的血液供应。同时, 整个手术应避免损伤的背节周围结构, 包括脊髓和神经根。值得注意的第二个关键操作步骤是注入。快速绿色染料与基因结构的解决方案混合, 以可视化从针中排出的溶液, 并在背节中扩散。一个成功的注射应该显示一个清晰的圆形的背节, 由荧光染料概述。如果用荧光染料的溶液在注射时从背节漏出, 在微针尖端的深度上进行来回微调, 可以确保完整地将所有溶液注入到背节胶囊中。避免在三多个不同的地点刺穿根背根。此外, 在根背根注射液后轻度出血通常是不可避免的, 因为 DRGs 与网 venosum13紧密包裹在一起。重要的是停止出血, 这样就不会有血液绝缘的背节的表面上电极在电穿孔。成功的电穿孔依赖于电流传导, PBS 溶液可以应用于电极上。最后, 用镊子粉碎的坐骨神经部位应进行显微缝合, 因为损伤部位在显微镜下是看不见的, 需要作为轴突再生的起始点进行图像分析。如果粉碎部位的 epineural 缝合结在动物灌注和解剖后脱落, 那么在挤压诱发的压痕仍可辨认的情况下, 立即在粉煤灰固定神经上重新标记同一部位是至关重要的。
在转染技术中, 电穿孔具有较高的转染率。根据我们的研究, 在体内电穿孔后, microRNAs 或 siRNAs 的背节神经元的转染率接近90%。更重要的是,体内电穿孔比基于病毒的方法消耗的时间要少得多, 这需要病毒包装所需的基因结构。据我们所知, 尽管脂质体体内转染的毒性比电穿孔少, 但脂质体在体内和体外都不能对背节神经元起作用。值得注意的是, 目前的方法有若干技术限制。首先, siRNA 功效的持续时间比基于病毒的质粒的传递要短。因此, 从电穿孔到动物牺牲的整个过程必须在第4-6 天14完成。此外, 在显微镜下进行的手术需要练习和一些手工灵巧。对于新手来说, 手术时间通常比预期长。对老鼠的麻醉剂量必须小心控制, 以防止不必要的死亡率。最后, 在进行 epifluorescent 成像时, 扁平化坐骨神经会导致轴突重叠。用共聚焦显微镜成像 unflattened 神经是一种选择。
解剖上, 背根神经节感觉神经元有两个轴突分支-周边下降分支和上升中心分支投射到脊髓的背部柱10。目前的方法也显示了独特的标签脊髓背柱。因此, 类似的方法可以作为一个模型来研究脊髓损伤后的感觉轴突再生。结合组织清除技术11, 传统的共焦显微术或光片显微镜可用于清除脊髓标本, 建立3D 重建图像的感觉轴突在脊髓背柱。
披露声明
作者没有什么可透露的。
致谢
这项研究获得资助 (授予 F Q。Z.) 由 NIH (R01NS064288, R01NS085176, R01GM111514, R01EY027347), 克雷格 h 尼尔森基金会和 BrightFocus 基金会。
材料
| Name | Company | Catalog Number | Comments |
| ECM 830 Square wave electroporation system | BTX Harvard Apparatus | 45-0052 | For in vivo electroporation |
| Tweezertrodes electrodes | BTX Harvard Apparatus | 45-0524 | For in vivo electroporation, 1 mm flat |
| Picospritzer III | Parker Instrumentation | 1096 | Intracellular Microinjection Dispense Systems |
| Glass Capillary Puller | NARISHIGE | PC-10 | |
| Borosilicate Glass Capillaries | World Precision Instruments, Inc. | 1902328 | |
| Stereo Dissection Microscope | Leica | M80 | |
| Microsurgery Rongeur | F.S.T | 16221-14 | |
| Microsurgery Forceps | FST by DUMONT, Switzerland | 11255-20 | Only for sciatic nerve crush |
| Glass Capillary | World Precision Instruments, Inc. | TW100-4 | 10 cm, standard wall |
| Tape | Fisherbrand | 15-901-30 | For fixing the mouse on the corkboard |
| 2, 2, 2-Tribromoethanol (Avertin) | Sigma-Aldrich | T48402 | Avertin stock solution |
| 2-methyl-2-butanol | Sigma-Aldrich | 152463 | Avertin stock solution |
| siRNA Fluorescent Universal Negative Control #1 | Sigma-Aldrich | SIC003 | Non-target siRNA with fluorescence |
| microRNA Mimic Transfection Control with Dy547 | Dharmacon | CP-004500-01-05 | Non-target microRNA with fluorescence |
| Plasmids preparation kit | Invitrogen Purelink | K210016 | GFP-coding plasmid preparation |
| Fast Green Dye | Millipore-Sigma | F7252 | For better visualization of the DRG outline during injection |
| Ketamine | Putney, Inc | NDC 26637-731-51 | Anesthesia induction |
| Xylazine | AnaSed | NDC 59399-110-20 | Anesthesia induction |
| Acetaminophen | McNeil Consumer Healthcare | NDC 50580-449-36 | Post-surgical pain relief |
参考文献
- Saijilafu, , et al. PI3K-GSK3 signalling regulates mammalian axon regeneration by inducing the expression of Smad1. Nature Communications. 4, 2690 (2013).
- Zhang, B. Y., et al. Akt-independent GSK3 inactivation downstream of PI3K signaling regulates mammalian axon regeneration. Biochemical and Biophysical Research Communications. 443 (2), 743-748 (2014).
- Jiang, J. J., et al. MicroRNA-26a supports mammalian axon regeneration in vivo by suppressing GSK3beta expression. Cell Death & Disease. 6, 1865 (2015).
- Krames, E. S. The role of the dorsal root ganglion in the development of neuropathic pain. Pain Medicine. 15 (10), 1669-1685 (2014).
- Salimzadeh, L., Jaberipour, M., Hosseini, A., Ghaderi, A. Non-viral transfection methods optimized for gene delivery to a lung cancer cell line. Avicenna Journal of Medical Biotechnology. 5 (2), 68-77 (2013).
- Keeler, A. M., ElMallah, M. K., Flotte, T. R. Gene Therapy 2017: Progress and Future Directions. Clinical and Translational Science. 10 (4), 242-248 (2017).
- Neumann, E., Schaeferridder, M., Wang, Y., Hofschneider, P. H. Gene-Transfer into Mouse Lyoma Cells by Electroporation in High Electric-Fields. The EMBO Journal. 1 (7), 841-845 (1982).
- Liu, C. M., et al. MicroRNA-138 and SIRT1 form a mutual negative feedback loop to regulate mammalian axon regeneration. Genes & Development. 27 (13), 1473-1483 (2013).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240 (1), 237-246 (2001).
- Saijilafu, E. M., Hur, F. Q., Zhou, Genetic dissection of axon regeneration via in vivo electroporation of adult mouse sensory neurons. Nature Communications. 2, 543 (2011).
- Pan, C., et al. Shrinkage-mediated imaging of entire organs and organisms using uDISCO. Nature Methods. 13, 859 (2016).
- Rao, R. D., Bagaria, V. B., Cooley, B. C. Posterolateral intertransverse lumbar fusion in a mouse model: surgical anatomy and operative technique. Spine Journal. 7 (1), 61-67 (2007).
- Dommisse, G. F. The blood supply of the spinal cord. A critical vascular zone in spinal surgery. The Journal of Bone and Joint Surgery. British Volume. 56 (2), 225-235 (1974).
- Sorensen, D. R., Leirdal, M., Sioud, M. Gene Silencing by Systemic Delivery of Synthetic siRNAs in Adult Mice. Journal of Molecular Biology. 327 (4), 761-766 (2003).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。