Method Article
التحقيق إكسون الثدييات التجديد: في فيفو انهانسر من العقدة الجذر الظهرية الماوس الكبار
In This Article
Summary
انهانسر نهج فعال لتوصيل الجينات المصالح إلى الخلايا. بتطبيق هذا النهج في فيفو على الخلايا العصبية العقدة الجذر الظهرية الماوس الكبار (DRG)، يصف لنا نموذجا لدراسة إكسون التجدد في فيفو.
Abstract
انهانسر نهج تعداء جينات غير فيروسية أساسية لإدخال والبلازميدات الحمض النووي أو جزيئات الحمض النووي الريبي صغيرة في الخلايا. العصبية حسية في العقدة الظهرية الجذرية (باﻷسعار) يمتد من إكسون واحدة بفرعين. فرع واحد يذهب إلى الطرفية العصبية (فرع الطرفية)، والفرع الآخر يدخل الحبل الشوكي من خلال الجذر الظهرية (فرع الوسطى). فرع الأجهزة الطرفية بعد الإصابة العصبية، تجدد قوة حين عدم تجديد الفرع المركزي. نظراً لارتفاع قدرة التجدد، تجديد إكسون الحسية وقد استخدمت على نطاق واسع كنظام نموذجي لدراسة تجديد إكسون الثدييات في الجهاز العصبي المحيطي (PNS) والجهاز العصبي المركزي (CNS). هنا، يمكننا وصف بروتوكول نهج المتبعة سابقا للتلاعب بالجينات في الخلايا العصبية الحسية ناضجة في فيفو عبر انهانسر. استناداً إلى تعداء مع البلازميدات أو أوليجوس صغيرة من الحمض النووي الريبي (سيرناس أو ميكرورناس)، النهج الذي يسمح لكل التجارب الخسارة والربح-من-وظيفة لدراسة أدوار الجينات للمصالح أو ميكرورناس في تنظيم إكسون التجدد في فيفو. وبالإضافة إلى ذلك، يمكن التحكم التلاعب بالجينات التعبير في فيفو مكانياً وزمنياً على حد سواء ضمن دورة زمنية قصيرة نسبيا. ويوفر هذا النظام النموذجي أداة فريدة للتحقيق في الآليات الجزيئية التي يتم التجديد إكسون الثدييات الخاضعة للتنظيم في فيفو.
Introduction
إصابات في الجهاز العصبي الناجم عن الصدمات العصبية أو أمراض الأعصاب المختلفة عادة ما تسفر عن العيوب في الوظائف الحركية والحسية والإدراكية. مؤخرا، قد كرس الكثير من الجهد لإعادة إنشاء قوتها التجدد في الخلايا العصبية الكبار لاستعادة الخلايا العصبية الفسيولوجية فونكتيونسوف أصيب1،2،3. الخلايا العصبية الحسية في الرسم هي مجموعة من الخلايا العصبية التي تنقل المنبهات الحسية المختلفة، مثل الألم، ودرجة الحرارة، واللمس، أو موقف الهيئة، إلى الدماغ. كل من هذه الخلايا العصبية الزائفة القطب الواحد ويحتوي على إكسون وحيدة التي إلى فرع واحد يمتد باتجاه المحيط وفرع أخرى تتجه نحو النخاع الشوكي4. من الخلايا العصبية الحسية الكبار في باﻷسعار بين الخلايا العصبية الثدييات ناضجة قليلة معروفة لتجديد على محاور عصبية بنشاط بعد الإصابة. ومن ثم الإصابات من محاور عصبية حسية على نطاق واسع استخدمت كنموذج بالغ الأهمية لدراسة آليات التجديد محواري في فيفو.
في فيفو تقنيات تعداء الجينات، وعادة ما تكون أقل استهلاكاً للوقت لإعداد وأكثر مرونة من استخدام الحيوانات المحورة وراثيا، لعب أدوار أساسية في دراسة وظائف الجينات وإشارات المسارات في الجهاز العصبي. ويمكن تصنيف التقنيات الرئيسية في نهجين اثنين: الفيروسات المستندة إلى صك و5. يمكن أن توفر على أساس الفيروسية في فيفو إيصال الجينات في الخلايا العصبية الكبار دقيقة التلاعب الزمانية المكانية ل التعبير الجيني6. ومع ذلك، تشارك عمليات كثيفة العمالة في الأساليب المستندة إلى الفيروسية، مثل إنتاج وتنقية الجزيئات الفيروسية التي تحتوي على الجين المطلوب. وبالإضافة إلى ذلك، يمكن تنشيط العديد من النواقل الفيروسية المناعي للبلد المضيف، والتي قد تتداخل مع الحصول على البيانات، تحليل البيانات، وربما تضليل تفسير النتائج التجريبية. يستخدم انهانسر، نهجاً تعداء المستندة إلى صك نموذجي، نبض كهربائية لزيادة نفاذية الخلية والأغشية النووية عابر، التي تفضل تدفق الجينات الناقلة أو الصغيرة رنا أوليجوس من الفضاء خارج الخلايا7 . في المختبر انهانسر المسلم به على نطاق واسع كاستراتيجية عابرة ولكنها ذات كفاءة عالية للتلاعب بالجينات المستهدفة في العديد من أنواع الخلايا. على الرغم من أن في فيفو انهانسر لا يؤدي إلا إلى التعبير الجيني عابر مع انخفاض كفاءة ترانسفيكتينج مقارنة بالنواقل الفيروسية، له مزايا مختلفة عبر نهج الفيروسية. على سبيل المثال، فإنه يمكن تطبيقها على تقريبا جميع الأنسجة والخلايا7،،من89. وباﻹضافة إلى ذلك، أما والبلازميدات ترميز الجينات في المصالح أو صغيرة أوليجوس الحمض النووي الريبي (مثلاً، سيرناس، ميكرورناس) ضد بعض النصوص يمكن حقنها في الأنسجة المستهدفة مباشرة وثم كهربائياً نابض، الذي جعل الإجراء العمل أقل-و الوقت المستهلكة. وعلاوة على ذلك، من الممكن ترانسفيكتينج والبلازميدات والجيش الملكي النيبالي أوليجوس في أن واحد مع انهانسر واحدة متعددة.
وقد أنشأنا في فيفو نهج انهانسر للتلاعب بالجينات في الخلايا العصبية الحسية الماوس الكبار وتطبيقها بنجاح والتحقق من صحة هذا النهج في عدة دراسات رائدة1،2،3 ،،من810. نقدم هنا، بروتوكول مفصلة لتسهيل استخدام هذا النهج للدراسات المستقبلية للتجدد إكسون الثدييات.
Protocol
أجريت جميع التجارب على الحيوانات وفقا لبروتوكول الحيوانية وافقت عليها لجنة الاستخدام وجونز هوبكنز رعاية الحيوان المؤسسية.
1-المواد والكواشف
-
الحيوانات
- استخدام عمرها ست الأسبوع الإناث CF1 الفئران وزنها 30 – 35 ز للتجارب.
ملاحظة: الفئران تم إيواء المجموعة (5 الفئران في قفص) في أقفاص معقمة التهوية على حدة مع 1/4 "الذرة الكوز الفراش و 2" مربع نيستليتس للتداخل. وأبقى في الأقفاص في دائرة الضوء الظلام 12-ح التي تسيطر عليها وكانت درجة حرارة الغرفة بين 19.4 درجة مئوية و 25 درجة مئوية. تم تغذية الفئران مع النظام الغذائي القوارض العالمية والمياه التلقائية تزويد النظام.
- استخدام عمرها ست الأسبوع الإناث CF1 الفئران وزنها 30 – 35 ز للتجارب.
-
الصكوك
- استخدام الأدوات الجراحية التالية بكفاءة إجراء الجراحة: الفراء المحاقن (ز 27، 1، 0 مل) للحقن داخل الماكينة ومجهر تشريح ستيريو وملقط الجراحة الصغرى، مقص الجراحة الصغرى والعظام الصغيرة رونجيورس وتعقيم منسوج الأسفنج.
ملاحظة: جميع الأدوات والمواد يعقم قبل الجراحة أو تعقيم مسبقاً قبل المنتجين. أثناء الجراحة، يتم رش الصكوك مع الكحول 75% للحفاظ على التعقيم.
- استخدام الأدوات الجراحية التالية بكفاءة إجراء الجراحة: الفراء المحاقن (ز 27، 1، 0 مل) للحقن داخل الماكينة ومجهر تشريح ستيريو وملقط الجراحة الصغرى، مقص الجراحة الصغرى والعظام الصغيرة رونجيورس وتعقيم منسوج الأسفنج.
-
حلول مخدر
- استخدام مخدر الحل #1 للحث على التخدير واستخدام التخدير الحل #2 قبل الحقن بالرسم للمحافظة على التخدير.
- جعل مخدر الحل #1، تضعف من الكيتامين وإكسيلازيني في المحلول الملحي المعقم بتركيز نهائي 10 ملغ/مل و 1.2 ملغ/مل.
- جعل مخدر الحل #2، تخفف من أفيرتين في المحلول الملحي المعقم بتركيز 20 ملغ/مل نهائي.
- استخدام مخدر الحل #1 للحث على التخدير واستخدام التخدير الحل #2 قبل الحقن بالرسم للمحافظة على التخدير.
-
بلازميد الحمض النووي والجيش الملكي النيبالي أوليجوس
- إعداد البلازميدات باستخدام مجموعة تجارية عقب بروتوكولات الشركة المصنعة تبعاً لذلك. تمييع بلازميد السلطات الوطنية المعينة في تعقيم المياه إلى تركيز 2.0 ميكروغرام/ميليلتر.
- إضافة حل صبغ "الأخضر سريعة" للوصول إلى نهائي تركيز 0.005 – 0.01% (v/v) لرؤية أفضل لمخطط الرسم أثناء الحقن.
- حل أوليجوس siRNA أو ميكرورنا في المقابل المخازن المؤقتة المقدمة من الشركات المصنعة للوصول إلى تركيز نهائي في 50 ميكرومتر.
-
ماصة الصغرى-حقن
- سحب الزجاج الشعرية استخدام ساحبة ميكروبيبيتي وقطع طرف الماصة الزجاجية الشعرية سحبت مع مقص الجراحة الدقيقة لتوليد فتحه مع قطر خارجي تقريبية 50 ميكرومتر. ثم تعقيم ماصة زجاجية تحت ضوء الأشعة فوق البنفسجية على مقاعد البدلاء نظيفة لمدة 20 – 30 دقيقة تقريبا.
- جبل ماصة زجاجية معقمة على حامل ماصة متصلاً microinjection داخل الخلايا الاستغناء عن النظام. تعيين معلمات النظام microinjection في 30 psi الضغط و 8 مللي ثانية لمدة.
-
نظام انهانسر
- قم بتوصيل الأقطاب النظام انهانسر موجه مربعة وتعيين المعلمات التالية: البقول 15 مللي ثانية في 35 الخامس مع فواصل 950 مللي ثانية انهانسر في فيفو .
-
نضح وتحديد الحل
- حل مسحوق بارافورمالدهيد (PFA) في برنامج تلفزيوني 1 x بتركيز 4% (w/v). مخزن الحل منهاج عمل بيجين في 4 درجات مئوية.
2. الإجراءات التجريبية
-
التعرض الجراحية من L4 و L5 باﻷسعار
- تخدير الماوس باستخدام حقنه داخل الحل مخدر #1 أعد مسبقاً (مع الكيتامين 100 مغ/كغ من وزن الجسم و xylazine 12 مغ/كغ من وزن الجسم).
- حلق المنطقة الجراحية بالماكينة الفراء.
ملاحظة: نظراً لأنه سيكون هناك عملية جراحية أخرى لسحق العصب الوركي الأيسر، فرو الفخذ الخلفي الأيسر يمكن حلق في وقت واحد. - ضع الماوس على بطانية ساخنة (35.0 درجة مئوية) ورصد درجة حرارة المستقيم مع تحقيق درجة حرارة.
- لاختبار التخدير، قرصه على أصابع قدميه وذيل الماوس ومراقبة الاستجابة السلوكية.
- الشريط أطرافه الأربعة من الماوس على corkboard.
- مسح منطقة الجراحي مع حل إيودوفور، ومن ثم مع 75 ٪ من الكحول لإزالة إيودوفور قبل قطع الجلد.
- تطبيق مرهم العيون في العيون لمنع جفاف بينما تحت التخدير.
- قبل شق، علامة كلا الجانبين من القمم حرقفي بقلم ماركر غرامة. رسم خط يربط بين نقطتين من القمم الحرقفي لتسهيل تحديد مواقف باﻷسعار L5.
- جعل شق 3 سم على طول خط الوسط من الظهر مع المقص الصغير. وعلاوة على ذلك، فصل العضلات باراسبينوس، مثل multifidus موسكولوس ولومبوروم لونجيسيموس موسكولوس، من L3 للعمليات الشائكة S1، وفضح مفاصل L4-5 والمستوي 5-6.
- استخدام الصغرى-رونجيور لإزالة مفاصل L4-5 والمستوي 5-6. وعلاوة على ذلك، إزالة قوس الأيسر العصبي L4 L5 وكشف الجهة الظهرية من باﻷسعار.
-
الحقن بالرسم
- حقن مخدر الحل #2 (مع أفيرتين 200 مغ/كغ من وزن الجسم) إينترابيريتونيلي للحفاظ على التخدير قبل الحقن بالرسم.
- تحميل والبلازميدات الحمض النووي أو الحمض النووي الريبي أوليجوس (1 ميليلتر في الرسم) إلى الماصة الشعرية الزجاج.
- إدراج تلميح ماصة زجاجية الشعرية بعناية في الرسم.
- حقن تدريجيا حل ميليلتر 1.0 والبلازميدات الحمض النووي أو الحمض النووي الريبي أوليجوس إلى الرسم استخدام microinjection داخل الخلايا الاستغناء عن نظم (30 psi، 8 مللي ثانية).
ملاحظة: من الحقن ينبغي أن تدوم مدة لا تقل عن 5 دقائق.
-
انهانسر
- إسقاط برنامج تلفزيوني على نصائح من أقطاب كهربائية.
- تنظيف النزيف بشاش معقم القطن مربعة.
- قرصه الهدف الرسم مع الأقطاب بلطف وتطبيق نبضات كهربائية مربعة 5 مع نظام انهانسر.
- إغلاق طبقات العضلات والجلد بخيوط النايلون 5-0 على التوالي.
- ضع الماوس على بطانية ساخنة (35.0 درجة مئوية) تحت عناية حتى تماما قد استعاد وعيه كافية للحفاظ على ريكومبينسي القصية. العودة الماوس إلى القفص المنزل بعد أن تعافي تماما من التخدير.
ملاحظة: يستغرق حوالي 60 دقيقة للماوس للتعافي تماما من التخدير في بطانية 37 درجة مئوية. حل واحد حبوب منع الحمل (200 مغ) الايبوبروفين إلى 1,000 مل من الماء (0.2 مغ/مل) للتغذية اليومية لتخفيف الألم بعد الجراحة.
-
العصب الوركي سحق
- يومين أو ثلاثة أيام (حسب التصميم التجريبي) بعد انهانسر DRG، تخدير الماوس إينترابيريتونيلي مع مخدر الحل #2 (مع أفيرتين 400 مغ/كغ من وزن الجسم).
- الشريط أطرافه الأربعة من الماوس على corkboard.
- إجراء شق 1 سم 0.5 سم على الجانب الأيسر على طول خط الوسط. قطع العضلات، مثل مكسيموس عضلة العضلات والعضلات الكمثرى، طوليا. يعرض هذا جزء العصب الوركي بين الثقبة الوركي أكبر والشق الوركي.
- سحق العصب مع ملقط الجراحة الدقيقة 12 s ومارك الموقع سحق مع خياطة ابينيورال نايلون 10-0. جعل عقده على الغشاء دورال بمناسبة الموقع سحق.
- إغلاق طبقات العضلات والجلد بخياطة نايلون 5-0.
- ضع الماوس على بطانية ساخنة (35.0 درجة مئوية) مع إيلاء اهتمام وثيق حتى تماما قد استعاد وعيه كافية للحفاظ على ريكومبينسي القصية. العودة الماوس إلى القفص المنزل بعد أن تعافي تماما من التخدير.
ملاحظة: يستغرق حوالي 60 دقيقة للماوس للتعافي تماما من التخدير في بطانية 37 درجة مئوية. حل واحد حبوب منع الحمل (200 مغ) الايبوبروفين إلى 1,000 مل من الماء (0.2 مغ/مل) للتغذية اليومية لتخفيف الألم بعد الجراحة.
-
نضح الماوس، والرسم، والحصاد العصب الوركي
- يومين أو ثلاثة أيام بعد سحق العصب الوركي (اعتماداً على التصميم التجريبي)، تخدير الماوس إينترابيريتونيلي مع مخدر الحل #2.
- نتخلل ترانسكارديالي الماوس مع برنامج تلفزيوني (درجة الحموضة 7.4) تليها المثلج بارافورمالدهيد 4% (PFA) (الرقم الهيدروجيني 7.5) في برنامج تلفزيوني.
- بعد نضح، فصل باﻷسعار جنبا إلى جنب مع جذور الأعصاب والعصب الوركي قبل الركبة بعناية مع مايكرو-المقص والملقط الصغير تحت مجهر التشريح. ضع العصب الوركي مباشرة في 4% بين عشية وضحاها منهاج عمل بيجين في 4 درجات مئوية.
-
تصوير وقياس محاور عصبية حسية Fluorescence المسمى
- قطاع بعيداً عن الأنسجة المرفقة والغشاء على العصب الوركي الثابتة مع مايكرو-المقص والملقط الصغير بعناية تحت مجهر التشريح. ثم تبادل 4% منهاج العمل مع برنامج تلفزيوني ويغسل العصب ثلاث مرات.
- ضع العصب الوركي على شريحة وإبقائه على التوالي. إضافة 80 ميليلتر لحل أنتيفادي حول العصب، ثم وضع ساترة على ذلك. تسطيح النسيج كله المحملة مع الضغط.
- ضع الأنسجة flattened في المجهر المقلوب epifluorescent مجهزة بملحق لاقتناء الفسيفساء ومعالجة الصور.
ملاحظة: أطوال الإثارة والانبعاثات هي 488 نانومتر و 509 نانومتر. من الممكن أيضا التقاط صور متداخلة متعددة يدوياً وغرزه الصور معا باستخدام إيماجيج مع الفسيفساء المكون الإضافي. - عند قياس طول محاور عصبية المجددة، تتبع جميع identifiable المسمى fluorescently محاور عصبية في العصب الوركي من موقع سحق (ملحوظ مع خياطة ابينيورال 10-0) إلى نهايات إكسون البعيدة.
النتائج
لتحديد سيتوتوكسيسيتي من البروتوكول الحالي والتحقق من أن معدل تعداء في فيفو انهانسر الرسم عالية بما يكفي، وإننا حقن وميكرورنا معلم فلوريسسينتلي اليكتروبوراتيد أو siRNA في L4 و L5 باﻷسعار. تم تجهيز باﻷسعار منفصلة عن طريق تقطيع البرد وإيمونوهيستوتشيميستري (الشكل 1أ-ب). عند تقدير معدل بقاء الخلية بعد الحقن وانهانسر، باﻷسعار سليمة من L4 L5 وحصادها ومعالجتها من خلال تمزيقها البرد وإيمونوهيستوتشيميستري. كثافة الخلايا العصبية، تنعكس تلطيخ Tuj1، لم تظهر فرقا ملحوظا بالمقارنة مع كثافة الخلايا العصبية من باﻷسعار سليمة، مما يشير إلى أن انهانسر الحث على عدم موت الخلايا العصبية (الشكل 1ج). تم حساب معدل تعداء كالنسبة بين العدد من الجيش الملكي النيبالي المعلمة اليغو الخلايا العصبية وعدد الخلايا العصبية الإيجابية Tuj1. هو معدل متوسط تعداء ميرنا 80.7 ± 4.3% و siRNA 94.2 ± 0.3% (الشكل 1د). عند تطبيق في فيفو انهانسر الأسلوب الحالي لدراسة تجديد إكسون، العصب الوركي بالأرض وتصويرها. يمكن تتبع كل إكسون المجددة مع مسار مميزة ونهاية إكسون القاصي يمكن التعرف عليها من موقع سحق المؤشرة عقده خياطة (الشكل 2). بالإضافة إلى ذلك، نحن اليكتروبوراتيد باﻷسعار مع البلازميدات اجفب وحصاد الحبل الشوكي من T7 إلى L2 جنبا إلى جنب مع الجذور الظهرية ل L4 L5 وبعد 7 أيام. استخدمنا أنسجة راسخة إزالة البروتوكول – أوديسكو لمسح الحبل الشوكي11. محاور الأعمدة الظهرية المسمى اجفب عصبية في الحبل الشوكي تم تصويرها مجهر [كنفوكل] وثم حددت الطولي وإبراز صور السهمي (الشكل 3). وبدلاً من ذلك، يمكن معالجة الصور [كنفوكل] مع البرمجيات التصور الفحص المجهري لإعادة بناء صورة ثلاثية الأبعاد (فيلم 1).

الشكل 1 : إيمونوهيستوتشيميستري DRG cryo-قسم بعد انهانسر للمعلمة فلوريسسينتلي غير محددة ميكرورنا أو siRNA في فيفو. (أ) cryo ممثلة-قسم الأنسجة DRG حقن واليكتروبوراتيد مع المعلمة فلوريسسينتلي ميكرورناس غير المستهدفة (Dy547). الصورة اليسرى: صورة إشارة الفلورسنت (اللون الأحمر) للمعلمة فلوريسسينتلي ميكرورناس غير المستهدفة (Dy547). منتصف الصورة: المناعية-تلطيخ (اللون الأخضر) من Tuj1 مع فلوروفوري Alexa488 على الجسم المضاد الثانوي. الصورة الصحيحة: الصورة المدمجة من قناتين السابقة. شريط المقياس = 100 ميكرومتر.(ب) cryo ممثلة-قسم الأنسجة DRG حقن واليكتروبوراتيد مع المعلمة فلوريسسينتلي سيرناس غير المستهدفة (Cy3). الصورة اليسرى: صورة إشارة الفلورسنت (اللون الأحمر) للمعلمة فلوريسسينتلي سيرناس غير المستهدفة (Cy3). منتصف الصورة: المناعية-تلطيخ (اللون الأخضر) من Tuj1 مع فلوروفوري Alexa488 على الجسم المضاد الثانوي. الصورة الصحيحة: الصورة المدمجة من قناتين السابقة. هو المقياس بار يمثل 100 ميكرومتر. (ج) كثافة الخلايا العصبية سليمة DRG cryo-قسم ل الخلايا/مم ± 14.2 809.62 (N = 6) وهو حقن DRG قسم cryo 801.6 ± 27.4 خلايا/مم2 (N = 6)، يعني ± ووزارة شؤون المرأة، الطالب t-اختبار، NS: لا أهمية. وكانت الفئران الثلاثة انهانسر المؤداة في فيفو الرسم على اليسار L4 و L5 باﻷسعار مع المعلمة siRNA. كلا اليمين واليسار L4 و L5 باﻷسعار يتم حصادها بعد 48 ساعة ومعالجتها من خلال قسم البرد وإيمونوهيستوتشيميستري. لقد تم مقطوع كل الرسم إلى شرائح 60 التقريبي وسمك الشريحة 10 ميكرومترات. ثلاث شرائح لكل الرسم اختارها 200 ميكرومتر وبلغ في المتوسط. (د) معدل تعداء ميرنا المعلمة هو 80.7 ± 4.3% (N = 4) وهو siRNA المعلمة 94.2 ± 0.3% (N = 6)، يعني ± sem. وكانت الفئران الثلاثة انهانسر المؤداة في فيفو الرسم على اليسار L4 و L5 باﻷسعار مع المعلمة siRNA واثنين من الفئران مع ميرنا المعلمة. باﻷسعار تحصد بعد 48 ساعة ومعالجتها من خلال قسم البرد وإيمونوهيستوتشيميستري. لقد تم مقطوع كل الرسم إلى شرائح 60 التقريبي وسمك الشريحة 10 ميكرومترات. ثلاث شرائح لكل الرسم اختارها 200 ميكرومتر وبلغ في المتوسط. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 2 : اكتوبيكالي عن اجفب يعرض إعادة إنشاء محاور عصبية العصبية في العصب الوركي بعد سحق إصابة. تتم تسمية محاور عصبية في عصب الوركي مسطح عانى من إصابة في سحق مع اجفب (الفلورية الخضراء) تنقل من اتفاقات لمحاور عصبية. الخط الأحمر يشير إلى موضع الموقع الضرر الساحق الذي اتسم أصلاً جراحيا بعقدة سوتورينج. السهم الأبيض، والسهم، والنجوم تشير إلى ثلاث نهايات إكسون المميزة، التي تمتد من موقع سحق. شريط المقياس = 500 ميكرومتر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
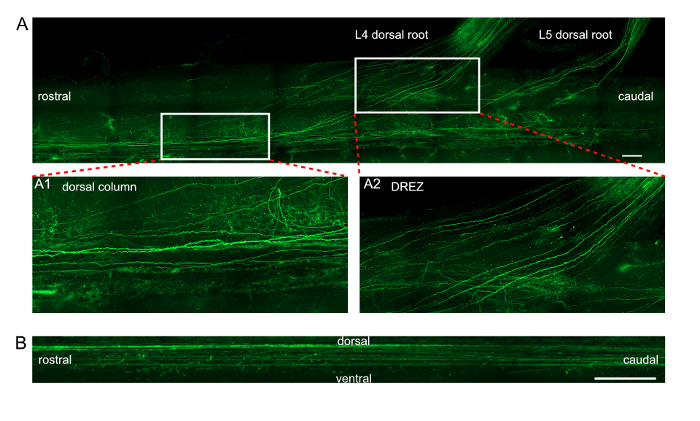
الشكل 3 : صور الإسقاط للتعبير عن اجفب محاور عصبية في الحبل الشوكي بعد في فيفو انهانسر من باﻷسعار. (أ) إسقاط طولية من محاور المسمى اجفب عصبية داخل العمود الظهرية والجذور الظهرية L4/L5. صور اقحم A1 و A2 إظهار طرق العرض المكبرة من المنطقتين مستطيلة ملحوظ في الفريق (أ). A1 يسلك طريقة عرض مفصلة لمحاور عصبية في العمود الظهري. A2 يسلك طريقة عرض مفصلة لمحاور عصبية في منطقة دخول الجذر الظهرية (دريز). شريط المقياس = الإسقاط السهمي 200 ميكرومتر. (ب) من محاور المسمى اجفب عصبية داخل العمود الظهرية. شريط المقياس = 50 ميكرومتر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
الفيلم 1: 3D التعمير للتعبير عن اجفب محاور عصبية في الحبل الشوكي بعد في فيفو انهانسر من باﻷسعار. من فضلك انقر هنا لمشاهدة هذا الفيديو. (انقر بالزر الأيمن التحميل.)
Discussion
العديد من الخطوات الجراحية تتطلب اهتماما خاصا. L4 و L5 باﻷسعار (موقع حسام)، التي تهيمن على العصب الوركي، تحتاج إلى تحديد بشكل صحيح وحقن بنيات الجينات. خلاف ذلك، ستكون غائبة التجارة والنقل-وضع العلامات في العصب الوركي محاور عصبية. يمكن اعتبار القمم حرقفي المعالم التشريحية مفيدة لتحديد L4 و L5 باﻷسعار. في معظم أجهزة الماوس، الأوجه المشتركة بين فقرات L5 و L6 قريب من القمم حرقفي12. بدلاً من ذلك، الرسم L3 يمكن اختيار بدلاً من L5، لا سيما لفحوصات مثل إيمونوهيستوتشيميستري أو لطخة غربية13، كما التعرض الجراحية للرسم L5 تجتمع عادة صعوبات كبيرة بسبب مكان عميق وإمدادات الدم الغني. أيضا، يجب تجنب الجراحة كله DRG الضارة المحيطة بالهياكل، بما في ذلك الحبل الشوكي وجذور الأعصاب. وتتمثل الخطوة الثانية الحاسمة التشغيلية الجدير بالحقن. الصبغة "الخضراء سريعة" مختلط مع الحل من بنيات الجينات لتصور الحل الذي طرد من الإبرة ومنتشر في الرسم. يجب أن تظهر حقنه ناجحة الرسم واضحة مستديرة الشكل المبين بصبغة الفلورسنت. إذا كان الحل بصبغة الفلورسنت التسريبات من الرسم أثناء الحقن، صقل ذهابا وإيابا على عمق غيض الإبرة الدقيقة يمكن ضمان حقن كاملة لكل حل في الكبسولة DRG. تجنب التخوزق الرسم في أكثر من ثلاثة مواقع مختلفة. علاوة على ذلك، معتدل النزيف أمر لا مفر منه عادة بعد الحقن بالرسم، كما يتم تغليف باﻷسعار محكم مع ريتي فينوسوم13. من المهم لوقف النزيف حيث أنه لن يكون هناك دم العزل سطح الرسم من أقطاب خلال انهانسر. انهانسر الناجح يعتمد على توصيل الكهرباء الحالية، ويمكن تطبيق حل برنامج تلفزيوني على مسرى. وأخيراً، الموقع في العصب الوركي حيث يتم سحقها بالملقط يجب وضع علامة مع مايكرو-خياطة، نظراً لأن الموقع الضرر غير مرئية تحت المجهر، ويحتاج إلى أن يبين كنقطة انطلاق للتجدد إكسون لتحليل الصور في وقت لاحق. إذا العقدة خياطة ابينيورال في موقع سحق يسقط بعد نضح الحيوان والتشريح، من الضروري إعادة تسمية الموقع نفسه مع خياطة فورا على العصب منهاج عمل بيجين--الثابتة عند المسافة البادئة التي يسببها الازدحام لا تزال قابلة للتحديد.
من بين التقنيات تعداء، قد انهانسر بمعدل أعلى من تعداء. ووفقا للدراسة، معدل تعداء العصبية DRG ميكرورناس أو سيرناس بعد في فيفو انهانسر ما يقرب من 90 في المائة. الأهم من ذلك، في فيفو انهانسر وقتاً أقل بكثير من الأساليب المستندة إلى الفيروس، التي تتطلب التغليف الفيروس من بنيات الجين المرغوب. وبقدر ما نعلم، على الرغم من أن قد تعداء المستندة إلى ليبوفيكتاميني في فيفو أقل سمية من انهانسر، ليبوفيكتاميني لا يعمل على الخلايا العصبية DRG خاصة، لا في فيفو أو في المختبر. الجدير بالذكر، بالمنهجية الحالية العديد من القيود التقنية. أولاً، مدة فعالية siRNA لإسقاط الجينات في المصالح أقصر من إيصال المستندة إلى الفيروس والبلازميدات. ولذلك الإجراء بأكمله من انهانسر للتضحية الحيوانية قد انتهى في 4 – 6 أيام14. بالإضافة إلى ذلك، يتطلب عملية جراحية تحت المجهر الممارسة وبعض البراعة اليدوية. لمبتدئ، غالباً ما مدة الجراحة وقتاً أطول من المتوقع. وقد جرعة مخدر تدار بالماوس التحكم بعناية لمنع الوفيات غير المرغوب فيها. وأخيراً، تسطيح العصب الوركي يسبب تداخل محاور عصبية عند إجراء تصوير ابيفلوريسسينت. تصوير الأعصاب المسطحة مع مجهر [كنفوكل] خيار بديل.
تشريحيا، يكون الرسم الخلايا العصبية الحسية فرعين محواري-فرع تنازلي المحيطية وفرع الوسطى تصاعدي إسقاط في الظهرية العمود الفقري10. كما يبين المنهجية الحالية لوضع العلامات المميزة العمود الظهرية للنخاع الشوكي. وهكذا، يمكن استخدام منهجية مماثلة كنموذج للتحقيق في التجدد إكسون الحسية بعد إصابة الحبل الشوكي. جنبا إلى جنب مع تقنيات إزالة الأنسجة11، الفحص المجهري [كنفوكل] التقليدية أو الخفيفة--ورقة الفحص المجهري يمكن أن تستخدم على عينة النخاع الشوكي تم مسحها لبناء 3D صور أعيد بناؤها من محاور عصبية حسية داخل العمود الظهرية للنخاع الشوكي.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
ومولت الدراسة (منح و-Q. Z.) من المعاهد الوطنية للصحة (R01NS064288، R01NS085176، R01GM111514، R01EY027347) ومؤسسة نيلسون H. كريغ ومؤسسة برايتفوكوس.
Materials
| Name | Company | Catalog Number | Comments |
| ECM 830 Square wave electroporation system | BTX Harvard Apparatus | 45-0052 | For in vivo electroporation |
| Tweezertrodes electrodes | BTX Harvard Apparatus | 45-0524 | For in vivo electroporation, 1 mm flat |
| Picospritzer III | Parker Instrumentation | 1096 | Intracellular Microinjection Dispense Systems |
| Glass Capillary Puller | NARISHIGE | PC-10 | |
| Borosilicate Glass Capillaries | World Precision Instruments, Inc. | 1902328 | |
| Stereo Dissection Microscope | Leica | M80 | |
| Microsurgery Rongeur | F.S.T | 16221-14 | |
| Microsurgery Forceps | FST by DUMONT, Switzerland | 11255-20 | Only for sciatic nerve crush |
| Glass Capillary | World Precision Instruments, Inc. | TW100-4 | 10 cm, standard wall |
| Tape | Fisherbrand | 15-901-30 | For fixing the mouse on the corkboard |
| 2, 2, 2-Tribromoethanol (Avertin) | Sigma-Aldrich | T48402 | Avertin stock solution |
| 2-methyl-2-butanol | Sigma-Aldrich | 152463 | Avertin stock solution |
| siRNA Fluorescent Universal Negative Control #1 | Sigma-Aldrich | SIC003 | Non-target siRNA with fluorescence |
| microRNA Mimic Transfection Control with Dy547 | Dharmacon | CP-004500-01-05 | Non-target microRNA with fluorescence |
| Plasmids preparation kit | Invitrogen Purelink | K210016 | GFP-coding plasmid preparation |
| Fast Green Dye | Millipore-Sigma | F7252 | For better visualization of the DRG outline during injection |
| Ketamine | Putney, Inc | NDC 26637-731-51 | Anesthesia induction |
| Xylazine | AnaSed | NDC 59399-110-20 | Anesthesia induction |
| Acetaminophen | McNeil Consumer Healthcare | NDC 50580-449-36 | Post-surgical pain relief |
References
- Saijilafu, , et al. PI3K-GSK3 signalling regulates mammalian axon regeneration by inducing the expression of Smad1. Nature Communications. 4, 2690 (2013).
- Zhang, B. Y., et al. Akt-independent GSK3 inactivation downstream of PI3K signaling regulates mammalian axon regeneration. Biochemical and Biophysical Research Communications. 443 (2), 743-748 (2014).
- Jiang, J. J., et al. MicroRNA-26a supports mammalian axon regeneration in vivo by suppressing GSK3beta expression. Cell Death & Disease. 6, 1865 (2015).
- Krames, E. S. The role of the dorsal root ganglion in the development of neuropathic pain. Pain Medicine. 15 (10), 1669-1685 (2014).
- Salimzadeh, L., Jaberipour, M., Hosseini, A., Ghaderi, A. Non-viral transfection methods optimized for gene delivery to a lung cancer cell line. Avicenna Journal of Medical Biotechnology. 5 (2), 68-77 (2013).
- Keeler, A. M., ElMallah, M. K., Flotte, T. R. Gene Therapy 2017: Progress and Future Directions. Clinical and Translational Science. 10 (4), 242-248 (2017).
- Neumann, E., Schaeferridder, M., Wang, Y., Hofschneider, P. H. Gene-Transfer into Mouse Lyoma Cells by Electroporation in High Electric-Fields. The EMBO Journal. 1 (7), 841-845 (1982).
- Liu, C. M., et al. MicroRNA-138 and SIRT1 form a mutual negative feedback loop to regulate mammalian axon regeneration. Genes & Development. 27 (13), 1473-1483 (2013).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240 (1), 237-246 (2001).
- Saijilafu, E. M., Hur, F. Q., Zhou, Genetic dissection of axon regeneration via in vivo electroporation of adult mouse sensory neurons. Nature Communications. 2, 543 (2011).
- Pan, C., et al. Shrinkage-mediated imaging of entire organs and organisms using uDISCO. Nature Methods. 13, 859 (2016).
- Rao, R. D., Bagaria, V. B., Cooley, B. C. Posterolateral intertransverse lumbar fusion in a mouse model: surgical anatomy and operative technique. Spine Journal. 7 (1), 61-67 (2007).
- Dommisse, G. F. The blood supply of the spinal cord. A critical vascular zone in spinal surgery. The Journal of Bone and Joint Surgery. British Volume. 56 (2), 225-235 (1974).
- Sorensen, D. R., Leirdal, M., Sioud, M. Gene Silencing by Systemic Delivery of Synthetic siRNAs in Adult Mice. Journal of Molecular Biology. 327 (4), 761-766 (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved