Method Article
Chargée de l’enquête la régénération axonale mammifères : In Vivo électroporation du Ganglion de la racine dorsale de souris adulte
Dans cet article
Résumé
Électroporation est une approche efficace pour livrer des gènes d’intérêts dans les cellules. En appliquant cette approche in vivo sur les neurones du ganglion de la racine dorsale de souris adulte (DRG), les auteurs décrivent un modèle pour l’étude de la régénération axonale in vivo.
Résumé
Électroporation est une approche de transfection du gène non viraux essentiel pour introduire des plasmides d’ADN ou de petites molécules d’ARN dans des cellules. Un neurone sensitif du ganglion de la racine dorsale (DRGs) s’étend d’un seul axone avec deux branches. Une branche va au périphérique nerf (branche périphérique) et l’autre branche pénètre dans la moelle épinière par l’intermédiaire de la racine dorsale (direction de la centrale). Après la lésion neurale, la branche périphérique régénère vigoureusement tandis que la branche centrale ne régénère pas. En raison de la forte capacité régénératrice, la régénération axonale sensorielle a été largement utilisée comme système modèle pour étudier la régénération axonale mammifères en système nerveux périphérique (SNP) et le système nerveux central (CNS). Nous décrivons ici un protocole approche établie antérieurement pour manipuler l’expression des gènes dans les neurones sensoriels matures in vivo par électroporation. Après transfection avec plasmides ou petits RNA oligos (siARN ou micro-ARN), l’approche permet les deux expériences de perte et de gain de-fonction d’étudier les rôles des gènes-de-intérêts ou de micro-ARN dans le règlement d’axon regeneration in vivo. En outre, la manipulation de l’expression génique in vivo peut être commandée spatialement et temporellement dans un cours laps de temps relativement court. Ce système de modèle fournit un outil unique pour étudier les mécanismes moléculaires par lesquels la régénération axonale mammifères est réglementé en vivo.
Introduction
Lésions du système nerveux provoquée par un traumatisme nerveux ou diverses maladies neurodégénératives généralement entraîner des défauts dans les fonctions motrices, sensorielles et cognitives. Récemment, beaucoup d’efforts a été consacré à la restitutio in integrum puissance régénératrice dans les neurones adultes pour restaurer les statuts physiologique blessé neurones1,2,3. Les neurones sensoriels dans le PMSI sont un amas de cellules nerveuses qui transmettent les stimuli sensoriels différents, tels que douleur, température, touch ou posture du corps, le cerveau. Chacun de ces neurones est Pseudo-aléatoire unipolaire et contient un seul axone qui bifurque avec une branche qui s’étend vers la périphérie et l’autre branche vers la moelle épinière4. Les neurones sensoriels adultes en GHM sont parmi les quelques neurones mammifères matures connues pour régénérer leurs axones activement après une blessure. Par conséquent, lésions des axones sensoriels ont été employées intensivement comme un modèle crucial pour étudier les mécanismes de la régénération axonale in vivo.
In vivo techniques de transfection génétique, qui sont généralement moins de temps à mettre en place et plus souple que l’utilisation d’animaux transgéniques, ont joué un rôle essentiel dans l’étude des fonctions des gènes et signalisation dans le système nerveux. Les principales techniques peuvent être classés en deux approches : la5axée sur l’instrument et la base de virus. Base virale in vivo la livraison de gène dans les neurones adultes peut fournir précise manipulation spatio-temporelle de gene expression6. Cependant, beaucoup de travail processus interviennent dans les méthodes axées sur le viral, tels que la production et la purification des particules virales contenant le gène désiré. En outre, beaucoup de vecteurs viraux pourrait activer le système immunitaire de l’hôte, qui peut interférer avec l’acquisition de données, analyse de données et éventuellement induire en erreur l’interprétation des résultats expérimentaux. Électroporation, une approche axée sur l’instrument typique de la transfection, utilise une impulsion électrique pour augmenter la perméabilité des cellules et des membranes nucléaires transitoirement, ce qui favorise l’afflux de vecteurs de gènes ou de petits RNA oligos depuis l’espace à l’extérieur des cellules7 . In vitro électroporation est largement reconnue comme une stratégie transitoire mais très efficace pour manipuler l’expression des gènes ciblés dans plusieurs types de cellules. Bien que en vivo électroporation ne conduit qu’à l’expression transitoire avec la faible efficacité de transfection par rapport aux vecteurs viraux, il a plusieurs avantages par rapport aux approches virales. Par exemple, il peut être appliqué à presque tous les tissus et cellules7,8,9. En outre, deux plasmides codant des gènes d’intérêt ou petits RNA oligos (p. ex., siRNAs, microARN) contre certaines transcriptions peuvent être injectés directement dans le tissu cible et puis électrique pulsés, qui rendre la procédure moins du travail - et temps - consommer. En outre, il est possible de transfectants plusieurs plasmides et RNA oligos simultanément avec l’électroporation unique.
Nous avons établi une démarche d’électroporation in vivo pour manipuler l’expression des gènes dans les neurones sensoriels de souris adultes et appliquée avec succès et validé cette approche dans nombreuses études pionnières1,2,3 ,8,10. Nous présentons ici un protocole détaillé afin de faciliter l’utilisation de cette approche pour les études futures de la régénération axonale chez les mammifères.
Protocole
Toutes les expériences animales ont été effectuées conformément au protocole animal approuvé par le Comité de l’emploi et de Johns Hopkins Institutional Animal Care.
1. matériels et réactifs
-
Animaux
- Utilisez la souris CF1 femelles âgés de six semaines, pesant 30 à 35 g pour les expériences.
Remarque : Les souris ont été logés en groupe (5 souris par cage) dans des cages stérilisés individuellement ventilés avec 1/4" corn cob literie et 2" carrées nidification pour la nidification. Les cages ont été maintenus dans un cycle lumière-obscurité de 12 h à l’adresse contrôlé et la température de la pièce était entre 19,4 ° C et 25 ° C. Les souris ont été nourries avec globale alimentation rongeur et fournissant le système automatique de l’eau.
- Utilisez la souris CF1 femelles âgés de six semaines, pesant 30 à 35 g pour les expériences.
-
Instruments de
- Utiliser les instruments chirurgicaux suivants pour procéder efficacement à la chirurgie : fourrure de seringues jetables (27 G, 1,0 mL) pour injection intrapéritonéale, tondeuse, microscope stéréo dissection, pinces de microchirurgie, microchirurgie ciseaux et pinces-gouges petit os et stérilisés éponges non tissé.
NOTE : Tous les instruments et les matériaux sont stérilisés à l’autoclave avant la chirurgie ou préalablement stérilisé par les producteurs. Pendant la chirurgie, les instruments sont pulvérisés avec de l’alcool de 75 % de maintenir la stérilisation.
- Utiliser les instruments chirurgicaux suivants pour procéder efficacement à la chirurgie : fourrure de seringues jetables (27 G, 1,0 mL) pour injection intrapéritonéale, tondeuse, microscope stéréo dissection, pinces de microchirurgie, microchirurgie ciseaux et pinces-gouges petit os et stérilisés éponges non tissé.
-
Solutions anesthésiques
- Utiliser la solution anesthésique #1 pour induire l’anesthésie et utiliser la solution #2 de l’anesthésie avant l’injection de DRG pour maintenir l’anesthésie.
- Pour rendre la solution anesthésique #1, diluer la kétamine et xylazine dans du sérum physiologique stérile à une concentration finale de 10 mg/mL et 1,2 mg/mL.
- Pour rendre la solution anesthésique #2, diluer avertin dans du sérum physiologique stérile à une concentration finale de 20 mg/mL.
- Utiliser la solution anesthésique #1 pour induire l’anesthésie et utiliser la solution #2 de l’anesthésie avant l’injection de DRG pour maintenir l’anesthésie.
-
L’ADN plasmidique et ARN Oligos
- Préparer les plasmides à l’aide de la trousse commerciale suivant les protocoles du fabricant en conséquence. Diluer le plasmide DNAs dans l’eau désionisée stérile à la concentration de 2,0 µg/µL.
- Ajouter la solution de colorant vert rapide pour atteindre une concentration finale de 0,005 à 0.01 % (v/v) pour une meilleure visualisation de l’esquisse de la DRG pendant l’injection.
- Dissoudre les oligos siARN ou miARN dans les tampons correspondants fournis par les fabricants pour atteindre une concentration finale à 50 µM.
-
Pipette de micro-injection
- Tirer le verre capillaire en utilisant les micropipettes et couper l’extrémité de la pipette de verre capillaire extraite avec des ciseaux de microchirurgie à générer une ouverture avec un diamètre extérieur approximatif de 50 µm. Puis stériliser la pipette de verre sous la lumière UV sur un banc propre pendant 20 à 30 min environ.
- Mont la pipette de verre stérilisé sur le titulaire de la pipette reliée à une microinjection intracellulaire Pipeter système. Définissez les paramètres du système microinjection à 30 lb/po2 de pression et 8 ms de durée.
-
Système d’électroporation
- Connecter les électrodes au système électroporation onde carrée et définir les paramètres suivants : ms 15 impulsions à 35 V avec intervalles de 950 ms pour in vivo électroporation.
-
La perfusion et la Solution de fixation
- Dissoudre la poudre de paraformaldéhyde (PFA) dans du PBS 1 x à une concentration de 4 % (p/v). Stocker la solution de la PFA à 4 ° C.
2. experimental procédures
-
Exposition chirurgicale de la L4 et L5 DRGs
- Anesthésier la souris à l’aide d’une injection intrapéritonéale de la solution anesthésique #1 préparé auparavant (avec la kétamine 100 mg/kg de poids corporel et de xylazine 12 mg/kg de poids corporel).
- Raser la zone chirurgicale avec la tondeuse de la fourrure.
Remarque : Puisqu’il y aura une autre chirurgie pour l’écrasement du nerf sciatique gauche, la fourrure de la cuisse postérieure gauche peut être rasée en même temps. - Placez votre souris sur la couverture chauffée (35,0 ° C) et de surveiller la température rectale avec une sonde de température.
- Pour tester l’anesthésie, pincez les orteils et la queue de la souris et observer les réponses comportementales.
- Bande des quatre membres de la souris sur le tableau des visages.
- Essuyer la zone chirurgicale avec solution iodophore, puis à 75 % d’alcool pour enlever l’iodophore avant de couper la peau.
- Appliquer pommade ophtalmique sur les yeux pour prévenir le dessèchement tandis que sous anesthésie.
- Avant l’incision, marque les deux côtés de la ligne de crête iliaque avec un marqueur de fin. Tracer une ligne reliant deux points de crêtes iliaques pour faciliter l’identification des positions des GHM L5.
- Faire une incision de 3 cm le long de la ligne médiane du bas du dos avec des micro-ciseaux. En outre, détacher les muscles paraspinous, tels que le multifidus musculus et le musculus longissimus lumborum, de la L3 à S1 apophyses épineuses et exposer les articulations facettaires de 5-L4 et L5-6.
- Utiliser un micro-rongeur pour enlever les joints de facette du 5-L4 et L5-6. En outre, supprimer l’arc neural gauche de L4 et L5 pour exposer la face dorsale de la DRG.
-
Injection de DRG
- Injecter la solution anesthésique #2 (avec avertin 200 mg/kg de poids corporel) par voie intrapéritonéale pour maintenir l’anesthésie avant l’injection de DRG.
- Charger les plasmides d’ADN ou RNA oligos (1 µL par DRG) dans la pipette capillaire de verre.
- Insérez l’extrémité de la pipette de verre capillaire soigneusement dans le PMSI.
- Injecter progressivement 1,0 µL de solution de plasmides d’ADN ou RNA oligos dans le PMSI en utilisant la microinjection intracellulaire administrer des systèmes (30 psi, 8 ms).
Remarque : La durée de l’injection devrait durer pas moins de 5 minutes.
-
Électroporation
- Laisser tomber des PBS sur les bouts des électrodes.
- Nettoyer le saignement avec de la gaze de coton carré stérilisé.
- Pincez la cible DRG avec les électrodes doucement et appliquer 5 impulsions carrées électriques avec le système d’électroporation.
- Fermer les couches de muscle et de peau respectivement avec les sutures de nylon de 5-0.
- Placez votre souris sur une couverture chauffée (35,0 ° C) sous une grande attention jusqu'à ce qu’il a complètement repris conscience suffisante pour maintenir le décubitus sternal. Retourner la souris à la cage après qu’il a pleinement récupéré de l’anesthésie.
Remarque : Il faut environ 60 min pour la souris complètement récupérer de l’anesthésie sur la couverture de 37 ° C. Faites dissoudre un ibuprofène comprimé (200 mg) dans 1 000 ml d’eau (0,2 mg/ml) destinés à l’alimentation quotidienne pour soulager la douleur postopératoire.
-
Écrasement du nerf sciatique
- Deux ou trois jours (selon le protocole expérimental) après l’électroporation DRG, anesthésier la souris par voie intrapéritonéale avec solution anesthésique #2 (avec avertin 400 mg/kg de poids corporel).
- Bande des quatre membres de la souris sur le tableau des visages.
- Faire une incision de 1 cm 0,5 cm vers la gauche le long de la ligne médiane. Couper les muscles, tels que le muscle grand fessier et le muscle piriforme, longitudinalement. Exposer le segment du nerf sciatique entre le plus grand foramen sciatique et l’entaille sciatique.
- Écrasement du nerf avec une pince de microchirurgie pour 12 s et marque le site de l’écrasement par une suture d’epineural en nylon 10-0. Faire un noeud sur la membrane durale pour marquer le site de l’écrasement.
- Fermer les couches de muscle et de peau avec suture de nylon de 5-0.
- Placez votre souris sur une couverture chauffée (35,0 ° C) avec une grande attention jusqu'à ce qu’il a complètement repris conscience suffisante pour maintenir le décubitus sternal. Retourner la souris à la cage après qu’il a pleinement récupéré de l’anesthésie.
Remarque : Il faut environ 60 min pour la souris complètement récupérer de l’anesthésie sur la couverture de 37 ° C. Faites dissoudre un ibuprofène comprimé (200 mg) dans 1 000 ml d’eau (0,2 mg/ml) destinés à l’alimentation quotidienne pour soulager la douleur postopératoire.
-
Perfusion de souris, PMSI et récolte de nerf sciatique
- Deux ou trois jours après l’écrasement du nerf sciatique (selon le protocole expérimental), anesthésier la souris par voie intrapéritonéale avec solution anesthésique #2.
- Perfuse la transcardially souris avec du PBS (pH 7,4), suivie de paraformaldéhyde glacée de 4 % (PFA) (pH 7.5) dans du PBS.
- Après la perfusion, séparez les DRGs ainsi que les racines nerveuses et le nerf sciatique avant le genou avec soin par micro-ciseaux et micro-forceps sous le microscope à dissection. Placez le nerf sciatique directement chez 4 % PFA pour la nuit à 4 ° C.
-
Imagerie et en mesurant les axones sensoriels marqués par Fluorescence
- Dénudez la gencive attachée et la membrane sur le nerf sciatique fixe avec micro-ciseaux et pinces-micro soigneusement sous le microscope à dissection. Puis, échanger les 4 % PFA avec PBS et laver le nerf trois fois.
- Déposer le nerf sciatique sur une lame et continuez tout droit. Ajouter 80 µL de solution antifade autour du nerf, puis poser une lamelle sur elle. Aplatir le tissu tout monté avec pression.
- Placer les tissus de niveler le microscope inversé epifluorescent équipé d’un accessoire pour l’acquisition de mosaïque et de traitement d’image.
Remarque : Les longueurs d’excitation et d’émission sont 488 nm et 509 nm. Il est également possible de prendre plusieurs images qui se chevauchent manuellement et relier les images avec ImageJ avec la plug-in de mosaïque. - Lorsque vous mesurez la longueur des axones régénérés, trace identifiables tous marqués au fluorescently des axones dans le nerf sciatique depuis le site d’écrasement (marqué par la suture epineural de 10-0) à l’extrémité de l’axone distal.
Résultats
Pour quantifier la cytotoxicité du protocole actuel et de valider que la transfection in vivo DRG électroporation est assez élevée, nous avons injecté et électroporation fluorescent-étiquetées micro-ARN ou siARN dans L4 et L5 DRGs. Les DRGs détachés ont été traitées par cryo-sectionnement et immunohistochimie (Figure 1A-B). Lors de l’estimation du taux de survie de cellule après l’injection et l’électroporation, les DRGs intacts de L4 et L5 ont été récoltées et transformées par cryo-sectionnement et l’immunohistochimie. Les densités de neurone, traduites avec une coloration Tuj1, n’a pas montré une différence significative par rapport à la densité de neurones des GHM intact, ce qui indique que l’électroporation n’a pas induit la mort des cellules neuronales (Figure 1C). Le taux de transfection a été calculé comme le rapport entre le nombre de neurones d’oligo RNA Tags et le nombre de neurones Tuj1 positifs. Le taux moyen de transfection de miRNA est 80,7 ± 4,3 % et le siARN 94,2 ± 0,3 % (Figure 1D). Lorsque vous appliquez l’actuel en vivo électroporation méthode pour étudier la régénération axonale, le nerf sciatique a été aplati et imagé. Chaque axone régénérée avec trajectoire distinctif et à la fin de l’axone distal reconnaissable peut être tracée sur le site de l’écrasement indiqué par le nœud de suture (Figure 2). En outre, nous électroporation les DRGs avec plasmides EGFP et récolté de la moelle épinière de T7 à L2 avec racines dorsales de L4 et L5 après 7 jours. Nous avons utilisé un tissu bien établi protocole de compensation — uDISCO pour effacer la moelle épinière11. Les axones de la colonne dorsale marquée EGFP dans la moelle épinière ont été photographiés avec un microscope confocal et ensuite identifiées dans le longitudinal et les projeter des images sagittales (Figure 3). Par ailleurs, les images confocales peuvent être traitées avec logiciel de visualisation de microscopie à reconstruire une image 3D (film 1).

Figure 1 : Immunohistochimie de DRG cryo-section après l’électroporation de fluorescent-étiquetées non-spécifiques micro-ARN ou siRNA in vivo. (A) représentant cryo-section de tissu DRG injecté et électroporation avec fluorescent-tag (Dy547) non cibles microARN. Image de gauche : l’image du signal fluorescent (couleur rouge) de fluorescent-tag (Dy547) non cibles microARN. Image du milieu : immunomarquage (couleur verte) de Tuj1 avec un fluorophore Alexa488 sur l’anticorps secondaire. Image de droite : l’image fusionnée des deux canaux précédents. Echelle = 100 µm.()B) représentant cryo-section du tissu DRG injecté et électroporation avec fluorescent-étiquetées (Cy3) non-cibles siRNAs. Image de gauche : l’image du signal fluorescent (couleur rouge) des siRNAs de non-cible (Cy3) fluorescent-étiquetées. Image du milieu : immunomarquage (couleur verte) de Tuj1 avec un fluorophore Alexa488 sur l’anticorps secondaire. Image de droite : l’image fusionnée des deux canaux précédents. L’échelle bar représente 100 µm. (C), la densité de neurones d’une cryo-section DRG intacte est 809.6 ± 14,2 cellules/mm2 (N = 6) et une injection DRG cryo-section est 801.6 ± 27,4 cellules/mm2 (N = 6), moyenne ± SEM, de Student t-test, NS : aucun signification. Trois souris ont été exécutées en vivo DRG électroporation sur la gauche L4 et L5 DRGs avec siARN étiqueté. Aussi bien droite et gauche L4 et L5 DRGs sont récoltées après 48 h et traitées par cryo-section et l’immunohistochimie. Chaque DRG a été sectionné en environ 60 tranches et l’épaisseur de la tranche est de 10 μm. Trois tranches de chaque DRG sont sélectionnés par 200 μm et moyenne. (D), le taux de transfection de la miRNA marqué est de 80,7 ± 4,3 % (N = 4) et le siARN étiqueté est 94,2 ± 0,3 % (N = 6), moyenne ± SEM Trois souris ont été exécutées en vivo DRG électroporation sur la gauche L4 et L5 DRGs avec siARN étiqueté et deux souris avec miRNA étiqueté. Le DRG est récoltées après 48 h et traitées par cryo-section et l’immunohistochimie. Chaque DRG a été sectionné en environ 60 tranches et l’épaisseur de la tranche est de 10 μm. Trois tranches de chaque DRG sont sélectionnés par 200 μm et moyenne. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : Exprimée de façon ectopique EGFP affiche régénéré des axones neurones dans le nerf sciatique après écrasement. Les axones dans un nerf sciatique aplati, souffrait d’une blessure par écrasement sont étiquetés avec EGFP (fluorescence verte) transportée des somas dans les axones. La ligne rouge indique la position du site de lésion écrasant, initialement chirurgicalement marquée par un noeud de suture. La flèche blanche, flèche et star indiquent trois extrémités de l’axone distinctif, qui s’étendent depuis le site de l’écrasement. Echelle = 500 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
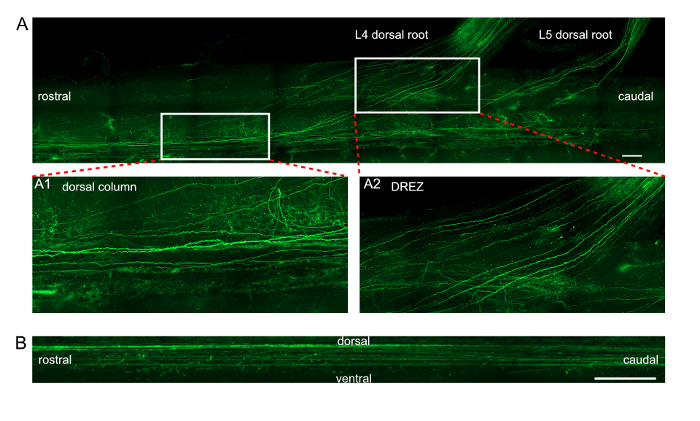
Figure 3 : Images de projection des axones exprimant EGFP dans la moelle épinière après en vivo électroporation des GHM. (A) projection longitudinale des axones EGFP marqués dans la colonne dorsale et les racines dorsales L4/L5. Images de médaillon A1 et A2 montrent une vue agrandie des zones rectangulaires deux dans panneau (A). A1 présente une vue détaillée des axones dans la colonne dorsale. A2 présente une vue détaillée des axones dans la zone d’entrée de la racine dorsale (zerd). Echelle = 200 µm. (B) projection sagittale des axones EGFP marqués dans la colonne dorsale. Echelle = 50 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Movie 1 : reconstruction 3D d’axones exprimant EGFP dans la moelle épinière après en vivo électroporation des GHM. S’il vous plaît cliquez ici pour voir cette vidéo. (Clic droit pour télécharger.)
Discussion
Plusieurs étapes chirurgicales nécessitent une attention particulière. Le L4 et L5 DRGs (emplacement de somas), qui dominent le nerf sciatique, doivent être correctement identifiés et une injection de gènes chimères. Dans le cas contraire, la GFP-étiquetage seront absent dans les axones du nerf sciatique. Les crêtes iliaques peuvent considérer comme des repères anatomiques utiles pour déterminer des L4 et L5 DRGs. Dans la plupart des souris, la facette conjointe entre les vertèbres L5 et L6 est proche de celle des crêtes iliaques,12. Alternativement, DRG L3 peut être choisie au lieu de L5, surtout pour les tests comme l’immunohistochimie ou par transfert western13, comme l’exposition chirurgicale de DRG L5 réunit habituellement de grandes difficultés en raison d’une situation profonde et d’approvisionnement en sang riche. Aussi, la chirurgie toute devrait éviter DRG nuisible autour de structures, y compris la moelle épinière et les racines nerveuses. La deuxième étape opérationnelle essentielle à noter est l’injection. Le colorant Fast Green était mélangé à la solution des gènes chimères pour visualiser la solution éjectée de l’aiguille et diffuse dans le PMSI. Une injection réussie devrait montrer une forme ronde clairs DRG décrite par le colorant fluorescent. Si la solution avec un colorant fluorescent s’écoule de la DRG s’injecter, un arrière-et-vient affiner sur la profondeur de la pointe de l’aiguille-micro peut assurer injection complete de toute la solution dans la capsule DRG. Évitez d’empaler la DRG sur plus de trois sites différents. En outre, légère hémorragie est habituellement inévitable après injection de DRG, DRG est encapsulés hermétiquement avec rete venosum13. Il est important d’arrêter le saignement afin qu’il y aura pas de sang, isolant la surface de DRG d’électrodes au cours de l’électroporation. Électroporation réussie dépend de la transduction du courante électrique, et solution de PBS peut être appliquée sur l’électrode. Enfin, le site sur le nerf sciatique s’est écrasé avec pinces doivent être marquées avec micro-suturer, parce que le site de la lésion est invisible au microscope et doit être indiqué comme point de départ de la régénération axonale d’analyse d’image plus tard. Si le nœud de suture epineural sur le site de l’écrasement se décolle après dissection et perfusion animale, il est essentiel de ré-étiqueter le même site avec une suture immédiatement sur le nerf PFA-correction quand l’indentation induite par l’écrasement est toujours identifiable.
Parmi les techniques de transfection, électroporation a un taux plus élevé de la transfection. Selon notre étude, le taux de transfection du neurone DRG pour micro-ARN ou siRNAs après en vivo electroporation est près de 90 %. Plus important encore, en vivo electroporation est beaucoup moins de temps que les méthodes axées sur le virus, qui exigent des emballages de virus de désirée gènes chimères. Que nous savons, même si la transfection basée sur lipofectamine en vivo a une toxicité moindre que l’électroporation, la lipofectamine ne fonctionne pas sur les neurones de la DRG en particulier, ni in vivo ni in vitro. Remarquable, la méthodologie actuelle a plusieurs limitations techniques. Tout d’abord, la durée de l’efficacité des siARN pour faire tomber le gène d’intérêt est plus courte que la prestation de base de virus de plasmides. Par conséquent, tout le processus depuis l’électroporation de sacrifices d’animaux doit être terminé en 4 à 6 jours,14. En outre, la chirurgie exécutée sous le microscope nécessite pratique et une dextérité manuelle. Pour un novice, la durée de la chirurgie est souvent plus longtemps que prévu. La dose d’anesthésique administrée à la souris doit être soigneusement contrôlé pour éviter la mortalité non désirée. Enfin, aplatissement du nerf sciatique provoque chevauchement des axones lorsqu’il procède à l’imagerie épifluorescence. Imagerie des nerfs non aplaties avec un microscope confocal est une option alternative.
Anatomiquement, les neurones sensoriels de la DRG ont deux branches axonales - la branche descendante périphérique et la branche centrale ascendante, la projection dans la colonne dorsale de la moelle épinière10. La méthodologie actuelle montre également un étiquetage distinctif de la colonne dorsale de la moelle épinière. Ainsi, une méthodologie similaire peut servir comme modèle pour étudier la régénération axonale sensorielle après une lésion de la moelle épinière. Combiné avec le nettoyage des tissus techniques11, en microscopie confocale classique ou microscopie de lumière-feuille peut être utilisée sur l’échantillon de dégagé la moelle épinière pour construire 3D images reconstruites d’axones sensoriels dans la colonne dorsale de la moelle épinière.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
L’étude a été financée (décernée à F-Q. Z.) par les NIH (R01NS085176, R01GM111514, R01NS064288, R01EY027347), the Craig H. Neilsen Foundation et la Fondation BrightFocus.
matériels
| Name | Company | Catalog Number | Comments |
| ECM 830 Square wave electroporation system | BTX Harvard Apparatus | 45-0052 | For in vivo electroporation |
| Tweezertrodes electrodes | BTX Harvard Apparatus | 45-0524 | For in vivo electroporation, 1 mm flat |
| Picospritzer III | Parker Instrumentation | 1096 | Intracellular Microinjection Dispense Systems |
| Glass Capillary Puller | NARISHIGE | PC-10 | |
| Borosilicate Glass Capillaries | World Precision Instruments, Inc. | 1902328 | |
| Stereo Dissection Microscope | Leica | M80 | |
| Microsurgery Rongeur | F.S.T | 16221-14 | |
| Microsurgery Forceps | FST by DUMONT, Switzerland | 11255-20 | Only for sciatic nerve crush |
| Glass Capillary | World Precision Instruments, Inc. | TW100-4 | 10 cm, standard wall |
| Tape | Fisherbrand | 15-901-30 | For fixing the mouse on the corkboard |
| 2, 2, 2-Tribromoethanol (Avertin) | Sigma-Aldrich | T48402 | Avertin stock solution |
| 2-methyl-2-butanol | Sigma-Aldrich | 152463 | Avertin stock solution |
| siRNA Fluorescent Universal Negative Control #1 | Sigma-Aldrich | SIC003 | Non-target siRNA with fluorescence |
| microRNA Mimic Transfection Control with Dy547 | Dharmacon | CP-004500-01-05 | Non-target microRNA with fluorescence |
| Plasmids preparation kit | Invitrogen Purelink | K210016 | GFP-coding plasmid preparation |
| Fast Green Dye | Millipore-Sigma | F7252 | For better visualization of the DRG outline during injection |
| Ketamine | Putney, Inc | NDC 26637-731-51 | Anesthesia induction |
| Xylazine | AnaSed | NDC 59399-110-20 | Anesthesia induction |
| Acetaminophen | McNeil Consumer Healthcare | NDC 50580-449-36 | Post-surgical pain relief |
Références
- Saijilafu, , et al. PI3K-GSK3 signalling regulates mammalian axon regeneration by inducing the expression of Smad1. Nature Communications. 4, 2690 (2013).
- Zhang, B. Y., et al. Akt-independent GSK3 inactivation downstream of PI3K signaling regulates mammalian axon regeneration. Biochemical and Biophysical Research Communications. 443 (2), 743-748 (2014).
- Jiang, J. J., et al. MicroRNA-26a supports mammalian axon regeneration in vivo by suppressing GSK3beta expression. Cell Death & Disease. 6, 1865 (2015).
- Krames, E. S. The role of the dorsal root ganglion in the development of neuropathic pain. Pain Medicine. 15 (10), 1669-1685 (2014).
- Salimzadeh, L., Jaberipour, M., Hosseini, A., Ghaderi, A. Non-viral transfection methods optimized for gene delivery to a lung cancer cell line. Avicenna Journal of Medical Biotechnology. 5 (2), 68-77 (2013).
- Keeler, A. M., ElMallah, M. K., Flotte, T. R. Gene Therapy 2017: Progress and Future Directions. Clinical and Translational Science. 10 (4), 242-248 (2017).
- Neumann, E., Schaeferridder, M., Wang, Y., Hofschneider, P. H. Gene-Transfer into Mouse Lyoma Cells by Electroporation in High Electric-Fields. The EMBO Journal. 1 (7), 841-845 (1982).
- Liu, C. M., et al. MicroRNA-138 and SIRT1 form a mutual negative feedback loop to regulate mammalian axon regeneration. Genes & Development. 27 (13), 1473-1483 (2013).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240 (1), 237-246 (2001).
- Saijilafu, E. M., Hur, F. Q., Zhou, Genetic dissection of axon regeneration via in vivo electroporation of adult mouse sensory neurons. Nature Communications. 2, 543 (2011).
- Pan, C., et al. Shrinkage-mediated imaging of entire organs and organisms using uDISCO. Nature Methods. 13, 859 (2016).
- Rao, R. D., Bagaria, V. B., Cooley, B. C. Posterolateral intertransverse lumbar fusion in a mouse model: surgical anatomy and operative technique. Spine Journal. 7 (1), 61-67 (2007).
- Dommisse, G. F. The blood supply of the spinal cord. A critical vascular zone in spinal surgery. The Journal of Bone and Joint Surgery. British Volume. 56 (2), 225-235 (1974).
- Sorensen, D. R., Leirdal, M., Sioud, M. Gene Silencing by Systemic Delivery of Synthetic siRNAs in Adult Mice. Journal of Molecular Biology. 327 (4), 761-766 (2003).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon