Method Article
成体マウス後根神経節の調査の哺乳類の軸索の再生: In Vivoエレクトロポレーション
要約
エレクトロポレーションは、興味の遺伝子を細胞に提供する効果的なアプローチです。このアプローチは生体内で成体マウス後根神経節 (DRG) のニューロンに適用すると、軸索再生の生体を研究するためのモデルについて述べる。
要約
エレクトロポレーションは、DNA プラスミッドまたは小さな RNA 分子を細胞に導入する本質的な非ウイルス性遺伝子導入アプローチです。後根神経節 (Drg) の感覚ニューロンは、2 つの分岐の 1 つの軸索を拡張します。1 つの分岐は、周辺機器に行く神経 (末梢枝) と他の支店 (中央支部) 後根を介して脊髄に入る。神経損傷後末梢枝は中央支店、再生成しないに対し力強く再生されます。ため高い再生能力感覚軸索の再生は広く使用されてモデル システムとして末梢神経系 (PNS)、中枢神経系 (CNS) の両方で哺乳類の軸索の再生を研究します。ここでは、成熟したニューロンの生体内でエレクトロポレーションによる遺伝子発現を操作する以前に確立されたアプローチ プロトコルについて述べる。アプローチ芳司プラスミッドまたは小さな RNA oligos (Sirna またはマイクロ Rna) に基づき、遺伝子の利益または軸索再生の生体内の調節におけるマイクロ Rna の役割を検討する両方の損失と利得-の機能実験のためことができます。さらに、空間的そして一時的は比較的短時間で遺伝子発現の体内操作の制御ができます。このモデル系は、哺乳類の軸索の再生が規制生体内では分子メカニズム解明のためのユニークなツールを提供します。
概要
神経外傷による神経系の傷害または様々 な神経変性疾患は、通常、モーター、感覚と認知機能の欠陥になります。最近では、多くの努力は、負傷した生理機能ニューロン1,2,3を復元する大人ニューロンの再生力再建に専念してきました。DRG ニューロンは痛み、温度、タッチ、または脳への姿勢など、さまざまな感覚刺激を伝達する神経細胞のクラスターです。各これらのニューロンは擬似単極、周囲に向かって拡張 1 つの支店と4脊髄に向かって他の支店を分割単一の軸索が含まれています。Drg の大人の感覚ニューロンはいくつか成熟した哺乳類神経損傷後の軸索を積極的に再生する知られています。したがって、感覚軸索の損傷広範囲として採用されている重要なモデル軸索再生の生体内のメカニズムを研究します。
生体内で遺伝子トランスフェクション技術は、通常以下をセットアップする時間がかかり、トランスジェニック動物を使用するよりもより柔軟な遺伝子の機能を勉強し、中枢神経系における情報伝達システムに必須の役割を果たしています。主な技術は、2 つの方法に分類できます: 計測器およびウイルス ベース5。大人ニューロンの遺伝子デリバリー ウイルス ベースは生体内で遺伝子発現6の正確な時空間操作を提供できます。しかし、労働集約的なプロセスは生産目的の遺伝子を含んでいるウイルス粒子の精製など、ウイルス ベースの方法で関与しています。さらに、多くのウイルスのベクトルは、データ集録、データの解析を妨げる可能性があり、可能性の実験結果の解釈を誤解するホストの免疫システムをアクティブにでした。エレクトロポレーション、典型的な楽器ベースのトランスフェクション アプローチ遺伝子ベクターまたは7 細胞外スペースから小さな RNA oligos の流入を支持の一過性細胞および原子膜の透過性を高める電気パルスを使用して、.体外エレクトロポレーションは、さまざまなタイプのターゲット遺伝子発現を操作するための一時的な非常に効率的な戦略として認識されています。体内エレクトロポレーションは、効率が低い株ウイルスのベクトルと比較しての一時的な遺伝子発現に他ならない、ウイルスのアプローチに比べて様々 な利点があります。たとえば、ほとんどすべて組織・細胞7,8,9に適用できます。さらに、特定の成績に対してどちらかのプラスミド (例えばSirna、マイクロ Rna) の興味の遺伝子または小さな RNA oligos 標的組織に直接注入でき、電気的パルス、手順にして以下の労働 - と時間のかかります。また、複数のプラスミドと単一エレクトロポレーションと同時に RNA oligos の株は、可能です。
我々 が成体マウス感覚神経細胞における遺伝子発現を操作する生体内でエレクトロポレーション アプローチを確立が正常に適用され、1,パイオニア研究多数2,3 でこのようなアプローチを検証 ,8,10。ここでは、哺乳類の軸索の再生の将来の研究のためのこのアプローチの使用を容易にするために詳細なプロトコルを提案する.
プロトコル
ジョンズ ・ ホプキンス機関動物ケアおよび使用委員会によって承認された動物のプロトコルに従ってすべての動物実験を行った。
1. 材料および試薬
-
動物
- 実験のための 30-35 g の重量を量る 6 週齢雌 CF1 マウスを使用します。
注: マウスだったグループは建物 (5 マウス ケージごと) 1/4"トウモロコシ穂軸ベッド、2" 平方 nestlets ネスティングのために滅菌個別換気ケージの中で。ケージされた制御された 12 時間の明暗周期で維持され、部屋の温度は 19.4 ° C から 25 ° Cマウスは、グローバルの齧歯動物の食事と自動水供給システムで飼育しました。
- 実験のための 30-35 g の重量を量る 6 週齢雌 CF1 マウスを使用します。
-
楽器
- 次の手術器具を使用して、効率的に手術を実施する: 腹腔内注射用使い捨て注射器 (27 G、1.0 mL) 毛皮のクリッパー、ステレオ解剖顕微鏡、マイクロ手術鉗子、マイクロ外科はさみ、小さな骨 rongeurs滅菌不織スポンジ。
注: すべての機器、材料、手術前にオートクレーブまたは生産者によって殺菌済み。手術中に楽器は滅菌を維持するために 75% アルコールを吹き付けています。
- 次の手術器具を使用して、効率的に手術を実施する: 腹腔内注射用使い捨て注射器 (27 G、1.0 mL) 毛皮のクリッパー、ステレオ解剖顕微鏡、マイクロ手術鉗子、マイクロ外科はさみ、小さな骨 rongeurs滅菌不織スポンジ。
-
麻酔のソリューション
- 麻酔を誘導し、DRG 注入前に麻酔解決策 #2 を使用して麻酔を維持するために麻酔液 #1 を使用してください。
- 麻酔液 #1 をするためには、ケタミン ・ キシラジン最終濃度 10 mg/mL と 1.2 mg/mL に滅菌生理食塩水で希釈します。
- 麻酔解決策 #2 をするためには、タヴェルタン最終濃度 20 mg/mL に滅菌生理食塩水で希釈します。
- 麻酔を誘導し、DRG 注入前に麻酔解決策 #2 を使用して麻酔を維持するために麻酔液 #1 を使用してください。
-
プラスミド DNA と RNA Oligos
- 次の製造元のプロトコルに応じて市販のキットを使用してプラスミッドを準備します。プラスミド Dna 濃度 2.0 μ g/μ L の滅菌の脱イオン水で希釈します。
- 0.005-0.01 の最終濃度に到達する高速グリーン色素溶液を追加注入中に DRG アウトラインの視覚化に適した % (v/v)。
- 50 μ M の最終濃度に到達するメーカーから提供される対応するバッファーでマイクロ Rna、siRNA または oligos を溶解します。
-
マイクロインジェクション ピペット
- マイクロ ピペットの引き手を使用して毛細管ガラスを引き、おおよそ 50 μ m 外径の開口部を生成するマイクロサージェリー ハサミで引っ張られた毛細管ガラス ピペットの先端をカットします。その後、約 20-30 分のためクリーン ベンチでの紫外線の下でガラス ピペットを滅菌します。
- 細胞内のマイクロインジェクションに接続して滅菌ガラス ピペット ピペット ホルダーのマウントは調剤システムです。30 psi の圧力の期間の 8 ms でのインジェクション システムのパラメーターを設定します。
-
エレクトロポレーション システム
- 方形波エレクトロポレーション システムに電極を接続し、次のパラメーターを設定:生体内でエレクトロポレーション用 950 ms 間隔で 35 V で 15 ms パルス。
-
血流とソリューションを修正
- 4% (w/v) の濃度で 1 × PBS のパラホルムアルデヒド (PFA) 粉溶解します。4 ° C で PFA ソリューションを格納します。
2 実験手順
-
L4 と L5 Drg の手術手技
- #1 以前 (とケタミン 100 mg/kg 体重とキシラジン 12 mg/kg 体重) 準備麻酔液の腹腔内注入を使用するマウスを麻酔します。
- 毛皮クリッパーで外科領域を剃る。
メモ: 左の坐骨神経のクラッシュのための別の手術がある、ので左大腿後部の毛皮が剃毛同時に。 - 温水毛布 (35.0 ° C) の上にマウスを置くし、温度プローブで直腸の温度を監視します。
- 麻酔をテストするには、つま先とマウスの尾をピンチ、行動反応を観察します。
- コルクボードの上でマウスの 4 つの手足をテープします。
- 皮膚を切断する前に、iodophor を削除する 75% アルコール iodophor ソリューションとし、外科領域を拭いてください。
- 麻酔中の乾燥を防ぐため目に眼軟膏を適用します。
- 切開する前に罰金のマーカーペンと腸骨稜の両側をマークします。L5 Drg の位置の識別を容易にする腸骨稜の 2 つの点を結ぶ直線を描画します。
- マイクロ剪刀と腰痛の正中線に沿って 3 cm の切開を行います。また、毛様体筋 multifidus と毛様体筋最長筋腰、S1 棘突起に L3 からなど、棘筋を外し、5 L4 と L5 6 椎間関節を公開します。
- 5 L4 と L5 6 椎間関節を削除するのにには、マイクロ rongeur を使用します。また、L4、L5、Drg の背側を公開する左の神経弓を削除します。
-
DRG 注入
- (200 mg/kg 体重をタヴェルタン) と麻酔解決策 #2 を挿入腹腔 DRG 注射の前に麻酔を維持するために。
- ガラス毛細管ピペットにプラスミド DNA または RNA oligos (DRG あたり 1 μ L) を読み込みます。
- DRG に毛細管ガラス ピペットの先端を慎重に挿入します。
- DNA プラスミドの 1.0 μ L 溶液を注入して徐々 にまたはに後根神経節細胞内マイクロインジェクションを使用して RNA oligos 塗布システム (30 psi、8 ms)。
注: 注入の期間は、5 分を持続させるべき。
-
エレクトロポレーション
- 電極の先端に PBS をドロップします。
- 正方形の滅菌ガーゼで出血をクリーンアップします。
- 電極とターゲット DRG を軽くピンチ、エレクトロポレーション システム 5 正方形電気パルスを適用します。
- それぞれ 5-0 ナイロン縫合糸で筋肉と皮膚の層を閉じます。
- それは完全に胸骨の横臥を維持するために十分な意識を取り戻したまで細心の注意の下で温水毛布 (35.0 ° C) の上にマウスを配置します。麻酔から完全に回復した後マウスを家のケージに戻ります。
注: それは 37 ° C 毛布に麻酔から完全に回復するためにマウスの約 60 分かかります。手術後の痛みを和らげるために給餌の 1 つ (200 mg) の丸薬イブプロフェンを 1,000 ml の水 (0.2 mg/ml) に溶解します。
-
坐骨神経のクラッシュ
- DRG エレクトロポレーション後 (実験計画) によって 2 つまたは 3 日間は麻酔麻酔液 #2 (400 mg/kg 体重をタヴェルタン) と腹腔内でマウスです。
- コルクボードの上でマウスの 4 つの手足をテープします。
- 正中線に沿って左側に 1 cm の切開 0.5 cm を作る。大殿筋や梨状筋などの筋肉を縦にカットします。大坐骨孔と坐骨切痕の間坐骨神経の部分を公開します。
- 12 s のマーク 10-0 ナイロン epineural 縫合糸でクラッシュ サイト手術鉗子で神経のクラッシュ。クラッシュ サイトをマークする硬膜に結び目を作る。
- 5-0 ナイロン縫合糸で筋肉と皮膚の層を閉じます。
- それは完全に胸骨の横臥を維持するために十分な意識を取り戻したまで細心の注意と温水毛布 (35.0 ° C) の上にマウスを配置します。麻酔から完全に回復した後マウスを家のケージに戻ります。
注: それは 37 ° C 毛布に麻酔から完全に回復するためにマウスの約 60 分かかります。手術後の痛みを和らげるために給餌の 1 つ (200 mg) の丸薬イブプロフェンを 1,000 ml の水 (0.2 mg/ml) に溶解します。
-
マウス灌流、DRG、坐骨神経の収穫
- 2 つまたは 3 日間 (実験計画) によって坐骨神経のクラッシュ後のマウス腹腔内麻酔解決策 #2 を麻酔します。
- 冷えた 4% パラホルムアルデヒド (PFA) (pH 7.5) PBS で続く PBS (pH 7.4) とマウス transcardially を灌流します。
- 後、マイクロ剪刀と解剖顕微鏡マイクロ鉗子一緒に神経根や坐骨神経膝に Drg を慎重に区切ります。4 %pfa 一晩 4 ° C で坐骨神経を直接に
-
イメージングと蛍光標識感覚軸索を測定
- 接続されている組織、マイクロ剪刀と解剖顕微鏡の下で慎重にマイクロ鉗子で固定の坐骨神経の膜をはがします。4% を交換し、十分に洗うと PBS PFA 神経 3 回します。
- スライドの坐骨神経を置き、それをまっすぐに保ちます。Antifade ソリューション、神経の周りの 80 μ L を追加し、それを観察を置きます。圧力マウント全体の組織をフラット化します。
- モザイク集録および画像処理用アクセサリーを搭載した倒立 epifluorescent 顕微鏡に flattened 組織を配置します。
注: 励起と放射距離は、488 nm および 509 nm。また、手動で複数の重複した画像を取るし、一緒にプラグインのモザイクで ImageJ を用いた画像をステッチすることが可能です。 - 再生軸索の長さを測定する場合は、すべて identifiable fluorescently ラベルにおける軸索遠位軸索の端に (10-0 epineural 縫合でマーク) クラッシュ サイトから坐骨神経をトレースします。
結果
L4 と L5 Drg に DRG エレクトロポレーション体内のトランスフェクション率は十分に高く、注入我々 を検証し、現在のプロトコルの細胞毒性や electroporated 蛍光タグ付きマイクロ Rna、siRNA を定量化します。戸建の Drg を用いて電子顕微鏡や免疫組織化学 (図 1A B) 経由で処理されました。注射エレクトロポレーション後の細胞生存率を推定、L4 と L5 からそのまま DRGs いた収穫を用いて電子顕微鏡や免疫組織化学を介して処理されます。Tuj1 染色で反射神経細胞密度は、エレクトロポレーションは、神経細胞死 (図 1C) を誘発しなかったことを示す有意差そのまま Drg ニューロン密度と比較した場合を表示されませんでした。トランスフェクション率だったタグ RNA オリゴ ニューロンの数と Tuj1 陽性ニューロンの数の比率として計算されます。MiRNA の平均遺伝子導入率は 80.7 ± 4.3% と siRNA 94.2 ± 0.3% (図 1D)。現在体内のエレクトロポレーション法軸索の再生を適用すると、坐骨神経が平坦化し、イメージします。独特の軌道と認識可能な遠位軸索すべて再生軸索は、縫合糸の結び目 (図 2) によって示されるクラッシュ サイトからたどることができます。さらに、我々 electroporated EGFP プラスミドと Drg と 7 日後脊髄 T7 から L2 に L4 と L5 の後根と一緒にを収穫します。プロトコルをクリア老舗組織を用いて、脊髄11をクリアする uDISCO。脊髄の背側列の EGFP ラベル軸索共焦点顕微鏡を用いたイメージングし、縦波および矢状断面の投影画像 (図 3) で識別されます。また、3 D 画像 (映画 1) を再構築する顕微鏡可視化ソフトウェアと共焦点画像を処理できます。

図 1: 蛍光タグ非特定のマイクロ Rna、siRNA体内のエレクトロポレーション後 DRG クライオ セクションの免疫組織化学。(A) 代表クライオ - 注入後根神経節組織と蛍光タグ (Dy547) 非標的マイクロ Rna と electroporated のセクション。左の画像: 蛍光タグ (Dy547) 非標的マイクロ Rna の蛍光信号 (赤色) のイメージ。中央の画像: 免疫染色 (グリーン色) Tuj1 の二次抗体の Alexa488 蛍光を持つ。右の画像: 前の 2 つのチャネルの結合されたイメージ。スケールバー = 100 μ m.(B) 注入後根神経節組織と蛍光タグ (Cy3) 非標的 Sirna と electroporated の代表低温セクション。左の画像: 蛍光タグ (Cy3) 非標的 Sirna の蛍光信号 (赤色) のイメージ。中央の画像: 免疫染色 (グリーン色) Tuj1 の二次抗体の Alexa488 蛍光を持つ。右の画像: 前の 2 つのチャネルの結合されたイメージ。スケール バーを表します 100 μ m (C)、そのまま DRG の低温電子顕微鏡セクションのニューロン密度が 809.6 ± 14.2 セル/mm2 (N = 6)、注入された後根神経節の低温電子顕微鏡セクション、801.6 ± 27.4 セル/mm2 (N = 6)、± Sem、スチューデントのt-テスト、NS: なし。意義。三匹の鼠はタグ siRNA と左 L4 と L5 Drg に DRG エレクトロポレーションを実行される生体内で.両方左右 L4 と L5 Drg は 48 時間後に収穫、低温セクションおよび免疫組織化学を介して処理されます。各 DRG はおおよそ 60 スライスに切断されているし、スライスの厚さは 10 μ m。各 DRG の 3 つのスライスが 200 μ m で、平均されます。(D) タグのマイクロ Rna の導入率は 80.7 ± 4.3% (N = 4)、タグの siRNA は 94.2 ± 0.3% (N = 6)、± SEM. の意味三匹の鼠はタグ siRNA とタグ miRNA と 2 つのマウス左 L4 と L5 Drg に DRG エレクトロポレーションを実行される生体内で.Drg は 48 時間後に収穫、低温セクションおよび免疫組織化学を介して処理されます。各 DRG はおおよそ 60 スライスに切断されているし、スライスの厚さは 10 μ m。各 DRG の 3 つのスライスが 200 μ m で、平均されます。この図の拡大版を表示するのにはここをクリックしてください。

図 2: 異所萌出へ表現された EGFP 表示傷害を粉砕した後坐骨神経の神経軸索を再生成します。クラッシュの傷害に苦しんだ平坦化された坐骨神経の軸索は、細胞体から軸索に輸送 EGFP (蛍光グリーン) が付いています。赤い線は、破砕の傷害のサイトは、外科的縫合結び目によって示された本来の位置を示します。白い矢印、矢印、星、クラッシュ サイトから拡張すべての 3 つの特徴的な軸索末端を示します。スケール バー = 500 μ m.この図の拡大版を表示するのにはここをクリックしてください。
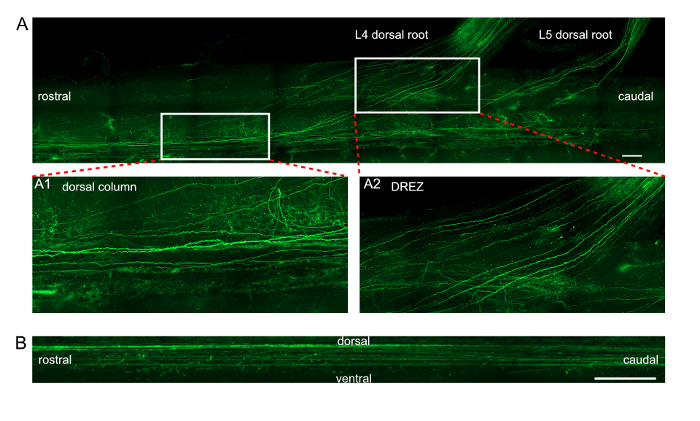
図 3: Drg の生体内でエレクトロポレーション後脊髄軸索の EGFP 発現の投影像。(A) 脊髄後索と L4 ・ L5 後根内 EGFP ラベル軸索の縦投影。はめ込み画像 A1 と A2 は、パネル (A) でマークされた 2 つの長方形領域の拡大ビューを表示します。A1 展示背側列の軸索の詳細を表示しています。A2 は、後根進入部 (DREZ) における軸索の詳細ビューを展示します。スケール バー = 脊髄後索内 EGFP ラベル軸索の 200 μ m。 (B) 矢状投影。スケールバー = 50 μ m.この図の拡大版を表示するのにはここをクリックしてください。
映画 1: Drg の生体内でエレクトロポレーション後脊髄軸索の EGFP 発現の三次元。してくださいここをクリックしてこのビデオを表示します。(右クリックしてダウンロード)
ディスカッション
いくつかの手術の手順には、特に注意が必要です。L4 と L5 drg コード (細胞体の位置) は、坐骨神経を支配を正しく識別され、遺伝子構造に注入する必要があります。そうでなければ、GFP 標識が休演いたします坐骨神経軸索で。腸骨稜は、L4 と L5 Drg を特定する有用な解剖学的ランドマークとして見なすことができます。L5 と L6 の椎間関節面は、ほとんどマウス腸骨稜12に近接。また、L3 DRG を選択できます、L5 ではなく免疫組織化学など西部のしみ13、試金のために特に L5 DRG の手術手技は通常深い場所と豊富な血液供給のための大きな困難を満たしているように。また、全体の手術は、周囲の脊髄や神経根など構造損傷の DRG を避けてください。注目に値する 2 番目の重要な運用手順は、注射です。高速グリーンの色素は、DRG で拡散を針から放出されるソリューションを視覚化して遺伝子構造のソリューションと混合しました。成功した注入蛍光色素によって記載されている透明な円形の DRG が表示されます。マイクロ針の先端の深さの微調整を行ったり来たりで蛍光色素をソリューションは、注入しながら DRG から漏れて、DRG カプセルへのすべてのソリューションの完全な注入が確実にできます。以上の 3 つの異なるサイトに DRG を刺しは避けてください。Drg に rete 潰瘍13がしっかりとカプセル化され、さらに、軽度の出血は DRG 注射後通常避けられないです。エレクトロポレーションの中に電極から後根神経節の表面を絶縁血がないあるので、出血を停止することが重要です。電気の現在の伝達に依存して成功したエレクトロポレーションと PBS ソリューションを電極に適用します。サイトでは最後に、坐骨神経に粉砕は、鉗子でマークしてくださいマイクロ縫合、損傷部位は顕微鏡下で表示されず、画像解析の後で軸索の再生の開始点として表示する必要がありますので。動物の血流と郭清後クラッシュ サイトで epineural 縫合糸の結び目が落ちる場合、クラッシュによるインデントがまだ個人場合すぐに PFA 固定神経縫合糸で同じサイトを再ラベル付けする重要です。
トランスフェクション法エレクトロポレーション導入率を持っています。私たちの調査によるとマイクロ Rna または生体内でエレクトロポレーション後 Sirna の後根神経節ニューロンのトランスフェクション率は 90% に近いです。もっと重要なは、生体内でエレクトロポレーションは目的遺伝子構造のウイルスの包装が必要なウイルス ベースの方法よりもはるかに少ない時間がかかる。後根神経節ニューロンに、lipofectamine が働かない限り私たちが知っているにもかかわらず、体内の lipofectamine ベースのトランスフェクションはエレクトロポレーションよりも毒性が少ない、特に、どちらもin vivoも生体外で。注目すべき、現在の方法いくつかの技術的な制限があります。まず、興味の遺伝子をノックダウンする siRNA の効果の持続期間は、プラスミドのウイルス ベースの配信より短いです。したがって、動物の犠牲をエレクトロポレーションから全体の手順は 4-6 日14で終了します。さらに、顕微鏡下での手術には、実践といくつかの手先の器用さが必要です。初心者は、手術期間が通常、予想よりも長いです。麻酔薬投与マウスに投与が不要な死亡率を防ぐために慎重に制御すること。最後に、坐骨神経を平坦化 epifluorescent イメージングを行う際、軸索の重複が発生します。高解像度神経を共焦点顕微鏡を用いたイメージングは、代替オプションです。
解剖学的, 後根神経節の感覚ニューロンは 2 つの軸索分岐 - 行枝末梢および脊髄10の脊髄後索に投影する昇順の中央枝にあります。現在の方法では、脊髄の背側列の特徴的なラベリングも示しています。したがって、同様の方法論は、脊髄損傷後感覚軸索の再生を調査するためのモデルとして使用できます。組織クリアリング テクニック11と組み合わせると、従来の共焦点顕微鏡や光シート顕微鏡使用できますクリアされた脊髄のサンプルに脊髄の背側列内感覚軸索の 3 D 像を構築します。
開示事項
著者が明らかに何もありません。
謝辞
(F q 受賞資金が供給された研究Z.) NIH (R01NS064288、R01NS085176、R01GM111514、R01EY027347)、クレイグ H. Neilsen 財団、BrightFocus 財団によって。
資料
| Name | Company | Catalog Number | Comments |
| ECM 830 Square wave electroporation system | BTX Harvard Apparatus | 45-0052 | For in vivo electroporation |
| Tweezertrodes electrodes | BTX Harvard Apparatus | 45-0524 | For in vivo electroporation, 1 mm flat |
| Picospritzer III | Parker Instrumentation | 1096 | Intracellular Microinjection Dispense Systems |
| Glass Capillary Puller | NARISHIGE | PC-10 | |
| Borosilicate Glass Capillaries | World Precision Instruments, Inc. | 1902328 | |
| Stereo Dissection Microscope | Leica | M80 | |
| Microsurgery Rongeur | F.S.T | 16221-14 | |
| Microsurgery Forceps | FST by DUMONT, Switzerland | 11255-20 | Only for sciatic nerve crush |
| Glass Capillary | World Precision Instruments, Inc. | TW100-4 | 10 cm, standard wall |
| Tape | Fisherbrand | 15-901-30 | For fixing the mouse on the corkboard |
| 2, 2, 2-Tribromoethanol (Avertin) | Sigma-Aldrich | T48402 | Avertin stock solution |
| 2-methyl-2-butanol | Sigma-Aldrich | 152463 | Avertin stock solution |
| siRNA Fluorescent Universal Negative Control #1 | Sigma-Aldrich | SIC003 | Non-target siRNA with fluorescence |
| microRNA Mimic Transfection Control with Dy547 | Dharmacon | CP-004500-01-05 | Non-target microRNA with fluorescence |
| Plasmids preparation kit | Invitrogen Purelink | K210016 | GFP-coding plasmid preparation |
| Fast Green Dye | Millipore-Sigma | F7252 | For better visualization of the DRG outline during injection |
| Ketamine | Putney, Inc | NDC 26637-731-51 | Anesthesia induction |
| Xylazine | AnaSed | NDC 59399-110-20 | Anesthesia induction |
| Acetaminophen | McNeil Consumer Healthcare | NDC 50580-449-36 | Post-surgical pain relief |
参考文献
- Saijilafu, , et al. PI3K-GSK3 signalling regulates mammalian axon regeneration by inducing the expression of Smad1. Nature Communications. 4, 2690 (2013).
- Zhang, B. Y., et al. Akt-independent GSK3 inactivation downstream of PI3K signaling regulates mammalian axon regeneration. Biochemical and Biophysical Research Communications. 443 (2), 743-748 (2014).
- Jiang, J. J., et al. MicroRNA-26a supports mammalian axon regeneration in vivo by suppressing GSK3beta expression. Cell Death & Disease. 6, 1865 (2015).
- Krames, E. S. The role of the dorsal root ganglion in the development of neuropathic pain. Pain Medicine. 15 (10), 1669-1685 (2014).
- Salimzadeh, L., Jaberipour, M., Hosseini, A., Ghaderi, A. Non-viral transfection methods optimized for gene delivery to a lung cancer cell line. Avicenna Journal of Medical Biotechnology. 5 (2), 68-77 (2013).
- Keeler, A. M., ElMallah, M. K., Flotte, T. R. Gene Therapy 2017: Progress and Future Directions. Clinical and Translational Science. 10 (4), 242-248 (2017).
- Neumann, E., Schaeferridder, M., Wang, Y., Hofschneider, P. H. Gene-Transfer into Mouse Lyoma Cells by Electroporation in High Electric-Fields. The EMBO Journal. 1 (7), 841-845 (1982).
- Liu, C. M., et al. MicroRNA-138 and SIRT1 form a mutual negative feedback loop to regulate mammalian axon regeneration. Genes & Development. 27 (13), 1473-1483 (2013).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240 (1), 237-246 (2001).
- Saijilafu, E. M., Hur, F. Q., Zhou, Genetic dissection of axon regeneration via in vivo electroporation of adult mouse sensory neurons. Nature Communications. 2, 543 (2011).
- Pan, C., et al. Shrinkage-mediated imaging of entire organs and organisms using uDISCO. Nature Methods. 13, 859 (2016).
- Rao, R. D., Bagaria, V. B., Cooley, B. C. Posterolateral intertransverse lumbar fusion in a mouse model: surgical anatomy and operative technique. Spine Journal. 7 (1), 61-67 (2007).
- Dommisse, G. F. The blood supply of the spinal cord. A critical vascular zone in spinal surgery. The Journal of Bone and Joint Surgery. British Volume. 56 (2), 225-235 (1974).
- Sorensen, D. R., Leirdal, M., Sioud, M. Gene Silencing by Systemic Delivery of Synthetic siRNAs in Adult Mice. Journal of Molecular Biology. 327 (4), 761-766 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved