Method Article
Investigadora de axón mamífero de regeneración: En Vivo electroporación de ganglio de raíz Dorsal de ratón adulto
En este artículo
Resumen
La electroporación es un enfoque efectivo para entregar genes de interés en las células. Al aplicar este enfoque en vivo en las neuronas del ganglio de la raíz dorsal de ratón adulto (DRG), se describe un modelo para el estudio de la regeneración del axón en vivo.
Resumen
La electroporación es un enfoque de transfección de genes no virales esenciales para introducir ADN plásmidos o pequeñas moléculas de ARN en células. Una neurona sensorial en el ganglio de raíz dorsal (GRD) extiende un solo axón con dos ramas. Una rama va al periférico del nervio (rama periférica) y la otra rama entra en la médula espinal a través de la raíz dorsal (rama central). Después de la lesión neuronal, la rama periférica regenera robusta mientras que la rama central no se regenera. Debido a la gran capacidad regenerativa, regeneración del axón sensorial ha sido ampliamente utilizada como un sistema modelo para estudiar la regeneración del axón mamífero en sistema nervioso periférico (PNS) y sistema nervioso central (SNC). Aquí, describimos un protocolo de acercamiento previamente establecido para manipular genes en neuronas sensoriales maduras en vivo a través de electroporación. Basado en la transfección con plásmidos o pequeño oligos de RNA (siRNAs o microRNA), el enfoque permite para que ambos experimentos de pérdida y ganancia de función estudiar el papel de los genes de interés o microRNA en regulación de la regeneración de axones en vivo. Además, la manipulación de la expresión génica en vivo puede ser controlada tanto espacial como temporal dentro de un curso de tiempo relativamente corto. Este sistema de modelo constituye una herramienta única para investigar los mecanismos moleculares que regeneración del axón mamíferos es regulado en vivo.
Introducción
Lesiones del sistema nervioso causaron por un traumatismo neural o diversas enfermedades neurodegenerativas generalmente son el resultado de defectos en las funciones de motor, sensoriales y cognitivas. Recientemente, se ha dedicado mucho esfuerzo al restablecimiento de potencia regenerativa en neuronas adultas para restaurar la functionsof fisiológica herido las neuronas1,2,3. Las neuronas sensoriales en el DRG son un grupo de células nerviosas que transmiten diferentes estímulos sensoriales, tales como dolor, temperatura, tacto o postura del cuerpo, al cerebro. Cada uno de estas neuronas seudo unipolar y contiene un único axón que se bifurca con una rama que se extiende hacia la periferia y la otra rama hacia la médula espinal4. Las neuronas sensoriales adultos en DRGs son entre unas neuronas maduras de mamíferas conocidas para regenerar sus axones activamente después de la lesión. Por lo tanto, lesiones de los axones sensoriales han sido ampliamente utilizados como un modelo fundamental para el estudio de los mecanismos de regeneración axonal en vivo.
En vivo técnicas de transfección génica, que son generalmente menos desperdiciador de tiempo configurar y más flexible que el uso de animales transgénicos, han jugado papeles esenciales en el estudio de las funciones de genes y señalización de vías en el sistema nervioso. Las principales técnicas pueden dividirse en dos enfoques: instrumento y virus5. Viral basado en vivo entrega de genes en neuronas adultas puede proporcionar precisa manipulación espacio-temporal de gene expresión6. Sin embargo, procesos que requieren mucho trabajo participan en métodos basados en virales, tales como la producción y purificación de partículas virales que contiene el gen deseado. Además, muchos vectores virales podrían activar el sistema inmune del huésped, que puede interferir con la adquisición de datos, análisis de datos y posiblemente confundir la interpretación de resultados experimentales. Electroporación, un enfoque basado en el instrumento típico de la transfección, utiliza un impulso eléctrico para aumentar la permeabilidad celular y las membranas nucleares transitoriamente, que favorece la afluencia de vectores del gene o pequeño RNA oligos de espacio fuera de las células7 . Electroporación in vitro es reconocida ampliamente como una estrategia transitoria pero muy eficiente para manipular la expresión de genes específicos en muchos tipos celulares. Aunque en vivo electroporación sólo conduce a la expresión génica transitoria con baja eficiencia de transferencia en comparación con vectores virales, tiene diversas ventajas sobre enfoques virales. Por ejemplo, se puede aplicar a casi todas las células y tejidos7,8,9. Además, ambos plásmidos que codifican genes de interés o pequeños RNA oligos (p. ej., siRNAs, microRNA) contra ciertas transcripciones pueden ser inyectados directamente en el tejido de la blanco y entonces pulsados eléctricamente, que hacer el procedimiento menos mano de obra - y tiempo - consumiendo. Además, es posible transfectar múltiples plásmidos y RNA oligos simultáneamente con electroporación sola.
Hemos establecido un método de electroporación en vivo para manipular genes en neuronas sensoriales de ratón adulto y aplicado con éxito y validado dicho enfoque en numerosos estudios pioneros de1,2,3 ,8,10. Aquí, presentamos un protocolo detallado para facilitar el uso de este enfoque para futuros estudios de la regeneración del axón mamífero.
Protocolo
Todos los experimentos con animales se realizaron según el protocolo animal aprobado por la Johns Hopkins institucional Animal cuidado y uso.
1. materiales y reactivos
-
Animales
- Utilizar ratones CF1 femeninos seis semanas de edad que pesa 30-35 g para los experimentos.
Nota: Los ratones fueron alojados en grupo (5 ratones por jaula) en jaulas ventiladas individualmente esterilizados con 1/4" maíz mazorca ropa de cama y 2" cuadrado nestlets para anidar. Las jaulas se mantuvieron en un ciclo de luz-oscuridad de 12 h controlado y la temperatura ambiente fue de 19,4 ° C a 25 ° C. Los ratones fueron alimentados con una dieta de roedor global y automático sistema de abastecimiento de agua.
- Utilizar ratones CF1 femeninos seis semanas de edad que pesa 30-35 g para los experimentos.
-
Instrumentos
- Utilizar los siguientes instrumentos quirúrgicos para llevar a cabo eficientemente la cirugía: piel de Iknyecciones desechables (27 G, 1,0 mL) por inyección intraperitoneal, clipper, microscopio estéreo disección, pinzas de microcirugía, tijeras de microcirugía y gubias hueso pequeño y esponjas no tejida esterilizadas.
Nota: Todos los instrumentos y materiales son autoclave antes de la cirugía o previamente esterilizado por los productores. Durante la cirugía, los instrumentos son rociados con alcohol al 75% para mantener la esterilización.
- Utilizar los siguientes instrumentos quirúrgicos para llevar a cabo eficientemente la cirugía: piel de Iknyecciones desechables (27 G, 1,0 mL) por inyección intraperitoneal, clipper, microscopio estéreo disección, pinzas de microcirugía, tijeras de microcirugía y gubias hueso pequeño y esponjas no tejida esterilizadas.
-
Soluciones anestésicas
- Utilice solución anestésica #1 para inducir la anestesia y solución de anestesia #2 antes de la inyección de DRG para mantener la anestesia.
- Para hacer la solución anestésica #1, diluir la ketamina y xilacina en solución salina estéril a una concentración final de 10 mg/mL y 1.2 mg/mL.
- Para hacer la solución anestésica #2, diluir avertin en solución salina estéril a una concentración final de 20 mg/mL.
- Utilice solución anestésica #1 para inducir la anestesia y solución de anestesia #2 antes de la inyección de DRG para mantener la anestesia.
-
Plásmido de DNA y RNA Oligos
- Preparación de plásmidos mediante el kit comercial siguiendo los protocolos del fabricante por consiguiente. Diluir el plásmido DNAs en agua desionizada estéril a la concentración de 2.0 μg/μl.
- Añadir solución de tinte verde Fast Green para llegar a una concentración final de 0.005-0.01% (v/v) para mejor visualización del contorno DRG durante la inyección.
- Disolver los oligos siRNA o microRNA en buffers correspondientes proporcionados por los fabricantes para llegar a una concentración final a 50 μm.
-
Pipeta de microinyección
- Tire el vaso capilar utilizando el tirador de la micropipeta y cortar la punta de la pipeta de vidrio capilar tirado con tijeras de microcirugía para generar un orificio con un diámetro exterior de aproximadamente 50 μm. Luego esterilizar la pipeta de cristal bajo luz UV en un banco limpio para 20-30 min aproximadamente.
- Monte la pipeta de vidrio esterilizada en el soporte de pipeta conectada a una microinyección intracelular dispense el sistema. Configure los parámetros del sistema de microinyección en 30 psi de presión y 8 ms de duración.
-
Sistema de electroporación
- Conecte los electrodos para el sistema de electroporación de onda cuadrada y definir los siguientes parámetros: pulsos de 15 ms a 35 V con intervalos de 950 ms para la electroporación en vivo .
-
Perfusión y la solución de fijación
- Disolver el polvo paraformaldehido (PFA) en PBS 1 x a una concentración del 4% (w/v). Almacenar la solución de la PFA a 4 ° C.
2. experimentales procedimientos
-
Exposición quirúrgica de la L4 y L5 DRGs
- Anestesiar el ratón utilizando una inyección intraperitoneal de solución anestésica #1 preparado previamente (con ketamina 100 mg/kg de peso y 12 mg/kg de xilacina peso corporal).
- Rasure el área quirúrgico con la recortadora de pelo.
Nota: Ya que habrá otra cirugía para el nervio ciático izquierdo agolpamiento, la piel del muslo posterior izquierdo puede ser afeitada simultáneamente. - Coloque el ratón sobre la manta climatizada (35,0 ° C) y controlar la temperatura rectal con una sonda de temperatura.
- Prueba de la anestesia, pellizcar los dedos de los pies y cola de ratón y observar las respuestas conductuales.
- Los cuatro miembros del ratón sobre el panel de corcho con cinta.
- Limpie el área quirúrgico con solución de yodoforo y luego con alcohol al 75% para quitar el yodoforo antes de cortar la piel.
- Aplicar pomada oftálmica en los ojos para evitar la sequedad bajo anestesia.
- Antes de la incisión, marque ambos lados de la cresta ilíaca con un rotulador fino. Dibujar una línea que conecta dos puntos de las crestas ilíacas para facilitar la identificación de las posiciones de DRG L5.
- Hacer una incisión de 3 cm a lo largo de la línea media de la espalda baja con micro tijeras. Además, separar los músculos paraspinous, como la multifidus musculus del musculus longissimus lumborum, de L3 a S1 apófisis y exponer las articulaciones facetarias L4-5 y L5-6.
- Utilice una pinza de micro para quitar las articulaciones facetarias L4-5 y L5-6. Por otra parte, eliminar el arco neural izquierdo de L4 y L5 para exponer el lado dorsal de la GRD.
-
Inyección de DRG
- Inyectar la solución anestésica #2 (con avertin 200 mg/kg de peso corporal) por vía intraperitoneal para mantener la anestesia antes de la inyección de la DRG.
- Cargar los plásmidos de DNA o RNA oligos (1 μl por DRG) dentro de la pipeta capilar de vidrio.
- Inserte cuidadosamente la punta de la pipeta capilar de vidrio en el DRG.
- Poco a poco inyecte 1,0 solución μl plásmidos de DNA o RNA oligos en el DRG usando la microinyección intracelular dispensar sistemas (30 psi, 8 ms).
Nota: La duración de la inyección debe durar no menos de 5 minutos.
-
Electroporación
- Gota de PBS sobre las puntas de los electrodos.
- Limpiar el sangrado con una gasa esterilizada cuadrado de algodón.
- Pellizque suavemente el objetivo DRG con los electrodos y aplicar 5 pulsos cuadrados eléctricos con el sistema de electroporación.
- Cerca de las capas de músculo y la piel con suturas de nylon 5-0 respectivamente.
- Coloque el ratón sobre una manta climatizada (35,0 ° C) debajo de mucha atención hasta que completamente ha recuperado la conciencia suficiente para mantener el recumbency esternal. Volver el ratón a la jaula casera después de que ha recuperado de la anestesia.
Nota: Tarda aproximadamente 60 minutos para que el ratón para recuperarse totalmente de la anestesia en la manta de 37 ° C. Disolver un ibuprofeno (200 mg) la píldora en 1.000 ml de agua (0,2 mg/ml) para la alimentación diaria para aliviar el dolor post-surgical.
-
Aplastamiento del nervio ciático
- Dos o tres días (dependiendo del diseño experimental) después de la electroporación DRG, anestesiar el ratón por vía intraperitoneal con solución anestésica #2 (con avertin 400 mg/kg de peso corporal).
- Los cuatro miembros del ratón sobre el panel de corcho con cinta.
- Realizar una incisión de 1 cm de 0,5 cm en el lado izquierdo a lo largo de la línea media. Cortar los músculos, como el glúteo mayor y el músculo piriforme, longitudinalmente. Exponga el segmento del nervio ciático entre el foramen ciático mayor y la muesca ciática.
- Aplastamiento del nervio con pinzas de microcirugía para 12 s y marca el sitio de crush con sutura epineural nylon 10-0. Hacer un nudo en la membrana dural para marcar el sitio de crush.
- Cerca de las capas de músculo y la piel con sutura de nylon 5-0.
- Coloque el ratón sobre una manta climatizada (35,0 ° C) con mucha atención hasta que completamente ha recuperado la conciencia suficiente para mantener el recumbency esternal. Volver el ratón a la jaula casera después de que ha recuperado de la anestesia.
Nota: Tarda aproximadamente 60 minutos para que el ratón para recuperarse totalmente de la anestesia en la manta de 37 ° C. Disolver un ibuprofeno (200 mg) la píldora en 1.000 ml de agua (0,2 mg/ml) para la alimentación diaria para aliviar el dolor post-surgical.
-
Perfusión de ratón, DRG y cosecha de nervio ciático
- Dos o tres días después del aplastamiento del nervio ciático (dependiendo del diseño experimental), anestesiar el ratón por vía intraperitoneal con solución anestésica #2.
- Inundar el transcardially ratón con PBS (pH 7.4) seguido por la helada 4% paraformaldehido (PFA) (pH 7,5) en PBS.
- Después de la perfusión, separar los DRGs junto con las raíces de nervio y el nervio ciático antes de la rodilla cuidadosamente con tijeras micro y micro pinzas bajo el microscopio de disección. Coloque el nervio ciático directamente en el 4% PFA durante la noche a 4 ° C.
-
La proyección de imagen y medición de los axones sensoriales marcados con fluorescencia
- Tira el tejido Unido y membrana en el nervio ciático fijo con tijeras micro y micro pinzas cuidadosamente bajo el microscopio de disección. Entonces, cambio el 4% del PFA con PBS y lavado el nervio tres veces.
- Coloque el nervio ciático en un portaobjetos y seguir recto. Añadir 80 μl de solución antifade alrededor del nervio, luego coloque un cubreobjetos sobre ella. Aplanar el tejido todo montado con la presión.
- Coloque los flattened tejidos en el microscopio invertido epifluorescent equipado con un accesorio para mosaico adquisición y procesamiento de imágenes.
Nota: Las longitudes de excitación y emisión son 488 nm y 509 nm. También es posible tomar varias imágenes superpuestas manualmente y coser las imágenes ImageJ junto con el plug-in de mosaico. - Al medir la longitud de los axones regenerados, trace identifiable todos fluorescently-labeled axones en el nervio ciático desde el sitio de crush (marcado con la sutura epineural de 10-0) a los extremos del axón distal.
Resultados
Para cuantificar la citotoxicidad del protocolo actual y para validar que tipo de transfección de en vivo DRG electroporación es lo suficientemente alta, inyectamos y electroporated fluorescencia etiquetada microRNA o siRNA en L4 y L5 GRD. Los DRGs separadas fueron procesados a través de cryo-seccionamiento e inmunohistoquímica (figura 1A-B). Estimación de la tasa de supervivencia de la célula después de la inyección y electroporación, el GRD intacto de L4 y L5 fueron cosechadas y procesadas a través de cryo-seccionamiento y immunohistochemistry. Las densidades de la neurona, con coloración Tuj1, no mostró una diferencia significativa en comparación con las densidades de la neurona de DRGs intactos, lo que indica que la electroporación no indujo la muerte celular neuronal (figura 1C). Se calculó la tasa de transfección como el cociente entre el número de etiquetados RNA oligo neuronas y el número de neuronas Tuj1 positivas. La tasa media de transfección de miRNA es 80,7 ± 4,3% y el siRNA 94.2 ± 0,3% (figura 1D). Al aplicar el método actual que en vivo la electroporación para estudiar la regeneración del axón, el nervio ciático era aplanado y reflejado. Cada axón regenerado con trayectoria distintivo y reconocible axon distal puede rastrearse desde el sitio de crush indicado por el nudo de la sutura (figura 2). Además, nos electroporated el GRD con plásmidos EGFP y la médula espinal de T7 a L2 junto con raíces dorsales de L4 y L5 después de 7 días. Utilizamos un tejido bien establecido protocolo de compensación — uDISCO para eliminar la médula espinal11. Los axones de la columna dorsal EGFP marcado en la médula espinal se fotografiada con un microscopio confocal y luego identificados en la longitudinal y las imágenes de proyección sagitales (figura 3). Por otra parte, las imágenes confocales pueden ser procesadas con software de visualización de microscopía para reconstruir una imagen 3D (película 1).

Figura 1 : Inmunohistoquímica de DRG cryo-sección después de la electroporación de tagged fluorescencia inespecífica microRNA o siRNA en vivo. (A) representante cryo-sección de tejido DRG inyectado y electroporated con etiqueta fluorescente (Dy547) no objetivo microRNAs. Imagen de la izquierda: la imagen de la señal fluorescente (color rojo) de etiquetado fluorescente (Dy547) no objetivo microRNAs. Imagen intermedia: inmuno-tinción (color verde) de Tuj1 con un fluoróforo Alexa488 en el anticuerpo secundario. Imagen de la derecha: la imagen combinada de los dos canales anteriores. Barra de escala = 100 μm.()B) representante cryo-sección de tejido DRG inyectado y electroporated con etiquetado fluorescencia (Cy3) distintos siRNAs. Imagen de la izquierda: la imagen de la señal fluorescente (color rojo) de etiquetado fluorescencia (Cy3) distintos siRNAs. Imagen intermedia: inmuno-tinción (color verde) de Tuj1 con un fluoróforo Alexa488 en el anticuerpo secundario. Imagen de la derecha: la imagen combinada de los dos canales anteriores. La escala representa 100 μm. (C) la densidad de neuronas de una DRG intacto cryo-sección de la barra es 809.6 ± 14.2 células/mm2 (N = 6) y una crio-sección de inyección DRG es 801.6 ± 27,4 células/mm2 (N = 6), media ± SEM, de Student t-test, NS: no significación. Tres ratones eran realizados en vivo DRG electroporación en la izquierda L4 y L5 DRGs con etiquetado siRNA. Tanto izquierda y derecha L4 y L5 DRGs son cosechadas después de 48 h y procesados a través de cryo-sección e inmunohistoquímica. Cada GRD ha sido seccionado en 60 rebanadas aproximados y el grueso de la rebanada es 10 μm. Tres rebanadas de cada GRD seleccionadas por 200 μm y un promedio de. (D) la tasa de la transfección de la miRNA etiquetado es de 80,7 ± 4,3% (N = 4) y el siRNA etiquetado 94.2 ± 0,3% (N = 6), media ± SEM. Tres ratones eran realizados en vivo DRG electroporación en la izquierda L4 y L5 DRGs con etiquetado siRNA y dos ratones con miRNA etiquetado. Los DRGs son cosechadas después de 48 h y procesados a través de cryo-sección e inmunohistoquímica. Cada GRD ha sido seccionado en 60 rebanadas aproximados y el grueso de la rebanada es 10 μm. Tres rebanadas de cada GRD seleccionadas por 200 μm y un promedio de. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2 : Ectopically expresado EGFP muestra regenerada neuronales axons en el nervio ciático después de machacar lesiones. Los axones de un nervio ciático aplastado sufridas de lesión del agolpamiento se etiquetan con EGFP (fluorescencia verde) transportado desde el soma a axones. La línea roja indica la posición del sitio de lesión machacante, que originalmente quirúrgicamente fue marcada por un nudo de sutura. La flecha blanca, flecha y estrella indican tres extremos axón distintivo, que se extienden desde el sitio de crush. Barra de escala = 500 μm. haga clic aquí para ver una versión más grande de esta figura.
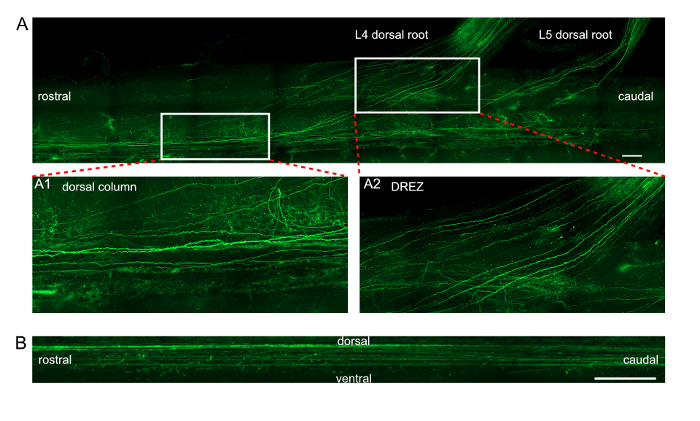
Figura 3 : Imágenes de la proyección de EGFP expresar axones de la médula espinal después de la electroporación en vivo de DRGs. Proyección Longitudinal (A) de los axones EGFP marcado dentro de la columna dorsal y de las raíces dorsales de L4/L5. Imágenes de recuadro A1 y A2 muestran vistas magnificadas de las dos zonas rectangulares marcadas en el panel (A). A1 exhibe una vista detallada de axones en la columna dorsal. A2 exhibe una vista detallada de axones en la zona de entrada de raíz dorsal (DREZ). Barra de escala = 200 μm. (B) proyección sagital de los axones EGFP marcado dentro de la columna dorsal. Barra de escala = 50 μm. haga clic aquí para ver una versión más grande de esta figura.
Película 1: reconstrucción 3D de EGFP expresar axones de la médula espinal después de la electroporación en vivo de GRD. Por favor haga clic aquí para ver este video. (Clic derecho para descargar)
Discusión
Varios pasos quirúrgicos requieren especial atención. La L4 y L5 DRGs (localización del Soma), que dominan el nervio ciático, necesitan ser correctamente identificados e inyectado con construcciones de genes. De lo contrario, el etiquetado de GFP estará ausente en los axones del nervio ciático. Las crestas ilíacas pueden verse como puntos de referencia anatómicas útiles localizar L4 y L5 GRD. En la mayoría de ratones, empalme entre las vértebras L5 y L6 de la faceta es proximal a las crestas ilíacas12. Por otra parte, DRG L3 puede ser elegido en lugar de L5, especialmente para ensayos de inmunohistoquímica o western blot13, como exposición quirúrgica del DRG L5 generalmente cumple con grandes dificultades debido a la localización profunda y suministro de sangre rica. También, la cirugía todo debe evitar perjudicial DRG que rodea las estructuras, incluyendo la médula espinal y la raíz de nervio. El segundo paso crítico operacional vale la pena destacar es la inyección. El tinte verde Fast Green se mezcló con la solución de construcciones gene a visualizar la solución expulsada de la aguja y difuso en el DRG. Una inyección exitosa debe mostrar un DRG de claro en forma de ronda por el tinte fluorescente. Si la solución con colorante fluorescente se fuga del DRG al inyectar, un atrás y puesta a punto en la profundidad de la punta de la aguja micro puede garantizar inyección completa de toda la solución en la cápsula de la DRG. Evitar empalando al DRG en más de tres sitios diferentes. Otro, leve sangrado es generalmente inevitable después de la inyección de DRG, GRD se encapsula firmemente con red venosa13. Es importante detener el sangrado por lo que no habrá sangre que aislar la superficie de DRG de electrodos durante la electroporación. Electroporación exitosa depende de la transducción de la corriente eléctrica, y puede aplicarse solución de PBS en el electrodo. Por último, el sitio en el nervio ciático donde es machacado con fórceps deben ser marcado con sutura de micro, porque el sitio de la lesión es invisible al microscopio y necesita ser indicado como punto de partida de la regeneración del axón para análisis de imagen más tarde. Si el nudo de la sutura epineural en el sitio de crush se cae después de la disección y perfusión animal, es importante volver a etiquetar el mismo sitio con una sutura inmediatamente sobre el nervio PFA-fijo cuando la sangría inducida por aplastamiento es todavía reconocible.
Entre las técnicas de transfección, electroporación tiene una tasa mayor de transfección. Según nuestro estudio, la tasa de la transfección de las neuronas DRG microRNAs o siRNAs después en vivo electroporación es cerca del 90%. Más importante aún, electroporación en vivo es mucho menos tiempo que los métodos basados en el virus, que requieren envasado virus de construcciones gene deseado. Lo que sabemos, a pesar de la transfección lipofectamine basado en vivo tiene menos toxicidad que la electroporación, la lipofectamine no funciona en las neuronas DRG en particular, ni en vivo ni en vitro. Notable, la metodología actual tiene varias limitaciones técnicas. En primer lugar, la duración de la eficacia de siRNA para derribar el gen de interés es más corta que la entrega de base de virus de plásmidos. Por lo tanto, todo el proceso de electroporación para sacrificio de animales debe ser terminado en 4 – 6 días14. Además, la cirugía realizada bajo el microscopio requiere práctica y habilidad manual. Para un principiante, la duración de la cirugía es a menudo más de lo esperado. La dosis de anestésica administrada al ratón tiene que controlarse cuidadosamente para evitar la mortalidad no deseada. Finalmente, aplanamiento del nervio ciático provoca superposición de axones al realizar la proyección de imagen epifluorescente. Los nervios sin acoplar la proyección de imagen con un microscopio confocal es una opción alternativa.
Anatómicamente, las neuronas sensoriales del DRG tienen dos ramas axonales - el periférico rama descendente y la rama ascendente central proyectando en la columna dorsal de la médula espinal10. La metodología actual también muestra etiquetado distintivo de la columna dorsal de la médula espinal. Así, una metodología similar se puede utilizar como un modelo para investigar la regeneración del axón sensorial después de lesión de la médula espinal. Combinado con técnicas de remoción de tejido11, microscopía confocal convencional o microscopía de luz de hoja puede ser empleada en la muestra de médula espinal despejado para crear 3D imágenes reconstruidas de axones sensoriales dentro de la columna dorsal de la médula espinal.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
El estudio fue financiado (otorgado a F-Q. Z.) por NIH (R01NS064288, R01NS085176, R01GM111514, R01EY027347), la Fundación Craig H. Neilsen y la BrightFocus Foundation.
Materiales
| Name | Company | Catalog Number | Comments |
| ECM 830 Square wave electroporation system | BTX Harvard Apparatus | 45-0052 | For in vivo electroporation |
| Tweezertrodes electrodes | BTX Harvard Apparatus | 45-0524 | For in vivo electroporation, 1 mm flat |
| Picospritzer III | Parker Instrumentation | 1096 | Intracellular Microinjection Dispense Systems |
| Glass Capillary Puller | NARISHIGE | PC-10 | |
| Borosilicate Glass Capillaries | World Precision Instruments, Inc. | 1902328 | |
| Stereo Dissection Microscope | Leica | M80 | |
| Microsurgery Rongeur | F.S.T | 16221-14 | |
| Microsurgery Forceps | FST by DUMONT, Switzerland | 11255-20 | Only for sciatic nerve crush |
| Glass Capillary | World Precision Instruments, Inc. | TW100-4 | 10 cm, standard wall |
| Tape | Fisherbrand | 15-901-30 | For fixing the mouse on the corkboard |
| 2, 2, 2-Tribromoethanol (Avertin) | Sigma-Aldrich | T48402 | Avertin stock solution |
| 2-methyl-2-butanol | Sigma-Aldrich | 152463 | Avertin stock solution |
| siRNA Fluorescent Universal Negative Control #1 | Sigma-Aldrich | SIC003 | Non-target siRNA with fluorescence |
| microRNA Mimic Transfection Control with Dy547 | Dharmacon | CP-004500-01-05 | Non-target microRNA with fluorescence |
| Plasmids preparation kit | Invitrogen Purelink | K210016 | GFP-coding plasmid preparation |
| Fast Green Dye | Millipore-Sigma | F7252 | For better visualization of the DRG outline during injection |
| Ketamine | Putney, Inc | NDC 26637-731-51 | Anesthesia induction |
| Xylazine | AnaSed | NDC 59399-110-20 | Anesthesia induction |
| Acetaminophen | McNeil Consumer Healthcare | NDC 50580-449-36 | Post-surgical pain relief |
Referencias
- Saijilafu, , et al. PI3K-GSK3 signalling regulates mammalian axon regeneration by inducing the expression of Smad1. Nature Communications. 4, 2690 (2013).
- Zhang, B. Y., et al. Akt-independent GSK3 inactivation downstream of PI3K signaling regulates mammalian axon regeneration. Biochemical and Biophysical Research Communications. 443 (2), 743-748 (2014).
- Jiang, J. J., et al. MicroRNA-26a supports mammalian axon regeneration in vivo by suppressing GSK3beta expression. Cell Death & Disease. 6, 1865 (2015).
- Krames, E. S. The role of the dorsal root ganglion in the development of neuropathic pain. Pain Medicine. 15 (10), 1669-1685 (2014).
- Salimzadeh, L., Jaberipour, M., Hosseini, A., Ghaderi, A. Non-viral transfection methods optimized for gene delivery to a lung cancer cell line. Avicenna Journal of Medical Biotechnology. 5 (2), 68-77 (2013).
- Keeler, A. M., ElMallah, M. K., Flotte, T. R. Gene Therapy 2017: Progress and Future Directions. Clinical and Translational Science. 10 (4), 242-248 (2017).
- Neumann, E., Schaeferridder, M., Wang, Y., Hofschneider, P. H. Gene-Transfer into Mouse Lyoma Cells by Electroporation in High Electric-Fields. The EMBO Journal. 1 (7), 841-845 (1982).
- Liu, C. M., et al. MicroRNA-138 and SIRT1 form a mutual negative feedback loop to regulate mammalian axon regeneration. Genes & Development. 27 (13), 1473-1483 (2013).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240 (1), 237-246 (2001).
- Saijilafu, E. M., Hur, F. Q., Zhou, Genetic dissection of axon regeneration via in vivo electroporation of adult mouse sensory neurons. Nature Communications. 2, 543 (2011).
- Pan, C., et al. Shrinkage-mediated imaging of entire organs and organisms using uDISCO. Nature Methods. 13, 859 (2016).
- Rao, R. D., Bagaria, V. B., Cooley, B. C. Posterolateral intertransverse lumbar fusion in a mouse model: surgical anatomy and operative technique. Spine Journal. 7 (1), 61-67 (2007).
- Dommisse, G. F. The blood supply of the spinal cord. A critical vascular zone in spinal surgery. The Journal of Bone and Joint Surgery. British Volume. 56 (2), 225-235 (1974).
- Sorensen, D. R., Leirdal, M., Sioud, M. Gene Silencing by Systemic Delivery of Synthetic siRNAs in Adult Mice. Journal of Molecular Biology. 327 (4), 761-766 (2003).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados