Method Article
Обнаружение малых ГТФазы Prenylation и GTP привязки с помощью мембраны фракционирования и ГТФазы-Assay иммуносорбента
В этой статье
Резюме
Здесь мы описываем протокол для исследования prenylation и 5'-гуанозинтрифосфатом (GTP)-Загрузка Rho ГТФазы. Этот протокол состоит из двух подробных методов, а именно мембраны фракционирования и связаны ГТФазы иммуноферментного анализа. Протокол может использоваться для измерения prenylation и GTP загрузки различных других малых GTPases.
Аннотация
Rho ГТФазы семья принадлежит к надсемейства ран и включает в себя около 20 членов в организме человека. GTPases Ро имеют важное значение в регуляции различных клеточных функций, включая цитоскелета динамики, подвижности клеток, клеток полярности, аксональное руководство, везикулярной людьми и клеточного цикла управления. Изменения в Rho ГТФазы сигнализации играют важную роль регулирования в многих патологических состояний, таких как рак, заболевания центральной нервной системы и иммунной системы зависимых заболеваний. Посттрансляционная модификация Ро GTPases (то есть, prenylation, интермедиатов мевалоната путь) и GTP привязки являются ключевыми факторами, которые влияют на активации этого белка. В этом документе две основные и простые методы предоставляются для выявления широкого спектра Rho ГТФазы prenylation и GTP привязку деятельности. Разъясняются детали технических процедур, которые использовались шаг за шагом в этой рукописи.
Введение
Ро GTPases представляют собой группу небольших белков (21-25 кДа), которые хорошо сохраняются на протяжении эволюции и образуют уникальный подсемейство в РАН надсемейство малых GTPases. В каждом подсемейство в пределах этого надсемейства существует общий G домена ядро, которое участвует в деятельности ГТФазы и нуклеотидов обмен1. Разница между Ро семьи и других подсемейств РАН является наличие «Ро Вставка домена» в рамках 5й β прядь и 4й α спирали в небольшой ГТФазы домена2.
Основываясь на недавних классификации, Ро GTPases считаются семейство сигнализации белки, которые вписываются в Ras ГТФазы надсемейства3. У млекопитающих Ро GTPases имеют 22 членов, основанный на их конкретные функции и общая характеристика4 , в котором RhoA, Rac1 и Cdc42 являются членами наиболее учился в этой группе. GTPases Ро, связаны с внутриклеточных сигнальных путей через жестко регулируемых механизм, который зависит от молекулярных переключателей через белка Посттрансляционная модификации5.
GTP загрузки и гидролиза основных механизмов активации/деактивации цикла малых Ро GTPases и регулируется через ГТФазы активации белков (пробелы). Пробелы отвечают за гидролиза ГТФ и работать во взаимодействии с гуаниновых нуклеотидов обмен факторов (GEFs) которые отвечают за реакции GTP-загрузки. Ро ВВП диссоциации ингибиторы (GDIs) предоставлять ВВП прыгните Ро GTPases дальнейшее регулирование малых GTPases Ро через привязки. Это препятствует ВВП диссоциации и облегчает поглощения из небольших GTPases Ро от сайтов активных внутриклеточные мембраны. Существует также дальнейшее регулирование Rho ГТФазы белков, с участием prenylation GDIs, который регулирует гидролизе нуклеотида и обмена и управления ВВП/GTP Велоспорт1,6,,78.
GTP-загрузки и Rho ГТФазы prenylation участвуют в движение Rho ГТФазы между цитозоле и клеточных мембран, изменяя липофильных свойств этих белков1,9. Вышеупомянутые регуляторы взаимодействуют с фосфолипиды мембраны клетки и другие модулирующих белки ВВП/GTP обмен деятельности10. Кроме того GDIs, диссоциация ингибиторы, блокировать гидролиз ГТФ и ВВП/ГТУ обмен. GDIs подавляют диссоциации неактивных белков Ро от ВВП и, следовательно, их взаимодействие с течению эффекторов. GDIs также регулируют Велоспорт GTPases между в цитозоле и мембраны в ячейке. Деятельность GTPases Ро в значительной степени зависит от их движение к клеточной мембраны; Таким образом GDIs рассматриваются в качестве важнейших регуляторов, которые могут поглощать GTPases в цитоплазме через сокрытие их гидрофобные региона/домены11,12.
Для Rho ГТФазы иметь оптимальный сигнализации и функции на всех этапах цикла его активации динамический цикл гидролиза ГТФ загрузки/GTP имеет решающее значение. Любые изменения в этом процессе может привести к последующие изменения в функции клеток, регулируется Rho ГТФазы, таких как клетки полярности, распространения, морфогенез, цитокинез, миграция, адгезии и выживания13,14.
Текущий протокол предоставляет читателям подробный метод для мониторинга малых RhoA ГТФазы активации через расследования их prenylation и ВВП/GTP загрузки. Этот метод также может использоваться для обнаружения prenylation и GTP привязку широкого круга малых GTPases. ГТФазы соединенный assay иммуносорбента может использоваться для измерения уровня активации других видов GTPases, таких как Rac1, Rac2, Rac3, H-, K- или N-РАН, АРФД и Ро-15. СИМВАСТАТИН фармакологических агента используется в качестве примера, как недавно сообщили участвовать в регулировании малого Rho ГТФазы prenylation и активность8,9,14,16.
протокол
1. Определение RhoA локализации с помощью мембраны/цитозоль фракционирования
-
Клеток культуры и симвастатин лечение
- Семя 50000 U251 клетки в 100 мм блюдо и культуры их в Дульбекко изменение средних орла (DMEM) (высокая глюкозы, 10% плода бычьим сывороточным [FBS]).
- Когда 30% притока, лечить клетки путем удаления среды и добавления к нему (10 мкм СИМВАСТАТИН, растворенных в диметилсульфоксида [ДМСО]) симвастатин содержащих среднего и инкубировать в течение 36 часов при 37 ° C8. Использование ДМСО только как элемент управления транспортного средства.
Примечание: 10 миллионов клетки необходимы для фракционирования цитозоле и мембраны клеток.
-
Коллекция ячеек
- Удаление ячеек из инкубатора 37 ° C. Посмотрите на клетки под микроскопом, чтобы подтвердить confluency.
Примечание: Клетки должна быть 70% - 80% притока. - Аспирационная среды, вымыть клетки 1 x с холодной фосфат амортизированное saline (PBS). Добавьте 5 мл Этилендиаминтетрауксусная кислота (ЭДТА) буфера (KCl: 400 мг/Л, NaCl: 6800 мг/Л, NaHCO3: 2200 мг/Л, NaH2PO4. H2O: 140 мг/Л, D-глюкозы: 1000 мг, ЭДТА динатрия: 373 мг/Л) на пластину и место клетки обратно в инкубатора 37 ° C за 5 мин.
- После 5 минут инкубации собирают ЭДТА с клетками в трубу 15 мл, содержащий такое же количество средних как ЭДТА.
Примечание: Имея средний в трубы нейтрализует ЭДТА и предотвращает любые дальнейшие пищеварение клеточных мембран. - Установите трубку лед и приступить к центрифуге.
- Настройка центрифуги для 1500 x g при 4 ° C и спина клетки за 5 мин.
- Удалить супернатант не нарушая гранулы и добавьте 1 mL холодной PBS. Хорошо перемешайте клетки.
- Передача смеси ячейки (раствор) новой 1,5 мл трубки, центрифуги на 1500 x g при 4 ° C и спина клетки за 5 мин.
- Проверьте размер гранул (для оценки объема буфера для следующего шага). Поместите образцы на льду. Полностью отменить супернатант не нарушая гранулы.
- Добавьте ледяной буфера, которую я (10 мм трис-HCl [pH 7.5], 0,1 мм ЭДТА, 0,1 мм EGTA, 1 мм Дитиотреитол и ингибитор протеазы коктейль), смешайте образцы хорошо закупорить вверх и вниз, а затем перейти к sonication.
- Удаление ячеек из инкубатора 37 ° C. Посмотрите на клетки под микроскопом, чтобы подтвердить confluency.
-
Sonication
- Набор sonicator для пяти циклов, 5 s каждый и повторять 3 x.
- Выполните sonication на льду. Перейти к ультрацентрифугирования.
Примечание: Лед и холодная условие сохранения белки и сделать более достоверные результаты.
-
Ultracentrifugation
- Позволяет разделить цитоплазмы клеток гомогенатах ультрацентрифуга и мембраны фракции. Установите центрифуги 100,000 x g 35 мин при 4 ° C. Как показано на рисунке 1, проверьте размер гранул.
Примечание: Мембранные часть находится в самой нижней части трубки и остальное другие цитоплазматических компоненты. - Соберите супернатант полностью будучи осторожны, чтобы не нарушить гранулы. Супернатант является цитозольной фракции. Место супернатант в недавно помечены трубку.
- Добавить 300 мкл диссоциации буфера (buffer II) (50 мм трис-HCl [pH 7.5], 0,15 М NaCl, Дитиотреитол 1 мм, 1% SDS, 1 мм ЭДТА, 1 мм EGTA и ингибитор протеазы коктейль) Пелле (содержит часть мембраны). Смешайте хорошо закупорить вверх и вниз.
- Перейти к определение белка и подготовка образца Вестерн-блот (иммуноблот анализ).
- Позволяет разделить цитоплазмы клеток гомогенатах ультрацентрифуга и мембраны фракции. Установите центрифуги 100,000 x g 35 мин при 4 ° C. Как показано на рисунке 1, проверьте размер гранул.
-
Immunoblotting
- Подготовьте одноклеточного белка выдержки из отдельных фракций литического буфера (20 мм трис-HCl [pH 7.5], 0.5 мм PMSF, 0,5% неионные моющих средств-40, 100 мкм β-глицерин-3-фосфат и 0,5% ингибитор протеазы коктейль).
- Измерить концентрацию белка, используя метод Лоури8 и вычислить объем буфера lysis (20 мм трис-HCl [pH 7.5], 0.5 мм PMSF, nondenaturing 0,5% моющего средства, octylphenoxypolyethoxyethanol, 100 мкм-3-фосфат β-глицерина и 0,5% коктейль ингибитор протеазы) нормализовать концентрацию белка между выборками.
- Тепла образцы на 90 ° C за 5 мин и загрузить 15-20 мкл образцов на 15% геля SDS-PAGE чтобы отделить белки.
Примечание: Загрузка 1 мкг белка для каждого образца. Вычислите объем, который необходимо запускать соответственно. - Передать разлученных белки мембраны нейлона под уменьшением условий (500 Нм глицин, мм 50 Tris-HCl и 20% метанола) за 2 ч, при комнатной температуре (RT) на 100 V.
Примечание: Для подтверждения успешного белка передачи, используйте Понсо пятно или визуализировать маркер белка на мембране. - Блокировать мембраны с 5% обезжиренное сухое молоко и 1 x трис буфер солевой раствор содержащие моющего средства (TBS/0.01% неионных моющих средств; TBST) блокировать неспецифических антитела связывая на 4 ° C на ночь или на RT 1 h.
- Добавление первичного антитела для immunoblotting анализа и инкубировать на ночь при 4 ° C.
Примечание: В этом эксперименте, Rac1/2/3, cdc42, RhoA, GAPDH и Пан Кадгерины были использованы при разбавлении 1:1,000 в молоке 1% в 1 x TBST. Пан-Кадгерины и GAPDH были использованы для подтверждения мембраны и чистоту цитозольной фракции, соответственно. - Вымойте мембраны 3 x с Отмывающий буфер с 1 x TBST 20 мин.
- Инкубации мембран с анти кролик пероксидазы (ПХ)-конъюгированных вторичное антитело для соответствующих первичных антител (за 1 час на RT).
- Вымойте помарки 3 x 20 мин и развивать их с обнаружением увеличенная хемолюминесценция (ЭСЛ).
2. измерение нагрузки ГТУ RhoA, используя Assay небольшой активация G-белка
- Всего 10 000 клеток/мл и культуры блюдо U251 клетки в 100 мм.
- Когда они 30% притока, лечить клетки с СИМВАСТАТИН, как описано в пункте 1.1.2.
- Принесите культуры пластин из инкубатора. Посмотрите на клетки под микроскопом, чтобы подтвердить confluency. Убедитесь, что клетки являются 70% - 80% притока. Поместите на Петри блюдо на льду, аспирационная СМИ и вымыть клетки 3 x с ледяной PBS (pH 7.2).
- Аспирационная PBS. Наклоните Петри на льду за дополнительные минуты, чтобы удалить все остатки PBS.
Примечание: Остаточные PBS отрицательно влияет на этот assay. - Лизируйте клетки в объеме 700 мкл буфера lysis ледяной, содержащие ингибиторы протеазы и фосфатазы.
Примечание: 700 мкл, как правило, достаточно для 100 мм Петри. Смотрите таблицу 1 найти надлежащий объем для каждого судна культуры. - Урожай lysate клетки с скребок ячейки. Наклона пластины культуры для этой техники.
- Передавать lysate помечены ледяной cryotube и держать его на льду.
- Смесь тщательно с использованием вихря. Держите 10 мкл lysate для assay протеина, чтобы измерить концентрацию белка в образце.
- Snap заморозить остальные ячейки lysate в жидком азоте.
Примечание: Подготовьте несколько аликвоты до оснастки замораживания их, чтобы избежать повторного замораживания/оттаивания циклов, которые могут привести к потере активности RhoA ГТФазы lysate клетки. - Передача cryotubes оснастки замороженные в морозильной камере-80 ° C и хранить образцы для ГТФазы соединенный assay иммуносорбента.
Примечание: Не храните образцы для более чем 14 дней. Работать быстро и никогда не оставляйте образцы на льду более чем на 10 мин. Никогда не одновременно обрабатывать все Петри. - Измерить концентрацию белка, используя метод Лоури8 и вычислить объем буфера lysis нормализовать концентрацию белка между выборками.
Примечание: Лучшая концентрация составляет 1 мг/мл; Тем не менее 0,3 - 2 мг/мл может быть обнаружено. - Подготовьте пустой элемент управления путем добавления Микропробирка 60 мкл буфера lysis и 60 мкл буфера привязки.
Примечание: Пустой элемент управления имеет все реагенты за исключением антигена и используется для вычитание фона. - Подготовьте положительный контроль путем добавления 12 мкл Rho белка управления, 48 мкл буфера lysis и 60 мкл буфера привязки.
Примечание: Положительный контроль имеет все реагенты плюс подтвержденных антиген для ро-A-GTP. - Возьмите Ро сродство пластины из своего мешка и разместить его на льду.
- Растворите порошок в скважинах с 100 мкл ледяной дистиллированной воды. Держите пластины на льду.
- Оттепель замороженных оснастки lysates клетки на водяной бане, равным 25 ° C.
- Добавьте вычисляемый объем ледяной литического буфера (от шага 2.11) для каждого образца нормализовать концентрацию белка.
Примечание: Удалите PBS после мытья клетки (используя Вакуумный аспиратор) чтобы избежать, вызывая изменения в составе литического буфера. Сравнять счет образца белка в концентрации между 0,8 и 2 мг/мл для точного сравнения между выборками в ГТФазы активации анализов. Таблица 2 содержит сведения о буфере использоваться для этот assay. - Передача 60 мкл нормализованных ледяной образцов для пробирок и 60 мкл привязки буфер; тщательно перемешать образцы и держать их на льду.
- Полностью удалите решения воды из микропланшетов, энергичный жест, следуют пять-семь жестких краны на коврике лаборатории.
- 50 мкл нормализованных образцов, пустой элемент управления и положительный контроль скважины в дубликаты.
- Место пластину на орбитальный шейкер для 30 мин при температуре 4 ° C на 300 об/мин.
Примечание: Пожимая шаг очень важен, и рекомендуется для использования орбитальных пластины шейкер на 300 об/мин. - Очистить образцы от плиты, стряхивая и мыть их 2 x с 200 мкл отмывающего буфера на RT. энергично удалить Отмывающий буфер из скважин после каждого мытья, стряхивая, затем нажатием и держать пластину на скамейке на RT.
- Добавить 200 мкл буфера антиген представляя RT в каждой скважине и Инкубируйте на RT на 2 мин.
- Флик, решение из скважин и Промыть лунки 3 x с 200 мкл отмывающего буфера на RT.
- 50 мкл свежеприготовленные анти RhoA 1/250 первичных антител к каждой скважины.
- Место пластину на орбитальный шейкер для 45 мин при 300 об/мин, равным 25 ° C. Флик, решение из колодца.
- Повторите шаги Стиральная 2 x (шаг 2.24).
- 50 мкл свежеприготовленные анти RhoA 1/250 вторичные антитела к каждой скважины.
- Место пластину поверх орбитальный шейкер для 45 мин при 300 об/мин, равным 25 ° C.
- Подготовка реагента обнаружения HRP смешиванием равных объемах реагентов A и реагент б.
- Флик, решение от каждой скважины и Промыть лунки 3 x с 200 мкл отмывающего буфера на RT.
- Добавьте 50 мкл Реагента свежеприготовленные HRP обнаружения для каждой скважины.
- Читайте светящийся сигнал в течение 3-5 мин для получения максимального сигнала и анализировать результаты, используя пакет соответствующего программного обеспечения.
Примечание: Чтений должны приниматься в течение 3-5 мин для получения максимального сигнала. Запуск «испытательной пластине» для подтверждения надлежащего lysis объем буфера используется для lysates клетки так, что концентрация белка является достаточно высоким, чтобы обнаружить RhoA ГТФазы деятельность. (Тест пластина является плита используется для определения, если концентрации протеина падает в допустимых пределах, а также чтобы определить, является ли соответствующий объем буфера lysis клеток). Положительный контроль следует читать 4 - 10 раз выше, чем пустой скважин если это линейного диапазона. Если нет, то настроить Люминометр путем консультаций с изготовителем. Параметры для Люминометр приведены в таблице 3. - Введите исходные данные в столбцах, где заголовки читают образца, значит, стандартное отклонение, РЭП1, rep2, rep3и rep4, который должен показать количество реплицирует делается на каждом образце.
- Поле, значит, введите формулу =average(Xn:Yn) где X = обозначение столбцов для РЭП1, Y = обозначение столбцов для rep4, а n = обозначение строки строки, работал на.
- В разделе стандартное отклонение, введите формулу = stdev (Xn:Yn) где X = обозначение столбцов для РЭП1, Y = обозначение столбцов для rep4, а n = обозначение строки строки, работал на.
- Введите реплицировать данные в РЭП1, rep2и т.д.
- После ввода данных, используйте метод click и волочите чтобы выбрать образец, значити стандартное отклонение.
- Затем в программное обеспечение для анализа данных, выберите функцию для приготовления, который выглядит как квадрат с мини линейчатой диаграммы внутри диаграммы.
Примечание: Это приносит вверх диаграммы процесс принятия, где это возможно, дизайн графики, основанные на данных, введенных. - Выберите гистограмма и для ввода значений, обозначают номера означает .
Примечание: Диаграммы для чисел означает впервые сделал, и затем назначается стандартное отклонение столбец для оси y погрешностей. Чтобы сделать это, дважды щелкните на панели Диаграмма, выберите вкладку ось y ошибка , щелкните параметр Custom и выберите область листа для ввода расположения данных стандартное отклонение . Разница между группами, которые нужно сравнить можно увидеть после создания желаемой диаграммы.
Результаты
Фракционирование мембраны:
Ultracentrifugation был использован для фракционирования мембраны и цитозоле компонентов. Как показано на рисунке 1, супернатанта содержит цитозольной фракции и гранулы содержит часть мембраны. Обилие RhoA в andmembrane цитозольной фракции, полученные из клеток U251 был рассмотрен после лечения с СИМВАСТАТИН, используя immunoblotting. Чистота и контроля мембраны и цитозоле фракции загрузки были подтверждены Пан Кадгерины и GAPDH соответственно. Как показано на рисунке 2, лечение симвастатина уменьшено количество ГТФазы RhoA мембраны границы, в то время как он увеличил его цитозольной содержание. Это согласуется с известных влияние статинов на транслокации GTPases, основанный на ингибирование RhoA prenylation. СИМВАСТАТИН тормозит prenylation RhoA ГТФазы, и таким образом, unprenylated RhoA удалось закрепить в мембранах клеток плазмы, что приводит к его выше цитозольной концентрации.
RhoA-GTP граница:
Мы измеряется GTP-прыгните RhoA белков с помощью ГТФазы соединенный assay иммуносорбента и показал что СИМВАСТАТИН значительно (P < 0,05) увеличение GTP-прыгните RhoA в U251 клетках (рис. 3). Таким образом в то время как СИМВАСТАТИН тормозится RhoA ГТФазы белок prenylation (рис. 2), также увеличилась его GTP загрузки по сравнению с ячейками элемента управления. Это указывает на тот факт, что prenylation и ГТФ, привязки и играть роль в деятельности и регулирования ГТФазы RhoA. Для получения дополнительной информации относительно этого явления пожалуйста, обратитесь к исходной публикации с помощью этого протокола8.
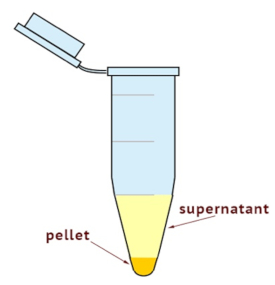
Рисунок 1 : Схема цитозольной и мембраны фракций после ultracentrifugation. Гранулы содержит часть мембраны, а супернатант цитозольной фракции.

Рисунок 2 : СИМВАСТАТИН изменяет локализации RhoA. U251 клетки обрабатывали симвастатин (10 мкм; 12, 24 и 36 h) и обилие RhoA в цитозольной фракции и мембраны определяется immunoblotting. Обилие GAPDH и Пан Кадгерины также оценивалась в элемент управления для загрузки в цитозольной и мембраны фракций и подтвердить отсутствие цитозольной загрязнения в долях мембраны. Данные, как правило, от трех независимых экспериментов с использованием различных основных культур. Этот показатель был изменен с Ализаде и др. 8. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3 : СИМВАСТАТИН модулирует активность ГТФазы RhoA. ГТФазы соединенный assay иммуносорбента был использован для измерения GTP-прыгните Ро белка в U251 клетках. Различные условия были протестированы на 36 часов, включая голод и симвастатин (10 мкм). Для каждого эксперимента конститутивно активных белковых RhoA комплекта был использован как позитивный элемент управления. Результаты выражаются как среднее ± SD два реплицирует в независимых экспериментах (* P < 0,001). Этот показатель был изменен с Ализаде и др. 8.
| Сосуд культуры клетки | Площадь поверхности (2см) | Буфер Lysis (мкл) | |
| Блюда | 35 мм | 9 | 100 |
| 60 мм | 21 | 300 | |
| 100 мм | 55 | 700 | |
| 150 мм | 145 | 1500 | |
| Плиты | 6-а | 9.4 / хорошо | 100 |
| 12-а | 3.8 / хорошо | 70 | |
| 24-а | 1.9 / хорошо | 40 | |
| Фляги | T-25 | 25 | 250 |
| T-75 | 75 | 1000 | |
| T-150 | 150 | 1500 | |
Таблица 1: Рекомендуется объем буфера lysis клетки U251. Громкость регулируется для различных типов клеток.
| Имя буфера lysis | Состав буфера lysis | Небольших целевых G-белка | Примечания |
| GL35 | Трис (1 X GL36), MgCl2 (8 X GL36), NaCl (2 X GL36), IGEPAL (1 X GL36), SDS (5 X GL36) | Cdc42 | Идентичных компонентов GL36, состав меняется следующим образом; |
| GL36 | собственной разработки трис pH 7.5, MgCl2, NaCl, IGEPAL и ПБ | Рала | Стандартный буфер, совместимых с наиболее связаны ГТФазы иммуноферментного анализа. |
| GL36 | собственной разработки трис pH 7.5, MgCl2, NaCl, IGEPAL и ПБ | Rac1 | Стандартный буфер, совместимых с наиболее связаны ГТФазы иммуноферментного анализа. |
| GL36 | собственной разработки трис pH 7.5, MgCl2, NaCl, IGEPAL и ПБ | Rac1, 2, 3 | Стандартный буфер, совместимых с наиболее связаны ГТФазы иммуноферментного анализа. |
| GL36 | собственной разработки трис pH 7.5, MgCl2, NaCl, IGEPAL и ПБ | РАН | Стандартный буфер, совместимых с наиболее связаны ГТФазы иммуноферментного анализа. |
| GL36 | собственной разработки трис pH 7.5, MgCl2, NaCl, IGEPAL и ПБ | RhoA | Стандартный буфер, совместимых с наиболее связаны ГТФазы иммуноферментного анализа. |
| GL36 | собственной разработки трис рН 7,5, MgCl2 | Arf1 | Стандартный буфер, совместимых с наиболее связаны ГТФазы иммуноферментного анализа. |
Таблица 2: Связанный список ГТФазы иммуносорбента пробирного лизис буферов и рекомендовал лизис композиции для малых GTPases.
| Параметры | Примечания | ||
| ПОЛУЧИТЬ | УСИЛЕНИЯ параметр регулирует чувствительность машины. Большинство luminometers использование автоматической калибровки или функция ограниченной калибровки. Пользователю следует читать прирост на низкой, средней и высокой для того чтобы увидеть если чтения находится в пределах диапазона линейной, который варьируется в разных документах. | ||
| ВРЕМЯ ИНТЕГРИРОВАНИЯ | Рекомендуется иметь этот параметр на самом низком уровне как очень высокий раз может читать из линейного диапазона. Это может потребовать ненужной работы как с помощью нижней разрежения или первичных и вторичных антител. ВРЕМЯ ИНТЕГРИРОВАНИЯ также варьируется в разных документах. | ||
| ПОКАЧИВАЯ | Рекомендуется использовать 5s орбитальных ВСТРЯХИВАНИЯ. Это не так критичен как другие параметры для точности анализа. | ||
| ТЕМПЕРАТУРА | Комнатной температуре рекомендуется | ||
| ТИП ПЛИТЫ | Использование согласно плита, которую вы используете. Пластину обычно 96-луночных, плоские и белый. | ||
| ФИЛЬТРЫ | Возбуждения или выбросов фильтры не требуются для свечения. Возбуждения можно установить в любое нужное значение и оптимальный диапазон для выбросов составляет 430-445 Нм. Оставьте пустыми поля фильтра. Если это не вариант, | ||
Таблица 3: Подробное описание параметров люминометра.
Обсуждение
Здесь мы описываем точный метод измерения малых ГТФазы prenylation и GTP привязки, показанный как малые ГТФазы субцеллюлярные локализации (мембраны против цитозоль) и Ро GTP загрузки. Малые GTPases выражаются в эукариотических клетках и играть существенную роль в пролиферации и моторики, структура. Prenylation и GTP привязки участвуют в регулирование деятельности ГТФазы; Таким образом анализы для оценки prenylation и GTP привязку этих белков являются важными инструментами для клеток биологи1,8.
На основе результатов недавнего исследования, Ро белка GTP загрузки типа клеток конкретных8и таким образом, отличается среди различных типов клеток. Кроме того субцеллюлярные локализации и geranylgeranylation (GGT) Ро белки являются определяющим шаги в регуляции их функции. Это регулируется также дальнейшее взаимодействие эффекторных белков ГЭФ, разрыв и GDI для крупных GTPases.
СИМВАСТАТИН известен для увеличения загрузки Rac GTP в THP-1 моноцитов, уменьшить prenylation Rac присутствии амилоида β стимуляции и уменьшить воспалительные реакции от этих клеток17. Мы также знаем, что функция Т-клеток не подвержен Ро GTP загрузки, но, скорее, ГГТ Ро определяет функции18,19. Поэтому мы рекомендуем, чтобы обнаруживать Rho ГТФазы активности, prenylation и GTP загрузки необходимо одновременно измерять в клетках.
Следует отметить, для достижения высокой чистоты цитозольной и мембраны фракции наиболее важные шаги протокола являются sonication и ultracentrifugation. Для assay Ро GTP-привязки наиболее важным этапом является оснастки замораживание lysates клетки до последовательной обработки. Следующие важные шаги будет производить последовательное и воспроизводимые результаты в исследовании GTPases в живых системах.
Ключевым шагом для изучения конкретной внутриклеточные структуры или мембраны белок является разделение сотовой отделения друг от друга. Фракционирование использует свойства каждого сотовой отсека, как размер и форма, поверхностная плотность заряда и жизнерадостный плотность20. Она основана главным образом на дифференциального центрифугирования в средствах массовой информации высокой вязкости при 4 ° C. Метод фракционирования мембраны, который был использован здесь основана главным образом на размер каждого отсека и на высокой скорости гравитационного, где после ultracentrifugation, мембранных белков перейдите к нижней части трубки и цитозольной белки остаются в супернатант.
Важно отметить, что образцы содержащие концентрации высоким содержанием белка и, возможно, высокий уровень недостатков потенциально может инактивировать целевой ГТФазы. Эта проблема может возникать даже в буфера lysis и может привести к ложным отрицательные результаты. Одним из ключевых параметров, которые определяют успех и воспроизводимости результатов анализа деятельности ГТФазы является здоровье и оперативности, используемых в эксперимент8клеток. Настоятельно рекомендуется, что следователи определить оптимальный/надлежащих условий и удвоение время для клетки под исследование, чтобы определить ГТФазы активации/торможение. Кроме того ГТФазы деятельность всех малых GTPases жестко регулируется и, следовательно, подвержены быстрому уменьшается через гидролиз ГТФ молекулы обязан фермента через действие пробелов (во время и после процедуры лизис клеток ). Это приводит к быстрому инактивации ГТФазы интерес. Поэтому настоятельно рекомендуется, что лизис клетки быстро выполняется при температуре 4 ° C, для достижения точные и воспроизводимые результаты.
Есть несколько факторов, в зависимости от экспериментальных условий, которые определяют окончательный lysate клетки. Во-первых, общее количество ГТФазы RhoA в клеточной линии или конкретных тканей: количество эндогенного RhoA ГТФазы является переменной в различных типах клеток и тканей; Таким образом это может привести к более энергичной ответ на активатор или деактиватор. Во-вторых, количество активации/деактивации достигнутые в экспериментальных условиях: это важно учитывать, что около 2% до 10% всего сотовой малых ГТФазы возможно активируется в ответ на конкретный раздражитель8. Количество деактивации также исключительно зависит от типа раздражителей и это переменная в различных клетках и тканях. Таким образом для каждого типа малых Rho ГТФазы деятельности пробирного, состав лизис буфер и сотовых отсек имеет решающее значение. Таблица 3 показывает рекомендуемый состав литического буфера для каждой конкретной небольшой ГТФазы белок.
Концентрация lysate белка нормализованных клеток является одним из основных требований потому, что он позволяет следователям для сравнения ГТФазы деятельность различных образцов. Таким образом мытья клетки от всех образцов в любых условиях с холодной PBS является обязательным для удаления белка из тканевой культуры средств массовой информации. Важно также, что все реагенты и буферы используются при холодной температуре (4 ° C) во всех этапах эксперимента. Эта холодная температура сведет к минимуму гидролиза GTPases, включая Rho ГТФазы, во время подготовки проб. Важно, что эта обработка lysates клетки проводится быстро (в 10-15 минут в общей сложности) для того, чтобы избежать потери ГТФазы RhoA активности. Кроме того наиболее важным шагом подготовки lysate клетки является аликвоты от lysate оснастки замораживание в жидком азоте для поддержания RhoA малой ГТФазы ферментативной активности. Это особенно важно, если есть разные timepoints или несколько образцов в эксперименте. После подготовки оснастки замороженные лизатов образцы могут храниться в-80 ° С без потери их Rho ГТФазы деятельность.
Указанный протокол для анализа мембраны якорь RhoA ГТФазы представляет только косвенный инструмент для измерения prenylation небольшие GTPases и не в состоянии непосредственно обнаружить или количественно определить привязку составляет остатков целевого белка. Это одна из очень немногих ограничений этот assay. Таким образом он дает оценку prenylation белков. Были определены некоторые подходы, которые в состоянии непосредственно измерить футов (farnesylation) и/или ГГТ трансферазы Фарнезилпирофосфат или geranylgeranyl-трансферазу, соответственно и в культивируемых клеток животных и человека производные опухоли. Анализы использовать электрофоретической подвижности shift, Фарнезилпирофосфат дифосфат [3H] и geranylgeranyl дифосфат [3H] и [3H] Мевалоновая кислота маркировки, следуют иммунопреципитации и SDS-PAGE21.
Мы использовали RhoA ГТФазы-соединенный assay иммуносорбента для обнаружения любых мембраны якорь и деятельности ГТФазы RhoA. Он состоит из ро-GTP-связывающий белок, который связан к добрам плиты 96-луночных. Таким образом GTP-граница активного Ро в клетки или ткани лизатов связывает скважин, в то время как ВВП Граница неактивного Ро смыты во время стирки шаги. Затем связанные, активных RhoA в скважинах будет обнаружен с помощью RhoA специфические антитела и хемилюминесценции. Это позволяет определить степень RhoA активации, сравнивая показания от lysates клетки активации для nonactivated. Сыворотка голода (использование сыворотки свободной среды на культивируемых клеток) обычно используется для инактивации RhoA в культуре ткани. Следует также отметить, что спектр ГТФазы соединенный assay иммуносорбента в активации требует 10-50 мкг белка для обнаружения RhoA ГТФазы активности.
Настоятельно рекомендуется, что неочищенные образцы имеют низкими базальный сотовой ГТФазы активности (состояние элемента управления). Как, например надлежащего ячейки голода условия могут помощью ГТФазы деятельности и обеспечивают идеальные условия, чтобы показать их активации в экспериментальных условиях. Кроме того активации и торможения анализы выполняются в духе времени - и доза ответ получить лучшие ответы ГТФазы активации/торможение. Что еще более важно, во время подготовки сотовой, очень важно использовать клетки, которые не являются overconfluent (> 70%), чтобы избежать любых толерантности клеток к активации/торможение раздражителей.
Luminometers значительно отличаются с точки зрения чувствительности и абсолютной чтений. Таким образом с тем чтобы определить, что именно в линейному диапазону, мы предлагаем, управлением ГТФазы соединенный assay иммуносорбента с пустым и положительный контроль. Если проба из диапазона линейной (положительный контроль должен быть 4 x - 10 x выше, чем буфер только для чтения) или пустой чтение выше 9-10 миллионов, то рекомендуется использовать дальнейшего разбавления антитела. Кроме того мы настоятельно рекомендуем, калибровка Люминометр читать в пределах диапазона линейной пробу перед началом assay.
Есть также преимущества для ГТФазы соединенный assay иммуносорбента, которые заслуживают упоминания. Связанный с ГТФазы иммуноферментного анализа улучшают текущий экспериментальный дизайн и технологии для облегчения экспериментов, которые не были возможны с старые методы вытащить Даунс22. Связанный с ГТФазы иммуноферментного анализа также обеспечивают точность обнаружения и чувствительности, что позволяет анализ деятельности ГТФазы в подготовке ранее закрыты для23выпадающее assays. Несколько недавних исследований по сравнению связаны ГТФазы иммуноферментного анализа активации с тянуть Даунс и пришел к выводу, что ГТФазы соединенный assay иммуносорбента имеет некоторые очевидные преимущества, а именно, что связано ГТФазы иммуноферментного анализа выше из-за их возможность использования небольших количествах белок22,24, их большей чувствительности24и их количественного измерения23. Связанные ГТФазы иммуносорбента пробирного комплект доступен в luminometric или Колориметрическое определение версии, где luminometric анализов более чувствительны. Этот ГТФазы соединенный assay иммуносорбента основан на довольно простой и быстрый протокол, требует лишь небольшое количество образцов и дает количественные и точные результаты. Таким образом она может быть хорошей идеей, чтобы далее развивать этот assay для обнаружения других типов на основе ГТФазы белков в различных клеточных линий и клетки культуры ткани с гораздо выше, специфичность и точность.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Саид Ghavami было поддержано Грант операционной центра науки здоровья, CHRIM, Грант и исследования Манитоба новый следователь операционной Грант. Джавад Ализаде было поддержано исследований Манитоба студенчества. Шахла Шоджаеи было поддержано здоровье науки фонд действующих грантов и ускорить MITACS докторантура стипендий. Адель Резаи Могадам был поддержан Сенти операционной Грант, который был проведен, Джозеф у. Гордон. Амир а. Zeki было поддержано NIH/NHLBI K08 премии (1K08HL114882-01A1). Марек J. Лос любезно признает поддержку от НКС Грант #2016/21/B/NZ1/02812, поддержке LE STUDIUM института передовых исследований (регион центр-Валь-де-Луар, Франция) через программу Smart Долина Луары общих и совместно финансируется Мари Склодовской-Кюри действия, Грант #665790. Симоне да Силва Роза была поддержана UMGF студенчества.
Материалы
| Name | Company | Catalog Number | Comments |
| DMEM high Glucose | VWR (Canada) | VWRL0101-0500 | |
| Fetal Bovine Serum | VWR (Canada) | CA45001-106 | |
| Penicillin/Streptomycin | VWR (Canada) | 97062-806 | |
| EDTA (Ethylenediamine tetraacetic acid) | VWR (Canada) | CA71007-118 | |
| EGTA (Ethylene glycol bis(2-aminoethyl ether)-N,N,N',N'-tetraacetic acid) | VWR (Canada) | CAAAJ60767-AE | |
| DTT (DL-Dithiothreitol) | VWR (Canada) | CA97061-340 | |
| Ammonium Persulfate | VWR (Canada) | CABDH9214-500G | |
| Tris-Hydroxymethylaminomethane | VWR (Canada) | CA71009-186 | |
| 30% Acrylamide/Bis Solution | Biorad (Canada) | 1610158 | |
| TEMED | Biorad (Canada) | 1610801 | |
| Protease Inhibitor cocktail | Sigma/Aldrich (Canada) | P8340-5ML | 1:75 dilution |
| Rho-GTPase Antibody Sampler Kit | Cell Signaling (Canada) | 9968 | 1:1000 dilution |
| Pan-Cadherin antibody | Cell Signaling (Canada) | 4068 | 1:1000 dilution |
| GAPDH antibody | Santa Cruz Biotechnology (USA) | sc-69778 | 1:3000 dilution |
| RhoA G-LISA Activation Assay (Luminescence format) | Cytoskeleton Inc. (USA) | BK121 | Cytoskeleton I. G-LISA Activation Assays Technical Guide. 2016. |
| RhoA Antibody | Cell Signaling | 2117 | |
| ECL | Amersham-Pharmacia Biotech | RPN2209 | |
| Anti-Rabbit IgG (whole molecule) Peroxidase antibody | Sigma | A6154-1ML | |
| SpectraMax iD5 Multi-Mode Microplate Reader | Molecular Devices | 1612071A | Spectrophotometer |
| Nonidet P-40 | Sigma | 11332473001 | non-denaturing detergent, octylphenoxypolyethoxyethanol |
| DMSO | Sigma | D8418-50ML | |
| PBS | Sigma | P5493-1L | |
| Phophatase Inhibitor cocktail | Sigma | P5726-5ML | 1:75 Dilution |
Ссылки
- Yeganeh, B., et al. Targeting the mevalonate cascade as a new therapeutic approach in heart disease, cancer and pulmonary disease. Pharmacology & Therapeutics. 143 (1), 87-110 (2014).
- Valencia, A., Chardin, P., Wittinghofer, A., Sander, C. The ras protein family: evolutionary tree and role of conserved amino acids. Biochemistry. 30 (19), 4637-4648 (1991).
- Hall, A. Rho family GTPases. Biochemical Society Transactions. 40 (6), 1378-1382 (2012).
- Rojas, A. M., Fuentes, G., Rausell, A., Valencia, A. The Ras protein superfamily: evolutionary tree and role of conserved amino acids. The Journal of Cell Biology. 196 (2), 189-201 (2012).
- Cherfils, J., Zeghouf, M. Regulation of small GTPases by GEFs, GAPs, and GDIs. Physiological Reviews. 93 (1), 269-309 (2013).
- Shojaei, S., et al. Perillyl Alcohol (Monoterpene Alcohol), Limonene. Enzymes. 36, 7-32 (2014).
- Ghavami, S., et al. Airway mesenchymal cell death by mevalonate cascade inhibition: integration of autophagy, unfolded protein response and apoptosis focusing on Bcl2 family proteins. Biochimica et Biophysica Acta. 1843 (7), 1259-1271 (2014).
- Alizadeh, J., et al. Mevalonate Cascade Inhibition by Simvastatin Induces the Intrinsic Apoptosis Pathway via Depletion of Isoprenoids in Tumor Cells. Scientific Reports. 7, 44841(2017).
- Ghavami, S., et al. Mevalonate cascade regulation of airway mesenchymal cell autophagy and apoptosis: a dual role for p53. PLoS One. 6 (1), e16523(2011).
- Tang, Y., Olufemi, L., Wang, M. T., Nie, D. Role of Rho GTPases in breast cancer. Frontiers in Bioscience: A Journal and Virtual Library. 13, 759-776 (2008).
- DerMardirossian, C., Bokoch, G. M. GDIs: central regulatory molecules in Rho GTPase activation. Trends in Cell Biology. 15 (7), 356-363 (2005).
- Garcia-Mata, R., Boulter, E., Burridge, K. The 'invisible hand': regulation of RHO GTPases by RHOGDIs. Nature Reviews Molecular Cell Biology. 12 (8), 493-504 (2011).
- Etienne-Manneville, S., Hall, A. Rho GTPases in cell biology. Nature. 420 (6916), 629-635 (2002).
- Ghavami, S., et al. Geranylgeranyl transferase 1 modulates autophagy and apoptosis in human airway smooth muscle. American Journal of Physiology - Lung Cellular and Molecular Physiology. 302 (4), L420-L428 (2012).
- Clark, E. A., Golub, T. R., Lander, E. S., Hynes, R. O. Genomic analysis of metastasis reveals an essential role for RhoC. Nature. 406 (6795), 532-535 (2000).
- Ghavami, S., et al. Statin-triggered cell death in primary human lung mesenchymal cells involves p53-PUMA and release of Smac and Omi but not cytochrome c. Biochimica et Biophysica Acta. 1803 (4), 452-467 (2010).
- Cordle, A., Koenigsknecht-Talboo, J., Wilkinson, B., Limpert, A., Landreth, G. Mechanisms of statin-mediated inhibition of small G-protein function. Journal of Biological Chemistry. 280 (40), 34202-34209 (2005).
- Waiczies, S., Bendix, I., Zipp, F. Geranylgeranylation but not GTP-loading of Rho GTPases determines T cell function. Science Signaling. 1 (12), pt3(2008).
- Waiczies, S., et al. Geranylgeranylation but not GTP loading determines rho migratory function in T cells. Journal of Immunology. 179 (9), 6024-6032 (2007).
- Satori, C. P., Kostal, V., Arriaga, E. A. Review on Recent Advances in the Analysis of Isolated Organelles. Analytica Chimica Acta. 753, 8-18 (2012).
- Berndt, N., Sebti, S. M. Measurement of protein farnesylation and geranylgeranylation in vitro, in cultured cells and in biopsies, and the effects of prenyl transferase inhibitors. Nature Protocols. 6 (11), 1775-1791 (2011).
- Keely, P. J., Conklin, M. W., Gehler, S., Ponik, S. M., Provenzano, P. P. Investigating integrin regulation and signaling events in three-dimensional systems. Methods in Enzymology. 426, 27-45 (2007).
- Oliver, A. W., et al. The HPV16 E6 binding protein Tip-1 interacts with ARHGEF16, which activates Cdc42. British Journal of Cancer. 104 (2), 324-331 (2011).
- Moniz, S., Matos, P., Jordan, P. WNK2 modulates MEK1 activity through the Rho GTPase pathway. Cellular Signalling. 20 (10), 1762-1768 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены