Method Article
Detección de la pequeña GTPasa Prenilación y GTP obligatorio usar membrana fraccionamiento y GTPasa-linked Immunosorbent Assay
En este artículo
Resumen
Aquí se describe un protocolo para investigar la Prenilación y guanosina-5'-trifosfato (GTP)-carga de la GTPasa Rho. Este protocolo consta de dos métodos detallados, es decir, ensayo de fraccionamiento de la membrana y un GTPasa-ligado del inmunosorbente. El protocolo puede ser usado para medir la Prenilación y GTP carga de diferentes otras GTPasas pequeñas.
Resumen
La familia de Rho GTPasa pertenece a la superfamilia Ras e incluye a aproximadamente 20 miembros en seres humanos. Rho GTPasas son importantes en la regulación de diversas funciones celulares, incluyendo la dinámica del citoesqueleto, motilidad celular, polaridad celular, Guía axonal, tráfico vesicular y el control del ciclo celular. Cambios en la señalización de la GTPasa Rho juegan un papel regulador esencial en muchas condiciones patológicas, tales como cáncer, enfermedades del sistema nervioso central y sistema inmune-enfermedades. La modificación postraduccional de GTPasas Rho (es decir, Prenilación de mevalonate camino intermedios) y la Unión de GTP son factores clave que afectan a la activación de esta proteína. En este trabajo, se proporcionan dos métodos esenciales y simples para detectar una amplia gama de Rho GTPasa Prenilación y actividades de unión de GTP. Detalles de los procedimientos técnicos que se han utilizado son explicados paso a paso en este manuscrito.
Introducción
Rho GTPasas son un grupo de proteínas pequeñas (21-25 kDa), que bien se conservan a lo largo de la evolución y formar una única subfamilia de la superfamilia Ras de GTPasas pequeñas. En cada subfamilia dentro de esta superfamilia, hay un núcleo de dominio compartido G que participa en la actividad de la GTPasa y de intercambio de nucleótidos1. La diferencia entre la familia de Rho y las otras subfamilias de Ras es la presencia de un "dominio de inserto de Rho" dentro de la 5th β del filamento y el 4th α hélice en la pequeña GTPasa dominio2.
Basado en la clasificación reciente, GTPasas Rho se consideran una familia de proteínas que encajan dentro de la superfamilia de Ras GTPase3de señalización. Mamíferos de Rho de GTPasas tienen 22 miembros basados en su función específica y la caracterización general4 que RhoA, Rac1 y Cdc42 se encuentran entre los miembros más estudiados en este grupo. Rho GTPasas están vinculados a intracelular señalización vías a través de un mecanismo bien regulado que es dependiente de interruptores moleculares vía proteína modificaciones del posttranslational5.
Carga de GTP e hidrólisis son mecanismos esenciales en el ciclo de activación/desactivación de pequeñas GTPasas Rho y están reguladas por proteínas GTPase-que activan (boquetes). Son responsables de la hidrólisis de GTP y trabajar en conjunto con nucleótido intercambio factores de guanina (GEFs) que son responsables de la reacción de carga GTP. Inhibidores de disociación de la PIB de Rho (GDIs) proporcionan más regulación de Rho GTPasas pequeñas vía atar al PIB-limite Rho GTPasas. Esto inhibe la disociación de PIB y facilita el secuestro de pequeñas GTPasas Rho de los sitios de la membrana intracelular activa. Hay también más regulación de proteínas GTPasa Rho con la Prenilación de GDIs que regula la hidrólisis del nucleótido y cambio y los controles PIB/GTP ciclismo1,6,7,8.
GTP-carga y Prenilación de GTPasa Rho participan en el movimiento de la GTPasa Rho entre citosol y membranas de la célula cambiando las propiedades lipofílicas de estas proteínas1,9. Los reguladores antes mencionados interactúan con los fosfolípidos de la membrana celular y otras proteínas modulación del PIB/GTP intercambio actividad10. Por otra parte, GDIs, inhibidores de la disociación, bloquean la hidrólisis de GTP y el intercambio de GTP/PIB. GDIs inhiben la disociación de las proteínas Rho inactivadas de PIB y, por tanto, su interacción con los efectores corriente abajo. GDIs también regulan el ciclo de las GTPasas entre el citosol y la membrana de la célula. La actividad de Rho GTPasas depende en gran medida de su movimiento a la membrana celular; por lo tanto, GDIs son considerados reguladores críticos que pueden secuestrar GTPasas en el citoplasma a través de ocultar su región hidrofóbica/dominios11,12.
Para que Rho GTPasa que una señalización óptima y la función en todas las etapas de su ciclo de activación, el ciclo dinámico de la hidrólisis de GTP-carga/GTP es crucial. Cualquier tipo de alteraciones en este proceso puede resultar en cambios posteriores en las funciones celulares reguladas por Rho GTPasa, como célula polaridad, proliferación, morfogénesis, citocinesis, migración, adherencia y supervivencia13,14.
El protocolo actual proporciona a los lectores con un detallado método para controlar pequeños RhoA GTPase activación a través de la investigación de Prenilación y PIB/GTP de carga. Este método también puede utilizarse para detectar la Prenilación y Unión de GTP de una amplia gama de GTPasas pequeñas. El ensayo de inmunosorción GTPasa puede utilizarse para medir el nivel de activación de otras clases de GTPasas, como Rac1, Rac2, Rac3, H-, K- y N-RAS, Arf y Rho15. La simvastatina agente farmacológico se utiliza como un ejemplo, como se informó recientemente que participan en la regulación de la pequeña GTPasa Rho Prenilación y actividad8,9,14,16.
Protocolo
1. determinación de la localización de RhoA mediante fraccionamiento de membrana/citosol
-
De la célula cultura y simvastatina tratamiento
- Semillas 50.000 de U251 células en 100 mm plato y cultura en de Dulbecco modifican medio de águila (DMEM) (glucosa alta, 10% suero bovino fetal [SBF]).
- Cuando 30% confluente, tratar las células eliminando el medio y añadiendo medio que contienen simvastatina (10 μm de la simvastatina disuelto en dimetilsulfóxido [DMSO]) e incubar durante 36 h a 37 ° C8. Uso de DMSO como un control del vehículo.
Nota: se necesitan 10 millones de células para el fraccionamiento de citosol y membrana de las células.
-
Colección de células
- Eliminar las células de la incubadora de 37 ° C. Observar las células bajo un microscopio para confirmar la confluencia.
Nota: Las células deben ser confluente de 70% - 80%. - Aspire el medio, lavar las células 1 x frío solución salina tamponada con fosfato (PBS). Añadir 5 mL de tampón de ácido (EDTA) etilendiaminotetraacético (KCl: 400 mg/L de NaCl: 6800 mg/L, NaHCO3: 2200 mg/L, NaH2PO4. H2O: 140 mg/L, D-glucosa: 1.000 mg, EDTA disódico: 373 mg/L) por placa y lugar de las células nuevamente dentro de la incubadora de 37 ° C durante 5 minutos.
- Después de 5 minutos de incubación, recoger el EDTA con las células en un tubo de 15 mL que contiene la misma cantidad de medio como EDTA.
Nota: Medio en el tubo neutraliza el EDTA y previene cualquier digestión adicional de las membranas celulares. - Coloque el tubo en una caja de hielo y proceda a la centrifugadora.
- Configurar la centrifugadora a 1.500 x g a 4 ° C y centrifugar las células durante 5 minutos.
- Quite el sobrenadante sin perturbar el pellet y añadir 1 mL de PBS frío. Mezclar bien las células.
- Transferir la mezcla celular (solución) a un nuevo tubo de 1.5 mL, centrifugar a 1.500 x g a 4 ° C y centrifugar las células durante 5 minutos.
- Compruebe el tamaño de la pelotilla (para estimar el volumen de tampón para el siguiente paso). Coloque las muestras en hielo. Descartar completamente el sobrenadante sin perturbar el pellet.
- Agregar helado buffer (10 mM Tris-HCl [pH 7.5] 0.1 mM EDTA, 0,1 mM EGTA, 1 mM Ditiotreitol y cóctel del inhibidor de la proteasa), mezclar las muestras bien transfiriendo hacia arriba y hacia abajo y luego, proceder a sonicación.
- Eliminar las células de la incubadora de 37 ° C. Observar las células bajo un microscopio para confirmar la confluencia.
-
Sonicación
- Establecer el sonicador durante cinco ciclos, 5 s cada uno y repetir x 3.
- Realizar la sonicación en hielo. Proceder a la ultracentrífuga.
Nota: Hielo y condiciones frías preservar las proteínas y los resultados más confiables.
-
Ultracentrifugación
- Utilice una ultracentrífuga para separar los homogenados celulares en citoplásmico y fracciones de la membrana. Establecer la centrifugadora a 100.000 x g durante 35 min a 4 ° C. Como se muestra en la figura 1, compruebe el tamaño de la pelotilla.
Nota: La fracción de membrana es en la parte inferior del tubo y el resto es de otros componentes citoplasmáticos. - Recoger totalmente el sobrenadante teniendo cuidado de no perturbar el sedimento. El sobrenadante es la fracción citosólica. Colocar el sobrenadante en un tubo etiquetado recientemente.
- Añadir 300 μL de tampón de disociación (buffer II) (50 mM Tris-HCl [pH 7.5], 0,15 M NaCl, 1 mM Ditiotreitol, SDS 1%, 1 mM EDTA, 1 mM EGTA y cóctel del inhibidor de la proteasa) para el sedimento (contiene la fracción de membrana). Mezclar por pipeteo arriba y abajo.
- Proceder a la determinación de proteínas y western blot (el análisis de immunoblot) preparación de la muestra.
- Utilice una ultracentrífuga para separar los homogenados celulares en citoplásmico y fracciones de la membrana. Establecer la centrifugadora a 100.000 x g durante 35 min a 4 ° C. Como se muestra en la figura 1, compruebe el tamaño de la pelotilla.
-
Immunoblotting
- La proteína de la célula se preparan extractos de las fracciones separadas en tampón de lisis (20 mM Tris-HCl [pH 7.5], 0,5 mM PMSF, detergente no iónico de 0.5%-40, 100 μm β-glicerol 3-fosfato y 0.5% inhibidor de la proteasa cóctel).
- Medir la concentración de proteína usando el método de Lowry8 y calcular el volumen de tampón de lisis (20 mM Tris-HCl [pH 7.5], 0,5 mM PMSF, 0.5% de detergente nondenaturing, octylphenoxypolyethoxyethanol, 100 μm β-glicerol 3-fosfato y 0.5% Cóctel de inhibidor de la proteasa) para normalizar la concentración de proteína entre las muestras.
- Calentar las muestras a 90 ° C por 5 min y carga 15-20 μl de las muestras en un gel de SDS-PAGE de 15% para separar las proteínas.
Nota: Carga 1 μg de proteína para cada muestra. Calcular el volumen que necesita para funcionar en consecuencia. - Transferir las proteínas separadas a membranas de nylon bajo reducción de condiciones (500 nM glicina, 50 mM Tris-HCl y 20% metanol) por 2 h, a temperatura ambiente (RT) a 100 V.
Nota: Para confirmar a la transferencia exitosa de la proteína, use colorante Ponceau o visualizar el marcador de la proteína de la membrana. - Bloquear las membranas con 5% leche en polvo descremada y 1 x Tris-buffer salino con detergente (TBS/0.01% detergente no iónico; TBST) para bloquear la Unión de anticuerpos no específicos a 4 ° C durante la noche o a temperatura ambiente durante 1 hora.
- Añadir anticuerpos primarios para el análisis de immunoblotting e incubar durante una noche a 4 ° C.
Nota: En este experimento, Rac1/2/3, cdc42, RhoA, GAPDH y pan-cadherina se utilizaron en una dilución de 1:1,000 en la leche de 1% en 1 x TBST. Pan-cadherina y GAPDH fueron utilizados para confirmar la membrana y la pureza de la fracción citosólica, respectivamente. - Lavar las membranas 3 x con un tampón de lavado con 1 x TBST por 20 min.
- Incubar las membranas con anti-conejo peroxidasa (HRP)-anticuerpo secundario conjugado de los respectivos anticuerpos primarios (de 1 h a temperatura ambiente).
- Lavar las manchas blancas /negras x 3 por 20 min y desarrollarlas con la detección de la quimioluminescencia realzada (ECL).
2. medición de la carga de GTP RhoA usando un análisis de activación de proteínas G pequeñas
- Cuenta 10.000 células/mL y cultivo las células U251 en 100 mm plato.
- Cuando son 30% confluente, tratar las células con simvastatina como se describe en el paso 1.1.2.
- Traer las placas de cultivo de la incubadora. Observar las células bajo el microscopio para confirmar la confluencia. Asegúrese de que las células son confluentes de 70% - 80%. Coloque el plato Petri en hielo, aspirar los medios de comunicación y lavar las células 3 x con helada PBS (pH 7.2).
- Aspire el PBS. Incline la caja Petri en hielo por un minuto adicional eliminar los restos de PBS.
Nota: PBS Residual afecta negativamente este ensayo. - Lyse las células en un volumen de 700 μl de tampón de lisis helada que contienen inhibidores de la proteasa y fosfatasa.
Nota: 700 μl es generalmente suficiente para una placa de Petri de 100 mm. Vea la tabla 1 para encontrar el volumen adecuado para cada buque de la cultura. - Cosecha el lysate de la célula con la rasqueta de la célula. Incline la placa de cultivo para esta técnica.
- Transferir el lisado a una etiqueta criotubo helada y mantenerlo en hielo.
- Mezclar bien con un vortex. Mantener 10 μl del lisado para el análisis de proteína, para medir la concentración de proteína en la muestra.
- Rápido-congele la célula restante lisado en nitrógeno líquido.
Nota: Preparar múltiples alícuotas de células lisado antes de congelación rápido ellos, para evitar ciclos repetidos de congelación/descongelación, que pueden conducir a la pérdida de la actividad de RhoA GTPase. - Transferencia de los criotubos de congelado rápido que un congelador de-80 ° C y almacenar las muestras para el análisis de la GTPasa-ligado del inmunosorbente.
Nota: No guarde las muestras por más de 14 días. Trabajar rápidamente y nunca dejar las muestras en hielo durante más de 10 minutos. Nunca manejar simultáneamente todos los platos de Petri. - Medir la concentración de proteína usando el método de Lowry8 y calcular el volumen de tampón de lisis para normalizar la concentración de proteína entre las muestras.
Nota: La mejor concentración es generalmente 1 mg/mL; sin embargo, 0.3 - 2 mg/mL puede ser detectable. - Preparar un control en blanco añadiendo 60 μL de tampón de lisis y 60 μL de tampón de unión a un microtubo.
Nota: El control en blanco tiene todos los reactivos excepto el antígeno y se utiliza para la sustracción del fondo. - Preparar un control positivo agregando 12 μl de proteína de control Rho, 48 μl de tampón de lisis y 60 μL de tampón de Unión.
Nota: El control positivo tiene todos los reactivos y un antígeno confirmado para Rho-A-GTP. - Saque la placa de afinidad Rho de su bolsa y coloque en hielo.
- Disolver el polvo en los pozos con 100 μl de agua destilada helada. Mantenga la placa de hielo.
- Descongelar los lysates de la célula congelada de snap en un baño de agua a 25 ° C.
- Agregar el volumen calculado de tampón de lisis helada (de paso 2.11) a cada muestra para normalizar la concentración de proteína.
Nota: Retire el PBS después de lavar las células (con un aspirador de tubo de vacío) para evitar que provoquen cambios en la composición del buffer de lisis. Igualar la proteína de la muestra a una concentración entre 0.8 y 2 mg/mL para una comparación precisa entre las muestras en los ensayos de activación GTPasa. Cuadro 2 ofrece detalles sobre el buffer utilizado para este ensayo. - Transferencia 60 μL de las muestras heladas normalizadas para microtubos y agregar 60 μL de binding buffer; homogeneizar las muestras y conservarlas en el hielo.
- Elimine totalmente el agua y soluciones de la microplaca por chasquear vigoroso, seguido por cinco a siete grifos duros sobre una estera de laboratorio.
- Añadir 50 μl de las muestras normalizadas, un control en blanco y un control positivo a los pocillos por duplicado.
- Colocar la placa sobre un agitador orbital durante 30 min a 4 ° C a 300 rpm.
Nota: El paso de agitación es muy importante, y se recomienda usar el vibrador de placa orbital a 300 rpm. - Claras muestras de la placa por chasquear y lavarlas 2 x con 200 μL de tampón de lavado en RT. vigorosamente quitar el tampón de lavado de los pozos después de cada colada por chasquear, siguió tocando y mantenga la placa en el banquillo a TA.
- Añadir 200 μL de tampón de antígeno-presentación de RT a cada pozo e incubar a RT por 2 min.
- Película de la solución de los pozos y lavar los pocillos 3 x con 200 μL de tampón de lavado a TA.
- Añadir 50 μl de anticuerpo primario recién preparada de 1/250 anti-RhoA a cada pocillo.
- Colocar la placa sobre un agitador orbital durante 45 min a 300 rpm a 25 ° C. Flick la solución desde el pozo.
- Repita los pasos de lavado 2 x (paso 2.24).
- Añadir 50 μl de anticuerpo secundario recién preparada de 1/250 anti-RhoA a cada pocillo.
- Coloque la placa sobre un agitador orbital durante 45 min a 300 rpm a 25 ° C.
- Preparar el reactivo de detección HRP mezclando volúmenes iguales de reactivo A y reactivo B.
- Película de la solución de cada pozo y lavar los pocillos 3 x con 200 μL de tampón de lavado a TA.
- Añadir 50 μl de reactivo de detección de HRP recién preparada para cada pozo.
- Leer la señal luminiscente dentro de 3-5 minutos para obtener la máxima señal y analizar los resultados utilizando un paquete de software apropiado.
Nota: Las lecturas deben tomarse dentro de 3-5 minutos para obtener la máxima señal. Ejecutar una "placa de prueba" para confirmar la lisis adecuada volumen de tampón se utiliza para los lysates de la célula para que la concentración de proteína es lo suficientemente alta para detectar la actividad de RhoA GTPase. (Una placa de prueba es una placa de células utilizadas para determinar si la concentración de proteína cae dentro del rango aceptable y también para determinar si el volumen del buffer de lisis se utiliza es la adecuada). El control positivo debe leer 4 a 10 veces más alto que los pocillos del blanco si es en el rango lineal. Si no es así, entonces ajuste el luminómetro por consultar al fabricante. La configuración para el luminómetro se da en la tabla 3. - Introducir datos en las columnas donde los títulos leer muestra, media, desviación estándar, rep1, rep2, rep3y rep4, que debe mostrar el número de repeticiones realizadas en cada muestra.
- Decir, introduzca la fórmula =average(Xn:Yn) donde X = el indicador de columna por rep1, Y = el indicador de columna rep4y n = el indicador de fila de la fila que se está trabajando.
- Desviación estándar, introduzca la fórmula = DesvEst (Xn:Yn) donde X = el indicador de columna por rep1, Y = el indicador de columna rep4y n = el indicador de fila de la fila que se está trabajando.
- Introduce los datos repetidos rep1, rep2, etc.
- Después de introducir los datos, utilice el método haga clic y arrastre para seleccionar la muestra, mediay desviación estándar.
- A continuación, en software de análisis de datos, seleccione la función para gráfico de lo que parece un cuadrado con un mini bar dentro.
Nota: Esto trae para arriba la tabla de proceso donde es posible cartas de diseño basadas en los datos introducidos. - Elegir columnas y, para valores de entrada, designar los números significan .
Nota: La tabla de los números significa en primer lugar se hace, y luego, se señala la columna de desviación estándar para las barras de error de eje y. Para ello, haga doble clic en las barras del gráfico, seleccione la ficha error de eje y , haga clic en la opción personalizado y seleccione el área en la hoja de trabajo para entrar en la ubicación de los datos de desviación estándar . La diferencia entre los grupos que necesitan compararse puede verse después de la creación de las cartas deseadas.
Resultados
Fraccionamiento de la membrana:
Ultracentrifugación se utilizó para el fraccionamiento de los componentes de la membrana y el citosol. Como se muestra en la figura 1, el sobrenadante contiene la fracción citosólica y el sedimento la fracción de membrana. La abundancia de RhoA en fracciones citosólica andmembrane Obtenido de células U251 fue examinada después del tratamiento con simvastatina mediante immunoblotting. La pureza y control de la fracción de membrana y el citosol de carga fueron confirmados por pan-cadherina y GAPDH respectivamente. Como se muestra en la figura 2, el tratamiento de simvastatina redujo la cantidad de membrana-limitan RhoA GTPase, mientras que aumentó su contenido citosólico. Esto es consistente con los efectos conocidos de las estatinas en la translocación de GTPasas basado en la inhibición de la Prenilación de RhoA. Simvastatina inhibe la Prenilación de RhoA GTPase, y por lo tanto, unprenylated RhoA no puede anclar en membranas del plasma de la célula, que resulta en su mayor concentración citosólica.
Enlazados a GTP RhoA:
Medimos enlazados a GTP RhoA proteína usando un análisis de la GTPasa-ligado del inmunosorbente y demostró que simvastatina significativamente (P < 0,05) mayor enlazados a GTP RhoA en U251 células (figura 3). Por lo tanto, mientras que la simvastatina inhibe la Prenilación de proteínas RhoA GTPase (figura 2), también aumentó su GTP carga en comparación con las células del control. Esto apunta al hecho de que Prenilación y GTP vinculante tanto desempeñan un papel en la actividad y la regulación de RhoA GTPase. Para obtener información adicional acerca de este fenómeno, por favor consulte la publicación original usando este protocolo8.
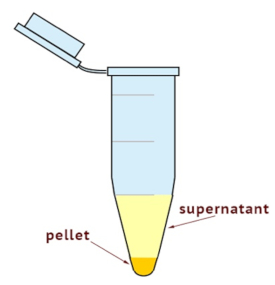
Figura 1 : Vista esquemática de las fracciones citosólicas y la membrana después de la ultracentrifugación. El precipitado contiene la fracción de membrana y el sobrenadante la fracción citosólica.

Figura 2 : Simvastatina cambia la localización de RhoA. Las células U251 fueron tratadas con simvastatina (10 μm; 12, 24 y 36 h) y la abundancia de RhoA en la membrana y fracciones citosólicas se determinó mediante immunoblotting. La abundancia GAPDH y pan-cadherina se evaluó también a control para la carga en la fracción citosólica y la membrana y para confirmar la ausencia de contaminación citosólica en las fracciones de la membrana. Los datos son típicamente de tres experimentos independientes con diferentes cultivos primarios. Esta figura ha sido modificada de Alizadeh et al. 8. haga clic aquí para ver una versión más grande de esta figura.

Figura 3 : Simvastatina modula la actividad de RhoA GTPase. El análisis de la GTPasa-ligado del inmunosorbente fue utilizado para medir la proteína Rho GTP-limite en células U251. Diferentes condiciones fueron probadas para 36 h, incluyendo el hambre y la simvastatina (10 μm). Para cada experimento, una proteína RhoA constitutivamente activa en el juego fue utilizada como control positivo. Los resultados se expresan como la media ± SD de dos repeticiones de experimentos independientes (* P < 0,001). Esta figura ha sido modificada de Alizadeh et al. 8.
| Recipiente de cultivo celular | Superficie (cm2) | Tampón de lisis (μL) | |
| Platos | 35 mm | 9 | 100 |
| 60 mm | 21 | 300 | |
| 100 mm | 55 | 700 | |
| 150 mm | 145 | 1500 | |
| Placas de | 6-bien | 9.4 / bien | 100 |
| 12-bien | 3.8 / bien | 70 | |
| 24-bien | 1.9 / bien | 40 | |
| Frascos | T-25 | 25 | 250 |
| T-75 | 75 | 1000 | |
| T-150 | 150 | 1500 | |
Tabla 1: Recomendado volúmenes de tampón de lisis de las células U251. El volumen es ajustable para diferentes tipos de células.
| Nombre de tampón de lisis | Composición del tampón de lisis | Pequeña proteína G blanco | Notas |
| GL35 | Tris (1 X GL36), MgCl2 (8 X GL36), NaCl (2 X GL36), IGEPAL (1 X GL36), SDS (5 X GL36) | Cdc42 | GL36 componentes idénticos, la composición varía como sigue; |
| GL36 | una formulación patentada de Tris pH 7,5, NaCl, MgCl2 y SDS, IGEPAL | RalA | Tampón estándar, compatible con más GTPasa-ligado del inmunosorbente ensayos. |
| GL36 | una formulación patentada de Tris pH 7,5, NaCl, MgCl2 y SDS, IGEPAL | RAC1 | Tampón estándar, compatible con más GTPasa-ligado del inmunosorbente ensayos. |
| GL36 | una formulación patentada de Tris pH 7,5, NaCl, MgCl2 y SDS, IGEPAL | Rac1, 2, 3 | Tampón estándar, compatible con más GTPasa-ligado del inmunosorbente ensayos. |
| GL36 | una formulación patentada de Tris pH 7,5, NaCl, MgCl2 y SDS, IGEPAL | Ras | Tampón estándar, compatible con más GTPasa-ligado del inmunosorbente ensayos. |
| GL36 | una formulación patentada de Tris pH 7,5, NaCl, MgCl2 y SDS, IGEPAL | RhoA | Tampón estándar, compatible con más GTPasa-ligado del inmunosorbente ensayos. |
| GL36 | una formulación patentada de Tris pH 7,5, MgCl2 | Arf1 | Tampón estándar, compatible con más GTPasa-ligado del inmunosorbente ensayos. |
Tabla 2: Lista de GTPasa-ligado del inmunosorbente análisis almacenadores intermediarios de la lisis y se recomienda la composición de la lisis de GTPasas pequeñas.
| Parámetros | Notas | ||
| GANANCIA | Opción de ganancia ajusta la sensibilidad de la máquina. Luminómetros más usan calibración automática o función de calibración limitada. Usuario debe leer la ganancia en baja, media y alta para ver si la lectura está dentro del rango lineal que varía en diferentes instrumentos. | ||
| TIEMPO DE INTEGRACIÓN | Se recomienda tener esta opción en su nivel más bajo como muy alta veces puede leer fuera del rango lineal. Esto podría requerir trabajo innecesario como usar dilución menor o anticuerpos primarios y secundarios. TIEMPO de integración también varía en diferentes instrumentos. | ||
| AGITACIÓN | Se recomienda utilizar el 5s agitación orbital. No es tan crítico como otros parámetros para la precisión del ensayo. | ||
| TEMPERATURA | Temperatura ambiente se recomienda | ||
| TIPO DE PLACA | Utilizar según la placa que está utilizando. La placa es generalmente 96 pocillos, plana y blanca. | ||
| FILTROS | No tienen filtros de excitación o emisión de luminiscencia. La excitación se puede establecer en cualquier valor deseado y óptima de emisión es de 430-445 nm. Dejar en blanco los espacios del filtro. Si esto no es una opción, | ||
Tabla 3: Una descripción detallada de la configuración de luminómetro.
Discusión
Aquí describimos un método preciso para medir la pequeña GTPasa Prenilación y GTP obligatorio muestra pequeña GTPasa localización subcelular (membrana versus citosol) y Rho GTP carga. GTPasas pequeñas se expresan en las células eucariotas y desempeñan un papel esencial en la proliferación celular, la motilidad y estructura. Prenilación y atar GTP están implicados en la regulación de la actividad GTPasa; por lo tanto, los ensayos para evaluar la Prenilación y GTP obligatorio de estas proteínas son herramientas importantes para la célula biólogos1,8.
Basado en los resultados de un estudio reciente, Rho proteína GTP carga es tipo de la célula específica8y por lo tanto, diferencia entre diferentes tipos de células. Además, la localización subcelular y la geranylgeranylation (GGT) de las proteínas Rho son lo determinante en la regulación de su función. Esto también es regulado por la interacción de las proteínas efectoras del FMAM, GAP y GDI para la GTPasas principales.
Simvastatina es conocida para aumentar carga GTP Rac en THP-1 monocitos, disminuir la Prenilación de Rac en presencia de estimulación de β amiloide y reducir las respuestas inflamatorias de estas células17. También sabemos que función de la célula T no es afectada por Rho GTP carga pero, por el contrario, la GGT de Rho determina función18,19. Por lo tanto, recomendamos que, con el fin de detectar actividad GTPasa Rho, Prenilación y carga GTP deben simultáneamente medirse en las células.
De nota, para lograr alta pureza citosólica y fracciones de la membrana, los pasos más importantes del protocolo son la sonicación y la ultracentrifugación. Para el ensayo de unión a GTP Rho, el paso más crítico es snap-congelación los lysates de la célula antes de procesamiento secuencial. Siguiendo estos pasos importantes se producen resultados consistentes y reproducibles en el estudio de GTPasas en sistemas vivos.
Un paso clave para examinar una determinada proteína estructura o membrana intracelular es la separación de los compartimentos celulares uno del otro. Fraccionamiento aprovecha las propiedades de cada compartimiento celular, como tamaño, forma, densidad de carga superficial y densidad boyante20. Se basa en la centrifugación diferencial en medios de alta viscosidad a 4 ° C. El método de fraccionamiento de membrana que se utilizó aquí se basa principalmente en el tamaño de cada compartimento y en alta velocidad gravitacional donde, después de la ultracentrifugación, proteínas de la membrana van a la parte inferior del tubo y las proteínas citosólicas permanecen en el sobrenadante.
Es importante tener en cuenta que las muestras que contienen concentraciones de proteínas y, posiblemente, altos niveles de lagunas potencialmente pueden inactivar el objetivo GTPasa. Este problema puede ocurrir incluso en tampón de lisis y puede llevar a resultados falsos negativos. Uno de los parámetros clave que determinan el éxito y la reproducibilidad de resultados de análisis de actividad GTPasa es la salud y la capacidad de respuesta de las células se utilizan en el experimento8. Se recomienda que los investigadores identifican las condiciones de crecimiento óptimo/caso y tiempo de duplicación de las células bajo estudio para determinar la activación/inhibición de GTPasa. Además, la actividad de GTPasa de GTPasas pequeñas todo se regula firmemente y es, por tanto, susceptibles de rápida disminuye a través de hidrólisis de la molécula de GTP enlazado a la enzima a través de la acción de las lagunas (durante y después del procedimiento de lisis celular ). Esta acción resulta en la rápida inactivación de la GTPasa de interés. Por lo tanto, se recomienda encarecidamente que lisis celular se realizaron rápidamente a 4 ° C, para lograr resultados precisos y reproducibles.
Hay varios factores dependiendo de las condiciones experimentales que determinan la celda final lisada. Primero, la cantidad total de RhoA GTPase en la línea celular o tejido específico: la cantidad de RhoA GTPase endógena es variable en diferentes tipos de células y tejidos; por lo tanto, esto puede resultar en una respuesta más enérgica a un activador o desactivador. En segundo lugar, la cantidad de activación/desactivación lograda bajo las condiciones experimentales: es importante considerar que aproximadamente del 2 al 10% de la GTPasa pequeña celular total posiblemente se activa en respuesta a un estímulo específico8. La cantidad de desactivación también únicamente depende del tipo de estímulos y es variable en diferentes células y tejidos. Por lo tanto, para cada tipo de ensayo de actividad de pequeña GTPasa Rho, la composición del compartimento celular y tampón de lisis es crucial. La tabla 3 muestra la composición recomendada de la solución de lisis para cada específica pequeña GTPasa de la proteína.
La concentración de proteína lisado de célula normalizada es un requisito importante ya que permite a los investigadores a comparar la actividad de GTPasa de diferentes muestras. Por lo tanto, lavar las células de todas las muestras en todas las condiciones con PBS frío es obligatorio para eliminar proteínas de los medios de cultivo de tejidos. También es esencial que todos los reactivos y tampones se utilizan en frío (4 ° C) en todas las etapas del experimento. Este frío reducirá al mínimo la hidrólisis de GTPasas, como Rho GTPasa, durante la preparación de la muestra. Es fundamental que este proceso de lysates de la célula se lleva a cabo rápidamente (en 10-15 min en total) para evitar la pérdida de la actividad de RhoA GTPase. Además, el paso más importante de la preparación de lisado celular es snap-congelar alícuotas del lisado en nitrógeno líquido para mantener la actividad enzimática GTPasa pequeña RhoA. Esto es especialmente importante si hay horarios diferentes o múltiples muestras en el experimento. Después de la preparación de lisados de congelado rápido, las muestras pueden ser guardadas en-80 ° C sin perder su actividad GTPasa Rho.
El protocolo previsto para el análisis del anclaje de la membrana de RhoA GTPase representa solamente una herramienta indirecta para medir la Prenilación de GTPasas pequeñas y no es capaz de detectar directamente o cuantificar el atascamiento de residuos isoprenoides a la proteína diana. Esta es una de las pocas limitaciones de este ensayo. Por lo tanto, da una estimación de la Prenilación de proteínas. Se han definido algunos enfoques que son capaces de medir directamente FT (farnesylation) o GGT farnesil transferasa o geranilgeranil transferasa, respectivamente, en células cultivadas y en tumores derivados de humanos y animales. Los ensayos de usan cambio de movilidad electroforética, farnesil difosfato de [3H] y geranilgeranil difosfato de [3H] y [3H] mevalónico ácido etiquetado, seguido de la inmunoprecipitación y SDS-PAGE21.
Utilizamos el análisis de la GTPasa RhoA-ligado del inmunosorbente para detectar cualquier anclaje de membrana y la actividad de RhoA GTPase. Consiste en una proteína Rho-GTP-que atan que está vinculada a los pocillos de una placa de 96 pocillos. Así, el GTP-limite activa Rho en los lysates de la célula o tejido se une a los pozos, mientras que PIB-limite Rho inactiva es arrastrado durante los pasos de lavado. Entonces, el encuadernado, activa RhoA en los pozos se detectarán usando un anticuerpo específico de RhoA y quimioluminiscencia. Es posible determinar el grado de activación de RhoA comparando las lecturas de lysates de la célula activados a nonactivated. Hambre de suero (el uso de medio sin suero en células cultivadas) se utiliza generalmente para inactivar RhoA en cultivo de tejidos. También debe mencionarse que la GTPasa-ligado del inmunosorbente rango de activación requiere de 10-50 μg de proteína para la detección de la actividad de RhoA GTPase.
Se recomienda que las muestras no tratadas tienen niveles bajos de celulares basals de actividad GTPasa (estado de control). Por ejemplo, hambre celular adecuada condiciones puede regular a la baja actividad de GTPasa y proporcionan las condiciones ideales para mostrar su activación bajo condiciones experimentales. También, se realizan ensayos de activación e inhibición de manera tiempo-dosis-respuesta y obtener las mejores respuestas de activación/inhibición de GTPasa. Más importante aún, durante la preparación celular, es muy importante utilizar las células que no son overconfluent (> 70%), para evitar cualquier nonresponsiveness de las células a los estímulos de activación/inhibición.
Luminómetros difieren mucho en cuanto a la sensibilidad y la absolutas lecturas. Por lo tanto, para determinar que está en el rango lineal, se aconseja ejecutar un ensayo de inmunosorción GTPasa con un espacio en blanco y un control positivo. Si el ensayo es de la gama lineal (el control positivo debe ser 4 x - 10 x mayor que la lectura sólo buffer) o la lectura en blanco es superior a 9 millones, entonces se recomienda además utilizar diluciones de anticuerpos. Por otra parte, se recomienda calibrar el luminómetro leer dentro del rango lineal del ensayo antes de comenzar el ensayo.
También hay ventajas para el ensayo de inmunosorción GTPasa que vale la pena mencionar. Análisis de la GTPasa-ligado del inmunosorbente mejoran el actual diseño experimental y tecnología facilitar los experimentos que no eran posibles con el viejo desplegables técnicas22. Los ensayos de la GTPasa-ligado del inmunosorbente también proporcionan precisión en la detección y la sensibilidad que permite análisis de actividad GTPasa en preparaciones previamente prohibidas para el desplegable ensayos23. Un par de estudios recientes en comparación con ensayos de activación GTPasa-ligado del inmunosorbente con pull-downs y llegó a la conclusión eso Análisis de GTPasa-ligado del inmunosorbente tiene algunas ventajas claras, es decir que GTPasa-ligado del inmunosorbente ensayos son superiores debido a su posibilidad de utilizar pequeñas cantidades de proteína22,24, su mayor sensibilidad24y sus mediciones cuantitativas23. El kit de ensayo de la GTPasa-ligado del inmunosorbente está disponible en luminometric o versiones de detección colorimétrica, donde los ensayos luminometric son más sensibles. Este análisis GTPasa-ligado del inmunosorbente se basan en un protocolo bastante simple y rápido, requiere sólo pequeñas cantidades de muestra y obtienen resultados cuantitativos y exactos. Por lo tanto, podría ser una buena idea para desarrollar este análisis para detectar otros tipos de proteínas GTPasa en diferentes líneas celulares y células de cultivo de tejidos con una mayor especificidad y precisión.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Saeid Ghavami fue apoyado por una beca salud ciencia centro de funcionamiento, que es CHRIM grant e investigación investigador Manitoba nueva concesión de funcionamiento de funcionamiento. Javad Alizadeh fue apoyado por la beca de investigación de Manitoba. Shahla Shojaei fue apoyado por una beca de Fundación de ciencia de salud funcionamiento y la beca postdoctoral de acelerar el paso. Adel Rezaei Moghadam fue apoyado por un NSERC operación grant que fue sostenida por Joseph W. Gordon. Amir A. Zeki apoyaron el K08 NIH/NHLBI Premio (1K08HL114882-01A1). Marek J. Los amablemente reconoce el apoyo de NCN #2016/21/B/NZ1/02812, apoyado por LE estudio Instituto de estudios avanzados (región Centre Val de Loire, Francia), a través de su Smart Programa General de Valle de Loira y cofinanciado por el Marie Acciones de Sklodowska-Curie, beca #665790. Simone da Silva Rosa fue apoyada por la beca UMGF.
Materiales
| Name | Company | Catalog Number | Comments |
| DMEM high Glucose | VWR (Canada) | VWRL0101-0500 | |
| Fetal Bovine Serum | VWR (Canada) | CA45001-106 | |
| Penicillin/Streptomycin | VWR (Canada) | 97062-806 | |
| EDTA (Ethylenediamine tetraacetic acid) | VWR (Canada) | CA71007-118 | |
| EGTA (Ethylene glycol bis(2-aminoethyl ether)-N,N,N',N'-tetraacetic acid) | VWR (Canada) | CAAAJ60767-AE | |
| DTT (DL-Dithiothreitol) | VWR (Canada) | CA97061-340 | |
| Ammonium Persulfate | VWR (Canada) | CABDH9214-500G | |
| Tris-Hydroxymethylaminomethane | VWR (Canada) | CA71009-186 | |
| 30% Acrylamide/Bis Solution | Biorad (Canada) | 1610158 | |
| TEMED | Biorad (Canada) | 1610801 | |
| Protease Inhibitor cocktail | Sigma/Aldrich (Canada) | P8340-5ML | 1:75 dilution |
| Rho-GTPase Antibody Sampler Kit | Cell Signaling (Canada) | 9968 | 1:1000 dilution |
| Pan-Cadherin antibody | Cell Signaling (Canada) | 4068 | 1:1000 dilution |
| GAPDH antibody | Santa Cruz Biotechnology (USA) | sc-69778 | 1:3000 dilution |
| RhoA G-LISA Activation Assay (Luminescence format) | Cytoskeleton Inc. (USA) | BK121 | Cytoskeleton I. G-LISA Activation Assays Technical Guide. 2016. |
| RhoA Antibody | Cell Signaling | 2117 | |
| ECL | Amersham-Pharmacia Biotech | RPN2209 | |
| Anti-Rabbit IgG (whole molecule) Peroxidase antibody | Sigma | A6154-1ML | |
| SpectraMax iD5 Multi-Mode Microplate Reader | Molecular Devices | 1612071A | Spectrophotometer |
| Nonidet P-40 | Sigma | 11332473001 | non-denaturing detergent, octylphenoxypolyethoxyethanol |
| DMSO | Sigma | D8418-50ML | |
| PBS | Sigma | P5493-1L | |
| Phophatase Inhibitor cocktail | Sigma | P5726-5ML | 1:75 Dilution |
Referencias
- Yeganeh, B., et al. Targeting the mevalonate cascade as a new therapeutic approach in heart disease, cancer and pulmonary disease. Pharmacology & Therapeutics. 143 (1), 87-110 (2014).
- Valencia, A., Chardin, P., Wittinghofer, A., Sander, C. The ras protein family: evolutionary tree and role of conserved amino acids. Biochemistry. 30 (19), 4637-4648 (1991).
- Hall, A. Rho family GTPases. Biochemical Society Transactions. 40 (6), 1378-1382 (2012).
- Rojas, A. M., Fuentes, G., Rausell, A., Valencia, A. The Ras protein superfamily: evolutionary tree and role of conserved amino acids. The Journal of Cell Biology. 196 (2), 189-201 (2012).
- Cherfils, J., Zeghouf, M. Regulation of small GTPases by GEFs, GAPs, and GDIs. Physiological Reviews. 93 (1), 269-309 (2013).
- Shojaei, S., et al. Perillyl Alcohol (Monoterpene Alcohol), Limonene. Enzymes. 36, 7-32 (2014).
- Ghavami, S., et al. Airway mesenchymal cell death by mevalonate cascade inhibition: integration of autophagy, unfolded protein response and apoptosis focusing on Bcl2 family proteins. Biochimica et Biophysica Acta. 1843 (7), 1259-1271 (2014).
- Alizadeh, J., et al. Mevalonate Cascade Inhibition by Simvastatin Induces the Intrinsic Apoptosis Pathway via Depletion of Isoprenoids in Tumor Cells. Scientific Reports. 7, 44841(2017).
- Ghavami, S., et al. Mevalonate cascade regulation of airway mesenchymal cell autophagy and apoptosis: a dual role for p53. PLoS One. 6 (1), e16523(2011).
- Tang, Y., Olufemi, L., Wang, M. T., Nie, D. Role of Rho GTPases in breast cancer. Frontiers in Bioscience: A Journal and Virtual Library. 13, 759-776 (2008).
- DerMardirossian, C., Bokoch, G. M. GDIs: central regulatory molecules in Rho GTPase activation. Trends in Cell Biology. 15 (7), 356-363 (2005).
- Garcia-Mata, R., Boulter, E., Burridge, K. The 'invisible hand': regulation of RHO GTPases by RHOGDIs. Nature Reviews Molecular Cell Biology. 12 (8), 493-504 (2011).
- Etienne-Manneville, S., Hall, A. Rho GTPases in cell biology. Nature. 420 (6916), 629-635 (2002).
- Ghavami, S., et al. Geranylgeranyl transferase 1 modulates autophagy and apoptosis in human airway smooth muscle. American Journal of Physiology - Lung Cellular and Molecular Physiology. 302 (4), L420-L428 (2012).
- Clark, E. A., Golub, T. R., Lander, E. S., Hynes, R. O. Genomic analysis of metastasis reveals an essential role for RhoC. Nature. 406 (6795), 532-535 (2000).
- Ghavami, S., et al. Statin-triggered cell death in primary human lung mesenchymal cells involves p53-PUMA and release of Smac and Omi but not cytochrome c. Biochimica et Biophysica Acta. 1803 (4), 452-467 (2010).
- Cordle, A., Koenigsknecht-Talboo, J., Wilkinson, B., Limpert, A., Landreth, G. Mechanisms of statin-mediated inhibition of small G-protein function. Journal of Biological Chemistry. 280 (40), 34202-34209 (2005).
- Waiczies, S., Bendix, I., Zipp, F. Geranylgeranylation but not GTP-loading of Rho GTPases determines T cell function. Science Signaling. 1 (12), pt3(2008).
- Waiczies, S., et al. Geranylgeranylation but not GTP loading determines rho migratory function in T cells. Journal of Immunology. 179 (9), 6024-6032 (2007).
- Satori, C. P., Kostal, V., Arriaga, E. A. Review on Recent Advances in the Analysis of Isolated Organelles. Analytica Chimica Acta. 753, 8-18 (2012).
- Berndt, N., Sebti, S. M. Measurement of protein farnesylation and geranylgeranylation in vitro, in cultured cells and in biopsies, and the effects of prenyl transferase inhibitors. Nature Protocols. 6 (11), 1775-1791 (2011).
- Keely, P. J., Conklin, M. W., Gehler, S., Ponik, S. M., Provenzano, P. P. Investigating integrin regulation and signaling events in three-dimensional systems. Methods in Enzymology. 426, 27-45 (2007).
- Oliver, A. W., et al. The HPV16 E6 binding protein Tip-1 interacts with ARHGEF16, which activates Cdc42. British Journal of Cancer. 104 (2), 324-331 (2011).
- Moniz, S., Matos, P., Jordan, P. WNK2 modulates MEK1 activity through the Rho GTPase pathway. Cellular Signalling. 20 (10), 1762-1768 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados