Method Article
Rilevazione di piccolo GTPase prenilazione e GTP Binding mediante frazionamento di membrana e GTPase-collegata dell'immunosorbente
In questo articolo
Riepilogo
Qui descriviamo un protocollo per studiare la prenilazione e guanosina-5'-trifosfato (GTP)-caricamento di Rho GTPasi. Questo protocollo è costituito da due metodi dettagliati, vale a dire del kit membrana frazionamento e un GTPase-collegata dell'immunosorbente. Il protocollo può essere utilizzato per misurare la prenilazione e GTP caricamento di diverse altre piccole GTPasi.
Abstract
La famiglia di Rho GTPasi appartiene alla superfamiglia Ras e comprende circa 20 membri in esseri umani. Rho GTPasi sono importanti nella regolazione di diverse funzioni cellulari, tra cui la dinamica del citoscheletro, motilità cellulare, polarità cellulare, guida assonale, traffico vescicolare e controllo del ciclo cellulare. Cambiamenti nella segnalazione di GTPasi Rho svolgono un ruolo normativo essenziale in molte condizioni patologiche, quali cancro, malattie del sistema nervoso centrale e malattie del sistema immunitario-dipendente. La modifica di posttranslational di Rho GTPasi (cioè, prenilazione di mevalonate pathway intermedi) e grippaggio di GTP sono fattori chiave che influenzano l'attivazione di questa proteina. In questa carta, sono disponibili due metodi semplici ed essenziali per rilevare una vasta gamma di Rho GTPasi prenilazione e attività obbligatorie di GTP. Dettagli delle procedure tecniche che sono state utilizzate sono spiegati passo dopo passo in questo manoscritto.
Introduzione
Rho GTPasi sono un gruppo di piccole proteine (21-25 kDa), che sono ben conservate nel corso dell'evoluzione e formano un'unica sottofamiglia della superfamiglia Ras di piccolo GTPases. In ciascuna sottofamiglia all'interno di questa superfamiglia, c'è un nucleo di dominio condiviso di G che è coinvolto nella attività GTPasica e del nucleotide exchange1. La differenza tra la famiglia di Rho e le altre sottofamiglie di Ras è la presenza di un "dominio di inserto Rho" all'interno del filo del βth 5 e il 4th α elica in piccole GTPasi dominio2.
Secondo la classificazione recente, Rho GTPasi sono considerati una famiglia di proteine che si inseriscono nella superfamiglia Ras GTPase3di segnalazione. Mammiferi Rho GTPasi hanno 22 membri in base alla loro funzione specifica e caratterizzazione generale4 in cui RhoA, Rac1 e Cdc42 sono tra i membri più studiato in questo gruppo. Rho GTPasi sono collegati a intracellulare segnalazione vie tramite un meccanismo strettamente regolato che è dipendente da interruttori molecolari via proteina modifiche di posttranslational5.
GTP caricamento e idrolisi sono meccanismi essenziali nel ciclo di attivazione/disattivazione delle GTPasi Rho e sono regolamentati tramite proteine Gap (Gap). Le lacune sono responsabili dell'idrolisi del GTP e lavorano in concerto con fattori di scambio di nucleotide della guanina (GEF) che sono responsabili per la reazione di GTP-caricamento. Inibitori di Rho PIL dissociazione (GDIs) forniscono ulteriore regolamento di piccole GTPasi Rho via associazione per l'associazione a PIL Rho GTPasi. Questo inibisce la dissociazione di PIL e facilita sequestrante di Rho GTPasi dai siti intracellulari attiva della membrana. Ci è inoltre ulteriore regolamento delle proteine GTPasi Rho che coinvolgono la prenilazione di GDIs che regola sia idrolisi del nucleotide e cambio e controlli GDP/GTP ciclismo1,6,7,8.
GTP-caricamento sia Rho GTPasi prenilazione sono coinvolti nel movimento di Rho GTPasi tra citosol e membrane cellulari modificando le proprietà lipofiliche di queste proteine1,9. I regolatori di cui sopra interagiscono con i fosfolipidi della membrana cellulare e di altre proteine modulante dell'attività di scambio GDP/GTP10. Inoltre, GDIs, inibitori di dissociazione, bloccare sia l'idrolisi del GTP e lo scambio GDP/GTP. GDIs inibiscono la dissociazione delle proteine Rho inattive dal PIL e, pertanto, la loro interazione con effettori a valle. GDIs regolano anche il ciclismo delle GTPasi tra il citosol e membrana nella cella. L'attività di Rho GTPasi dipende in gran parte loro movimento alla membrana delle cellule; così, GDIs sono considerati come regolatori critici che possono sequestrare GTPasi nel citoplasma attraverso nascondendo loro regione/domini idrofobici11,12.
Per Rho GTPasi ad avere una segnalazione ottimale e la funzione in tutte le fasi del suo ciclo di attivazione, il ciclo dinamico di idrolisi del GTP-caricamento/GTP è cruciale. Qualsiasi tipo di alterazioni in questo processo può comportare modifiche successive di funzioni cellulari regolamentate da Rho GTPasi, come cellula polarità, proliferazione, morfogenesi, citochinesi, migrazione, adesione e la sopravvivenza di13,14.
L'attuale protocollo fornisce ai lettori con un metodo dettagliato monitoraggio piccolo RhoA GTPase attivazione tramite l'indagine sui loro prenilazione e GDP/GTP caricamento. Questo metodo può essere utilizzato anche per rilevare la prenilazione e grippaggio di GTP di una vasta gamma di piccole GTPasi. Il GTPase-collegata dell'immunosorbente può essere utilizzato per misurare il livello di attivazione di altri generi di GTPasi, come Rac1, Rac2, Rac3, H, K o N-Ras, Arf e Rho15. La simvastatina agente farmacologico è usato come un esempio, come recentemente è stato segnalato per essere coinvolti nella regolazione di piccole GTPasi Rho prenilazione e attività8,9,14,16.
Protocollo
1. la determinazione della localizzazione di RhoA mediante membrana/Cytosol frazionamento
-
Trattamento della cultura e simvastatina
- Seme 50.000 di U251 cellule in un 100mm piatto e cultura li in di Dulbecco per volta medio dell'Aquila (DMEM) (alto glucosio, 10% di siero fetale bovino [FB]).
- Quando 30% confluenti, trattare le cellule rimuovendo il mezzo e aggiungere mezzo contenenti simvastatina ad esso (10 µM di simvastatina disciolto in dimetilsolfossido [DMSO]) e incubare per 36 h a 37 ° C8. Uso di DMSO da solo come un controllo del veicolo.
Nota: 10 milioni di cellule sono necessari per il frazionamento cytosol e membrana delle cellule.
-
Insieme di celle
- Rimuovere le celle da incubatore 37 ° C. Guardate le cellule al microscopio per confermare il confluency.
Nota: Le cellule dovrebbero essere 70% - 80% confluenti. - Aspirare il mezzo, lavare le cellule 1 x con freddo tampone fosfato salino (PBS). Aggiungere 5 mL di tampone (EDTA) l'acido etilendiamminotetracetico (KCl: 400 mg/L, NaCl: 6800 mg/L, NaHCO3: 2200 mg/L, NaH2PO4. H2o: 140 mg/L, D-glucosio: 1.000 mg, disodio EDTA: 373 mg/L) per piastra e posto le cellule nuovamente dentro l'incubatore 37 ° C per 5 min.
- Dopo 5 min di incubazione, raccogliere l'EDTA con le cellule in una provetta da 15 mL che contengono la stessa quantità di mezzo di EDTA.
Nota: Avendo medio nel tubo neutralizza l'EDTA e impedisce qualsiasi ulteriore digestione delle membrane cellulari. - Posizionare il tubo in una scatola di ghiaccio e procedere con la centrifuga.
- Impostare la centrifuga a 1.500 x g a 4 ° C e far girare le cellule per 5 min.
- Rimuovere il sopranatante senza disturbare il pellet e aggiungere 1 mL di PBS freddo. Mescolare bene le cellule.
- Trasferire il composto di cellule (soluzione) in una nuova provetta da 1,5 mL, centrifuga a 1.500 x g a 4 ° C e girare le cellule per 5 min.
- Controllare il formato della pallina (per stimare il volume del buffer per il passaggio successivo). Porre i campioni su ghiaccio. Scartare il surnatante completamente senza disturbare il pellet.
- Aggiungere tampone ghiacciata (10 mM Tris-HCl [pH 7.5], 0,1 mM EDTA, 0,1 mM EGTA, 1 mM dithiothreitol e inibitore della proteasi cocktail), mescolare i campioni ben pipettando su e giù e poi, procedere a sonicazione.
- Rimuovere le celle da incubatore 37 ° C. Guardate le cellule al microscopio per confermare il confluency.
-
Sonicazione
- Impostare il sonicatore per cinque cicli, 5 s ciascuno e ripetere 3x.
- Eseguire la sonicazione sul ghiaccio. Procedere con l'ultracentrifuga.
Nota: Condizione di freddo e ghiaccio preservare le proteine e rendere più affidabili i risultati.
-
Ultracentrifugazione
- Utilizzare un'ultracentrifuga per separare gli omogeneati delle cellule in citoplasmatica e frazioni della membrana. Impostare la centrifuga su 100.000 x g per 35 min a 4 ° C. Come illustrato nella Figura 1, verificare la dimensione del pellet.
Nota: La frazione di membrana è nella parte inferiore del tubo e il resto è altri componenti citoplasmatici. - Raccogliere il surnatante completamente mentre facendo attenzione a non disturbare il pellet. Il supernatante è frazione citosolica. Posto il surnatante in una provetta etichettata recentemente.
- Aggiungere 300 µ l di buffer di dissociazione (buffer II) (50 mM Tris-HCl [pH 7.5], 0.15 M NaCl, 1 mM dithiothreitol, 1% SDS, 1 mM EDTA, 1 mM EGTA e cocktail dell'inibitore di proteasi) per il pellet (contiene la frazione di membrana). Miscelare bene pipettando su e giù.
- Procedere alla determinazione della proteina e preparazione del campione macchia occidentale (analisi di immunoblot).
- Utilizzare un'ultracentrifuga per separare gli omogeneati delle cellule in citoplasmatica e frazioni della membrana. Impostare la centrifuga su 100.000 x g per 35 min a 4 ° C. Come illustrato nella Figura 1, verificare la dimensione del pellet.
-
Immunoblotting
- Preparare le proteine delle cellule estratti da frazioni separate in tampone di lisi (20 mM Tris-HCl [pH 7.5], 0,5 mM PMSF, 0,5% detergente non ionico-40, 100 µM β-glicerolo 3-fosfato e 0,5% inibitore della proteasi cocktail).
- Misurare la concentrazione di proteina usando il metodo di Lowry8 e calcolare il volume di tampone di lisi (20 mM Tris-HCl [pH 7.5] 0,5 mM PMSF, 0,5% nondenaturing detergente, octylphenoxypolyethoxyethanol, 100 µM β-glicerolo 3-fosfato e 0,5% cocktail di inibitore di proteasi) per normalizzare la concentrazione di proteina tra i campioni.
- Riscaldare i campioni a 90 ° C per 5 min e 15-20 µ l dei campioni su un gel di SDS-PAGE 15% per separare le proteine di carico.
Nota: Caricare 1 µ g di proteine per ogni campione. Calcolare il volume che deve essere eseguito di conseguenza. - Trasferire le proteine separate per membrane di nylon sotto condizioni (500 nM glicina, 50 mM Tris-HCl e 20% metanolo) per 2 ore, a temperatura ambiente (TA) a 100 V riducenti.
Nota: Per confermare il trasferimento di successo della proteina, utilizzare Ponceau macchia o visualizzare l'indicatore di proteina sulla membrana. - Bloccare le membrane con latte in polvere senza grassi 5% e 1 x soluzione fisiologica tamponata contenente detergente (TBS/0.01% non ionici; TBST) per bloccare il legame non specifico dell'anticorpo a 4 ° C durante la notte o a RT per 1 h.
- Aggiungere gli anticorpi primari per l'analisi di immunoblotting e incubare per una notte a 4 ° C.
Nota: In questo esperimento, 3/2/Rac1, cdc42, RhoA, GAPDH e pan-Cadherin sono stati usati ad una diluizione di 1:1,000 in 1% latte in 1 x TBST. Pan-caderina e GAPDH sono stati usati per confermare la membrana e la frazione citosolica purezza, rispettivamente. - Lavare le membrane 3 x con un tampone di lavaggio con 1 x TBST per 20 min.
- Incubare le membrane anti-coniglio alla perossidasi di rafano (HRP)-anticorpo secondario coniugato per i rispettivi anticorpi primari (per 1 h a RT).
- Lavare le macchie di 3x per 20 min e svilupparle con rilevazione di chemiluminescenza (ECL).
2. misura del carico di GTP RhoA usando un'analisi di piccole proteine G attivazione
- Conteggio 10.000 cellule/mL e cultura le cellule U251 in un 100mm piatto.
- Quando essi sono 30% confluenti, trattare le cellule con simvastatina come descritto al punto 1.1.2.
- Portare le piastre di coltura fuori dell'incubatrice. Guardate le cellule al microscopio per confermare confluency. Assicurarsi che le celle siano 70% - 80% confluenti. Mettere la capsula di Petri sul ghiaccio, aspirare i media e lavare le cellule 3 x con gelida PBS (pH 7,2).
- Aspirare il PBS. Inclinare il piatto di Petri sul ghiaccio per un minuto rimuovere tutti i residui di PBS.
Nota: PBS residuo incide negativamente questo test. - Lisare le cellule in un volume di 700 µ l di tampone di lisi ghiacciata contenente inibitori di proteasi e fosfatasi.
Nota: 700 µ l di solito è sufficiente per un 100mm di Petri. Vedere la tabella 1 per trovare il volume giusto per ogni nave di cultura. - Raccogliere il lysate delle cellule con il raschietto di cella. Inclinare la piastra di coltura per questa tecnica.
- Trasferire il lisato di un stoccaggio PROVETTE CRIOGENIA ghiacciata con etichetta e tenerlo sul ghiaccio.
- Mescolare accuratamente con un vortice. Mantenere 10 µ l di lisato per l'analisi della proteina, per misurare la concentrazione di proteine nel campione.
- Snap-freeze sulla rimanente cella lysate in azoto liquido.
Nota: Preparare diverse aliquote del lysate prima di loro, per evitare cicli ripetuti di congelamento/scongelamento che possono portare alla perdita di attività di RhoA GTPase snap-congelamento delle cellule. - Trasferire le provette per criogenia snap-congelato per un congelatore-80 ° C e conservare i campioni per l'analisi di GTPase-collegata dell'immunosorbente.
Nota: Non conservare i campioni per più di 14 giorni. Lavorare velocemente e non lasciare mai i campioni su ghiaccio per più di 10 min. Non maneggiate mai contemporaneamente tutte le capsule di Petri. - Misurare la concentrazione di proteina usando il metodo di Lowry8 e calcolare il volume di tampone di lisi per normalizzare la concentrazione di proteina tra i campioni.
Nota: La concentrazione migliore è di solito 1 mg/mL; Tuttavia, 0,3 - 2 mg/mL può essere rilevabile. - Preparare un controllo vuoto aggiungendo 60 µ l di tampone di lisi e 60 µ l di tampone di associazione ad una microprovetta.
Nota: Il controllo in bianco ha tutti i reagenti tranne l'antigene e viene utilizzato per la sottrazione del background. - Preparare un controllo positivo aggiungendo 12 µ l di proteina di controllo di Rho, 48 µ l di tampone di lisi e 60 µ l di tampone di associazione.
Nota: Il controllo positivo ha tutti i reagenti più un antigene confermato per Rho-A-GTP. - Togliete la piastra di affinità di Rho dalla busta e posizionarlo sul ghiaccio.
- Sciogliere la polvere nei pozzetti con 100 µ l di acqua distillata ghiacciata. Tenere la piastra sul ghiaccio.
- Scongelare i lisati cellulari snap-congelato in un bagnetto ad acqua settato a 25 ° C.
- Aggiungere il volume calcolato di tampone di lisi ghiacciata (dal punto 2.11) per ogni campione per normalizzare la concentrazione nella proteina.
Nota: Rimuovere il PBS dopo aver lavato le celle (utilizzando un aspiratore tubo a vuoto) per evitare di causare modifiche nella composizione del buffer di lisi. Equalizzare la proteina di campione ad una concentrazione compresa tra 0,8 e 2 mg/mL per un accurato confronto tra i campioni in analisi di attivazione di GTPase. La tabella 2 fornisce informazioni dettagliate sul buffer da utilizzare per questo test. - Trasferimento 60 µ l dei campioni ghiacciati normalizzati per microprovette e aggiungere 60 µ l di binding buffer; mescolare accuratamente i campioni e tenerli sul ghiaccio.
- Rimuovere completamente l'acqua/soluzioni dalla micropiastra scorrendo vigoroso, seguita da cinque a sette rubinetti duri su una stuoia di laboratorio.
- Aggiungere 50 µ l dei campioni normalizzati, un controllo in bianco e un controllo positivo ai pozzetti in duplicati.
- Collocare la piastra su un agitatore orbitale per 30 min a 4 ° C a 300 giri/min.
Nota: Il passo d'agitazione è molto importante, e si raccomanda di utilizzare l'agitatore orbitale a 300 giri/min. - Deselezionare i campioni dalla piastra, spostando e lavarli 2x con 200 µ l di tampone di lavaggio a RT. vigorosamente rimuovere il tampone di lavaggio dai pozzetti dopo ogni lavaggio, spostando, seguita da intercettazioni e tenere la piastra sul banco a TA.
- Aggiungere 200 µ l di tampone di RT antigene-presentare ad ogni pozzetto e incubare a temperatura ambiente per 2 min.
- Scorri la soluzione dai pozzetti e lavare i pozzetti 3 x con 200 µ l di tampone di lavaggio a TA.
- Aggiungere 50 µ l di anticorpo primario anti-RhoA di preparati 1/250 a ciascun pozzetto.
- Collocare la piastra su un agitatore orbitale per 45 min a 300 giri impostato a 25 ° C. Rovesciare la soluzione dal pozzo.
- Ripetere i passaggi di lavaggio 2 x (passo 2.24).
- Aggiungere 50 µ l di anticorpo secondario anti-RhoA di preparati 1/250 a ciascun pozzetto.
- Posizionare la piastra sulla cima di un agitatore orbitale per 45 min a 300 giri impostato a 25 ° C.
- Preparare il reagente di rilevazione HRP mescolando volumi uguali di reagente A e reagente B.
- Scorri la soluzione da ogni pozzetto e lavare i pozzetti 3 x con 200 µ l di tampone di lavaggio a TA.
- Aggiungere 50 µ l di reagente di rivelazione HRP preparata ad ogni pozzetto.
- Leggere il segnale luminescente entro 3-5 min per ottenere il segnale massimo e analizzare i risultati utilizzando un pacchetto software appropriato.
Nota: Letture devono essere prese entro 3-5 min per ottenere il massimo del segnale. Eseguire un "test plate" per confermare la lisi adeguata volume tampone viene utilizzato per i lisati cellulari affinché la concentrazione nella proteina è sufficientemente elevata per rilevare attività di RhoA GTPase. (Una piastra di prova è un piatto di celle utilizzate per determinare se la concentrazione di proteina rientri nell'intervallo accettabile e anche per determinare se il volume del buffer di lisi utilizzato è appropriato). Il controllo positivo dovrebbe essere 4 - 10 volte superiore a pozzetti del bianco se è nella gamma lineare. In caso contrario, quindi regolare il luminometro consultando il produttore. Le impostazioni per il luminometro sono presentate nella tabella 3. - Immettere i dati grezzi in colonne dove le intestazioni leggere campione, media, Deviazione Standard, rep1, rep2, rep3e rep4, che è quello di mostrare il numero di repliche che viene fatto su ogni campione.
- In media, immettere la formula =average(Xn:Yn) dove X = l'indicatore di colonna per rep1, Y = l'indicatore di colonna per rep4e n = l'indicatore di riga della riga in lavorazione.
- In Deviazione Standard, immettere la formula = stdev (Xn:Yn) dove X = l'indicatore di colonna per rep1, Y = l'indicatore di colonna per rep4e n = l'indicatore di riga della riga in lavorazione.
- Immettere i dati replicati in rep1, rep2, ecc.
- Dopo aver inserito i dati, utilizzare il metodo di fare clic e trascinare per selezionare il campione, diree la Deviazione Standard.
- Quindi, nel software di analisi dati, è possibile selezionare la funzione per fare che si presenta come un quadrato con un mini grafico a barre all'interno del grafico.
Nota: Questo porta il grafico di processo decisionale dove è possibile ai grafici di progettazione sulla base dei dati inseriti. - Scegliere grafico a colonne e, per i valori di input, designare i numeri significa .
Nota: Il grafico per i numeri significa in primo luogo è fatta, e quindi, la colonna di Deviazione Standard per le barre di errore y è definita. Per effettuare questa operazione, fare doppio clic sulle barre del grafico, selezionare la scheda di errore dell'asse y , scegliere l'opzione personalizzata e selezionare l'area del foglio di lavoro di immettere il percorso dei dati di Deviazione Standard . La differenza tra i gruppi che devono essere confrontati può essere visto dopo la creazione dei grafici desiderati.
Risultati
Frazionamento di membrana:
Ultracentrifugazione è stato usato per il frazionamento dei componenti della membrana e citoplasma. Come illustrato nella Figura 1, il surnatante contiene la frazione citosolica e il pellet contiene la frazione di membrana. L'abbondanza di RhoA in andmembrane citosolico frazioni ottenute da cellule U251 è stato esaminato dopo il trattamento con simvastatina mediante immunoblotting. La purezza e il controllo della frazione della membrana e citosol di caricamento sono stati confermati da pan-caderina e GAPDH rispettivamente. Come illustrato nella Figura 2, il trattamento di simvastatin ridotto la quantità di membrana-limitano RhoA GTPase, mentre ha aumentato il suo contenuto citosolico. Ciò è coerente con i noti effetti delle statine sulla traslocazione di GTPasi basato sull'inibizione di RhoA prenilazione. Simvastatina inibisce la prenilazione di RhoA GTPase, e pertanto, unprenylated RhoA è in grado di ancorare in membrane plasmatiche delle cellule, che si traduce nelle sue più alte concentrazioni citosoliche.
RhoA-GTP legato:
Abbiamo misurato la proteina GTP-associazione RhoA usando un GTPase-collegata dell'immunosorbente ed hanno mostrato che la simvastatina significativamente (P < 0,05) aumentato associato a GTP RhoA in U251 cellule (Figura 3). Pertanto, mentre simvastatin inibito prenylation della proteina RhoA GTPase (Figura 2), inoltre ha aumentato la GTP caricamento rispetto alle cellule di controllo. Questo sottolinea il fatto che la prenilazione e GTP binding entrambi svolgono un ruolo nell'attività e nella regolazione di RhoA GTPase. Per ulteriori dettagli riguardanti questo fenomeno, fare riferimento alla pubblicazione originale utilizzando questo protocollo n.8.
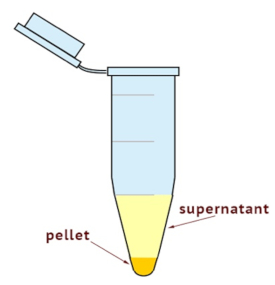
Figura 1 : Rappresentazione schematica delle frazioni citosoliche e di membrana dopo ultracentrifugazione. Il pellet contiene la frazione di membrana e il surnatante contiene la frazione citosolica.

Figura 2 : Simvastatin cambia la localizzazione di RhoA. U251 cellule sono state trattate con simvastatina (10 µM; 12, 24 e 36 h) e l'abbondanza di RhoA nella membrana e frazioni citosoliche è stata determinata dall'immunoblotting. L'abbondanza GAPDH e pan-Cadherin inoltre è stata valutata al controllo per il caricamento nelle frazioni citosoliche e di membrana e per confermare l'assenza di contaminazione citosolico nelle frazioni della membrana. I dati sono in genere da tre esperimenti indipendenti, utilizzando diverse colture primarie. Questa figura è stata modificata da Alizadeh et al. 8. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3 : Simvastatina modula l'attività di RhoA GTPase. Il GTPase-collegata dell'immunosorbente fu utilizzato per misurare la proteina GTP-associato a Rho in U251 cellule. Diverse condizioni sono state testate per 36 h, tra cui la fame e simvastatina (10 µM). Per ogni esperimento, una proteina RhoA costitutivamente attiva fornita nel kit è stata usata come controllo positivo. I risultati sono espressi come media ± SD di due replicati in esperimenti indipendenti (* P < 0,001). Questa figura è stata modificata da Alizadeh et al. 8.
| Vaso di coltura cellulare | Superficie (cm2) | Buffer di lisi (µ l) | |
| Piatti | 35 mm | 9 | 100 |
| 60 mm | 21 | 300 | |
| 100 mm | 55 | 700 | |
| 150 mm | 145 | 1500 | |
| Piastre | 6 pozzetti | 9,4 / ben | 100 |
| 12-pozzetti | 3,8 / ben | 70 | |
| 24 pozzetti | 1,9 / ben | 40 | |
| Boccette | T-25 | 25 | 250 |
| T-75 | 75 | 1000 | |
| T-150 | 150 | 1500 | |
Tabella 1: Consigliato volumi di tampone di lisi per cellule U251. Il volume è regolabile per diversi tipi di cellule.
| Nome del Buffer di lisi | Composizione del Buffer di lisi | Piccolo G-proteina bersaglio | Note |
| GL35 | Tris (1 X GL36), MgCl2 (8 X GL36), NaCl (2 X GL36), IGEPAL (1 X GL36), SDS (5 X GL36) | Cdc42 | Componenti identici a GL36, composizione varia come segue; |
| GL36 | una formulazione brevettata di Tris-HCl pH 7.5, MgCl2, NaCl, IGEPAL e SDS | RalA | Tampone standard, compatibile con più GTPase-collegata di analisi dell'immunosorbente. |
| GL36 | una formulazione brevettata di Tris-HCl pH 7.5, MgCl2, NaCl, IGEPAL e SDS | Rac1 | Tampone standard, compatibile con più GTPase-collegata di analisi dell'immunosorbente. |
| GL36 | una formulazione brevettata di Tris-HCl pH 7.5, MgCl2, NaCl, IGEPAL e SDS | Rac1, 2, 3 | Tampone standard, compatibile con più GTPase-collegata di analisi dell'immunosorbente. |
| GL36 | una formulazione brevettata di Tris-HCl pH 7.5, MgCl2, NaCl, IGEPAL e SDS | Ras | Tampone standard, compatibile con più GTPase-collegata di analisi dell'immunosorbente. |
| GL36 | una formulazione brevettata di Tris-HCl pH 7.5, MgCl2, NaCl, IGEPAL e SDS | RhoA | Tampone standard, compatibile con più GTPase-collegata di analisi dell'immunosorbente. |
| GL36 | una formulazione brevettata di Tris-HCl pH 7.5, MgCl2 | Arf1 | Tampone standard, compatibile con più GTPase-collegata di analisi dell'immunosorbente. |
Tabella 2: Elenco di GTPase-collegata dell'immunosorbente assay buffer di lisi e consigliato composizione di lisi per piccole GTPasi.
| Parametri | Note | ||
| GUADAGNO | Opzione di guadagno regola la sensibilità della macchina. Maggior parte dei luminometri utilizzano calibrazione automatica o funzione di calibrazione limitato. Leggere il guadagno a bassa, media e alta al fine di vedere se la lettura è all'interno della gamma lineare che varia in diversi strumenti. | ||
| TEMPO DI INTEGRAZIONE | Si consiglia di avere questa opzione ai livelli più bassi come l'altissima volte potrebbe leggere fuori della gamma lineare. Ciò potrebbe richiedere un lavoro inutile come l'utilizzo di diluizione inferiore o anticorpi primari e secondari. TEMPO di integrazione varia anche in diversi strumenti. | ||
| AGITAZIONE | Si raccomanda di utilizzare il 5s agitazione orbitale. Non è critico come altri parametri per la precisione del dosaggio. | ||
| TEMPERATURA | Temperatura ambiente è consigliato | ||
| TIPO DI PIASTRA | Utilizzare secondo la piastra che si sta utilizzando. La piastra è solitamente 96 pozzetti, piatto e bianco. | ||
| FILTRI | Filtri di eccitazione o di emissione non sono necessari per luminescenza. Eccitazione può essere impostata a qualsiasi valore desiderato e gamma ottimale per l'emissione è 430-445 nm. Lasciare vuoti gli spazi del filtro. Se non si tratta di un'opzione, | ||
Tabella 3: Una descrizione dettagliata delle impostazioni luminometro.
Discussione
Qui descriviamo un metodo accurato per misurare piccole GTPasi prenilazione e mostrato come piccolo GTPase localizzazione subcellulare (membrana rispetto al cytosol) e Rho GTP caricamento del grippaggio di GTP. Piccole GTPasi sono espressi nelle cellule eucariotiche e svolgono un ruolo essenziale nella proliferazione cellulare, della motilità e della struttura. Sia prenilazione e grippaggio di GTP sono coinvolti nella regolazione dell'attività GTPasica; di conseguenza, le analisi per valutare la prenilazione e grippaggio di GTP di queste proteine sono strumenti importanti per cella biologi1,8.
Sulla base dei risultati di un recente studio, Rho proteina GTP caricamento è specifico di cellula-tipo8e pertanto differisce tra diversi tipi di cellule. Inoltre, la localizzazione subcellulare e geranylgeranylation (GGT) delle proteine Rho sono i passi determinanti nella regolazione della loro funzione. Ciò è ulteriormente regolata dall'interazione delle proteine effettrici GEF, GAP e GDI per la GTPasi principali.
Simvastatina è noto per aumentare il carico di Rac GTP in monociti THP-1, diminuire la prenilazione di Rac in presenza di stimolazione β amiloide e ridurre le risposte infiammatorie da queste cellule17. Sappiamo anche che la funzione a cellula T non è interessata da Rho GTP caricamento ma, piuttosto, la GGT di Rho determina funzione18,19. Si consiglia pertanto che, al fine di rilevare attività GTPasica di Rho, sia prenilazione e GTP caricamento deve misurare contemporaneamente nelle cellule.
Da notare, per ottenere elevata purezza citosolico e frazioni di membrana, i passi più importanti del protocollo sono la sonicazione e l'ultracentrifugazione. Per il dosaggio di Rho GTP-legante, la fase più critica è snap-congelamento i lisati cellulari prima elaborazione sequenziale. Seguendo questi passi importanti produrrà risultati coerenti e riproducibili nello studio delle GTPasi nei sistemi viventi.
Un passaggio chiave per esaminare una particolare proteina intracellulare di struttura o di membrana è la separazione dei compartimenti cellulari uno da altro. Frazionamento sfrutta le proprietà di ogni compartimento cellulare, come dimensione e forma, densità superficiale di carica e densità capace di galleggiare20. Si basa principalmente sulla centrifugazione differenziale nei media ad alta viscosità a 4 ° C. Il metodo di frazionamento di membrana che è stato usato qui è basato principalmente sulle dimensioni di ciascun vano e sull'alta velocità gravitazionale dove, dopo ultracentrifugazione, proteine di membrana andare al fondo del tubo e le proteine citosoliche rimangono nella surnatante.
È importante notare che i campioni contenenti concentrazioni ad alta percentuale proteica e, possibilmente, alti livelli di lacune potenzialmente possono inattivare il bersaglio GTPasi. Questo problema può verificarsi anche in buffer di lisi e può portare a risultati falsi negativi. Uno dei parametri chiavi che determinano il successo e la riproducibilità dei risultati del test attività GTPasica è la salute e la reattività delle cellule utilizzata esperimento8. Si raccomanda vivamente che gli investigatori identificano il tempo di raddoppiamento per le cellule in fase di studio per determinare l'attivazione/inibizione di GTPase e condizioni di crescita ottimali/del caso. Inoltre, l'attività GTPasica di tutte le piccole GTPasi è strettamente regolato ed è, pertanto, suscettibile di rapida diminuisce tramite idrolisi della molecola di GTP associato a enzima tramite l'azione delle lacune (durante e dopo la procedura di lisi delle cellule ). Questa azione provoca l'inattivazione rapida di GTPase di interesse. Pertanto, si raccomanda vivamente che la lisi cellulare viene eseguita rapidamente a 4 ° C, per ottenere risultati accurati e riproducibili.
Ci sono diversi fattori a seconda delle condizioni sperimentali che determinano il lisato cellulare finale. Prima di tutto, la quantità totale di RhoA GTPase nella linea cellulare o tessuto specifico: la quantità di endogeno RhoA GTPase è variabile nei diversi tipi di cellule e tessuti; di conseguenza, questo può provocare una risposta più vigorosa di un attivatore o deactivator. In secondo luogo, la quantità di attivazione/disattivazione raggiunto condizioni sperimentali: è importante considerare che circa il 2% al 10% del GTPase piccolo cellulare totale probabilmente è attivato in risposta a un determinato stimolo8. La quantità di disattivazione anche esclusivamente dipende dal tipo di stimoli ed è variabile in diverse cellule e tessuti. Pertanto, per ogni tipo di analisi di attività piccola GTPasi Rho, la composizione del compartimento cellulare e buffer di Lisi è cruciale. La tabella 3 Mostra la composizione raccomandata di tampone di lisi per ogni specifica proteina piccola GTPasi.
La concentrazione nella proteina lisato cellulare normalizzata è un requisito importante perché essa consente ai ricercatori di confrontare l'attività GTPasica di diversi campioni. Pertanto, le cellule da tutti i campioni in tutte le condizioni con PBS freddo di lavaggio è obbligatorio rimuovere proteina dal supporto di coltura del tessuto. È anche essenziale che tutti i reagenti e i buffer vengono utilizzati a basse temperature (4 ° C) in tutte le fasi dell'esperimento. Questa temperatura fredda riduce al minimo l'idrolisi delle GTPasi, tra cui Rho GTPasi, durante la preparazione del campione. È fondamentale che questo trattamento dei lisati cellulari avviene rapidamente (in 10-15 min in totale) al fine di evitare la perdita di attività di RhoA GTPase. Inoltre, il passo più importante della preparazione del lysate delle cellule è quello di aliquote del lisato snap-congelamento in azoto liquido per mantenere l'attività enzimatica di GTPase piccolo RhoA. Ciò è particolarmente importante se ci sono diversi punti temporali o campioni multipli nell'esperimento. Dopo la preparazione dei lysates snap-congelato, i campioni possono essere tenuti a-80 ° C senza perdere la loro attività di Rho GTPasi.
Il protocollo fornito per l'analisi di ammorsamento di membrana di RhoA GTPase rappresenta solo uno strumento indiretto per misurare la prenilazione di piccolo GTPases e non è in grado di rilevare direttamente o di quantificare l'associazione del isoprenoid residui alla proteina bersaglio. Questo è uno dei pochi limiti di questo test. Di conseguenza, dà una stima di prenilazione delle proteine. Sono stati definiti alcuni approcci che sono in grado di misurare direttamente FT (farnesylation) e/o GGT di farnesil transferasi e/o Geranilgeranil transferasi, rispettivamente sia in cellule in coltura che negli animali e tumori di derivazione umana. I dosaggi utilizzano MAIUSC mobilità elettroforetica, difosfato farnesil [3H] e difosfato di geranylgeranyl [3H] e acido di mevalonic [3H] etichettatura, seguito da immunoprecipitazione e SDS-PAGE21.
Abbiamo usato la GTPasi RhoA-collegata dell'immunosorbente per rilevare qualsiasi ancoraggio di membrana e l'attività di RhoA GTPase. Si compone di una proteina Rho-GTP-legante che è legata ai pozzetti di una piastra a 96 pozzetti. Così, la Rho attiva associato a GTP nei lisati di cellule o tessuti associa ai pozzetti, mentre PIL associati inattivo Rho è spazzato via durante le fasi di lavaggio. Quindi, verrà rilevato il RhoA associato, attivo nei pozzetti utilizzando un anticorpo specifico RhoA e chemiluminescenza. È possibile determinare il grado di attivazione di RhoA confrontando letture da lisati cellulari attivati per non attivate. Deprivazione di siero (l'uso di medium senza siero sulle cellule coltivate) viene solitamente utilizzato per inattivare RhoA nella coltura del tessuto. Va anche ricordato che la gamma di test di immunoassorbimento GTPase di attivazione richiede 10-50 µ g di proteina per la rilevazione di attività di RhoA GTPase.
Si raccomanda vivamente che campioni non trattati hanno livelli basali bassi di attività GTPasica (controllo dello stato). Ad esempio, adeguata delle cellule inedia condizioni può downregulate attività GTPasica e offrono le condizioni ideali per mostrare la loro attivazione in condizioni sperimentali. Inoltre, analisi attivazione e di inibizione sono eseguite in maniera tempo - e dose-risposta per ottenere le migliori risposte di attivazione/inibizione di GTPase. Ancora più importante, durante la preparazione del cellulare, è molto importante utilizzare le cellule che non sono overconfluent (> 70%), per evitare qualsiasi nonresponsiveness delle cellule agli stimoli di attivazione/inibizione.
Luminometri differiscono notevolmente in termini di sensibilità e assolute letture. Pertanto, al fine di determinare che è in campo lineare, suggeriamo che in esecuzione di un test di immunoassorbimento GTPase con uno spazio vuoto e un controllo positivo. Se il dosaggio è su campo lineare (controllo positivo dovrebbe essere 4 x - 10 x superiore la lettura sola buffer) o la lettura vuota è superiore a 9 milioni, quindi si consiglia di utilizzare ulteriori diluizioni di anticorpo. Inoltre, si consiglia di calibrare il luminometro leggere all'interno della gamma lineare del test prima di iniziare il dosaggio.
Ci sono anche vantaggi per il GTPase-collegata dell'immunosorbente che sono degni di nota. Analisi GTPase-collegate dell'immunosorbente migliorare l'attuale disegno sperimentale e attivare la tecnologia facilitare esperimenti che non erano possibili con vecchio pull-down tecniche22. L'analisi di GTPase-collegate dell'immunosorbente anche forniscono precisione di rilevamento e sensibilità che permette analisi di attività GTPasica nei preparati precedentemente off-limits per saggi di pull-down23. Un paio di recenti studi rispetto analisi di attivazione di GTPase-collegate dell'immunosorbente con pull-down e concluso che GTPase-collegata dell'immunosorbente ha alcuni vantaggi evidenti, vale a dire che analisi GTPase-collegate dell'immunosorbente sono superiori a causa loro possibilità di utilizzare piccole quantità di proteina22,24, loro maggiore sensibilità24e loro misurazioni quantitative23. Il kit di dosaggio di GTPase-collegata dell'immunosorbente è disponibile nelle versioni di rilevazione colorimetrica, o luminometrici dove i saggi di luminometrici sono più sensibili. Questo GTPase-collegata dell'immunosorbente si basa su un protocollo piuttosto semplice e veloce, richiede solo piccole quantità di campione e produce risultati quantitativi e accurate. Di conseguenza, esso potrebbe essere una buona idea per sviluppare ulteriormente questo test per rilevare altri tipi di proteine a base di GTPase in diverse linee cellulari e cellule di coltura del tessuto con una specificità molto più alta e la precisione.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Saeid Ghavami è stata sostenuta da una sovvenzione di funzionamento di salute scienza centro, CHRIM grant e ricerca Manitoba nuovo investigatore uso Grant di funzionamento. Javad Alizadeh è stato sostenuto da studentship ricerca Manitoba. Shahla Shojaei era sostenuto da un uso di salute scienza Foundation grant e la borsa di studio post-dottorato MITACS accelerare. Adel Rezaei Moghadam è stato sostenuto da una sovvenzione che era detenuto da Joseph W. Gordon di funzionamento di NSERC. Amir r. Zeki è stata sostenuta dal premio NIH/NHLBI K08 (1K08HL114882-01A1). Marek J. Los gentilmente riconosce il sostegno da NCN concedere #2016/21/B/NZ1/02812, supportato da LE STUDIUM Institute for Advanced Studies (regione centro-Val de Loire, Francia) attraverso il suo programma generale di Smart Loire Valley e co-finanziato dalla Marie Azioni di Sklodowska-Curie, concedere #665790. Simone da Silva Rosa è stato sostenuto da studentship UMGF.
Materiali
| Name | Company | Catalog Number | Comments |
| DMEM high Glucose | VWR (Canada) | VWRL0101-0500 | |
| Fetal Bovine Serum | VWR (Canada) | CA45001-106 | |
| Penicillin/Streptomycin | VWR (Canada) | 97062-806 | |
| EDTA (Ethylenediamine tetraacetic acid) | VWR (Canada) | CA71007-118 | |
| EGTA (Ethylene glycol bis(2-aminoethyl ether)-N,N,N',N'-tetraacetic acid) | VWR (Canada) | CAAAJ60767-AE | |
| DTT (DL-Dithiothreitol) | VWR (Canada) | CA97061-340 | |
| Ammonium Persulfate | VWR (Canada) | CABDH9214-500G | |
| Tris-Hydroxymethylaminomethane | VWR (Canada) | CA71009-186 | |
| 30% Acrylamide/Bis Solution | Biorad (Canada) | 1610158 | |
| TEMED | Biorad (Canada) | 1610801 | |
| Protease Inhibitor cocktail | Sigma/Aldrich (Canada) | P8340-5ML | 1:75 dilution |
| Rho-GTPase Antibody Sampler Kit | Cell Signaling (Canada) | 9968 | 1:1000 dilution |
| Pan-Cadherin antibody | Cell Signaling (Canada) | 4068 | 1:1000 dilution |
| GAPDH antibody | Santa Cruz Biotechnology (USA) | sc-69778 | 1:3000 dilution |
| RhoA G-LISA Activation Assay (Luminescence format) | Cytoskeleton Inc. (USA) | BK121 | Cytoskeleton I. G-LISA Activation Assays Technical Guide. 2016. |
| RhoA Antibody | Cell Signaling | 2117 | |
| ECL | Amersham-Pharmacia Biotech | RPN2209 | |
| Anti-Rabbit IgG (whole molecule) Peroxidase antibody | Sigma | A6154-1ML | |
| SpectraMax iD5 Multi-Mode Microplate Reader | Molecular Devices | 1612071A | Spectrophotometer |
| Nonidet P-40 | Sigma | 11332473001 | non-denaturing detergent, octylphenoxypolyethoxyethanol |
| DMSO | Sigma | D8418-50ML | |
| PBS | Sigma | P5493-1L | |
| Phophatase Inhibitor cocktail | Sigma | P5726-5ML | 1:75 Dilution |
Riferimenti
- Yeganeh, B., et al. Targeting the mevalonate cascade as a new therapeutic approach in heart disease, cancer and pulmonary disease. Pharmacology & Therapeutics. 143 (1), 87-110 (2014).
- Valencia, A., Chardin, P., Wittinghofer, A., Sander, C. The ras protein family: evolutionary tree and role of conserved amino acids. Biochemistry. 30 (19), 4637-4648 (1991).
- Hall, A. Rho family GTPases. Biochemical Society Transactions. 40 (6), 1378-1382 (2012).
- Rojas, A. M., Fuentes, G., Rausell, A., Valencia, A. The Ras protein superfamily: evolutionary tree and role of conserved amino acids. The Journal of Cell Biology. 196 (2), 189-201 (2012).
- Cherfils, J., Zeghouf, M. Regulation of small GTPases by GEFs, GAPs, and GDIs. Physiological Reviews. 93 (1), 269-309 (2013).
- Shojaei, S., et al. Perillyl Alcohol (Monoterpene Alcohol), Limonene. Enzymes. 36, 7-32 (2014).
- Ghavami, S., et al. Airway mesenchymal cell death by mevalonate cascade inhibition: integration of autophagy, unfolded protein response and apoptosis focusing on Bcl2 family proteins. Biochimica et Biophysica Acta. 1843 (7), 1259-1271 (2014).
- Alizadeh, J., et al. Mevalonate Cascade Inhibition by Simvastatin Induces the Intrinsic Apoptosis Pathway via Depletion of Isoprenoids in Tumor Cells. Scientific Reports. 7, 44841(2017).
- Ghavami, S., et al. Mevalonate cascade regulation of airway mesenchymal cell autophagy and apoptosis: a dual role for p53. PLoS One. 6 (1), e16523(2011).
- Tang, Y., Olufemi, L., Wang, M. T., Nie, D. Role of Rho GTPases in breast cancer. Frontiers in Bioscience: A Journal and Virtual Library. 13, 759-776 (2008).
- DerMardirossian, C., Bokoch, G. M. GDIs: central regulatory molecules in Rho GTPase activation. Trends in Cell Biology. 15 (7), 356-363 (2005).
- Garcia-Mata, R., Boulter, E., Burridge, K. The 'invisible hand': regulation of RHO GTPases by RHOGDIs. Nature Reviews Molecular Cell Biology. 12 (8), 493-504 (2011).
- Etienne-Manneville, S., Hall, A. Rho GTPases in cell biology. Nature. 420 (6916), 629-635 (2002).
- Ghavami, S., et al. Geranylgeranyl transferase 1 modulates autophagy and apoptosis in human airway smooth muscle. American Journal of Physiology - Lung Cellular and Molecular Physiology. 302 (4), L420-L428 (2012).
- Clark, E. A., Golub, T. R., Lander, E. S., Hynes, R. O. Genomic analysis of metastasis reveals an essential role for RhoC. Nature. 406 (6795), 532-535 (2000).
- Ghavami, S., et al. Statin-triggered cell death in primary human lung mesenchymal cells involves p53-PUMA and release of Smac and Omi but not cytochrome c. Biochimica et Biophysica Acta. 1803 (4), 452-467 (2010).
- Cordle, A., Koenigsknecht-Talboo, J., Wilkinson, B., Limpert, A., Landreth, G. Mechanisms of statin-mediated inhibition of small G-protein function. Journal of Biological Chemistry. 280 (40), 34202-34209 (2005).
- Waiczies, S., Bendix, I., Zipp, F. Geranylgeranylation but not GTP-loading of Rho GTPases determines T cell function. Science Signaling. 1 (12), pt3(2008).
- Waiczies, S., et al. Geranylgeranylation but not GTP loading determines rho migratory function in T cells. Journal of Immunology. 179 (9), 6024-6032 (2007).
- Satori, C. P., Kostal, V., Arriaga, E. A. Review on Recent Advances in the Analysis of Isolated Organelles. Analytica Chimica Acta. 753, 8-18 (2012).
- Berndt, N., Sebti, S. M. Measurement of protein farnesylation and geranylgeranylation in vitro, in cultured cells and in biopsies, and the effects of prenyl transferase inhibitors. Nature Protocols. 6 (11), 1775-1791 (2011).
- Keely, P. J., Conklin, M. W., Gehler, S., Ponik, S. M., Provenzano, P. P. Investigating integrin regulation and signaling events in three-dimensional systems. Methods in Enzymology. 426, 27-45 (2007).
- Oliver, A. W., et al. The HPV16 E6 binding protein Tip-1 interacts with ARHGEF16, which activates Cdc42. British Journal of Cancer. 104 (2), 324-331 (2011).
- Moniz, S., Matos, P., Jordan, P. WNK2 modulates MEK1 activity through the Rho GTPase pathway. Cellular Signalling. 20 (10), 1762-1768 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon