Method Article
Erkennung von kleine GTPase Prenylation und GTP binden mit Membran Fraktionierung und GTPase verbundene Immunosorbentprobe Assay
In diesem Artikel
Zusammenfassung
Hier beschreiben wir ein Protokoll, um die Prenylation und Guanosin-5'-Triphosphat (GTP) untersuchen-Laden von Rho GTPase. Dieses Protokoll besteht aus zwei detaillierte Methoden, nämlich Membran Fraktionierung und ein GTPase verbundene Immunosorbentprobe assay. Das Protokoll kann verwendet werden, zur Messung der Prenylation und GTP Laden von verschiedenen anderen kleinen GTPasen.
Zusammenfassung
Die Rho-GTPase Familie gehört zu den Ras-Superfamilie und umfasst rund 20 Mitglieder in den Menschen. Rho-GTPasen sind wichtig bei der Regulation des diverse zelluläre Funktionen, einschließlich Zellskelett Dynamik, Zelle Motilität Zellpolarität, axonalen Beratung, vesikuläre Menschenhandel und Zellzyklus-Kontrolle. Änderungen bei der Signalisierung Rho GTPase spielen eine wichtige regulatorische Rolle in vielen pathologischen Bedingungen, wie Krebs, Erkrankungen des zentralen Nervensystems und Immunsystem-abhängigen Krankheiten. Die posttranslationale Modifikation der Rho-GTPasen (d.h. Prenylation von Mevalonat Weg Zwischenprodukte) und GTP-Bindung sind wichtige Faktoren, die die Aktivierung dieses Proteins beeinflussen. In diesem Beitrag werden zwei wesentliche und einfache Methoden bereitgestellt, um eine breite Palette von Rho GTPase Prenylation und GTP-Bindung-Aktivitäten zu erkennen. Details der technischen Verfahren, die verwendet wurden erklärt Schritt für Schritt in diesem Manuskript.
Einleitung
Rho-GTPasen sind eine Gruppe von kleinen Proteine (21-25 kDa), die sind gut im Laufe der Evolution konserviert, und bilden eine einzigartige Unterfamilie in der Ras-Superfamilie der kleinen GTPasen. In jeder Unterfamilie innerhalb dieser Überfamilie gibt es ein gemeinsame G Domäne-Kern, der die GTPase-Aktivität und Nukleotid Exchange1beteiligt ist. Der Unterschied zwischen der Rho-Familie und den anderen Unterfamilien der Ras ist das Vorhandensein einer "Rho einfügen Domäne" innerhalb der 5th -β-Strang und die 4th -α-Helix in die kleine GTPase Domäne2.
Aufgrund der aktuellen Klassifizierung, Rho-GTPasen gelten eine Familie von Signalproteinen, die in der Ras GTPase-Superfamilie3passen. Säugetier-Rho-GTPasen haben 22 Mitgliedern, die aufgrund ihrer spezifischen Funktion und allgemeine Charakterisierung4 in der RhoA, Rac1 und Cdc42 unter den Mitgliedern die meisten studierte in dieser Gruppe sind. Rho-GTPasen sind intrazelluläre Signal-Wege über einen streng regulierten Mechanismus verbunden, der molekulare Schalter über Protein posttranslationale Modifikationen5abhängig ist.
GTP beladen und Hydrolyse sind wesentliche Mechanismen in den Kreislauf der Aktivierung/Deaktivierung der kleinen Rho-GTPasen und regulierten über GTPase-aktivierende Proteine (Lücken). Lücken sind verantwortlich für die GTP-Hydrolyse und arbeiten im Konzert mit Guanin-Nukleotid Exchange Faktoren (GEFs) die für die GTP-Loading Reaktion verantwortlich sind. Rho BIP Dissoziation Inhibitoren (GDIs) bieten weitere Regulierung der kleinen Rho-GTPasen durch Bindung an die BIP-gebundenen Rho-GTPasen. Dies hemmt BIP Dissoziation und erleichtert die Sequestrierung von kleinen Rho-GTPasen Weg von der aktiven intrazellulären Membran-Websites. Außerdem gibt es weitere Regulierung der Rho-GTPase Proteine mit der Prenylation des GDIs regelt sowohl Nukleotid Hydrolyse und Austausch und Steuerelemente BIP/GTP Radfahren1,6,7,8.
GTP-Loading und Rho GTPase Prenylation sind in der Bewegung der Rho-GTPase zwischen Zytosol und Zellmembranen beteiligt, durch Ändern der lipophilen Eigenschaften dieser Proteine1,9. Die oben genannten Regler interagieren mit Phospholipide der Zellmembran und andere modulierenden Proteine des BIP/GTP Exchange Aktivität10. Darüber hinaus blockieren GDIs, Dissoziation-Inhibitoren, die GTP-Hydrolyse und der BIP/GTP-Austausch. GDIs hemmen die Dissoziation der inaktiven Rho Proteine von BIP und somit ihre Interaktion mit nachgeschalteten Effektoren. GDIs regulieren auch den Radsport GTPasen zwischen Zytosol und Membran in die Zelle. Die Aktivität der Rho-GTPasen hängt zu einem großen Teil ihrer Bewegung an der Zellmembran; So werden GDIs als wichtige Regulatoren angesehen, die im Zytoplasma durch verstecken ihre hydrophoben Region/Domänen11,12GTPasen absondern können.
Für Rho GTPase eine optimale Signal- und Funktion in allen Phasen des Lebenszyklus Aktivierung haben ist der dynamische Zyklus der GTP-laden/GTP Hydrolyse entscheidend. Jede Art von Änderungen in diesem Prozess führen nachträgliche Änderungen in Zellfunktionen Rho GTPase, z. B. Zelle Polarität, Verbreitung, Morphogenese, Cytokinese, Migration, Haftung und überleben13,14geregelt.
Das aktuelle Protokoll bietet den Lesern eine detaillierte Methode, um kleine RhoA GTPase Aktivierung über überwachen die Untersuchung ihrer Prenylation und BIP/GTP beladen. Diese Methode kann auch verwendet werden, die Prenylation und GTP-Bindung eine Vielzahl von kleinen GTPasen zu erkennen. Die GTPase verbundene Immunosorbentprobe Assay kann zur Messung der Aktivierung anderer Arten von GTPasen, wie Rac1, Rac2, Rac3, h-, k- oder N-Ras, Arf und Rho15verwendet werden. Die pharmakologische Agenten Simvastatin dient als Beispiel, wie es vor kurzem berichtet wurde, beteiligt an der Regulation des kleinen Rho GTPase Prenylation und Aktivität8,9,14,16.
Protokoll
1. Festlegung des RhoA Lokalisierung mit Membran/Zytosol Fraktionierung
-
Kultur und Simvastatin Zelltherapie
- 50.000 Samen der U251 Zellen in einem 100 mm-Speise- und Kultur sie in Dulbecco den geändert Adlers Medium (DMEM) (hohe Glukose, 10 % fötalen Rinderserum [FBS]).
- Wenn 30 % Zusammenfluss, behandeln die Zellen durch das Medium entfernen und hinzufügen Simvastatin-haltigen Medium (10 µM von Simvastatin in Dimethyl Sulfoxid [DMSO] aufgelöst) und inkubieren Sie 36 Stunden bei 37 ° C8. Verwenden Sie DMSO allein als eine Fahrzeugkontrolle.
Hinweis: 10 Millionen Zellen sind für die Zellflüssigkeit und Membran Fraktionierung der Zellen benötigt.
-
Auflistung von Zellen
- Entfernen Sie die Zellen aus dem Inkubator 37 ° C. Schauen Sie sich die Zellen unter dem Mikroskop die Konfluenz zu bestätigen.
Hinweis: Die Zellen sollte 70-80 % Zusammenfluss. - Das Medium Aspirieren, waschen Sie die Zellen 1 X mit kalten Phosphat-gepufferte Kochsalzlösung (PBS). Geben Sie 5 mL der Ethylenediaminetetraacetic Säure (EDTA)-Puffer (KCl: 400 mg/L NaCl: 6800 mg/L, NaHCO3: 2200 mg/L, NaH2PO4. H2o: 140 mg/L, D-Glucose: 1.000 mg, EDTA Binatrium: 373 mg/L) pro Platte und die Zellen wieder in den Inkubator 37 ° C für 5 min Platz.
- Nach 5 min Inkubation sammeln Sie die EDTA mit den Zellen in einer 15 mL Tube mit der gleichen Menge des Mediums als EDTA.
Hinweis: Mit Medium in das Rohr neutralisiert die EDTA und verhindert jede weitere Verdauung der Zellmembranen. - Legen Sie das Rohr in eine Eisbox und fahren Sie mit der Zentrifuge.
- Richten Sie die Zentrifuge bis 1.500 X g bei 4 ° C und drehen Sie die Zellen für 5 min.
- Entfernen Sie den Überstand zu, ohne zu stören das Pellet und 1 mL kaltem PBS. Mischen Sie die Zellen gut.
- Übertragen Sie die Zelle Mischung (Lösung) zu einem neuen 1,5 mL Schlauch, Zentrifuge bei 1.500 X g bei 4 ° C, und drehen Sie die Zellen für 5 min.
- Überprüfen Sie die Pellet-Größe (für die Schätzung der Lautstärke des Puffers für den nächsten Schritt). Legen Sie die Proben auf Eis. Verwerfen des Überstands vollständig ohne zu stören das Pellet.
- Eiskalte Puffer, die ich (10 mM Tris-HCl [pH 7.5], 0, 1 mM EDTA 0,1 mM EGTA, 1 mM Dithiothreitol und Protease-Inhibitor cocktail), Proben mischen Sie gut durch Pipettieren rauf und runter, und gehen Sie dann zur Beschallung.
- Entfernen Sie die Zellen aus dem Inkubator 37 ° C. Schauen Sie sich die Zellen unter dem Mikroskop die Konfluenz zu bestätigen.
-
Beschallung
- Legen Sie die Sonikator für fünf Zyklen, 5 s, und wiederholen Sie 3 X.
- Führen Sie die Anwendung von Ultraschall auf Eis. Fahren Sie mit der Ultrazentrifuge.
Hinweis: Eis und kalten Zustand bewahren die Proteine und die Ergebnisse zuverlässiger zu machen.
-
Ultrazentrifugation
- Verwenden einer Ultrazentrifuge, um die Zelle Homogenates in zytoplasmatischen zu trennen und Membran-Fraktionen. Legen Sie die Zentrifuge auf 100.000 X g für 35 min bei 4 ° C. Wie in Abbildung 1gezeigt, überprüfen Sie die Pellet-Größe.
Hinweis: Die Membran Bruch ist an der Unterseite des Rohres und der Rest ist andere cytoplasmatischen Komponenten. - Sammeln Sie überstand vollständig, während man aufpassen, nicht zu stören das Pellet. Der Überstand wird die cytosolische Fraktion. Ort der Überstand in ein neu beschrifteten Röhrchen.
- Fügen Sie 300 µL Puffer Dissoziation (Puffer II) (50 mM Tris-HCl [pH 7.5], 0,15 M NaCl, 1 mM Dithiothreitol, 1 % SDS, 1 mM EDTA, 1 mM EGTA und Protease-Inhibitor cocktail) zum Pellet (enthält die Membran-Bruch). Mischen Sie gut durch Pipettieren rauf und runter.
- Gehen Sie zur Proteinbestimmung und western-Blot (Immunoblot Analyse) Probenvorbereitung.
- Verwenden einer Ultrazentrifuge, um die Zelle Homogenates in zytoplasmatischen zu trennen und Membran-Fraktionen. Legen Sie die Zentrifuge auf 100.000 X g für 35 min bei 4 ° C. Wie in Abbildung 1gezeigt, überprüfen Sie die Pellet-Größe.
-
Immunoblotting
- Bereiten Sie die Zelle Protein Auszüge aus den getrennten Fraktionen in Lyse Puffer (20 mM Tris-HCl [pH 7.5], 0,5 mM PMSF, 0,5 % nicht-ionische Waschmittel-40, 100 µM β-Glycerin-3-Phosphat und 0,5 % Proteaseinhibitor cocktail).
- Messen Sie die Konzentration des Proteins mit der Lowry-Methode8 und berechnen Sie das Volumen des Puffers lyse (20 mM Tris-HCl [pH 7.5], 0,5 mM PMSF 0,5 % nondenaturing Reinigungsmittel, Octylphenoxypolyethoxyethanol, 100 µM β-Glycerin-3-Phosphat und 0,5 % Protease-Hemmer Cocktail), die Konzentration des Proteins zwischen den Proben zu normalisieren.
- Erwärmen Sie die Proben bei 90 ° C für 5 min und laden Sie 15-20 µL der Proben auf einem 15 % SDS-PAGE Gel um die Proteine zu trennen.
Hinweis: Last 1 µg Protein für jede Probe. Berechnen Sie das Volumen, das muss entsprechend ausgeführt werden. - Übertragen Sie die getrennten Proteine auf Nylon-Membranen unter reduzierenden Bedingungen (500 nM Glycin 50 mM Tris-HCl und 20 % Methanol) für 2 h bei Raumtemperatur (RT) bei 100 V.
Hinweis: Zur Bestätigung des erfolgreichen Protein Transfers verwenden Sie Ponceau Fleck oder visualisieren Sie den Protein-Marker auf der Membran zu. - Blockieren der Membranen mit 5 % getrockneten Magermilch und 1 X Tris gepufferte Kochsalzlösung mit Waschmittel (TBS/0.01% nichtionische Reinigungsmittel; TBST), unspezifische Antikörperbindung bei 4 ° C über Nacht oder bei RT für 1 h zu blockieren.
- Fügen Sie Primärantikörper für Immunoblotting Analyse und über Nacht bei 4 ° c inkubieren
Hinweis: In diesem Experiment Rac1/2/3, cdc42, RhoA, GAPDH und Pan-Cadherin dienten bei einem 1:1,000 Verdünnung in 1 % Milch in 1 X TBST. Pan-Cadherin und GAPDH wurden verwendet, um die Membran und die cytosolische Fraktion Reinheit, bzw. bestätigen. - Waschen Sie die Membranen 3 X mit einem Wasch-Puffer mit 1 X TBST für 20 Minuten.
- Die Membranen mit Anti-Kaninchen-Meerrettich-Peroxidase (HRP) inkubieren-konjugierten Sekundärantikörper für die jeweiligen primären Antikörper (für 1 h bei RT).
- Waschen Sie die Flecken 3 X 20 min und verstärkte Chemilumineszenz (ECL) Erkennung zu entwickeln.
2. Messung der RhoA GTP Last mit einem kleinen G-Protein-Aktivierung-Assay
- Graf 10.000 Zellen/mL und Kultur Gericht die U251 Zellen in einem 100 mm.
- Wenn sie 30 % Zusammenfluss sind, behandeln Sie die Zellen mit Simvastatin wie unter Punkt 1.1.2 beschrieben.
- Die Kultur-Platten aus dem Inkubator zu bringen. Schauen Sie sich die Zellen unter dem Mikroskop, Konfluenz zu bestätigen. Sicherstellen Sie, dass die Zellen 70-80 % Zusammenfluss sind. Die Petrischale auf Eis legen, aspirieren Sie die Medien und waschen Sie die Zellen 3 X mit eiskaltem PBS (pH 7,2).
- Aspirieren Sie die PBS. Kippen Sie die Petrischale auf Eis für eine weitere Minute, alle Reste von PBS zu entfernen.
Hinweis: Passives PBS beeinträchtigt dieser Assay. - Lösen Sie die Zellen in einem 700 µL Volumen von eiskalten Lyse Puffer mit Phosphatase, Protease-Inhibitoren.
Hinweis: 700 µL ist normalerweise ausreichend für eine 100 mm Petrischale. Siehe Tabelle 1 , die richtige Lautstärke für jede Kulturgefäß zu finden. - Ernten Sie die Zelle lysate mit der Zelle-Schaber. Neigen Sie die Kultur-Platte für diese Technik.
- Übertragen Sie der lysate auf einem beschrifteten eiskalten Cryotube und halten sie auf dem Eis.
- Mischen Sie gründlich mit einem Wirbel. Halten Sie 10 µL lysate für das Protein Assay, der Proteinkonzentration in der Probe zu messen.
- Snap-Freeze die noch verbleibende Zelle lysate in flüssigem Stickstoff.
Hinweis: Bereiten Sie mehrere Aliquote Zelle lysate vor dem Snap-einfrieren lassen, um wiederholte Frost/Tau-Wechseln zu vermeiden, die zum Verlust der Aktivität der RhoA GTPase führen kann. - Übertragen Sie die Snap eingefroren Cryoröhrchen bis-80 ° C Gefrierschrank und speichern Sie die Proben für die GTPase verbundene Immunosorbentprobe Assay.
Hinweis: Bewahren Sie die Proben länger als 14 Tage. Arbeiten Sie schnell und lassen Sie niemals die Proben auf Eis länger als 10 Minuten. Nie behandeln Sie alle Petrischalen gleichzeitig. - Messen Sie die Konzentration des Proteins mit der Lowry-Methode8 und berechnen Sie das Volumen des Puffers Lyse die Konzentration des Proteins zwischen den Proben zu normalisieren.
Hinweis: Die beste Konzentration ist in der Regel 1 mg/mL; jedoch können 0,3 - 2 mg/mL nachweisbar sein. - Bereiten Sie ein leeres Steuerelement, indem 60 µL Lyse Puffer und 60 µL Puffer Bindung an ein Reaktionscup.
Hinweis: Die Blindkontrolle hat alle Reagenzien außer das Antigen und dient für die Subtraktion des Hintergrunds. - Bereiten Sie eine Positivkontrolle indem 12 µL Rho Kontrolle Protein, 48 µL Lyse Puffer und 60 µL Bindung Puffer.
Hinweis: Die Positivkontrolle hat alle Reagenzien sowie eine bestätigte Antigen für Rho-A-GTP. - Nehmen Sie die Rho-Affinität-Platte aus seiner Tasche und legen Sie ihn auf Eis.
- Das Pulver in den Vertiefungen mit 100 µL eiskaltes destilliertem Wasser auflösen. Halten Sie die Platte auf dem Eis.
- Tauen Sie das Snap eingefroren Zelle Lysates in einem Wasserbad, eingestellt auf 25 ° C.
- Fügen Sie das berechnete Volumen der eiskalte Lyse-Puffer (ab Schritt 2.11) zu jeder Probe, die Proteinkonzentration zu normalisieren.
Hinweis: Entfernen Sie die PBS nach dem Waschen der Zellen (mit einer Vakuumröhre Absauganlage) um zu vermeiden, dass Änderungen in der Zusammensetzung des Puffers Lyse. Das Probe-Protein zu einer Konzentration zwischen 0,8 und 2 mg/mL für einen genauen Vergleich zwischen Proben in GTPase Aktivierung Assays auszugleichen. Tabelle 2 enthält Details über den Puffer für diesen Test verwendet werden. - Übertragen Sie 60 µL der normalisierten eiskalten Proben für Mikroröhrchen und fügen Sie 60 µL Puffer zu binden; Mischen der Proben und halten sie auf dem Eis.
- Vollständig zu entfernen die Wasserlösungen aus der Mikrotestplatte durch kräftiges streichen, gefolgt von fünf bis sieben harte Hähne auf einem Labor-Matte.
- Die Brunnen in Duplikate 50 µL der normalisierten Proben, ein leeres Steuerelement und eine Positivkontrolle hinzufügen.
- Legen Sie die Platte auf einem Orbitalschüttler für 30 min bei 4 ° C bei 300 u/min.
Hinweis: Der schüttelnde Schritt ist sehr wichtig, und es wird empfohlen, den orbitalen Platte Shaker bei 300 u/min zu verwenden. - Deaktivieren Sie die Proben von der Platte durch streichen und waschen Sie sie 2 X mit 200 µL Waschpuffer bei RT kräftig entfernen waschen Puffer aus den Brunnen nach jedem Waschen durch streichen, gefolgt von klopfen, und halten Sie die Platte auf der Bank bei RT
- Fügen Sie 200 µL RT Antigen-präsentierenden Puffer in jede Vertiefung und 2 min bei RT inkubieren.
- Streichen Sie die Lösung aus dem Brunnen und waschen Sie die Brunnen 3 X mit 200 µL Waschpuffer bei RT
- Jede Vertiefung 50 µL der frisch zubereiteten 1/250 Anti-RhoA Primärantikörper hinzufügen.
- Legen Sie die Platte auf einem Orbitalschüttler für 45 min bei 300 u/min, eingestellt auf 25 ° C. Streichen Sie die Lösung aus dem Brunnen.
- Wiederholen Sie die Waschschritte 2 x (Schritt 2.24).
- Jede Vertiefung 50 µL der frisch zubereiteten 1/250 Anti-RhoA Sekundärantikörper hinzufügen.
- Legen Sie die Platte auf einem Orbitalschüttler für 45 min bei 300 u/min, eingestellt auf 25 ° C.
- Bereiten Sie das HRP-Erkennung-Reagenz durch Mischen gleiche Volumina von Reagenz A und Reagenz B.
- Die Lösung aus jedem Brunnen wechseln und Waschen der Vertiefungen 3 X mit 200 µL Waschpuffer bei RT
- Jede Vertiefung 50 µL frisch zubereitete HRP-Erkennung-Reagenz hinzufügen.
- Lesen Sie die leuchtende Signal innerhalb 3-5 min, das maximale Signal erhalten und analysieren Sie die Ergebnisse mit einer entsprechenden Software-Paket.
Hinweis: Lesungen müssen innerhalb von 3-5 min getroffen werden, um die maximale Signal zu erhalten. Führen Sie eine "Testplatte" bestätigen die richtige Lyse Puffervolumen ist für die Zelle Lysates verwendet wird, so dass die Proteinkonzentration hoch genug ist, um RhoA GTPase-Aktivität zu erkennen. (Eine Testplatte ist eine Platte von Zellen verwendet, um festzustellen, ob die Proteinkonzentration im zulässigen Bereich fällt und auch um festzustellen, ob die Lautstärke des Puffers Lyse verwendet wird.) Die Positivkontrolle sollte 4 bis 10 fache höher als die leeren Brunnen lesen, wenn es im linearen Bereich. Wenn dies nicht der Fall ist, dann stellen Sie die Luminometer durch Rücksprache mit dem Hersteller. Die Einstellungen für die Luminometer sind in Tabelle 3angegeben. - Geben Sie raw-Daten in den Spalten wo die Überschriften lesen, Probe, bedeuten, Standardabweichung, rep1, rep2, rep3und rep4, die ist, die Anzahl der Wiederholungen getan wird auf jede Probe zu zeigen.
- Unter bedeuten, geben Sie die Formel =average(Xn:Yn) wobei X = Spalte Kennung für rep1, Y = Spalte Kennung für rep4und n = Zeile Bezeichner der Zeile gearbeitet wird.
- Unter Standardabweichung, geben Sie die Formel = STABW (Xn:Yn) wobei X = Spalte Kennung für rep1, Y = Spalte Kennung für rep4und n = Zeile Bezeichner der Zeile gearbeitet wird.
- Geben Sie die Replicate Daten in rep1, rep2, etc.
- Verwenden Sie nach Eingabe der Daten die Click-and-Drag Methode der Probe, die Bedeutungund die Standardabweichungzu wählen.
- Wählen Sie im Daten-Analyse-Software, die Funktion für Diagramm machen, die aussieht wie ein Quadrat mit einem Mini-Balkendiagramm im Inneren.
Hinweis: Dadurch wird das Diagramm Entscheidungsprozess wo Design Diagramme basierend auf den Daten, die eingegeben werden kann. - Wählen Sie Säulendiagramm und für Eingabewerte, bezeichnen Sie die Zahlen bedeuten .
Hinweis: Das Diagramm für die Zahlen bedeuten wird zuerst, und dann wird die Spalte " Standardabweichung " für die y-Achse Fehlerindikatoren bezeichnet. Um dies zu tun, doppelklicken Sie auf die Grafik Balken, wählen Sie die Registerkarte " Y-Achse Fehler ", klicken Sie auf die Option " Benutzerdefiniert " und wählen Sie den Bereich im Arbeitsblatt, die Position der Standardabweichung Daten einzugeben. Nach der Erstellung der gewünschten Charts sehen der Unterschied zwischen den Gruppen, die verglichen werden müssen.
Ergebnisse
Membran Fraktionierung:
Ultrazentrifugation wurde für die Fraktionierung von Membran und Zytosol Komponenten verwendet. Wie in Abbildung 1dargestellt, der Überstand enthält die cytosolische Fraktion und das Pellet den Membran-Bruch. Die Fülle von RhoA in Bruchteilen der cytosolischen Andmembrane aus U251 Zellen gewonnen wurde nach der Behandlung mit Simvastatin mit Immunoblotting untersucht. Die Reinheit und Ladekontrolle der Membran und Zytosol Fraktion wurden von Pan-Cadherin und GAPDH bestätigt. Wie in Abbildung 2dargestellt, reduziert die Simvastatin-Behandlung die Menge an Membrane-springen RhoA GTPase, während es inhaltlich cytosolischen erhöht. Dies steht im Einklang mit den bekannten Wirkungen von Statinen auf die Translokation von GTPasen basierend auf die Hemmung von RhoA Prenylation. Simvastatin hemmt die Prenylation der RhoA GTPase und Unprenylated RhoA deshalb ankern in Zellmembranen Plasma, die Ergebnisse in seiner höheren cytosolischen Konzentrationen.
RhoA-GTP gebunden:
Wir GTP-gebundenen RhoA Protein mit einem GTPase verbundene Immunosorbentprobe Assay gemessen und zeigte, dass Simvastatin signifikant (P < 0,05) erhöht GTP-gebundenen RhoA in U251 Zellen (Abbildung 3). Daher während Simvastatin RhoA GTPase Protein Prenylation (Abbildung 2) gehemmt wird, erhöht es auch seine GTP laden im Vergleich zu der Kontrollzellen. Dies deutet darauf hin, dass Prenylation und GTP binden beide in der Tätigkeit und Regulierung von RhoA GTPase eine Rolle spielen. Zusätzliche Angaben über dieses Phänomen finden Sie in der ursprünglichen Veröffentlichung unter Verwendung dieses Protokolls-8.
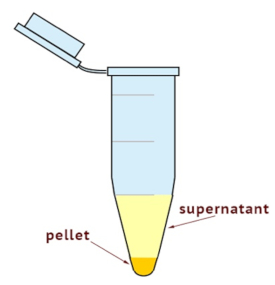
Abbildung 1 : Schematische Darstellung der cytosolischen und Membran-Fraktionen nach Ultrazentrifugation. Das Pellet enthält die Membran-Fraktion und der Überstand enthält die cytosolische Fraktion.

Abbildung 2 : Simvastatin ändert sich die Lokalisierung von RhoA. U251 Zellen mit Simvastatin behandelt wurden (10 µM; 12, 24 und 36 h) und die Fülle von RhoA in der Membran und cytosolischen Fraktionen wurde durch Immunoblotting bestimmt. Die GAPDH und Pan-Cadherin Fülle wurde auch zur Kontrolle für die Beladung in der cytosolischen und Membran-Fraktionen und den Mangel an cytosolischen Kontamination in den Membran-Fraktionen zu bestätigen bewertet. Die Daten sind in der Regel aus drei unabhängigen Experimenten mit verschiedenen Primärkulturen. Diese Zahl wurde von Alizadeh Et Al. modifiziert 8. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3 : Simvastatin RhoA GTPase-Aktivität moduliert. Die GTPase verbundene Immunosorbentprobe-Assay wurde zur GTP-gebundenen Rho Protein in U251 Zellen zu messen. Verschiedene Bedingungen wurden für 36 h, einschließlich Hunger und Simvastatin (10 µM) getestet. Für jedes Experiment wurde ein konstitutiv aktives RhoA Protein im Kit enthalten als Positivkontrolle verwendet. Die Ergebnisse werden als Mittelwert ± SD von zwei Wiederholungen in unabhängigen Experimenten ausgedrückt (* P < 0,001). Diese Zahl wurde von Alizadeh Et Al. modifiziert 8.
| Zelle Kulturgefäß | Fläche (cm2) | Lyse Puffer (µl) | |
| Gerichte | 35 mm | 9 | 100 |
| 60 mm | 21 | 300 | |
| 100 mm | 55 | 700 | |
| 150 mm | 145 | 1500 | |
| Platten | 6-well | 9,4 / gut | 100 |
| 12-well | 3,8 / gut | 70 | |
| 24-well | 1.9 / gut | 40 | |
| Fläschchen | T-25 | 25 | 250 |
| T-75 | 75 | 1000 | |
| T-150 | 150 | 1500 | |
Tabelle 1: Bände der Lyse Puffer für U251 Zellen empfohlen. Die Lautstärke ist einstellbar für verschiedene Zelltypen.
| Lyse Puffer Name | Lyse Puffer Zusammensetzung | Kleines G-Protein-Ziel | Notizen |
| GL35 | Tris (1 X GL36), MgCl2 (8 X GL36), NaCl (2 X GL36), IGEPAL (1 X GL36), SDS (5 X GL36) | Cdc42 | Identische Komponenten, GL36, variiert die Zusammensetzung wie folgt; |
| GL36 | eine proprietäre Formulierung von Tris pH 7.5, MgCl2, NaCl, IGEPAL und SDS | RalA | Standard-Puffer, kompatibel mit GTPase-linked Immunosorbentprobe Assays. |
| GL36 | eine proprietäre Formulierung von Tris pH 7.5, MgCl2, NaCl, IGEPAL und SDS | RAC1 | Standard-Puffer, kompatibel mit GTPase-linked Immunosorbentprobe Assays. |
| GL36 | eine proprietäre Formulierung von Tris pH 7.5, MgCl2, NaCl, IGEPAL und SDS | RAC1, 2, 3 | Standard-Puffer, kompatibel mit GTPase-linked Immunosorbentprobe Assays. |
| GL36 | eine proprietäre Formulierung von Tris pH 7.5, MgCl2, NaCl, IGEPAL und SDS | RAS | Standard-Puffer, kompatibel mit GTPase-linked Immunosorbentprobe Assays. |
| GL36 | eine proprietäre Formulierung von Tris pH 7.5, MgCl2, NaCl, IGEPAL und SDS | RhoA | Standard-Puffer, kompatibel mit GTPase-linked Immunosorbentprobe Assays. |
| GL36 | eine proprietäre Formulierung von Tris pH 7.5, MgCl2 | Arf1 | Standard-Puffer, kompatibel mit GTPase-linked Immunosorbentprobe Assays. |
Tabelle 2: Liste der GTPase verknüpft Immunosorbentprobe assay Lyse Puffer und Lyse Komposition für kleinen GTPasen empfohlen.
| Parameter | Notizen | ||
| ZU GEWINNEN | Gewinn Möglichkeit stellt die Maschine Empfindlichkeit. Die meisten Luminometer verwenden automatische Kalibrierung oder begrenzte Kalibrierfunktion. Benutzer sollte den Gewinn bei niedrigen, mittleren und hohen lesen, um festzustellen, ob die Lesung innerhalb des linearen Bereichs ist die in verschiedenen Instrumenten unterschiedlich ist. | ||
| INTEGRATIONSZEIT | Es wird empfohlen, diese Option auf dem niedrigsten Stand als sehr hoch Zeiten macht aus den linearen Bereich gelesen haben. Dies erfordert möglicherweise unnötigen Arbeit wie mit niedrigeren Verdünnung oder primäre und sekundäre Antikörper. INTEGRATIONSZEIT variiert auch in verschiedenen Instrumenten. | ||
| SCHÜTTELN | Es wird empfohlen, verwenden Sie die 5 s orbital schütteln. Es ist nicht so kritisch wie andere Parameter für die Genauigkeit des Tests. | ||
| TEMPERATUR | Raumtemperatur wird empfohlen | ||
| PLATTENTYP | Verwendung nach der Platte, die du verwendest. In der Regel ist die Platte 96-Well, flach und weiß. | ||
| FILTER | Erregung oder Emission Filter sind nicht erforderlich für Lumineszenz. Erregung kann auf jeden gewünschten Wert eingestellt werden und optimale Reichweite für Emission beträgt 430-445 nm. Lassen Sie die Räume des Filters leer. Wenn dies nicht möglich ist, | ||
Tabelle 3: Eine detaillierte Beschreibung der Einstellungen Luminometer.
Diskussion
Hier beschreiben wir eine genaue Methode zur Messung der kleine GTPase Prenylation und GTP-Bindung als kleine GTPase subzelluläre Lokalisation (Membran gegen Zytosol) und Rho GTP laden gezeigt. Kleinen GTPasen sind in eukaryotischen Zellen und spielen eine entscheidende Rolle in der Zellproliferation, Motilität und Struktur. Prenylation und GTP-Bindung engagieren sich bei der Regulierung der GTPase-Aktivität; Tests zur Bewertung der Prenylation und GTP-Bindung dieser Proteine sind daher wichtige Werkzeuge für Zelle Biologen1,8.
Basierend auf den Ergebnissen einer aktuellen Studie, Rho Protein GTP beladen ist Zelltyp spezifische8, und unterscheidet sich daher unter verschiedenen Zelltypen. Auch sind die subzelluläre Lokalisation und Geranylgeranylation (GGT) von Proteinen, Rho die entscheidenden Schritte bei der Regulierung ihrer Funktion. Dies wird auch weiter durch das Zusammenspiel von Effektorproteine GEF, GAP und GDI für die großen GTPasen geregelt.
Simvastatin ist bekannt, Rac GTP laden in THP-1 Monozyten zu erhöhen, verringern die Prenylation des Rac in Anwesenheit von Amyloid-β-Stimulation und Entzündungsreaktionen aus diesen Zellen17zu reduzieren. Wir wissen auch, dass T-Zell-Funktion ist von Rho GTP laden nicht betroffen, sondern vielmehr der GGT Rho Funktion18,19 bestimmt. Daher empfehlen wir, um Rho GTPase-Aktivität zu erkennen, Prenylation und GTP laden gleichzeitig in Zellen gemessen werden müssen.
Hervorzuheben, hochreine cytosolischen und Membran Brüche zu erreichen sind die wichtigsten Schritte des Protokolls der Beschallung und der Ultrazentrifugation. Für die Rho GTP-Bindung-Assay der wichtigste Schritt ist Snap-Zelle Lysates vor der sequenziellen Verarbeitung einfrieren. Folgende wichtige Schritte wird konsistent und reproduzierbare Ergebnisse bei der Untersuchung von GTPasen in lebenden Systemen produzieren.
Ein wichtiger Schritt zu prüfen, ein bestimmtes intrazelluläres Struktur oder Membran-Protein ist die Trennung der zellulären Kompartimenten voneinander. Fraktionierung nutzt die Eigenschaften jedes zelluläre Fach, wie Größe und Form, Oberflächenladungsdichte und Dichte20. Es basiert hauptsächlich auf differentielle Zentrifugation in Medien mit hoher Viskosität bei 4 ° c Die Membran-Fraktionierung-Methode, die hier verwendet wurde basiert im Wesentlichen auf die Größe der einzelnen Kammern und Schwerkraft Highspeed stellt sich nach Ultrazentrifugation, Membranproteine gehen an der Unterseite des Rohres und der cytosolischen Proteine verbleiben in der Überstand.
Es ist wichtig zu beachten, dass Proben mit hoher Proteinkonzentrationen und gegebenenfalls hohe Lücken können möglicherweise das Ziel GTPase inaktivieren. Dieses Problem kann auftreten, selbst in Lyse Puffer und kann zu falsch-negativen Ergebnissen führen. Einer der wichtigsten Parameter, die den Erfolg bestimmen und Reproduzierbarkeit der Prüfergebnisse GTPase-Aktivität ist die Gesundheit und die Reaktionsfähigkeit der Zellen in der Experiment-8verwendet wird. Es wird dringend empfohlen, dass die Ermittler die optimale/geeignete Wachstumsbedingungen und Verdopplungszeit für die Zellen unter Studie zur Bestimmung der GTPase Aktivierung/Hemmung zu identifizieren. Darüber hinaus die GTPase-Aktivität von allen kleinen GTPasen ist streng geregelt und ist daher anfällig für schnelle Abnahme über Hydrolyse von GTP-Molekül an das Enzym über die Wirkung von Lücken (während und nach der Zelle Lysis Verfahren gebunden ). Diese Aktion führt das schnelle Inaktivierung der GTPase von Interesse. Es wird daher dringend empfohlen, dass diese Zelle Lyse bei 4 ° C, schnell durchgeführt wird, um genaue und reproduzierbare Ergebnisse zu erzielen.
Es gibt mehrere Faktoren je nach experimentellen Bedingungen, die die letzte Zelle lysate zu bestimmen. Erstens, der Gesamtbetrag der RhoA GTPase in der Zelllinie oder bestimmte Gewebe: die Höhe der endogenen RhoA GTPase ist variabel in verschiedenen Arten von Zellen und Geweben; Daher kann dadurch eine stärkere Reaktion auf ein Aktivator oder Deactivator. Zweitens, die Menge der Aktivierung/Deaktivierung unter den experimentellen Bedingungen erreicht: Es ist wichtig zu bedenken, dass etwa 2 % bis 10 % der gesamten zellulären kleine GTPase möglicherweise als Reaktion auf einen bestimmten Reiz8aktiviert ist. Die Menge der Deaktivierung auch allein hängt von der Art von Reizen und es ist variabel in verschiedenen Zellen und Geweben. Daher ist die Zusammensetzung der Lyse Puffer und Handy-Fach für jede Art von kleinen Rho GTPase-Aktivität-Assay, entscheidend. Tabelle 3 zeigt die empfohlene Zusammensetzung des Puffers Lyse für jedes spezifische kleine GTPase Protein.
Die normalisierte Zelle lysate Proteinkonzentration ist eine wesentliche Voraussetzung, weil dadurch die Ermittler, die GTPase-Aktivität der verschiedenen Proben zu vergleichen. Daher ist es obligatorisch, Protein aus der Gewebekultur Medien entfernen, Waschen der Zellen aus allen Proben unter allen Bedingungen mit kaltem PBS. Es ist auch wichtig, dass alle Reagenzien und Puffer bei kalten Temperaturen (4 ° C) in allen Schritten des Experiments verwendet werden. Diese kalten Temperaturen wird die Hydrolyse von GTPasen, einschließlich Rho GTPase, während der Probenvorbereitung minimieren. Es ist wichtig, dass diese Verarbeitung der Zelle Lysates schnell (in 10-15 min insgesamt) durchgeführt wird, um den Verlust von RhoA GTPase-Aktivität zu vermeiden. Darüber hinaus ist der wichtigste Schritt der Zelle lysate Vorbereitung zu Snap-Freeze Aliquote von der lysate in flüssigem Stickstoff, die RhoA kleine GTPase enzymatische Aktivität beizubehalten. Dies ist besonders wichtig, wenn es verschiedene Zeitpunkte oder mehrere Proben im Experiment gibt. Nach der Vorbereitung des Snap eingefroren Lysates können die Proben bei-80 ° C gehalten werden, ohne ihre Rho GTPase-Aktivität.
Das angegebene Protokoll für die Analyse der Membran Verankerung der RhoA GTPase stellt nur eine indirekte Werkzeug, um die Prenylation der kleinen GTPasen zu messen und kann nicht direkt zu erkennen oder die Bindung der Nahrung Rückstände an das Zielprotein zu quantifizieren. Dies ist eine der wenigen Einschränkungen des Assays. Daher gibt es eine Schätzung der Prenylation von Proteinen. Einige Ansätze haben definiert, die in der Lage sind, direkt FT (Farnesylation) und/oder GGT an Farnesyl-Transferase und/oder Geranylgeranyl Transferase bzw., in kultivierten Zellen und bei Tieren und Menschen abgeleitet Tumoren zu messen. Die Assays verwenden elektrophoretische Mobilität Verschiebung, [3H] Farnesyl diphosphat und Geranylgeranyl diphosphat [3H] und [3H] Mevalonic Säure Beschriftung, gefolgt von Immunopräzipitation und SDS-PAGE21.
Wir verwendet der RhoA GTPase verbundene Immunosorbentprobe Assay, um Membran Verankerung und Aktivität der RhoA GTPase zu erkennen. Es besteht aus ein Rho-GTP-bindende Protein, das in den Vertiefungen einer 96-Well-Platte verbunden ist. Also, bindet die GTP-gebundenen aktiven Rho in Zelle oder eines Gewebes Lysates an die Brunnen, während BIP-gebundenen inaktiven Rho während der Waschschritte weggewaschen wird. Dann werden die gebundenen, aktive RhoA in den Vertiefungen mit einem RhoA-spezifischen Antikörper und Chemilumineszenz erkannt. Es ist möglich, den Grad der RhoA Aktivierung durch den Vergleich der Messwerte von aktivierten, nonactivated Zelle Lysates bestimmen. Serum-Hunger (die Verwendung von serumfreien Medium auf kultivierten Zellen) wird in der Regel verwendet, um RhoA in der Gewebekultur zu inaktivieren. Es sollte auch erwähnt werden, dass der GTPase verbundene Immunosorbentprobe-Test verschiedener Aktivierung 10-50 µg Protein für den Nachweis von RhoA GTPase-Aktivität erfordert.
Es wird dringend empfohlen, dass unbehandelte Proben niedrige basale zelluläre GTPase-Aktivität (Steuerelementzustand) haben. Als Beispiel richtige Zelle verhungern Bedingungen kann die Downregulate GTPase Tätigkeit und bieten ideale Voraussetzungen, ihre Aktivierung unter experimentellen Bedingungen zu zeigen. Aktivierung und Hemmung Assays sind außerdem in einer Zeit und Dosis-Wirkungs-Weise, um die besten GTPase Aktivierung/Hemmung Antworten ausgeführt. Noch wichtiger ist, während der zellulären Vorbereitung, es ist sehr wichtig, Zellen zu verwenden, die nicht Overconfluent sind (> 70 %), um alle Nonresponsiveness der Zellen auf Aktivierung/Hemmung Reize zu vermeiden.
Luminometer unterscheiden sich erheblich in Bezug auf Sensitivität und absolute Messungen. Deshalb, um festzustellen, dass es im linearen Bereich ist, empfehlen wir einen GTPase verbundene Immunosorbentprobe Assay mit einem Leerzeichen und einer positiven Kontrolle ausgeführt. Wenn der Test ist des linearen Bereichs (die Positivkontrolle sollte 4 x - 10 X größer als der Puffer nur lesen) oder das leere lesen ist höher als 9 Millionen, dann es wird empfohlen, weitere Antikörper-Verdünnungen verwenden. Darüber hinaus empfehlen wir kalibrieren Luminometer innerhalb des linearen Bereichs des Assays vor Beginn des Tests zu lesen.
Es gibt auch Vorteile für die GTPase verbundene Immunosorbentprobe Assay, die erwähnenswert sind. GTPase verbundene Immunosorbentprobe Assays verbessern das aktuelle experimentelle Design und Technologie, um Experimente zu ermöglichen, die nicht mit alten Pulldown-Menüs Techniken22möglich waren ermöglichen. Die GTPase verbundene Immunosorbentprobe Assays bieten auch Erkennungsgenauigkeit und Sensibilität, die Analysen der GTPase-Aktivität in Vorbereitungen für Pulldown-Assays23bisher tabu ermöglicht. Ein paar neuere Studien verglichen GTPase verbundene Immunosorbentprobe Aktivierung Assays mit Pulldown-Menüs und geschlossen, dass GTPase verbundene Immunosorbentprobe Assay hat einige deutliche Vorteile, nämlich, die GTPase verbundene Immunosorbentprobe Assays überlegen aufgrund ihrer Möglichkeit, kleine Mengen an Protein22,24, ihre größere Empfindlichkeit24und ihre quantitative Messungen23verwenden. GTPase verbundene Immunosorbentprobe Assay Kit ist erhältlich in Luminometric oder farbmetrische Erkennung Versionen, wo sind die Luminometric-Assays empfindlicher. Diese GTPase verbundene Immunosorbentprobe Assay basiert auf eine recht einfache und schnelle Protokoll, erfordert nur geringe Mengen an Probe und liefert quantitative und genaue Ergebnisse. Daher wäre es eine gute Idee zu diesem Test zur Erkennung von anderen Arten von GTPase-basierten Proteinen in verschiedenen Zelllinien und Gewebekultur Zellen mit einer viel höheren Spezifität und Genauigkeit weiter zu entwickeln.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Saeid Ghavami war Gesundheit Wissenschaft Mitte in Betrieb, CHRIM Grant und Manitoba neue Ermittler Betrieb Forschungsstipendium in Betrieb unterstützt. Javad Alizadeh unterstützte Forschung Manitoba Zugehörigkeit. Shahla Shojaei wurde durch eine Finanzhilfe von Gesundheit Wissenschaft Stiftung und die MITACS beschleunigen postdoctoral Fellowship unterstützt. Adel Rezaei Moghadam wurde unterstützt durch eine NSERC Betrieb Zuschuss von Joseph W. Gordon stattfand. Amir A. Zeki wurde von den NIH/NHLBI K08-Award (1K08HL114882-01A1) unterstützt. Marek J. Los bitte würdigt die Unterstützung von NCN gewähren #2016/21/B/NZ1/02812, von LE STUDIUM Institute for Advanced Studies (Region Centre-Val de Loire, Frankreich) durch seine intelligente Loire Tal allgemeine Programm unterstützt und mitfinanziert von Marie Sklodowska-Curie-Maßnahmen, gewähren #665790. Simone da Silva Rosa wurde von UMGF Zugehörigkeit unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| DMEM high Glucose | VWR (Canada) | VWRL0101-0500 | |
| Fetal Bovine Serum | VWR (Canada) | CA45001-106 | |
| Penicillin/Streptomycin | VWR (Canada) | 97062-806 | |
| EDTA (Ethylenediamine tetraacetic acid) | VWR (Canada) | CA71007-118 | |
| EGTA (Ethylene glycol bis(2-aminoethyl ether)-N,N,N',N'-tetraacetic acid) | VWR (Canada) | CAAAJ60767-AE | |
| DTT (DL-Dithiothreitol) | VWR (Canada) | CA97061-340 | |
| Ammonium Persulfate | VWR (Canada) | CABDH9214-500G | |
| Tris-Hydroxymethylaminomethane | VWR (Canada) | CA71009-186 | |
| 30% Acrylamide/Bis Solution | Biorad (Canada) | 1610158 | |
| TEMED | Biorad (Canada) | 1610801 | |
| Protease Inhibitor cocktail | Sigma/Aldrich (Canada) | P8340-5ML | 1:75 dilution |
| Rho-GTPase Antibody Sampler Kit | Cell Signaling (Canada) | 9968 | 1:1000 dilution |
| Pan-Cadherin antibody | Cell Signaling (Canada) | 4068 | 1:1000 dilution |
| GAPDH antibody | Santa Cruz Biotechnology (USA) | sc-69778 | 1:3000 dilution |
| RhoA G-LISA Activation Assay (Luminescence format) | Cytoskeleton Inc. (USA) | BK121 | Cytoskeleton I. G-LISA Activation Assays Technical Guide. 2016. |
| RhoA Antibody | Cell Signaling | 2117 | |
| ECL | Amersham-Pharmacia Biotech | RPN2209 | |
| Anti-Rabbit IgG (whole molecule) Peroxidase antibody | Sigma | A6154-1ML | |
| SpectraMax iD5 Multi-Mode Microplate Reader | Molecular Devices | 1612071A | Spectrophotometer |
| Nonidet P-40 | Sigma | 11332473001 | non-denaturing detergent, octylphenoxypolyethoxyethanol |
| DMSO | Sigma | D8418-50ML | |
| PBS | Sigma | P5493-1L | |
| Phophatase Inhibitor cocktail | Sigma | P5726-5ML | 1:75 Dilution |
Referenzen
- Yeganeh, B., et al. Targeting the mevalonate cascade as a new therapeutic approach in heart disease, cancer and pulmonary disease. Pharmacology & Therapeutics. 143 (1), 87-110 (2014).
- Valencia, A., Chardin, P., Wittinghofer, A., Sander, C. The ras protein family: evolutionary tree and role of conserved amino acids. Biochemistry. 30 (19), 4637-4648 (1991).
- Hall, A. Rho family GTPases. Biochemical Society Transactions. 40 (6), 1378-1382 (2012).
- Rojas, A. M., Fuentes, G., Rausell, A., Valencia, A. The Ras protein superfamily: evolutionary tree and role of conserved amino acids. The Journal of Cell Biology. 196 (2), 189-201 (2012).
- Cherfils, J., Zeghouf, M. Regulation of small GTPases by GEFs, GAPs, and GDIs. Physiological Reviews. 93 (1), 269-309 (2013).
- Shojaei, S., et al. Perillyl Alcohol (Monoterpene Alcohol), Limonene. Enzymes. 36, 7-32 (2014).
- Ghavami, S., et al. Airway mesenchymal cell death by mevalonate cascade inhibition: integration of autophagy, unfolded protein response and apoptosis focusing on Bcl2 family proteins. Biochimica et Biophysica Acta. 1843 (7), 1259-1271 (2014).
- Alizadeh, J., et al. Mevalonate Cascade Inhibition by Simvastatin Induces the Intrinsic Apoptosis Pathway via Depletion of Isoprenoids in Tumor Cells. Scientific Reports. 7, 44841 (2017).
- Ghavami, S., et al. Mevalonate cascade regulation of airway mesenchymal cell autophagy and apoptosis: a dual role for p53. PLoS One. 6 (1), e16523 (2011).
- Tang, Y., Olufemi, L., Wang, M. T., Nie, D. Role of Rho GTPases in breast cancer. Frontiers in Bioscience: A Journal and Virtual Library. 13, 759-776 (2008).
- DerMardirossian, C., Bokoch, G. M. GDIs: central regulatory molecules in Rho GTPase activation. Trends in Cell Biology. 15 (7), 356-363 (2005).
- Garcia-Mata, R., Boulter, E., Burridge, K. The 'invisible hand': regulation of RHO GTPases by RHOGDIs. Nature Reviews Molecular Cell Biology. 12 (8), 493-504 (2011).
- Etienne-Manneville, S., Hall, A. Rho GTPases in cell biology. Nature. 420 (6916), 629-635 (2002).
- Ghavami, S., et al. Geranylgeranyl transferase 1 modulates autophagy and apoptosis in human airway smooth muscle. American Journal of Physiology - Lung Cellular and Molecular Physiology. 302 (4), L420-L428 (2012).
- Clark, E. A., Golub, T. R., Lander, E. S., Hynes, R. O. Genomic analysis of metastasis reveals an essential role for RhoC. Nature. 406 (6795), 532-535 (2000).
- Ghavami, S., et al. Statin-triggered cell death in primary human lung mesenchymal cells involves p53-PUMA and release of Smac and Omi but not cytochrome c. Biochimica et Biophysica Acta. 1803 (4), 452-467 (2010).
- Cordle, A., Koenigsknecht-Talboo, J., Wilkinson, B., Limpert, A., Landreth, G. Mechanisms of statin-mediated inhibition of small G-protein function. Journal of Biological Chemistry. 280 (40), 34202-34209 (2005).
- Waiczies, S., Bendix, I., Zipp, F. Geranylgeranylation but not GTP-loading of Rho GTPases determines T cell function. Science Signaling. 1 (12), pt3 (2008).
- Waiczies, S., et al. Geranylgeranylation but not GTP loading determines rho migratory function in T cells. Journal of Immunology. 179 (9), 6024-6032 (2007).
- Satori, C. P., Kostal, V., Arriaga, E. A. Review on Recent Advances in the Analysis of Isolated Organelles. Analytica Chimica Acta. 753, 8-18 (2012).
- Berndt, N., Sebti, S. M. Measurement of protein farnesylation and geranylgeranylation in vitro, in cultured cells and in biopsies, and the effects of prenyl transferase inhibitors. Nature Protocols. 6 (11), 1775-1791 (2011).
- Keely, P. J., Conklin, M. W., Gehler, S., Ponik, S. M., Provenzano, P. P. Investigating integrin regulation and signaling events in three-dimensional systems. Methods in Enzymology. 426, 27-45 (2007).
- Oliver, A. W., et al. The HPV16 E6 binding protein Tip-1 interacts with ARHGEF16, which activates Cdc42. British Journal of Cancer. 104 (2), 324-331 (2011).
- Moniz, S., Matos, P., Jordan, P. WNK2 modulates MEK1 activity through the Rho GTPase pathway. Cellular Signalling. 20 (10), 1762-1768 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten