Method Article
小さい gtp アーゼ プレニル化および分子量 GTP 結合を使用して膜分画と gtp アーゼ抗体法の検出
要約
ここでプレニル化とグアノシン 5'-三リン酸 (GTP) を調査するためのプロトコルを説明-GTPase の読み込み。このプロトコルは、2 つの詳細なメソッドで構成されています、すなわち膜分画と gtp アーゼ抗体アッセイします。プレニル化と GTP を測定するプロトコルを使用することができます別の他の低分子量 g タンパク質の読み込み。
要約
Rho である家族は、Ras スーパーファミリーに属するし、人間でおよそ 20 人のメンバーが含まれています。低分子量 g 蛋白質 Rho、細胞骨格、細胞運動、細胞極性、軸索ガイダンス、小胞輸送、細胞周期制御を含む、多様な細胞機能の調節に重要です。Rho GTPase シグナリングの変化は、がん、中枢神経系疾患、免疫システム依存性疾患など、多くの病的状態における重要な規制役割を果たします。における Rho gtp アーゼ (すなわち、メバロン酸経路の中間体によるプレニル化) と GTP 結合の翻訳後修飾は、このタンパク質の活性化に影響を与える重要な要因です。本稿 Rho GTPase の広範な範囲のプレニル化と GTP 結合活性を検出する 2 つの重要なメソッドが提供されます。使用されている技術的な手順の詳細を説明したこの原稿で一歩一歩。
概要
低分子量 g 蛋白質 Rho Gtpase の Ras スーパーファミリーになりユニークな亜科、進化、よく保存されて小さい蛋白質 (21-25 kDa) のグループであります。このスーパーファミリー内各亜科、GTPase 活性とヌクレオチド交換1関与している共有 G ドメイン コアがあります。Rho ファミリーと他の Ras サブファミリーとの違いは、5番目の β ストランドと小さい gtp アーゼ ドメイン2の 4th α ヘリックス内「Rho 挿入ドメイン」の存在です。
最近の分類に基づいて、Rho Gtpase シグナリング分子 gtp アーゼ Ras スーパーファミリー3に収まるの家族と見なされます。哺乳類における Rho gtp アーゼは、一般的性質4 ρ、Rac1 と Cdc42 がこのグループのほとんどを学んだメンバーの間では、特定の機能に基づく 22 のメンバーを持ちます。Rho Gtpase は厳しく規制されたメカニズム蛋白質翻訳後修飾を介して分子スイッチ5に依存する細胞内シグナル伝達経路を介してにリンクされます。
GTP の読み込みと加水分解の Rho Gtpase 活性化/不活性化サイクルに不可欠な機構が、規制を介してGTPase 活性化蛋白質 (ギャップ)。ギャップは GTP 加水分解を担当し、GTP の読み込み反応に責任があるグアニン ヌクレオチド交換要因 (一種) と連携して動作します。Rho GDP 解離阻害剤 (GDIs) はさらに GDP 結合 Rho gtp アーゼに結合を介して小さな Rho Gtpase の調節を提供します。これは GDP の解離を抑制する、アクティブな細胞内膜サイトから Rho Gtpase の隔離が容易になります。さらにでは、ヌクレオチド加水分解と交換とコントロール GDP/GTP1,6,7、8をサイクリングの両方を調節する GDIs のプレニル化を含む GTPase 蛋白質の規則はまた。
これら蛋白質1,9の脂溶性の性質を変更することによって GTPase の細胞質と細胞膜との間の動きは、GTP の読み込みと Rho GTPase プレニル化を関与しています。上記の規制当局は、細胞膜のリン脂質と GDP/GTP 交流活動10の他の変調の蛋白質と対話します。また、GDIs、解離の阻害剤は GTP 加水分解して GDP/GTP exchange をブロックします。GDIs は、GDP から非アクティブな Rho 蛋白質の解離と、したがって、下流のエフェクターとの相互作用を阻害します。GDIs は、低分子量 g 蛋白質の細胞質と細胞膜の間のサイクリングも規制します。Rho Gtpase の活動は細胞膜; する動きに大幅に依存します。したがって、GDIs はその疎水性領域/ドメイン11,12を非表示を通って細胞質に低分子量 g 蛋白質を隔離することができます重要な調節因子として見なされます。
その活性化サイクルのすべての段階で最適なシグナル伝達と機能を持っている GTPase の GTP-読み込み/GTP 加水分解の動的なサイクルは重要です。その後細胞極性、増殖、形態形成、細胞質分裂、移行、接着、および生存13,14など Rho GTPase によって調整される細胞機能の変化のこのプロセスの変更についてのあらゆる種類があります。
現在のプロトコルは、プレニル化・ GDP/GTP ロード調査小さい ρ GTPase 活性化を介して監視する詳細な方法で読者を提供します。このメソッドは、プレニル化と低分子量 g タンパク質の広い範囲の GTP 結合検出にも使用できます。Gtp アーゼ アッセーを使用して、他の種類、Rac1、Rac2、Rac3、H、K、または N Ras、Arf、および Rho15など低分子量 g 蛋白質の活性化のレベルを測定できます。薬理学的エージェント シンバスタチンは、最近小さな GTPase プレニル化と活動8,9,14,16の調節に関与すると報告されたなどとして使用します。
プロトコル
1. 膜/細胞質分画を用いた ρ 定位法の定量
-
細胞培養とシンバスタチン治療
- U251 100 mm のセル皿し、ダルベッコの文化のそれらの種 50,000 イーグル培地 (DMEM) (高グルコース, 10% 牛胎児血清 [FB]) に変更。
- メディアを取り外して、シンバスタチン含有培地を追加すること (ジメチルスルホキシド [DMSO] に溶解シンバスタチンの 10 μ M)、細胞を治療に 30% 合流と 37 ° C8時 36 時間孵化させなさい。車両制御として単独で DMSO を使用します。
注: 1000 万の細胞は、細胞の細胞質と膜分画に必要です。
-
セルのコレクション
- 37 ° C の定温器からセルを削除します。密度を確認する顕微鏡下で細胞を見てください。
注: セルは 70%-80% の合流をする必要があります。 - 培地を吸引、洗浄セル 1 冷たいリン酸緩衝生理食塩水 (PBS) と x。5 mL のエチレンジアミン酸 (EDTA) バッファーを追加 (KCl: 400 mg/L の NaCl: 6800 mg/L、NaHCO3: 2200 mg/L、NaH2PO4。H2o: 140 mg/L、D-グルコース: 1,000 mg、EDTA 二ナトリウム: 373 mg/L) プレートとセルが 5 分の 37 ° C の定温器に戻る場所あたり。
- 孵化の 5 分後、EDTA と媒体の同じ量を含む 15 mL チューブに細胞を EDTA を収集します。
注: チューブで媒体を持っている EDTA を中和して細胞膜のそれ以上の消化を防ぐことができます。 - アイス ボックスにチューブを設置し、遠心分離機に進みます。
- 1,500 × gで 4 ° C に遠心分離機を設定し、5 分のセルをスピンします。
- ペレットを乱すことがなく上澄みを除去し、1 mL の冷 PBS を追加します。セルをよく混ぜます。
- 4 ° c、1,500 × gで遠心する新しい 1.5 mL チューブに細胞混合物 (ソリューション) を転送し、5 分のセルをスピンします。
- (次のステップのバッファー量を推定) のペレット サイズを確認してください。氷の上にサンプルを配置します。ペレットを乱すことがなく上清を完全に破棄します。
- 上下、ピペッティングでよくサンプルを混ぜる (10 mM トリス-HCl [pH 7.5]、0.1 ミリメートルの EDTA、0.1 mM グリコールエーテルジアミン四酢酸、1 mM ジチオトレイトールおよびプロテアーゼ抑制剤のカクテル)、冷たいバッファーを加えて超音波処理に進みます。
- 37 ° C の定温器からセルを削除します。密度を確認する顕微鏡下で細胞を見てください。
-
超音波処理
- 5 サイクル、5、超音波発生装置を設定、それぞれ s とリピートの 3 倍。
- 氷の上、超音波処理を実行します。超遠心機に進みます。
注: 氷と冷たい状態のタンパク質を保持、結果の信頼性を高めます。
-
超遠心法
- 細胞質細胞ホモジネートに分割する、超遠心機を使用し、膜の一部分。遠心分離機を 100,000 × g 4 ° C で 35 分に設定します。図 1のように、ペレット サイズを確認します。
注: 膜画分はチューブの一番下に、残りは細胞内の他のコンポーネント。 - ペレットを邪魔しないように注意しながら完全に上清を収集します。上澄みは、ゾル性細胞質の一部です。新しくラベル付けされたチューブに上清を配置します。
- 解離のバッファー (バッファー II) の 300 μ L を追加 (50 mM トリス-HCl [pH 7.5]、0.15 M 塩化ナトリウム、1 mM ジチオトレイトール、1 %sds、1 mM EDTA、グリコールエーテルジアミン四酢酸、1 mM とプロテアーゼ阻害剤のカクテル) (膜画分を含む) ペレットにします。上下にピペッティングでよく混ぜます。
- タンパク質の定量および西部のしみ (イムノブロット) サンプル準備に進みます。
- 細胞質細胞ホモジネートに分割する、超遠心機を使用し、膜の一部分。遠心分離機を 100,000 × g 4 ° C で 35 分に設定します。図 1のように、ペレット サイズを確認します。
-
免疫ブロット
- 細胞蛋白質の換散バッファー (20 mM トリス-HCl [pH 7.5] 0.5 mM PMSF、0.5% 非イオン性洗剤 40、100 μ M β グリセロール 3-リン酸と 0.5% プロテアーゼ抑制剤のカクテル) で区切られた分数からの抽出物を準備します。
- Lowry 方法8を用いたタンパク質濃度を測定し、(20 mM トリス-HCl [pH 7.5]、0.5 mM PMSF、0.5 %nondenaturing 洗剤、octylphenoxypolyethoxyethanol、100 μ M β グリセロール 3-リン酸、および 0.5% の換散バッファーのボリュームを計算プロテアーゼ阻害剤カクテル) サンプルの蛋白質の濃度を正常化します。
- 90 ° C、5 分でサンプルを加熱し、蛋白質を分けるのに 15 %sds ページのゲルのサンプルの 15-20 μ L をロードします。
注: 読み込む各サンプルの蛋白質の 1 μ g です。それに応じて実行する必要がありますボリュームを計算します。 - 室温 (RT) 100 V で、2 h の条件 (500 nM グリシン、50 ミリメートル トリス-HCl と 20% メタノール) を還元下でナイロン膜に分けられた蛋白質を転送します。
注: 正常なタンパク質の転送を確認するには、Ponceau 染色を使用または膜上のタンパク質マーカーを可視化します。 - 5% 無脂肪ドライミルクと 1 x 含有トリス緩衝生理食塩水 (TBS/0.01% 非イオン性洗剤の洗剤を含む膜をブロックします。TBST) 1 h の RT、または一晩の 4 ° C で非特異的な抗体の結合をブロックします。
- イムノブロット解析の一次抗体を追加し、4 ° C で一晩インキュベート
注: この実験でパン カドヘリン、GAPDH、ρ cdc42 Rac1/2/3 使用された 1% の牛乳 1 の縮尺希釈で x TBST。パン型カドヘリンおよび GAPDH それぞれ膜と細胞質画分の純度を確認する使用されました。 - 3 膜を洗浄 1 洗浄バッファー x 20 分の x TBST。
- 抗家兎西洋ワサビペルオキシダーゼ (HRP) の膜を孵化させなさい-(RT で 1 h) のそれぞれの一次抗体の共役二次抗体。
- 黒子を洗う 20 分の 3 倍、化学発光 (ECL) の検出とそれらを開発。
2. 小 G タンパク質活性アッセイを用いた ρ GTP 負荷の測定
- カウント 10,000 細胞/mL と文化 100 mm の U251 セルの皿します。
- 1.1.2 の手順で説明するよう、30% 合流、シンバスタチンとセルを扱います。
- インキュベーター外培養皿をもたらします。密度の確認を顕微鏡下で細胞を見てください。セルが 70-80% の合流であるを確認します。氷のペトリ皿を場所、メディアを吸引、洗浄セル 3 x 氷冷 PBS (pH 7.2)。
- PBS を吸い出しなさい。PBS のすべての残党を削除する追加分の氷の上にペトリ皿を傾けます。
注: 残留の PBS は、この試金悪影響を及ぼします。 - ホスファターゼとプロテアーゼ阻害剤を含む冷たい換散バッファーの 700 μ L のボリュームで細胞を溶解させます。
注: 700 μ L、通常十分な 100 mm シャーレ。各培養器の適切なボリュームを見つけるための表 1を参照してください。 - 細胞スクレーパー細胞ライセートの収穫します。この技術のため培養プレートを傾斜します。
- ライセート転送ラベル冷たい cryotube 氷の上保管してください。
- 渦を使用して徹底的にミックスします。サンプルの蛋白質の集中を測定するための蛋白質の試金の溶解液の 10 μ L を保ちます。
- スナップ-凍結残った細胞ライセートの液体窒素。
注: は、細胞ライセート スナップ凍結 ρ gtp アーゼ活性の損失につながることができる繰り返し凍結/解凍サイクルを避けるために、それらの前に、の複数の因数を準備します。 - -80 ° C のフリーザーにスナップ冷凍 cryotubes を転送および gtp アーゼ アッセーのサンプルを保存します。
注: は、14 日以上のサンプルを保管しないでください。すぐに働き、氷上で 10 分以上のサンプルが離れない。すべてペトリ皿を同時に扱うことはありません。 - Lowry 方法8を用いたタンパク質濃度を測定し、サンプルの蛋白質の濃度を正常化する換散バッファーのボリュームを計算します。
注記: 最高濃度は 1 mg/mL;ただし、0.3 - 2 mg/mL は検出可能なことができます。 - マイクロ チューブに換散バッファーの 60 μ L と結合バッファーの 60 μ L を追加することで空のコントロールを準備します。
注: 空白のコントロール抗原を除くすべての試薬には、バック グラウンドの引き算のため使用されます。 - ロー制御タンパク質の 12 μ L、換散バッファーの 48 μ L、結合バッファーの 60 μ L を追加することによって肯定的な制御を準備します。
注: すべての試薬に加えて、Rho-A-GTP の確認された抗原肯定的なコントロールがあります。 - そのバッグの Rho の親和性プレートを取るし、氷の上に置きます。
- 冷たい蒸留水を 100 μ l 添加と井戸の粉溶解します。氷の上のプレートを保ちます。
- 25 ° C に設定水浴のスナップ固定セル lysates を解凍します。
- タンパク質濃度を正常化するには、各サンプルに (ステップ 2.11) から冷たい換散バッファーの計算されたボリュームを追加します。
注: は、換散バッファーの組成の変更を回避するために (真空管式アスピレータを使用) セルを洗浄した後、PBS を削除します。0.8 と gtp アーゼ活性化アッセイのサンプル間の比較を正確に 2 mg/mL の濃度にサンプルの蛋白質を均等化します。表 2は、この試金のために使用するバッファーの詳細についてを提供します。 - マイクロ チューブに正規化された冷たいサンプルの 60 μ L を転送し、バッファーをバインドの 60 μ L を追加サンプルを徹底的にミックス、氷の上にそれらを保ちます。
- 完全に削除/水溶液マイクロ プレート、積極的なフリックすることで研究室のマットの上に 5 ~ 7 ハード タップが続きます。
- 重複で井戸に正規化されたサンプル、空白のコントロールおよび肯定的な制御の 50 μ L を追加します。
- 300 rpm で 4 ° C で 30 分間軌道シェーカーにプレートを配置します。
注: 振動の手順は非常に重要で、300 rpm で軌道プレート シェーカーを使用する勧めします。 - フリックでプレートからサンプルをオフにし、それらを洗浄した積極的で洗浄液 200 μ L を 2 倍洗浄バッファーから削除井戸各洗浄後フリック、タップ、続いてし、プレートをベンチに室温維持
- 各ウェルに RT 抗原提示バッファーの 200 μ L を追加し、RT で 2 分間インキュベートします。
- 井戸からソリューションをフリックし、井戸 3 室温洗浄液 200 μ L と x
- 常に新鮮な 1/250 反 ρ 一次抗体の 50 μ L を各ウェルに追加します。
- 25 ° C に設定 300 rpm の 45 分の軌道シェーカーでプレートを配置します。井戸からソリューションをフリックします。
- 洗濯の手順 2 を繰り返します (手順 2.24) x。
- 常に新鮮な 1/250 反 ρ 二次抗体の 50 μ L を各ウェルに追加します。
- 25 ° C に設定 300 rpm の 45 分の軌道シェーカーの上にプレートを配置します。
- 試薬 A と試薬 B の等しい容積を混合することによって HRP 検出試薬を準備します。
- 各ウェルからソリューションをフリックし、井戸 3 室温洗浄液 200 μ L と x
- 作りたての HRP 検出試薬 50 μ L を各ウェルに追加します。
- 最大信号を取得し、適切なソフトウェア パッケージを使用して結果を分析する 3-5 分以内で発光信号を読みます。
注: 測定値は最大の信号を取得する 3-5 分以内で取られなければなりません。""テスト プレートを実行確認適切な換散バッファー ボリュームが使用されてセル lysates のタンパク質濃度が十分に高い ρ GTPase 活性を検出するようにします。(テスト プレートは換散バッファーの量が適切かどうか、またタンパク質濃度が許容範囲内にあるかどうかを決定するために使用するセルのプレート)肯定的な制御読むべき 4 〜 10 倍空井戸より高い線形の範囲内にある場合です。ない場合は、製造元に問い合わせる、ルミノを調整します。表 3に、ルミノの設定が与えられます。 - 列見出しがサンプル、平均、標準偏差、 rep1、表示 rep2、 rep3を読むとrep4、各サンプルで行われている複製の数を示すことである raw データを入力します。
- 意味するには、[入力式=average(Xn:Yn) X rep1Y の列指定子を = = rep4と n 列指定子 = 取り組まれている行の行識別子。
- 標準偏差、下= stdev (Xn:Yn)数式を入力ここで、X = rep1Y の列指定子 = rep4と n 列指定子 = 取り組まれている行の行識別子。
- 表示 rep2 rep1等に複製データを入力します。
- データを入力した後に、サンプル、意味、および標準偏差を選択するクリック ・ ドラッグ メソッドを使います。
- データ分析ソフトウェアで、作るよう正方形の内側にミニ バー グラフとグラフの関数を選択します。
注: これは、入力されたデータに基づいて設計チャートにプロセスを作るグラフをもたらします。 - 縦棒グラフを選択し、入力値を意味する番号を指定します。
注:を意味する数字のグラフは最初になされた y 軸誤差の標準偏差の欄を指定するし、.これを行うには、グラフのバーをダブルクリックして、 y 軸エラータブを選択、カスタムオプションをクリックして、標準偏差データの場所を入力するワークシートで範囲を選択します。必要なグラフの作成後、比較する必要がありますグループの違いを見ることができます。
結果
膜分画:
超遠心法は、膜と細胞質成分の分別に使われました。図 1に示すように、上清に含まれて細胞質画分とペレットが入っている膜画分。U251 細胞から得られた細胞内導入が期待されて分数の ρ の豊かさはシンバスタチン免疫ブロットを使用で治療後調べた。純度と膜と細胞質画分のコントロールを読み込むは、それぞれパン型カドヘリンおよび GAPDH によって確認されました。図 2に示すように、シンバスタチン治療がそのゾル性細胞質の内容が増加したが膜結合型 ρ GTPase の量を減らします。これは ρ プレニル化の阻害に基づく低分子量 g 蛋白質の転流にスタチン系薬剤の知られている効果と一貫性が。シンバスタチン ρ GTPase のプレニル化を阻害する、したがって、unprenylated ρ は細胞膜に固定することができる細胞内濃度が高い結果。
Ρ GTP バインド:
Gtp アーゼ抗体アッセイを用いた ρ GTP 結合蛋白質を測定し、, そのシンバスタチンを有意 (P 0.05 <) GTP 結合 ρ U251 細胞 (図 3) を増加しました。したがって、シンバスタチンは、ρ GTPase 蛋白質プレニル化 (図 2) を抑制しながら制御の細胞と比較して読み込み、GTP も増加。これはプレニル化とバインディングは、ともに GTP が活動と ρ GTPase の規制の役割を果たすという事実を指します。この現象に関する詳細は、このプロトコルの8を使用して元の文書を参照してください。
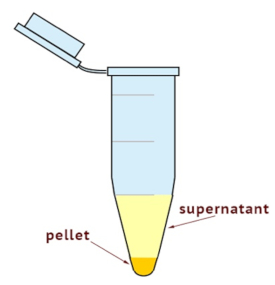
図 1: 遠心後ゾル性細胞質と膜分画のスケマティック ビュー 。ペレットが入っている膜画分と上澄みに細胞質画分が含まれています。

図 2: シンバスタチン変更 ρ のローカリゼーション。U251 細胞はシンバスタチンと扱われた (10 μ M 12、24、36 h) とイムノブロット ρ の膜と細胞質画分の豊かさを求めた。GAPDH とパン カドヘリンの豊富は読み込みゾル性細胞質と膜の分画と膜画分におけるゾル性細胞質の汚染の欠如を確認するコントロールにも評価されました。データは、通常、異なるプライマリ カルチャを使用して 3 つの独立した実験から。この図は、アリザデらから変更されています。8.この図の拡大版を表示するのにはここをクリックしてください。

図 3:シンバスタチン ρ GTPase 活性を調節する.Gtp アーゼ アッセーは U251 細胞における Rho GTP 結合蛋白質を測定するために使用されました。36 h、飢餓とシンバスタチン (10 μ M) などを含むさまざまな条件を調べた。各実験のため、キットで提供される恒常活性 ρ 蛋白質は肯定的な制御として使用されました。結果は、独立した実験で 2 つの複製の平均 ± SD で表されます (* P < 0.001)。この図は、アリザデらから変更されています。8。
| 細胞培養容器 | 表面積 (センチメートル2) | 換散バッファー (μ l) | |
| 料理 | 35 mm | 9 | 100 |
| 60 mm | 21 | 300 | |
| 100 mm | 55 | 700 | |
| 150 mm | 145 | 1500 | |
| プレート | 6 ウェル | 9.4/ | 100 |
| 12 ウェル | 3.8/ | 70 | |
| 24 ウェル | 1.9/ | 40 | |
| フラスコ | T-25 | 25 | 250 |
| T-75 | 75 | 1000 | |
| T-150 | 150 | 1500 | |
表 1:U251 細胞の換散バッファーのボリュームをお勧めします。ボリュームは、異なる種類の細胞の調節可能です。
| 換散バッファーの名前 | 換散バッファー組成 | 小さい G 蛋白質ターゲット | ノート |
| GL35 | トリス (1 X GL36)、MgCl2 (8 X GL36)、塩化ナトリウム (2 X GL36)、IGEPAL (1 X GL36) SDS (5 X GL36) | Cdc42 | GL36 に同一コンポーネント構成変わるとおりであります。 |
| GL36 | トリス pH 7.5、MgCl2、塩化ナトリウム、IGEPAL、SDS の独自の処方 | RalA | 標準的なバッファー、最も GTPase リンク抗体法と互換性があります。 |
| GL36 | トリス pH 7.5、MgCl2、塩化ナトリウム、IGEPAL、SDS の独自の処方 | Rac1 | 標準的なバッファー、最も GTPase リンク抗体法と互換性があります。 |
| GL36 | トリス pH 7.5、MgCl2、塩化ナトリウム、IGEPAL、SDS の独自の処方 | Rac1、2、3 | 標準的なバッファー、最も GTPase リンク抗体法と互換性があります。 |
| GL36 | トリス pH 7.5、MgCl2、塩化ナトリウム、IGEPAL、SDS の独自の処方 | Ras | 標準的なバッファー、最も GTPase リンク抗体法と互換性があります。 |
| GL36 | トリス pH 7.5、MgCl2、塩化ナトリウム、IGEPAL、SDS の独自の処方 | Ρ | 標準的なバッファー、最も GTPase リンク抗体法と互換性があります。 |
| GL36 | トリス pH 7.5、MgCl2 の独自の処方 | Arf1 | 標準的なバッファー、最も GTPase リンク抗体法と互換性があります。 |
表 2:リストの gtp アーゼ抗体アッセイの換散バッファーと低分子量 g タンパク質の溶解成分をお勧めします。
| パラメーター | ノート | ||
| ゲイン | ゲインのオプションは、マシンの感度を調整します。ほとんどの luminometers は、自動校正または限られた校正機能を使用します。ユーザーは、読み取りがさまざまな楽器に変化する線形の範囲内にある場合を参照してくださいするために低、中、高利得をお読みください。 | ||
| 統合時間 | 線形の範囲外を読む非常に高い可能性があります時間と最低の水準でこのオプションを持っていることをお勧めします。低い希釈または第一次および二次抗体を使用してのような不要な作業が必要です。積分時間の異なる楽器もによって異なります。 | ||
| 揺れ | それは、5 s を使用する勧め軌道振動。アッセイの精度の他のパラメーターとして、重要ではありません。 | ||
| 温度 | 部屋の温度をお勧めします | ||
| プレート型 | 使用している板によると使用します。通常プレートは 96 ウェル、フラットと白です。 | ||
| フィルター | 励起または排出フィルターは発光に必要ではありません。励起は、お好みの値に設定できます、排出量の最適な範囲 430 445 nm です。フィルターのスペースは空白のままにします。これは、オプションではない場合 | ||
テーブル 3:ルミノ設定の詳細な説明。
ディスカッション
ここで我々 は小さな GTPase プレニル化と GTP 結合小さい gtp アーゼ内局 (膜と細胞質) および Rho GTP の読み込みを測定する正確な方法をについて説明します。低分子量 g タンパク質は真核細胞で表現し、構造、運動、細胞増殖に必須の役割を果たします。プレニル化と GTP 結合; GTPase 活性の調節に関与しています。したがって、プレニル化とこれらの蛋白質の GTP 結合を評価する試金、細胞生物学者1,8のための重要なツールです。
最近の研究の結果に基づき、Rho 蛋白質 GTP の読み込みは携帯型特定8で、したがって、異なる細胞の種類によって異なります。また、内局と Rho 蛋白質の geranylgeranylation (GGT) 彼らの機能の調節に決定する手順を示します。これはまたさらに GEF、ギャップ、および GDI のエフェクタータンパク質の主要な低分子量 g 蛋白質の相互作用によって調整されます。
シンバスタチンは、THP 1 球で Rac GTP 読み込み、アミロイド β 刺激の存在下で Rac のプレニル化を調整し17これらの細胞からの炎症性応答を減らす知られています。我々 はまた、T 細胞の機能は Rho GTP ロードの影響を受けませんが、むしろ、Rho の GGT 決定関数18,19を知っています。したがって、Rho GTPase 活性を検出するためにプレニル化と GTP の読み込みする必要がありますが同時に測定セル内をお勧めします。
高純度のゾル性細胞質と膜画分を達成するために、メモのプロトコルの最も重要なステップは、超音波処理、遠心。Rho GTP 結合の試金の最も重要なステップは、スナップ-凍結シーケンシャル処理の前にセル lysates。重要な手順に従う生活における低分子量 g 蛋白質の研究で一貫して再現可能な結果になります。
特定の細胞内構造や膜タンパク質を調べるための重要なステップは、1 つから別の細胞コンパートメントの分離です。分別は、サイズと形状、表面電荷密度と浮揚性の密度20のような各細胞内コンパートメントのプロパティを活用します。それは 4 ° C で高粘度のメディアで差動遠心分離に基づいて主に各区画のサイズと高重力速度遠心、後膜タンパク質が管の底に行くし、ゾル性細胞質蛋白質が、ここで使われた膜の分別法は主に基づいて、上清。
注意すること含む高蛋白質濃度のサンプルし、おそらく、ギャップの高レベルことができます潜在的ターゲット gtp アーゼ非アクティブ化が重要です。この問題は換散バッファーでも発生することが、偽否定的な結果につながる可能性があります。Gtp アーゼ活性アッセイ結果の再現性と成功を決定する重要なパラメーターの 1 つは、健康と実験8で使用されているセルの応答性です。捜査官が/適切な最適な成長条件と gtp アーゼ活性化/抑制を決定するための調査の下で細胞の倍加時間を識別することを強くお勧めします。また、すべての Gtpase の GTPase 活性が堅く調整される、つまり、ギャップのアクション (中と後のセル換散の手順を介して酵素にバインドされて GTP 分子の加水分解によって急速に影響を受け減少).この操作の関心の gtp アーゼの急速な不活性化の結果します。したがって、4 ° C で正確かつ再現性のある結果を達成するために、セル換散を急速に実行を強くお勧めします。
最終的な細胞ライセートを決定する実験の条件によっていくつかの要因があります。まず、細胞または特定の組織で ρ GTPase の合計金額: 内因性 ρ GTPase の量は細胞と組織のさまざまな種類の変数したがって、この活性化または活へのより積極的な応答で結果ことができます。第二に、活性化/不活性化実験の条件下で達成額: 総細胞小さい gtp アーゼの約 2% に 10% がおそらく8特定の刺激への応答でアクティブである考慮することが重要です。非アクティブ化の量だけまた刺激の種類によって異なります、さまざまな細胞や組織内の変数です。したがって、小さな GTPase 活性測定法の種類ごとの換散バッファーと細胞コンパートメントの組成が重要です。表 3は、各特定の小さな GTPase 蛋白質の換散バッファーの推奨構成を示します。
さまざまなサンプルの GTPase 活性を比較する調査を可能にするため、正規化された細胞ライセート タンパク質濃度は主要な要件です。したがって、冷 PBS とすべての条件のすべてのサンプルから細胞を洗浄培養メディアからタンパク質を削除する必須です。また、実験のすべての段階で低温 (4 ° C) で、すべての試薬とバッファーを使用することが不可欠です。この冷たさは、試料中に Rho GTPase を含む低分子量 g 蛋白質の加水分解を最小限になります。Ρ GTPase 活性が失われないようにするために、急速に (合計で 10-15 分) でセル lysates のこの処理を行うことが重要です。さらに、セル lysate の準備の最も重要なステップは、スナップ凍結ライセートの因数を ρ 小さな GTPase 酵素活性を維持するために液体窒素ですることです。これは、異なる縦長または実験で複数のサンプルがある場合に特に重要です。スナップ凍結溶解液の準備の後サンプルは-80 ° C での Rho GTPase 活性を失うことがなく維持できます。
Ρ GTPase の膜のアンカリングの分析のため提供されているプロトコルは、低分子量 g タンパク質のプレニル化を測定する間接ツールのみを表し、直接検出またはターゲット蛋白質イソプレノイド残基の結合を定量化することができません。これは、このアッセイの非常に少数の制限の 1 つです。従って、それはタンパク質のプレニル化の推定を与えます。直接測定するフィート (ファルネルシル) および/または GGT ファルネシルピロリン酸トランスフェラーゼおよび/またはゲラニルゲラニル トランスフェラーゼ, 培養細胞と動物とひと由来腫瘍の両方ことができるいくつかの方法が定義されています。法は、電気泳動の移動性シフト、[3 H] ファルネシル二リン酸と 【 3 H 】 ゲラニルゲラニル二リン酸 [3 H] メバロン酸ラベリング、続いて免疫沈降と SDS ページ21を使用します。
任意膜アンカーと ρ gtp アーゼ活性を検出する ρ GTPase アッセーを使いました。96 ウェル プレートの井戸にリンクされている Rho GTP 結合タンパク質で構成されています。だから、GDP 結合非アクティブ ・ ローで洗浄のステップ中に流されている間、細胞や組織の lysates GTP 結合アクティブなローは、井戸にバインドします。その後、井戸にバインドされている、アクティブな ρ は ρ 特異抗体と化学発光を使用して検出されます。Nonactivated をアクティブ セル lysates からの測定値を比較することによって ρ 活性化の程度を判断することが可能です。血清飢餓 (培養細胞の無血清培地の使用) は組織培養で ρ を不活化する通常使用されます。また、活性化の gtp アーゼ抗体アッセイの範囲が ρ GTPase 活性の検出のための蛋白質の 10-50 μ g を必要とすること述べられるべきであります。
未処理のサンプルある GTPase 活性 (コントロールの状態) の低い基底細胞レベルであることを強くお勧めします。例としては、適切なセル飢餓 and 条件をできるレセプター GTPase 活性実験条件下で、活性化を示しに理想的な条件を提供します。また、活性化および抑制の試金は最高の gtp アーゼ活性化/抑制応答を取得する時間と用量反応方法で実行されます。もっと重要なは、細胞の準備時に非常に overconfluent セルを使用することが重要だ (> 70%)、細胞の活性化/抑制刺激への任意の nonresponsiveness を避けるために。
Luminometers は、感度と絶対測定値の面で大きく異なります。したがって、線形の範囲内にあることを決定するためには、gtp アーゼ - アッセーを実行し、空白と肯定的な制御することをお勧めします。試金は (肯定的な制御は 4 x 10 x バッファー専用の読書よりも高いはず) 線形の範囲または空白の読書は 900 万より高いし、さらに抗体の希薄を使用をお勧めします。さらに、分析を開始する前に試金の線形範囲を読むルミノのキャリブレーションをお勧めします。
また、言及する価値がある GTPase アッセーに利点があります。Gtp アーゼ抗体アッセイは現在実験的なデザインを改善し、古いプルダウン テクニック22不可能だった実験を容易にする技術を有効にします。Gtp アーゼ抗体アッセイも検出精度と準備でプルダウンの試金23以前立ち入り禁止 GTPase 活性の解析を可能にする感度を提供します。最近の研究のいくつかプルダウンで gtp アーゼ抗体活性化法を比較し、その GTPase 抗体アッセイにいくつかの明確な利点は、すなわち GTPase 抗体アッセイのために優れていると結論した、少量のタンパク質22,24、彼らより感度24とその定量的測定23を使用する機能。Gtp アーゼ抗体アッセイ キットは luminometric または比色検出のバージョンで利用可能な luminometric の試金がより敏感。この gtp アーゼ抗体アッセイ、むしろシンプルで高速なプロトコルに基づいて、サンプルの少量を必要とし、定量的で正確な結果が得られます。したがって、さらにはるかに高い特異性と精度を持つ異なる細胞およびティッシュ文化セルの gtp アーゼ ベースのタンパク質の他の種類を検出するこのアッセイを開発することをお勧めしていることがあります。
開示事項
著者が明らかに何もありません。
謝辞
島田ガバミは、健康科学センター運営助成金、CHRIM 営業許可と研究マニトバ州新しい探偵の営業補助によって支えられました。バエディ アリザデは研究マニトバ学生の身分によって支えられました。Shahla Shojaei は、健康科学財団営業許可と MITACS 加速員によって支持されました。アデル Rezaei モガダムは、ジョセフ ・ w ・ ゴードンで開催された助成金を営業、レベルによって支えられました。アミール a. ぜひともは NIH/NHLBI K08 賞 (1K08HL114882 01A1) によって支えられました。マレク ・ j ・ ロス親切 NCN 付与 #2016/21/B/NZ1/02812、スマート ロワール バレー一般プログラムを通じて総合研究 (地域センター ヴァル ・ ド ・ ロワール、フランス) ル球場研究所でサポートされており、共同出資者、マリーからサポートが認めています。マリアスクウォドフスカ キュリー アクション #665790 を付与します。シモーネ ・ ダ ・ シルバ ・ ローザは、UMGF 学生の身分によって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| DMEM high Glucose | VWR (Canada) | VWRL0101-0500 | |
| Fetal Bovine Serum | VWR (Canada) | CA45001-106 | |
| Penicillin/Streptomycin | VWR (Canada) | 97062-806 | |
| EDTA (Ethylenediamine tetraacetic acid) | VWR (Canada) | CA71007-118 | |
| EGTA (Ethylene glycol bis(2-aminoethyl ether)-N,N,N',N'-tetraacetic acid) | VWR (Canada) | CAAAJ60767-AE | |
| DTT (DL-Dithiothreitol) | VWR (Canada) | CA97061-340 | |
| Ammonium Persulfate | VWR (Canada) | CABDH9214-500G | |
| Tris-Hydroxymethylaminomethane | VWR (Canada) | CA71009-186 | |
| 30% Acrylamide/Bis Solution | Biorad (Canada) | 1610158 | |
| TEMED | Biorad (Canada) | 1610801 | |
| Protease Inhibitor cocktail | Sigma/Aldrich (Canada) | P8340-5ML | 1:75 dilution |
| Rho-GTPase Antibody Sampler Kit | Cell Signaling (Canada) | 9968 | 1:1000 dilution |
| Pan-Cadherin antibody | Cell Signaling (Canada) | 4068 | 1:1000 dilution |
| GAPDH antibody | Santa Cruz Biotechnology (USA) | sc-69778 | 1:3000 dilution |
| RhoA G-LISA Activation Assay (Luminescence format) | Cytoskeleton Inc. (USA) | BK121 | Cytoskeleton I. G-LISA Activation Assays Technical Guide. 2016. |
| RhoA Antibody | Cell Signaling | 2117 | |
| ECL | Amersham-Pharmacia Biotech | RPN2209 | |
| Anti-Rabbit IgG (whole molecule) Peroxidase antibody | Sigma | A6154-1ML | |
| SpectraMax iD5 Multi-Mode Microplate Reader | Molecular Devices | 1612071A | Spectrophotometer |
| Nonidet P-40 | Sigma | 11332473001 | non-denaturing detergent, octylphenoxypolyethoxyethanol |
| DMSO | Sigma | D8418-50ML | |
| PBS | Sigma | P5493-1L | |
| Phophatase Inhibitor cocktail | Sigma | P5726-5ML | 1:75 Dilution |
参考文献
- Yeganeh, B., et al. Targeting the mevalonate cascade as a new therapeutic approach in heart disease, cancer and pulmonary disease. Pharmacology & Therapeutics. 143 (1), 87-110 (2014).
- Valencia, A., Chardin, P., Wittinghofer, A., Sander, C. The ras protein family: evolutionary tree and role of conserved amino acids. Biochemistry. 30 (19), 4637-4648 (1991).
- Hall, A. Rho family GTPases. Biochemical Society Transactions. 40 (6), 1378-1382 (2012).
- Rojas, A. M., Fuentes, G., Rausell, A., Valencia, A. The Ras protein superfamily: evolutionary tree and role of conserved amino acids. The Journal of Cell Biology. 196 (2), 189-201 (2012).
- Cherfils, J., Zeghouf, M. Regulation of small GTPases by GEFs, GAPs, and GDIs. Physiological Reviews. 93 (1), 269-309 (2013).
- Shojaei, S., et al. Perillyl Alcohol (Monoterpene Alcohol), Limonene. Enzymes. 36, 7-32 (2014).
- Ghavami, S., et al. Airway mesenchymal cell death by mevalonate cascade inhibition: integration of autophagy, unfolded protein response and apoptosis focusing on Bcl2 family proteins. Biochimica et Biophysica Acta. 1843 (7), 1259-1271 (2014).
- Alizadeh, J., et al. Mevalonate Cascade Inhibition by Simvastatin Induces the Intrinsic Apoptosis Pathway via Depletion of Isoprenoids in Tumor Cells. Scientific Reports. 7, 44841(2017).
- Ghavami, S., et al. Mevalonate cascade regulation of airway mesenchymal cell autophagy and apoptosis: a dual role for p53. PLoS One. 6 (1), e16523(2011).
- Tang, Y., Olufemi, L., Wang, M. T., Nie, D. Role of Rho GTPases in breast cancer. Frontiers in Bioscience: A Journal and Virtual Library. 13, 759-776 (2008).
- DerMardirossian, C., Bokoch, G. M. GDIs: central regulatory molecules in Rho GTPase activation. Trends in Cell Biology. 15 (7), 356-363 (2005).
- Garcia-Mata, R., Boulter, E., Burridge, K. The 'invisible hand': regulation of RHO GTPases by RHOGDIs. Nature Reviews Molecular Cell Biology. 12 (8), 493-504 (2011).
- Etienne-Manneville, S., Hall, A. Rho GTPases in cell biology. Nature. 420 (6916), 629-635 (2002).
- Ghavami, S., et al. Geranylgeranyl transferase 1 modulates autophagy and apoptosis in human airway smooth muscle. American Journal of Physiology - Lung Cellular and Molecular Physiology. 302 (4), L420-L428 (2012).
- Clark, E. A., Golub, T. R., Lander, E. S., Hynes, R. O. Genomic analysis of metastasis reveals an essential role for RhoC. Nature. 406 (6795), 532-535 (2000).
- Ghavami, S., et al. Statin-triggered cell death in primary human lung mesenchymal cells involves p53-PUMA and release of Smac and Omi but not cytochrome c. Biochimica et Biophysica Acta. 1803 (4), 452-467 (2010).
- Cordle, A., Koenigsknecht-Talboo, J., Wilkinson, B., Limpert, A., Landreth, G. Mechanisms of statin-mediated inhibition of small G-protein function. Journal of Biological Chemistry. 280 (40), 34202-34209 (2005).
- Waiczies, S., Bendix, I., Zipp, F. Geranylgeranylation but not GTP-loading of Rho GTPases determines T cell function. Science Signaling. 1 (12), pt3(2008).
- Waiczies, S., et al. Geranylgeranylation but not GTP loading determines rho migratory function in T cells. Journal of Immunology. 179 (9), 6024-6032 (2007).
- Satori, C. P., Kostal, V., Arriaga, E. A. Review on Recent Advances in the Analysis of Isolated Organelles. Analytica Chimica Acta. 753, 8-18 (2012).
- Berndt, N., Sebti, S. M. Measurement of protein farnesylation and geranylgeranylation in vitro, in cultured cells and in biopsies, and the effects of prenyl transferase inhibitors. Nature Protocols. 6 (11), 1775-1791 (2011).
- Keely, P. J., Conklin, M. W., Gehler, S., Ponik, S. M., Provenzano, P. P. Investigating integrin regulation and signaling events in three-dimensional systems. Methods in Enzymology. 426, 27-45 (2007).
- Oliver, A. W., et al. The HPV16 E6 binding protein Tip-1 interacts with ARHGEF16, which activates Cdc42. British Journal of Cancer. 104 (2), 324-331 (2011).
- Moniz, S., Matos, P., Jordan, P. WNK2 modulates MEK1 activity through the Rho GTPase pathway. Cellular Signalling. 20 (10), 1762-1768 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved