Method Article
膜分馏和 gtpase-关联免疫吸附法检测小 gtpase 预基化和 gtp 结合
摘要
在这里, 我们描述了一个方案, 以研究前化和鸟苷-5 ' 三磷酸 (gtp) 加载的 rho gtpase。该方案由两种详细的方法组成, 即膜分馏和 gtpase 连锁免疫吸附法。该协议可用于测量不同其他小型 gtpase 的预化和 gtp 负载。
摘要
rho gtpase 家族属于 ras 超级家族, 在人类中包括大约20名成员。rho gtpase 在调节各种细胞功能方面非常重要, 包括细胞骨架动力学、细胞动力、细胞极性、轴突引导、水泡贩运和细胞周期控制。rho gtpase 信号的变化在许多病理条件下发挥着至关重要的调节作用, 如癌症、中枢神经系统疾病和免疫系统依赖性疾病。rho gtpase (即甲氧基酯途径中间体的预化) 和 gtp 结合的翻译后修饰是影响该蛋白活化的关键因素。本文提供了两种基本而简单的方法来检测 rho gtpase 的预化和 gtp 结合活性。本手稿对已使用的技术程序的详细情况进行了逐步说明。
引言
rho gtpase 是一组小蛋白质 (21-25 kda), 在整个进化过程中得到很好的保存, 并在小 gtpase 的 ras 超级家族中形成一个独特的亚科。在这个超家族中的每个亚科, 都有一个共享的 g 域核心, 参与 gtpase 活性和核苷酸交换1。rho 家族和其他 ras 子家族的区别在于, 在小 gtpase 域2中存在 "rho 插入域 "。
根据最近的分类, rho gtpase 被认为是一个信号蛋白家族, 适合 ras gtpase 超级家族3。mammalian rho gtpases 有22个成员, 根据其具体功能和一般特征4 , 其中除甘酸、r比1和 cdc42 是该组研究最多的成员。rho gtpase通过严格调节的机制与细胞内信号通路相连, 这种机制依赖于分子开关, 通过蛋白质翻译后修饰5。
gtp 负载和水解是小型 rho gtpase 活性失活循环中必不可少的机制,通过gtpas-激活蛋白 (gap) 进行调节。gap 负责 gtp 水解, 并与负责 gtp 加载反应的鸟嘌呤核苷酸交换因子 (gef) 协同工作。rho gdp 离解抑制剂 (gdi)通过结合到结合到结合到 gdp 绑定的 rho gtpases, 提供了小 rho gtpases 的进一步调控。这抑制了 gdp 离解, 并促进了小 rho gtpase 远离活性的细胞膜位点的分离。还进一步调节了 rho gtpase 蛋白, 涉及 gdi 的前化, 它调节核苷酸的水解和交换, 并控制 gdpw gtp 循环1,6,7,8。
gtp 负载和 rho gtptase 的前化都参与了 rho gtptase 在细胞溶胶和细胞膜之间的运动, 改变了这些蛋白质 1,9的亲脂性。上述调节剂与 gdp/gtp 交换活性10的细胞膜磷脂和其他调节蛋白相互作用.此外, gdi, 离解抑制剂, 阻止 gtp 水解和 gdp/gtp 交换。gdi 抑制了非活性 rho 蛋白与 gdp 的分离, 因此, 它们与下游效应的相互作用。gdi 还调节细胞中的细胞溶胶和膜之间 gtpase 的循环。rho gtpase 的活动在很大程度上取决于它们对细胞膜的运动;因此, gdi 被认为是关键的调节剂, 可以通过隐藏其疏水区域 11,12来隔离细胞质中的 gtpase。
为了使 rho gtpase 在其活化周期的所有阶段都具有最佳的信号和功能, gtp-boxing/gtp 水解的动态循环至关重要。在这一过程中的任何类型的改变可能会导致随后的变化, 由 rhgtpase 调节的细胞功能, 如细胞极性, 增殖, 形态发生, 细胞分裂, 迁移, 粘附和生存13, 14。
目前的协议为读者提供了一个详细的方法来监测小丙二酸 gtpase 激活通过调查他们的婚前和 gdp/gtp 加载. 该方法也可用于检测各种小 gtpase 的预化和 gtp 结合。gtpase 连锁免疫吸附法可用于测量其他类型 gtpase 的活化水平, 如 rac1、rac2、rac3. h-、k-或 n-ras、arf 和 rho15。药理剂辛伐他汀被用作一个例子, 因为最近有报道称, 它参与了小 rho gtpase 的前化和活性8、9、14、16的调节。
研究方案
1. 用膜细胞分裂法测定红景天的归因
-
细胞培养和辛伐他汀治疗
- 种子 50, 000 u251 细胞在100毫米的盘子和培养他们在杜尔贝克的改良鹰的培养基 (dmem) (高葡萄糖, 10% 胎儿牛血清 [fbs])。
- 当30% 的融合时, 通过去除培养基并加入含有辛伐他汀的培养基 (在二甲基亚硫酸盐 [dmso] 中溶解的辛伐他汀 10μm) 对细胞进行处理, 并在 37°c 8 下孵育 36小时.单独使用 dmso 作为车辆控制。
注: 细胞的细胞和膜分馏需要1000万细胞。
-
细胞的收集
- 从37°c 孵化器中取出细胞。观察显微镜下的细胞以确认融合。
注: 细胞应为 70%-80% 融合。 - 吸入培养基, 用冷磷酸盐缓冲盐水 (pbs) 清洗细胞1x。加入5毫升乙二胺四乙酸 (edta) 缓冲液 (kcl:400 mgl, nacl:6800 mgl, nahco3:2200 mgl, nah22004.h2o:140 mg/2, d-葡萄糖: 1, 000 毫克, edta 二钠: 373 mg/2), 并将细胞放回37°c 孵化器 5分钟.
- 孵育5分钟后, 用细胞在含有与 edta 相同量的培养基的15毫升管中收集 edta。
注: 在管内有介质中和 edta, 并阻止细胞膜的任何进一步消化。 - 将管子放入冰盒中, 然后进入离心机。
- 在4°c 下将离心机设置为 1, 500 x g,并将电池旋转5分钟。
- 在不干扰颗粒的情况下取出上清液, 加入1毫升的冷 pbs。把细胞混合好。
- 将细胞混合物 (溶液) 转移到新的 1.5 ml 管中, 在4°c 时在 1, 500 x g的温度下离心, 并将细胞旋转5分钟。
- 检查颗粒大小 (用于估计下一步缓冲区的体积)。把样品放在冰上。完全丢弃上清液而不干扰颗粒。
- 加入冰凉缓冲液 i (10 mm tris-hcl [ph 7.5]、0.1 mm edta、0.1 mm egta、1 mm 二硫素醇和蛋白酶抑制剂鸡尾酒), 通过上下移液将样品混合好, 然后进行超声处理。
- 从37°c 孵化器中取出细胞。观察显微镜下的细胞以确认融合。
-
声纳
- 将声纳设置为五个周期, 每个周期 5秒, 并重复3倍。
- 在冰上执行超声。到超离心机上。
注: 冰凉条件保存蛋白质, 使结果更可靠。
-
超离心
- 使用超离心分离细胞均质体到细胞质和膜组分。将离心机设置为 100, 000 x g , 在4°c 下使用35分钟。如图 1所示, 检查颗粒大小。
注: 膜分数在管的最底部, 其余是其他细胞质成分。 - 收集上清液完全, 同时注意不要打扰颗粒。上清液是细胞质的一部分。将上清液放入新标记的管中。
- 加入300μl 的离解缓冲液 (缓冲液 ii) (50 mm tris-hcl [ph 7.5]、0.15 mm 氯化钠、1 mm 二硫醇、1% sds、1 mm edta、1 mm egta 和蛋白酶抑制剂鸡尾酒) 颗粒 (含有膜分数)。通过上下移液很好地混合。
- 进行蛋白质测定和西方印迹 (免疫印迹分析) 样品制备。
- 使用超离心分离细胞均质体到细胞质和膜组分。将离心机设置为 100, 000 x g , 在4°c 下使用35分钟。如图 1所示, 检查颗粒大小。
-
免疫印迹
- 从裂解缓冲液中分离的组分制备细胞蛋白提取物 (20 mm tris-hcl [ph 7.5]、0.5 mm pmsf、0.5% 非离子洗涤剂40、100μm β-甘油 3-磷酸和0.5% 蛋白酶抑制剂鸡尾酒)。
- 使用 lowry 方法8测量蛋白质浓度,并计算裂解缓冲液的体积 (20 mm tris-hcl [ph 7.5]、0.5 mm pmf、0.5% 非变性洗涤剂、辛烷基苯氧基聚氧乙烯醚、100μm β-甘油 3-磷酸和 0.5%)蛋白酶抑制剂鸡尾酒), 使样品之间的蛋白质浓度正常化。
- 在90°c 下加热样品 5分钟, 并将样品装上 15% sds-page 凝胶以分离蛋白质。
注: 为每个样品装入1μg 的蛋白质。计算需要相应运行的卷。 - 在还原条件下 (500 nm 甘氨酸、50 mm Tris-HCl 和20% 甲醇) 将分离的蛋白质转移到尼龙膜中 2小时, 在 100 v 的室温 (rt) 下。
注: 要确认成功的蛋白质转移, 请使用 ponceau 染色或可视化膜上的蛋白质标记。 - 用5% 脱脂干牛奶和1x 含乳缓冲盐洗涤剂 (tbssp 0.01% 非离子洗涤剂) 阻断膜;tbst) 在4°c 过夜或 rt 处阻止非特异性抗体结合1小时。
- 添加原代抗体进行免疫印迹分析, 并在4°c 下孵育过夜。
注: 在本实验中, 在 1x tbst 1% 的牛奶中使用了 rac这家数、cdc42、r搜救、gapdh 和泛卡粘蛋白 (12:1000) 稀释剂。采用泛卡粘蛋白和 gapdh 分别测定了膜和细胞质分数的纯度。 - 用 1x tbst 清洗膜 3倍, 时间为20分钟。
- 用抗兔辣根过氧化物酶 (hrp) 结合二级抗体对相应的原代抗体 (rt 为 1小时) 对膜进行培养。
- 将斑点清洗 3x 20分钟, 并通过增强的化学发光 (ecl) 检测进行开发。
2. 使用小 g 蛋白活化法测量 rja gtp 负载
- 计数 10, 000 细胞/和培养 u251 细胞在一个100毫米的盘子。
- 当它们是30% 的融合, 治疗细胞与辛伐他汀描述的步骤1.1.2。
- 把培养板从孵化器里拿出来。观察显微镜下的细胞以确认融合。确保细胞融合 70%-80%。将培养皿放在冰上, 吸气培养基, 用冰凉的 pbs (ph 值 7.2) 清洗细胞3倍。
- 吸收 pbs。在冰上倾斜 petri 菜一分钟, 以清除 pbs 的所有残余。
注: 残留的 pbs 会对此检测产生不利影响。 - 将细胞在含有蛋白酶和磷酸酶抑制剂的冰凉裂解缓冲液中裂解。
注: 700μl 通常足以满足100毫米培养皿的需要。请参见表 1 , 以找到每个养殖容器的适当体积。 - 用细胞刮刀收获细胞裂解液。倾斜这种技术的培养板。
- 将裂解液转移到贴有标签的冰凉低温管, 并将其保持在冰上。
- 使用漩涡彻底混合。保留10μl 的裂解液进行蛋白质检测, 以测量样品中的蛋白质浓度。
- 将剩余的细胞裂解液冷冻在液氮中。
注: 在冷冻细胞裂解液之前, 准备多个细胞裂解物, 以避免反复的冻融循环, 这可能导致丙二酸 gtpase 的活性损失。 - 将冷冻冷冻管转移到-80°c 的冷冻室, 并将样品存放在 gtpase 联免疫吸附试验中。
注: 不要将样品存放超过14天。工作迅速, 不要将样品放在冰上超过10分钟。不要同时处理所有的 petri 菜肴。 - 使用 lowry 方法8测量蛋白质浓度,并计算裂解缓冲液的体积, 使样品之间的蛋白质浓度正常化。
注: 最佳浓度通常为 1 mg/ml;但是, 可以检测到 0.3-2 mgml。 - 在微管中加入60μl 的裂解缓冲液和60μl 的结合缓冲液, 准备一个空白控制。
注: 空白控件具有除抗原以外的所有试剂, 并用于背景的减法。 - 通过添加12μl 的 rho 控制蛋白、48μl 的裂解缓冲液和60μl 的结合缓冲液来制备阳性控制。
注: 阳性对照具有所有试剂, 加上已确认的用于 rha-gtp 的抗原。 - 把 rho 亲和力板从袋子里拿出来, 放在冰上。
- 用100μl 的冰凉蒸馏水溶解井中的粉末。把盘子放在冰上。
- 在设置为25°c 的水浴中解冻快速冷冻细胞裂解物。
- 在每个样品中加入计算出的冷裂解缓冲液 (从步骤 2.11), 使蛋白质浓度正常化。
注: 清洗电池后 (使用真空管吸入器) 后取出 pbs, 以避免导致裂解缓冲液成分的变化。将样品蛋白平衡到0.8 到2时的浓度, 以便准确比较 gtpase 活化检测中的样品。表 2提供了有关用于此检测的缓冲液的详细信息。 - 将归一化的冷样品转移60μl 到微管中, 加入60μl 的结合缓冲液;将样品充分混合, 并将其保存在冰上。
- 通过有力的闪烁, 完全去除微板上的水/溶液, 然后在实验室垫子上进行5到7个硬水龙头。
- 在井中添加50μl 的归一化样本、空白控件和正对照。
- 在4°c 时, 在300转/分的温度下, 将板材放在轨道振动台上30分钟。
注: 晃动步骤非常重要, 建议在300转/分处使用轨道板振动台。 - 在 rt 用200μl 的洗涤缓冲液清除盘子中的样品 2x, 每次洗完后都要用闪烁的方式大力取出井内的洗涤缓冲液, 然后敲击, 并将盘子放在 rt 的长凳上。
- 在每口井中加入200μl 的 rt 抗原显示缓冲液, 并在 rt 孵育2分钟。
- 从井中挤出溶液, 用 rt 上的200μl 洗涤缓冲液清洗3x 井。
- 在每口井加入50μl 的新鲜制备的半250抗 rhoa 原代抗体。
- 将板放在轨道振动台上 45分钟, 每分钟300转, 设定为25°c。从井里把溶液翻出来。
- 重复清洗步骤 2x (步骤 2.24)。
- 在每口井加入50μl 的新鲜制备的半250抗 rhoa 二级抗体。
- 将板放在轨道振动台的顶部 45分钟, 每分钟300转, 设定为25°c。
- 将等量的试剂 a 和试剂 b 混合制备 hrp 检测试剂。
- 从每口井中挤出溶液, 用 rt 的200μl 洗涤缓冲液清洗3x 井。
- 在每口井中加入50μl 新鲜制备的 hrp 检测试剂。
- 在3-5分钟内读取发光信号, 以获得最大信号, 并使用适当的软件包分析结果。
注: 读数必须在3-5分钟内进行, 才能获得最大信号。运行一个 "测试板", 以确认正确的裂解缓冲液体积被用于细胞裂解物, 使蛋白质浓度足够高, 以检测 r有望 gtptase 活性。(测试板是一种细胞板, 用于确定蛋白质浓度是否在可接受的范围内, 并确定所使用的裂解缓冲液的体积是否合适。如果在线性范围内, 正控制应改为比空白井高4至10倍。如果没有, 则通过咨询制造商来调整亮度计。表 3给出了发光计的设置。 - 在标题为 "示例"、 "平均值"、 "标准偏差"、 "排斥1"、 "排斥2"、 "排斥3" 和"排斥"4 的列中输入原始数据, 以显示每个示例上所做的复制次数。
- 在"平均值" 下, 输入公式= 平均值 (xn:yn) , 其中 x = rep1 的列指示符, y = repex4的列指示符, n = 正在处理的行的行指示符。
- 在"标准偏差" 下, 输入公式= stdev (xn:yn) , 其中 x = rep1的列指示符, y = repr4 的列指示符, n = 正在处理的行的行的行指示符。
- 将复制数据输入到回收1、 rep1等中.
- 输入数据后, 使用单击和拖动方法选择 "示例"、 "平均值" 和"标准偏差"。
- 然后, 在数据分析软件中, 选择图表制作功能, 该函数看起来像一个正方形, 里面有一个迷你条形图。
注: 这将引入图表制作过程, 在该过程中, 可以根据输入的数据设计图表。 - 选择柱形图, 并为输入值指定"均值数"。
注:首先制作平均值的图表, 然后指定 y 轴误差线的"标准偏差" 列。为此, 请双击图形栏, 选择 y 轴错误选项卡, 单击 "自定义" 选项, 然后选择工作表中的区域以输入"标准偏差" 数据的位置。在创建所需的图表后, 可以看到需要比较的组之间的差异。
结果
膜分馏:
采用超离心法制备膜和细胞溶胶成分。如图 1所示, 上清液含有细胞质部分, 颗粒含有膜分数。在辛伐他汀免疫印迹法治疗后, 检测了从 u251 细胞中获得的红景天的丰度。用泛卡粘蛋白和 gapdh 分别测定了膜和细胞溶胶组分的纯度和负载控制。如图 2所示, 辛伐他汀治疗减少了膜结合的丙二醇酯, 同时增加了其细胞质含量。这与司他汀基于抑制丙二酸二甲酰化对 gtpase 易位的已知影响是一致的。辛伐他汀抑制丙二酸氢氧化二氢电池的前化, 因此, 未前对丙基的丙二醛不能锚定在细胞膜中, 从而导致其更高的细胞质浓度。
roa-gtp 绑定:
我们用 gtac硅联免疫吸附法测定了 gtp 结合的 rhoa 蛋白, 发现辛伐他汀在 u251 细胞中显著增加了 gtp-约束的 rhoa (图 3).因此, 虽然辛伐他汀抑制丙二酸 gtpase 蛋白的前化 (图 2), 但与对照细胞相比, 它的 gtp 负载也增加了。这表明, 前化和 gtp 结合在丙二酸氢氧化氢运动的活动和监管中都起着作用。有关此现象的更多详细信息, 请参阅使用本协议的原始出版物8。
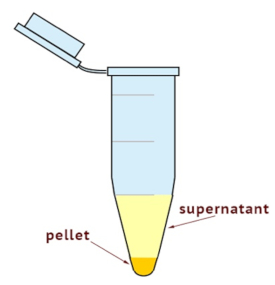
图 1: 超离心后的细胞质和膜组分示意图。颗粒含有膜分数, 上清液含有细胞质分数。

图 2* 辛伐他汀改变了红景天的定位.用辛伐他汀 (10μm; 12、24和 36 h) 治疗 u251 细胞, 免疫印迹法测定膜中的丙酸丰度和细胞质分数。gapdh 和泛卡粘蛋白丰度也被评估为控制细胞质和膜组分的负载, 并确认膜部分中没有细胞质污染。这些数据通常来自使用不同初级区域性的三个独立实验。这一数字已从 alizadeh等人处修改。8.请点击此处查看此图的较大版本.

图 3:辛伐他汀调节罗斯塔 gtpase 活性.采用 gtpase 连锁免疫吸附法测定 u251 细胞中 gtp 结合 rho 蛋白。对不同的条件进行了36小时的测试, 包括饥饿和辛伐他汀 (10μm)。对于每个实验, 试剂盒中提供的一种本构活性的 rhoa 蛋白都被用作阳性对照。结果在独立实验中表示为两个副本的平均值±sd (* * * p & lt; 0.001)。这一数字已从 alizadeh等人处修改。8。
| 细胞培养容器 | 表面积 (厘米2) | 裂解缓冲器 (μl) | |
| 菜 | 35毫米 | 9 | 100元 |
| 60毫米 | 21 | 300元 | |
| 100毫米 | 55 | 700元 | |
| 150毫米 | 145 | 1500元 | |
| 板 | 6井 | 9.4/井 | 100元 |
| 12井 | 3.8/好 | 70 | |
| 24井 | 1.9/井 | 40 | |
| 烧瓶 | t-25 | 25 | 250人 |
| t-75 | 75 | 1000元 | |
| t-150 | 150人 | 1500元 | |
表 1:建议的 u251 细胞裂解缓冲液的体积.对于不同的细胞类型, 音量是可调节的。
| 裂解缓冲区名称 | 裂解缓冲区组成 | 小 g 蛋白靶标 | 笔记 |
| gl35 | tris (1x gl36)、mgcl2 (8x gl36)、nacl (2x gl36)、igepal (1x gl36)、sds (5x gl36) | cdc42 | 与 gl36 相同的成分, 成分变化如下; |
| gl36 | tris ph 7.5、mgcl2、nacl、igepal 和 sds 的专有配方 | ra | 标准缓冲液, 与大多数 gtpase 相关免疫吸附检测兼容。 |
| gl36 | tris ph 7.5、mgcl2、nacl、igepal 和 sds 的专有配方 | 赛车1 | 标准缓冲液, 与大多数 gtpase 相关免疫吸附检测兼容。 |
| gl36 | tris ph 7.5、mgcl2、nacl、igepal 和 sds 的专有配方 | 赛车 1, 2, 3 | 标准缓冲液, 与大多数 gtpase 相关免疫吸附检测兼容。 |
| gl36 | tris ph 7.5、mgcl2、nacl、igepal 和 sds 的专有配方 | Ras | 标准缓冲液, 与大多数 gtpase 相关免疫吸附检测兼容。 |
| gl36 | tris ph 7.5、mgcl2、nacl、igepal 和 sds 的专有配方 | 罗大 | 标准缓冲液, 与大多数 gtpase 相关免疫吸附检测兼容。 |
| gl36 | tris ph 7.5 的专有配方 | arf1 | 标准缓冲液, 与大多数 gtpase 相关免疫吸附检测兼容。 |
表 2:gtpase-链反应分析裂解缓冲液和推荐的小 gtpase 裂解组合物列表.
| 参数 | 笔记 | ||
| 获得 | gain 选项可调整机器灵敏度。大多数发光计使用自动校准或有限的校准功能。用户应以低、中、高的方式读取 gain, 以查看读数是否在不同仪器中不同的线性范围内。 | ||
| 集成时间 | 建议将此选项放在最低, 因为非常高的时间可能会读出线性范围。这可能需要不必要的工作, 如使用较低的稀释或初级和二级抗体。集成时间在不同的仪器中也各不相同。 | ||
| 摇 | 建议使用5轨道晃动。它并不像其他参数那样对检测的准确性至关重要。 | ||
| 温度 | 建议使用室温 | ||
| 板材类型 | 根据您使用的板材使用。通常板是96井, 平和白色。 | ||
| 过滤 器 | 发光不需要励磁或发射过滤器。励磁可设置在任何所需的值, 最佳排放范围为430-445 纳米。将筛选器的空格留空。如果这不是一个选项, | ||
表 3:发光计设置的详细说明.
讨论
在这里, 我们描述了一个准确的方法来测量小 gtpase 前化和 gtp 结合显示为小 gtpase 亚细胞定位 (膜对细胞溶胶) 和 rho gtp 负载。小 gtpase 在真核细胞中表达, 在细胞增殖、运动和结构中起着至关重要的作用。前化和 gtp 结合都参与了 gtpase 活性的调节;因此, 评估这些蛋白质的前代化和 gtp 结合是细胞生物学家1,8的重要工具。
根据最近的一项研究结果, rho 蛋白 gtp 负载为细胞类型特异性 8, 因此在不同的细胞类型之间存在差异。此外, rho 蛋白的亚细胞定位和老六 (ggt) 是调节其功能的决定性步骤。主要 gtpase 的效应蛋白 gef、gap 和 gdi 的相互作用也进一步调节了这一点。
辛伐他汀是已知的增加 rac gtp 负载在 thp-1 单核细胞, 减少在淀粉样β刺激存在的 rac 的前化, 并减少从这些细胞17的炎症反应。我们还知道 t 细胞函数不受 rho gtp 加载的影响, 而是由 rho 的 ggt 确定函数18,19。因此, 我们建议, 为了检测 rho gtpase 活性, 必须同时在细胞中测量前化和 gtp 负载。
值得注意的是, 为了实现高纯度的细胞质和膜分数, 该协议最重要的步骤是超声和超离心。对于 rho gtp 结合法, 最关键的步骤是在序贯处理前对细胞裂解物进行快速冷冻。遵循这些重要步骤将在对生活系统中的 gtpase 的研究中产生一致和可重复的结果。
检查特定细胞内结构或膜蛋白的一个关键步骤是分离细胞隔间。分馏利用了每个细胞室的特性, 如大小和形状、表面电荷密度和浮力密度20。它主要是基于在4°c 高粘度介质中的差动离心。这里使用的膜分馏方法主要基于每个隔间的大小和高速, 在超离心后, 膜蛋白进入管底, 细胞蛋白留在液。
需要注意的是, 含有高蛋白质浓度和可能高水平的 gap 的样本有可能使目标 gtpase 失活。即使在裂解缓冲区中也可能发生此问题, 并可能导致错误的负面结果。决定 gtpase 活性测定结果的成功和重现性的关键参数之一是实验8中使用的细胞的健康和反应能力。强烈建议研究人员确定最佳的生长条件和加倍时间, 以便所研究的细胞确定 gtpase 激活/抑制。此外, 所有小型 gtpase 的 gtpase 活性都受到严格调控, 因此,通过gap 的作用 (在细胞裂解过程中和之后), 通过水解与酶结合的 gtp 分子, 很容易迅速减少。).这一行动导致感兴趣的 gtpase 迅速失活。因此, 强烈建议在4°c 下快速进行细胞裂解, 以获得准确和可重复的结果。
有几个因素取决于实验条件, 决定最终细胞裂解液。首先, 细胞系或特定组织中的丙酸氢氧化亚 gtpase 总量: 在不同类型的细胞和组织中, 内源性丙酸 gtpase 的含量是可变的;因此, 这可能会导致对激活剂或失活剂的更有力的响应。其次, 在实验条件下实现的激活/失活量: 重要的是要考虑到大约2% 到10% 的细胞小 gtpase 可能是激活响应特定的刺激8。失活的量也完全取决于刺激的类型, 它在不同的细胞和组织中是可变的。因此, 对于每种类型的小 rho gtpase 活性测定, 裂解缓冲液和细胞室的组成是至关重要的。表 3显示了每个特定的小 gtpase 蛋白的裂解缓冲液的推荐成分。
归一化细胞裂解蛋白浓度是一个主要要求, 因为它使研究人员能够比较不同样品的 gtpase 活性。因此, 在所有条件下使用冷 pbs 清洗所有样品中的细胞是必须从组织培养基中去除蛋白质的。在实验的所有步骤中, 所有试剂和缓冲液都必须在低温 (4°c) 下使用。这种低温将最大限度地减少 gtpase (包括 rho gtpase) 在样品制备过程中的水解。至关重要的是, 这种细胞裂解物的处理应迅速进行 (总共 10-15分钟), 以避免失去罗素 gtpase 活性。此外, 细胞裂解液制备最重要的步骤是在液氮中对裂解物的脂肪进行冷冻, 以保持丙二酸 gtpase 的小酶活性。如果实验中有不同的时间点或多个样本, 这一点尤其重要。在制备速冻裂解物后, 样品可以保存在-80°c, 而不会失去其 rho gtpase 活性。
所提供的用于分析丙又二氢基因对 gtpase 膜锚固的协议只是测量小型 gtpase 的婚前反应的间接工具, 无法直接检测或量化异戊酸残留物与目标蛋白的结合。这是这种检测的极少数限制之一。因此, 它给出了蛋白质的前化估计。在培养细胞、动物和人类肿瘤中, 分别用法尼烷基转移酶和/或 geranylgeranyanyb 转移酶直接测量 ft (farnesylation) 和 ggt 的方法。该检测使用电泳移动性转移, [3H]farnesyl 二磷酸盐和 [二磷酸 3H]geranylgeranyl, 以及 [3H]mevalonic 酸标记, 然后是免疫沉淀和 sds-page21。
我们使用除氮 gtasce 联免疫吸附法检测除除氮 gtpase 的任何膜锚固和活性。它由一个 rho-gtp 结合蛋白组成, 它与96孔板的井相连。因此, 细胞或组织裂解物中的 gtp 结合活性 rho 与井结合, 而 gdp 结合的非活性 rho 在洗涤步骤中被冲走。然后, 利用红素特异性抗体和化学发光检测井中的结合、活性红素 a。通过比较从活化细胞裂解物到非活化细胞裂解物的读数, 可以确定 rhoa 激活的程度。血清饥饿 (在培养细胞上使用无血清培养基) 通常用于在组织培养中灭活罗亚。还应提及的是, gtpase 连锁免疫吸附检测的激活范围需要10-50 微克的蛋白质来检测经去的 gtpase 活性。
强烈建议未经处理的样品具有较低的基本细胞水平的 gtpase 活性 (控制状态)。例如, 适当的细胞饥饿条件可以降低 gtpase 活性, 并提供理想的条件, 以显示他们在实验条件下的激活。此外, 激活和抑制检测都以时间和剂量响应的方式进行, 以获得最佳的 gtpase 活性/抑制反应。更重要的是, 在细胞制备过程中, 使用不过度融合 (& gt;70%) 的细胞是非常重要的, 以避免细胞对活性/抑制刺激的任何不响应。
照明仪在灵敏度和绝对读数方面差别很大。因此, 为了确定它在线性范围内, 我们建议运行一个 gtpase 连锁免疫吸附检测与空白和积极的控制。如果检测超出了线性范围 (阳性控制应高于仅缓冲区读数的 4倍-10倍) 或空白读数高于 9-1, 000万, 则建议使用进一步的抗体稀释。此外, 我们强烈建议在开始检测之前校准亮度计, 以便在检测的线性范围内阅读。
gtpase 联免疫吸附试验也有值得一提的优点。gtpase 连锁免疫吸附检测改进了目前的实验设计, 并使技术能够促进旧的拉拔技术无法进行的实验22。gtpase 连锁免疫吸附检测还提供了检测精度和灵敏度, 可以分析以前禁止下拉检测23的制剂中的 gtpase 活性.最近的几项研究将 gtpase 联免疫吸附检测与拉下进行了比较, 得出的结论是, gtpase 联免疫吸附试验具有一些明显的优势, 即 gtpase 联免疫吸附检测具有优越性, 因为能够使用少量的蛋白质22,24, 他们更大的敏感性24, 和他们的定量测量23。gtpase-链接免疫吸附检测试剂盒提供发光或比色检测版本, 其中光度检测更敏感。这种 gtpase 连锁免疫吸附法基于一个相当简单和快速的协议, 只需要少量的样本, 并产生定量和准确的结果。因此, 进一步开发这种检测方法可能是一个好主意, 以检测不同细胞系和组织培养细胞中其他类型的 gtpasal 蛋白, 其特异性和准确性要高得多。
披露声明
作者没有什么可透露的。
致谢
saeid ghavami 得到了卫生科学中心业务赠款、chrim 业务赠款和马尼托巴省研究新调查员业务赠款的支持。javad alizadeh 得到了马尼托巴省研究学生的支持。shahla shojaei 得到了卫生科学基金会业务赠款和多边开发协会加快博士后研究金的支持。adel rezaei moghadam 得到了 joseph w. gordon 持有的 nserc 业务补助金的支持。amir a. zeki 得到了 nihsp nhlbi k08 奖 (1k08hl114882-01a1) 的支持。marek j. los 感谢 ncn 赠款 #2016/21 bznzben02812, 该赠款得到了由法国里拉姆大学高级研究所 (法国中央-瓦尔德卢瓦尔河地区) 通过其智能卢瓦尔河谷总方案提供的支持, 并由 marie 共同资助sklolowska-curie 行动, 授予 #665790。西蒙娜·达席尔瓦·罗莎得到了 umgf 学生的支持。
材料
| Name | Company | Catalog Number | Comments |
| DMEM high Glucose | VWR (Canada) | VWRL0101-0500 | |
| Fetal Bovine Serum | VWR (Canada) | CA45001-106 | |
| Penicillin/Streptomycin | VWR (Canada) | 97062-806 | |
| EDTA (Ethylenediamine tetraacetic acid) | VWR (Canada) | CA71007-118 | |
| EGTA (Ethylene glycol bis(2-aminoethyl ether)-N,N,N',N'-tetraacetic acid) | VWR (Canada) | CAAAJ60767-AE | |
| DTT (DL-Dithiothreitol) | VWR (Canada) | CA97061-340 | |
| Ammonium Persulfate | VWR (Canada) | CABDH9214-500G | |
| Tris-Hydroxymethylaminomethane | VWR (Canada) | CA71009-186 | |
| 30% Acrylamide/Bis Solution | Biorad (Canada) | 1610158 | |
| TEMED | Biorad (Canada) | 1610801 | |
| Protease Inhibitor cocktail | Sigma/Aldrich (Canada) | P8340-5ML | 1:75 dilution |
| Rho-GTPase Antibody Sampler Kit | Cell Signaling (Canada) | 9968 | 1:1000 dilution |
| Pan-Cadherin antibody | Cell Signaling (Canada) | 4068 | 1:1000 dilution |
| GAPDH antibody | Santa Cruz Biotechnology (USA) | sc-69778 | 1:3000 dilution |
| RhoA G-LISA Activation Assay (Luminescence format) | Cytoskeleton Inc. (USA) | BK121 | Cytoskeleton I. G-LISA Activation Assays Technical Guide. 2016. |
| RhoA Antibody | Cell Signaling | 2117 | |
| ECL | Amersham-Pharmacia Biotech | RPN2209 | |
| Anti-Rabbit IgG (whole molecule) Peroxidase antibody | Sigma | A6154-1ML | |
| SpectraMax iD5 Multi-Mode Microplate Reader | Molecular Devices | 1612071A | Spectrophotometer |
| Nonidet P-40 | Sigma | 11332473001 | non-denaturing detergent, octylphenoxypolyethoxyethanol |
| DMSO | Sigma | D8418-50ML | |
| PBS | Sigma | P5493-1L | |
| Phophatase Inhibitor cocktail | Sigma | P5726-5ML | 1:75 Dilution |
参考文献
- Yeganeh, B., et al. Targeting the mevalonate cascade as a new therapeutic approach in heart disease, cancer and pulmonary disease. Pharmacology & Therapeutics. 143 (1), 87-110 (2014).
- Valencia, A., Chardin, P., Wittinghofer, A., Sander, C. The ras protein family: evolutionary tree and role of conserved amino acids. Biochemistry. 30 (19), 4637-4648 (1991).
- Hall, A. Rho family GTPases. Biochemical Society Transactions. 40 (6), 1378-1382 (2012).
- Rojas, A. M., Fuentes, G., Rausell, A., Valencia, A. The Ras protein superfamily: evolutionary tree and role of conserved amino acids. The Journal of Cell Biology. 196 (2), 189-201 (2012).
- Cherfils, J., Zeghouf, M. Regulation of small GTPases by GEFs, GAPs, and GDIs. Physiological Reviews. 93 (1), 269-309 (2013).
- Shojaei, S., et al. Perillyl Alcohol (Monoterpene Alcohol), Limonene. Enzymes. 36, 7-32 (2014).
- Ghavami, S., et al. Airway mesenchymal cell death by mevalonate cascade inhibition: integration of autophagy, unfolded protein response and apoptosis focusing on Bcl2 family proteins. Biochimica et Biophysica Acta. 1843 (7), 1259-1271 (2014).
- Alizadeh, J., et al. Mevalonate Cascade Inhibition by Simvastatin Induces the Intrinsic Apoptosis Pathway via Depletion of Isoprenoids in Tumor Cells. Scientific Reports. 7, 44841(2017).
- Ghavami, S., et al. Mevalonate cascade regulation of airway mesenchymal cell autophagy and apoptosis: a dual role for p53. PLoS One. 6 (1), e16523(2011).
- Tang, Y., Olufemi, L., Wang, M. T., Nie, D. Role of Rho GTPases in breast cancer. Frontiers in Bioscience: A Journal and Virtual Library. 13, 759-776 (2008).
- DerMardirossian, C., Bokoch, G. M. GDIs: central regulatory molecules in Rho GTPase activation. Trends in Cell Biology. 15 (7), 356-363 (2005).
- Garcia-Mata, R., Boulter, E., Burridge, K. The 'invisible hand': regulation of RHO GTPases by RHOGDIs. Nature Reviews Molecular Cell Biology. 12 (8), 493-504 (2011).
- Etienne-Manneville, S., Hall, A. Rho GTPases in cell biology. Nature. 420 (6916), 629-635 (2002).
- Ghavami, S., et al. Geranylgeranyl transferase 1 modulates autophagy and apoptosis in human airway smooth muscle. American Journal of Physiology - Lung Cellular and Molecular Physiology. 302 (4), L420-L428 (2012).
- Clark, E. A., Golub, T. R., Lander, E. S., Hynes, R. O. Genomic analysis of metastasis reveals an essential role for RhoC. Nature. 406 (6795), 532-535 (2000).
- Ghavami, S., et al. Statin-triggered cell death in primary human lung mesenchymal cells involves p53-PUMA and release of Smac and Omi but not cytochrome c. Biochimica et Biophysica Acta. 1803 (4), 452-467 (2010).
- Cordle, A., Koenigsknecht-Talboo, J., Wilkinson, B., Limpert, A., Landreth, G. Mechanisms of statin-mediated inhibition of small G-protein function. Journal of Biological Chemistry. 280 (40), 34202-34209 (2005).
- Waiczies, S., Bendix, I., Zipp, F. Geranylgeranylation but not GTP-loading of Rho GTPases determines T cell function. Science Signaling. 1 (12), pt3(2008).
- Waiczies, S., et al. Geranylgeranylation but not GTP loading determines rho migratory function in T cells. Journal of Immunology. 179 (9), 6024-6032 (2007).
- Satori, C. P., Kostal, V., Arriaga, E. A. Review on Recent Advances in the Analysis of Isolated Organelles. Analytica Chimica Acta. 753, 8-18 (2012).
- Berndt, N., Sebti, S. M. Measurement of protein farnesylation and geranylgeranylation in vitro, in cultured cells and in biopsies, and the effects of prenyl transferase inhibitors. Nature Protocols. 6 (11), 1775-1791 (2011).
- Keely, P. J., Conklin, M. W., Gehler, S., Ponik, S. M., Provenzano, P. P. Investigating integrin regulation and signaling events in three-dimensional systems. Methods in Enzymology. 426, 27-45 (2007).
- Oliver, A. W., et al. The HPV16 E6 binding protein Tip-1 interacts with ARHGEF16, which activates Cdc42. British Journal of Cancer. 104 (2), 324-331 (2011).
- Moniz, S., Matos, P., Jordan, P. WNK2 modulates MEK1 activity through the Rho GTPase pathway. Cellular Signalling. 20 (10), 1762-1768 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。