Method Article
Трехмерные Organotypic культуры вестибулярных и слуховых органов чувств
В этой статье
Резюме
Трехмерные organotypic культур мышиных utricle и улитки в оптически ясно коллагена, я гели заповедник врожденной ткани морфологии, позволяют для механической стимуляции путем регулировки матрицы жесткости и позволяют доставки генов вируса опосредованной.
Аннотация
Органы чувств внутреннего уха сложны для изучения млекопитающих из-за их недоступности экспериментальных манипуляций и оптических наблюдений. Кроме того хотя существующие методы культуры позволяют пертурбаций биохимическими, эти методы не обеспечивают средства для изучения воздействия механической силы и жесткость тканей во время разработки внутреннего уха органов чувств. Здесь мы описываем метод для трехмерной organotypic культуру нетронутыми мышиных utricle и улитки, которая преодолевает эти ограничения. Техника для регулировки трехмерные матрицы жесткости, описанные здесь разрешает манипуляции упругой силы, противостоящие роста тканей. Таким образом, этот метод может использоваться для изучения роли механических сил во время разработки внутреннего уха. Кроме того культур позволяют вирус опосредованной гена доставки, которые могут быть использованы для усиления - и -из функция потерь экспериментов. Этот метод культуры сохраняет врожденной волосковых клеток и поддерживая клетки и служит в качестве потенциально превосходной альтернативой традиционной двумерной культуры вестибулярных и слуховых органов чувств.
Введение
Изучение большинство аспектов развития млекопитающих органа была облегчена в vitro системах. Две основные методы в настоящее время используются для культуры вестибулярных органов чувств: свободно плавающего1 и сторонником2 препаратов. Оба метода позволяют исследования уязвимостей клетки волос3 и регенерации4 -1, в пробирке. Кроме того у развития роли паз5,6,7,Wnt8и эпидермального фактора роста рецепторов (EGFR)9,10 сигнальные каскады во внутреннем ухе было установлено, в частности, благодаря использованию в vitro культуры чувств эпителия. Однако клеточный рост и дифференциация находятся под контролем, не только через сигнализации, morphogens, но и через физические и механические подсказки, такие как межклеточных контактов, жесткость внеклеточного матрикса и механического растяжения или сужение. Роль таких механических раздражителей является сложной задачей для расследования в развивающихся внутреннего уха в естественных условиях. Кроме того существующие методы культуры свободного плавания и сторонником не подходят для такого исследования в пробирке. Здесь мы описываем метод для трехмерной organotypic культуры в коллагена я гелей различной жесткости. Этот метод главным образом сохраняет в естественных условиях архитектура кохлеарная и вестибулярная органов чувств и позволяет исследование воздействия механической силы на рост и дифференцировку11.
Потому что механических раздражителей, как известно для того чтобы активировать течению молекулярные события, такие как Бегемот, сигнальный путь12,13,14,15, важно иметь возможность объединить механической стимуляции с биохимических и генетических манипуляций. Описанный здесь метод культуры позволяет доставки генов вируса опосредованной и таким образом может использоваться для изучения, как механических, так и молекулярных сигналов во время внутреннего уха развития11.
протокол
Все методы, описанные здесь были одобрены животное уход и использование комитетов Рокфеллеровского университета и университета Южной Калифорнии.
1. (необязательно) подготовка коллагена я решение от Mouse-tail сухожилий
Примечание: Коллаген я коммерчески доступны решения. Следуйте инструкциям производителя для приготовления геля.
- Усыпить 5-10 молодых взрослых (3-5 недель) мышах любого дикого типа штамма с двуокиси углерода в соответствии с протоколом, утвержденным соответствующими институциональный уход животных и использование Комитета16. Собирать хвосты и лечить их, погрузив в 70% этанол как минимум 4 ч при комнатной температуре.
Примечание: Следует избегать инкубации в течение более 48 часов, как это приводит к чрезмерной ткани обезвоживания и тормозит процесс извлечения сухожилия. - Удалите кожу от каждого хвоста, вводя продольный разрез с лезвием скальпеля и втягивания всей кожи пинцетом. Передать кожурой хвосты Петри 100-мм заполнены с чистой 70% этанола и порежьте их на сегменты 10-мм.
Примечание: Отбросить тонкие части хвосты, которые трудно манипулировать. - С помощью щипцов, обеспечить каждый сегмент хвоста к нижней части Петри и использовать вторую пару тонкой щипцов для извлечения сухожилия из хвост, один за один раз. Отдельных сухожилия волокна должны выйти с минимальным сопротивлением.
Примечание: Старой, скучной #5 Щипцы хорошо работать для этого шага. - Подготовка 100 мл 0,1% раствора (по объему) уксусной кислоты в воде стерильные, молекулярно класса и добавьте 10 мл этого раствора стерильную Петри 100-мм. Передача сухожилий на Петри блюдо и оставить на 1 час при комнатной температуре, чтобы денатурировать коллаген I.
- Используйте стерильным скальпель или иридэктомия ножницы с тупыми, изогнутые советы для фарша сухожилия на фрагменты 1-2 мм. Переложите фарш сухожилий стерильную пробирку 50 мл и добавьте 0,1% уксусной кислоты довести объем до 50 мл.
Примечание: Использовать четыре или пять хвостов для каждого 50 мл кислоты для достижения коллаген я концентрации 2,0-2,5 мг/мл. - Охладите коллаген я решение на 4 ° C для минимум 48 часов для облегчения полной белка денатурации. Вихрь с настольная вихрь присвоено максимальная скорость 1 минут дважды в день.
- Измерить концентрацию белка решения с помощью bicinchoninic кислоты assay, отрегулировать коллаген я концентрации до 2,0-2,5 мг/мл, добавив 0,1% раствором уксусной кислоты, и хранить при 4 ° C.
Примечание: Коллаген я раствор может храниться в течение одного-двух лет. - (Необязательно) Центрифуга коллаген я решение на 2000 x g за 1 час при 4 ° C и использовать полупрозрачные Топ дроби (примерно половина объема), для достижения оптически ясно коллаген гели в разделе 4.
2. рассечение вестибулярных и слуховых органов
- Усыпить беременных мышей любого штамма с двуокиси углерода в соответствии с протоколом, утвержденным соответствующими институциональный уход животных и использование Комитета16. Извлечение и обезглавить эмбрионов.
Примечание: Lfng-CreERT2/tdTomato мышей может использоваться чтобы позволить постоянное маркировки поддержки клеток под воздействием 4-hydroxytamoxifen17. - Простерилизуйте все рабочие поверхности и рассечение инструментов, включая две пары #5 щипцы и волосы нож18, путем очистки их с 70% этиловом спирте.
- Разделите каждый руководитель в две половинки путем введения продольный разрез с лезвием стерильным скальпель или с помощью двух пар #5 щипцов. Экстракт височной кости, которые содержат внутренний уши19и поместите их в 15 мл ледяной Хэнк сбалансированного солевого раствора (HBSS) в чашку Петри 60-мм. Держите блюдо на льду.
Примечание: Успешно используются эмбрионы на различных этапах от E13.5 до E18.5. - (Необязательно) Вымойте внутренний уши, осторожно встряхивая их в конической Тюбик 50 мл, содержащие 30 мл ледяной HBSS и замена HBSS три или четыре раза. Держите трубку на льду.
Примечание: Этот шаг ограничивает возможные загрязнения культуры ткани и быстро приносит температуры на 4 ° C, который предотвращает смерть деградации и клеток тканей. - С помощью двух пар тонкой #5 щипцов, отделить внутренний уши от височной кости и передачи уши, три или четыре в то время, в чашке Петри 60-мм, наполненный ледяной HBSS.
- Вскрыть вестибулярных органов чувств.
- Ориент уши медиальной стороне вверх и найти utricle. С двумя парами #5 щипцами удалите хряща, окружающих вестибулярных органов. Аккуратно разорвать вестибулярного нерва, связь между utricle и мешочки и полукружных каналов, как показано на рисунке 1. Осторожно потяните utricle и прилагаемый ампулы Улучшенный и горизонтальных полукружных каналов из уха.
Примечание: Этот метод может использоваться на внутренний уши этапов E16.5 - E18.5. Сохраняйте фрагменты хряща для раздела 3 ниже.
- Ориент уши медиальной стороне вверх и найти utricle. С двумя парами #5 щипцами удалите хряща, окружающих вестибулярных органов. Аккуратно разорвать вестибулярного нерва, связь между utricle и мешочки и полукружных каналов, как показано на рисунке 1. Осторожно потяните utricle и прилагаемый ампулы Улучшенный и горизонтальных полукружных каналов из уха.
- Вскрыть улитки.
- Удаление хрящевой ткани, окружающие органы слуха с двумя парами #5 щипцов. Аккуратно разорвать связь между улитковый базы и мешочки, как показано на рисунке 1.
Примечание: Для этапов E13.5 - E14.5, смягчить хряща до вскрытия, рассматривая внутренний уши с 0,25% коллагеназы я в растворе фосфат амортизированное saline (PBS) для 5 мин при комнатной температуре. Сохраняйте фрагменты хряща для раздела 3 ниже.
- Удаление хрящевой ткани, окружающие органы слуха с двумя парами #5 щипцов. Аккуратно разорвать связь между улитковый базы и мешочки, как показано на рисунке 1.
- С помощью пипетки 200 мкл оснащены широким антипригарной кончик, передать 30-мм Петри, наполненный среднего роста, состоящий из DMEM/F12 с 33 мм Dglucose, бикарбонат натрия 19 мм, 15 мм 4(2hydroxyethyl) - utricles и cochleae 1piperazineethanesulfonic кислота (HEPES), 1 мм глутамина, никотинамид 1 мм, 20 мг/Л-эпидермального фактора роста, фактор роста фибробластов 20 мг/Л, 10 мг/Л инсулина, трансферрин 5,5 мг/Л и селенит натрия 5 мкг/Л.
- Сохранить utricle подготовки до 3 ч при 37 ° C в инкубатор культуры ткани, загазованность с 5% углекислого газа позволяет заживления порезов в эпителии, во время вскрытия. Улитки препараты должны быть переданы гель коллагена 10 мин после вскрытия.
Примечание: Потому что анатомирование выполняется в ледяной HBSS, нет необходимости предварительно теплой среднего роста до 37 ° C.
3. (необязательно) отрегулируйте коллаген я гель жесткость, добавив различной концентрации хондроцитов
Примечание: Метод для изоляции хондроцитов был изменен от Gosset и др. 20
- Подготовить 1% раствором коллагеназы в стерильных 1 x PBS и хранить 100-200 мкл аликвоты-80 ° c. Размораживание на льду, когда это необходимо, избегая несколько циклов замораживания оттаивания.
- Использование тонкой щипцы для сбора штук оставшихся от рассечения вестибулярных и слуховых органов от 10-12 ушей хрящ. Отдельной соединительной и внутреннего уха ткани хряща. Передать Петри блюдо 30-мм хряща и 300 мкл стерильных роста среднего.
- Используйте стерильным скальпель лезвия или иридэктомия ножницы с тупыми изогнутые советы, чтобы фарш ткани для достижения хряща штук примерно 0,5 мм в длину.
- Добавить коллагеназы я средний с хряща для достижения окончательного фермента концентрации 0,25%. Передача блюдо в инкубатор культуры ткани при 37 ° C, загазованность с 5% углекислого газа. Пипетки, активно используя 1000 мкл накапайте каждые 20 мин до тех пор, пока кусочки хряща отмежеваться и больше не различимы в растворе, затем инкубировать еще 20 мин.
Примечание: В случае utricle препараты хондроцитов изоляции может быть выполнена во время шага 2.9; Она занимает около 2 ч (3-4 дозирования раундов). - Собирать суспензию клеток в 15 мл Конические трубки и отрегулировать громкость до 10 мл с стерильных ПБС. Центрифуга на 800 x g 5 мин при 4 ° C. Удалить супернатант и Ресуспензируйте клетки в 10 мл стерильной ПБС. Центрифуга на 800 x g 5 минут при температуре 4 ° C и удалить супернатант.
Примечание: Важно, чтобы вымыть клетки дважды; любые оставшиеся коллагеназы, я будет переваривать коллагена, который я геля. - С помощью пипетки 200 мкл, добавьте 100 мкл культуры средних клеток гранул и пипетки для нежно ресуспензируйте. Подсчитать ячейки, используя Горяева и поддерживать их на льду до использования.
- Для увеличения жесткости гель, добавить хондроцитов нейтрализованы коллаген я геля раствор (раздел 1) и перемешать быстро распространить клеток на протяжении до застывания геля.
Примечание: Упругости коллагена я гель (мера жесткости), увеличивается линейно с количество хондроцитов Добавлено11. Связь определяется экспериментальным путем линейной функции E = 206· NC + 15, в котором E является упругости в Паскалях и Nc — количество хондроцитов в миллионах. Для подробного протокола для геля измерения жесткости, пожалуйста, обратитесь к оригинальной статьи11.
4. место вестибулярных и слуховых сензорный орган в коллагена, который я гель
- В стерильную пробирку 1,5 мл, подготовить коллагена я полимеризации решение путем смешивания 160 мкл 10 x PBS с фенола Красного pH индикатор, 133 мкл рабочего раствора гидроксида натрия 0,34 М, 70 мкл бикарбоната натрия 0,9 М и 40 мкл 1 М HEPES. Держите трубку на льду.
Примечание: Этот рецепт обеспечивает решение полимеризации, необходимых для подготовки 2 мл коллагена я гель, но может быть расширена при необходимости. - Смесь 100 мкл раствора полимеризации и 400 мкл коллагена я решение на льду, нежно закупорить вверх и вниз в охлажденной 1,5 мл. Для увеличения жесткости гель, добавьте 50 мкл среднего роста, содержащие хондроцитов и смешайте нежно, как описано в разделе 3.
- Передачи 500 мкл нейтрализованы коллагена я решение охлажденные 30-мм Петри с 10-мм стекло дно вставкой или хорошо четыре ну плиты.
Примечание: Важно, чтобы держать все реагенты на льду для предотвращения быстрого и неравномерным полимеризации коллагена I. - Быстро передавать нейтрализованы коллагена cochleae или utricles я решения и отрегулировать органов их желаемой позиции с стерильных волосы нож18 или пара тонкой щипцов.
Примечание: Коллаген я полимеризации становится заметным после 1-2 мин, как это решение становится мутным. - После того, как решение вокруг ткани полимеризуется, место Петри или четырех ну пластина для 20 минут при 37 ° C в инкубатор культуры ткани, загазованность с 5% двуокиси углерода для обеспечения полной полимеризации.
- Добавьте 3 мл среднего роста, с 0,5% плода бычьим сывороточным (ФБС) на Петри блюдо или 500 мкл же среднего за хорошо четыре ну плиты. Сохранение культуры при 37 ° C в инкубатор культуры ткани, загазованность с 5% углекислого газа. При желании, дополнение среднего роста с 10 µM 5-ethynyl-2´ дезоксиуридина (EdU) для обозначения пролиферирующих клеток.
Примечание: Более высокие концентрации FBS может использоваться при необходимости.
5. вирусные инъекции в трехмерной культур вестибулярных и слуховых органов чувств
- Размораживание желаемого вирус на льду и смешивают с раствором Трипановый синий в 0,5 мл Конические трубки для достижения окончательного краситель концентрации 0,05%. Используйте 10-20 x краситель, чтобы избежать значительное разбавление вируса. Держите на льду.
Примечание: Аденовирусы серотип 5 работает лучше всего для заражения вспомогательные клетки в utricle19, тогда как аденоассоциированный вирус Anc80 может заразить клетки обеих волос и поддерживая клетки в utricle и улитки21. - Разбейте кончик иглы стекла, подготовленных на микропипеткой съемник с чистой тонкой щипцами при соблюдении при максимальном увеличении бинокля рассекает микроскопом.
Примечание: Важно оптимизировать параметры на иглу съемник. Иглы с хвостовиком 9 - 12 мм и 20 - 30 мкм отверстия работают лучше всего. - Удаление сензорный орган культуры из инкубатора. Прикрепите иглы для microinjector и заполнить его с 2-3 мкл смеси краски и вирусов. Заранее иглу в сензорный орган наблюдая его под бинокль, рассекает микроскопом.
- Аккуратно диск кончик иглы через мезенхимальных и эпителиальных слои крыши трехмерной утрикулярной культуры. Придать вирусный смесь до тех пор, пока полостей utricle и ампулы заполнить с синей краской.
Примечание: Потому что это позволяет легкий доступ к органов чувств, чашку Петри 10-мм стекло дно является оптимальным для инъекции. - Инкубируйте при 37 ° C в инкубатор культуры ткани, загазованность с 5% углекислого газа.
Примечание: Когда зеленый или красный флуоресцирующий белок используется в Вирусный конструкции, флюоресценция быть очевидной 24 ч после вирусных трансдукции.
Результаты
Вестибулярных и слуховых органов чувств от эмбриональных уши, культивированный в 40-Pa коллагеновые гели, подражая низкую жесткость эмбриональных условия11, сохранять относительно нормальной трехмерной структуры (рис. 1) и поддерживать волосковые клетки и Поддержка клеток (рис. 2 и рис. 3). Хотя поддержка плотность клеток уменьшается более чем на 30% ( t -критерия Стьюдента: n = 4, p < 0,004) и плотность волос клеток снижается на 60% ( t -критерия Стьюдента: n = 5, p < 0.0001) после 3 дней в утрикулярной культур (Рисунок 2 ), площадь более чем в два раза за тот же период времени11 макулы (n = 3, p = 0.0002). Это показывает, что метод для трехмерных культуры, описанные здесь позволяет значительное увеличение числа вспомогательных клеток11, сохраняя при этом 80% существующих волосковых клеток в utricle в течение 3 дней. В трехмерной культур с E14.5 улитки Sox2-положительных клеток-предшественников дифференцировать как морфологически различимых ряда внутренних и внешних волосковых клеток после 3 дней в культуре (рис. 3).
Экспрессия генов можно манипулировать в трехмерной культур вестибулярных и слуховых органов чувств посредством вирусной инфекции. 4hydroxytamoxifen добавляется к питательной среды с лейблом, поддерживая клетки в улитковый эксплантов с E15.5 эмбрионов Lfng-CreERT2/tdTomato мышей17. Инъекции аденовирус типа 5 в Люмене результатов культуры в инфекции поддержки клетки на базе органа (рис. 4A). Инъекции же вирус в просвете утрикулярной культуры с E17.5 эмбриона, результаты главным образом инфекции поддержки клеток на протяжении сенсорные эпителия (Рисунок 4B).

Рисунок 1. Схемы вскрытия и свет микроскопических изображений представитель культур utricle и улитки в трехмерном коллаген я гели. (A) A Схематический рисунок изображает сенсорные эпителия (зеленый) из шести органов рецептор мышиных внутреннего уха. Красные линии разграничения сокращений во время вскрытия utricle и улитки. (B) световой микроскопии изображений изобразить E17.5 utricle (Верхняя панель) и E14.5 улитки (Нижняя панель) встроенный в коллагена я гель и культивировали в течение 48 часов. Масштаб бары представляют 100 мкм. Этот рисунок был изменен с Gnedeva и др. 11 Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
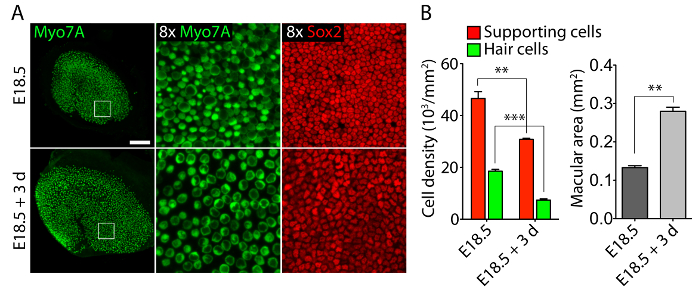
Рисунок 2. Клетки волос и вспомогательные клетки в трехмерной утрикулярной культурах. (A) Confocal микроскопических изображений изобразить E18.5 utricle до эксплантация (верхней панели) и после 3 дней в трехмерной культуре в 40-Pa коллаген я гель (нижней панели). Клетки волос помечены для Myo7A (зеленый) и поддерживая клетки для Sox2 (красный). Линейки шкалы представляет 50 µm. (B) количественной поддержки клеток плотности (красные столбики), плотности волос клеток (зеленые бары) и макулярной области (серые полосы) в E18.5 utricles до эксплантация и после 3 дней в трехмерной органной культуре представлены как средства ± SEMs (p < 0,001 представлена как ** и p < 0,0001 как ***). Этот показатель был изменен с Gnedeva и др. 11 Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
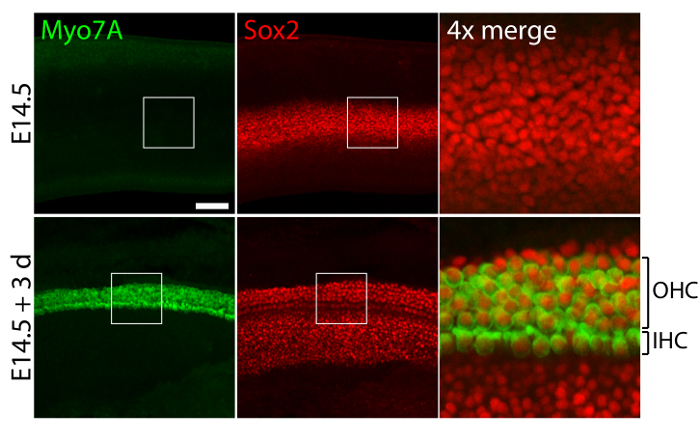
На рисунке 3. Клетки волос и вспомогательные клетки в трехмерной улитковый культур. Конфокальный микроскопических изображений изобразить E14.5 улитки до эксплантация (верхней панели) и после 3 дней в трехмерной культуре в 40-Pa коллаген я гель (нижней панели). Myo7A и Sox2 позитивных, внутренние волосковые клетки (IHC) и внешние клетки волос (OHC) появляются в строках 4-5 после 3 дней в культуре. Вспомогательные клетки также помечены для Sox2 (красный). Линейки шкалы представляет 25 µm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4. Представитель результаты вирусных инфекций в культурах трехмерной органа улитки и utricle. (A) инъекций аденовирус серотипа 5 в трехмерной улитковый культур создана от Lfng-CreERT2/tdTomato26 E15.5 эмбрионы результаты в инфекции (GFP, зеленый) поддержки клетки (помидоры, красный) на базе органа. Сенсорные эпителия, разделенное в серый. Линейки шкалы представляет 100 мкм. (B) идентичных инъекции в трехмерном утрикулярной культуры создан из эмбриона E17.5 приводит к инфекции (GFP, зеленый) поддержки клетки (Sox2, красный) на протяжении всего органа. Сенсорные эпителия, разделенное в серый. Линейки шкалы представляет собой 100 мкм. Этот показатель был изменен с Gnedeva и др. 11 Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Молекулярных сигналов, которые mediate рост и дифференцировку в внутреннего уха во время разработки были широко изучены5,6,,78,9,10. Однако доказательства, полученные из системы утрикулярной модель предполагает, что механические сигналы, почувствовал через соединения клеток и активации Бегемот сигнализации, также играть важную роль в этих процессах2,11, 22. Кроме того, как экструзии умирающие клетки волос от чувственного эпителия и последующее формирование новых сенсорных рецепторов через transdifferentiation может повлиять на механической силы, воспринимается остаточной, поддерживая клетки, вызывая их чтобы повторно ввести клеточного цикла в процессе регенерации. Система трехмерного культуры, описанные здесь обеспечивает экспериментальные средства расследования роли механической силы роста управления во время разработки внутреннего уха11 и, потенциально, роль же силы во время клетки волос Регенерация. Кроме того, этот подход облегчает вирусная инфекция, которая обеспечивает метод изменения экспрессии генов в эпителии чувств, что позволяет сочетание механических и молекулярные манипуляции для расследования роста и регенерации в уха органов чувств11.
Ограничения метода относятся минимальной информации, имеющейся на эндогенных сил и механическим воздействиям во время эмбриогенеза внутреннего уха. Измерения жесткости ткани в развивающемся внутреннем ухе не существует к нашим знаниям; Поэтому трудно оценить, какой жесткости коллагена, я гель соответствует условиям в естественных условиях . Наши наблюдения и модель предлагаю силы, противостоящие рост utricle низкий первоначально и увеличивает как орган приближается к его окончательный размер11. Поэтому мы предполагаем, что коллаген, которую я гель без хондроцитов является физиологически соответствующих субстрата в котором культура эмбриональных вестибулярных и слуховых органов чувств.
Трехмерные культуры метод, описанный здесь индуцирует образование новых клеток поддержки в утрикулярной макуле11, а также поддержание более 80% клеток волос после 3 дней в культуре (рис. 2). Метод, таким образом, является лучшей альтернативой для двумерных культур utricle, в которых лишь 40-50% волосковых клеток выжить после первых 24 ч в культуры5,8и может использоваться для изучения уязвимости клетки волос и Регенерация в пробирке.
Хотя мы продемонстрировать формирование анатомически различимых организованной строк внутренней и внешней волосковых клеток в искусственный орган о Корти, больше работы требуется определить, поддерживает ли нормальной трехмерной культуры метод, описанный здесь улитковый проток удлинение во время процесса конвергентных расширение (CE)23,24,25. CE представляет собой весьма динамичный процесс с участием клеток миграции, перегруппировки и ячеек контакта изменения26 , могут быть затронуты внешней силы, производимые в тканях, окружающих развивающихся улитковый проток. Этот метод сохранения относительно нормальной трехмерной ткани архитектуры и потенциально может быть полезным для изучения CE в пробирке.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Мы благодарим д-р A. Jacobo, д-р J. Сальви и A. Petelski за их вклад в оригинальных исследований, на котором основан этот протокол. Мы также благодарим J. Лам и W. Makmura для оказания технической помощи и животноводства. Мы признаем NIDCD обучения Грант T32 DC009975, NIDCD Грант R01DC015530, Робертсон терапевтического фонда развития и Фонд семьи Карузо для финансирования. Наконец мы признаем поддержку от Говард Хьюз медицинский институт, следователь которого является доктор Хадспет.
Материалы
| Name | Company | Catalog Number | Comments |
| #10 Surgical Blades | Miltex | 4-110 | |
| #5 Forceps | Dumont | 11252-20 | |
| 100 mm Petri dish | Sigma | P5856-500EA | |
| 250 uL large orifice pipette tips | USA Scientific | 1011-8406 | |
| 30 mm glass-bottom Petri dish | Matsunami Glass USA Corporation | D35-14-1.5-U | |
| 4 well plate | Thermo Fisher Scientific | 176740 | |
| 4-Hydroxytamoxifen | Sigma | H7904 | |
| 60 mm Petri dish | Thermo Fisher Scientific | 123TS1 | |
| Acetic acid | Sigma | 537020 | |
| Ad-GFP | Vector Biolabs | 1060 | |
| Anti-GFP, chicken IgY fraction | Invitrogen | A10262 | |
| Anti-Myo7A | Proteus Biosciences | 25-6790 | |
| Anti-Sox2 Antibody (Y-17) | Santa Cruz | sc-17320 | |
| Bicinchoninic acid assay | Thermo Fisher Scientific | 23225 | |
| Click-iT EdU Alexa Fluor 647 Imaging Kit | Thermo Fisher Scientific | C10340 | |
| Collagenase I | Gibco | 17100017 | |
| D-glucose | Sigma | G8270 | |
| DMEM/F12 | Gibco | 11320033 | |
| Epidermal growth factor | Sigma | E9644 | |
| Fetal Bovine Serum (FBS) | Thermo Fisher Scientific | 16140063 | |
| Fibroblast growth factor | Sigma | F5392 | |
| Flaming/Brown Micropipette Puller | Sutter Instrument | P-97 | |
| Glutamine | Sigma | G8540 | |
| HBSS | Gibco | 14025092 | |
| Hemocytometer | Daigger | EF16034F | |
| HEPES | Sigma | H4034 | |
| Insulin | Sigma | I3536 | |
| Iridectomy scissors | Zepf Medical Instruments | 08-1201-10 | |
| Microinjector | Narishige | IM-6 | |
| Nicotinamide | Sigma | N0636 | |
| PBS (10X), pH 7.4 | Gibco | 70011044 | |
| PBS (1X), pH 7.4 | Gibco | 10010023 | |
| Phenol Red pH indicator | Sigma | P4633 | |
| Pure Ethanol, 200 Proof | Decon Labs | 2716 | |
| RFP antibody | ChromoTek | 5F8 | |
| Sodium bicarbonate | Sigma | S5761 | |
| Sodium hydroxide | Sigma | S8045 | |
| Sodium selenite | Sigma | S5261 | |
| Tabletop vortex | VWR | 97043-562 | |
| Transferrin | Sigma | T8158 | |
| Trypan blue | Sigma | T6146 |
Ссылки
- Oesterle, E. C., Tsue, T. T., Reh, T. A., Rubel, E. W. Hair-cell regeneration in organ cultures of the postnatal chicken inner ear. Hear Res. 70 (1), 85-108 (1993).
- Meyers, J. R., Corwin, J. T. Shape change controls supporting cell proliferation in lesioned mammalian balance epithelium. J Neurosci Off J Soc Neurosci. 27 (16), 4313-4325 (2007).
- Cunningham, L. L. The adult mouse utricle as an in vitro preparation for studies of ototoxic-drug-induced sensory hair cell death. Brain Res. 1091 (1), 277-281 (2006).
- Warchol, M. E., Lambert, P. R., Goldstein, B. J., Forge, A., Corwin, J. T. Regenerative proliferation in inner ear sensory epithelia from adult guinea pigs and humans. Science. 259 (5101), 1619-1622 (1993).
- Lin, V., Golub, J. S., Nguyen, T. B., Hume, C. R., Oesterle, E. C., Stone, J. S. Inhibition of Notch activity promotes nonmitotic regeneration of hair cells in the adult mouse utricles. J Neurosci Off J Soc Neurosci. 31 (43), 15329-15339 (2011).
- Wu, J., et al. Co-regulation of the Notch and Wnt signaling pathways promotes supporting cell proliferation and hair cell regeneration in mouse utricles. Sci Rep. 6, 29418 (2016).
- Chai, R., et al. Wnt signaling induces proliferation of sensory precursors in the postnatal mouse cochlea. Proc Natl Acad Sci U S A. 109 (21), 8167-8172 (2012).
- Wang, T., et al. Lgr5+ cells regenerate hair cells via proliferation and direct transdifferentiation in damaged neonatal mouse utricle. Nat Commun. 6, 6613 (2015).
- Doetzlhofer, A., White, P. M., Johnson, J. E., Segil, N., Groves, A. K. In vitro growth and differentiation of mammalian sensory hair cell progenitors: a requirement for EGF and periotic mesenchyme. Dev Biol. 272 (2), 432-447 (2004).
- White, P. M., Stone, J. S., Groves, A. K., Segil, N. EGFR signaling is required for regenerative proliferation in the cochlea: conservation in birds and mammals. Dev Biol. 363 (1), 191-200 (2012).
- Gnedeva, K., Jacobo, A., Salvi, J. D., Petelski, A. A., Hudspeth, A. J. Elastic force restricts growth of the murine utricle. eLife. 6, (2017).
- Aragona, M., et al. A mechanical checkpoint controls multicellular growth through YAP/TAZ regulation by actin-processing factors. Cell. 154 (5), 1047-1059 (2013).
- Dong, J., et al. Elucidation of a universal size-control mechanism in Drosophila and mammals. Cell. 130 (6), 1120-1133 (2007).
- Low, B. C., Pan, C. Q., Shivashankar, G. V., Bershadsky, A., Sudol, M., Sheetz, M. YAP/TAZ as mechanosensors and mechanotransducers in regulating organ size and tumor growth. FEBS Lett. 588 (16), 2663-2670 (2014).
- Zhao, B., et al. Inactivation of YAP oncoprotein by the Hippo pathway is involved in cell contact inhibition and tissue growth control. Genes Dev. 21 (21), 2747-2761 (2007).
- . . AVMA Guidelines for the Euthanasia of Animals: 2013 Edition. , (2013).
- Semerci, F., et al. Lunatic fringe-mediated Notch signaling regulates adult hippocampal neural stem cell maintenance. eLife. 6, (2017).
- Tuan, R. S., Lo, C. W. Developmental biology protocols. Methods in molecular biology. , 137 (2000).
- Brandon, C. S., Voelkel-Johnson, C., May, L. A., Cunningham, L. L. Dissection of adult mouse utricle and adenovirus-mediated supporting-cell infection. J Vis Exp JoVE. (61), (2012).
- Gosset, M., Berenbaum, F., Thirion, S., Jacques, C. Primary culture and phenotyping of murine chondrocytes. Nat Protoc. 3 (8), 1253-1260 (2008).
- Landegger, L. D., et al. A synthetic AAV vector enables safe and efficient gene transfer to the mammalian inner ear. Nat Biotechnol. 35 (3), 280-284 (2017).
- Burns, J. C., et al. Reinforcement of cell junctions correlates with the absence of hair cell regeneration in mammals and its occurrence in birds. J Comp Neurol. 511 (3), 396-414 (2008).
- Wang, J., et al. Regulation of polarized extension and planar cell polarity in the cochlea by the vertebrate PCP pathway. Nat Genet. 37 (9), 980-985 (2005).
- Chacon-Heszele, M. F., Ren, D., Reynolds, A. B., Chi, F., Chen, P. Regulation of cochlear convergent extension by the vertebrate planar cell polarity pathway is dependent on p120-catenin. Dev Camb Engl. 139 (5), 968-978 (2012).
- Yamamoto, N., Okano, T., Ma, X., Adelstein, R. S., Kelley, M. W. Myosin II regulates extension, growth and patterning in the mammalian cochlear duct. Dev Camb Engl. 136 (12), 1977-1986 (2009).
- Tada, M., Heisenberg, C. -. P. Convergent extension: using collective cell migration and cell intercalation to shape embryos. Dev Camb Engl. 139 (21), 3897-3904 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены