Method Article
Culture organotypique en trois dimensions des organes sensoriels vestibulaires et auditives
Dans cet article
Résumé
Cultures organotypique tridimensionnelle de l’utricule murin et la cochlée en défricher collagène j’ai gélifie morphologie tissulaire innée preserve optiquement, permettant une stimulation mécanique au moyen d’ajustement de la rigidité de la matrice et permettent la livraison de gène induite par le virus.
Résumé
Les organes sensoriels de l’oreille interne sont difficiles à étudier chez les mammifères en raison de leur inaccessibilité aux manipulations expérimentales et d’observation optique. En outre, bien que des techniques de culture existants permettent des perturbations biochimiques, ces méthodes ne fournissent pas un moyen d’étudier les effets de la force mécanique et la rigidité des tissus pendant le développement de l’oreille interne des organes sensoriels. Nous décrivons ici une méthode pour la culture organotypique tridimensionnelle de l’utricule murine intact et cochlée qui permet de surmonter ces limitations. La technique pour l’ajustement d’une rigidité de la matrice tridimensionnelle décrite ici permet la manipulation de la force élastique s’opposant à la croissance des tissus. Cette méthode peut donc être utilisée pour étudier le rôle des forces mécaniques au cours du développement de l’oreille interne. En outre, les cultures permettent la livraison de gène induite par le virus, qui peut être utilisée pour des expériences de gain - et perte de fonction. Cette méthode de culture préserve innée des cellules ciliées et des cellules et sert comme une alternative potentiellement supérieure à la culture traditionnelle à deux dimensions des organes sensoriels vestibulaires et auditives.
Introduction
L’étude de la plupart des aspects du développement des organes de mammifères a été facilitée par les systèmes in vitro . Deux méthodes principales sont maintenant utilisées pour la culture des organes sensoriels vestibulaires : flottant1 et adhérentes2 préparations. Les deux méthodes permettent l’étude des cellules ciliées vulnérabilités3 et régénération1,4 in vitro. En outre, le rôle du développement de l’encoche5,6, Wnt7,8et facteur de croissance épidermique receptor (EGFR)9,10 , signalisation des cascades dans l’oreille interne ont été établi, en partie, à l’aide de in vitro de cultures de l’épithélium sensoriel. Cependant, la différenciation et la croissance des cellules sont contrôlés, non seulement par le biais de signalisation par morphogènes, mais aussi par le biais de signaux physiques et mécaniques tels que des contacts intercellulaires, la rigidité de la matrice extracellulaire et mécaniques d’étirement ou constriction. Le rôle de ces stimuli mécaniques est difficile à étudier dans les pays en développement oreille interne in vivo. En outre, les méthodes actuelles de culture flottante et adhérentes ne conviennent pas pour ces études in vitro. Nous décrivons ici une méthode pour la culture organotypique tridimensionnelle en collagène I gelées de raideur variable. Cette méthode est en grande partie conserve l’architecture in vivo des organes sensoriels vestibulaires et cochléaires et permet d’étudier les effets de la force mécanique sur la croissance et la différenciation11.
Parce que les stimuli mécaniques sont connus pour activer les événements moléculaires en aval, tels que l’hippopotame signalisation voie12,13,14,15, il est important d’être capable de combiner la stimulation mécanique avec les manipulations génétiques et biochimiques. La méthode de culture décrite ici permet la livraison de gène induite par le virus et peut donc être utilisée pour étudier la signalisation mécanique et moléculaire au cours de l’oreille interne développement11.
Protocole
Toutes les méthodes décrites ici ont été approuvés par les comités de l’Université Rockefeller d’utilisation et animalier et de l’University of Southern California.
1. (facultative) préparation du collagène I Solution de Tendons de Mouse-tail
Remarque : Collagène I solutions sont disponibles dans le commerce. Suivez les instructions du fabricant pour la préparation du gel.
- Euthanasier des souris jeunes adultes (âgés de 3 à 5 semaines) 5-10 de toute souche de type sauvage avec le dioxyde de carbone conformément au protocole approuvé par les institutionnels animalier et Comité d’utilisation pertinente16. Recueillir les queues et les désinfecter en immergeant dans l’éthanol à 70 % pour un minimum de 4 h à température ambiante.
Remarque : Incubation pendant plus de 48 h doit être évitée car il crée des déshydratation excessive des tissus et entrave le processus d’extraction de tendon. - Enlever la peau de chaque queue en introduisant une coupe longitudinale avec une lame de bistouri Swann-Morton et rétraction de la peau entière avec une pince. Transférer la queue dénudée à une boîte de Pétri 100 mm rempli d’éthanol pur à 70 % et les couper en segments de 10 mm.
Remarque : Rejeter les parties plus fine de la queue, qui sont difficile à manipuler. - Avec une pincette, fixez chaque segment de la queue au fond de la boîte de Pétri et utiliser une deuxième paire de pinces fines pour extraire les tendons de la queue un à la fois. Fibres du tendon individuels devraient émerger avec une résistance minimale.
Remarque : Vieux, terne #5 pinces fonctionnent bien pour cette étape. - Préparer 100 mL d’une solution à 0,1 % (en volume) d’acide acétique dans l’eau stérile, moléculaire-grade et ajouter 10 mL de cette solution à une boîte de Petri stérile de 100 mm. Transférer les tendons à la boîte de Pétri et laisser pendant 1 h à température ambiante pour dénaturer le collagène I.
- Utilisez une paire de ciseaux scalpel ou iridectomie stérile avec embouts émoussées, courbes mâcher le tendon en fragments de 1 à 2 mm. Transférer les tendons hachées dans un tube stérile de 50 mL et ajouter 0,1 % d’acide acétique pour porter le volume à 50 mL.
Remarque : Utilisez quatre ou cinq queues pour chaque 50 mL d’acide pour obtenir un collagène I concentration de 2,0 à 2,5 mg/mL. - Réfrigérer le collagène j’ai une solution à 4 ° C pendant au moins 48 h pour faciliter la dénaturation de la protéine complète. Vortex avec un vortex sur table défini, à la vitesse maximale pendant 1 minute, deux fois par jour.
- Mesurer la concentration de protéines de la solution d’essai sur les acides bicinchoninic, ajustez le collagène I concentration de 2,0 à 2,5 mg/mL en ajoutant la solution à 0,1 % d’acide acétique et magasin à 4 ° C.
Remarque : Collagène I solution peut être conservée pendant un à deux ans. - (Facultatif) Centrifuger le collagène j’ai une solution à 2 000 x g pendant 1 h à 4 ° C et l’utilisation de la fraction supérieure translucide (environ la moitié du volume), pour atteindre optiquement transparent collagène gels à la Section 4.
2. dissection des organes vestibulaires et auditives
- Euthanasier des souris enceintes de toute souche avec du dioxyde de carbone conformément au protocole approuvé par les institutionnels animalier et Comité d’utilisation pertinente16. Extraire et décapiter les embryons.
Remarque : LNFG-CreERT2/tdTomato souris peuvent être utilisés pour permettre le marquage permanent des cellules lors de l’exposition à 4-hydroxytamoxifen17de soutien. - Stériliser tous les surfaces de travail et les instruments de dissection, y compris deux paires de pinces #5 et un couteau de cheveux18, en les nettoyant avec l’éthanol à 70 %.
- Diviser chaque tête en deux moitiés en introduisant une coupe longitudinale avec une lame de bistouri stérile ou à l’aide de deux paires de pinces #5. Extrait de l’OS temporal, qui contiennent de l' oreille interne19et rangez-les dans 15 mL de solution saline équilibrée de Hank glacee (HBSS) dans un plat de Pétri de 60 mm. Garder le plat sur la glace.
Remarque : Embryons à différents stades de E13.5 à E18.5 ont été utilisées avec succès. - (Facultatif) Laver l’oreille interne en les secouant doucement dans un tube conique de 50 mL contenant 30 mL HBSS glacée et remplacement du HBSS trois ou quatre fois. Maintenir le tube sur la glace.
Remarque : Cette étape limite la contamination possible de la culture de tissus et apporte rapidement la température à 4 ° C, ce qui empêche le tissu la dégradation et la mort cellulaire. - À l’aide de deux paires de pinces fines de #5, séparer l’oreille interne de l’OS temporal et transférer les oreilles, trois ou quatre à la fois, dans une boite de Petri de 60 mm rempli de HBSS glacée.
- Disséquer les organes sensoriels vestibulaires.
- Orientez le côté médial de l’oreille vers le haut et repérez l’utricule. Avec deux paires de pinces #5, retirez le cartilage entourant les organes vestibulaires. Doucement rompre la connexion entre les canaux semi-circulaires, l’utricule et saccule nerf vestibulaire, tel qu’illustré à la Figure 1. Tirez doucement sur l’utricule et la joints ampoules des canaux semi-circulaires supérieures et horizontales de l’oreille.
Remarque : Cette méthode peut être utilisée sur l’oreille interne des stades E16.5 - E18.5. Préserver les fragments de cartilage pour la Section 3 ci-dessous.
- Orientez le côté médial de l’oreille vers le haut et repérez l’utricule. Avec deux paires de pinces #5, retirez le cartilage entourant les organes vestibulaires. Doucement rompre la connexion entre les canaux semi-circulaires, l’utricule et saccule nerf vestibulaire, tel qu’illustré à la Figure 1. Tirez doucement sur l’utricule et la joints ampoules des canaux semi-circulaires supérieures et horizontales de l’oreille.
- Disséquer la cochlée.
- Retirez le tissu cartilagineux qui entoure l’organe de l’audition avec deux paires de pinces #5. Doucement rompre la connexion entre la base cochléaire et le saccule, comme illustré à la Figure 1.
Remarque : Pour les stades E13.5 - E14.5, adoucissent le cartilage avant dissection en traitant l’intérieur oreilles avec 0,25 % collagénase je dans une solution saline tamponnée au phosphate (PBS) pendant 5 min à température ambiante. Préserver les fragments de cartilage pour la Section 3 ci-dessous.
- Retirez le tissu cartilagineux qui entoure l’organe de l’audition avec deux paires de pinces #5. Doucement rompre la connexion entre la base cochléaire et le saccule, comme illustré à la Figure 1.
- À l’aide d’une pipette de 200 µL muni d’un embout large antiadhésif, transférer les utricules et le limaçon à une boîte de Pétri 30 mm rempli de milieu de croissance comprenant DMEM/F12 additionné de 33 mM Dglucose, bicarbonate de sodium 19 mM, 15 mM 4(2hydroxyethyl)- acide 1piperazineethanesulfonic (HEPES), glutamine 1 mM, 1 mM nicotinamide, facteur de croissance épidermique de 20 mg/L, facteur de croissance fibroblastique de 20 mg/L, 10 mg/L d’insuline, la transferrine 5,5 mg/L et sélénite de sodium 5 µg/L.
- Maintenir les préparatifs de l’utricule pendant 3 h à 37 ° C dans un incubateur de culture tissulaire gazé avec 5 % de dioxyde de carbone pour permettre la guérison des coupures dans l’épithélium a présenté au cours de la dissection. Préparations de la cochlée devraient être transférées au gel de collagène 10 min après la dissection.
Remarque : La dissection est exécuté dans HBSS glacée, il n’y a pas besoin de Préchauffer le milieu de culture à 37 ° C.
3. (facultatif) ajuster le collagène je Gel rigidité en ajoutant diverses Concentrations de Chondrocytes
Remarque : Modification de la méthode pour l’isolement des chondrocytes de Gosset et al. 20
- Préparer une solution de 1 % de collagénase je stérile 1 x PBS et magasin de 100-200 µL d’extraits à-80 ° C. Dégivrage sur la glace quand nécessaire, en évitant les multiples cycles de gel-dégel.
- Utilisation fine pince à recueillir les morceaux de cartilage laissés par la dissection des organes vestibulaires et auditives du 10-12 oreilles. Tissus conjonctifs et oreille interne distincts du cartilage. Transférer le cartilage dans un plat de Pétri de 30 mm et ajouter 300 µL de milieu de croissance stérile.
- Utilisez une paire de ciseaux iridectomie ou de la lame du bistouri stérile avec pointes courbées émoussés pour émincer le tissu pour obtenir des morceaux de cartilage environ 0,5 mm de longueur.
- Ajouter collagénase j’ai au milieu avec cartilage pour atteindre une concentration de l’enzyme finale de 0,25 %. Placer la capsule dans un incubateur de culture tissulaire à 37 ° C, gazés au dioxyde de carbone de 5 %. Pipette vigoureusement en utilisant une pipette 1 000 µL toutes les 20 min jusqu'à ce que les morceaux de cartilage se dissocient et ne sont plus distinguables dans la solution, puis incuber pendant un 20 min supplémentaire.
Remarque : Dans le cas de la préparation de l’utricule, chondrocyte isolement peut être effectuée au cours de l’étape 2.9 ; Il faut compter environ 2 h (3-4 tours pipetage). - Recueillir la suspension de cellules dans un tube conique de 15 mL et ajuster le volume à 10 mL avec du PBS stérile 1 x. Centrifuger à 800 x g pendant 5 min à 4 ° C. Retirez le surnageant et remettre en suspension les cellules dans 10 mL de PBS stérile 1 x. Centrifuger à 800 g pendant 5 min à 4 ° C et éliminer le surnageant.
Remarque : Il est essentiel de laver les cellules à deux reprises ; une collagénase restant j’ai digèrera le collagène que je gel. - À l’aide d’une pipette de 200 µL, ajouter 100 µL de milieu de culture pour le culot cellulaire et la pipette doucement pour remettre en suspension. Compter les cellules à l’aide d’un hémocytomètre et de les entretenir sur l’avant de la glace de l’utiliser.
- Pour augmenter la rigidité de gel, ajouter des chondrocytes au collagène neutralisé je gel solution (Section 1) et mélanger rapidement pour distribuer les cellules tout au long du gel avant solidification.
Remarque : Le module d’élasticité du collagène I gel (une mesure de rigidité), augmente linéairement avec le nombre des chondrocytes ajouté11. La relation est décrite par la fonction linéaire déterminée expérimentalement E = 206· NC + 15, où E est le module d’élasticité en Pascals et Nc est le nombre des chondrocytes en millions de dollars. Pour un protocole détaillé pour le gel des mesures de rigidité veuillez consulter l' initial de l’article11.
4. Placer l’organe sensoriel vestibulaire ou sonore dans un collagène que je Gel
- Dans un tube stérile de 1,5 mL, préparer le collagène j’ai solution de polymérisation en mélangeant 160 µL de PBS de x 10 avec indicateur de pH de rouge de phénol, 133 µL de solution d’hydroxyde de sodium de 0,34 M, 70 µL de bicarbonate de sodium 0,9 M et 40 µL de 1 M HEPES. Maintenir le tube sur la glace.
Remarque : Cette recette constitue la solution de polymérisation nécessaire pour préparer 2 mL de collagène je gel, mais peut être adapté selon les besoins. - Mélanger 100 µL de solution de polymérisation et de 400 µL de collagène j’ai solution sur la glace en pipettant également doucement de haut en bas dans un tube de 1,5 mL réfrigéré. Pour augmenter la rigidité de gel, ajouter 50 µL de milieu de culture contenant des chondrocytes et mélanger doucement, comme décrit dans la Section 3.
- Transférer 500 µL du collagène neutralisée j’ai solution un réfrigérés Pétri de 30 mm avec un fond en verre 10 mm insert ou d’un puits d’une plaque quatre puits.
Remarque : Il est essentiel de garder tous les réactifs sur la glace pour empêcher la polymérisation rapide et inégale du collagène I. - Transférer rapidement le limaçon ou utricules vers le collagène neutralisé j’ai solution et ajuster les organes à leur position désirée avec un couteau à cheveux stérile18 ou paire de pinces fines.
Remarque : Collagène I polymérisation devient perceptible après 1-2 min alors que la solution devient trouble. - Après que la solution autour du tissu a polymérisé, placez la boîte de Pétri ou plaque de quatre puits pendant 20 min à 37 ° C dans un incubateur de culture tissulaire gazé au dioxyde de carbone de 5 % pour assurer une polymérisation complète.
- Ajouter 3 mL de milieu de culture additionné de 0,5 % sérum fœtal (SVF) par boîte de Pétri ou 500 µL du même milieu / puits d’une plaque quatre puits. Maintenir la culture à 37 ° C dans un incubateur de culture tissulaire gazé au dioxyde de carbone de 5 %. Si vous le désirez, compléter le milieu de croissance avec 10 µM 5-éthynyl-2´-déoxyuridine (EdU) pour marquer les cellules en prolifération.
Remarque : Des concentrations plus élevées de FBS peuvent être utilisées si vous le souhaitez.
5. virales Injections dans des Cultures en trois dimensions des organes sensoriels vestibulaires et auditives
- Dégivrer le virus désiré sur la glace et mélanger avec le bleu trypan solution dans un tube conique 0,5 mL d’obtenir une concentration finale de colorant de 0,05 %. Colorant de 10-20 x permet d’éviter une dilution importante du virus. Rester sur la glace.
Remarque : Adénovirus sérotype 5 fonctionne mieux infecter des cellules de soutien dans l’utricule19, alors que le virus adeno-associé Anc80 peut infecter les cellules ciliées et de soutenir des cellules à l’utricule et la cochlée21. - Casser la pointe d’une aiguille de verre préparée sur un terrain de micropipettes avec une pince fine propre tout en l’observant dans le grossissement des jumelles binoculaire.
Remarque : Il est important d’optimiser les paramètres de l’extracteur de l’aiguille. Aiguilles 9 - 12 mm queue cylindrique et 20 - 30 µm ouvertures fonctionnent le mieux. - Sortir une culture d’organe sensoriel de l’incubateur. Fixer l’aiguille à la microinjector et remplissez-le avec 2-3 µL du mélange de colorant et virus. Avancer l’aiguille dans l’organe sensoriel tout en l’observant sous les jumelles binoculaire.
- Doucement rouler la pointe de l’aiguille à travers les couches mésenchymateuses et épithéliales du toit d’une culture utriculaire en trois dimensions. Injecter le mélange viral jusqu'à ce que les cavités de l’utricule et ampoules remplissent avec le colorant bleu.
Remarque : Parce qu’il permet un accès facile à des organes sensoriels, un fond en verre 10 mm boîte de Pétri est optimal pour les injections. - Incuber à 37 ° C dans un incubateur de culture tissulaire gazé au dioxyde de carbone de 5 %.
Remarque : Lorsque la protéine fluorescente verte ou rouge est utilisée dans la construction virale, la fluorescence est apparent 24h après transduction virale.
Résultats
Organes sensoriels vestibulaires et auditives d’oreilles embryonnaires, cultivées en collagène 40-Pa j’ai gels imitant faible rigidité des conditions embryonnaires11, conserver les structures tridimensionnelles relativement normales (Figure 1) et l’entretien des cellules ciliées et soutenir des cellules (Figure 2 et Figure 3). Bien que soutenant la densité cellulaire diminue de plus de 30 % (test tde Student : n = 4, p < 0,004) et la densité des cellules de cheveux diminue de 60 % (test tde Student : n = 5, p < 0,0001) après 3 jours de cultures utriculaire (Figure 2 ), la région de la macula plus que doubler sur la même période de temps11 (n = 3, p = 0,0002). Cela démontre que la méthode de culture tridimensionnelle décrite ici permet une augmentation significative du nombre de soutenir des cellules11, tout en conservant 80 % des cellules de cheveux existants dans l’utricule sur une période de 3 jours. Dans les cultures en trois dimensions établies à partir d’E14.5 cochlée, les cellules progénitrices Sox2-positif différencient comme morphologiquement distinctes rangées de cellules ciliées internes et externes après 3 jours de culture (Figure 3).
L’expression des gènes peut être manipulée dans des cultures en trois dimensions des organes sensoriels vestibulaires et auditives au moyen d’une infection virale. 4hydroxytamoxifen est ajouté au milieu de culture à étiquette cellules de soutien dans les explants cochléaires établies à partir d’embryons E15.5 de LNFG-CreERT2/tdTomato souris17. Injection d’adénovirus de type 5 dans la lumière des résultats de la culture dans l’infection de cellules à base de l’orgue (Figure 4A) de soutien. Injection du même virus dans la lumière de la culture utriculaire établie à partir d’embryons E17.5, résultats principalement dans l’infection des cellules tout au long de l’épithélium sensoriel (Figure 4B) de soutien.

La figure 1. Diagrammes schématiques des dissections et microscope photonique images des cultures représentatives de l’utricule et la cochlée en collagène en trois dimensions j’ai gélifie. Schéma de principe (A), A dépeint l’épithélium sensoriel (vert) des six organes récepteurs de l’oreille interne murine. Les lignes rouges délimitent les coupes a présenté au cours de la dissection d’un utricule et la cochlée. (B) microscopie optique images illustrent la E17.5 utricule (panneau du haut) et la cochlée E14.5 (panneau inférieur) incorporé dans le collagène I gel et cultivé pendant 48 h. Les barres d’échelle représentent 100 µm. Ce chiffre a été modifié par Gnedeva et al. 11 S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
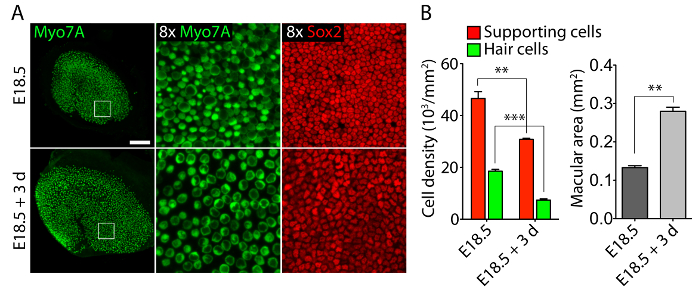
La figure 2. Cellules ciliées et des cellules de soutien dans les trois dimensions cultures utriculaire. (A) Microscopie Confocal images illustrent un utricule E18.5 avant l’explantation (panneaux supérieure) et après 3 jours dans une culture tridimensionnelle en collagène 40-Pa je gel (panneaux inférieurs). Cellules ciliées sont étiquetés pour Myo7A (verts) et soutenir les cellules pour Sox2 (rouge). La barre d’échelle représente 50 µm. (B) Quantifications de soutenir des densités cellulaires (barres rouges), la densité de cellules ciliées (barres vertes) et les zones maculaires (barres grises) dans des utricules E18.5 avant l’explantation et après que 3 jours de culture de l’orgue en trois dimensions sont représenté comme moyen ± SEMs (p < 0,001 est représenté comme ** et p < 0,0001 comme ***). Ce chiffre a été modifié par Gnedeva et al. 11 S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
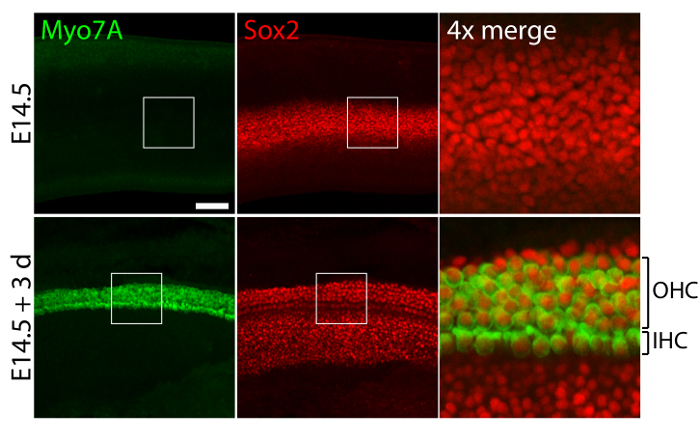
La figure 3. Cellules ciliées et des cellules de soutien dans les cultures cochléaires tridimensionnels. Microscope confocal images illustrent une cochlée E14.5 avant l’explantation (panneaux supérieure) et après 3 jours dans une culture tridimensionnelle en collagène 40-Pa je gel (panneaux inférieurs). Cellules ciliées internes de Myo7A - et Sox2 positives (IHC) et des cellules ciliées (externes CCE) apparaissent dans les 4-5 rangées après 3 jours de culture. Cellules de soutien sont également étiquetés pour Sox2 (rouges). La barre d’échelle représente 25 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

La figure 4. Des résultats représentatifs des infections virales dans les cultures d’organes en trois dimensions de la cochlée et l’utricule. (A) Injection d’adénovirus sérotype 5 cultures cochléaire en trois dimensions établi de LNFG-CreERT2/tdTomato26 E15.5 résultats d’embryons dans l’infection (GFP, vert) de cellules (tomate, rouge) à la base de l’organe de soutien. L’épithélium sensoriel est délimitée en gris. La barre d’échelle représente 100 µm. (B) une injection identique dans une culture utriculaire en trois dimensions établies à partir d’un embryon E17.5 se traduit par une infection (GFP, vert) de cellules (Sox2, rouge) de soutien tout au long de l’orgue. L’épithélium sensoriel est délimitée en gris. La barre d’échelle représente 100 µm. Ce chiffre a été modifié par Gnedeva et al. 11 S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Les signaux moléculaires qui médiat de la croissance et la différenciation dans l’oreille interne au cours du développement ont été étudiés intensivement5,6,7,8,9,10. Toutefois, les données obtenues dans le système utriculaire modèle suggèrent que signaux mécaniques, sentis à travers les jonctions cellulaires et l’activation de la signalisation de Hippo, également jouent un rôle important dans ces processus2,11, 22. en outre, tant l’extrusion de la mort des cellules ciliées de l’épithélium sensoriel et la formation subséquente de nouveaux récepteurs sensoriels par le biais de transdifférenciation peuvent affecter la force mécanique, captée par les résidus de cellules, ce qui leur fait de soutien à réintégrer le cycle cellulaire pendant la régénération. Le système de culture en trois dimensions décrit ici fournit un moyen expérimental d’enquêter sur le rôle de force mécanique au contrôle de la croissance au cours de l’oreille interne développement11 et, potentiellement, le rôle de la même force au cours des cellules ciliées régénération. En outre, l’approche facilite l’infection virale qui fournit une méthode de modification de l’expression des gènes dans l’épithélium sensoriel, ce qui permet une combinaison de manipulations mécaniques et moléculaires pour l’étude de la croissance et la régénération en la d’organes sensoriels de l’oreille11.
Les limites de la méthode concernent les informations minimales disponibles sur les forces endogènes et les stimuli mécaniques au cours de l’embryogénèse de l’oreille interne. Il n’existent pas de mesures de la rigidité des tissus de l’oreille interne en voie de développement à notre connaissance ; Il est donc difficile d’estimer quelle rigidité du collagène I gel correspond à des conditions in vivo . Nos observations et le modèle suggèrent que la force s’opposant à la croissance de l’utricule est faible au départ et augmente sa taille finale11l’approche de l’orgue. Par conséquent, nous émettons l’hypothèse qu’un collagène que je gel sans chondrocytes est un substrat physiologiquement pertinent permettant la culture embryonnaires organes sensoriels vestibulaires et auditives.
La méthode de culture en trois dimensions décrite ici induit la formation de nouvelles cellules de soutien dans la macule utriculaire11, tout en maintenant plus de 80 % des cellules ciliées après 3 jours de culture (Figure 2). Par conséquent, la méthode représente une alternative supérieure aux cultures bidimensionnels de l’utricule, dans laquelle seul 40 à 50 % des cellules ciliées survivre après les premières 24 h en culture5,8et peut être utilisé pour étudier les cellules ciliées vulnérabilités et la régénération in vitro.
Bien que nous démontrons la formation d’anatomiquement distinctes rangées organisées d’intérieures et extérieures des cellules ciliées de l’organe de Corti cultivé, plus de travail est nécessaire pour déterminer si la méthode de culture en trois dimensions décrite ici prend en charge normale allongement du canal cochléaire au cours du processus d’extension convergente (EC)23,24,25. CE est un processus très dynamique impliquant cell migration, réarrangement et cellules changements contact26 qui est susceptible d’être affecté par la force externe produite par les tissus entourant le canal cochléaire en voie de développement. Cette méthode préserve-t-il architecture relativement normale tissu tridimensionnel et pourrait être bénéfique pour l’étude de CE in vitro.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions le Dr A. Jacobo, Dr J. Salvi et A. Petelski pour leurs contributions à la recherche originale sur laquelle se fonde le présent protocole. Nous remercions également J. lamas et W. Makmura pour l’assistance technique et de l’élevage. Nous reconnaissons subvention du NIDCD formation T32 DC009975, NIDCD accorder R01DC015530, Robertson thérapeutique Development Fund et la Fondation de la famille Caruso pour financement. Enfin, nous reconnaissons le soutien du Howard Hughes Medical Institute, dont le Dr Hudspeth est un enquêteur.
matériels
| Name | Company | Catalog Number | Comments |
| #10 Surgical Blades | Miltex | 4-110 | |
| #5 Forceps | Dumont | 11252-20 | |
| 100 mm Petri dish | Sigma | P5856-500EA | |
| 250 uL large orifice pipette tips | USA Scientific | 1011-8406 | |
| 30 mm glass-bottom Petri dish | Matsunami Glass USA Corporation | D35-14-1.5-U | |
| 4 well plate | Thermo Fisher Scientific | 176740 | |
| 4-Hydroxytamoxifen | Sigma | H7904 | |
| 60 mm Petri dish | Thermo Fisher Scientific | 123TS1 | |
| Acetic acid | Sigma | 537020 | |
| Ad-GFP | Vector Biolabs | 1060 | |
| Anti-GFP, chicken IgY fraction | Invitrogen | A10262 | |
| Anti-Myo7A | Proteus Biosciences | 25-6790 | |
| Anti-Sox2 Antibody (Y-17) | Santa Cruz | sc-17320 | |
| Bicinchoninic acid assay | Thermo Fisher Scientific | 23225 | |
| Click-iT EdU Alexa Fluor 647 Imaging Kit | Thermo Fisher Scientific | C10340 | |
| Collagenase I | Gibco | 17100017 | |
| D-glucose | Sigma | G8270 | |
| DMEM/F12 | Gibco | 11320033 | |
| Epidermal growth factor | Sigma | E9644 | |
| Fetal Bovine Serum (FBS) | Thermo Fisher Scientific | 16140063 | |
| Fibroblast growth factor | Sigma | F5392 | |
| Flaming/Brown Micropipette Puller | Sutter Instrument | P-97 | |
| Glutamine | Sigma | G8540 | |
| HBSS | Gibco | 14025092 | |
| Hemocytometer | Daigger | EF16034F | |
| HEPES | Sigma | H4034 | |
| Insulin | Sigma | I3536 | |
| Iridectomy scissors | Zepf Medical Instruments | 08-1201-10 | |
| Microinjector | Narishige | IM-6 | |
| Nicotinamide | Sigma | N0636 | |
| PBS (10X), pH 7.4 | Gibco | 70011044 | |
| PBS (1X), pH 7.4 | Gibco | 10010023 | |
| Phenol Red pH indicator | Sigma | P4633 | |
| Pure Ethanol, 200 Proof | Decon Labs | 2716 | |
| RFP antibody | ChromoTek | 5F8 | |
| Sodium bicarbonate | Sigma | S5761 | |
| Sodium hydroxide | Sigma | S8045 | |
| Sodium selenite | Sigma | S5261 | |
| Tabletop vortex | VWR | 97043-562 | |
| Transferrin | Sigma | T8158 | |
| Trypan blue | Sigma | T6146 |
Références
- Oesterle, E. C., Tsue, T. T., Reh, T. A., Rubel, E. W. Hair-cell regeneration in organ cultures of the postnatal chicken inner ear. Hear Res. 70 (1), 85-108 (1993).
- Meyers, J. R., Corwin, J. T. Shape change controls supporting cell proliferation in lesioned mammalian balance epithelium. J Neurosci Off J Soc Neurosci. 27 (16), 4313-4325 (2007).
- Cunningham, L. L. The adult mouse utricle as an in vitro preparation for studies of ototoxic-drug-induced sensory hair cell death. Brain Res. 1091 (1), 277-281 (2006).
- Warchol, M. E., Lambert, P. R., Goldstein, B. J., Forge, A., Corwin, J. T. Regenerative proliferation in inner ear sensory epithelia from adult guinea pigs and humans. Science. 259 (5101), 1619-1622 (1993).
- Lin, V., Golub, J. S., Nguyen, T. B., Hume, C. R., Oesterle, E. C., Stone, J. S. Inhibition of Notch activity promotes nonmitotic regeneration of hair cells in the adult mouse utricles. J Neurosci Off J Soc Neurosci. 31 (43), 15329-15339 (2011).
- Wu, J., et al. Co-regulation of the Notch and Wnt signaling pathways promotes supporting cell proliferation and hair cell regeneration in mouse utricles. Sci Rep. 6, 29418 (2016).
- Chai, R., et al. Wnt signaling induces proliferation of sensory precursors in the postnatal mouse cochlea. Proc Natl Acad Sci U S A. 109 (21), 8167-8172 (2012).
- Wang, T., et al. Lgr5+ cells regenerate hair cells via proliferation and direct transdifferentiation in damaged neonatal mouse utricle. Nat Commun. 6, 6613 (2015).
- Doetzlhofer, A., White, P. M., Johnson, J. E., Segil, N., Groves, A. K. In vitro growth and differentiation of mammalian sensory hair cell progenitors: a requirement for EGF and periotic mesenchyme. Dev Biol. 272 (2), 432-447 (2004).
- White, P. M., Stone, J. S., Groves, A. K., Segil, N. EGFR signaling is required for regenerative proliferation in the cochlea: conservation in birds and mammals. Dev Biol. 363 (1), 191-200 (2012).
- Gnedeva, K., Jacobo, A., Salvi, J. D., Petelski, A. A., Hudspeth, A. J. Elastic force restricts growth of the murine utricle. eLife. 6, (2017).
- Aragona, M., et al. A mechanical checkpoint controls multicellular growth through YAP/TAZ regulation by actin-processing factors. Cell. 154 (5), 1047-1059 (2013).
- Dong, J., et al. Elucidation of a universal size-control mechanism in Drosophila and mammals. Cell. 130 (6), 1120-1133 (2007).
- Low, B. C., Pan, C. Q., Shivashankar, G. V., Bershadsky, A., Sudol, M., Sheetz, M. YAP/TAZ as mechanosensors and mechanotransducers in regulating organ size and tumor growth. FEBS Lett. 588 (16), 2663-2670 (2014).
- Zhao, B., et al. Inactivation of YAP oncoprotein by the Hippo pathway is involved in cell contact inhibition and tissue growth control. Genes Dev. 21 (21), 2747-2761 (2007).
- . . AVMA Guidelines for the Euthanasia of Animals: 2013 Edition. , (2013).
- Semerci, F., et al. Lunatic fringe-mediated Notch signaling regulates adult hippocampal neural stem cell maintenance. eLife. 6, (2017).
- Tuan, R. S., Lo, C. W. Developmental biology protocols. Methods in molecular biology. , 137 (2000).
- Brandon, C. S., Voelkel-Johnson, C., May, L. A., Cunningham, L. L. Dissection of adult mouse utricle and adenovirus-mediated supporting-cell infection. J Vis Exp JoVE. (61), (2012).
- Gosset, M., Berenbaum, F., Thirion, S., Jacques, C. Primary culture and phenotyping of murine chondrocytes. Nat Protoc. 3 (8), 1253-1260 (2008).
- Landegger, L. D., et al. A synthetic AAV vector enables safe and efficient gene transfer to the mammalian inner ear. Nat Biotechnol. 35 (3), 280-284 (2017).
- Burns, J. C., et al. Reinforcement of cell junctions correlates with the absence of hair cell regeneration in mammals and its occurrence in birds. J Comp Neurol. 511 (3), 396-414 (2008).
- Wang, J., et al. Regulation of polarized extension and planar cell polarity in the cochlea by the vertebrate PCP pathway. Nat Genet. 37 (9), 980-985 (2005).
- Chacon-Heszele, M. F., Ren, D., Reynolds, A. B., Chi, F., Chen, P. Regulation of cochlear convergent extension by the vertebrate planar cell polarity pathway is dependent on p120-catenin. Dev Camb Engl. 139 (5), 968-978 (2012).
- Yamamoto, N., Okano, T., Ma, X., Adelstein, R. S., Kelley, M. W. Myosin II regulates extension, growth and patterning in the mammalian cochlear duct. Dev Camb Engl. 136 (12), 1977-1986 (2009).
- Tada, M., Heisenberg, C. -. P. Convergent extension: using collective cell migration and cell intercalation to shape embryos. Dev Camb Engl. 139 (21), 3897-3904 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon