Method Article
Culturas Organotypic tridimensionales de órganos sensoriales vestibulares y auditivas
En este artículo
Resumen
Culturas organotypic tridimensional del utrículo murino y cóclea en ópticamente claro colágeno geles preservar tejido natural morfología, permiten estimulación mecánica mediante ajuste de la rigidez de la matriz y permitan de genes mediada por virus.
Resumen
Los órganos sensoriales del oído interno son desafiantes para estudiar en los mamíferos debido a su inaccesibilidad a la manipulación experimental y observación óptica. Por otra parte, aunque las técnicas de cultivo existentes permiten perturbaciones bioquímicas, estos métodos no proporcionan un medio para estudiar los efectos de fuerza mecánica y rigidez del tejido durante el desarrollo de los órganos sensoriales del oído interno. Aquí se describe un método de cultura organotypic tridimensional del utrículo murino intacto y cóclea que supera estas limitaciones. La técnica para el ajuste de una rigidez de la matriz tridimensional que se describe aquí permite la manipulación de la fuerza elástica contra crecimiento del tejido. Por lo tanto, este método puede utilizarse para estudiar el papel de las fuerzas mecánicas durante el desarrollo del oído interno. Además, las culturas permiten entrega de genes mediada por virus, que puede ser utilizada para experimentos de ganancia y pérdida de función. Este método de cultivo conserva innata de las células ciliadas y las células y sirve como una alternativa potencialmente superior a la tradicional cultura bidimensional de órganos sensoriales vestibulares y auditivos.
Introducción
El estudio de la mayoría de los aspectos del desarrollo del órgano de los mamíferos ha sido facilitado por sistemas in vitro . Ahora se utilizan dos métodos principales para el cultivo de órganos sensoriales vestibulares: flotante1 y adherente2 preparados. Ambos métodos permiten la investigación de la célula de pelo vulnerabilidades3 regeneración1,4 y in vitro. Además, el papel del desarrollo de la muesca5,67,de Wnt8y factor de crecimiento epidérmico receptor (EGFR)9,10 señalización cascadas en el oído interno tiene se ha establecido, en parte, mediante el uso de cultivos en vitro de epitelio sensorial. Sin embargo, se controlan la diferenciación y crecimiento celular, no sólo a través de la señalización por morfógenos, sino también a través de estímulos físicos y mecánicos como contactos intercelulares, la rigidez de la matriz extracelular y mecánicos de estiramiento o constricción. El papel de tales estímulos mecánicos es un desafío para investigar en el desarrollo del oído interno en vivo. Por otra parte, los métodos existentes de cultura libre-flotación y adherentes no son adecuados para estos estudios in vitro. Aquí describimos un método de cultura organotypic tridimensional de colágeno geles de rigidez variable. En gran parte, este método conserva la arquitectura en vivo de los órganos sensoriales vestibulares y cocleares y permite la investigación de los efectos de la fuerza mecánica en el crecimiento y la diferenciación11.
Debido a estímulos mecánicos son conocidos para activar eventos moleculares posteriores, como el hipopótamo señalización vía12,13,14,15, es importante ser capaz de combinar la estimulación mecánica con manipulaciones bioquímicas y genéticas. El método de cultivo que se describe aquí permite la entrega de genes mediada por virus y puede ser utilizado para el estudio de mecánicos y moleculares de señalización durante el desarrollo de oído interno11.
Protocolo
Todos los métodos aquí descritos han sido aprobados por el cuidado Animal y comités de uso de la Universidad de Rockefeller y de la Universidad de California del sur.
1. (opcional) preparación del colágeno I solución de tendones Mouse-tail
Nota: Colágeno las soluciones están disponibles comercialmente. Siga las instrucciones del fabricante para la preparación del gel.
- Eutanasia a ratones del adulto joven (3-5 semanas) de 5-10 de cualquier cepa de tipo salvaje con dióxido de carbono según el protocolo aprobado por el Comité de uso y cuidado institucional del Animal relevantes16. Recoger las colas y desinfectar sumergiendo en etanol al 70% durante un mínimo de 4 h a temperatura ambiente.
Nota: Incubación por más de 48 h debe evitarse, ya que resulta en deshidratación excesiva del tejido y dificulta el proceso de extracción del tendón. - Retire la piel de cada cola introduciendo un corte longitudinal con una hoja de bisturí y retrayendo la piel todo con pinzas. Transferencia de las colas sin piel en un plato de Petri de 100 mm lleno de etanol al 70% limpio y cortado en segmentos de 10 mm.
Nota: Desechar las partes más finas de las colas, que son difíciles de manipular. - Con unas pinzas, Asegure cada segmento de la cola a la parte inferior de la caja Petri y usar un segundo par de Pinzas finas para extraer los tendones de la cola una a la vez. Las fibras individuales del tendón deberán surgir con resistencia mínima.
Nota: Fórceps #5 viejo, sordo funcionan bien para este paso. - Preparar 100 mL de una solución al 0.1% (por volumen) de ácido acético en agua estéril grado molecular y añadir 10 mL de esta solución a un plato de Petri de 100 mm estériles. Transferir los tendones a la placa de Petri y dejar durante 1 hora a temperatura ambiente para desnaturalizar el colágeno I.
- Utilice una tijera estéril de bisturí o iridectomía con puntas romas, curva para picar el tendón en fragmentos de 1-2 mm. Transferir los tendones picaditos a un tubo estéril de 50 mL y Añadir ácido acético al 0.1% para llevar el volumen a 50 mL.
Nota: Utilice cuatro o cinco colas por cada 50 mL de ácido para lograr un colágeno concentración de 2.0-2.5 mg/mL. - Refrigere el colágeno solución a 4 ° C durante un mínimo de 48 h para facilitar la desnaturalización de la proteína completa. Vortex con un vórtex mesa situado a la máxima velocidad durante 1 minuto dos veces al día.
- Medir la concentración de la solución usando el análisis de ácido bicinchoninic, ajustar el colágeno I concentración a 2.0-2.5 mg/mL mediante la adición de solución al 0.1% de ácido acético y almacenar a 4 ° C.
Nota: Colágeno solución se puede conservar por uno o dos años. - (Opcional) Centrifugue el colágeno solución a 2.000 x g durante 1 h a 4 ° C y usar geles de la fracción superior translúcida (aproximadamente de la mitad del volumen), para conseguir colágeno ópticamente claro en la sección 4.
2. disección de los órganos vestibulares y auditivas
- Eutanasia a ratones embarazadas de cualquier tensión con dióxido de carbono según el protocolo aprobado por el Comité de uso y cuidado institucional del Animal relevantes16. Extraer y decapitar a los embriones.
Nota: Lfng CreERT2/tdTomato ratones pueden usarse para permitir el etiquetado permanente de apoyar a las células a la exposición 4-hydroxytamoxifen17. - Esterilizar todos los superficies de trabajo e instrumentos de disección, incluyendo dos pares de #5 pinzas y cuchillo pelo18, limpiar con etanol al 70%.
- Dividir cada cabeza en dos mitades mediante la introducción de un corte longitudinal con una hoja de bisturí estéril o con dos pares de pinzas #5. Extraer los huesos temporales, que contienen los oídos interno19y colocarlos en 15 mL de solución salina equilibrada fría de Hank (HBSS) en caja Petri de 60 mm. Mantener el plato en el hielo.
Nota: Embriones en una serie de etapas desde E13.5 E18.5 se han utilizado con éxito. - (Opcional) Lavar los oídos interno agitando suavemente les en un tubo cónico de 50 mL que contenga 30 mL helado HBSS y reemplazar la HBSS tres o cuatro veces. Mantenga el tubo en hielo.
Nota: Este paso limita la posible contaminación de la cultura de tejido y lleva rápidamente la temperatura a 4 ° C, que impide que el tejido la degradación y la muerte celular. - Usando dos pares de Pinzas finas para #5, separar las orejas del interior del hueso temporal y transferir las orejas, tres o cuatro a la vez, en un plato de Petri de 60 mm con HBSS helada.
- Disecar los órganos sensoriales vestibulares.
- Orientar el lado medial de la orejas para arriba y busque el utrículo. Con dos pares de pinzas #5, quitar el cartílago que rodea los órganos vestibulares. Suavemente separa el nervio vestibular, la conexión entre el utrículo y el sáculo y los canales semicirculares, como se muestra en la figura 1. Tire el utrículo y el ámpula adjunta de los canales semicirculares superiores y horizontales de la oreja.
Nota: Este método puede utilizarse en interior de etapas E16.5 - E18.5. Preservar los fragmentos de cartílago para la sección 3 más abajo.
- Orientar el lado medial de la orejas para arriba y busque el utrículo. Con dos pares de pinzas #5, quitar el cartílago que rodea los órganos vestibulares. Suavemente separa el nervio vestibular, la conexión entre el utrículo y el sáculo y los canales semicirculares, como se muestra en la figura 1. Tire el utrículo y el ámpula adjunta de los canales semicirculares superiores y horizontales de la oreja.
- Diseccionar la cóclea.
- Retire el tejido cartilaginoso que rodea el órgano de la audición con dos pares de pinzas #5. Suavemente separa la conexión entre la base coclear y el sáculo, como se muestra en la figura 1.
Nota: Para etapas E13.5 - E14.5, suavizan el cartílago antes de la disección por el tratamiento interno oídos con colagenasa 0.25% I en solución salina tamponada con fosfato (PBS) por 5 min a temperatura ambiente. Preservar los fragmentos de cartílago para la sección 3 más abajo.
- Retire el tejido cartilaginoso que rodea el órgano de la audición con dos pares de pinzas #5. Suavemente separa la conexión entre la base coclear y el sáculo, como se muestra en la figura 1.
- Utilizando una pipeta de 200 μL cabido con una punta ancha antiadherente, transferir a un plato de Petri de 30 mm con medio de cultivo compuesto por DMEM/F12 suplementado con 33 mM DGlucosa, bicarbonato de sodio de 19 mM, 15 mM 4(2hydroxyethyl) - el utricles y cócleas 1piperazineethanesulfonic ácido (HEPES), glutamina 1 mM, nicotinamida de 1 mM, 20 mg/L factor de crecimiento epidérmico, factor de crecimiento fibroblástico de 20 mg/L, 10 mg/L insulina, transferrina de 5.5 mg/L y selenito de sodio de 5 μg/L.
- Mantener los preparativos del utrículo de hasta 3 h a 37 ° C en una incubadora de cultivo de tejidos gaseada con 5% de dióxido de carbono para permitir la cicatrización de los cortes en el epitelio introducidas durante la disección. Preparaciones de cóclea deben ser transferidas al gel de colágeno 10 min después de la disección.
Nota: Ya que la disección se realiza en HBSS helada, no hay ninguna necesidad de precalentar el medio de cultivo a 37 ° C.
3. (opcional) ajuste colágeno Gel rigidez mediante la adición de concentraciones variables de condrocitos
Nota: Fue modificado el método para el aislamiento de condrocitos de Gosset et al. 20
- Preparar una solución de 1% de colagenasa en estéril 1 x PBS y tienda 100-200 μL partes alícuotas a-80 ° C. Descongela el hielo cuando sea necesario, evitando múltiples ciclos de hielo-deshielo.
- Uso finas pinzas para recoger los pedazos de cartílago de la disección de los órganos vestibulares y auditivos de 10-12 orejas. Tejidos conectivos y del oído interno separados del cartílago. El cartílago de la transferencia a un plato de Petri de 30 mm y añadir 300 μL de medio de cultivo estéril.
- Utilice unas tijeras de hoja o iridectomía estéril de bisturí con puntas romas y curvadas para picar el tejido para lograr piezas de cartílago aproximadamente 0,5 mm de longitud.
- Añadir colagenasa I al medio con cartílago para lograr una concentración de la enzima final del 0,25%. Transferir el plato a una incubadora de cultivo de tejidos a 37 ° C gas 5% dióxido de carbono. Pipeta vigorosamente utilizando una pipeta de 1000 μl cada 20 min hasta pedazos de cartílago se disocian y no son distinguibles en la solución, luego incubar un 20 minutos adicionales.
Nota: En el caso de las preparaciones del utrículo, aislamiento de condrocitos se puede realizar en el paso 2.9; tarda aproximadamente 2 horas (3-4 rondas de pipeteo). - Recoge la suspensión de células en un tubo cónico de 15 mL y ajustar el volumen a 10 mL con PBS estéril 1 x. Centrifugar a 800 x g durante 5 min a 4 ° C. Quite el sobrenadante y resuspender las células en 10 mL de PBS estéril 1 x. Centrifugue a 800 x g durante 5 min a 4 ° C y eliminar el sobrenadante.
Nota: Es importante lavar las células dos veces; cualquier restante colagenasa que digiero el colágeno que gel. - Utilizando una pipeta de 200 μL, añada 100 μl de medio de cultivo al pellet celular y pipetee suavemente para resuspender. Contar las células usando un hemocitómetro y mantenerlas en antes hielo.
- Para aumentar la rigidez del gel, agregar condrocitos para el colágeno neutralizado gel solución (sección 1) y mezclar rápidamente para distribuir las células en el gel antes de la solidificación.
Nota: El módulo de elasticidad del colágeno (una medida de la rigidez) del gel, aumenta linealmente con el número de condrocitos agregó11. La relación es descrita por la función lineal determinada experimentalmente E = 206· NC + 15, en la que E es el módulo elástico en pascales y Nc es el número de condrocitos en millones. Para un protocolo detallado para gel medidas de rigidez consulte el original artículo11.
4. Coloque el órgano sensorial Vestibular o auditivo en un colágeno que gel
- En un tubo de 1,5 mL estéril, preparación de colágeno I solución de polimerización mediante la mezcla de 160 μl de PBS de x 10 con indicador de pH rojo de fenol, 133 μl 0,34 M de hidróxido de sodio, 70 μl 0,9 M de bicarbonato de sodio y 40 μl de 1 M HEPES. Mantenga el tubo en hielo.
Nota: Esta receta proporciona la solución de polimerización necesaria para preparar 2 mL de colágeno gel, pero puede ampliarse según sea necesario. - Mezclar 100 μl de solución de polimerización y 400 μL de colágeno I solución sobre hielo transfiriendo suavemente hacia arriba y hacia abajo en un tubo de 1,5 mL refrigerado. Para aumentar la rigidez del gel, agregar 50 μl de medio de cultivo que contiene condrocitos y mezclar suavemente como se describe en la sección 3.
- Transferir 500 μl del colágeno neutralizado solución a un plato de Petri de 30 mm enfriada con un relleno de fondo de cristal de 10 mm o a un pozo de una placa de la pozo cuatro.
Nota: Es fundamental guardar todos los reactivos en el hielo para evitar una polimerización rápida y desigual del colágeno I. - Transferir rápidamente las cócleas o utricles al colágeno neutralizado solución y ajustar los órganos a la posición deseada con un pelo estéril cuchillo18 o un par de Pinzas finas.
Nota: Colágeno la polimerización se hace perceptible después de 1-2 min como la solución se vuelve turbia. - Después de la solución alrededor del tejido ha polimerizado, coloque el plato de Petri o la placa de la pozo cuatro por 20 min a 37 ° C en una incubadora de cultivo de tejidos gaseada con 5% de dióxido de carbono para asegurar la polimerización completa.
- Añadir 3 mL de medio de cultivo suplementado con suero bovino fetal (FBS) de 0,5% por caja de Petri o 500 μl del mismo medio por pozo de una placa de la pozo cuatro. Mantener el cultivo a 37 ° C en una incubadora de cultivo de tejidos gaseada con 5% de dióxido de carbono. Si lo desea, complementar el medio de cultivo con 10 μm 5-ethynyl-2´-desoxiuridina (EdU) para etiquetar las células proliferantes.
Nota: Concentraciones más altas de FBS se pueden utilizar si se desea.
5. virales inyecciones en cultivos tridimensionales de órganos sensoriales vestibulares y auditivos
- Descongelar el virus deseado en el hielo y mezclar con solución de azul tripán en un tubo cónico de 0,5 mL para alcanzar una concentración del tinte final de 0.05%. Utilizar tintura de 10-20 x para evitar la dilución sustancial del virus. Mantener en hielo.
Nota: Adenovirus serotipo 5 trabajos mejores para infectar células de soporte en el utrículo19, mientras que virus adeno-asociado Anc80 puede infectar las células de pelo y células de apoyo en el utrículo y la cóclea21. - Romper la punta de una aguja de vidrio preparada en un tirador de la micropipeta con pinzas limpias bien observando en el máximo aumento de un binocular microscopio de disección.
Nota: Es importante optimizar la configuración del extractor de aguja. Agujas con caña del 9 - 12 mm y 20 - 30 μm aberturas funcionan mejor. - Eliminar la cultura de una órgano sensorial de la incubadora. Conecte la aguja a la microinyectora y rellene con 2-3 μl de mezcla de tinte y virus. Avanzar la aguja en el órgano sensorial mientras observa con binoculares microscopio de disección.
- Conduce suavemente la punta de la aguja a través de capas epiteliales y mesenquimales de la azotea de una cultura utricular tridimensional. Inyectar la mezcla viral hasta llenan las cavidades del utrículo y ámpula con colorante azul.
Nota: Ya que permite fácil acceso a los órganos sensoriales, un plato de Petri de fondo de cristal de 10 mm es óptimo para las inyecciones. - Incubar a 37 ° C en una incubadora de cultivo de tejidos gaseada con 5% de dióxido de carbono.
Nota: Cuando la proteína fluorescente verde o roja es utilizada en la estructura viral, la fluorescencia es evidente 24 h después de transducción viral.
Resultados
Órganos sensoriales vestibulares y auditivos de oídos embrionarios, cultivadas en 40 Pa colágeno geles mímico rigidez bajo condiciones embrionarias11, retener relativamente normales estructuras tridimensionales (figura 1) y mantener las células de pelo y apoyo a las células (figura 2 y figura 3). Aunque apoyo la densidad celular disminuye en más del 30% (prueba tde Student: n = 4, p < 0,004) y densidad de la célula de pelo disminuye en un 60% (prueba tde Student: n = 5, p < 0.0001) después de 3 días en culturas utricular (figura 2 ), el área de la mácula más del doble respecto al mismo periodo de tiempo11 (n = 3, p = 0.0002). Esto demuestra que el método de cultivo tridimensional que se describe aquí permite un aumento significativo en el número de apoyar células11, manteniendo el 80% de las células de pelo existentes en el utrículo durante un período de 3 días. En las culturas tridimensionales establecidas de E14.5 cóclea, las células progenitoras de Sox2 positivo distinguen como morfológicamente distinguibles filas de células ciliadas internas y externas después de 3 días en cultivo (figura 3).
Expresión génica puede ser manipulada en cultivos tridimensionales de órganos sensoriales vestibulares y auditivos por medio de la infección viral. 4hydroxytamoxifen se añade al medio de cultivo para etiqueta de apoyar a las células en los explantes cocleares establecidos a partir de embriones E15.5 Lfng CreERT2/tdTomato ratones17. Inyección de adenovirus tipo 5 en la luz de los resultados de la cultura en la infección de las células en la base del órgano (figura 4A) de apoyo. Inyección del virus mismo en la luz de la cultura utricular establecida de E17.5 embrión, resultado sobre todo en infección de apoyar a las células en el epitelio sensorial (figura 4B).

Figura 1. Diagramas esquemáticos de disecciones y luz-microscópico imágenes de culturas representativas del utrículo y cóclea en tridimensional colágeno geles. Dibujo esquemático (A) A retrata los epitelios sensoriales (verde) de los seis órganos receptores del oído interno murino. Las líneas rojas delinean los recortes introducidos durante la disección de un utrículo y la cóclea. Imágenes de microscopía de luz (B) describen el utrículo E17.5 (panel superior) y E14.5 cóclea (panel inferior) en colágeno gel y cultivados durante 48 h. Las barras de escala representan 100 μm. Esta figura ha sido modificada de Gnedeva et al. 11 Haga clic aquí para ver una versión más grande de esta figura.
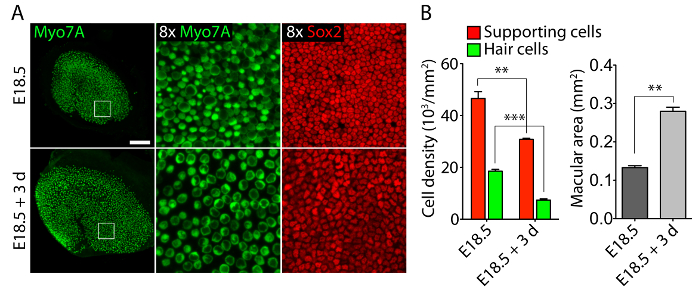
Figura 2. Las células ciliadas y células de soporte en tridimensionales culturas utricular. (A) Microscopio Confocal imágenes retratan un utrículo E18.5 antes de explantación (paneles superiores) y después de 3 días en una cultura tridimensional de colágeno de 40-Pa gel (paneles inferiores). Las células de pelo son etiquetadas para Myo7A (verde) y apoyo a las células de Sox2 (rojo). Representa a la barra de escala 50 μm. (B) cuantificaciones de soportar densidades celulares (barras rojas), densidades de células ciliadas (barras verdes) y áreas maculares (barras grises) en E18.5 utricles antes de explantación y después de 3 días en cultura de órgano tridimensional representado como medios ± SEM (p < 0,001 se representa como ** y p < 0,0001 como ***). Esta figura ha sido modificada de Gnedeva et al. 11 Haga clic aquí para ver una versión más grande de esta figura.
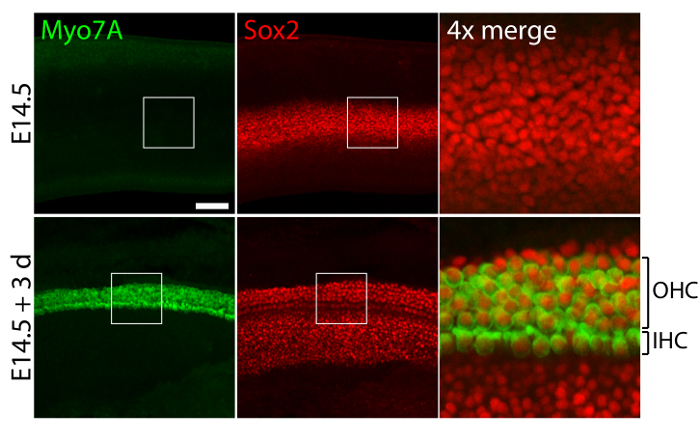
Figura 3. Las células ciliadas y células de soporte en culturas cocleares tridimensionales. Microscopio confocal imágenes retratan una cóclea E14.5 antes de explantación (paneles superiores) y después de 3 días en una cultura tridimensional de colágeno de 40-Pa gel (paneles inferiores). Células internas positivas Myo7A y Sox2 (IHC) y células de pelo externas (OHC) aparecen en filas de 4-5 después de 3 días en la cultura. Células de soporte son también el rótulo de Sox2 (rojo). La barra de escala representa 25 μm. haga clic aquí para ver una versión más grande de esta figura.

Figura 4. Resultados representativos de las infecciones virales en cultivos de órganos tridimensionales de la cóclea y del utrículo. (A) inyección de adenovirus serotipo 5 en culturas cocleares tridimensionales establecido de CreER LfngT2/tdTomato26 E15.5 resultados de embriones (GFP, verde) la infección de las células (tomate rojo) en la base del órgano de apoyo. El epitelio sensorial está delineado en color gris. La barra de la escala representa 100 μm. (B) una inyección idéntica en una cultura utricular tridimensional establecido a partir de un embrión E17.5 resulta en infección (GFP, green) de apoyar a las células (Sox2, rojo) a lo largo del órgano. El epitelio sensorial está delineado en color gris. La barra de la escala representa 100 μm. Esta figura ha sido modificada de Gnedeva et al. 11 Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Las señales moleculares que medie crecimiento y la diferenciación en el oído interno durante el desarrollo se han estudiaron extensivamente5,6,7,8,9,10. Sin embargo, la evidencia obtenida desde el sistema utricular modelo sugiere que señales mecánicas, detectados a través de uniones celulares y la activación de la señalización de hipopótamo, también juegan un papel importante en estos procesos2,11, 22. por otra parte, tanto la extrusión de morir las células ciliadas del epitelio sensorial y la subsecuente formación de nuevos receptores sensoriales mediante transdiferenciación pueden afectar la fuerza mecánica detectada por el residual de apoyar a las células, causando para volver a entrar el ciclo celular durante la regeneración. El sistema de cultivo tridimensional descrito aquí proporciona un medio experimental para investigar tanto el papel de la fuerza mecánica en el control del crecimiento durante el desarrollo de oído interno11 y, potencialmente, el papel de la misma fuerza en la célula de pelo regeneración. Por otra parte, el enfoque facilita la infección viral que proporciona un método de alterar la expresión de genes en el epitelio sensorial, lo que permite una combinación de manipulaciones mecánicas y moleculares para la investigación de crecimiento y la regeneración en el de órganos sensoriales del oído11.
Las limitaciones del método se relacionan con la información mínima disponible sobre las fuerzas endógenas y estímulos mecánicos durante la embriogénesis del oído interno. No existen mediciones de la rigidez del tejido en el oído interno convierte a nuestro conocimiento; por lo tanto es difícil estimar qué rigidez del colágeno gel corresponde a condiciones en vivo . Nuestras observaciones y el modelo sugieren que la fuerza de crecimiento del utrículo de la oposición es baja al principio y aumenta a medida que el órgano acerca a su tamaño final11. Por lo tanto presumimos que un colágeno que gel sin condrocitos es un sustrato fisiológico relevante en que a la cultura embrionarios órganos sensoriales vestibulares y auditivos.
El método de cultivo tridimensional descrito aquí induce la formación de nuevas células de apoyo en la mácula utricular11, manteniendo también sobre 80% de las células de pelo después de 3 días en cultivo (figura 2). El método, por lo tanto, representa una alternativa superior a las culturas de dos dimensiones del utrículo, en la que solamente 40-50% de las células de pelo sobreviven después de las primeras 24 h en cultura5,8y puede utilizarse para el estudio de las vulnerabilidades de la célula de pelo y regeneración in vitro.
Aunque nos demuestran la formación de filas organizadas anatómicamente distinguibles de internas y externas células de pelo en el órgano de Corti cultivado, más trabajo se requiere para determinar si el método de cultivo tridimensional descrito aquí soporta normal alargamiento del conducto coclear durante el proceso de extensión convergente (CE)23,24,25. CE es un proceso altamente dinámico en célula célula, migración y cambio cambios contacto26 que es susceptible de ser afectado por la fuerza externa producida por los tejidos que rodean el conducto coclear en vías de desarrollo. Este método preservar arquitectura de tejido tridimensional relativamente normal y podría ser beneficioso para el estudio de la CE en vitro.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a Dr. A. Jacobo, Dr. J. Salvi y Petelski A. por sus contribuciones a la investigación original en que se basa este protocolo. También agradecemos a Llamas J. y W. Makmura asistencia técnica y agricultura animal. Reconocemos la beca de formación de NIDCD T32 DC009975, NIDCD conceder R01DC015530, Fondo de desarrollo terapéutico de Robertson y la Fundación de la familia Caruso para la financiación. Finalmente, reconocemos el apoyo del Instituto médico de Howard Hughes, que es un investigador Dr. Hudspeth.
Materiales
| Name | Company | Catalog Number | Comments |
| #10 Surgical Blades | Miltex | 4-110 | |
| #5 Forceps | Dumont | 11252-20 | |
| 100 mm Petri dish | Sigma | P5856-500EA | |
| 250 uL large orifice pipette tips | USA Scientific | 1011-8406 | |
| 30 mm glass-bottom Petri dish | Matsunami Glass USA Corporation | D35-14-1.5-U | |
| 4 well plate | Thermo Fisher Scientific | 176740 | |
| 4-Hydroxytamoxifen | Sigma | H7904 | |
| 60 mm Petri dish | Thermo Fisher Scientific | 123TS1 | |
| Acetic acid | Sigma | 537020 | |
| Ad-GFP | Vector Biolabs | 1060 | |
| Anti-GFP, chicken IgY fraction | Invitrogen | A10262 | |
| Anti-Myo7A | Proteus Biosciences | 25-6790 | |
| Anti-Sox2 Antibody (Y-17) | Santa Cruz | sc-17320 | |
| Bicinchoninic acid assay | Thermo Fisher Scientific | 23225 | |
| Click-iT EdU Alexa Fluor 647 Imaging Kit | Thermo Fisher Scientific | C10340 | |
| Collagenase I | Gibco | 17100017 | |
| D-glucose | Sigma | G8270 | |
| DMEM/F12 | Gibco | 11320033 | |
| Epidermal growth factor | Sigma | E9644 | |
| Fetal Bovine Serum (FBS) | Thermo Fisher Scientific | 16140063 | |
| Fibroblast growth factor | Sigma | F5392 | |
| Flaming/Brown Micropipette Puller | Sutter Instrument | P-97 | |
| Glutamine | Sigma | G8540 | |
| HBSS | Gibco | 14025092 | |
| Hemocytometer | Daigger | EF16034F | |
| HEPES | Sigma | H4034 | |
| Insulin | Sigma | I3536 | |
| Iridectomy scissors | Zepf Medical Instruments | 08-1201-10 | |
| Microinjector | Narishige | IM-6 | |
| Nicotinamide | Sigma | N0636 | |
| PBS (10X), pH 7.4 | Gibco | 70011044 | |
| PBS (1X), pH 7.4 | Gibco | 10010023 | |
| Phenol Red pH indicator | Sigma | P4633 | |
| Pure Ethanol, 200 Proof | Decon Labs | 2716 | |
| RFP antibody | ChromoTek | 5F8 | |
| Sodium bicarbonate | Sigma | S5761 | |
| Sodium hydroxide | Sigma | S8045 | |
| Sodium selenite | Sigma | S5261 | |
| Tabletop vortex | VWR | 97043-562 | |
| Transferrin | Sigma | T8158 | |
| Trypan blue | Sigma | T6146 |
Referencias
- Oesterle, E. C., Tsue, T. T., Reh, T. A., Rubel, E. W. Hair-cell regeneration in organ cultures of the postnatal chicken inner ear. Hear Res. 70 (1), 85-108 (1993).
- Meyers, J. R., Corwin, J. T. Shape change controls supporting cell proliferation in lesioned mammalian balance epithelium. J Neurosci Off J Soc Neurosci. 27 (16), 4313-4325 (2007).
- Cunningham, L. L. The adult mouse utricle as an in vitro preparation for studies of ototoxic-drug-induced sensory hair cell death. Brain Res. 1091 (1), 277-281 (2006).
- Warchol, M. E., Lambert, P. R., Goldstein, B. J., Forge, A., Corwin, J. T. Regenerative proliferation in inner ear sensory epithelia from adult guinea pigs and humans. Science. 259 (5101), 1619-1622 (1993).
- Lin, V., Golub, J. S., Nguyen, T. B., Hume, C. R., Oesterle, E. C., Stone, J. S. Inhibition of Notch activity promotes nonmitotic regeneration of hair cells in the adult mouse utricles. J Neurosci Off J Soc Neurosci. 31 (43), 15329-15339 (2011).
- Wu, J., et al. Co-regulation of the Notch and Wnt signaling pathways promotes supporting cell proliferation and hair cell regeneration in mouse utricles. Sci Rep. 6, 29418(2016).
- Chai, R., et al. Wnt signaling induces proliferation of sensory precursors in the postnatal mouse cochlea. Proc Natl Acad Sci U S A. 109 (21), 8167-8172 (2012).
- Wang, T., et al. Lgr5+ cells regenerate hair cells via proliferation and direct transdifferentiation in damaged neonatal mouse utricle. Nat Commun. 6, 6613(2015).
- Doetzlhofer, A., White, P. M., Johnson, J. E., Segil, N., Groves, A. K. In vitro growth and differentiation of mammalian sensory hair cell progenitors: a requirement for EGF and periotic mesenchyme. Dev Biol. 272 (2), 432-447 (2004).
- White, P. M., Stone, J. S., Groves, A. K., Segil, N. EGFR signaling is required for regenerative proliferation in the cochlea: conservation in birds and mammals. Dev Biol. 363 (1), 191-200 (2012).
- Gnedeva, K., Jacobo, A., Salvi, J. D., Petelski, A. A., Hudspeth, A. J. Elastic force restricts growth of the murine utricle. eLife. 6, (2017).
- Aragona, M., et al. A mechanical checkpoint controls multicellular growth through YAP/TAZ regulation by actin-processing factors. Cell. 154 (5), 1047-1059 (2013).
- Dong, J., et al. Elucidation of a universal size-control mechanism in Drosophila and mammals. Cell. 130 (6), 1120-1133 (2007).
- Low, B. C., Pan, C. Q., Shivashankar, G. V., Bershadsky, A., Sudol, M., Sheetz, M. YAP/TAZ as mechanosensors and mechanotransducers in regulating organ size and tumor growth. FEBS Lett. 588 (16), 2663-2670 (2014).
- Zhao, B., et al. Inactivation of YAP oncoprotein by the Hippo pathway is involved in cell contact inhibition and tissue growth control. Genes Dev. 21 (21), 2747-2761 (2007).
- AVMA Guidelines for the Euthanasia of Animals: 2013 Edition. , (2013).
- Semerci, F., et al. Lunatic fringe-mediated Notch signaling regulates adult hippocampal neural stem cell maintenance. eLife. 6, (2017).
- Tuan, R. S., Lo, C. W. Developmental biology protocols. Methods in molecular biology. , Humana Press. Totowa, N.J. 137(2000).
- Brandon, C. S., Voelkel-Johnson, C., May, L. A., Cunningham, L. L. Dissection of adult mouse utricle and adenovirus-mediated supporting-cell infection. J Vis Exp JoVE. (61), (2012).
- Gosset, M., Berenbaum, F., Thirion, S., Jacques, C. Primary culture and phenotyping of murine chondrocytes. Nat Protoc. 3 (8), 1253-1260 (2008).
- Landegger, L. D., et al. A synthetic AAV vector enables safe and efficient gene transfer to the mammalian inner ear. Nat Biotechnol. 35 (3), 280-284 (2017).
- Burns, J. C., et al. Reinforcement of cell junctions correlates with the absence of hair cell regeneration in mammals and its occurrence in birds. J Comp Neurol. 511 (3), 396-414 (2008).
- Wang, J., et al. Regulation of polarized extension and planar cell polarity in the cochlea by the vertebrate PCP pathway. Nat Genet. 37 (9), 980-985 (2005).
- Chacon-Heszele, M. F., Ren, D., Reynolds, A. B., Chi, F., Chen, P. Regulation of cochlear convergent extension by the vertebrate planar cell polarity pathway is dependent on p120-catenin. Dev Camb Engl. 139 (5), 968-978 (2012).
- Yamamoto, N., Okano, T., Ma, X., Adelstein, R. S., Kelley, M. W. Myosin II regulates extension, growth and patterning in the mammalian cochlear duct. Dev Camb Engl. 136 (12), 1977-1986 (2009).
- Tada, M., Heisenberg, C. -P. Convergent extension: using collective cell migration and cell intercalation to shape embryos. Dev Camb Engl. 139 (21), 3897-3904 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados