Method Article
前庭と聴覚の感覚器官の三次元切片培養
要約
三次元切片培養マウス卵形嚢との蝸牛は光学的コラーゲン ゲル保持する生得的な組織形態の私をオフに、マトリックス剛性の調整により機械的刺激を可能にするおよびウイルス媒介性遺伝子配信を許可します。
要約
内耳の感覚器官は、実験操作と光学観測にその到達不能のための哺乳類の研究に挑戦しています。また、既存の培養技術は生化学的摂動ことは、これらのメソッドが、内耳感覚的な器官の開発中に機械的な力と組織剛性の効果を検討するための手段を提供しません。ここでそのままマウス卵形嚢とこれらの制限を克服して蝸牛の三次元培養法について述べる。ここで説明した三次元マトリックス剛性の調整法は、弾性組織の成長に反対の操作を許可します。このメソッドは、内耳開発中に機械的な力の役割を研究するため使用できます。さらに、文化は、利得と損失-の機能実験に使用することができますウイルス媒介性遺伝子配信を許可します。この培養法は、生来の有毛細胞を保持され、支持細胞し前庭と聴覚の感覚器官の伝統的な二次元文化を代替する可能性のある優れた役割を果たします。
概要
哺乳類の器官形成のほとんどの面の研究は、生体外でシステムによって促進されています。2 つの主な方法は今前庭感覚的な器官の培養用: 浮遊1と付着性2準備。両方のメソッドは、有毛細胞の脆弱性3と再生1,4 の生体外の調査を許可します。さらに、ノッチ5,6, Wnt7、8、上皮成長因子受容体 (EGFR)9,10内耳のカスケードをシグナル伝達の発達の役割があります。確立されて、一部、感覚上皮の体外培養を使用しています。しかし、細胞の成長と分化制御、細胞間の連絡先など物理的、機械的な手がかりにも介してモルフォゲン シグナル伝達細胞外マトリックスの剛性と機械的伸張または収縮だけではなく。このような機械的刺激の役割は、発展途上の内耳の生体内で調査するは困難です。また、既存の浮遊・付着性文化メソッドはこのような研究の培養に適してではありません。ここで述べるコラーゲンの三次元培養のため私はゲルのさまざまな剛性。このメソッドは主前庭と蝸牛の感覚器官の生体内でアーキテクチャを保持され、により、増殖・分化11機械力の影響の検討。
力学的刺激は、シグナリング経路12,13,14,15、カバなどの下流の分子イベントをアクティブにする知られているので機械的刺激を組み合わせることができることが重要です。生化学的および遺伝的操作。ここで説明した培養法は、ウイルスを介する遺伝子導入を可能し、内耳開発11時両方の機械的および分子伝達を研究するためすることができます。
プロトコル
ここで説明したすべてのメソッドは、動物のケアおよび使用委員会のロックフェラー大学と南カリフォルニア大学に承認されています。
1 (コラーゲンのオプション) 準備私 Mouse-tail 腱からソリューション
注:コラーゲン私ソリューション、商業的に利用できます。ゲルの準備のための製造元の指示に従ってください。
- 16関連機関動物ケアおよび使用委員会によって承認されたプロトコールに従った二酸化炭素と任意の野生型株の 5-10 若い大人 (3-5 週齢) マウスを安楽死させます。尾を収集し、室温で 4 時間以上の 70% のエタノールの沈没によってそれらを消毒します。
注:過剰な組織の脱水の結果腱抽出プロセスを妨げると、48 時間以上の培養は避けてください。 - 各尾からメスの刃で縦カットを導入し、全体の皮膚を鉗子で取り消しによって皮膚を削除します。100 mm のペトリ皿満ちているきれいな 70% エタノールと 10 mm のセグメントにそれらをカットする皮のツインテールを転送します。
注:操作しにくい尾の薄い部分を破棄します。 - 鉗子を使用して、ペトリ皿の底に尾の各セグメントをセキュリティで保護し、微細鉗子の 2 番目のペアを使用して、一度に 1 つ尾から腱を抽出します。個々 の腱線維が最小限の抵抗で登場。
注:昔、鈍い #5 鉗子は、この手順に適しています。 - 酢酸分子グレードの滅菌水での (ボリューム) で 0.1% 溶液 100 mL を準備し、その溶液 10 mL を滅菌 100 mm のペトリ皿に追加します。ペトリ皿に腱を転送し、コラーゲンを変性する室温で 1 時間私を残します。
- 1-2 mm の断片に腱をミンチに鈍、湾曲した先端の生殖不能のメスや虹彩のはさみを使用します。滅菌の 50 mL チューブにみじん切りにした腱を転送し、0.1% 酢酸 50 mL にボリュームを表示するを追加します。
注:4 つまたは 5 尾各 50 ml コラーゲンを達成するために酸の私 2.0 〜 2.5 mg/mL の濃度です。 - コラーゲンを冷蔵私ソリューションを完全な蛋白質の変性を促進する 48 時間の最小値のための 4 ° C で。卓上の渦と渦は 1 日 2 回 1 分の最大速度に設定します。
- ビシンコニン酸法による液のタンパク質濃度を測定し、コラーゲンを調整私 2.0 〜 2.5 mg/ml 4 ° C で、酢酸とストアの 0.1% 溶液を追加して濃度
注:コラーゲン私 1 ~ 2 年のソリューションを格納できます。 - (省略可能)コラーゲンを遠心分離機私 4 ° C と、半透明トップ画分 (ボリュームの約半分)、光学的に透明なコラーゲンを達成するためには、セクション 4 でゲル使用で 1 時間 2,000 x g でソリューション。
2. 前庭と聴覚器官の解剖
- 16関連機関動物ケアおよび使用委員会によって承認されたプロトコールに従った二酸化炭素と任意のひずみの妊娠マウスを安楽死させます。抽出し、胚の首をはねます。
注:Lfng クレエT2/tdTomato マウスは、支持細胞 4 hydroxytamoxifen17への露出の永久的な表示を可能に使用できます。 - すべての作業面、郭清楽器、#5 鉗子と髪ナイフ18の 2 つのペアを含む 70% エタノールでそれらを洗浄殺菌します。
- #5 鉗子の 2 つのペアを使用して、または生殖不能のメスの刃で縦方向のカットを導入することで二つの半分にそれぞれの頭を分割します。内耳19を含んでいる頭骨を抽出し、冷たいハンクの平衡塩溶液 (HBSS) 60 mm のペトリ皿に 15 mL にそれらを配置します。氷の上の皿を保ちます。
注:E13.5 から E18.5 までの段階の範囲では胚が正常に使用されています。 - (省略可能)軽く 30 mL を含む 50 mL の円錐管にそれらを揺することによって内側の耳を洗って冷たい HBSS、3 〜 4 回、HBSS の取り付け。氷の上の管を保ちます。
注:この手順では、組織培養の可能な汚染を制限し、迅速に、組織の低下と細胞死を防ぐことができます 4 ° C に温度をもたらします。 - 細かい #5 鉗子の 2 つのペアを使用して、側頭骨の内側の耳の区別し、冷たい HBSS でいっぱい 60 mm のペトリ皿に耳、3 つまたは 4 つ同時を転送します。
- 前庭感覚的な器官を解剖します。
- 耳の内側を向き、卵形嚢を探します。#5 鉗子の 2 つのペア、前庭器官の周囲の軟骨を削除します。図 1に示すように、優しく前庭神経、卵形嚢と球形嚢、半規管の接続を断ちます。卵形嚢と耳から優れたと水平半規管の添付ロレンチーニゆっくり引き抜きます。
注:このメソッドは、E16.5 - E18.5 の段階の内側の耳で使用できます。セクション 3 の下の軟骨の断片を保持します。
- 耳の内側を向き、卵形嚢を探します。#5 鉗子の 2 つのペア、前庭器官の周囲の軟骨を削除します。図 1に示すように、優しく前庭神経、卵形嚢と球形嚢、半規管の接続を断ちます。卵形嚢と耳から優れたと水平半規管の添付ロレンチーニゆっくり引き抜きます。
- 蝸牛を解剖します。
- #5 鉗子の 2 つのペアと聴覚器官を取り巻く軟骨組織を削除します。図 1に示すように、優しく蝸牛のベースと球形嚢の間の接続を断ちます。
注:段階 E13.5 - E14.5、内側を扱うことによって解剖前に軟骨を柔らかくために耳 0.25% コラゲナーゼと私のリン酸緩衝生理食塩水 (PBS) 溶液室温で 5 分間。セクション 3 の下の軟骨の断片を保持します。
- #5 鉗子の 2 つのペアと聴覚器官を取り巻く軟骨組織を削除します。図 1に示すように、優しく蝸牛のベースと球形嚢の間の接続を断ちます。
- 広いテフロン加工チップ 200 μ L ピペットを使用して装備、utricles と蝸牛を含む DMEM/F12 33 mM Dglucose、炭酸水素ナトリウム 19 ミリメートル、15 ミリメートル 4(2hydroxyethyl) - を添加した培地で満ちている 30 mm のペトリ皿に転送1piperazineethanesulfonic 酸 (HEPES)、1 mM グルタミン、1 mM ニコチンアミド、20 mg/L 表皮成長因子、20 mg/L 線維芽細胞成長因子、インスリン 10 mg/L、5.5 mg/L トランスフェリン、5 μ g/L ナトリウム亜セレン酸。
- 解剖の時に導入された上皮におけるカットの治癒を許可する 5% 二酸化炭素と毒ガス組織文化のインキュベーターで 37 ° C で 3 h までの卵形嚢準備を維持します。蝸牛の準備は、剥離後コラーゲンゲル 10 分に転送する必要があります。
注:前 37 ° C に成長培地を暖かく必要はありません冷たい HBSS で解剖が実行される、ため
3. (オプション) コラーゲンを調整する軟骨細胞の様々 な濃度を追加することによって剛性をゲル
注:Gossetらから軟骨細胞の分離方法を修正しました20
- コラゲナーゼの 1% 溶液を調製滅菌 1-80 ° C で PBS とストアの 100-200 μ L 因数 x 私霜氷が必要な複数の凍結融解サイクルを回避します。
- 軟骨の部分を収集するために使用微細鉗子は 10-12 の耳から聴覚・前庭器官の解剖から残っています。軟骨から別の結合と内耳の組織。30 mm のペトリ皿に軟骨を転送し、滅菌培 300 μ L を追加します。
- 鈍湾曲した先端の軟骨部分の長さ約 0.5 mm を達成するために組織をミンチに生殖不能のメスのブレードや虹彩のはさみを使用します。
- コラゲナーゼを追加私 0.25% の最終的な酵素濃度を達成するために軟骨の媒体へ。皿を 37 ° C 5% 二酸化炭素と毒ガスで組織文化のインキュベーターに転送します。ピペットの軟骨の部分を切り離して、ソリューションでは、区別は、もはやまで 1,000 μ L ピペット 20 分毎を積極的に使用し、さらに 20 分間インキュベートします。
注:段階 2.9; 卵形嚢製剤の場合軟骨細胞分離を実行できます。約 2 時間 (3-4 ピペッティング ラウンド) がかかります。 - 15 mL コニカル チューブに細胞懸濁液を収集し、滅菌 1x PBS で 10 mL にボリュームを調整します。800 x g で 4 ° C で 5 分間遠心上澄みを除去し、10 mL の滅菌 1 × PBS で細胞を再懸濁します。4 ° C で 5 分間 800 x g で遠心し、上清を除去します。
注:セルを 2 回洗浄することが重要任意の残りコラゲナーゼ コラーゲン ゲルの私を消化します。 - 200 μ L ピペットを使って、細胞ペレットを再懸濁しますに優しくピペットで移しに培養液 100 μ L を追加します。診断を使用してセルをカウントし、使用する前に氷でそれらを維持します。
- ゲル剛性を上げるには、軟骨細胞を追加私はゲル溶液 (セクション 1) と急速にミックスし、中和されたコラーゲンを凝固する前にジェル中の細胞を配布します。
注:弾性率 (剛性の測定) をゲル私のコラーゲン、軟骨細胞の数と線形増加追加11。関係が実験的に決定された線形関数Eによって記述されます = 206·Nc + 15、 EがパスカルとNcの弾性係数と、数百万で軟骨細胞数です。ゲルのための詳しいプロトコルの剛性測定は元資料11参照してください。
4. 私のゲルのコラーゲンに前庭神経や聴覚の感覚器官を配置します。
- 滅菌 1.5 mL チューブでコラーゲンを準備私フェノールレッド pH 指示薬、133 μ 0.34 M 水酸化ナトリウム、炭酸水素ナトリウム 0.9 M、70 μ 1 M HEPES の 40 μ L と 10 x PBS の 160 μ L を混合することによって重合液。氷の上の管を保ちます。
注:このレシピは、重合液のコラーゲン ゲル、けど必要に応じて縮小することができます 2 mL を準備するために必要を提供します。 - 重合液とコラーゲンの 400 μ L ミックス 100 μ L 私優しく上下チルド 1.5 mL チューブにピペッティングによる氷のソリューション。ゲル剛性を高めるため軟骨細胞を含んでいる成長媒体の 50 μ L を追加、セクション 3 で説明した軽く混ぜます。
- 500 μ l 添加し、中和されたコラーゲンを転送私ソリューション 10 mm ガラス底を挿入すると、冷蔵 30 mm シャーレまたは 4 ウェル プレートの井戸。
注:それはコラーゲンの迅速かつ不均一な重合を防ぐために氷の上のすべての試薬を保つために重要な私。 - 中和のコラーゲンに蝸牛または utricles をすばやく転送私ソリューションと滅菌髪ナイフ18または微細鉗子のペアを目的の位置に臓器を調整。
注:コラーゲン私重合が 1-2 分後に顕著になるソリューションが濁った。 - 周囲の組織のソリューションが重合した後、完全な重合を確保するため 5% 二酸化炭素と毒ガス組織文化のインキュベーターで 37 ° C でシャーレまたは 20 分の 4 ウェル プレートを配置します。
- シャーレまたは 4 ウェル プレートのウェルあたり同じ媒体の 500 μ L あたり 0.5% ウシ胎児血清 (FBS) を添加した培 3 mL を加えます。5% 二酸化炭素と毒ガス組織文化のインキュベーターで 37 ° C で文化を維持します。必要な場合は、10 μ M 5-エチニル-2´-デオキシウリジン (EdU) 細胞の増殖にラベルを付けると成長媒体を補足します。
注:FBS の高濃度は、必要な場合に使用できます。
5. ウイルス注射前庭と聴覚の感覚器官の三次元培養で
- 氷の上の目的のウイルスを解凍、0.05% の最終的な染料濃度を達成するために 0.5 mL の円錐管にトリパン ブルー溶液で混ぜます。ウイルスの実質的な希釈を避けるために 10-20 x 染料を使用します。氷の上を保ちます。
注:アデノ ウイルスはアデノ随伴ウイルス Anc80 することができます両方の有毛細胞を感染させるに対し、卵形嚢19支持細胞に感染して、卵形嚢と蝸牛21で支持細胞の 5 作品をベスト型します。 - クリーン微細鉗子で解剖顕微鏡双眼鏡の最高倍率で観察しながらピペット引き手上に作製したガラス針の先端を破る。
注:針の引き手の設定を最適化することが重要です。9 - 12 mm シャンク付き針と 20 - 30 μ m の開口部は最もよく働きます。 - インキュベーターから感覚器官培養を削除します。ガラスシリンジに針を付けるし、色素とウイルスの混合物の 2-3 μ L でそれを埋めます。感覚器官に双眼鏡を解剖顕微鏡の下で観察しながら針を進めます。
- 三次元小嚢培養の屋根の間葉系と上皮の層を介して針の先端を優しくドライブします。青い色素を持つ卵形嚢とロレンチーニの空洞を埋めるまでウイルスの混合物を注入します。
注:感覚的な器官へ簡単にアクセスできる、ため 10 mm ガラス底のシャーレは注射に最適です。 - 37 ° c 5% 二酸化炭素と毒ガス組織培養孵卵器で孵化させなさい。
注:緑または赤の蛍光タンパク質をウイルスの構築で使用する蛍光はウイルス伝達後明白な 24 h です。
結果
胚の耳から前庭と聴覚の感覚器官はマイク低剛性萌芽期の条件11を模倣したゲル 40 Pa コラーゲン培養、比較的普通の三次元構造 (図 1) を保ち、有毛細胞を維持し、支持細胞 (図 2および図 3)。30% 以上減少する細胞密度をサポート (スチューデントのt検定: n = 4、 p < 0.004) と有毛細胞密度減少 60% (スチューデントのt検定: n 5、 p = < 0.0001) 小嚢の文化 (図 2 で 3 日後)、11時間の同じ期間に倍以上の黄斑部 (n = 3, p = 0.0002)。これは、ここで説明した三次元培養法により支援数の大幅な増加は、3 日間にわたって、卵形嚢での既存の有毛細胞の 80% を維持しながら11を細胞のことを示しています。E14.5 蝸牛から確立の三次元培養、Sox2 陽性前駆細胞は文化 (図 3) で 3 日後に内側と外側の有毛細胞の形態学的に区別可能な行として区別します。
ウイルス感染による前庭と聴覚の感覚器官の三次元培養で遺伝子発現を操作できます。4hydroxytamoxifen はラベル Lfng クレエT2/tdTomato マウス17E15.5 胚から確立された人工内耳植で支持細胞に培養液に追加されます。アデノ ウイルスの注入は、支持細胞器官の基地 (図 4A) での感染症の培養結果の内腔に 5 を入力します。E17.5 胚の支持感覚上皮 (図 4B) を通して細胞感染の主に結果から確立小嚢の文化の内腔に同じウイルスの注入。

図 1。スケマティック ダイアグラム ゲルの解剖および卵形嚢と三次元コラーゲンで蝸牛の代表的な文化の光顕微鏡画像の私。(A) A 図マウス内耳の六つの受容器の感覚上皮 (緑) を描いています。赤い線は、卵形嚢と蝸牛の解剖中導入されたカットを描きます。(B) 光学顕微鏡画像を描く E17.5 卵形嚢 (上部パネル) と私はゲルし、48 時間培養コラーゲンに埋め込まれた E14.5 蝸牛 (下段)。スケール バーは、100 μ m を表します。この図は、Gnedevaらから変更されています。11この図の拡大版を表示するのにはここをクリックしてください。
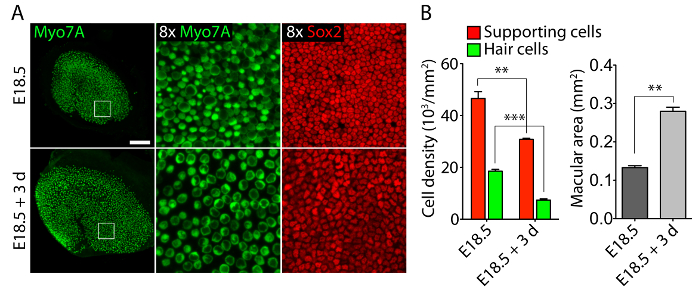
図 2。有毛細胞と支持細胞三次元小嚢培養で。(A) 共焦点顕微鏡画像を描く植 (トップ パネル) 前 E18.5 卵形嚢と 40 Pa コラーゲンの三次元培養 3 日後私はゲル (底面)。有毛細胞が (緑) Myo7A としてラベル付けされ、Sox2 (赤) の細胞をサポートします。スケール バーを表します 50 μ m。 (B) 数量 E18.5 utricles 植する前に、三次元の器官培養 3 日後の細胞の密度 (赤いバー), 有毛細胞密度 (緑色のバー)、黄斑領域 (灰色のバー) をサポート± セムスの手段として表される (p < 0.001 として表されます * * とp < 0.0001 として * * *)。この図は、Gnedevaらから変更されています。11この図の拡大版を表示するのにはここをクリックしてください。
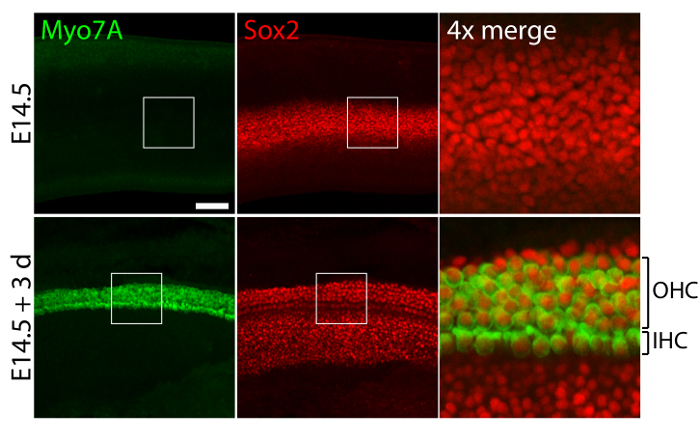
図 3。有毛細胞と支持細胞三次元人工内耳培養で。共焦点顕微鏡画像を描く植 (トップ パネル) の前に E14.5 蝸牛と 40 Pa コラーゲンの三次元培養 3 日後私はゲル (底面)。Myo7A 陽性と Sox2 内有毛細胞 (IHC) と外有毛細胞 (OHC) は、3 日間の培養後 4-5 行で表示されます。支持細胞も付いています Sox2 の (赤い)。スケール バーを表します 25 μ m.この図の拡大版を表示するのにはここをクリックしてください。

図 4。蝸牛と卵形嚢の 3次元組織培養におけるウイルス感染の代表の結果。アデノ ウイルス血清型 5 三次元人工内耳培養に Lfng クレエT2/tdTomato26 E15.5 胚結果から感染 (GFP、緑) の支持器官の基部細胞 (トマト、赤) に設立された (A) 注入。感覚上皮では灰色で区切られました。スケール バーを表します 100 μ m 開設 (B) と同じ三次元小嚢培養注入から E17.5 胚の器官を通して支持細胞 (Sox2、赤) (GFP、グリーン) 感染症の結果します。感覚上皮では灰色で区切られました。スケール バーは、100 μ m を表します。この図は、Gnedevaらから変更されています。11この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
仲介する成長と開発時に内耳に分化されている分子信号は盛んに5,6,7,8,9,10。ただし、小嚢のモデル システムから得られる証拠は、セル接合とカバがシグナル伝達の活性化を通した感覚の機械の手がかりがこれらプロセス2,11,も重要な役割を果たすことを示唆しています。22. 両方の感覚上皮から瀕死の有毛細胞の押出、分化転換を通じて新しい感覚受容器のそれに続く形成支持細胞、それらを引き起こして残留による機械的な力に影響することができますまた、再生時に細胞周期を再入力します。ここで説明した三次元培養システム内耳開発11時成長制御の機械的な力の役割と、潜在的に、有毛細胞の間に同じ力の役割の調査の実験的手段を提供します。再生。さらに、アプローチを容易にウイルスの成長と再生の調査のための力学および分子操作の組み合わせが可能、感覚上皮における遺伝子発現を変更するメソッドを提供する、耳の感覚的な器官の11。
メソッドの制限情報に関連する、最小限利用可能な内因性力と機械的刺激に内耳胚発生中に。我々 の知識に存在しない開発内耳の組織剛性の測定したがって体内の条件に対応するコラーゲン ゲルの私のどのような剛性を推定するは難しいです。我々 の観測とモデルは、卵形嚢の成長に反対力が低い最初器官その最終的なサイズ11に近づくにつれてをお勧めします。我々 したがって胚聴覚・前庭感覚器官を培養するための生理学的関連性の高い基板である私は軟骨なしゲル コラーゲンという仮説します。
ここで説明した三次元培養法は、文化 (図 2) で 3 日後に有毛細胞の 80% も維持しながら、11の小嚢の黄斑の新しい支持細胞の形成を誘導します。メソッドは、したがって、卵形嚢の二次元文化に優れた代替を表す、有毛細胞の唯一の 40-50% で生き残る文化5,8で最初の 24 時間後、有毛細胞の脆弱性を使用することができ、再生体外。
培養コルチ器官の内側と外側の有毛細胞の解剖学的区別の整頓されていた列の形成を示すためより多くの仕事はここで説明した三次元培養法が通常サポートするかどうかを判断する必要蝸牛管伸長プロセス中に収束的伸長 (CE)23,24,25。CE は、含むセル移行、再配置、およびセル連絡先の変更26発展途上の蝸牛管の周囲の組織によって生成された外部の力によって影響を受ける可能性のある非常にダイナミックなプロセスです。このメソッドは、比較的普通の 3次元組織構造を維持は、CEの in vitroの研究のために有益な可能性があります。
開示事項
著者が明らかに何もありません。
謝辞
このプロトコルの基になる元の研究への貢献、博士 A. ドンハコボラーナー、博士 j. サルヴィと A. Petelski に感謝します。また技術支援および動物飼育のため j. ラマと・ w ・ Makmura に感謝我々。我々 は NIDCD グラント R01DC015530、ロバートソン治療開発資金と資金・ カルーソ家族財団 NIDCD トレーニンググラントは T32 DC009975 を認めます。最後に、我々 は、ハワード ヒューズ医学研究所、博士ハズペスは捜査官からのサポートを認めます。
資料
| Name | Company | Catalog Number | Comments |
| #10 Surgical Blades | Miltex | 4-110 | |
| #5 Forceps | Dumont | 11252-20 | |
| 100 mm Petri dish | Sigma | P5856-500EA | |
| 250 uL large orifice pipette tips | USA Scientific | 1011-8406 | |
| 30 mm glass-bottom Petri dish | Matsunami Glass USA Corporation | D35-14-1.5-U | |
| 4 well plate | Thermo Fisher Scientific | 176740 | |
| 4-Hydroxytamoxifen | Sigma | H7904 | |
| 60 mm Petri dish | Thermo Fisher Scientific | 123TS1 | |
| Acetic acid | Sigma | 537020 | |
| Ad-GFP | Vector Biolabs | 1060 | |
| Anti-GFP, chicken IgY fraction | Invitrogen | A10262 | |
| Anti-Myo7A | Proteus Biosciences | 25-6790 | |
| Anti-Sox2 Antibody (Y-17) | Santa Cruz | sc-17320 | |
| Bicinchoninic acid assay | Thermo Fisher Scientific | 23225 | |
| Click-iT EdU Alexa Fluor 647 Imaging Kit | Thermo Fisher Scientific | C10340 | |
| Collagenase I | Gibco | 17100017 | |
| D-glucose | Sigma | G8270 | |
| DMEM/F12 | Gibco | 11320033 | |
| Epidermal growth factor | Sigma | E9644 | |
| Fetal Bovine Serum (FBS) | Thermo Fisher Scientific | 16140063 | |
| Fibroblast growth factor | Sigma | F5392 | |
| Flaming/Brown Micropipette Puller | Sutter Instrument | P-97 | |
| Glutamine | Sigma | G8540 | |
| HBSS | Gibco | 14025092 | |
| Hemocytometer | Daigger | EF16034F | |
| HEPES | Sigma | H4034 | |
| Insulin | Sigma | I3536 | |
| Iridectomy scissors | Zepf Medical Instruments | 08-1201-10 | |
| Microinjector | Narishige | IM-6 | |
| Nicotinamide | Sigma | N0636 | |
| PBS (10X), pH 7.4 | Gibco | 70011044 | |
| PBS (1X), pH 7.4 | Gibco | 10010023 | |
| Phenol Red pH indicator | Sigma | P4633 | |
| Pure Ethanol, 200 Proof | Decon Labs | 2716 | |
| RFP antibody | ChromoTek | 5F8 | |
| Sodium bicarbonate | Sigma | S5761 | |
| Sodium hydroxide | Sigma | S8045 | |
| Sodium selenite | Sigma | S5261 | |
| Tabletop vortex | VWR | 97043-562 | |
| Transferrin | Sigma | T8158 | |
| Trypan blue | Sigma | T6146 |
参考文献
- Oesterle, E. C., Tsue, T. T., Reh, T. A., Rubel, E. W. Hair-cell regeneration in organ cultures of the postnatal chicken inner ear. Hear Res. 70 (1), 85-108 (1993).
- Meyers, J. R., Corwin, J. T. Shape change controls supporting cell proliferation in lesioned mammalian balance epithelium. J Neurosci Off J Soc Neurosci. 27 (16), 4313-4325 (2007).
- Cunningham, L. L. The adult mouse utricle as an in vitro preparation for studies of ototoxic-drug-induced sensory hair cell death. Brain Res. 1091 (1), 277-281 (2006).
- Warchol, M. E., Lambert, P. R., Goldstein, B. J., Forge, A., Corwin, J. T. Regenerative proliferation in inner ear sensory epithelia from adult guinea pigs and humans. Science. 259 (5101), 1619-1622 (1993).
- Lin, V., Golub, J. S., Nguyen, T. B., Hume, C. R., Oesterle, E. C., Stone, J. S. Inhibition of Notch activity promotes nonmitotic regeneration of hair cells in the adult mouse utricles. J Neurosci Off J Soc Neurosci. 31 (43), 15329-15339 (2011).
- Wu, J., et al. Co-regulation of the Notch and Wnt signaling pathways promotes supporting cell proliferation and hair cell regeneration in mouse utricles. Sci Rep. 6, 29418 (2016).
- Chai, R., et al. Wnt signaling induces proliferation of sensory precursors in the postnatal mouse cochlea. Proc Natl Acad Sci U S A. 109 (21), 8167-8172 (2012).
- Wang, T., et al. Lgr5+ cells regenerate hair cells via proliferation and direct transdifferentiation in damaged neonatal mouse utricle. Nat Commun. 6, 6613 (2015).
- Doetzlhofer, A., White, P. M., Johnson, J. E., Segil, N., Groves, A. K. In vitro growth and differentiation of mammalian sensory hair cell progenitors: a requirement for EGF and periotic mesenchyme. Dev Biol. 272 (2), 432-447 (2004).
- White, P. M., Stone, J. S., Groves, A. K., Segil, N. EGFR signaling is required for regenerative proliferation in the cochlea: conservation in birds and mammals. Dev Biol. 363 (1), 191-200 (2012).
- Gnedeva, K., Jacobo, A., Salvi, J. D., Petelski, A. A., Hudspeth, A. J. Elastic force restricts growth of the murine utricle. eLife. 6, (2017).
- Aragona, M., et al. A mechanical checkpoint controls multicellular growth through YAP/TAZ regulation by actin-processing factors. Cell. 154 (5), 1047-1059 (2013).
- Dong, J., et al. Elucidation of a universal size-control mechanism in Drosophila and mammals. Cell. 130 (6), 1120-1133 (2007).
- Low, B. C., Pan, C. Q., Shivashankar, G. V., Bershadsky, A., Sudol, M., Sheetz, M. YAP/TAZ as mechanosensors and mechanotransducers in regulating organ size and tumor growth. FEBS Lett. 588 (16), 2663-2670 (2014).
- Zhao, B., et al. Inactivation of YAP oncoprotein by the Hippo pathway is involved in cell contact inhibition and tissue growth control. Genes Dev. 21 (21), 2747-2761 (2007).
- . . AVMA Guidelines for the Euthanasia of Animals: 2013 Edition. , (2013).
- Semerci, F., et al. Lunatic fringe-mediated Notch signaling regulates adult hippocampal neural stem cell maintenance. eLife. 6, (2017).
- Tuan, R. S., Lo, C. W. Developmental biology protocols. Methods in molecular biology. , 137 (2000).
- Brandon, C. S., Voelkel-Johnson, C., May, L. A., Cunningham, L. L. Dissection of adult mouse utricle and adenovirus-mediated supporting-cell infection. J Vis Exp JoVE. (61), (2012).
- Gosset, M., Berenbaum, F., Thirion, S., Jacques, C. Primary culture and phenotyping of murine chondrocytes. Nat Protoc. 3 (8), 1253-1260 (2008).
- Landegger, L. D., et al. A synthetic AAV vector enables safe and efficient gene transfer to the mammalian inner ear. Nat Biotechnol. 35 (3), 280-284 (2017).
- Burns, J. C., et al. Reinforcement of cell junctions correlates with the absence of hair cell regeneration in mammals and its occurrence in birds. J Comp Neurol. 511 (3), 396-414 (2008).
- Wang, J., et al. Regulation of polarized extension and planar cell polarity in the cochlea by the vertebrate PCP pathway. Nat Genet. 37 (9), 980-985 (2005).
- Chacon-Heszele, M. F., Ren, D., Reynolds, A. B., Chi, F., Chen, P. Regulation of cochlear convergent extension by the vertebrate planar cell polarity pathway is dependent on p120-catenin. Dev Camb Engl. 139 (5), 968-978 (2012).
- Yamamoto, N., Okano, T., Ma, X., Adelstein, R. S., Kelley, M. W. Myosin II regulates extension, growth and patterning in the mammalian cochlear duct. Dev Camb Engl. 136 (12), 1977-1986 (2009).
- Tada, M., Heisenberg, C. -. P. Convergent extension: using collective cell migration and cell intercalation to shape embryos. Dev Camb Engl. 139 (21), 3897-3904 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved