Method Article
Dreidimensionale organotypischen Kulturen der vestibulären und akustische Sinnesorgane
In diesem Artikel
Zusammenfassung
Dreidimensionale organotypischen Kulturen der murinen Utricle und Cochlea in optisch klar Kollagen ich bewahren angeborene Gewebe Morphologie Gele ermöglichen für mechanische Stimulation durch Anpassung der Matrix Steifigkeit und Virus-vermittelten gen Lieferung zu ermöglichen.
Zusammenfassung
Die Sinnesorgane des Innenohrs sind eine Herausforderung, um bei Säugetieren wegen ihrer Unzugänglichkeit experimentelle Manipulation und optischen Beobachtung zu studieren. Darüber hinaus obwohl bestehende Kulturtechniken biochemische Störungen können, bieten diese Methoden keine Mittel zur Untersuchung der Auswirkungen der mechanischen Kraft und Gewebe Steifigkeit während der Entwicklung der Sinnesorgane Innenohr. Hier beschreiben wir eine Methode zur dreidimensionalen organotypischen Kultur der intakten murinen Utricle und Cochlea, die diese Grenzen überwindet. Die Technik für die Anpassung der eine dreidimensionale Matrix Steifigkeit, die hier beschriebenen ermöglicht Manipulation die elastische Kraft gegen Gewebewachstum. Diese Methode kann daher zur Untersuchung der Rolle von mechanischen Kräfte während der Innenohr-Entwicklung. Darüber hinaus erlauben die Kulturen Virus-vermittelten gen Lieferung, die für Gewinn und Verlust-of-Function-Experimente genutzt werden kann. Diese Kultur-Methode bewahrt angeborene Haarzellen und Unterstützung von Zellen und dient als eine potentiell überlegene Alternative zu traditionellen zweidimensionalen Kultur der vestibulären und akustische Sinnesorgane.
Einleitung
Die Studie der meisten Aspekte der Säugetier-Organentwicklung wurde durch in-vitro- Systeme erleichtert. Zwei Hauptmethoden werden jetzt verwendet, für die Kultur der vestibulären Sinnesorgane: freischwebende1 und anhaftende2 Vorbereitungen. Beide Methoden erlauben die Untersuchung der Haarzelle Schwachstellen3 und Regeneration1,4 in Vitro. Darüber hinaus haben die entwicklungspolitischen Rollen der Kerbe5,6, Wnt7,8und epidermalen Wachstumsfaktor-Rezeptor (EGFR)9,10 Signalisierung Kaskaden im Innenohr etabliert, unter anderem durch den Einsatz von in-vitro- Kulturen von sensorischen Epithelien. Jedoch sind Zellwachstum und Differenzierung, nicht nur durch die Signalisierung von Morphogens, sondern auch durch physikalische und mechanische Signale z. B. interzellulären Kontakte, der Steifigkeit der extrazellulären Matrix und mechanische Dehnung oder Verengung gesteuert. Die Rolle solcher mechanischer Reize ist eine Herausforderung, in den Entwicklungsländern Innenohr in Vivozu untersuchen. Bestehenden freischwebend und anhaftende Kulturmethoden eignen sich darüber hinaus nicht für solche Studien in Vitro. Hier beschreiben wir eine Methode für die dreidimensionale organotypischen Kultur in Kollagen ich Gele unterschiedlicher Steifigkeit. Diese Methode weitgehend bewahrt die in Vivo -Architektur der vestibulären und Cochlea-Sinnesorgane und ermöglicht die Untersuchung der Auswirkungen der mechanischen Kraft auf Wachstum und Differenzierung11.
Da mechanische Reize bekannt sind, um nachgeschaltete molekularen Ereignisse, z. B. das Nilpferd Weg12,13,14,15, Signalisierung zu aktivieren ist es wichtig, mechanische Stimulation kombinieren zu können mit biochemischen und genetischen Manipulationen. Die hier beschriebene Methode Kultur gestattet Virus-vermittelten gen Lieferung und kann daher verwendet werden, um mechanische und molekularen Signalisierung im Innenohr Entwicklung11zu studieren.
Protokoll
Alle hier beschriebene Methoden wurden von der Animal Care und Nutzung Ausschüsse der Rockefeller University und der University of Southern California zugelassen.
1. (optional) Vorbereitung des Kollagens ich Lösung von Mouse-tail sehnen
Hinweis: Kollagen ich Lösungen sind im Handel erhältlich. Folgen Sie den Anweisungen des Herstellers für Gel-Vorbereitung.
- Einschläfern Sie 5-10 junger Erwachsener (3-5 Wochen alt) Mäusen Wildtyp-Stamm mit Kohlendioxid gemäß dem Protokoll genehmigt von den relevanten institutionellen Animal Care und Use Committee16. Sammeln Sie die Schwänzen und Desinfizieren sie durch Eintauchen in 70 % igem Ethanol bei einem Mindestaufenthalt von 4 h bei Raumtemperatur.
Hinweis: Für mehr als 48 h Inkubation sollte vermieden werden, da zu übermäßigem Gewebe Dehydrierung führt und die Sehne-Extraktion behindert. - Entfernen Sie die Haut jeden Schwanz durch die Einführung eines längs-Schnitt mit einem Skalpellklinge und zurückziehen die ganze Haut mit einer Pinzette. Übertragen Sie die dunkelhäutigen Schwänzen auf einer 100-mm-Petrischale gefüllt mit sauberen 70 % Ethanol und in 10-mm-Segmente schneiden.
Hinweis: Entsorgen Sie die dünnsten Teile des Tails, die schwierig zu handhaben sind. - Mit Pinzette, sichern Sie jedes Segment der Rute auf den Boden der Petrischale zu und verwenden Sie ein zweites Paar feine Pinzette, um die Sehnen vom Heck eine zu einem Zeitpunkt zu extrahieren. Einzelne Sehne Fasern sollten mit minimalem Widerstand entstehen.
Hinweis: Alte, Matte #5 Pinzetten eignen sich gut für diesen Schritt. - 100 mL einer 0,1 % Lösung (nach Volumen) von Essigsäure in sterilen, Molekulare-Grade Wasser bereiten und eine sterile Petrischale 100 mm 10 mL der Lösung hinzufügen. Übertragen Sie die Sehnen in der Petrischale und verlassen Sie ich für 1 h bei Raumtemperatur zu denaturieren die Kollagen zu.
- Verwenden Sie eine sterile Schere Skalpell oder Iridektomie mit stumpfen, gebogene Spitzen, um die Sehne in 1 – 2 mm Fragmente Blatt vor den Mund. Übertragen Sie die Hackfleisch / sehnen, ein steriles 50-mL-Röhrchen und fügen Sie 0,1 % Essigsäure um die Lautstärke auf 50 mL zu bringen.
Hinweis: Verwenden Sie vier oder fünf Schwänzen für je 50 mL Säure, ein Kollagen zu erreichen ich Konzentration von 2,0-2,5 mg/mL. - Kühlen Sie das Kollagen ich Lösung bei 4 ° C für mindestens 48 h, komplettes Protein-Denaturierung zu erleichtern. Wirbel mit einer Tischplatte Vortex soll die maximale Geschwindigkeit für 1 min zweimal am Tag.
- Die Proteinkonzentration der Lösung mit der Bicinchoninic Säure-Test zu messen, stellen Sie das Kollagen ich Konzentration auf 2,0-2,5 mg/mL durch Zugabe von 0,1 % ige Lösung von Essigsäure und Store bei 4 ° C.
Hinweis: Kollagen ich Lösung kann ein bis zwei Jahre lang aufbewahrt werden. - (Optional) Das Kollagen Zentrifuge ich Lösung bei 2.000 x g für 1 h bei 4 ° C und die Nutzung der transluzente Top Bruchteil (ca. die Hälfte des Volumens), optisch klare Kollagen zu erreichen in Abschnitt 4 Gele.
2. Präparation des auditorischen und vestibulären Organe
- Einschläfern Sie Schwangere Mäusen Belastung mit Kohlendioxid gemäß dem Protokoll von den relevanten institutionellen Animal Care und Use Committee16genehmigt. Extrahieren und die Embryonen zu enthaupten.
Hinweis: Lfng-CreERT2/tdTomato Mäuse können verwendet werden, ermöglichen dauerhafte Kennzeichnung von Stützzellen nach Exposition gegenüber 4-Hydroxytamoxifen17. - Sterilisieren Sie alle Arbeitsflächen und Dissektion Instrumente, darunter zwei Paare von #5 Zangen und ein Haar Messer18, mit 70 % igem Ethanol reinigt.
- Jeder Kopf in zwei Hälften durch die Einführung eines längs-Schnitt mit einem sterilen Skalpellklinge oder mithilfe von zwei Paaren von #5 Pinzetten aufgeteilt. Extrahieren Sie die Temporal Knochen, die die inneren Ohren19enthalten, und legen Sie sie in 15 mL eiskaltes Hank ausgeglichene Salzlösung (HBSS) in einer Petrischale 60 mm. Halten Sie die Schüssel auf dem Eis.
Hinweis: Embryonen bei einer Reihe von Phasen von E13.5 bis E18.5 sind erfolgreich benutzt worden. - (Optional) Waschen Sie die inneren Ohren durch Schütteln sie vorsichtig in ein 50 mL konische Röhrchen mit 30 mL eiskaltes HBSS und ersetzen die HBSS drei-oder viermal. Halten Sie das Rohr auf dem Eis.
Hinweis: Dieser Schritt begrenzt mögliche Kontamination der Gewebekultur und bringt schnell die Temperatur um 4 ° C, die Erniedrigung und Zelle Absterben von Gewebe verhindert. - Mit zwei Paaren von feinen #5 Pinzetten, trennen Sie die inneren Ohren aus dem Felsenbein und übertragen Sie die Ohren, drei oder vier in einer Zeit, in eine 60 mm Petrischale gefüllt mit eiskalten HBSS.
- Die vestibulären Sinnesorgane zu sezieren.
- Orientieren Sie die Ohren medialen Seite oben zu und suchen Sie die Utricle. Entfernen Sie mit zwei Paaren von #5 Pinzetten den Knorpel umgibt die vestibulären Organe. Trennen Sie vorsichtig Nervus Vestibular, die Verbindung zwischen der Utricle und Gleichgewichtsorgan und Bogengängen, wie in Abbildung 1dargestellt. Ziehen Sie vorsichtig die Utricle und die beigefügten Glasphiolen von superior und horizontale Bogengängen aus dem Ohr.
Hinweis: Diese Methode kann auf inneren Ohren Stufen E16.5 - E18.5 verwendet werden. Bewahren Sie die Knorpel-Fragmente für Abschnitt 3 unten.
- Orientieren Sie die Ohren medialen Seite oben zu und suchen Sie die Utricle. Entfernen Sie mit zwei Paaren von #5 Pinzetten den Knorpel umgibt die vestibulären Organe. Trennen Sie vorsichtig Nervus Vestibular, die Verbindung zwischen der Utricle und Gleichgewichtsorgan und Bogengängen, wie in Abbildung 1dargestellt. Ziehen Sie vorsichtig die Utricle und die beigefügten Glasphiolen von superior und horizontale Bogengängen aus dem Ohr.
- Die Cochlea zu sezieren.
- Die knorpelige Gewebe um das Hörorgan mit zwei Paaren von #5 Zange zu entfernen. Trennen Sie vorsichtig die Verbindung zwischen der Cochlea-Basis und das Gleichgewichtsorgan, wie in Abbildung 1dargestellt.
Hinweis: Für Stufen E13.5 - E14.5, den Knorpel vor Dissektion erweichen durch die Behandlung der Inneres Ohren ich mit 0,25 % Kollagenase Phosphat-gepufferte Kochsalzlösung (PBS) Lösung für 5 min bei Raumtemperatur. Bewahren Sie die Knorpel-Fragmente für Abschnitt 3 unten.
- Die knorpelige Gewebe um das Hörorgan mit zwei Paaren von #5 Zange zu entfernen. Trennen Sie vorsichtig die Verbindung zwischen der Cochlea-Basis und das Gleichgewichtsorgan, wie in Abbildung 1dargestellt.
- Mit einem 200-µL-Pipettieren mit einer breiten beschichteten Spitze ausgestattet, der Utricles und Cochleae auf einer 30-mm-Petrischale gefüllt mit Wachstumsmedium bestehend aus DMEM/F12 ergänzt mit 33 mM Dglucose, Natriumbicarbonat 19 mM, 15 mM 4(2hydroxyethyl) - übertragen 1piperazineethanesulfonic Säure (HEPES), 1 mM Glutamin 1 mM Nicotinamid, 20 mg/L epidermalen Wachstumsfaktor, Fibroblasten-Wachstumsfaktor 20 mg/L, 10 mg/L Insulin, 5,5 mg/L Transferrin und 5 µg/L Natriumselenit.
- Pflegen Sie die Utricle Vorbereitungen für bis zu 3 h bei 37 ° C in einer Gewebekultur Inkubator mit 5 % Kohlendioxid vergast erlauben Heilung der Schnitte in das Epithel, die während der Präparation eingeführt. Cochlea-Vorbereitungen sollten auf das Kollagen Gel 10 min nach der Dissektion übertragen werden.
Hinweis: Weil die Zerlegung in eiskalten HBSS durchgeführt wird, gibt es keine Notwendigkeit, das Wachstumsmedium auf 37 ° c Vorwärmen
3. (optional) passen Sie Kollagen Gel ich Steifigkeit durch Zugabe von unterschiedlichen Konzentrationen von Chondrozyten
Hinweis: Die Methode für die Knorpelzelltransplantation Isolierung wurde von Gosset Et Al. modifiziert. 20
- Bereiten Sie eine 1 % ige Lösung von Kollagenase ich in sterilen 1 x PBS und Speicher 100-200 µL Aliquots bei-80 ° C. Auf dem Eis bei Bedarf Auftauen, mehrere Gefrier-tau-Zyklen zu vermeiden.
- Die Zerlegung der auditorischen und vestibulären Organe von 10-12 Ohren übrig Nutzung feine Pinzette, die Stücke des Knorpels zu sammeln. Separate Bindegewebe und Innenohr Gewebe aus dem Knorpel. Übertragen des Knorpels zu einer 30-mm-Petrischale und fügen Sie 300 µL der sterilen Nährmedium.
- Verwenden Sie ein steriles Skalpell Klinge oder Iridektomie Schere mit stumpfen gebogenen Spitzen um zu hacken das Gewebe um Knorpel Stücke ca. 0,5 mm in der Länge zu erreichen.
- Hinzufügen von Kollagenase ich auf das Medium mit Knorpel, eine abschließende Enzym-Konzentration von 0,25 % zu erreichen. Übertragen Sie die Schale in einer Gewebekultur Inkubator bei 37 ° C mit 5 % Kohlendioxid vergast. Pipettieren kräftig mit einem 1.000 µL pipettieren alle 20 min bis Stücke des Knorpels distanzieren und unterscheiden sich nicht mehr in der Lösung dann inkubieren eine zusätzliche 20 min.
Hinweis: Im Falle der Utricle Vorbereitungen kann Knorpelzelltransplantation Isolierung während Schritt 2,9 durchgeführt werden; Es dauert ca. 2 h (3-4 pipettieren Runden). - Sammeln Sie die Zellsuspension in einem 15 mL konische Röhrchen zu und stellen Sie die Lautstärke auf 10 mL mit sterilen 1 X PBS. Zentrifuge bei 800 X g für 5 min bei 4 ° C. Entfernen Sie den überstand und Aufschwemmen der Zellen in 10 mL sterile 1 X PBS. Bei 800 X g für 5 min bei 4 ° C zentrifugiert und den überstand zu entfernen.
Hinweis: Es ist entscheidend für die Zellen zweimal waschen; Alle übrigen Kollagenase wird ich das Kollagen, die, das ich Gel, verdauen. - Mit einem 200-µL-pipettieren, hinzu kommen 100 µL Kulturmedium der Zelle Pellet und pipettieren sanft zu Aufschwemmen. Zählen der Zellen unter Verwendung einer Hemocytometer und auf Eis vor dem Gebrauch zu halten.
- Chondrozyten hinzufügen um Gel Steifigkeit zu erhöhen, die neutralisierte Kollagen ich gel-Lösung (Abschnitt 1) und schnell mischen, die Zellen im ganzen das Gel vor Erstarrung zu verteilen.
Hinweis: Der Elastizitätsmodul des Kollagen gel ich (ein Maß für die Steifigkeit), steigt linear mit der Anzahl der Chondrozyten hinzugefügt11. Das Verhältnis wird beschrieben durch die experimentell ermittelten lineare Funktion E = 206· NC + 15, in denen E der Elastizitätsmodul in Pascals und Nc ist, ist die Zahl der Chondrozyten in Millionenhöhe. Ein detailliertes Protokoll für Gel entnehmen Steifigkeit Maße Sie bitte den ursprünglichen Artikel11.
4. Legen Sie die vestibuläre oder auditive Sinnesorgan in einem Kollagen, die ich Gel
- In ein steriles Röhrchen 1,5 mL, bereiten Sie Kollagen ich Polymerisation Lösung durch Mischen von 160 µL 10 X PBS mit Phenol rot pH-Indikator, 133 µL 0,34 M Natronlauge, 70 µL von 0,9 M Natriumbicarbonat und 40 µL 1 M HEPES. Halten Sie das Rohr auf dem Eis.
Hinweis: Dieses Rezept ist die Polymerisation Lösung 2 mL des Kollagens vorbereiten ich gel, aber kann je nach Bedarf skaliert werden musste. - Mix 100 µL der Polymerisation Lösung und 400 µL des Kollagens ich Lösung auf Eis durch sanft nach oben und unten in einem gekühlten 1,5 mL Röhrchen pipettieren. Um Gel Steifigkeit zu erhöhen, fügen Sie 50 µL der Chondrozyten-haltigem Wachstumsmedium hinzu und mischen Sie, wie in Abschnitt 3 beschrieben.
- 500 µL des neutralisierten Kollagen zu übertragen ich Lösung auf einer gekühlten 30-mm-Petrischale mit einem 10-mm-Glasboden-Einsatz oder einem Brunnen der vier-Well-Platte.
Hinweis: Es ist wichtig, alle Reagenzien auf Eis, um zu verhindern, dass schnelle und ungleichmäßige Polymerisation des Kollagens zu halten ich. - Schnelle Übertragung von Cochleae oder Utricles auf die neutralisierte Kollagen ich Lösung und stellen Sie die Organe auf ihre gewünschte Position mit einer sterilen Haar Messer18 oder ein paar feine Pinzette.
Hinweis: Kollagen ich Polymerisation wird nach 1-2 min spürbar, da die Lösung trüb wird. - Nachdem die Lösung, um das Gewebe polymerisiert ist, platzieren Sie die Petrischale oder vier-Well-Platte für 20 min bei 37 ° C in einer Gewebekultur Inkubator vergast mit 5 % Kohlendioxid um vollständige Polymerisation zu gewährleisten.
- Fügen Sie 3 mL Wachstumsmedium ergänzt mit 0,5 % fetalen bovine Serum (FBS) pro Petrischale oder 500 µL des gleichen Mediums pro Bohrloch eine vier-Well-Platte. Pflegen Sie die Kultur bei 37 ° C in einer Gewebekultur Inkubator mit 5 % Kohlendioxid vergast. Auf Wunsch ergänzen Sie das Wachstumsmedium mit 10 µM 5-Ethynyl-winkel2-Deoxyuridine (EdU), wuchernde Zellen zu kennzeichnen.
Hinweis: Höhere Konzentrationen der FBS können bei Bedarf verwendet werden.
(5) virale Injektionen in dreidimensionale Kulturen der vestibulären und akustische Sinnesorgane
- Tauen Sie das gewünschte Virus auf Eis und mischen mit Trypan blau-Lösung in einem 0,5 mL konische Rohr, eine endgültige Farbstoff-Konzentration von 0,05 % zu erreichen. Verwenden Sie 10-20 X Farbstoff um zu erheblichen Verdünnung des Virus zu vermeiden. Halten Sie auf dem Eis.
Hinweis: Adenovirus Serotyp 5 funktioniert am besten für Stützzellen im Utricle19, zu infizieren, während Adeno-assoziierten Virus Anc80 beide Haarzellen infizieren kann und Stützzellen in der Utricle und Cochlea-21. - Brechen Sie ein Glas Nadelspitze vorbereitet auf einer Mikropipette Abzieher mit sauberen feinen Pinzette während Sie mit der höchsten Vergrößerung ein Fernglas Mikroskop sezieren beobachten.
Hinweis: Es ist wichtig, um die Einstellungen auf der Nadel Abzieher zu optimieren. Nadeln mit 9 - 12 mm Schäfte und 20 - 30 µm Öffnungen am besten funktionieren. - Entfernen Sie eine Sinnesorgan Kultur aus dem Inkubator. Legen Sie die Nadel auf die Microinjector und füllen Sie ihn mit 2-3 µL Farbstoff und Virus-Gemisch. Vorantreiben Sie die Nadel in das Sinnesorgan, während Sie unter dem Binokular Mikroskop sezieren beobachten.
- Fahren Sie vorsichtig die Nadelspitze durch mesenchymale und epithelialen Schichten des Daches einer dreidimensionalen utricular Kultur. Die virale Mischung zu injizieren, bis die Hohlräume der Utricle und Glasphiolen mit blauen Farbstoff füllen.
Hinweis: Weil sie leichten Zugang zu Sinnesorgane ermöglicht, ist ein 10-mm-Glasboden-Petrischale optimal für die Injektionen. - Inkubation bei 37 ° C in einer Gewebekultur Inkubator mit 5 % Kohlendioxid vergast.
Hinweis: Wenn grünes oder rotes fluoreszierendes Protein in der viralen Konstrukt verwendet wird, ist die Fluoreszenz sichtbar 24 h nach virale Transduktion.
Ergebnisse
Vestibuläre und akustische Sinnesorgane aus embryonalen Ohren kultiviert in 40-Pa Kollagen Gele imitiert geringe Steifigkeit embryonalen Bedingungen11, relativ normale dreidimensionale Strukturen (Abbildung 1) behalten und pflegen Haarzellen und Stützzellen (Abbildung 2 und Abbildung 3). Obwohl Zelldichte zu unterstützen um über 30 % verringert (Studenten t -Test: n = 4, p < 0,004) und Haarzellen Dichte verringert sich um 60 % (Studenten t -Test: n = 5, p < 0,0001) nach 3 Tagen in utricular Kulturen (Abbildung 2 ), den Bereich der Makula mehr als verdoppelt im gleichen Zeitraum der Zeit11 (n = 3, p = 0,0002). Dies zeigt, dass die Methode für die dreidimensionale Kultur hier beschriebenen eine deutliche Steigerung in der Anzahl ermöglicht der Zellen11, wobei 80 % der vorhandenen Haarzellen in der Utricle über einen Zeitraum von 3 Tagen. In der dreidimensionalen Kulturen aus E14.5 Cochlea gegründet differenzieren Sox2-positiven Vorläuferzellen als morphologisch unterscheidbar Zeilen der inneren und äußeren Haarzellen nach 3 Tagen in der Kultur (Abbildung 3).
Genexpression kann in dreidimensionale Kulturen der vestibulären und akustische Sinnesorgane durch Virusinfektion manipuliert werden. 4hydroxytamoxifen ergänzt das Kulturmedium Label Stützzellen in der Cochlea-Explantaten aus E15.5 Embryonen Lfng CreERT2/tdTomato Mäuse17gegründet. Injektion von Adenovirus Typ 5 in das Lumen der Kultur Ergebnisse bei einer Infektion von Stützzellen an der Orgel Basis (Abb. 4A). Injektion von dem gleichen Virus in das Lumen der utricular Kultur aus E17.5 Embryo, Ergebnisse in erster Linie bei Infektion der Stützzellen im gesamten das sensorische Epithel (Abbildung 4B) gegründet.

Abbildung 1. Schemata Sezierungen und Licht-mikroskopische Bilder von repräsentativen Kulturen der Utricle und Cochlea in dreidimensionale Kollagen ich Gele. (A) A schematische Zeichnung porträtiert die sensorischen Epithelien (grün) der sechs Rezeptor Organe des murinen Innenohrs. Die roten Linien umreißen die Einschnitte in die Zerlegung eines Utricle und Cochlea eingeführt. (B) Lichtmikroskopie Bilder zeigen die E17.5 Utricle (obere Abdeckung) und E14.5 Cochlea (untere Leiste) eingebettet in Kollagen ich gel und für 48 h kultiviert. Die Skala Balken stehen 100 µm. Diese Zahl wurde von Gnedeva Et al.modifiziert. 11 Bitte klicken Sie hier für eine größere Version dieser Figur.
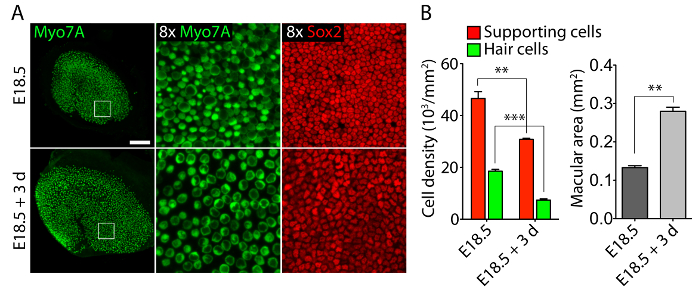
Abbildung 2. Haarzellen und Stützzellen in dreidimensionalen utricular Kulturen. (A) Confocal-mikroskopische Bilder zeigen ein E18.5 Utricle vor der Explantation (Paneele) und nach 3 Tagen in einer dreidimensionalen Kultur in 40-Pa Kollagen gel ich (untere Verkleidungen). Haarzellen sind für Myo7A (grün) gekennzeichnet und Unterstützung für Sox2 (rot) Zellen. Die Maßstabsleiste stellt 50 µm. (B) Quantifizierungen Zelldichten (roter Balken), Haare Zelldichten (grüne Balken) und Makula Bereiche (graue Balken) in E18.5 Utricles vor der Explantation und nach 3 Tagen in dreidimensionale Orgel Kultur unterstützt vertreten als ± SEMs bedeutet (p < 0,001 wird dargestellt als ** und p < 0,0001 wie ***). Diese Zahl wurde von Gnedeva Et Al. modifiziert 11 Bitte klicken Sie hier für eine größere Version dieser Figur.
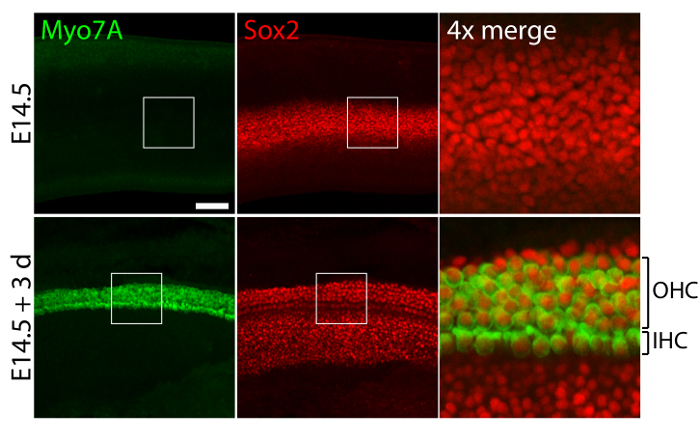
Abbildung 3. Haarzellen und Stützzellen im dreidimensionalen Cochlea-Kulturen. Konfokale mikroskopische Aufnahmen zeigen eine E14.5 Cochlea vor der Explantation (Paneele) und nach 3 Tagen in einer dreidimensionalen Kultur in 40-Pa Kollagen gel ich (untere Verkleidungen). Myo7A und Sox2 positiven inneren Haarzellen (IHC) und äußeren Haarzellen (OHC) erscheinen in 4-5 Zeilen nach 3 Tagen in Kultur. Stützzellen sind auch für Sox2 (rot) gekennzeichnet. Die Maßstabsleiste stellt 25 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4. Repräsentative Ergebnisse von Virusinfektionen in dreidimensionale Orgel Kulturen der Cochlea und Utricle. (A) Injektion von Adenovirus Serotyp 5 in dreidimensionale Cochlea-Kulturen (GLP, grüne) Infektion von Stützzellen (Tomatenrot) an der Basis der Orgel von Lfng CreERT2/tdTomato26 E15.5 Embryonen Ergebnisse gegründet. Das sensorische Epithel ist in Grau abgegrenzt. Die Maßstabsleiste repräsentiert 100 µm. (B) eine identische Injektion in eine dreidimensionale utricular Kultur gegründet von E17.5 Embryo führt Infektion (GLP, grüne) von Stützzellen (Sox2, rot) in der Orgel. Das sensorische Epithel ist in Grau abgegrenzt. Die Maßstabsleiste repräsentiert 100 µm. Diese Zahl wurde von Gnedeva Et Al. modifiziert 11 Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Die molekularen Signale, die vermitteln Wachstum und Differenzierung im Innenohr während der Entwicklung wurden studiert ausgiebig5,6,7,8,9,10. Aus der utricular Modellsystem erlangte Beweismittel deuten jedoch darauf hin, dass mechanische Hinweise, spürte durch Zelle Kreuzungen und die Aktivierung von Hippo-Signalisierung, auch eine wichtige Rolle in diesen Prozessen2,11, spielen 22. Darüber hinaus sowohl die Extrusion von sterbenden Haarzellen aus der sensorischen Epithel und die anschließende Bildung von neuen sensorischen Rezeptoren durch Transdifferenzierung können Einfluss auf die mechanische Kraft spürte durch die Resttilgung Stützzellen, wodurch sie der Zellzyklus während der Regeneration erneut eingeben. Die dreidimensionalen Kultursystems hier beschriebenen bietet eine experimentelle Möglichkeit untersuchen die Rolle der mechanischen Kraft in Wachstumskontrolle im Innenohr Entwicklung11 und möglicherweise, die Rolle der gleichen Kraft während der Haarzelle Regeneration. Darüber hinaus erleichtert das Konzept Virusinfektion, die eine Methode der Veränderung der Genexpression in der sensorischen Epithel, so dass eine Kombination aus mechanischen und molekulare Manipulationen für die Untersuchung des Wachstums und der Regeneration in bietet die des Ohres Sinnesorgane11.
Die Grenzen der Methode beziehen sich auf die minimale Informationen auf die endogenen Kräfte und mechanische Reize im Innenohr Embryogenese. Messungen des Gewebe Steifigkeit in den Entwicklungsländern Innenohr sind nach unserem Kenntnisstand nicht vorhanden; Daher ist es schwer einzuschätzen, welche Steifheit von Kollagen ich Gel in Vivo Bedingungen entspricht. Unsere Beobachtungen und das Modell deuten darauf hin, dass die Kraft gegen Wachstum der Utricle zunächst gering ist und erhöht das Organ seine endgültige Größe11nähert. Wir vermuten deshalb, dass eine Kollagen, die ich ohne Chondrozyten gel ist ein physiologisch relevanten Substrat in der embryonalen vestibulären und akustische Sinnesorgane Kultur.
Die hier beschriebene Methode der dreidimensionalen Kultur induziert Bildung von neuen Stützzellen in der utricular Makula11, gleichzeitig mehr als 80 % der Haarzellen nach 3 Tagen in Kultur (Abbildung 2). Die Methode, daher stellt eine überlegene Alternative zu zweidimensionalen Kulturen der Utricle, in denen nur 40-50 % der Haarzellen zu überleben, nach den ersten 24 h in Kultur5,8und kann verwendet werden, um die Haarzelle Schwachstellen zu studieren und Regeneration in Vitro.
Obwohl wir die Bildung von anatomisch unterscheidbar organisierten Reihen von inneren und äußeren Haarzellen in der kultivierten Organ von Corti zu demonstrieren, ist mehr Arbeit erforderlich, um festzustellen, ob die hier beschriebene Methode der dreidimensionalen Kultur normal unterstützt Cochlea-Kanal Dehnung während des Prozesses von konvergenten Erweiterung (CE)23,24,25. CE ist ein sehr dynamischer Prozess mit Zelle Migration, Neuordnung und Zellezelle Kontakt ändert26 , das durch die externe Kraft, die durch das Gewebe um den entwickelnden Cochlea-Kanal produziert betroffen sein dürfte. Diese Methode erhält relativ normale dreidimensionale Gewebearchitektur und könnte möglicherweise vorteilhaft für das Studium der CE in Vitro.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Wir danken Dr. A. Jacobo, Dr. J. Salvi und A. Petelski für ihre Beiträge an die ursprüngliche Forschung, auf der dieses Protokoll basiert. Wir danken auch Lamas J. und W. Makmura für technische Hilfe und Tierhaltung. Wir erkennen NIDCD Ausbildung Grant T32 DC009975 NIDCD gewähren R01DC015530, therapeutische Entwicklungsfonds Robertson und Caruso Family Foundation für die Finanzierung. Schließlich erkennen wir Unterstützung vom Howard Hughes Medical Institute, von denen Dr. Hudspeth ein Ermittler ist.
Materialien
| Name | Company | Catalog Number | Comments |
| #10 Surgical Blades | Miltex | 4-110 | |
| #5 Forceps | Dumont | 11252-20 | |
| 100 mm Petri dish | Sigma | P5856-500EA | |
| 250 uL large orifice pipette tips | USA Scientific | 1011-8406 | |
| 30 mm glass-bottom Petri dish | Matsunami Glass USA Corporation | D35-14-1.5-U | |
| 4 well plate | Thermo Fisher Scientific | 176740 | |
| 4-Hydroxytamoxifen | Sigma | H7904 | |
| 60 mm Petri dish | Thermo Fisher Scientific | 123TS1 | |
| Acetic acid | Sigma | 537020 | |
| Ad-GFP | Vector Biolabs | 1060 | |
| Anti-GFP, chicken IgY fraction | Invitrogen | A10262 | |
| Anti-Myo7A | Proteus Biosciences | 25-6790 | |
| Anti-Sox2 Antibody (Y-17) | Santa Cruz | sc-17320 | |
| Bicinchoninic acid assay | Thermo Fisher Scientific | 23225 | |
| Click-iT EdU Alexa Fluor 647 Imaging Kit | Thermo Fisher Scientific | C10340 | |
| Collagenase I | Gibco | 17100017 | |
| D-glucose | Sigma | G8270 | |
| DMEM/F12 | Gibco | 11320033 | |
| Epidermal growth factor | Sigma | E9644 | |
| Fetal Bovine Serum (FBS) | Thermo Fisher Scientific | 16140063 | |
| Fibroblast growth factor | Sigma | F5392 | |
| Flaming/Brown Micropipette Puller | Sutter Instrument | P-97 | |
| Glutamine | Sigma | G8540 | |
| HBSS | Gibco | 14025092 | |
| Hemocytometer | Daigger | EF16034F | |
| HEPES | Sigma | H4034 | |
| Insulin | Sigma | I3536 | |
| Iridectomy scissors | Zepf Medical Instruments | 08-1201-10 | |
| Microinjector | Narishige | IM-6 | |
| Nicotinamide | Sigma | N0636 | |
| PBS (10X), pH 7.4 | Gibco | 70011044 | |
| PBS (1X), pH 7.4 | Gibco | 10010023 | |
| Phenol Red pH indicator | Sigma | P4633 | |
| Pure Ethanol, 200 Proof | Decon Labs | 2716 | |
| RFP antibody | ChromoTek | 5F8 | |
| Sodium bicarbonate | Sigma | S5761 | |
| Sodium hydroxide | Sigma | S8045 | |
| Sodium selenite | Sigma | S5261 | |
| Tabletop vortex | VWR | 97043-562 | |
| Transferrin | Sigma | T8158 | |
| Trypan blue | Sigma | T6146 |
Referenzen
- Oesterle, E. C., Tsue, T. T., Reh, T. A., Rubel, E. W. Hair-cell regeneration in organ cultures of the postnatal chicken inner ear. Hear Res. 70 (1), 85-108 (1993).
- Meyers, J. R., Corwin, J. T. Shape change controls supporting cell proliferation in lesioned mammalian balance epithelium. J Neurosci Off J Soc Neurosci. 27 (16), 4313-4325 (2007).
- Cunningham, L. L. The adult mouse utricle as an in vitro preparation for studies of ototoxic-drug-induced sensory hair cell death. Brain Res. 1091 (1), 277-281 (2006).
- Warchol, M. E., Lambert, P. R., Goldstein, B. J., Forge, A., Corwin, J. T. Regenerative proliferation in inner ear sensory epithelia from adult guinea pigs and humans. Science. 259 (5101), 1619-1622 (1993).
- Lin, V., Golub, J. S., Nguyen, T. B., Hume, C. R., Oesterle, E. C., Stone, J. S. Inhibition of Notch activity promotes nonmitotic regeneration of hair cells in the adult mouse utricles. J Neurosci Off J Soc Neurosci. 31 (43), 15329-15339 (2011).
- Wu, J., et al. Co-regulation of the Notch and Wnt signaling pathways promotes supporting cell proliferation and hair cell regeneration in mouse utricles. Sci Rep. 6, 29418(2016).
- Chai, R., et al. Wnt signaling induces proliferation of sensory precursors in the postnatal mouse cochlea. Proc Natl Acad Sci U S A. 109 (21), 8167-8172 (2012).
- Wang, T., et al. Lgr5+ cells regenerate hair cells via proliferation and direct transdifferentiation in damaged neonatal mouse utricle. Nat Commun. 6, 6613(2015).
- Doetzlhofer, A., White, P. M., Johnson, J. E., Segil, N., Groves, A. K. In vitro growth and differentiation of mammalian sensory hair cell progenitors: a requirement for EGF and periotic mesenchyme. Dev Biol. 272 (2), 432-447 (2004).
- White, P. M., Stone, J. S., Groves, A. K., Segil, N. EGFR signaling is required for regenerative proliferation in the cochlea: conservation in birds and mammals. Dev Biol. 363 (1), 191-200 (2012).
- Gnedeva, K., Jacobo, A., Salvi, J. D., Petelski, A. A., Hudspeth, A. J. Elastic force restricts growth of the murine utricle. eLife. 6, (2017).
- Aragona, M., et al. A mechanical checkpoint controls multicellular growth through YAP/TAZ regulation by actin-processing factors. Cell. 154 (5), 1047-1059 (2013).
- Dong, J., et al. Elucidation of a universal size-control mechanism in Drosophila and mammals. Cell. 130 (6), 1120-1133 (2007).
- Low, B. C., Pan, C. Q., Shivashankar, G. V., Bershadsky, A., Sudol, M., Sheetz, M. YAP/TAZ as mechanosensors and mechanotransducers in regulating organ size and tumor growth. FEBS Lett. 588 (16), 2663-2670 (2014).
- Zhao, B., et al. Inactivation of YAP oncoprotein by the Hippo pathway is involved in cell contact inhibition and tissue growth control. Genes Dev. 21 (21), 2747-2761 (2007).
- AVMA Guidelines for the Euthanasia of Animals: 2013 Edition. , (2013).
- Semerci, F., et al. Lunatic fringe-mediated Notch signaling regulates adult hippocampal neural stem cell maintenance. eLife. 6, (2017).
- Tuan, R. S., Lo, C. W. Developmental biology protocols. Methods in molecular biology. , Humana Press. Totowa, N.J. 137(2000).
- Brandon, C. S., Voelkel-Johnson, C., May, L. A., Cunningham, L. L. Dissection of adult mouse utricle and adenovirus-mediated supporting-cell infection. J Vis Exp JoVE. (61), (2012).
- Gosset, M., Berenbaum, F., Thirion, S., Jacques, C. Primary culture and phenotyping of murine chondrocytes. Nat Protoc. 3 (8), 1253-1260 (2008).
- Landegger, L. D., et al. A synthetic AAV vector enables safe and efficient gene transfer to the mammalian inner ear. Nat Biotechnol. 35 (3), 280-284 (2017).
- Burns, J. C., et al. Reinforcement of cell junctions correlates with the absence of hair cell regeneration in mammals and its occurrence in birds. J Comp Neurol. 511 (3), 396-414 (2008).
- Wang, J., et al. Regulation of polarized extension and planar cell polarity in the cochlea by the vertebrate PCP pathway. Nat Genet. 37 (9), 980-985 (2005).
- Chacon-Heszele, M. F., Ren, D., Reynolds, A. B., Chi, F., Chen, P. Regulation of cochlear convergent extension by the vertebrate planar cell polarity pathway is dependent on p120-catenin. Dev Camb Engl. 139 (5), 968-978 (2012).
- Yamamoto, N., Okano, T., Ma, X., Adelstein, R. S., Kelley, M. W. Myosin II regulates extension, growth and patterning in the mammalian cochlear duct. Dev Camb Engl. 136 (12), 1977-1986 (2009).
- Tada, M., Heisenberg, C. -P. Convergent extension: using collective cell migration and cell intercalation to shape embryos. Dev Camb Engl. 139 (21), 3897-3904 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten