Method Article
Vestibular 및 청각 감각 기관의 3 차원 Organotypic 문화
요약
Murine utricle에 달팽이 관의 3 차원 organotypic 문화 광학, 콜라겐 보존 타고 난 조직 형태를 젤 취소 조정 매트릭스 강성의 기계적 자극에 대 한 허용 및 바이러스 중재 유전자 납품을 허용.
초록
내가 감각 기관 포유류 실험적인 조작 및 광학 관측의 어려움 때문에 공부에 도전 하. 또한, 기존의 문화 기술을 허용 생화학 물결, 이러한 메서드는 내가 감각 기관의 발달 동안에 기계적인 힘 및 조직 경직 효과 공부 하는 방법을 제공 하지 않습니다. 여기는 그대로 murine utricle 이러한 한계를 극복 하는 달팽이 관의 3 차원 organotypic 문화에 대 한 방법에 설명 합니다. 여기에 설명 된 3 차원 매트릭스 강성의 조정 위한 기술 조직의 성장 반대 탄성 력의 조작을 허용 합니다. 이 방법은 따라서 내가 개발 하는 동안 기계적인 힘의 역할을 연구 하기 사용할 수 있습니다. 또한, 문화 유전자 바이러스 중재 배달, 이득 및 손실-의-기능 실험을 위해 사용 될 수 있는 허용 한다. 이 문화 메서드는 타고 난 세포를 유지 하 고 지 원하는 세포 vestibular 및 청각 감각 기관의 전통적인 2 차원 문화에 대 한 잠재적으로 우수한 대안 역할.
서문
대부분의 포유류 기관 개발 측면의 연구 생체 외에서 시스템에 의해 촉진 되었습니다. 두 가지 주요 방법을 지금 vestibular 감각 기관의 문화에 대 한 사용 된다: 부동성1 및 부착2 . 두 방법 모두 머리 세포 취약점3 및 재생1,4 체 외조사를 허용합니다. 또한, 노치5,6, Wnt7,8, 그리고 표 피 성장 인자 수용 체 (EGFR)9,10 신호 계곡 내가의 발달 역할을 설립, 부분적으로, 생체 외에서 문화 감각 epithelia 통해. 그러나, 세포 성장과 분화 제어 됩니다, 뿐만 아니라 세포 외 매트릭스의 강성 morphogens 세포 연락처 등 물리적 및 기계적 신호를 통해 뿐만 아니라에 의해 신호 및 기계적 스트레칭 또는 긴축 통해. 이러한 기계적 자극의 역할 개발 내가 vivo에서 조사 도전 이다. 또한, 기존의 자유 부동 및 부착 문화 방법 등 연구 시험관에 대 한 적합 하지 않습니다. 여기 우리는 방법 설명 젤 나 콜라겐에서 3 차원 organotypic 문화에 대 한 다양 한 경직의. 이 방법은 주로 vestibular 및 인공 감각 기관의 비보에 아키텍처를 유지 하며 성장과 분화11기계적인 힘의 효과 조사
기계적 자극 신호 통로12,,1314,15, 마 등 다운스트림 분자 이벤트 활성화 알려져 있습니다 때문에 기계적 자극을 결합할 수 중요 하다 와 생화학 및 유전 조작. 여기에 설명 된 문화 방법 바이러스 중재 유전자 배달 허용 하 고 따라서 공부 기계 기도 하 고 분자 내가 개발11동안 신호를 사용할 수 있습니다.
프로토콜
여기에 설명 된 모든 방법은 동물 관리 및 사용 위원회의 록펠러 대학와 남부 캘리포니아의 대학 승인 있다.
1. (선택 사항) 준비 콜라겐의 나 Mouse-tail 힘 줄에서 솔루션
참고: 콜라겐 나 솔루션 상업적으로 사용할 수 있습니다. 젤 준비에 대 한 제조업체의 지침을 따릅니다.
- 5-10 젊은 성인 (3-5 주 이전) 마우스 프로토콜 관련 기관 동물 관리 및 사용 위원회16에 의해 승인에 따라 이산화탄소와 어떤 강포한 유형 긴장의 안락사 꼬리를 수집 하 고 실 온에서 4 h의 최소 70% 에탄올에 잠수 하 여 소독.
참고: 그것은 과도 한 조직 탈수에 결과 힘 줄 추출 과정을 방해 이상 48 h에 대 한 보육은 피해 야 한다. - 메스 칼 날 경도 컷을 소개 하 고 집게로 전체 피부를 제거 하 여 각 꼬리에서 피부를 제거 합니다. 100 mm 페 트리 접시와 10 mm 세그먼트로 그들을 잘라 깨끗 한 70% 에탄올으로 가득 차 피부 꼬리를 전송 합니다.
참고: 조작 하기 어려운 꼬리의 가장 얇은 부분을 삭제 합니다. - 집게를 사용 하 여, 페 트리 접시의 바닥에 꼬리의 각 세그먼트를 보안 하 고 좋은 집게의 두 번째 쌍을 사용 하 여 한 번에 하나의 꼬리에서 힘 줄을 추출. 개별 힘 줄 섬유는 최소한의 저항으로 등장 한다.
참고: 오래 된, 둔 #5 포 셉이이 단계에 대 한 잘 작동합니다. - 100 mL의 멸 균, 분자 급 물에 아세트산의 (볼륨)에 의해 0.1% 솔루션을 준비 하 고 살 균 100 mm 페 트리 접시에 해당 솔루션의 10 mL를 추가. 페 트리 접시에 힘 줄을 전송 하 고 콜라겐 변성을 실 온에서 1 h 나 두고.
- 무딘, 곡선 팁 살 균 메스 또는 iridectomy가 위를 사용 하 여 1-2 m m 조각으로 힘 줄을 말하다. 살 균 50 mL 튜브에 다진된 힘 줄을 전송 하 고 0.1% 아세트산 50 mL에 볼륨을가지고 추가 합니다.
참고: 4 사용 또는 5 꼬리는 콜라겐을 달성 하기 위해 산의 각 50 ml 나 2.0-2.5 mg/mL의 농도. - 콜라겐을 냉장 나 완전 한 단백질 변성을 촉진 하기 위하여 48 h의 최소 4 ° C에서 솔루션. 탁상 소용돌이와 소용돌이 하루에 두 번 1 분에 대 한 최대 속도를 설정합니다.
- Bicinchoninic 산 분석 결과 사용 하 여 솔루션의 단백질 농도 측정, 조정 하는 콜라겐 나 4 ° c.에 초 산, 그리고 저장소의 0.1% 솔루션을 추가 하 여 2.0-2.5 mg/ml 농도
참고: 콜라겐 나 솔루션 1 ~ 2 년 동안 저장할 수 있습니다. - (선택 사항) 콜라겐을 원심 나 2000 x g 1 h 4 ° C와 반투명 최고 분수 (약 절반 볼륨의), 광학 투명 콜라겐을 달성 하기 위해 제 4에 젤 사용에 대 한 솔루션.
2입니다. Vestibular 및 청각 기관의 해 부
- 관련 기관 동물 관리 및 사용 위원회16에 의해 승인 하는 프로토콜에 따라 이산화탄소와 어떤 긴장 든 지의 임신 쥐 안락사 추출 하 고 배아를 목을 벨.
참고: Lfng 크리스챤T2/tdTomato 마우스 지원 4-hydroxytamoxifen17에 노출 시 세포의 영구 라벨 수 있도록 사용할 수 있습니다. - 모든 작업 표면과 해 부 악기, #5 집게와 머리 칼18의 2 개 쌍을 포함 하 여 70% 에탄올과 그들을 청소 하 여 소독.
- 살 균 메스 칼 날 경도 컷을 소개 하거나 #5 집게의 두 쌍을 사용 하 여 두 개의 반쪽에 각 머리 분할. 내부 귀19를 포함 하는 측 뼈를 추출 하 고 차가운 행 크의 균형된 소금물 (HBSS) 60 mm 페 트리 접시에 15 mL에 넣어. 얼음에 접시를 유지.
참고: 배아 단계에서 E13.5 E18.5의 범위에서 성공적으로 사용 되었습니다. - (선택 사항) 부드럽게 포함 30 mL 50 mL 원뿔 튜브에 그들을 흔들어 내 귀를 씻고 차가운 HBSS 및 교체는 HBSS 3 ~ 4 번. 얼음에 튜브를 유지.
참고: 이 단계는 조직 문화의 가능한 오염 제한 하 고 신속 하 게 조직의 저하와 세포 죽음을 방지 하는 4 ° C에 온도 가져온다. - 잘 #5 집게의 두 쌍을 사용 하 여, 내부 귀 측 뼈에서 하 고 차가운 HBSS 가득 60 mm 페 트리 접시에 귀, 3 또는 4 한 번에 전송 합니다.
- Vestibular 감각 기관 해 부.
- 최대 귀 중간 측 방향 하 고는 utricle 찾습니다. #5 집게의 두 쌍, vestibular 장기 주변 연골을 제거 합니다. 그림 1에서 같이 부드럽게 vestibular 신경은 utricle 및 saccule, 반원의 운하 사이 연결을 끊다. 부드럽게 당겨는 utricle와 귀에서 우수 하 고 수평 반원의 운하의 첨부 ampullae.
참고: 이 메서드는 단계 E16.5-E18.5의 내 귀에 사용할 수 있습니다. 섹션 3 아래 연골 파편을 보존.
- 최대 귀 중간 측 방향 하 고는 utricle 찾습니다. #5 집게의 두 쌍, vestibular 장기 주변 연골을 제거 합니다. 그림 1에서 같이 부드럽게 vestibular 신경은 utricle 및 saccule, 반원의 운하 사이 연결을 끊다. 부드럽게 당겨는 utricle와 귀에서 우수 하 고 수평 반원의 운하의 첨부 ampullae.
- 달팽이 관을 해 부.
- 집게를 #5 두 켤레와 청각 기관 주변 연골 조직을 제거 합니다. 그림 1에서 보듯이 부드럽게 사이 인공 와우는 saccule 연결을 끊다.
참고: 위한 단계 E13.5-E14.5, 내부를 치료 하 여 해 부 이전 연골을 부드럽게 귀 0.25% 콜라와 나 실 온에서 5 분에 대 한 인산 염 버퍼 식 염 수 (PBS) 솔루션. 섹션 3 아래 연골 파편을 보존.
- 집게를 #5 두 켤레와 청각 기관 주변 연골 조직을 제거 합니다. 그림 1에서 보듯이 부드럽게 사이 인공 와우는 saccule 연결을 끊다.
- 넓은 nonstick 팁 장착 200 µ L 피펫으로 사용 하 여, 성장 매체 구성 된 DMEM/F12 33 m m Dglucose, 19 m m 탄산, 15 m m 4(2hydroxyethyl)-보충으로 가득 30 mm 페 트리 접시에 utricles와 cochleae를 전송 1piperazineethanesulfonic 산 (HEPES), 1mm 글루타민, 1mm 니코틴, 20 mg/L와 표 피 성장 인자, 20 mg/L 섬유 아 세포 성장 인자, 10 mg/L 인슐린, 5.5 mg/L 올려진다, 및 5 µ g/L 나트륨 selenite.
- 해 부 동안에 소개 하는 상피에 상처의 치유를 허용 5% 이산화탄소와 기름 조직 문화 인큐베이터에서 37 ° C에서 최대 3 h utricle 준비 유지 합니다. 달팽이 관 준비 해 부 후 콜라겐 젤 10 분에 전송 한다.
참고: 얼음 처럼 차가운 HBSS에서 해 부를 수행 하기 때문에 거기 아무 필요도 사전 37 ° c.에 성장 매체를 따뜻한
3. (선택 사항) 콜라겐 조정 내가 Chondrocytes의 다양 한 농도 추가 하 여 강성을 젤
참고: Chondrocyte 격리 방법 Gosset 외 에서 수정 된 20
- 콜라의 1% 솔루션 준비 나 PBS와 저장소-80 ° c.에 100-200 µ L aliquots x 살 균 1 필요할 때 얼음에 서 리 없애다, 여러 freeze-thaw 주기를 피하.
- 연골의 조각을 수집 하기 좋은 집게를 사용 10-12 귀에서 vestibular 및 청각 기관의 해 부에서 남은. 연골에서 별도 결합 및 내가 조직. 30 mm 페 트리 접시에 연골을 전송 하 고 살 균 성장 매체의 300 µ L를 추가 합니다.
- 무딘 곡선된 팁 살 균 메스 블레이드 또는 iridectomy가 위를 사용 하 여 연골 조각 길이 약 0.5 m m를 달성 하기 위해 조직 말하다.
- 콜라를 추가 0.25%의 마지막 효소 농도 달성 하기 위해 연골과 매체를. 37 ° C와 5% 이산화탄소 기름에서 조직 문화 인큐베이터에 접시를 전송. 피펫으로 연골의 해리 조각과 솔루션에서 구별할 수 더 이상 없을 때까지 적극적으로 1000 µ L 피펫으로 매 20 분을 사용 하 여 다음 추가 20 분 동안 품 어.
참고: Utricle 준비 경우 chondrocyte 절연 2.9; 단계 수행할 수 있습니다. 그것은 걸립니다 약 2 시간 (pipetting 라운드 3-4). - 15 mL 원뿔 튜브에 세포 현 탁 액을 수집 하 고 살 균 1 x PBS와 10 mL을 볼륨을 조정 합니다. 4 ° c.에서 5 분 동안 800 x g에서 원심 분리기 상쾌한을 제거 하 고 살 균 1 x PBS의 10 mL에 셀 resuspend. 4 ° C에서 5 분 동안 800 x g에서 centrifuge 고는 상쾌한을 제거 합니다.
참고: 셀을 두 번; 세척 하는 것이 중요 모든 나머지 콜라 나 내가 젤 콜라겐을 다이제스트 것입니다. - 200 µ L 피펫으로 사용 하 여 셀 펠 릿을 부드럽게 resuspend을 피펫으로 문화 매체의 100 µ L를 추가 합니다. hemocytometer를 사용 하 여 셀을 계산 하 고 사용 하기 전에 얼음에 그들을 유지 하는 것.
- 젤 강성을 높이기 위해 추가 chondrocytes 무력화 콜라겐 젤 솔루션 (제 1 항) 하 고 급속 하 게 혼합 응고 전에 젤을 통해 셀을 배포.
참고: 탄성 계수는 콜라겐의 내가 젤 (강성 측정), chondrocytes 수와 선형 증가 추가11. 실험적 결정된 선형 함수 E 에 의해 관계를 설명 하는 206· = Nc + 15, 있는 E 파스칼 및 Nc 에서 탄성 계수는 수백만에서 chondrocytes 수입니다. 젤에 대 한 자세한 프로토콜에 대 한 강성 측정을 참조 하십시오 원래 제11.
4. 장소 내가 젤 콜라겐에서 Vestibular 또는 청각 감각 기관
- 살 균 1.5 mL 튜브에 콜라겐 준비 나 페 놀 레드 pH 지시자, 0.34 M 수산화 나트륨의 133 µ L, 0.9 M 나트륨 중 탄산염의 70 µ L와 1 M HEPES의 40 µ L 10 x PBS의 160 µ L를 혼합 하 여 중 합 솔루션. 얼음에 튜브를 유지.
참고: 이 제조 법 합 솔루션을 콜라겐 젤, 하지만 필요에 따라 조정 될 수의 2 개 mL를 준비 하는 데 필요한을 제공 합니다. - 합 솔루션 및 콜라겐의 400 µ L의 믹스 100 µ L 나 부드럽게 위아래로 냉장된 1.5 mL 튜브에 pipetting으로 얼음에 솔루션. 젤 강성을 높이기 위해 chondrocytes 포함 된 성장 매체의 50 µ L을 추가 하 고 섹션 3에 설명 된 대로 부드럽게 혼합 합니다.
- 중화 콜라겐의 500 µ L을 전송 나 솔루션 10 m m 유리 하단 삽입 냉장된 30 mm 페 트리 접시 또는 4-잘 접시의 우물.
참고: 그것은 콜라겐의 신속 하 고 고르지 못한 중 합을 방지 하기 위해 얼음에 모든 시 약을 유지 하는 중요 한 나. - 신속 하 게 무력화 콜라겐을 cochleae 또는 utricles를 전송 나 솔루션 메 마른 머리 칼18 와 미세 집게의 쌍 그들의 원하는 위치에 장기 조정.
참고: 콜라겐 나 솔루션 탁 되면서 중 합 1-2 분 후 눈에 띄게 된다. - 조직 중심 솔루션은 생산 후 완전 한 중 합을 보장 하기 위해 5% 이산화탄소와 기름 조직 문화 인큐베이터에서 37 ° C에서 페 트리 접시 또는 20 분 4-잘 접시를 놓습니다.
- 페 트리 접시 또는 4-잘 접시의 당 같은 매체의 500 µ L 당 0.5% 태아 둔감 한 혈 청 (FBS)와 보충 성장 매체의 3 mL를 추가 합니다. 5% 이산화탄소와 기름 조직 문화 인큐베이터에서 37 ° C에서 문화를 유지 합니다. 원하는 경우, 성장 매체 10 µ M 5-ethynyl-2´-deoxyuridine (듀) 세포 확산을 함께 보충.
참고: 원하는 경우 높은 FBS 농도 사용할 수 있습니다.
5. 바이러스 주사 Vestibular 및 청각 감각 기관의 3 차원 문화에
- 얼음에 원하는 바이러스에 서 리 없애다과 0.05%의 최종 염료 농도 달성 하기 위해 0.5 mL 원뿔 튜브에서 trypan 블루 솔루션 믹스. 10-20 x 염료를 사용 하 여 바이러스의 실질적인 희석을 피하기 위해. 얼음에 계속.
참고: 아 데 노비 루스 serotype 5 작품을 최고의 adeno 관련 바이러스 Anc80 두 세포를 감염 시킬 수 있습니다 반면 utricle19에서 지 원하는 세포를 감염 하 고는 utricle에 달팽이 관21셀을 지원 하기 위한. - 해 부 현미경 쌍안경의 높은 배율에서 관찰 하는 동안 깨끗 한 고 운 집게 micropipette 끌어당기는 사람에 준비 유리 바늘의 팁을 휴식.
참고: 그것은 바늘 끌어당기는 설정을 최적화 하는 것이 중요입니다. 9-12 m m 정강이로 바늘을 20-30 μ m 채용 적합합니다. - 인큐베이터에서 감각 기관 문화를 제거 합니다. microinjector에 바늘을 연결 하 고 염료 및 바이러스 혼합물의 2-3 µ L로 그것을 채우십시오. 해 부 현미경 눈 아래 그것을 관찰 하는 동안 바늘 감각 기관에 사전.
- 부드럽게 3 차원 utricular 문화의 엽과 상피 층을 통해 바늘 팁 드라이브. 파란색 염료 채울 utricle ampullae의 충 치 때까지 바이러스 성 혼합물을 주사.
참고: 감각 기관에 쉽게 접근할 수 있기 때문에 10 m m 유리 하단 페 트리 접시 주사에 대 한 최적입니다. - 5% 이산화탄소와 기름 조직 문화 인큐베이터에서 37 ° C에서 품 어.
참고: 녹색 또는 빨간색 형광 단백질을 바이러스 구문에서 사용 될 때 형광은 명백한 24 h 바이러스 성 변환 후.
결과
Vestibular 및 청각 감각 기관 배아 귀에서 교양 40 Pa 콜라겐에서 내가 젤 낮은 강성 미 발달 조건11을 흉내 낸 상대적으로 정상 차원 구조 (그림 1)를 유지 하 고 세포를 유지 하 고 셀 (그림 2 및 그림 3)를 지원합니다. 30% 이상 감소 셀 밀도 지원 하지만 (스튜던트 t-검정: n = 4, p < 0.004) 머리 세포 밀도 60% 감소 (스튜던트 t-검정: n = 5, p < 0.0001) utricular 문화 (그림 2에서에서 3 일 후 ), 복식 시간11 의 같은 기간 동안 보다 더 많은 흑점의 지역 (n = 3, p = 0.0002). 이 여기에서 설명 하는 3 차원 문화에 대 한 메서드 지원 수가 중요 한 증가 3 일 동안은 utricle에 기존 세포의 80%를 유지 하면서11, 세포에 대 한 사용 방법을 보여 줍니다. 3 차원 문화 E14.5 달팽이 관에서 설립, Sox2 긍정적인 조상 세포 문화 (그림 3)에서 3 일 후 내부 및 외부 머리 세포의 형태학 상으로 구별할 수 행으로 구분 합니다.
유전자 발현 바이러스 성 감염에 의하여 vestibular 및 청각 감각 기관의 3 차원 문화에서 조작할 수 있습니다. 4hydroxytamoxifen은 레이블 Lfng 있다T2/tdTomato 마우스17의 E15.5 배아에서 설립 인공 explants에 셀을 지원 문화 매체에 추가 됩니다. 아 데 노 바이러스의 주입 지원 기관의 자료(그림 4)에서 세포의 감염에 문화 결과의 루멘에 5를 입력 합니다. Utricular 문화 E17.5 배아, 주로 셀 감각 상피 (그림 4B)를 통해 지원의 감염에서 결과에서 설립의 루멘으로 동일한 바이러스의 주입.

그림 1. 도식 다이어그램의 해 빛 미세한 utricle 및 3 차원 콜라겐 달팽이 관의 대표 문화 나 젤. (A) A 도식 그리기 표현 감각 epithelia murine 내가 6 수용 체 장기의 (녹색). 레드 라인 utricle 및 달팽이 관의 해 부 동안에 소개 하는 컷을 나타냅니다. (B) 가벼운 현미경 이미지 묘사 E17.5 utricle (위 패널) 및 E14.5 달팽이 관 (하단 패널) 콜라겐 젤과 48 h에 대 한 교양에 포함 된. 스케일 바 100 µ m을 나타냅니다. 이 그림은 Gnedeva 외에서 수정 되었습니다. 11 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
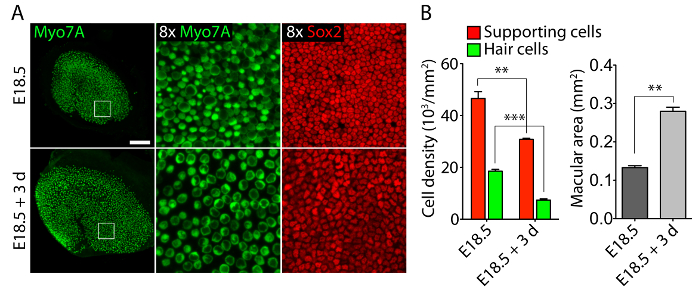
그림 2. 세포와 3 차원 utricular 문화 지원 셀. (A) Confocal 현미경 이미지 묘사 explantation (상단 패널) 이전 E18.5 utricle 고 3 일 후에 40-Pa 콜라겐에서 3 차원 문화 나 젤 (하단 패널). 세포 (녹색) Myo7A에 대 한 분류는 그리고 Sox2 (빨간색)에 대 한 세포 지원. 눈금 막대가 나타냅니다 50 µ m. (B) Quantifications를 E18.5 utricles explantation 이전 및 3 차원 기관 문화에서 3 일 후에 셀 밀도 (빨간색 막대), 머리 세포 밀도 (녹색 막대), 그리고 황 반 영역 (회색 막대)를 지원 ± SEMs 수단으로 표현 (p < 0.001로 표시 됩니다 * * 및 p < 0.0001로 * * *). 이 그림 Gnedeva 그 외 여러분 에서 수정 되었습니다. 11 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
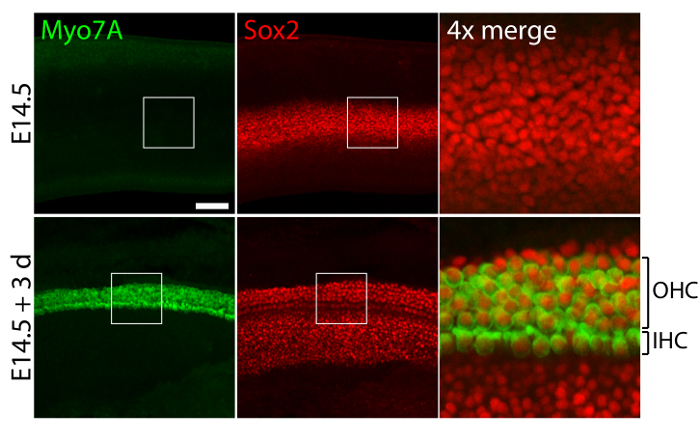
그림 3. 세포와 3 차원 인공 문화 지원 셀. Confocal 현미경 이미지 explantation (상단 패널) 이전 E14.5 달팽이 관을 묘사 하 고 3 일 후에 40-Pa 콜라겐에서 3 차원 문화 나 젤 (하단 패널). Myo7A-Sox2 긍정적인 내부 세포 (IHC) 및 외부 머리 세포 (OHC) 문화에서 3 일 후 4-5 행에 나타납니다. 지원 세포는 또한 분류 Sox2에 대 한 (빨간색). 눈금 막대를 나타냅니다 25 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 4. 달팽이 관 utricle의 3 차원 기관 문화에 바이러스 성 감염의 대표적인 결과. 아 데 노비 루스 serotype 5 3 차원 인공 문화에 감염 (GFP, 녹색) 장기의 기지에서 셀 (토마토, 붉은)를 지 원하는 Lfng 있다T2/tdTomato26 E15.5 배아 결과에서 설립의 하는 (A) 주입 감각 상피는 회색으로 구분 된. 눈금 막대 나타냅니다 100 µ m. (B) 3 차원 utricular 문화에 동일한 주사에서 설립 E17.5 태아 감염 (GFP, 녹색) 셀 (Sox2, 레드)는 장기에 걸쳐 지원의 결과. 감각 상피는 회색으로 구분 된. 눈금 막대는 100 µ m을 나타냅니다. 이 그림 Gnedeva 그 외 여러분 에서 수정 되었습니다. 11 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
중재 하십시오 성장 및 개발 하는 동안 내가 차별화 된 분자 신호5,6,7,8,,910광범위 하 게 공부. 그러나 Utricular 모델 시스템에서 얻은 증거는 세포 접합 및 Hippo 신호의 활성화를 통해 감지 기계적 신호 또한 중요 한 역할 이러한 프로세스2,11, 에서 제안 하는, 22. 또한, 모두 감각 상피에서 죽어가는 세포의 압출 및 transdifferentiation 통해 새로운 감각 수용 체의 후속 형성 영향을 미칠 수 잔여 지원 세포, 그들을 일으키는 의해 감지 하는 기계적인 힘 다시 재생성 하는 동안 세포 주기를 입력 합니다. 여기에 설명 된 3 차원 문화 시스템은 모두 성장 제어 내가 개발11 동안에 기계적인 힘의 역할 및, 잠재적으로, 머리 세포 동안 동일한 힘의 역할을 조사 하는 실험 방법을 재생입니다. 또한, 접근 용이 감각 상피, 따라서 허용 성장과 재생의 수사를 위한 기계 및 분자 조작의 조합에 있는 유전자 발현을 변경 하는 방법을 제공 하는 바이러스 성 감염에 귀의 감각 기관11.
방법의 한계는 최소한의 정보를 사용할 수 있는 내 생 세력 및 기계적 자극에 내가 embryogenesis 중 관계. 개발 내가에서 조직이 경직의 우리의 지식; 존재 하지 않는 따라서 콜라겐 나 젤의 어떤 강성 vivo에서 조건에 해당 하는 추정 하기 어렵다. 우리의 관측 및 모델은 utricle의 성장을 반대 하는 힘은 낮은 처음 장기 접근의 최종 크기11증가 하시기 바랍니다. 우리는 그러므로 chondrocytes 없이 젤 콜라겐 배아 vestibular 및 청각 감각 기관 문화는 순수 관련 기판은 가설.
여기 설명 하는 3 차원 문화 방법을 하면서 또한 이상 세포의 80% 문화 (그림 2)에서 3 일 후 utricular 황 반11새로운 지원 세포의 형성을 유도 합니다. 따라서 메서드는 utricle의 2 차원 문화에 대 한 뛰어난 대안을 나타냅니다, 세포의 어떤 유일한 40-50%에서 문화5,8에서 첫 번째 24 시간 후 생존과 머리 세포 취약점을 연구 하는 데 사용 수와 재생 체 외
우리가 보여 교양된 장기의 Corti에서 내부 및 외부 머리 세포의 해부학 적 구별 조직된 행의 형성, 더 많은 일 이지만 여기 설명 하는 3 차원 문화 방법을 정상 지원 하는지 여부를 결정 하는 데 필요한 집중 확장 (CE)23,,2425의 과정에서 달팽이 덕트 신장 CE 셀 이동, 재배열, 및 셀 연락처 변경26 개발 달팽이 덕트 주변 조직에 의해 생성 하는 외부 힘에 의해 영향을 받을 수 있는 포함 하는 매우 동적인 공정 이다. 이 방법은 상대적으로 정상적인 3 차원 조직 아키텍처, 유지 않습니다 그리고 잠재적으로 CE에서 생체 외에서의 연구에 대 한 도움이 될 수 있습니다.
공개
저자는 공개 없다.
감사의 말
우리이 프로토콜 기반으로 원래 연구에 그들의 공헌에 대 한 박사 A. 야 코 보, 닥터 제이 Salvi, 그리고 A. Petelski 감사 합니다. 우리 또한 기술 지원 및 축산에 대 한 제이 라마와 W. Makmura을 감사합니다. 우리 R01DC015530, 로버트 슨 치료 개발 기금, 그리고 자금 카루소 가족 재단 NIDCD 부여 NIDCD 훈련 그랜트 T32 DC009975, 인정 합니다. 마지막으로, 우리는 하 워드 휴즈 의학 연구소, 박사 Hudspeth 탐정은 지원을 인정 합니다.
자료
| Name | Company | Catalog Number | Comments |
| #10 Surgical Blades | Miltex | 4-110 | |
| #5 Forceps | Dumont | 11252-20 | |
| 100 mm Petri dish | Sigma | P5856-500EA | |
| 250 uL large orifice pipette tips | USA Scientific | 1011-8406 | |
| 30 mm glass-bottom Petri dish | Matsunami Glass USA Corporation | D35-14-1.5-U | |
| 4 well plate | Thermo Fisher Scientific | 176740 | |
| 4-Hydroxytamoxifen | Sigma | H7904 | |
| 60 mm Petri dish | Thermo Fisher Scientific | 123TS1 | |
| Acetic acid | Sigma | 537020 | |
| Ad-GFP | Vector Biolabs | 1060 | |
| Anti-GFP, chicken IgY fraction | Invitrogen | A10262 | |
| Anti-Myo7A | Proteus Biosciences | 25-6790 | |
| Anti-Sox2 Antibody (Y-17) | Santa Cruz | sc-17320 | |
| Bicinchoninic acid assay | Thermo Fisher Scientific | 23225 | |
| Click-iT EdU Alexa Fluor 647 Imaging Kit | Thermo Fisher Scientific | C10340 | |
| Collagenase I | Gibco | 17100017 | |
| D-glucose | Sigma | G8270 | |
| DMEM/F12 | Gibco | 11320033 | |
| Epidermal growth factor | Sigma | E9644 | |
| Fetal Bovine Serum (FBS) | Thermo Fisher Scientific | 16140063 | |
| Fibroblast growth factor | Sigma | F5392 | |
| Flaming/Brown Micropipette Puller | Sutter Instrument | P-97 | |
| Glutamine | Sigma | G8540 | |
| HBSS | Gibco | 14025092 | |
| Hemocytometer | Daigger | EF16034F | |
| HEPES | Sigma | H4034 | |
| Insulin | Sigma | I3536 | |
| Iridectomy scissors | Zepf Medical Instruments | 08-1201-10 | |
| Microinjector | Narishige | IM-6 | |
| Nicotinamide | Sigma | N0636 | |
| PBS (10X), pH 7.4 | Gibco | 70011044 | |
| PBS (1X), pH 7.4 | Gibco | 10010023 | |
| Phenol Red pH indicator | Sigma | P4633 | |
| Pure Ethanol, 200 Proof | Decon Labs | 2716 | |
| RFP antibody | ChromoTek | 5F8 | |
| Sodium bicarbonate | Sigma | S5761 | |
| Sodium hydroxide | Sigma | S8045 | |
| Sodium selenite | Sigma | S5261 | |
| Tabletop vortex | VWR | 97043-562 | |
| Transferrin | Sigma | T8158 | |
| Trypan blue | Sigma | T6146 |
참고문헌
- Oesterle, E. C., Tsue, T. T., Reh, T. A., Rubel, E. W. Hair-cell regeneration in organ cultures of the postnatal chicken inner ear. Hear Res. 70 (1), 85-108 (1993).
- Meyers, J. R., Corwin, J. T. Shape change controls supporting cell proliferation in lesioned mammalian balance epithelium. J Neurosci Off J Soc Neurosci. 27 (16), 4313-4325 (2007).
- Cunningham, L. L. The adult mouse utricle as an in vitro preparation for studies of ototoxic-drug-induced sensory hair cell death. Brain Res. 1091 (1), 277-281 (2006).
- Warchol, M. E., Lambert, P. R., Goldstein, B. J., Forge, A., Corwin, J. T. Regenerative proliferation in inner ear sensory epithelia from adult guinea pigs and humans. Science. 259 (5101), 1619-1622 (1993).
- Lin, V., Golub, J. S., Nguyen, T. B., Hume, C. R., Oesterle, E. C., Stone, J. S. Inhibition of Notch activity promotes nonmitotic regeneration of hair cells in the adult mouse utricles. J Neurosci Off J Soc Neurosci. 31 (43), 15329-15339 (2011).
- Wu, J., et al. Co-regulation of the Notch and Wnt signaling pathways promotes supporting cell proliferation and hair cell regeneration in mouse utricles. Sci Rep. 6, 29418(2016).
- Chai, R., et al. Wnt signaling induces proliferation of sensory precursors in the postnatal mouse cochlea. Proc Natl Acad Sci U S A. 109 (21), 8167-8172 (2012).
- Wang, T., et al. Lgr5+ cells regenerate hair cells via proliferation and direct transdifferentiation in damaged neonatal mouse utricle. Nat Commun. 6, 6613(2015).
- Doetzlhofer, A., White, P. M., Johnson, J. E., Segil, N., Groves, A. K. In vitro growth and differentiation of mammalian sensory hair cell progenitors: a requirement for EGF and periotic mesenchyme. Dev Biol. 272 (2), 432-447 (2004).
- White, P. M., Stone, J. S., Groves, A. K., Segil, N. EGFR signaling is required for regenerative proliferation in the cochlea: conservation in birds and mammals. Dev Biol. 363 (1), 191-200 (2012).
- Gnedeva, K., Jacobo, A., Salvi, J. D., Petelski, A. A., Hudspeth, A. J. Elastic force restricts growth of the murine utricle. eLife. 6, (2017).
- Aragona, M., et al. A mechanical checkpoint controls multicellular growth through YAP/TAZ regulation by actin-processing factors. Cell. 154 (5), 1047-1059 (2013).
- Dong, J., et al. Elucidation of a universal size-control mechanism in Drosophila and mammals. Cell. 130 (6), 1120-1133 (2007).
- Low, B. C., Pan, C. Q., Shivashankar, G. V., Bershadsky, A., Sudol, M., Sheetz, M. YAP/TAZ as mechanosensors and mechanotransducers in regulating organ size and tumor growth. FEBS Lett. 588 (16), 2663-2670 (2014).
- Zhao, B., et al. Inactivation of YAP oncoprotein by the Hippo pathway is involved in cell contact inhibition and tissue growth control. Genes Dev. 21 (21), 2747-2761 (2007).
- AVMA Guidelines for the Euthanasia of Animals: 2013 Edition. , (2013).
- Semerci, F., et al. Lunatic fringe-mediated Notch signaling regulates adult hippocampal neural stem cell maintenance. eLife. 6, (2017).
- Tuan, R. S., Lo, C. W. Developmental biology protocols. Methods in molecular biology. , Humana Press. Totowa, N.J. 137(2000).
- Brandon, C. S., Voelkel-Johnson, C., May, L. A., Cunningham, L. L. Dissection of adult mouse utricle and adenovirus-mediated supporting-cell infection. J Vis Exp JoVE. (61), (2012).
- Gosset, M., Berenbaum, F., Thirion, S., Jacques, C. Primary culture and phenotyping of murine chondrocytes. Nat Protoc. 3 (8), 1253-1260 (2008).
- Landegger, L. D., et al. A synthetic AAV vector enables safe and efficient gene transfer to the mammalian inner ear. Nat Biotechnol. 35 (3), 280-284 (2017).
- Burns, J. C., et al. Reinforcement of cell junctions correlates with the absence of hair cell regeneration in mammals and its occurrence in birds. J Comp Neurol. 511 (3), 396-414 (2008).
- Wang, J., et al. Regulation of polarized extension and planar cell polarity in the cochlea by the vertebrate PCP pathway. Nat Genet. 37 (9), 980-985 (2005).
- Chacon-Heszele, M. F., Ren, D., Reynolds, A. B., Chi, F., Chen, P. Regulation of cochlear convergent extension by the vertebrate planar cell polarity pathway is dependent on p120-catenin. Dev Camb Engl. 139 (5), 968-978 (2012).
- Yamamoto, N., Okano, T., Ma, X., Adelstein, R. S., Kelley, M. W. Myosin II regulates extension, growth and patterning in the mammalian cochlear duct. Dev Camb Engl. 136 (12), 1977-1986 (2009).
- Tada, M., Heisenberg, C. -P. Convergent extension: using collective cell migration and cell intercalation to shape embryos. Dev Camb Engl. 139 (21), 3897-3904 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유