Method Article
Мегакариоцитов дифференциации и образование тромбоцитов от человека пуповинной крови производные CD34 клетки+
В этой статье
Резюме
Очень чисто населения megakaryocytes могут быть получены из пуповинной крови производные CD34+ клеток. Метод для CD34+ изоляции и мегакариоцитов дифференцировки клеток описана здесь.
Аннотация
Производство тромбоцитов происходит главным образом в костном мозге в процессе, известном как thrombopoiesis. Во время thrombopoiesis прародитель гемопоэтических клеток дифференцировать в форме прекурсоров тромбоцитов под названием megakaryocytes, которые неизлечимо дифференцировать выпустить тромбоцитов долго цитоплазматических процессов, называемых proplatelets. Megakaryocytes являются редкие клетки, ограничивается костного мозга и поэтому трудно урожай в достаточном количестве для лабораторного использования. Эффективное производство человеческого megakaryocytes может быть достигнуто в пробирке путем культивирования CD34+ клеток при подходящих условиях. Протокол, здесь подробно описывает изоляции CD34+ клеток, магнитные ячейку Сортировка от образцов пуповинной крови. Описаны необходимые шаги для получения чистой, зрелый megakaryocytes сыворотки свободных условиях. Предоставляются также детали фенотипического анализа мегакариоцитов дифференциации и определение производства proplatelet формирования и тромбоцитов. Эффекторы, влияющих мегакариоцитов дифференциации и/или proplatelet формирования, такие как антитела анти-тромбоцитарный или thrombopoietin mimetics, могут быть добавлены культивируемых клеток, чтобы изучить биологические функции.
Введение
Изоляция адекватного числа первичных человеческих megakaryocytes (MK) для использования регулярных лабораторных невозможно из-за их низкой частоты в костном мозге, где они составляют ~0.01% ядерных клеток1. Удобной альтернативой является расширение ex vivo и дифференциации кроветворных стволовых и прогениторных клеток при наличии определенных факторов роста. Количество цитокинов, включая фактор стволовых клеток (СКФ; c комплект лигандом) и интерлейкина (IL) -3 и Ил-11 были заняты в системах культуры производить МКС. Thrombopoietin (ТПО) является наиболее эффективным фактором роста и дифференцировки для мегакариоцитарная культур и является эффективным в одиночку или с другими цитокинов, таких как СКФ и Ил-3-2. ТПО может действовать на население стволовых клеток в результате распространения и созревания МКС2.
MK производят тромбоцитов от цитоплазмы выступов, называется proplatelets и, в-vivo, примерно 1 х 1011 тромбоцитов формируется ежедневно для поддержания количества тромбоцитов в 150-400 x 109выпускаться тромбоцитов производства в пробирке — до 1000 -раз ниже, чем в естественных условиях оценки3, и это породило многочисленные культуры условий с помощью CD34+ клетки гемопоэтических предшественников для улучшения МК и тромбоцитов производства в пробирке. Первоначальный источник CD34+ ячеек, используемых для дифференциации MK было4периферической крови человека. Другие мобильные источники включают в себя костный мозг5,6, эмбриональных стволовых клеток и индуцированных плюрипотентных стволовых клеток (ESC/iPSC)7и пуповинной крови (УКБ)8,9,10 . Костного мозга человека CD34+ 11 и мыши линии отрицательных костного клетки5 продукции МК и тромбоцитов в vitro; Тем не менее, отсутствие наличия костного мозга человека ограничивает его использование в качестве источника CD34+ клеток. В противоположность этому ESC и iPSC представляют неограниченный источник клеток для производства в vitro тромбоцитов. Тромбоцитов производство из этих клеток требует фидер клеток, таких как мышиных OP9 клеток и дольше культуры. Тромбоцитов, полученных в условиях свободной подачи, как представляется, менее функциональной,12. iPSC производные тромбоцитов, вероятно быть применения в клинических условиях, так как они может быть расширена в крупном масштабе. Этот процесс требует лентивирусные опосредованной трансдукции факторов транскрипции и долгосрочные культуры клеток13.
UCB является доступным источником CD34+ клетки, которые могут быть легко использованы в исследования параметров. ТПО только может способствовать дифференциации шнура крови производные CD34+ клеток и это приводит к очень чистый, Зрелые МКС без необходимости в сыворотке добавок или совместного культуры с клетки фидера. Другие цитокины такие как СКФ может уменьшить дифференциации от UCB CD34+ клеток, в то время как лиганд Flt-3 и Ил-11 содействовать производству незрелых megakaryocytes14. Этот протокол описывает производства высоко чистых культур МК из пуповинной крови CD34+ клеток в условиях свободной от сыворотки.
протокол
Этот протокол был одобрен Юго Восточный Сидней человека Комитет по этике исследований и ратифицирован человека Комитет по этике исследований в Университете Нового Южного Уэльса. Пуповинная кровь, полученные от здоровых доноров была представлена в Сиднее банк пуповинной крови (Сидней, Новый Южный Уэльс, Австралия). Для этой процедуры были использованы томов приблизительно 100 мл.
Примечание: Работа в класс II биобезопасности, кабинет с помощью асептической техники. Обеззараживанию экстерьер пуповинной крови мешок с 70% этиловом спирте. Для этой процедуры используйте стерильные инструменты (ножницы, пинцеты).
1. кабель подготовка клетки крови и изоляции CD34 клетки+
- Подготовьте стерильные разделения буфера (SB) с-фосфатный буфер (PBS), pH 7.2 и содержащий 0,5% бычьего сывороточного альбумина и 2 мм ЭДТА.
- Обойтись 10 мл SB в 50 мл Конические трубки (1 тюбик 10 мл крови не требуется). С помощью G18 тупой иглой, монтируется на 10 мл шприц, привлечь 10 мл крови из мешка и обойтись в 50 мл пробирки с 10 мл SB.
- Добавьте 15 мл лимфоцитов разделения средств массовой информации (см. Таблицу материалы) в нижней части трубки, содержащий разбавленной крови, создавая два слоя.
Примечание: Отказаться от СМИ медленно в нижней части трубки, чтобы избежать смешивания различных уровней. - Центрифуга трубы на 1200 × г за 30 мин при комнатной температуре (RT) без перерыва и без ускорения.
- Передача слой вблизи центра трубка, содержащая мононуклеарных клеток (приблизительно 5-10 мл от каждой трубы) в новый Тюбик 50 мл с помощью пипетки Пастера. Добавьте SB в каждую пробирку с общим объемом 50 мл.
- Центрифуга на 400 g × 10 мин на RT. удалить супернатант.
- Ресуспензируйте клеток гранулы тщательно с пипетка Пастера в 5-10 мл SB. комбината подвесной клетки и довести объем до 50 мл с SB.
- Подсчет ячеек с помощью окрашивания Трипановый синий и Горяева или автоматизированных мобильных счетчика (см. Таблицу материалы). Чтобы определить процент CD34+ клеток в образце, Ресуспензируйте 2,5 × 105 клеток в 100 мкл SB и пятно, добавив 10 мкл антител анти CD34-PE для 15-30 мин при 4 ° C. Анализировать проточной цитометрии (рис. 1A).
- Пробирок на 400 g × 10 мин при 4 ° C. Выбросите супернатант.
Примечание: если они не требуются немедленно, мононуклеарных клеток могут быть заморожены на данном этапе. - Ресуспензируйте клетки в 300 мкл SB за 108 клеток. 100 мкл IgG человека FcR (блокирование реагента, смотрите Таблицу материалы) и 100 мкл CD34 магнитные шарики за 108 клеток. Осторожно перемешать и Инкубируйте на 4 ° C на 30-40 мин.
Примечание: Одна ячейка подвеска не требуется (при необходимости, пройти клетки хотя 30 мкм фильтр перед добавлением реагенты). Используйте реагент томов, описанные здесь 108 клеток или меньше. Для более чем 108 клеток масштабирование реагентов (SB, блокирования решения и CD34 магнитной бусины), соответственно. - Подготовьте LS разделения столбцов во время инкубационного периода, поместив столбец LS в магнитный держатель и мойки с 3 мл SB. удаления стоков.
Примечание: LS разделения столбцов могут быть загружены с до 2 × 108 всего клеток. Меньшие и большие столбцы доступны. - Добавить 5-10 мл SB в ячейку смесь и центрифуги на 400 × g 10 мин удалить супернатант.
- Ресуспензируйте клетки в 1,5 мл SB и загрузить суспензию клеток (1,5 мл) на столбце LS. Соберите поток через содержащие немеченого ячеек в коллекции 15 мл (отрицательный фракция #1). Пусть жидкость слейте воду и промойте колонку с 1,5 мл SB.
- Загрузить через (3 мл) собранных поток обратно в столбце и собирать через поток в же коллекции 15 мл трубки (отрицательный фракция #1). Промойте колонку LS 3 раза с 3 мл SB.
Примечание: Если требуется, клетки в отрицательных фракции (12 мл) смогите быть запятнано с анти CD34 антитела для выяснения захвата CD34+ ячеек в столбце LS. - Удалите столбец из магнитного сепаратора и очистить клетки медленно с поршень шприца в новой трубки 15 мл 2 мл SB.
- Место столбец обратно на магнитный сепаратор и нагрузки по 2 мл клеток обратно в столбце. Сбор через поток и мыть с 2 мл SB. Это негативное часть #2 (4 мл).
- Удалить столбец LS с магнитным сепаратором и добавить 2 мл SB. Flush клеток неуклонно и твердо с поршень шприца для сбора CD34+ клеток дроби. Подсчет количества ячеек, с помощью окрашивания Трипановый синий и Горяева или счетчик автоматизированных клеток.
- Пластиковых пробирок с позитивным дроби на 400 g × 15 мин при 4 ° C. Выбросите супернатант. Ресуспензируйте клеток в сыворотке свободных СМИ для CD34+ клетки (УЛП, смотрите Таблицу материалы).
Примечание: если они не требуются немедленно, клетки могут быть заморожены в жидком азоте на данном этапе.
2. чистоту проверка изолированных CD34 клетки+
- Пятно 2 х 104 клетки от положительных фракции с 10 антитела анти CD34-PE мкл и 20 мкл антител анти CD45-PerCP 15 мин при температуре 4 ° C (используйте отдельные трубки для управления изотипа) (рис. 1B).
- Добавьте 1 mL SB мыть. Центрифуга на 400 g × 10 мин Ресуспензируйте Пелле в 200 мкл SB.
- Выполнить анализ потока гранулярных и строба живой клетки населения исключить мусора (рис. 1B). Ворота для PE и PerCP положительных населения, с использованием элементов управления изотипа PE и PerCP (рис. 1B) и определить процент CD34+/CD45+ клеток.
3. мегакариоцитов дифференциация
- Семена 5 × 105 клеток/мл CD34+ клеток в 2 мл УЛП, дополнена 50 нг/мл рекомбинантного человеческого thrombopoietin (rhTPO) за хорошо в пластине 12-хорошо. Инкубируйте клетки при 37 ° C, 5% CO2 в атмосфере увлажненной. Если клетки вырожденная, прежде чем они требуются для анализа, сбора клеток и разделены на несколько скважин с свежими СМИ и rhTPO.
Примечание: Две или три скважины должны быть готовы специально отслеживать дифференциации в разное время точках (например, дни, 7, 9 и 10). - Урожай клетки из скважин, отложите в сторону для мониторинга дифференциация не нарушая ячеек в других скважин.
- Пятно клетки с 20 мкл антител анти GPIIb/CD41-FITC и 10 мкл анти GPIX/CD42a-Alexa Fluor 647 антитела в окончательный объем 100 мкл. Настройка элемента управления трубки, с использованием соответствующих isotype антитела управления. Инкубируйте 15-30 мин при 4 ° C.
- Добавьте 1 mL SB мыть.
- Добавьте 1 mL SB мыть. Центрифуга на 400 g × 10 мин Ресуспензируйте Пелле в 100 мкл SB и спина на стеклянное скольжение на 1000 x g для 5 минут исправить клетки на слайде путем погружения в метаноле за 30 с. воздух сухой, 20 мкл монтажа СМИ, содержащие DAPI (см. Таблицу материалы) , крышка с coverslip и визуализировать с помощью флуоресцентный микроскоп (рис. 2A).
- Вымойте с 2 мл PBS/0.1% тритон X 100 и центрифуги на 400 g × 10 мин, Ресуспензируйте в 100 мкл же буфера и добавить анти мыши IgG-Alexa 594 и анти кролик IgG-Alexa 488 (1: 100). Инкубируйте 30 мин при комнатной температуре, мыть с 2 мл PBS/0.1% тритон X 100, Ресуспензируйте в 100 мкл же буфера и добавить 20 мкл анти CD42b-APC. Затем спина клетки на стеклянных вставках, как описано в шаге 3.6.1 и подготовить образцы для микроскопических визуализации, как описано в шаге 3.6.1.
- Один раз мыть с 1 мл раствора SB и Ресуспензируйте Пелле в 300 мкл гипотонический цитрат буфера (1,25 мм цитрат натрия, хлорид натрия 2,5 мм, 3,5 мм декстроза) содержащий 20 мкг/мл пропидий йодидом и 0,05% Тритон-X 100. Инкубируйте 15 мин при 4 ° C, защищать от света.
- Добавить РНКазы в конечной концентрации 20 мкг/мл и Инкубируйте 30 мин при 4 ° C, защищать от света. Определите интенсивность пропидий йодидом проточной цитометрии, собирая 30000 до 50000 событий CD41-FITC+ населения (рис. 2 c).
4. proplatelet подсчет тромбоцитов перечисления и активации тромбоцитов
- Урожай клетки (из шага 3.1) в дни 8 или 9 дифференциации и семян на 1 × 104 клетки/колодец в 48-ну пластины в 200 мкл свежих УЛП, дополнена 50 нг/мл rhTPO. Культура на 5 дней при 37 ° C, 5% CO2.
Примечание: Для целей количественный, семя колодцы в трех экземплярах. Эта низкая плотность требуется для визуализации и подсчета proplatelet подшипника MK. Proplatelets обычно начинают появляться после 2 дней культуры. Пик-между 4 и 5 дней. - Подсчитать количество proplatelet подшипник МК в целом хорошо на Перевернутый световой микроскоп, используя 10 X или 20 X целей.
Примечание: С подогревом (37 ° C) микроскопа является предпочтительным, так как сохранение клеток при комнатной температуре для длительных периодов вызывает усадки proplatelet расширений. Proplatelets наблюдаются как долго расширения от MK тела. Каждый MK могут иметь несколько proplatelet выступов. Как proplatelets развиваются, тело MK уменьшается в размерах. - Урожай клетки и центрифуги на g 400 x 10 мин при комнатной температуре. Пятно клетки с 20 мкл антител анти человека CD41-FITC, как описано в шагах 3.3 и 3.4. Рассчитать процент MK proplatelet подшипник (pbMK): pbMK (%) = [(Proplatelet подшипник МКС/хорошо) / (всего CD41+ клеток / хорошо)] x 100
- Для подсчета тромбоцитов, выпущен в питательной среды, осторожно смешать клетки с пипетка Пастера и собирать 100 мкл в дни 14 или 15 культуры.
- Пятно с 20 мкл антинародным CD41-FITC антитела для 20-30 мин при 4 ° C. Настройка управления трубку с помощью соответствующих isotype антитела управления.
- Добавьте 150 мкл SB и 50 мкл подсчета бусины.
- Для анализа потока гранулярных установите FSC и SSC для входа масштаба. Использование нормальной крови тромбоцитов человека из тромбоцитов богатые плазмы витражи с CD41-FITC, как описано в разделе 4.4.1, чтобы задать ограничение для тромбоцитов (рис. 3A).
- Анализируйте окрашенных тромбоцитов с подсчета бусины проточной цитометрии. Соберите 1000 событий подсчета бусины с использованием FSC по сравнению SSC точечной диаграмме (рис. 3A). Рассчитайте количество тромбоцитов, основанные на CD41-FITC позитивные события (рис. 3B) по формуле:
Тромбоциты за мкл = [(количество CD41-FITC позитивные события)/1,000 beads)] x [(number of beads in 50 µL)/объем пробы)]
- Для анализа активации тромбоцитов, осторожно смешать клетки с пипетка Пастера и собирать 100 мкл в дни 14 или 15 культуры. Добавьте 1 mL Tyrode в буфер (137 мм NaCl, 2,7 мм KCl, MgCl 1 мм2, 1.8 мм CaCl2, 0,2 мм Na2HPO4, 12 мм NaHCO3, 5,5 мм D-глюкоза, рН 6,5) и центрифуги на 200 x g за 5 мин до Пелле клетки.
- Собирайте супернатант и центрифуги на 800 x g на 10 минут, чтобы гранулы тромбоцитов размера частиц.
- Отменить супернатант и Ресуспензируйте в 100 мкл буфера в Tyrode. 20 мкл антител PAC1-FITC и аденозиндифосфат (ADP) до конечной концентрации 20 мкм. инкубировать при комнатной температуре 20 мин анализ подачей cytometry определить процент FITC позитивные события. Используйте свежие тромбоцитов человека, относились так же, как положительный контроль (рис. 3 c).
Результаты
Этот протокол позволяет подготовки высоко чистых культур МК из пуповинной крови производные CD34+ клеток. Процент CD34+ клеток в пуповинной крови составляет примерно 1,3%15 (рис. 1A) и общее количество мононуклеарных клеток (шаг 1.8) колеблется от 90-300 x 106 единицу UCB. Чистота CD34 +/ CD45 + клеток после изоляции колеблется от 90 до 99% (рис. 1B). MK (определяется как CD41+ клетки) наблюдаются в начале сыворотки бесплатно CD34+ клеточные культуры в присутствии rhTPO. На 7 день, процент Зрелые MK (CD41+ и CD42a+ клетки) обычно составляет 30-40% (рис. 1 c). Высокий уровень CD41+ и CD42a+ двойной положительный клетки (90-99%) наблюдаются между дней 10 и 12 дифференциации (рис. 1 c). Изменчивость наблюдается зависит от основном источнике пуповинной крови и чистоту CD34+/CD45+ клетки изолированы в шаге 1.17. Урожай зрелых MK на день 10 колеблется от 5-10 за ввода CD34+ клеток. Зрелые MK (CD41+/CD42b+) наблюдается под Люминесцентная микроскопия показаны на рисунке 2A. Культивированный MK отображаются как большие, обычно многоядерные клетки (рисунок 2A, стрелок). MK на гранулированный содержание определяется vWf (зеленый) и CD62p (р селектина, красный) окрашивание (рис. 2B). В рисунке 2 cпоказано распределение плоидности, наблюдается в культивированный МКС.
Proplatelets являются длинные, вышитый бисером волокон или нитей, которые простираются от MK тела. Proplatelets может быть несколько сотен микрон длиной16 и содержат филиалов и растянутый регионов. Характеристика proplatelet подшипник MK проиллюстрирован на рис 2D. Доля proplatelet подшипник MK (pbMK) был 1,3 ± 0,17%.
Тромбоциты могут быть проанализированы и учитываются как описано в протоколе. Как показано на рисунке 3B, большинство тромбоцитов в клеточной культуре супернатанта подпадают аналитической ворота периферической крови тромбоцитов и являются позитивным для тромбоцитов маркер CD41 (рис. 3B). Тромбоцитов доходность от этого метода колеблется от 19 до 42 тромбоцитов на MK. тромбоцитов, произведенных в культуре может быть активирован тромбоцитов агонисты как ADP определяется расширение привязки активации конкретных PAC1 моноклональные антитела (рис. 3 c) .

Рисунок 1: Поток цитометрии участков CD34+ ячейки изоляции и MK дифференциация культуры. (A) мононуклеаров (закрытом как показано в левой панели) очищенного от человеческой пуповинной крови (шаг 1.8) окрашивали антитела анти CD34-PE для определения доли CD34+ клеток в образце (1,3%, правая панель). (B) после разделения, позитивные дроби (шаг 1.17) был окрашенных с анти CD34-PE и анти CD45 PerCP антител. Обогащенный CD34+ населения указывается на рисунке (98,1%, правая панель, верхний правый квадрат). (C) анализ фенотипических MK дифференцируются в vitro от CD34 + клеток для 7 дней или 11 дней были окрашенных с анти CD41 и анти CD42a антител. Зрелые MK являются позитивными для обеих CD41+ и CD42a+ (верхний правый квадрат). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2: MK окрашивание, плоидности и proplatelet формирование в vitro. (A) флуоресцентного изображения MK 11 день, окрашенных с анти CD41-PE и CD42b-APC антител. Ядер окрашивали DAPI. Желтая стрелка указывает несколько ядерных МКС. шкалы, 30 мкм. (B) флуоресцентных изображений день 14 МК, окрашенных с анти-vWf (зеленый), анти-CD62p (красный) и антитела анти CD42b-APC (пурпурный). Ядер окрашивали DAPI. Линейки, 15 мкм (C) представитель стробирования стратегия показаны плоидности распределение CD41+ события. Граф (Нижняя панель) показывает наблюдаемое распределение плоидности классов (n = 4), погрешностей, SD. (D) показана характерная морфология proplatelet подшипник MK. MK тело обозначается стрелкой. Долго цитоплазматических процессов, простирающейся от MK (proplatelets) обозначаются наконечники стрел. Это может быть неясно в некоторых областях/поля зрения ли одна или две MK производят эти proplatelet расширения. Это должно учитываться как один proplatelet подшипник MK. изображений, снятых с инвертированным микроскопом, 10 X цель. Линейки, 50 µm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
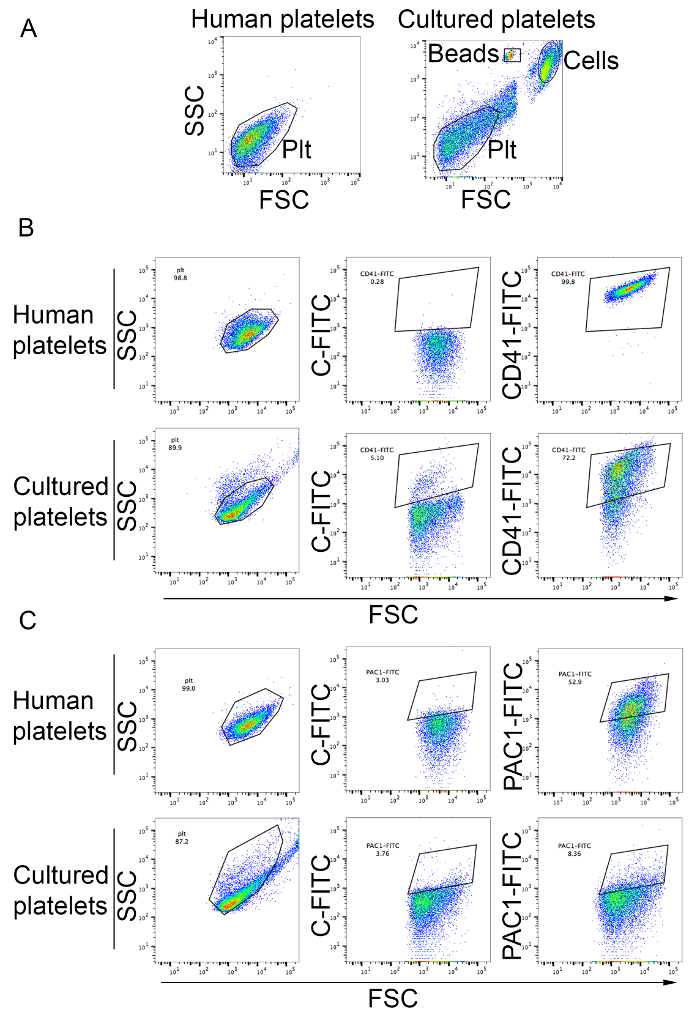
Рисунок 3: Обилие тромбоцитов производится в пробирке и тромбоцитов активации. (A) тромбоцитов человека из тромбоцитов богатые плазмы использовались для установки аналитического ворот с помощью логарифмическая шкала для передней и боковых точечной (левая панель). Правая панель показывает клетки от MK культур. Тромбоциты производства, в пробирке наблюдаются в аналитической ворота, определенные для тромбоцитов человека. Клетки и подсчета бусины указаны на рисунке. PLT, тромбоциты тромбоцитов (B), производимых в vitro окрашивали антитела анти CD41. Тромбоцитов человека из тромбоцитов богатые плазмы были использованы аналитические ворот с помощью логарифмическая шкала для вперед и стороны точечной и сравнить профиля в пределах CD41-FITC ворота. C-FITC, FITC изотипа управления (C) тромбоцитов активации после лечения ADP в конечной концентрации 20 мкм. тромбоцитов человека от тромбоцитов богатые плазмы были использованы в качестве контроля (верхней панели). Тромбоциты, производимых в культуре показаны в нижней панели. Привязка PAC1 антител указывает активации тромбоцитов. C-FITC, FITC изотипа управления. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Протокол, описанные здесь подходит для последовательного производства МК и тромбоцитов в культуре из пуповинной крови. Эти клетки могут использоваться для изучения различных процессов, таких как воздействие наркотиков или биологической деятельности на МК распространения, дифференциация, proplatelet формирования и тромбоцитов производства.
В литературе были представлены разнообразные культуры средств массовой информации и цитокина комбинаций. Добавление цитокинов, таких как фактор стволовых клеток, лигандом Flt-3, Ил-3 и ИЛ-6 поддерживает CD34+ клеток распространения. Однако это расширение приводит снижение MK чистоты в культуре14. Метод, представленные здесь, с использованием сыворотки свободных СМИ и rhTPO только, не позволяют значительное расширение клетки-предшественники, но позволяет unilineage мегакариоцитарная распространения и дифференциации и последовательного производства МК (90-99% CD41+ Двойной положительный клетки CD42a+ ) без загрязнения от других линий. Культуры периода формирования MK-10-12 дней без необходимости поддержки стромальные или клетки фидера. Это выгодно с другими методами, которые требуют больше культуры периодов (свыше 20 дней)17,18. Тромбоцитов выход из настоящего Протокола является 19-42 тромбоцитов в МК или до 420 тромбоцитов за ввода CD34+ клеток. Большинство протоколов результат в нижней тромбоцитов дает18,19.
Хотя выход является высоким по сравнению с другими методами, производить достаточное количество тромбоцитов для терапевтического использования необходимы большие источники CD34 клеток. Пуповинной крови MK Зрелые по более низкой ставке, как правило, меньше (из нижнего плоидности классов) и сократили тромбоцитов производственные мощности20. Тем не менее свежие UCB как правило является более доступным ресурсом, и это представляет собой значительное преимущество для исследователей. Другие методы, которые могут производить высокие урожаи МК и тромбоцитов с терапевтической цели были также описаны13,17.
Есть некоторые источники изменчивости рассмотреть: A) качество единицы пуповинной крови. Только пуповинной крови, собранные в течение 24 часов должен использоваться как источник CD34+ клеток. Следует также отказаться единиц крови шнура, содержащие сгустки. B) процент CD34+ клеток в мононуклеарных клеток фракции (шаг 1.8): использование мононуклеарных клеток фракций с менее 0,3% CD34+ клеток может привести к низкой урожайности относительно низкой чистоты CD34+ клетки. Эти клетки не рекомендуются для дифференциации MK. Важно, чтобы Жидкий сток только силой тяжести (например, шаги, 1.13, 1.14, 1.16). В случае закупорки столбца рекомендуется удалить столбец из магнита, вставьте клетки мягко с поршень шприца в новой трубки и перезагрузки на уравновешенной столбца.
Ряд условий влияет на число тромбоцитов и функции. Тромбоцитопения относится к заметное снижение числа тромбоцитов, что может привести к внешнего и внутреннего кровотечения. Авто иммунной условия, такие как иммунная тромбоцитопения (ITP) и препарат индуцированной тромбоцитопении (СТПР), хорошо известны причины тромбоцитопения21,22. Другие иммунные заболевания, такие как системная красная волчанка и ревматоидный артрит может также иметь пагубные последствия для тромбоцитов. Non иммунной тромбоцитопении причины лечение рака, тяжелой травмы, инфекции, недостаточность костного мозга и хирургии. Из-за высокой использования тромбоцитов пациентов, подвергающихся химиотерапии или получения стволовых клеток для трансплантации переливания тромбоцитов возрастала в последние десятилетия. МК и тромбоцитов исследования, несомненно, поможет в разработке больших масштабах тромбоцитов производства для клинического применения. Наличие в vitro производства функциональных тромбоцитов бы предотвратить дефицит тромбоцитов и позволяют Трансфузии тромбоцитов в огнеупорных пациентов. MK дифференциации и тромбоцитов производства в vitro являются важнейшими инструментами для изучения и понимания патологических состояний и физиологических механизмов, которые приводят к формированию тромбоцитов.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Авторы признают поддержке здравоохранения Австралии и Совет медицинских исследований (проект Грант 1012409 связан с БХК).
Материалы
| Name | Company | Catalog Number | Comments |
| Cell Culture Reagents | |||
| Recombinant Human TPO | Miltenyi Biotec | 130-094-013 | |
| StemSpan SFEM II | Stem Cell Technologies | 9605 | Serum-free media for CD34+ cells |
| Name | Company | Catalog Number | Comments |
| CD34 Isolation Reagents | |||
| CD34 MicroBead kit ultrapure | Miltenyi Biotec | 130-100-453 | This kit includes the FcR human IgG blocking reagent and CD34 microbeads. These beads contain the anti-CD34 antibody clone QBEND/10. Use a different anti-CD34 clone for purity check (e.g. clone 8G12). |
| Lymphoprep | Alere Technologies | 1114545 | Lymphocyte separation media (density 1.077 g/mL) |
| Sterile separation buffer (SB) | Miltenyi Biotec | 130-091-221 | This buffer contains phosphate buffered saline (PBS), pH 7.2 containing 0.5% bovine serum albumin and 2 mM EDTA. It can be prepared using sterile, cell culture grade components. De-gas before use because air bubbles can block the column. |
| Name | Company | Catalog Number | Comments |
| Flow Cytometry and Cell Staining Reagents | |||
| PE Mouse anti-Human CD34 | BD Biosciences | 340669 | Clone 8G12. This can be used for CD34 purity check. Final antibody concentration 1:10 dilution. |
| PerCP mouse anti-human CD45 | BD Biosciences | 347464 | 1:10 dilution |
| PerCP isotype control | BD Biosciences | 349044 | 1:10 dilution |
| FITC Mouse anti-Human CD41a | BD Biosciences | 340929 | Final antibody concentration 1:5 dilution. |
| APC Mouse anti-Human CD42b | BD Biosciences | 551061 | This antibody can also be used to detect mature MK (the percentage of positive cells in usually lower than with anti CD42a). Final antibody concentration 1:10 dilution. |
| Alexa Fluor 647 Mouse anti-Human CD42a | AbD Serotec | MCA1227A647T | Currently distributed by Bio-Rad. Final antibody concentration 1:10 dilution. |
| Alexa Fluor 647 Mouse Negative Control | AbD Serotec | MCA928A647 | Currently distributed by Bio-Rad. Isotype control antibody |
| Anti von Willebrand factor rabbit polyclonal | Abcam | AB6994 | 1:200 dilution |
| V450 mouse anti-humna CD41a | BD Biosciences | 58425 | 1: 20 dilution |
| V450 isotype control | BD Biosciences | 580373 | 1:20 dilution |
| PAC1-FITC antibody | BD Biosciences | 340507 | 1:10 dilution |
| Anti CD62p mouse monoclonal | Abcam | AB6632 | 1:200 dilution |
| Alexa Fluor 488 goat anti rabbit IgG | Invitrogen | A11008 | 1:100 dilution |
| Alexa Fluor 594 goat anti mouse IgG | Invitrogen | A11020 | 1:100 dilution |
| Ig Isotype Control cocktail-C | BD Biosciences | 558659 | Isotype control antibody |
| Propidium iodide | Sigma Aldrich | P4864 | |
| CountBright Absolute Counting Beads | Molecular Probes, Invitrogen | C36950 | Counting beads |
| Name | Company | Catalog Number | Comments |
| Materials | |||
| LS columns | Miltenyi Biotec | 130-042-401 | Smaller and larger columns are also commercially available |
| MidiMACS Separator magnet | Miltenyi Biotec | 130-042-302 | |
| MACS MultiStand | Miltenyi Biotec | 130-042-303 | |
| Falcon 5mL round bottom polypropylene FACS tubes, with Snap Cap, Sterile | In Vitro technologies | 352063 | |
| Glass slides | Menzel-Glaser | J3800AMNZ | |
| Mounting media with DAPI | Vector Laboratories | H-1200 | Antifade mounting medium with DAPI |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Inverted microscope | Leica | DMIRB inverted microscope | |
| Fluorescent microscope | Zeiss | Vert.A1 | |
| Cell analyser | BD Biosciences | FACS Canto II | |
| Cytospin centrifuge | ThermoScientific | Cytospin 4 | |
| Name | Company | Catalog Number | Comments |
| Software | |||
| Cell analyser software | BD Biosciences | FACS Diva Software | |
| Single cell analysis software | Tree Star | FlowJo | |
| Fluorescent microscope software | Zeiss | Zen 2 blue edition |
Ссылки
- Nakeff, A., Maat, B. Separation of megakaryocytes from mouse bone marrow by velocity sedimentation. Blood. 43 (4), 591-595 (1974).
- Zeigler, F. C., et al. In vitro megakaryocytopoietic and thrombopoietic activity of c-mpl ligand (TPO) on purified murine hematopoietic stem cells. Blood. 84 (12), 4045-4052 (1994).
- Reems, J. -. A., Pineault, N., Sun, S. In Vitro Megakaryocyte Production and Platelet Biogenesis: State of the Art. Transfus. Med. Rev. 24 (1), 33-43 (2010).
- Choi, E., Nichol, J. L., Hokom, M. M., Hornkohl, A. C., Hunt, P. Platelets generated in vitro from proplatelet-displaying human megakaryocytes are functional. Blood. 85 (2), 402-413 (1995).
- Perdomo, J., et al. A monopartite sequence is essential for p45 NF-E2 nuclear translocation, transcriptional activity and platelet production. J Thromb Haemost. 8 (11), 2542-2553 (2010).
- Shim, M. H., Hoover, A., Blake, N., Drachman, J. G., Reems, J. A. Gene expression profile of primary human CD34+CD38lo cells differentiating along the megakaryocyte lineage. Exp Hematol. 32 (7), 638-648 (2004).
- Feng, Q., et al. Scalable generation of universal platelets from human induced pluripotent stem cells. Stem cell reports. 3 (5), 817-831 (2014).
- Bruno, S., et al. In vitro and in vivo megakaryocyte differentiation of fresh and ex-vivo expanded cord blood cells: rapid and transient megakaryocyte reconstitution. Haematologica. 88 (4), 379-387 (2003).
- Iraqi, M., Perdomo, J., Yan, F., Choi, P. Y. I., Chong, B. H. Immune thrombocytopenia: antiplatelet autoantibodies inhibit proplatelet formation by megakaryocytes and impair platelet production in vitro. Haematologica. 100 (5), 623-632 (2015).
- Lev, P. R., et al. Impaired proplatelet formation in immune thrombocytopenia: a novel mechanism contributing to decreased platelet count. Br. J. Haematol. 165 (6), 854-864 (2014).
- Gandhi, M. J., Drachman, J. G., Reems, J. A., Thorning, D., Lannutti, B. J. A novel strategy for generating platelet-like fragments from megakaryocytic cell lines and human progenitor cells. Blood Cells Mol. Dis. 35 (1), 70-73 (2005).
- Lu, S. -. J., et al. Platelets generated from human embryonic stem cells are functional in vitro and in the microcirculation of living mice. Cell Res. 21 (3), 530-545 (2011).
- Moreau, T., et al. Large-scale production of megakaryocytes from human pluripotent stem cells by chemically defined forward programming. Nature Commun. 7, 11208 (2016).
- De Bruyn, C., Delforge, A., Martiat, P., Bron, D. Ex vivo expansion of megakaryocyte progenitor cells: cord blood versus mobilized peripheral blood. Stem Cells Dev. 14 (4), 415-424 (2005).
- Nimgaonkar, M. T., et al. A unique population of CD34+ cells in cord blood. Stem cells. 13 (2), 158-166 (1995).
- Italiano, J. E., Patel-Hett, S., Hartwig, J. H. Mechanics of proplatelet elaboration. J Thromb Haemost. 5, 18-23 (2007).
- Matsunaga, T., et al. Ex vivo large-scale generation of human platelets from cord blood CD34+ cells. Stem cells. 24 (12), 2877-2887 (2006).
- Sullenbarger, B., Bahng, J. H., Gruner, R., Kotov, N., Lasky, L. C. Prolonged continuous in vitro human platelet production using three-dimensional scaffolds. Exp Hematol. 37 (1), 101-110 (2009).
- Proulx, C., Boyer, L., Hurnanen, D. R., Lemieux, R. Preferential ex vivo expansion of megakaryocytes from human cord blood CD34+-enriched cells in the presence of thrombopoietin and limiting amounts of stem cell factor and Flt-3 ligand. J. Hematother. Stem Cell Res. 12 (2), 179-188 (2003).
- Bornstein, R., Garcia-Vela, J., Gilsanz, F., Auray, C., Cales, C. Cord blood megakaryocytes do not complete maturation, as indicated by impaired establishment of endomitosis and low expression of G1/S cyclins upon thrombopoietin-induced differentiation. Br. J. Haematol. 114 (2), 458-465 (2001).
- Chong, B. H., Choi, P. Y. I., Khachigian, L., Perdomo, J. Drug-induced Immune Thrombocytopenia. Hematol Oncol Clin North Am. 27 (3), (2013).
- Stasi, R., et al. Idiopathic thrombocytopenic purpura: Current concepts in pathophysiology and management. Thromb Haemost. 99 (1), 4-13 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены