Method Article
Diferenciación de megacariocitos y plaquetas formación de humanos CD34 derivadas de sangre de la cuerda+ de las células
En este artículo
Resumen
Una población altamente pura de megacariocitos puede obtenerse de cable derivadas de sangre CD34+ las células. Un método para CD34+ aislamiento y del megakaryocyte diferenciación se describe aquí.
Resumen
Producción de plaquetas se produce principalmente en la médula ósea en un proceso denominado Trombopoyesis. En la Trombopoyesis, células progenitoras hematopoyéticas distinguen a precursores de plaquetas de forma llamados megacariocitos, que terminal para liberar las plaquetas de procesos citoplásmicos largo denominados proplatelets. Megacariocitos son las células raras que limitan a la médula ósea y por lo tanto son difíciles de cosechar en número suficiente para uso en laboratorio. Producción eficiente de megakaryocytes humanos puede ser alcanzado en vitro por cultivo CD34+ de las células bajo condiciones convenientes. El protocolo detallado aquí describe el aislamiento de CD34 de las células+ por célula magnética clasificación de muestras de sangre de cordón umbilical. Se describen los pasos necesarios para producir los megakaryocytes altamente puros y maduros en condiciones libres de suero. También se proporcionan detalles de análisis fenotípico de la diferenciación de megacariocitos y determinación de la producción proplatelet de formación y de la plaqueta. Determinantes que influyen en la diferenciación de megacariocitos o formación de proplatelet, tales como anticuerpos antiplaquetarios o miméticos de la trombopoyetina, se pueden agregar a las células cultivadas para examinar la función biológica.
Introducción
Aislamiento de suficiente número de megacariocitos primarias humanas (MK) para uso en laboratorio regular no es factible debido a su baja frecuencia en la médula ósea, donde representan el ~0.01% de las células nucleadas1. Una alternativa conveniente es la expansión ex vivo y diferenciación de vástago de hematopoietic y células progenitoras en la presencia de factores de crecimiento específicos. Un número de citoquinas como factor de la célula de vástago (SCF; ligando c-kit) y el interleukin (IL) -3 y IL-11 ha sido empleadas en sistemas de cultivo para producir MKs. Thrombopoietin (TPO) es el factor más eficaz de crecimiento y la diferenciación megakaryocytic culturas y es eficaz solo o con otras citoquinas, como SCF y IL-32. TPO puede actuar sobre las poblaciones de células madre para dar lugar a la proliferación y maduración de MKs2.
Plaquetas de productos MK de protuberancias citoplasmáticas llamadas proplatelets y, en vivo, aproximadamente 1 x 1011 plaquetas formado diariamente para mantener las cuentas de plaqueta de 150-400 x 109plaquetas /L. producción en vitro es hasta 1000 -pliegue más bajo que el en vivo estima3, y esto ha dado lugar a numerosas condiciones de cultivo usando CD34+ células progenitoras hematopoyéticas para mejorar MK y plaquetas producción en vitro. La fuente inicial de CD34+ las células utilizadas para diferenciación de MK era sangre periférica4. Otras fuentes de células incluyen médula ósea5,6, inducido células madre embrionarias pluripotentes células madre (ESC/iPSC)7y cordón umbilical sangre (UCB)8,9,10 . Médula ósea humana CD34+ 11 y ratón linaje negativo médula células5 productos MK y las plaquetas in vitro; sin embargo, la falta de disponibilidad de médula ósea humana limita su uso como fuente de CD34+ las células. Por el contrario, ESC y iPSC representan una fuente ilimitada de células para la producción de plaquetas en vitro . Plaquetas la producción de estas células requiere células de alimentador como células murinas de OP9 y períodos más largos de la cultura. Plaquetas en condiciones libres de alimentación parecen ser menos funcional12. iPSC-derivado de las plaquetas están probable que sean de uso en contextos clínicos puesto que puede ser ampliados a gran escala. Este proceso requiere transducción mediada por lentivirales de factores de transcripción y a largo plazo de la célula cultura13.
UCB es una fuente accesible de CD34+ las células que se pueden usar en ajustes de la investigación. TPO solo puede promover la diferenciación de cable derivadas de sangre CD34+ las células y esto da lugar a MKs altamente puro, maduro, sin la necesidad de suplementos de suero o cocultivo con células de alimentador. Otras citocinas tales como SCF puede disminuir la diferenciación de UCB CD34+ de las células, mientras que el ligando de Flt-3 y IL-11 promoción la producción de megacariocitos inmaduros14. Este protocolo describe la producción de cultivos altamente puros de MK de sangre CD34+ las células en condiciones libres de suero.
Protocolo
Este protocolo fue aprobado por el Sur Oriental Sydney humano investigación Comité de ética y ratificado por el Comité de ética de investigación humana de la Universidad de New South Wales. Sangre del cordón umbilical obtenida de donantes sanos fue proporcionada por el Sydney cable de banco de sangre (Sydney, NSW, Australia). Se utilizaron volúmenes de 100 mL aproximadamente para este procedimiento.
Nota: Trabajo en un gabinete utilizando una técnica aséptica de bioseguridad clase II. Descontaminar el exterior de la bolsa de sangre de cordón con etanol al 70%. Utilizar instrumentos estériles (tijeras, pinzas) para este procedimiento.
1. cable de célula de sangre preparación y aislamiento de CD34 de las células+
- Preparar el tampón estéril separación (SB) con tampón fosfato salino (PBS), pH 7.2, y que contengan 0,5% bovino albúmina sérica y 2 mM EDTA.
- Pipetear 10 mL de SB en un tubo cónico de 50 mL (se requiere un tubo 10 mL de sangre). Utilizando una aguja Roma G18 montada en una jeringa de 10 mL, 10 mL de sangre de sacar de la bolsa y pipetear en los tubos de 50 mL que contiene 10 mL de SB.
- Añadir 15 mL de medio de separación de linfocitos (véase Tabla de materiales) a la parte inferior del tubo que contiene la sangre diluida, creando dos capas.
Nota: Servir los medios de comunicación poco a poco en la parte inferior del tubo para evitar mezclar las diferentes capas. - Centrifugar tubos a 1.200 × g durante 30 min a temperatura ambiente (RT) sin interrupción y sin aceleración.
- Transferir la capa cerca del centro del tubo que contiene las células mononucleares (aproximadamente 5-10 mL de cada tubo) en un nuevo tubo de 50 mL con una pipeta Pasteur. Añadir SB a cada tubo un volumen total de 50 mL.
- Centrifugar a 400 × g durante 10 min en RT. descartar el sobrenadante.
- Resuspender el pellet celular cuidadosamente con una pipeta Pasteur en 5-10 mL de SB combinan las células suspendidas y volumen a 50 mL con SB.
- Cuenta las células utilizando tinción Trypan azul y un hemocitómetro o automatizado de la célula contra (véase Tabla de materiales). Para determinar el porcentaje de CD34+ las células en la muestra, resuspender 2.5 × 105 células en 100 μl de SB y la mancha mediante la adición de 10 μl de anticuerpo anti-CD34-PE 15-30 min a 4 ° C. Análisis por citometría de flujo (figura 1A).
- Tubos de centrífuga en 400 × g por 10 min a 4 ° C. Deseche el sobrenadante.
Nota: Si no requiere inmediatamente, las células mononucleares se pueden congelar en este momento. - Resuspender las células en 300 μL de SB 108 células. Añada 100 μl de FcR de IgG humana (bloqueo reactivo, véase Tabla de materiales) y 100 μl de granos magnéticos de CD34 por 108 células. Mezclar suavemente e incubar a 4 ° C durante 30-40 minutos.
Nota: Se requiere que una suspensión unicelular (si es necesario, pasar las células aunque un filtro de 30 μm antes de añadir los reactivos). Utilizar volúmenes de reactivo descritos aquí para 108 células o menos. Para más de 108 células, escale los reactivos (SB, bloqueando la solución y bolas magnéticas CD34) en consecuencia. - Preparar la columna de la separación de LS durante el período de la incubación colocando la columna LS en un soporte magnético y lavado con 3 mL de SB desechar el efluente.
Nota: Las columnas de separación de LS se pueden cargar con hasta 2 × 108 células totales. Columnas más pequeñas y más grandes están disponibles. - Añadir 5-10 mL de SB a la mezcla de células y centrifugar a 400 x g durante 10 minutos eliminar el sobrenadante.
- Resuspender las células en 1,5 mL de SB y carga la suspensión celular (1.5 mL) en la columna de LS. Recoge el flujo a través de las células sin etiqueta en un tubo de colección de 15 mL (fracción negativa #1). Deje que el líquido escurrir y lavar la columna con 1,5 mL de SB.
- Carga el flujo recogido a través de (3 mL) en la columna y recoge el flujo a través del mismo tubo de colección de 15 mL (fracción negativa #1). Lavar la columna LS 3 veces con 3 mL de SB.
Nota: Si es necesario, las células de la fracción negativa (12 mL) pueden ser teñidas con anticuerpos anti-CD34 para determinar la captura de CD34 de las células+ por la columna de LS. - Quitar columna de separador magnético y lave las células lentamente con el émbolo de una jeringa en un nuevo tubo de 15 mL con 2 mL de SB.
- Coloque la columna en separador magnético y 2 mL de células de carga en la columna. Recoge el flujo a través y lavar con 2 mL SB. Se trata de la fracción negativa #2 (4 mL).
- Quitar LS columna de separador magnético y añadir 2 mL de SB ras células firmemente y constantemente con un émbolo de la jeringa para recoger el CD34+ fracción de la célula. Contar las células con tinción de azul de tripano y un hemocitómetro o contador de células automatizado.
- Tubo de centrífuga con la fracción positiva a 400 x g durante 15 min a 4 ° C. Deseche el sobrenadante. Resuspender las células en medios libres de suero para CD34+ las células (SFM, véase Tabla de materiales).
Nota: Si no requiere inmediatamente, las células pueden ser congeladas en nitrógeno líquido en esta etapa.
2. Check pureza de CD34 aisladas células+
- 2 x 104 células de la fracción positiva con 10 μl anti-CD34-PE y el anticuerpo 20 μl anti-CD45 PerCP durante 15 min a 4 ° C (uso tubo separado para los controles de isotipo) de la mancha (figura 1B).
- Añadir 1 mL de SB para lavar. Centrifugar a 400 x g durante 10 minutos pellet resuspender en 200 μL de SB.
- Realizar análisis cytometric del flujo y la población de células vivas para excluir los residuos (figura 1B) de la puerta. La puerta para PE y PerCP poblaciones positivas usando los PE y PerCP isotipo (figura 1B) y determinar el porcentaje de CD34+/CD45+ las células.
3. diferenciación de megacariocitos
- Semilla 5 × 105 células/mL CD34+ de las células en 2 mL de SFM suplementado con 50 ng/mL trombopoyetina humana recombinante (rhTPO) por pozo en una placa de 12 pozos. Incube las células a 37 ° C, 5% CO2 en un ambiente humidificado. Si las células son confluentes, antes de que se requiere para el análisis, cosechar las células y dividir en varios pozos con medio fresco y rhTPO.
Nota: Dos o tres pozos deben estar preparados específicamente para controlar la diferenciación en diferentes puntos temporales (por ejemplo, días 7, 9 y 10). - Cosechar las células de los pozos para monitorear la diferenciación sin molestar a las células en los otros pozos.
- Tinción de las células con el anticuerpo de anti-GPIIb/CD41-FITC de 20 μl y 10 μl anti-GPIX/CD42a-Alexa Fluor 647 el anticuerpo en un volumen final de 100 μl. establecer un control tubo usando los anticuerpos de control respectivo isotipo. Incube durante 15-30 min a 4 ° C.
- Añadir 1 mL de SB para lavar.
- Añadir 1 mL de SB para lavar. Centrifugar a 400 x g durante 10 minutos Resuspender el precipitado en 100 μl de SB y centrifugado sobre un portaobjetos de vidrio a 1.000 x g por 5 min fijar las células en la diapositiva por inmersión en metanol por 30 s. aire seco, añadir 20 μl de montaje multimedia con DAPI (véase Tabla de materiales) , cubrir con un cubreobjetos y visualizar utilizando un microscopio de fluorescencia (figura 2A).
- Lavar con 2 mL PBS/0.1% triton-X 100 centrifugar a 400 x g durante 10 min, resuspender en 100 μl de la solución de la misma y añadir anti-mouse IgG-Alexa 594 y anti-rabbit IgG-Alexa 488 (1: 100). Incubar durante 30 min a temperatura ambiente, lavar con 2 mL PBS/0.1% triton-X 100, resuspender en 100 μl de la solución de la misma y añadir 20 μl de anti CD42b-APC. Luego girar las células en portaobjetos, como se describe en el paso 3.6.1 y preparar muestras para visualización microscópica como se describe en el paso 3.6.1.
- Lavar una vez con 1 mL de SB y resuspender el precipitado en 300 μL de hipotónica citrato buffer (citrato de sodio 1,25 mM, 2,5 mM cloruro sódico, dextrosa 3,5 mM) que contiene 20 μg/ml propidio y 0.05% Triton-X 100. Incubar por 15 min a 4 ° C protegido de la luz.
- Añadir Rnasa a una concentración final de 20 μg/mL e incubar durante 30 min a 4 ° C protegido de la luz. Determinar la intensidad de yoduro de propidio por citometría de flujo por la recogida de 30.000 a 50.000 eventos de la población de CD41-FITC+ (figura 2).
4. proplatelet contando enumeración plaquetaria y activación de las plaquetas
- Las células (del paso 3.1) la cosecha en días 8 o 9 de la diferenciación y la semilla a 1 × 104 células/pozo en placas de 48 pocillos en 200 μL de fresco SFM suplementado con 50 ng/mL rhTPO. Cultura durante 5 días a 37 ° C, 5% CO2.
Nota: Para efectos de cuantificación, semilla pozos por triplicado. Esta baja densidad es necesaria para la visualización y contando del proplatelet-cojinete MK. Proplatelets generalmente comienzan a aparecer después de 2 días de la cultura. El pico es entre los días 4 y 5. - Contar el número de proplatelet-rodamiento de MK en el pozo todo en un microscopio de luz invertido usando 10 X o 20 X objetivos.
Nota: Una platina caliente (37 ° C) del microscopio es preferible, puesto que mantiene las células a temperatura ambiente durante períodos prolongados causa contracción de las extensiones proplatelet. Proplatelets se observan largas extensiones del cuerpo de MK. Cada MK tenga varias protuberancias proplatelet. Como desarrollar el proplatelets, el cuerpo del MK disminuye en tamaño. - Cosecha de las células y centrifugar a 400 x g durante 10 min a temperatura ambiente. Mancha las células con 20 μl anti-FITC CD41 anticuerpo, como se describe en los pasos 3.3 y 3.4. Calcular el porcentaje de MK proplatelet rodamiento (pbMK): pbMK (%) = [(Proplatelet-cojinete MKs/well) / (CD41 Total+ células / pozo)] x 100
- Para contar plaquetas liberadas en el medio de cultivo, las células se mezclan con una pipeta Pasteur y recoger 100 μl a los días 14 o 15 de la cultura.
- La mancha con 20 μl anti-FITC CD41 anticuerpo para 20-30 min a 4 ° C. Configurar un tubo de control utilizando el anticuerpo control de isotipo correspondiente.
- Añadir 150 μL de SB y 50 μl de contar los granos.
- Para el análisis cytometric del flujo, establece el FSC y SSC conectarse escala. Plaquetas sanguíneas humanas normales del uso de plasma rico en plaquetas teñidas con FITC CD41 como se describe en la sección 4.4.1 establecer la sincronización de las plaquetas (Figura 3A).
- Analizar las plaquetas manchadas con perlas de conteo por citometría de flujo. Recoger 1.000 eventos de contar cuentas usando el FSC frente a diagrama de dispersión SSC (Figura 3A). Calcular el número de plaquetas basado en CD41-FITC eventos positivos (figura 3B) utilizando la fórmula:
Plaquetas por μl = [(número de sucesos positivos CD41-FITC)/1,000 beads)] x [(number of beads in 50 µL)/volumen de la muestra)]
- Analizar la activación plaquetaria, suavemente las células se mezclan con una pipeta Pasteur y recoger 100 μl a los días 14 o 15 de la cultura. Añadir 1 mL de tampón (NaCl 137 mM, 2,7 mM KCl, 1 mM MgCl2, 1,8 mM CaCl2, 0,2 mM Na2HPO4, 12 mM NaHCO3, 5,5 mM D-glucosa, pH 6,5) y centrifugadora de Tyrode a 200 x g durante 5 minutos para que sedimenten las células.
- Recoger el sobrenadante y centrifugue a 800 x g durante 10 minutos para que sedimenten las partículas de tamaño de plaquetas.
- Deseche el sobrenadante y resuspender en 100 μl de buffer de Tyrode. Añadir 20 μl del anticuerpo PAC1-FITC y Adenosín difosfato (ADP) a una concentración final de 20 μm. incubar a temperatura ambiente durante 20 minutos analizar mediante citometría de flujo para determinar el porcentaje de sucesos positivos FITC. Uso de plaquetas humanas frescas tratadas en la misma forma que un control positivo (figura 3).
Resultados
Este protocolo permite la preparación de cultivos altamente puros de MK de cable derivadas de sangre CD34+ las células. El porcentaje de CD34+ las células de cordón de sangre es de aproximadamente 1,3%15 (figura 1A) y el número total de las gamas de células mononucleares (paso 1.8) de 90-300 x 106 por unidad UCB. La pureza de CD34 + / CD45 + células después de rangos aislamiento de 90 a 99% (figura 1B). MK (definido como CD41+ células) se observan principios de CD34 libre de suero+ cultivos en presencia de rhTPO celulares. En el día 7, el porcentaje de madurar MK (CD41+ y CD42a+ células) es generalmente 30-40% (figura 1). Los niveles más altos de CD41+ y CD42a+ se observan células dobles positivas (90-99%) entre los días 10 y 12 de diferenciación (figura 1). La variabilidad observada depende principalmente la fuente de sangre de cordón y de la pureza de la CD34+/CD45+ células aisladas en el paso 1.17. El rendimiento de MK madura en gamas del día 10 de 5-10 por CD34 entrada+ celular. Madura MK (CD41+/CD42b+) observada bajo fluorescentes microscopia se muestran en la figura 2A. MK cultivada aparecen como células grandes, generalmente multinucleadas (figura 2A, puntas de flecha). Contenido granular de MK se determinó por vWf (verde) y CD62p (p-selectina, rojo) tinción (figura 2B). En figura 2se muestra la distribución de ploidía en MKs cultivadas.
Proplatelets son fibras largas, con cuentas o filamentos que se extienden desde el cuerpo de MK. Proplatelets puede ser varios cientos de micrómetros de largo16 y contener ramas y regiones distendidas. Una característica proplatelet-rodamiento de MK se ilustra en la Figura 2D. El porcentaje de MK proplatelet rodamiento (pbMK) fue 1,3 ± 0,17%.
Plaquetas pueden ser analizadas y contó como se describe en el protocolo. Como se muestra en la figura 3B, más plaquetas en el sobrenadante de cultivo celular entran en la puerta del análisis de las plaquetas de sangre periféricas y son positivas para el marcador de plaquetas CD41 (figura 3B). La producción de plaquetas de este método se extiende de 19 a 42 plaquetas por MK. plaquetas producidas en la cultura puede ser activada por agonistas de plaquetas como ADP según lo determinado por la mayor unión del activación específica PAC1 monoclonal anticuerpos (figura 3) .

Figura 1: Flujo cytometry parcelas de CD34+ celular aislamiento y diferenciación de MK en cultura. (A) las células mononucleares (cerradas como se muestra en el panel izquierdo) purificadas de la sangre del cordón umbilical humano (paso 1.8) fueron teñidas con anticuerpos anti-CD34-PE para determinar el porcentaje de la CD34+ de las células en la muestra (1.3%, panel derecho). (B) después de la separación, la fracción positiva (paso 1.17) fue manchada con los anticuerpos de anti-CD34-PE y anti-CD45 PerCP. El CD34 enriquecido+ población se indica en la figura (98,1%, panel derecho, cuadrante superior derecho). (C) análisis fenotípico de MK diferenciados en vitro de las células CD34 + por 7 días o 11 días fueron teñidas con anticuerpos anti-CD41 y anti-CD42a. Madura MK son positivas para ambos CD41+ y CD42a+ (cuadrante superior derecho). Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: MK tinción, ploidía y formación proplatelet en vitro. (A) imágenes fluorescentes de día 11 MK teñidas con anti-CD41-PE y anticuerpos CD42b-APC. Los núcleos fueron teñidos con DAPI. Punta de flecha amarilla indica múltiples nuclear MKs. escala de la barra, 30 μm. (B) imágenes fluorescentes de día 14 MK teñidas con anti vWf (verde), CD62p (rojo) y anticuerpos anti-CD42b-APC (magenta). Los núcleos fueron teñidos con DAPI. Barra de escala, estrategia bloquea representante 15 μm (C) que muestra la distribución de la ploidía de CD41+ eventos. El gráfico (panel inferior) muestra la distribución observada de las clases de ploidía (n = 4), barras de error, SD (D) se muestra la morfología característica de cojinete proplatelet MK. El cuerpo de MK es indicado por la flecha. Puntas de flecha indican los procesos citoplásmicos largos que se extienden desde el MK (proplatelets). Puede ser confuso en algunas áreas/campos de la vista si uno o dos MK están produciendo estas extensiones proplatelet. Esto debe considerarse un cojinete proplatelet MK. imágenes tomadas con un microscopio invertido, el objetivo de X 10. Barra de escala 50 μm. haga clic aquí para ver una versión más grande de esta figura.
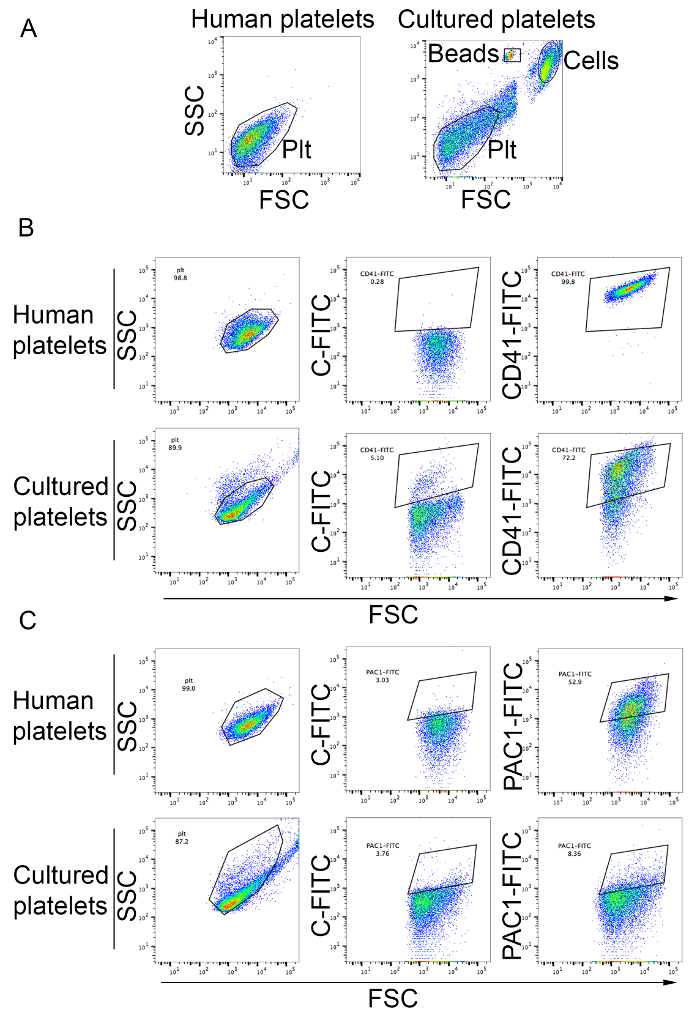
Figura 3: Abundancia de plaquetas producidas in vitro y plaqueta activación. (A) humano plaquetas del plasma rico en plaquetas se utilizaron para establecer la puerta analítica utilizando escala logarítmica para la dispersión hacia delante y lateral (panel izquierdo). El panel derecho muestra células de culturas de MK. Las plaquetas producidas en vitro se observan en la puerta analítica definida para las plaquetas humanas. Células y contar los granos se indican en la figura. PLT, plaquetas plaquetas (B) producidos en vitro fueron teñidas con anticuerpos anti-CD41. Humanas plaquetas del plasma rico en plaquetas fueron utilizadas para fijar la puerta analítica utilizando escala logarítmica para el avance y la dispersión lateral y comparar el perfil dentro de la puerta CD41-FITC. C-FITC, FITC isotipo control de plaquetas (C) activación después del tratamiento por ADP a una concentración final de 20 μm. humano plaquetas del plasma rico en plaquetas se utilizaron como control (paneles superiores). Las plaquetas producidas en cultura se muestran en los paneles inferiores. Atascamiento del PAC1 anticuerpo indica activación plaquetaria. C-FITC, control de isotipo FITC. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El protocolo descrito aquí es conveniente para la producción constante de MK y plaquetas en la cultura de la sangre del cordón umbilical. Estas células se pueden utilizar para estudiar varios procesos tales como el efecto de drogas o actividades biológicas sobre la proliferación de MK, diferenciación, formación proplatelet y producción de plaquetas.
Una variedad de medios de cultivo y combinaciones de citoquinas se han presentado en la literatura. Además de las citoquinas como el factor de células madre, ligando de Flt-3, IL-3 y IL-6 soportes CD34+ proliferación de la célula. Sin embargo, esta expansión resulta en menor pureza de MK en la cultura14. El método presentado aquí, utilizando los medios libres de suero y rhTPO solo, no permite una expansión significativa de las células progenitoras, pero permite unilineage megakaryocytic proliferación y diferenciación y constante producción de MK (CD41 90-99%+ Las células doble positivas de CD42a+ ) sin contaminación de otros linajes. El período de cultivo para la formación de MK es de 10 a 12 días sin la necesidad de apoyar a estroma o células de alimentador. Esto se compara favorablemente con otros métodos que requieren mayor cultura períodos (más de 20 días)17,18. La producción de plaquetas desde el presente Protocolo es 19-42 plaquetas por MK o hasta 420 plaquetas por CD34 entrada+ celular. La mayoría resultado de protocolos en la plaqueta inferior rinde18,19.
Aunque el rendimiento es alto en comparación con otros métodos, se necesitan fuentes grandes de células CD34 para producir un número suficiente de plaquetas para uso terapéutico. MK de sangre de cordón maduran a un ritmo inferior, son generalmente más pequeño (de clases más bajas de ploidía) y han reducido la capacidad de producción de plaquetas20. Sin embargo, UCB fresco suele ser un recurso más accesible y esto representa una ventaja significativa para los investigadores. Otros métodos que pueden producir rendimientos más altos de MK y plaquetas con fines terapéuticos también han sido descritos13,17.
Hay algunas fuentes de variabilidad a considerar: A) calidad de la unidad de sangre de cordón. Sólo la sangre del cordón umbilical recogida en 24 h se debe utilizar como una fuente de CD34+ las células. Unidades de sangre de cordón que contiene coágulos también deben ser descartadas. B) porcentaje de CD34 células+ en la fracción de células mononucleares (paso 1.8): usando fracciones de células mononucleares con menos de 0.3% CD34+ células pueden resultar en bajos rendimientos de poca pureza CD34+ de las células. Estas células no se recomiendan para la diferenciación de MK. Es esencial dejar que el drenaje de líquido por la fuerza de gravedad sólo (p. ej., pasos 1.13, 1.14, 1.16). En caso de bloqueo de la columna, se recomienda quitar la columna del imán, introducir las células suavemente con el émbolo de la jeringa en un tubo nuevo y cargar en una nueva columna equilibrada.
Un número de condiciones afecta la función y el número de plaquetas. Trombocitopenia se refiere a una marcada disminución en el número de plaquetas que puede conducir a sangrado interno y externo. Condiciones autoinmune tales como trombocitopenia inmune (PTI) y la trombocitopenia inducida por drogas (DITP) son causas bien conocidas de trombocitopenia21,22. Otras enfermedades inmunes como el lupus eritematoso sistémico y artritis reumatoide también pueden tener efectos perjudiciales en las plaquetas. Causas no inmunes de la trombocitopenia incluyen tratamiento contra el cáncer, traumatismos severos, infecciones, insuficiencia de la médula ósea y cirugía. Debido a la alta utilización de las plaquetas de los pacientes que reciben quimioterapia o recibir trasplantes de células madre, transfusión de plaquetas ha aumentado constantemente durante las últimas décadas. Investigación de MK y plaquetas sin duda ayudará en el desarrollo de la producción de plaquetas a gran escala para aplicaciones clínicas. Disponibilidad de en vitro producidas plaquetas funcionales prevenir la escasez de plaquetas y permite las transfusiones de plaquetas en pacientes refractarios. Diferenciación de MK y la producción de plaquetas en vitro son herramientas críticas para el estudio y comprensión de las condiciones patológicas y los mecanismos fisiológicos que conducen a la formación de plaquetas.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores reconocen el apoyo de la salud australiano y el Consejo de investigación médica (proyecto grant 1012409 ligado a CSF).
Materiales
| Name | Company | Catalog Number | Comments |
| Cell Culture Reagents | |||
| Recombinant Human TPO | Miltenyi Biotec | 130-094-013 | |
| StemSpan SFEM II | Stem Cell Technologies | 9605 | Serum-free media for CD34+ cells |
| Name | Company | Catalog Number | Comments |
| CD34 Isolation Reagents | |||
| CD34 MicroBead kit ultrapure | Miltenyi Biotec | 130-100-453 | This kit includes the FcR human IgG blocking reagent and CD34 microbeads. These beads contain the anti-CD34 antibody clone QBEND/10. Use a different anti-CD34 clone for purity check (e.g. clone 8G12). |
| Lymphoprep | Alere Technologies | 1114545 | Lymphocyte separation media (density 1.077 g/mL) |
| Sterile separation buffer (SB) | Miltenyi Biotec | 130-091-221 | This buffer contains phosphate buffered saline (PBS), pH 7.2 containing 0.5% bovine serum albumin and 2 mM EDTA. It can be prepared using sterile, cell culture grade components. De-gas before use because air bubbles can block the column. |
| Name | Company | Catalog Number | Comments |
| Flow Cytometry and Cell Staining Reagents | |||
| PE Mouse anti-Human CD34 | BD Biosciences | 340669 | Clone 8G12. This can be used for CD34 purity check. Final antibody concentration 1:10 dilution. |
| PerCP mouse anti-human CD45 | BD Biosciences | 347464 | 1:10 dilution |
| PerCP isotype control | BD Biosciences | 349044 | 1:10 dilution |
| FITC Mouse anti-Human CD41a | BD Biosciences | 340929 | Final antibody concentration 1:5 dilution. |
| APC Mouse anti-Human CD42b | BD Biosciences | 551061 | This antibody can also be used to detect mature MK (the percentage of positive cells in usually lower than with anti CD42a). Final antibody concentration 1:10 dilution. |
| Alexa Fluor 647 Mouse anti-Human CD42a | AbD Serotec | MCA1227A647T | Currently distributed by Bio-Rad. Final antibody concentration 1:10 dilution. |
| Alexa Fluor 647 Mouse Negative Control | AbD Serotec | MCA928A647 | Currently distributed by Bio-Rad. Isotype control antibody |
| Anti von Willebrand factor rabbit polyclonal | Abcam | AB6994 | 1:200 dilution |
| V450 mouse anti-humna CD41a | BD Biosciences | 58425 | 1: 20 dilution |
| V450 isotype control | BD Biosciences | 580373 | 1:20 dilution |
| PAC1-FITC antibody | BD Biosciences | 340507 | 1:10 dilution |
| Anti CD62p mouse monoclonal | Abcam | AB6632 | 1:200 dilution |
| Alexa Fluor 488 goat anti rabbit IgG | Invitrogen | A11008 | 1:100 dilution |
| Alexa Fluor 594 goat anti mouse IgG | Invitrogen | A11020 | 1:100 dilution |
| Ig Isotype Control cocktail-C | BD Biosciences | 558659 | Isotype control antibody |
| Propidium iodide | Sigma Aldrich | P4864 | |
| CountBright Absolute Counting Beads | Molecular Probes, Invitrogen | C36950 | Counting beads |
| Name | Company | Catalog Number | Comments |
| Materials | |||
| LS columns | Miltenyi Biotec | 130-042-401 | Smaller and larger columns are also commercially available |
| MidiMACS Separator magnet | Miltenyi Biotec | 130-042-302 | |
| MACS MultiStand | Miltenyi Biotec | 130-042-303 | |
| Falcon 5mL round bottom polypropylene FACS tubes, with Snap Cap, Sterile | In Vitro technologies | 352063 | |
| Glass slides | Menzel-Glaser | J3800AMNZ | |
| Mounting media with DAPI | Vector Laboratories | H-1200 | Antifade mounting medium with DAPI |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Inverted microscope | Leica | DMIRB inverted microscope | |
| Fluorescent microscope | Zeiss | Vert.A1 | |
| Cell analyser | BD Biosciences | FACS Canto II | |
| Cytospin centrifuge | ThermoScientific | Cytospin 4 | |
| Name | Company | Catalog Number | Comments |
| Software | |||
| Cell analyser software | BD Biosciences | FACS Diva Software | |
| Single cell analysis software | Tree Star | FlowJo | |
| Fluorescent microscope software | Zeiss | Zen 2 blue edition |
Referencias
- Nakeff, A., Maat, B. Separation of megakaryocytes from mouse bone marrow by velocity sedimentation. Blood. 43 (4), 591-595 (1974).
- Zeigler, F. C., et al. In vitro megakaryocytopoietic and thrombopoietic activity of c-mpl ligand (TPO) on purified murine hematopoietic stem cells. Blood. 84 (12), 4045-4052 (1994).
- Reems, J. -. A., Pineault, N., Sun, S. In Vitro Megakaryocyte Production and Platelet Biogenesis: State of the Art. Transfus. Med. Rev. 24 (1), 33-43 (2010).
- Choi, E., Nichol, J. L., Hokom, M. M., Hornkohl, A. C., Hunt, P. Platelets generated in vitro from proplatelet-displaying human megakaryocytes are functional. Blood. 85 (2), 402-413 (1995).
- Perdomo, J., et al. A monopartite sequence is essential for p45 NF-E2 nuclear translocation, transcriptional activity and platelet production. J Thromb Haemost. 8 (11), 2542-2553 (2010).
- Shim, M. H., Hoover, A., Blake, N., Drachman, J. G., Reems, J. A. Gene expression profile of primary human CD34+CD38lo cells differentiating along the megakaryocyte lineage. Exp Hematol. 32 (7), 638-648 (2004).
- Feng, Q., et al. Scalable generation of universal platelets from human induced pluripotent stem cells. Stem cell reports. 3 (5), 817-831 (2014).
- Bruno, S., et al. In vitro and in vivo megakaryocyte differentiation of fresh and ex-vivo expanded cord blood cells: rapid and transient megakaryocyte reconstitution. Haematologica. 88 (4), 379-387 (2003).
- Iraqi, M., Perdomo, J., Yan, F., Choi, P. Y. I., Chong, B. H. Immune thrombocytopenia: antiplatelet autoantibodies inhibit proplatelet formation by megakaryocytes and impair platelet production in vitro. Haematologica. 100 (5), 623-632 (2015).
- Lev, P. R., et al. Impaired proplatelet formation in immune thrombocytopenia: a novel mechanism contributing to decreased platelet count. Br. J. Haematol. 165 (6), 854-864 (2014).
- Gandhi, M. J., Drachman, J. G., Reems, J. A., Thorning, D., Lannutti, B. J. A novel strategy for generating platelet-like fragments from megakaryocytic cell lines and human progenitor cells. Blood Cells Mol. Dis. 35 (1), 70-73 (2005).
- Lu, S. -. J., et al. Platelets generated from human embryonic stem cells are functional in vitro and in the microcirculation of living mice. Cell Res. 21 (3), 530-545 (2011).
- Moreau, T., et al. Large-scale production of megakaryocytes from human pluripotent stem cells by chemically defined forward programming. Nature Commun. 7, 11208 (2016).
- De Bruyn, C., Delforge, A., Martiat, P., Bron, D. Ex vivo expansion of megakaryocyte progenitor cells: cord blood versus mobilized peripheral blood. Stem Cells Dev. 14 (4), 415-424 (2005).
- Nimgaonkar, M. T., et al. A unique population of CD34+ cells in cord blood. Stem cells. 13 (2), 158-166 (1995).
- Italiano, J. E., Patel-Hett, S., Hartwig, J. H. Mechanics of proplatelet elaboration. J Thromb Haemost. 5, 18-23 (2007).
- Matsunaga, T., et al. Ex vivo large-scale generation of human platelets from cord blood CD34+ cells. Stem cells. 24 (12), 2877-2887 (2006).
- Sullenbarger, B., Bahng, J. H., Gruner, R., Kotov, N., Lasky, L. C. Prolonged continuous in vitro human platelet production using three-dimensional scaffolds. Exp Hematol. 37 (1), 101-110 (2009).
- Proulx, C., Boyer, L., Hurnanen, D. R., Lemieux, R. Preferential ex vivo expansion of megakaryocytes from human cord blood CD34+-enriched cells in the presence of thrombopoietin and limiting amounts of stem cell factor and Flt-3 ligand. J. Hematother. Stem Cell Res. 12 (2), 179-188 (2003).
- Bornstein, R., Garcia-Vela, J., Gilsanz, F., Auray, C., Cales, C. Cord blood megakaryocytes do not complete maturation, as indicated by impaired establishment of endomitosis and low expression of G1/S cyclins upon thrombopoietin-induced differentiation. Br. J. Haematol. 114 (2), 458-465 (2001).
- Chong, B. H., Choi, P. Y. I., Khachigian, L., Perdomo, J. Drug-induced Immune Thrombocytopenia. Hematol Oncol Clin North Am. 27 (3), (2013).
- Stasi, R., et al. Idiopathic thrombocytopenic purpura: Current concepts in pathophysiology and management. Thromb Haemost. 99 (1), 4-13 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados