Method Article
Megacariócito diferenciação e formação de plaquetas de humanos cabo hemoderivados CD34 células+
Neste Artigo
Resumo
Uma população altamente pura de megacariócitos pode ser Obtida de cordão hemoderivados CD34+ células. Um método para CD34+ diferenciação de isolamento e megacariócito célula está descrita aqui.
Resumo
A produção de plaquetas ocorre principalmente na medula óssea em um processo conhecido como thrombopoiesis. Durante thrombopoiesis, células progenitoras hematopoiéticas diferenciam de precursores de plaquetas de formulário chamados megacariócitos, que diferenciam terminal para liberar as plaquetas de processos citoplasmáticos tempo denominados proplatelets. Megacariócitos são células raras confinadas à medula óssea e, portanto, são difíceis de colheita em número suficiente para uso em laboratório. Produção eficiente de megacariócitos humanas pode ser alcançada em vitro por cultivo CD34+ células sob condições apropriadas. O protocolo detalhado aqui descreve o isolamento de CD34+ células por célula magnética, classificação de amostras de sangue de cordão umbilical. São descritos os passos necessários para produzir megacariócitos altamente puros, maduros, em condições de livre de soro. Detalhes de análise fenotípica de diferenciação megacariócito e determinação da produção proplatelet de formação e plaquetas também são fornecidos. Efetores que influenciam a diferenciação do megacariócito e/ou formação proplatelet, tais como anticorpos anti-plaquetários ou mimetics trombopoietina, podem ser adicionados às células cultivadas para examinar a função biológica.
Introdução
Isolamento de números adequados de megacariócitos humanos primários (MK) para uso em laboratório regular não é viável devido a sua baixa frequência na medula óssea, onde eles representam ~0.01% de células nucleadas1. Uma alternativa conveniente é a expansão ex vivo e diferenciação de tronco hematopoiético e células progenitoras na presença de fatores de crescimento específicos. Um número de citocinas, incluindo o fator de células-tronco (SCF; c-kit ligand) e interleucina (IL) -3 e IL-11 foram empregadas nos sistemas de cultura para produzir MKs. Thrombopoietin (TPO) é o fator mais eficaz de crescimento e diferenciação para culturas megakaryocytic e é eficaz, sozinho ou com outras citocinas, tais como SCF e IL-32. TPO pode agir sobre as populações de células-tronco para ocasionar a proliferação e a maturação dos MKs2.
E MK produzem plaquetas de protrusões citoplasmáticas, chamados proplatelets, in vivo, aproximadamente 1 x 1011 plaquetas formada diariamente para manter a contagem de plaquetas de 150-400 x 109plaquetas /L. produção em vitro é até 1000 -Dobre inferior a na vivo estima3, e isto tem dado origem a inúmeras condições de cultura usando CD34+ células progenitoras hematopoiéticas para melhorar MK e plaquetas produção em vitro. A fonte inicial de CD34+ células utilizadas para diferenciação de MK foi sangue periférico humano4. Outras fontes de célula incluem a medula óssea5,6, células-tronco embrionárias/induzida (ESC/iPSC) as células-tronco pluripotentes7e cordão umbilical sangue (UCB)8,9,10 . Medula óssea humana CD34+ 11 e mouse linhagem negativa da medula óssea células5 produtos MK e plaquetas in vitro; no entanto, a falta de disponibilidade de medula óssea humana limita a sua utilização como fonte de CD34+ células. Em contraste, ESC e iPSC representam uma fonte ilimitada de células para a produção de plaquetas em vitro . Produção de plaquetas a partir dessas células requer alimentador células como murino células OP9 e períodos mais longos de cultura. As plaquetas derivadas no alimentador-free condições parecem ser menos funcional12. iPSC-derivado de plaquetas são susceptíveis de ser de uso em ambientes clínicos desde que eles podem ser expandidos para grande escala. Este processo requer transdução mediada por Lentivirus de fatores de transcrição e de cultura de células a longo prazo13.
UCB é uma fonte acessível de CD34+ células que podem ser facilmente usadas em configurações de pesquisa. TPO sozinho pode promover a diferenciação da medula hemoderivados CD34+ células e isto dá origem a MKs altamente puro, maduro, sem a necessidade de suplementação de soro ou co-cultura com células do alimentador. Outras citocinas tais como SCF pode diminuir a diferenciação da UCB CD34+ células, enquanto o ligante Flt-3 e IL-11 promovem a produção de megacariócitos imaturo14. Este protocolo descreve a produção de culturas de MK altamente puras do sangue do cordão CD34+ células em condições de livre de soro.
Protocolo
Este protocolo foi aprovado pelo sul oriental Sydney humano pesquisa Comitê de ética e ratificado pela Comissão de ética de pesquisa humana a Universidade de New South Wales'. Sangue de cordão umbilical obtido de doadores saudáveis foi fornecido por o Sydney banco de sangue (Sydney, NSW, Austrália). Volumes de cerca de 100 mL foram utilizados para este procedimento.
Nota: Trabalho em uma segurança biológica classe II gabinete utilizando técnica asséptica. Descontaminar o exterior do saco de sangue de cordão com etanol a 70%. Use instrumentos esterilizados (tesouras, pinças) para este procedimento.
1. cabo de isolamento de CD34 e preparação de glóbulos+ células
- Prepare o tampão estéril de separação (SB) com solução salina tamponada fosfato (PBS), em pH 7,2 e contendo 0,5% bovina albumina de soro e 2 mM EDTA.
- Dispense 10 mL de SB em um tubo cónico de 50 mL (um tubo por 10 mL de sangue é necessário). Usando uma agulha montada em uma seringa de 10 mL G18, retirar 10 mL de sangue do saco e distribuir para os tubos de 50 mL contendo 10 mL de SB.
- Adicione 15 mL de mídia de separação de linfócitos (ver Tabela de materiais) para o fundo do tubo contendo o sangue diluído, criando duas camadas.
Observação: Consomem mídia lentamente na parte inferior do tubo para evitar misturar as diferentes camadas. - Centrifugar tubos em 1.200 × g por 30 min à temperatura ambiente (RT) sem interrupção e sem aceleração.
- Transferi a camada perto do centro do tubo contendo células mononucleares (aproximadamente 5-10 mL de cada tubo) em um novo tubo de 50 mL com uma pipeta Pasteur. Adicione SB para cada tubo para um volume total de 50 mL.
- Centrifugar a 400 × g por 10 min a RT. descartar o sobrenadante.
- Resuspenda pelotas célula cuidadosamente com uma pipeta Pasteur em 5-10 mL de SB Combine as células suspensas e trazer volume para 50 mL com SB.
- Contagem de células usando Trypan azul coloração e um hemocytometer ou automatizada de células contador (ver Tabela de materiais). Para determinar a porcentagem de CD34+ células na amostra, Ressuspender 2,5 × 105 em 100 µ l de SB e mancha, adicionando 10 µ l de anticorpo anti-CD34-PE por 15-30 min a 4 ° C. Análise por citometria de fluxo (figura 1A).
- Tubos de centrífuga a 400 × g por 10 min a 4 ° C. Descarte o sobrenadante.
Nota: se não for necessário imediatamente, células mononucleares podem ser congeladas nesta fase. - Ressuspender as células em 300 µ l de SB por 108 células. Adicione 100 µ l de IgG humana FcR (bloqueio de reagente, consulte Tabela de materiais) e 100 µ l de CD34 grânulos magnéticos por 108 células. Misture delicadamente e incubar a 4 ° C por 30-40 min.
Nota: Uma suspensão de célula única é necessária (se necessário, passar as células embora um filtro 30 µm antes de adicionar os reagentes). Use os volumes de reagente descritos aqui por 10 células de8 ou menos. Para mais de 108 células, aumenta os reagentes (SB, bloqueando a solução e grânulos magnéticos CD34) conformemente. - Prepare a coluna de separação é durante o período de incubação, colocando a coluna de LS em um suporte magnético e o efluente de lavagem com 3 mL de SB Discard.
Nota: Colunas de separação de LS podem ser carregadas com até 2 × 108 células total. Colunas maiores e menores estão disponíveis. - Adicionar 5-10 mL de SB para a mistura de células e centrifugar 400 × g por 10 min. descartar o sobrenadante.
- Ressuspender as células em 1,5 mL de SB e carregar a suspensão de eritrócitos (1,5 mL) para a coluna de LS. Colete o fluxo que contém as células sem rótulo em um tubo de coleta de 15 mL (fração negativa #1). Deixe o líquido escorrer e lavar a coluna com 1,5 mL de SB.
- Carregar o fluxo coletado através de (3 mL) volta para a coluna e coletar o fluxo através do tubo de coleta 15 mL mesmo (fração negativa #1). Lave a coluna de LS 3 vezes com 3 mL de SB.
Nota: Se necessário, as células na fração negativa (12 mL) podem ser manchadas com anticorpo anti-CD34 para apurar a captura de CD34+ células pela coluna LS. - Remover coluna a partir do separador magnético e irrigue células lentamente com um êmbolo da seringa para um novo tubo de 15 mL com 2 mL de SB.
- Coloque a coluna volta no separador magnético e carga a 2 mL de células volta para a coluna. Coletar o fluxo através de e lavar com 2 mL SB. Esta é a fração negativa #2 (4 mL).
- Remover coluna LS de separador magnético e adicionar 2 mL de SB Flush células firmemente e firmemente com um êmbolo da seringa para coletar o CD34+ fração de célula. Conte as células com coloração azul trypan e um hemocytometer ou contador automatizado de células.
- Tubo de centrífuga com a fração positiva a 400 × g por 15 min a 4 ° C. Desprezar o sobrenadante. Ressuspender as células em media serum-free para CD34+ células (SFM, consulte Tabela de materiais).
Nota: se não for necessário, imediatamente, as células podem ser congeladas em nitrogênio líquido nesta fase.
2. seleção pureza de CD34 isoladas células+
- Mancha de 2 x 104 células da fracção positiva com 10 µ l anti-CD34-PE anticorpo e anticorpo anti-CD45-PerCP de 20 µ l por 15 min a 4 ° C (use um separado tubo para controles do isotipo) (figura 1B).
- Adicione 1 mL de SB para lavar. Centrifugar a 400 × g por 10 min. Ressuspender pelota em 200 µ l de SB.
- Realizar análise de fluxo cytometric e portão a população de células vivas para excluir os detritos (figura 1B). Definir o portão para PE PerCP positivo as populações e usando os controles de isotipo PE e PerCP (figura 1B) e determinar a porcentagem de CD34+/CD45+ células.
3. megacariócito diferenciação
- Semente de 5 × 105 células/mL CD34+ em 2 mL de SFM suplementado com 50 ng/mL Trombopoietina humana recombinante (rhTPO) por bem em uma placa de 12 células. Incube as células a 37 ° C, 5% de CO2 em um ambiente umidificado. Se as células são confluentes, antes que eles são necessários para a análise, colher as células e dividir em vários poços com mídia fresca e rhTPO.
Nota: Dois ou três poços devem ser preparados especificamente para monitorar a diferenciação em pontos de tempo diferente (por exemplo, dias 7, 9 e 10). - Colher células dos poços reservou para monitorar diferenciação sem perturbar as células em outros poços.
- Mancha de células com anticorpo anti-GPIIb/CD41-FITC de 20 µ l e 10 µ l anti-GPIX/CD42a-Alexa Fluor 647 anticorpo um volume final de 100 µ l. configurar um controle tubo usando anticorpos respectivos do isotipo controle. Incubar durante 15-30 min a 4 ° C.
- Adicione 1 mL de SB para lavar.
- Adicione 1 mL de SB para lavar. Centrifugar a 400 × g por 10 min. resuspenda o pellet em 100 µ l de SB e girar numa lâmina de vidro a 1.000 x g, durante 5 min. Fix células no slide mergulhando em metanol por 30 s. ar seco, adicionar 20 µ l de mídia contendo DAPI de montagem (ver Tabela de materiais) , cobrir com uma lamela e Visualizar usando um microscópio fluorescente (Figura 2A).
- Lavar com 2 mL PBS/0.1% triton-X100 e centrifugar a 400 × g por 10 min, resuspenda em 100 µ l de buffer mesmo e adicionar anti-mouse IgG-Alexa 594 e anti-coelho IgG-Alexa 488 (1: 100). Incubar durante 30 min à temperatura ambiente, lave com 2 mL PBS/0.1% triton-X100, resuspenda em 100 µ l de buffer mesmo e adicionar 20 µ l de anti CD42b-APC. Em seguida girar as células em lâminas de vidro, conforme descrito na etapa 3.6.1 e preparar amostras para visualização microscópica, conforme descrito na etapa 3.6.1.
- Lave uma vez com 1 mL de SB e resuspenda o pellet em 300 µ l de citrato hipotônica tampão (citrato de sódio 1,25 mM, 2,5 mM de cloreto de sódio, glicose de 3,5 mM) contendo 20 µ g/ml propidium iodeto e 0,05% Triton X 100. Incube por 15 min a 4 ° C, protegido da luz.
- Adicionar RNase a uma concentração final de 20 µ g/mL e incube por 30 min a 4 ° C, protegido da luz. Determine a intensidade de iodeto de propidium por citometria de fluxo através da recolha de 30.000 a 50.000 eventos da população CD41-FITC+ (Figura 2).
4. proplatelet contagem, Enumeração plaquetária e Ativação plaquetária
- Colheita de células (da etapa 3.1) cada dias 8 ou 9 da diferenciação e da semente no 1 × 104 células/poço em placas boas 48 em 200 µ l de SFM fresco suplementado com 50 ng/mL rhTPO. Cultura durante 5 dias a 37 ° C, 5% CO2.
Nota: Para fins de quantificação, semente wells em triplicado. Esta baixa densidade é necessária para a visualização e contagem dos proplatelet-rolamento Proplatelets MK geralmente começam a aparecer depois de 2 dias de cultura. O pico é entre os dias 4 e 5. - Conte o número de proplatelet-rolamento MK no poço inteiro em um microscópio invertido usando 10 X ou 20 X de objectivos.
Nota: Um palco de microscópio aquecida (37 ° C) é preferível, desde que manter as células à temperatura ambiente por períodos prolongados provoca encolhimento das extensões de proplatelet. Proplatelets são observados como longas extensões do corpo MK. Cada MK pode ter várias saliências proplatelet. Como desenvolver proplatelets, o corpo do MK diminui de tamanho. - Colheita de células e centrifugar a 400 x g durante 10 minutos à temperatura ambiente. Mancha de células com anticorpo anti-humano CD41-FITC 20 µ l como descrito nos passos 3.3 e 3.4. Calcular a porcentagem de MK proplatelet-rolamento (pbMK): pbMK (%) = [(Proplatelet-rolamento MKs/bem) / (Total CD41+ células / bem)] x 100
- Para contar as plaquetas lançadas no meio de cultura, delicadamente misture as células com uma pipeta Pasteur e coletar 100 µ l em dias 14 ou 15 da cultura.
- Mancha com 20 µ l anti-humano CD41-FITC de anticorpos para 20-30 min a 4 ° C. Configure um tubo de controle usando o respectivo do isotipo controle anticorpo.
- Adicione 150 µ l de SB e 50 µ l de contagem de grânulos.
- Para análise de fluxo cytometric, defina o FSC e SSC para escala de log. Uso normais plaquetas sanguíneas humanas do plasma rico em plaquetas manchado com CD41-FITC, conforme descrito na seção 4.4.1 para definir o canal para plaquetas (Figura 3A).
- Analise as plaquetas manchadas com a contagem de grânulos por citometria de fluxo. Colete 1.000 eventos de contagem de contas usando o FSC contra SSC gráfico de dispersão (Figura 3A). Calcule o número de plaquetas com base em eventos positivos CD41-FITC (Figura 3B) usando a fórmula:
Plaquetas por µ l = [(número de eventos positivos CD41-FITC)/1,000 beads)] x [(number of beads in 50 µL)/volume de amostra)]
- Para analisar a ativação plaquetária, delicadamente misture as células com uma pipeta Pasteur e coletar 100 µ l em dias 14 ou 15 da cultura. Adicione 1 mL do Tyrode buffer (137 mM NaCl, 2,7 mM KCl, 1 mM MgCl2, 1.8 mM CaCl2, 0,2 mM Na2HPO4, 12mm NaHCO3, 5,5 mM D-glicose, pH 6,5) e centrifugar a 200 x g por 5 min para células de Pelotas.
- Recolha o sobrenadante e centrifugar a 800 x g durante 10 minutos para as plaquetas de tamanho de partículas de Pelotas.
- Descartar o sobrenadante e ressuspender em 100 µ l de tampão de Tyrode. Adicionar 20 µ l de anticorpo PAC1-FITC e difosfato de adenosina (ADP) a uma concentração final de 20 µM. Incubar à temperatura ambiente por 20 min. análise por citometria de fluxo para determinar a porcentagem de eventos positivos FITC. Uso de plaquetas humanas frescas trataram da mesma maneira como um controle positivo (Figura 3).
Resultados
Este protocolo permite a preparação das culturas de MK altamente puras do cordão hemoderivados CD34+ células. A porcentagem de CD34+ células na medula sangue é, aproximadamente, 1,3%15 (figura 1A) e o número total de células mononucleares (passo 1.8) intervalos de 90-300 x 106 por unidade da UCB. A pureza do CD34 + / CD45 + células após intervalos de isolamento de 90 a 99% (figura 1B). MK (definido como CD41+ células) são observados no início de CD34 isento de soro+ culturas na presença de rhTPO de pilha. No dia 7, o percentual de amadurecer MK (CD41+ e CD42a+ células) é geralmente 30-40% (Figura 1). Os mais altos níveis de CD41+ e CD42a+ são observadas células positivas duplas (90-99%) entre os dias 10 e 12 de diferenciação (Figura 1). A variabilidade observada depende principalmente da fonte de sangue do cordão e a pureza do CD34+/CD45+ células isoladas na etapa 1.17. O rendimento de MK maduro em intervalos de 10 dia de 5-10 por CD34 entrada+ célula. Maduras MK (CD41+/CD42b+) observada sob fluorescente microscopia são mostrados na Figura 2A. MK culta aparecem como células grandes, geralmente multinucleadas (Figura 2A, pontas de seta). Conteúdo granular do MK foi determinado pelo vWf (verde) e CD62p (p-selectina, vermelho) coloração (Figura 2B). A distribuição de ploidia observada no MKs culta é mostrada na Figura 2.
Proplatelets são fibras longas, frisadas ou filamentos que se estendem desde o corpo de MK. Proplatelets pode ser várias centenas de micrômetros longa16 e conter ramos e regiões distendidas. Uma característica proplatelet-rolamento MK é ilustrada na Figura 2D. A porcentagem de MK proplatelet-rolamento (pbMK) foi 1,3 ± 0,17%.
As plaquetas podem ser analisadas e contadas como descrito no protocolo. Como mostrado na Figura 3B, a maioria das plaquetas no sobrenadante de cultura de pilha cair dentro o portal analítico das plaquetas de sangue periféricas e são positivas para o marcador de plaquetas CD41 (Figura 3B). O rendimento de plaquetas deste varia de método de 19 a 42 plaquetas por MK plaquetas produzidas na cultura pode ser ativado por agonistas de plaquetas como ADP, conforme determinado pelo maior ligação do anticorpo monoclonal PAC1 ativação específicos (Figura 3) .

Figura 1: Fluxo cytometry parcelas de CD34+ isolamento e diferenciação de MK em cultura celular. Células mononucleares (A) (condomínio fechadas como mostrado no painel a esquerda) purificadas do sangue do cordão umbilical humano (passo 1.8) foram coradas com anticorpo anti-CD34-PE para determinar a porcentagem do CD34+ células na amostra (1,3%, painel direito). (B) após a separação, a fração positiva (etapa 1.17) estava manchada com anti-CD34-PE e anti-CD45 PerCP anticorpos. O CD34 enriquecido+ população é indicada na figura (98,1%, painel direito, quadrante superior direito). (C) análise fenotípica de MK diferenciadas em vitro de células CD34 + por 7 dias ou 11 dias foram corados com anticorpos anti-CD41 e anti-CD42a. MK maduro são positivos para ambos CD41+ e CD42a+ (quadrante superior direito). Clique aqui para ver uma versão maior desta figura.

Figura 2: MK coloração, ploidia e formação proplatelet em vitro. (A) fluorescente imagens do dia 11 MK manchado com anti-CD41-PE e anticorpos CD42b-APC. Núcleos estavam manchados com DAPI. Ponta de seta amarela indica multi nuclear MKs. escala bar, 30 µm. (B) fluorescente imagens do dia 14 MK manchado com anti vWf (verde), anti-CD62p (vermelho) e anticorpos anti-CD42b-APC (magenta). Núcleos estavam manchados com DAPI. Barra de escala, a estratégia de associada representante 15 µm (C), mostrando a distribuição de ploidia de CD41+ eventos. O gráfico (painel inferior) mostra a distribuição observada das classes de ploidia (n = 4), barras de erros, SD. (D) a morfologia característica de proplatelet-rolamento MK é mostrada. O corpo de MK é indicado pela seta. Os processos tempo citoplasmáticos estendendo-se desde o MK (proplatelets) são indicados por setas. Pode ser claro em algumas áreas/campos de visão, se um ou dois MK estão produzindo essas extensões proplatelet. Isto deve ser contado como um proplatelet-rolamento MK imagens tiradas com um microscópio invertido, objectivo de X 10. Barra de escala, 50 µm. clique aqui para ver uma versão maior desta figura.
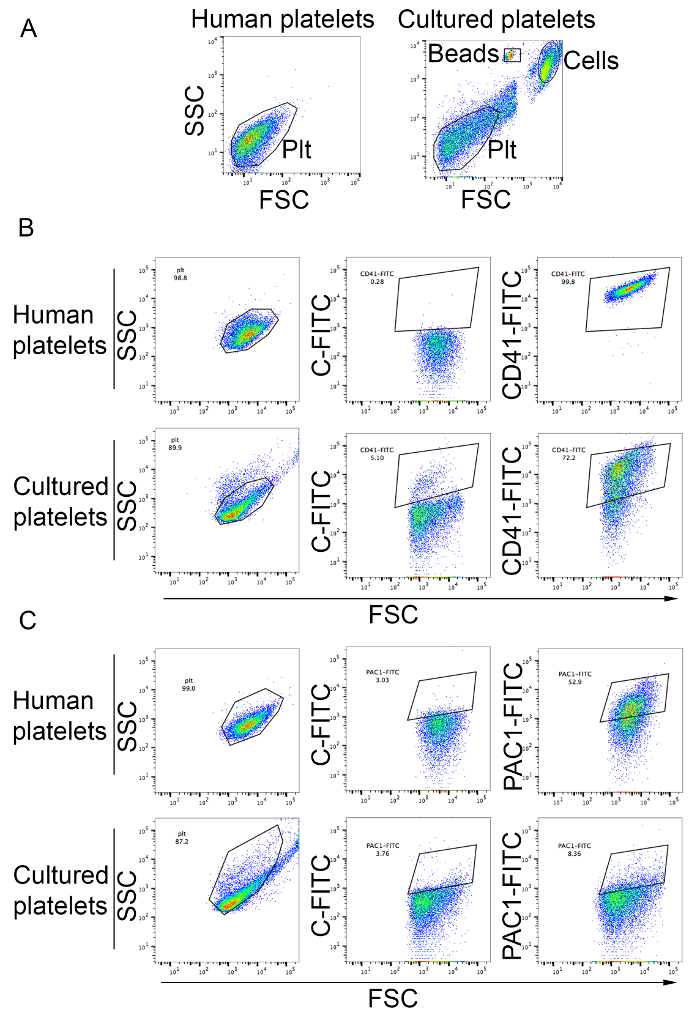
Figura 3: Abundância de plaquetas produzidos in vitro e plaquetária ativação. (A) plaquetas humanas do plasma rico em plaquetas foram usadas para definir o portal analítico usando a escala logarítmica para dispersão de frente e lateral (painel esquerdo). O painel direito mostra células de culturas de MK. Plaquetas produzidos em vitro são observadas no portão analítico definido para plaquetas humanas. Células e contagem de grânulos são indicados na figura. PLT, plaquetas plaquetas (B) produzidos em vitro foram corados com anticorpo anti-CD41. As plaquetas humanas do plasma rico em plaquetas foram usadas para definir o portal analítico usando a escala logarítmica para avançar e dispersão de lado e comparar o perfil dentro do portão CD41-FITC. C-FITC, FITC isotipo controle (C) plaquetária ativação após tratamento por ADP para uma concentração final de 20 µM. plaquetas humanas do plasma rico em plaquetas foram utilizada como controle (painéis superiores). As plaquetas produzidas na cultura são mostradas nos painéis inferiores. Emperramento do PAC1 anticorpo indica a ativação plaquetária. C-FITC, controle do isotipo FITC. Clique aqui para ver uma versão maior desta figura.
Discussão
O protocolo descrito aqui é adequado para uma produção consistente de MK e plaquetas na cultura do sangue do cordão umbilical. Estas células podem ser usadas para estudar vários processos tais como o efeito de drogas ou atividades biológicas na MK proliferação, diferenciação, proplatelet de formação e produção de plaquetas.
Uma variedade de meios de cultura e combinações de citocinas foram apresentados na literatura. Adição de citocinas, como fator de células-tronco, ligante de Flt-3, IL-3 e IL-6 suporta CD34+ a proliferação de células. No entanto, essa expansão resulta em reduzida pureza MK na cultura14. O método apresentado aqui, usando a mídia livre de soro e rhTPO sozinho, não permite expansão significativa das células progenitoras, mas permite que unilineage megakaryocytic proliferação e diferenciação e produção consistente de MK (CD41 90-99%+ CD42a+ duplas células positivas) sem contaminação de outras linhagens. O período de cultura para formação de MK é 10 a 12 dias sem a necessidade de apoio do estroma ou células de alimentador. Isso se compara favoravelmente com outros métodos que exigem maior cultura períodos (mais de 20 dias)17,18. O rendimento de plaquetas do presente protocolo é 19-42 plaquetas por MK ou até 420 plaquetas por CD34 entrada+ célula. A maioria resultado de protocolos em plaquetas baixa rende18,19.
Embora o rendimento é alto em relação a outros métodos, grandes fontes de células CD34 são necessários para produzir um número suficiente de plaquetas para uso terapêutico. MK de sangue de cordão maduro a uma taxa inferior, são geralmente menor (de classes mais baixas da ploidia) e reduziram de capacidade de produção de plaquetas20. Não obstante, UCB fresco geralmente é um recurso mais acessível e isto representa uma vantagem significativa para os investigadores. Outros métodos que podem produzir rendimentos mais elevados do MK e plaquetas com objectivos terapêuticos têm também sido descritos13,17.
Existem algumas fontes de variabilidade a considerar: A) qualidade da unidade de sangue de cordão. Só o sangue do cordão umbilical coletado dentro de 24 h deve ser usado como uma fonte de CD34+ células. Unidades de sangue de cordão contendo coágulos também devem ser descartadas. B) percentagem de CD34+ células na fração de células mononucleares (passo 1,8): usando frações de células mononucleares com menos de 0,3% CD34+ células podem resultar em baixo rendimento de pureza relativamente baixo CD34+ células. Estas células não são recomendadas para diferenciação de MK. É essencial deixar a líquido Escorra pela força de gravidade apenas (por exemplo, etapas 1.13, 1.14, 1.16). Em caso de bloqueio da coluna, é aconselhável remover a coluna do ímã, empurrar as células suavemente com o êmbolo da seringa para um tubo novo e recarregar em uma nova coluna equilibrada.
Uma série de condições afeta a função e o número de plaquetas. Trombocitopenia refere-se a um marcado declínio no número de plaquetas que pode levar a hemorragia interna e externa. Autoimune condições tais como trombocitopenia imune (ITP) e trombocitopenia induzida por drogas (DITP) são conhecidas causas de trombocitopenia21,22. Outras doenças imunes, tais como Lúpus eritematoso sistêmico e artrite reumatoide também podem ter efeitos prejudiciais sobre as plaquetas. Causas não-imune de trombocitopenia incluem tratamento de câncer, traumatismo, infecções, insuficiência de medula óssea e cirurgia. Devido à alta utilização das plaquetas por pacientes submetidos a quimioterapia ou a receber transplantes de células-tronco, a transfusão de plaquetas aumentou constantemente nas últimas décadas. Pesquisa de MK e plaquetas, sem dúvida, ajudará no desenvolvimento da produção de plaquetas em larga escala para aplicações clínicas. Disponibilidade de em vitro produzido funcional plaquetas iria evitar escassez de plaquetas e permitem transfusões de plaquetas em pacientes refratários. Diferenciação de MK e plaquetas produção em vitro são ferramentas essenciais para o estudo e compreensão de ambos os estados patológicos e os mecanismos fisiológicos que levam à formação de plaquetas.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Os autores reconhecem o apoio da saúde australiano e Medical Research Council (projeto concessão 1012409 ligado ao BHC).
Materiais
| Name | Company | Catalog Number | Comments |
| Cell Culture Reagents | |||
| Recombinant Human TPO | Miltenyi Biotec | 130-094-013 | |
| StemSpan SFEM II | Stem Cell Technologies | 9605 | Serum-free media for CD34+ cells |
| Name | Company | Catalog Number | Comments |
| CD34 Isolation Reagents | |||
| CD34 MicroBead kit ultrapure | Miltenyi Biotec | 130-100-453 | This kit includes the FcR human IgG blocking reagent and CD34 microbeads. These beads contain the anti-CD34 antibody clone QBEND/10. Use a different anti-CD34 clone for purity check (e.g. clone 8G12). |
| Lymphoprep | Alere Technologies | 1114545 | Lymphocyte separation media (density 1.077 g/mL) |
| Sterile separation buffer (SB) | Miltenyi Biotec | 130-091-221 | This buffer contains phosphate buffered saline (PBS), pH 7.2 containing 0.5% bovine serum albumin and 2 mM EDTA. It can be prepared using sterile, cell culture grade components. De-gas before use because air bubbles can block the column. |
| Name | Company | Catalog Number | Comments |
| Flow Cytometry and Cell Staining Reagents | |||
| PE Mouse anti-Human CD34 | BD Biosciences | 340669 | Clone 8G12. This can be used for CD34 purity check. Final antibody concentration 1:10 dilution. |
| PerCP mouse anti-human CD45 | BD Biosciences | 347464 | 1:10 dilution |
| PerCP isotype control | BD Biosciences | 349044 | 1:10 dilution |
| FITC Mouse anti-Human CD41a | BD Biosciences | 340929 | Final antibody concentration 1:5 dilution. |
| APC Mouse anti-Human CD42b | BD Biosciences | 551061 | This antibody can also be used to detect mature MK (the percentage of positive cells in usually lower than with anti CD42a). Final antibody concentration 1:10 dilution. |
| Alexa Fluor 647 Mouse anti-Human CD42a | AbD Serotec | MCA1227A647T | Currently distributed by Bio-Rad. Final antibody concentration 1:10 dilution. |
| Alexa Fluor 647 Mouse Negative Control | AbD Serotec | MCA928A647 | Currently distributed by Bio-Rad. Isotype control antibody |
| Anti von Willebrand factor rabbit polyclonal | Abcam | AB6994 | 1:200 dilution |
| V450 mouse anti-humna CD41a | BD Biosciences | 58425 | 1: 20 dilution |
| V450 isotype control | BD Biosciences | 580373 | 1:20 dilution |
| PAC1-FITC antibody | BD Biosciences | 340507 | 1:10 dilution |
| Anti CD62p mouse monoclonal | Abcam | AB6632 | 1:200 dilution |
| Alexa Fluor 488 goat anti rabbit IgG | Invitrogen | A11008 | 1:100 dilution |
| Alexa Fluor 594 goat anti mouse IgG | Invitrogen | A11020 | 1:100 dilution |
| Ig Isotype Control cocktail-C | BD Biosciences | 558659 | Isotype control antibody |
| Propidium iodide | Sigma Aldrich | P4864 | |
| CountBright Absolute Counting Beads | Molecular Probes, Invitrogen | C36950 | Counting beads |
| Name | Company | Catalog Number | Comments |
| Materials | |||
| LS columns | Miltenyi Biotec | 130-042-401 | Smaller and larger columns are also commercially available |
| MidiMACS Separator magnet | Miltenyi Biotec | 130-042-302 | |
| MACS MultiStand | Miltenyi Biotec | 130-042-303 | |
| Falcon 5mL round bottom polypropylene FACS tubes, with Snap Cap, Sterile | In Vitro technologies | 352063 | |
| Glass slides | Menzel-Glaser | J3800AMNZ | |
| Mounting media with DAPI | Vector Laboratories | H-1200 | Antifade mounting medium with DAPI |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Inverted microscope | Leica | DMIRB inverted microscope | |
| Fluorescent microscope | Zeiss | Vert.A1 | |
| Cell analyser | BD Biosciences | FACS Canto II | |
| Cytospin centrifuge | ThermoScientific | Cytospin 4 | |
| Name | Company | Catalog Number | Comments |
| Software | |||
| Cell analyser software | BD Biosciences | FACS Diva Software | |
| Single cell analysis software | Tree Star | FlowJo | |
| Fluorescent microscope software | Zeiss | Zen 2 blue edition |
Referências
- Nakeff, A., Maat, B. Separation of megakaryocytes from mouse bone marrow by velocity sedimentation. Blood. 43 (4), 591-595 (1974).
- Zeigler, F. C., et al. In vitro megakaryocytopoietic and thrombopoietic activity of c-mpl ligand (TPO) on purified murine hematopoietic stem cells. Blood. 84 (12), 4045-4052 (1994).
- Reems, J. -. A., Pineault, N., Sun, S. In Vitro Megakaryocyte Production and Platelet Biogenesis: State of the Art. Transfus. Med. Rev. 24 (1), 33-43 (2010).
- Choi, E., Nichol, J. L., Hokom, M. M., Hornkohl, A. C., Hunt, P. Platelets generated in vitro from proplatelet-displaying human megakaryocytes are functional. Blood. 85 (2), 402-413 (1995).
- Perdomo, J., et al. A monopartite sequence is essential for p45 NF-E2 nuclear translocation, transcriptional activity and platelet production. J Thromb Haemost. 8 (11), 2542-2553 (2010).
- Shim, M. H., Hoover, A., Blake, N., Drachman, J. G., Reems, J. A. Gene expression profile of primary human CD34+CD38lo cells differentiating along the megakaryocyte lineage. Exp Hematol. 32 (7), 638-648 (2004).
- Feng, Q., et al. Scalable generation of universal platelets from human induced pluripotent stem cells. Stem cell reports. 3 (5), 817-831 (2014).
- Bruno, S., et al. In vitro and in vivo megakaryocyte differentiation of fresh and ex-vivo expanded cord blood cells: rapid and transient megakaryocyte reconstitution. Haematologica. 88 (4), 379-387 (2003).
- Iraqi, M., Perdomo, J., Yan, F., Choi, P. Y. I., Chong, B. H. Immune thrombocytopenia: antiplatelet autoantibodies inhibit proplatelet formation by megakaryocytes and impair platelet production in vitro. Haematologica. 100 (5), 623-632 (2015).
- Lev, P. R., et al. Impaired proplatelet formation in immune thrombocytopenia: a novel mechanism contributing to decreased platelet count. Br. J. Haematol. 165 (6), 854-864 (2014).
- Gandhi, M. J., Drachman, J. G., Reems, J. A., Thorning, D., Lannutti, B. J. A novel strategy for generating platelet-like fragments from megakaryocytic cell lines and human progenitor cells. Blood Cells Mol. Dis. 35 (1), 70-73 (2005).
- Lu, S. -. J., et al. Platelets generated from human embryonic stem cells are functional in vitro and in the microcirculation of living mice. Cell Res. 21 (3), 530-545 (2011).
- Moreau, T., et al. Large-scale production of megakaryocytes from human pluripotent stem cells by chemically defined forward programming. Nature Commun. 7, 11208 (2016).
- De Bruyn, C., Delforge, A., Martiat, P., Bron, D. Ex vivo expansion of megakaryocyte progenitor cells: cord blood versus mobilized peripheral blood. Stem Cells Dev. 14 (4), 415-424 (2005).
- Nimgaonkar, M. T., et al. A unique population of CD34+ cells in cord blood. Stem cells. 13 (2), 158-166 (1995).
- Italiano, J. E., Patel-Hett, S., Hartwig, J. H. Mechanics of proplatelet elaboration. J Thromb Haemost. 5, 18-23 (2007).
- Matsunaga, T., et al. Ex vivo large-scale generation of human platelets from cord blood CD34+ cells. Stem cells. 24 (12), 2877-2887 (2006).
- Sullenbarger, B., Bahng, J. H., Gruner, R., Kotov, N., Lasky, L. C. Prolonged continuous in vitro human platelet production using three-dimensional scaffolds. Exp Hematol. 37 (1), 101-110 (2009).
- Proulx, C., Boyer, L., Hurnanen, D. R., Lemieux, R. Preferential ex vivo expansion of megakaryocytes from human cord blood CD34+-enriched cells in the presence of thrombopoietin and limiting amounts of stem cell factor and Flt-3 ligand. J. Hematother. Stem Cell Res. 12 (2), 179-188 (2003).
- Bornstein, R., Garcia-Vela, J., Gilsanz, F., Auray, C., Cales, C. Cord blood megakaryocytes do not complete maturation, as indicated by impaired establishment of endomitosis and low expression of G1/S cyclins upon thrombopoietin-induced differentiation. Br. J. Haematol. 114 (2), 458-465 (2001).
- Chong, B. H., Choi, P. Y. I., Khachigian, L., Perdomo, J. Drug-induced Immune Thrombocytopenia. Hematol Oncol Clin North Am. 27 (3), (2013).
- Stasi, R., et al. Idiopathic thrombocytopenic purpura: Current concepts in pathophysiology and management. Thromb Haemost. 99 (1), 4-13 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados