Method Article
Différenciation du mégacaryocyte et plaquettes Formation de l’homme cordon CD34 dérivés du sang des cellules+
Dans cet article
Résumé
Une population très pure de mégacaryocytes peut provenir de cordon dérivés du sang CD34+ cellules. Une méthode pour CD34+ la différenciation des cellules d’isolement et mégacaryocyte est décrite ici.
Résumé
Production de plaquettes se produit principalement dans la moelle osseuse dans un processus appelé Thrombopoïèse. Au cours de la Thrombopoïèse, cellules progénitrices hématopoïétiques différencient aux précurseurs de plaquettes de forme appelés mégacaryocytes, qui se différencient en phase terminale pour libérer les plaquettes des processus longs cytoplasmiques appelés proplaquettes. Mégacaryocytes sont rares cellules confinés à la moelle osseuse et sont donc difficiles à récolter en nombre suffisant pour utilisation en laboratoire. Une production efficace de mégacaryocytes humaines peut être obtenue in vitro en cultivant CD34+ des cellules dans des conditions appropriées. Le protocole détaillé ici décrit l’isolement des CD34+ cellules par cellule magnétique de tri des échantillons de sang de cordon ombilical. Les mesures nécessaires pour produire des mégacaryocytes extrêmement purs, matures dans des conditions sans sérum sont décrites. Détails des analyses phénotypiques de la différenciation du mégacaryocyte et détermination des proplaquettes production formation et plaquettes sont également fournis. Effecteurs qui influencent la différenciation mégacaryocyte et/ou formation proplaquettes, tels que les anticorps antiplaquettaires ou mimétiques de la thrombopoïétine, peuvent être ajoutés à des cellules cultivées à examiner la fonction biologique.
Introduction
Isolement d’un nombre suffisant de mégacaryocytes humains primaires (MK) pour une utilisation régulière de laboratoire n’est pas possible en raison de leur faible fréquence dans la moelle osseuse, où ils représentent ~0.01% de cellules nucléées1. Une alternative commode est l’ex vivo de l’expansion et la différenciation des souches hématopoïétiques et des cellules progénitrices en présence de facteurs de croissance spécifiques. Un certain nombre de cytokines dont stem cell factor (SCF ; c-kit ligand) et interleukine (IL) -3 et IL-11 ont été utilisés dans les systèmes de culture pour produire MKs. thrombopoïétine (TPO) est le facteur de croissance et la différenciation plus efficace pour les cultures megakaryocytic et est efficace seul ou avec d’autres cytokines, telles que le SCF et l’IL-32. TPO peut agir sur les populations de cellules souches se traduire par la prolifération et la maturation de MKs2.
Plaquettes produits MK de protubérances cytoplasmiques appelées proplaquettes et, in vivo, environ 1 x 1011 plaquettes sont formés tous les jours pour soutenir les numérations plaquettaires de 150-400 x 109/l. plaquettes production in vitro est jusqu'à 1000 -plier plus bas que in vivo estime à3, et cela a donné lieu à nombreuses conditions de culture à l’aide de CD34+ cellules progénitrices hématopoïétiques pour améliorer MK et plaquettes production in vitro. La source initiale de CD34+ cellules utilisées pour la différenciation MK était de sang périphérique humain4. Autres sources de cellules incluent la moelle osseuse5,6, les cellules souches embryonnaires et induits pluripotentes cellules souches (ESC/iPSC)7et cordon ombilical sang (UCB)8,9,10 . La moelle osseuse humaine CD34+ 11 et la souris lignée négative la moelle osseuse des cellules5 produits MK et plaquettes in vitro; Néanmoins, le manque de disponibilité de la moelle osseuse humaine limite son utilisation comme source de CD34+ cellules. En revanche, ESC et iPSC représentent une source illimitée de cellules pour la production de plaquettes in vitro . Production de plaquettes de ces cellules nécessite des cellules nourricières tels que les cellules murines OP9 et de plus longues périodes de culture. Plaquettes dérivées dans des conditions sans chargeur semblent être moins fonctionnel12. iPSC-dérivé des plaquettes sont susceptibles d’être d’utilisation en milieu clinique, puisqu’ils peuvent être étendus à grande échelle. Ce processus nécessite transduction LENTIVIRAUX médiée par des facteurs de transcription et à long terme de la culture de cellule13.
UCB est une source accessible de CD34+ cellules qui peuvent être facilement utilisés dans les paramètres de recherche. TPO seul peut favoriser la différenciation du cordon de dérivés du sang CD34+ cellules et cela donne lieu à MKs extrêmement pur, mature sans besoin de supplémentation de sérum ou de co-culture avec des cellules nourricières. Autres cytokines telles que le SCF peut diminuer la différenciation de l’UCB CD34+ cellules, tandis que Flt-3 ligand et IL-11 favorisent la production de mégacaryocytes immatures14. Ce protocole décrit la production de cultures de MK très pures de sang de cordon ombilical CD34+ cellules dans des conditions de milieu sans sérum.
Protocole
Ce protocole a été approuvé par la South Eastern Sydney Human Research Ethics Committee et ratifiée par le University of New South Wales' Human Research Ethics Committee. Sang de cordon ombilical provenant de donneurs sains a été fourni par le cordon sang Bank de Sydney (Sydney, NSW, Australie). Volumes d’environ 100 mL ont été utilisés pour cette procédure.
NOTE : Les travaux dans une placard à l’aide d’une technique aseptique de biosécurité classe II. Décontaminer l’extérieur du sac de sang de cordon avec l’éthanol à 70 %. Utiliser des instruments stériles (ciseaux, pince à épiler) pour cette procédure.
1. préparation des cellules sanguines et l’isolement des CD34 de cordon de cellules+
- Préparer le tampon de séparation stérile (SB) avec du sérum physiologique tamponné au phosphate (PBS), pH 7,2 et contenant 0,5 % bovine serum albumine et 2 mM EDTA.
- Diluer 10 mL de SB dans un tube conique de 50 mL (un tube par 10 mL de sang est nécessaire). À l’aide d’une aiguille émoussée G18, montée sur une seringue de 10 mL, 10 mL de sang faire sortir du sachet et verser dans les tubes de 50 mL contenant 10 mL de SB.
- Ajouter 15 mL de médias de séparation de lymphocytes (voir Table des matières) jusqu’au fond du tube contenant le sang dilué, créant deux couches.
Remarque : Distribuer les médias lentement au fond du tube pour éviter de mélanger les différentes couches. - Centrifuger les tubes à 1 200 × g pendant 30 min à température ambiante (RT) avec aucune coupure et pas d’accélération.
- Transférer la couche près du centre du tube contenant des cellules mononucléaires (environ 5-10 mL de chaque tube) dans un nouveau tube de 50 mL à l’aide d’une pipette Pasteur. Ajouter SB dans chaque tube pour un volume total de 50 mL.
- Centrifuger à 400 × g pendant 10 min à RT. jeter le surnageant.
- Resuspendre les granules cellulaires soigneusement avec une pipette Pasteur en 5-10 mL de moissonneuse-batteuse SB. les cellules en suspension et porter le volume à 50 mL avec SB.
- Comte de cellules en utilisant une coloration bleu Trypan et un hémocytomètre ou automatisée de cellules encontre (voir Table des matières). Pour déterminer le pourcentage de CD34+ des cellules dans l’échantillon, remettre 2,5 × 105 cellules dans 100 µL de SB et tache en ajoutant 10 µL d’anticorps anti-CD34-PE de 15 à 30 min à 4 ° C. Analyse par cytométrie en flux (Figure 1 a).
- Tubes à centrifuger à 400 × g pendant 10 min à 4 ° C. Jeter le surnageant.
Remarque : si ce n’est nécessaire immédiatement, les cellules mononucléaires peuvent être congelés à ce stade. - Remettre en suspension les cellules dans 300 µL de SB par 108 cellules. Ajouter 100 µL de FcR IgG humaines (blocage réactif, voir la Table des matières) et 100 µL de billes magnétiques CD34 par 108 cellules. Mélanger doucement et laisser incuber à 4 ° C pendant 30-40 min.
Remarque : Une suspension monocellulaire est nécessaire (si nécessaire, passer les cellules même si un filtre de 30 µm avant d’ajouter les réactifs). Utiliser les volumes de réactifs décrits ici pour 10 cellules de8 ou moins. Pour plus de 108 cellules, échelle des réactifs (SB, bloquant la solution et CD34 billes magnétiques) en conséquence. - Préparer la colonne de séparation LS au cours de la période d’incubation en plaçant la colonne LS dans un support magnétique et de lavage avec 3 mL du SB. jeter l’effluent.
Remarque : Les colonnes de séparation LS peuvent être chargés avec jusqu'à 2 × 108 cellules total. Petites et grandes colonnes sont disponibles. - Ajouter 5 à 10 mL de SB au mélange cellulaire et centrifuger à 400 × g pendant 10 min. éliminer le surnageant.
- Remettre en suspension des cellules dans 1,5 mL de SB et charger la suspension cellulaire (1,5 mL) sur la colonne de LS. Recueillir le débit à travers contenant les cellules non marquées dans un tube de prélèvement de 15 mL (fraction négatif #1). Laisser le liquide vider et laver la colonne avec 1,5 mL de SB.
- Charger le flux collecté à travers (3 mL) dans la colonne et collecter le débit à travers dans le même tube de prélèvement de 15 mL (fraction négatif #1). Laver la colonne LS 3 fois avec 3 mL de SB.
Remarque : Si nécessaire, les cellules de la fraction négative (12 mL) peuvent être colorés avec un anticorps anti-CD34 à savoir la capture de CD34+ des cellules de la colonne de LS. - Retirer la colonne du séparateur magnétique et rincer les cellules lentement avec un piston de la seringue dans un nouveau tube de 15 mL avec 2 mL de SB.
- Replacer la colonne sur séparateur magnétique et charge le 2 mL de cellules dans la colonne. Recueillir le débit à travers et laver avec 2 mL SB. Il s’agit de la fraction négative #2 (4 mL).
- Supprimer colonne LS séparateur magnétique et ajouter 2 mL de cellules SB. chasse d’eau régulièrement et fermement avec un piston de la seringue pour recueillir le CD34+ fraction cellulaire. Compter les cellules à l’aide d’une coloration bleu trypan et un hémocytomètre ou compteur de cellules automatisées.
- Tube à centrifuger avec la fraction positive à 400 × g pendant 15 min à 4 ° C. Jeter le surnageant. Remettre en suspension les cellules dans un milieu sans sérum pour CD34+ cellules (gestion durable des forêts, voir la Table des matières).
Remarque : si ce n’est nécessaire immédiatement, les cellules peuvent être congelés dans l’azote liquide à ce stade.
2. pureté cocher de CD34 isolé des cellules+
- 2 x 104 cellules de la fraction positive avec les anticorps anti-CD34-PE µL et les anticorps anti-CD45-PerCP 20 µL pendant 15 min à 4 ° C (utiliser un autre tube pour isotype contrôles) 10 (Figure 1 b).
- Ajouter 1 mL de SB à laver. Centrifuger à 400 × g pendant 10 min. remettre culot dans 200 µL de SB.
- Effectuer l’analyse en cytométrie en flux et porte la population de cellules vivantes pour exclure les débris (Figure 1 b). Fixer la porte pour PE et PerCP les populations positives en utilisant les contrôles d’isotype PE et PerCP (Figure 1 b) et déterminer le pourcentage de CD34+/CD45+ cellules.
3. mégacaryocyte différenciation
- Graines de 5 × 105 cellules/mL CD34+ cellules dans 2 mL de l’AFD additionné de 50 ng/mL thrombopoïétine humaine recombinante (rhTPO) / puits dans une plaque de 12 puits. Incuber les cellules à 37 ° C, 5 % de CO2 dans une atmosphère humidifiée. Si les cellules sont confluentes avant qu’ils soient nécessaires pour l’analyse, récolter les cellules et divisé en plusieurs loges avec supports neufs et rhTPO.
NOTE : Deux ou trois puits devraient être établis spécifiquement pour surveiller la différenciation à des moments différents (p. ex., 7, 9 et 10 jours). - Récolter les cellules provenant des puits mis de côté pour surveiller la différenciation sans déranger les cellules dans les autres puits.
- Cellules de tache avec anticorps anti-GPIIb/CD41-FITC 20 µL et 10 µL anti-GPIX/CD42a-Alexa Fluor 647 l’anticorps dans un volume final de 100 µL. mis en place un contrôle tube à l’aide de l’anticorps de contrôle respectifs isotype. Incuber pendant 15 à 30 min à 4 ° C.
- Ajouter 1 mL de SB à laver.
- Ajouter 1 mL de SB à laver. Centrifuger à 400 × g pendant 10 min. Resuspendre le culot dans 100 µL de SB et un essorage sur une lame de verre à 1 000 x g pendant 5 min. Fix cellules sur la diapositive en plongeant dans le méthanol pour 30 s. de l’Air sec, ajouter 20 µL de milieux contenant du DAPI de montage (voir Table des matières) , recouvrir d’un lamelle couvre-objet et visualiser à l’aide d’un microscope à fluorescence (Figure 2 a).
- Laver avec 2 mL PBS/0.1% triton-X 100 et centrifuger à 400 × g pendant 10 min, resuspendre dans 100 µL de tampon de la même et ajouter de anti-souris IgG-Alexa 594 et anti-lapin IgG-Alexa 488 (1/100). Incuber 30 min à température ambiante, laver avec 2 mL PBS/0.1% triton-X 100, remettre en suspension dans 100 µL de tampon de la même et ajouter 20 µL d’anti-CD42b-APC. Puis faites tourner les cellules sur des lames de verre comme indiqué au point 3.6.1 et préparer les échantillons pour la visualisation microscopique comme indiqué au point 3.6.1.
- Laver une fois avec 1 mL de SB et Resuspendre le culot dans 300 µL de citrate hypotonique tampon (1,25 mM du citrate de sodium, chlorure de sodium 2,5 mM, dextrose de 3,5 mM) contenant 20 µg/ml d’iodure de propidium et 0,05 % Triton X 100. Incuber pendant 15 min à 4 ° C, abri de la lumière.
- Ajouter RNase à une concentration finale de 20 µg/mL et incuber 30 min à 4 ° C, abri de la lumière. Déterminer l’intensité de l’iodure de propidium par cytométrie en flux de collecte des événements de 30 000 à 50 000 de la population de CD41-FITC+ (Figure 2).
4. proplaquettes décompte, énumération plaquettaire et l’Activation des plaquettes
- Récolter les cellules (de l’étape 3.1) aux jours 8 ou 9 de différenciation et de semences à 1 × 104 cellules/puits dans les plaques de 48 puits dans 200 µL de GDF frais additionné de 50 ng/mL rhTPO. Culture pendant 5 jours à 37 ° C, 5 % CO2.
Remarque : À des fins de quantification, graine de puits en triple exemplaire. Cette faible densité est nécessaire pour la visualisation et le comptage des proplaquettes-roulement MK proplaquettes habituellement commencent à apparaître après 2 jours de culture. Le pic est entre 4 et 5 jours. - Compter le nombre de porteurs proplaquettes MK dans l’ensemble bien sur un microscope inversé de lumière à l’aide de 10 X ou 20 X objectifs.
Remarque : Une platine du microscope chaud (37 ° C) est préférable puisque gardant les cellules à température ambiante pendant une période prolongée provoque le rétrécissement des proplaquettes extensions. Proplaquettes sont observés comme des longues extensions du corps de MK. Chaque MK peut avoir plusieurs protubérances proplaquettes. Développent des proplaquettes, le corps du MK diminue en taille. - Récolter les cellules et centrifuger à 400 g pendant 10 min à température ambiante. Colorer les cellules anticorps anti-humain CD41-FITC 20 µL comme décrit aux points 3.3 et 3.4. Calculer le pourcentage des proplaquettes-roulement MK (pbMK) : pbMK (%) = [(Proplatelet-roulement MKs/bien) / (Total CD41+ cellules / puits)] x 100
- Pour compter les plaquettes libérées dans le milieu de culture, délicatement mélanger les cellules avec une pipette Pasteur et prélever 100 µL au jour 14 ou 15 de la culture.
- Coloration à l’anticorps de l’ITCF CD41 anti-humain de 20 µL pendant 20-30 min à 4 ° C. Préparer un tube de contrôle à l’aide de l’anticorps de contrôle respectifs isotype.
- Ajouter 150 µL de SB et 50 µL de compter les perles.
- Pour cytométrie, régler la FSC et le SSC se connecter échelle. Utilisation normale des plaquettes de sang humains de plasma riche en plaquettes colorées au CD41-FITC comme décrit dans section 4.4.1 pour définir le processus de blocage pour les plaquettes (Figure 3 a).
- Analyser les plaquettes colorées avec le comptage des perles par cytométrie en flux. Collecter 1 000 événements de compter les perles à l’aide de la FSC versus diagramme de dispersion des SSC (Figure 3 a). Calculer le nombre de plaquettes basé sur des événements positifs CD41-FITC (Figure 3 b) selon la formule suivante :
Plaquettes par µL = [(nombre d’événements positifs CD41-FITC)/1,000 beads)] x [(number of beads in 50 µL)/volume de l’échantillon)]
- Pour analyser l’activation plaquettaire, délicatement mélanger les cellules avec une pipette Pasteur et prélever 100 µL au jour 14 ou 15 de la culture. Ajouter 1 mL de tampon (137 mM NaCl, KCl 2,7 mM, 1 mM MgCl2, 1,8 mM CaCl2, 0,2 mM Na2HPO4, 12 mM NaHCO3, 5,5 mM D-glucose, pH 6,5) et la centrifugeuse Tyrode à 200 x g pendant 5 min granuler des cellules.
- Récupérer le surnageant et centrifuger à 800 g pendant 10 min granuler particules plaquettaire.
- Jeter le surnageant et remettre en suspension dans 100 µL de tampon de Tyrode. Ajouter 20 µL d’anticorps PAC1-FITC et adénosine diphosphate (ADP) à une concentration finale de 20 µM. Incuber à température ambiante pendant 20 min. analyse par cytométrie de flux pour déterminer le pourcentage d’événements positifs FITC. Utiliser les plaquettes humaines fraîches traitées de la même manière qu’un contrôle positif (Figure 3).
Résultats
Ce protocole permet la préparation de cultures très pures de MK de cordon dérivés du sang CD34+ cellules. Le pourcentage de CD34+ des cellules dans le cordon sang est d’environ 1,3 %15 (Figure 1 a) et le nombre total de cellules mononucléées (étape 1.8) s’étend de 90-300 x 106 unitaire de l’UCB. La pureté du CD34 + / CD45 + cellules après isolement s’étend de 90 à 99 % (Figure 1 b). MK (défini comme CD41+ cellules) sont observées au début de CD34 sans sérum+ cell cultures en présence de rhTPO. Jour 7, le pourcentage de mature MK (CD41+ et CD42a+ cellules) est généralement de 30 à 40 % (Figure 1). Les plus hauts niveaux du CD41+ et CD42a+ doubles cellules positives (90 à 99 %) sont observées entre les jours de 10 et 12 de la différenciation (Figure 1). La variabilité observée dépend principalement la source de sang de cordon et la pureté de la CD34+/CD45+ cellules isolées à l’étape 1.17. Le rendement du MK mature sur les plages de jour 10 de 5 à 10 par CD34 d’entrée+ cellulaire. Mature MK (CD41+/CD42b+) observées sous fluorescentes microscopie sont indiquées dans la Figure 2 a. MK cultivée apparaissent sous forme de grosses cellules multinucléées habituellement (Figure 2 a, pointes de flèches). Contenu granulaire de MK dépendait de vWf (vert) et CD62p (p-sélectine, rouge) coloration (Figure 2 b). La distribution de ploïdie chez MKs cultivées est montrée dans la Figure 2.
Proplaquettes sont longs, perles fibres ou filaments qui s’étendent de l’organe de MK. Proplaquettes peut être plusieurs centaines de micromètres de long16 et contenir des directions générales et des régions distendues. Une caractéristique proplaquettes-roulement MK est illustrée en Figure 2D. Le pourcentage des proplaquettes-roulement MK (pbMK) était de 1,3 ± 0,17 %.
Les plaquettes peuvent être analysées et comptés comme décrit dans le protocole. Comme le montre la Figure 3 b, la plupart des plaquettes dans le surnageant de culture cellulaire relèvent de la porte analyse de périphérique des plaquettes sanguines et sont positifs pour le marqueur de plaquettes CD41 (Figure 3 b). Le rendement plaquettaire de cette méthode s’échelonne de 19 à 42 plaquettes par Marc plaquettes produites en culture peut être activé par les agonistes de plaquettes comme ADP tel que déterminé par une liaison de l’anticorps monoclonal PAC1 activation spécifique (Figure 3) .

Figure 1 : Flow cytometry parcelles de CD34+ de cellules d’isolement et différenciation de MK en culture. (A) les cellules mononucléaires (contrôlés comme indiqué sur le panneau de gauche) purifiées à partir de sang de cordon humain (étape 1.8) ont été colorées avec de l’anticorps anti-CD34-PE pour déterminer le pourcentage de la CD34+ des cellules de l’échantillon (1,3 %, panneau de droite). (B) après la séparation, la fraction positive (étape 1.17) était marquée avec les anticorps anti-CD34-PE et anti-CD45 de PerCP. Le CD34 enrichi+ population est indiquée sur la figure (98,1 %, panneau de droite, quadrant supérieur droit). (C) analyse phénotypique du MK différenciées in vitro de cellules CD34 + pendant 7 jours, ou 11 jours ont été colorées avec les anticorps anti-CD41 et anti-CD42a. MK mature sont positifs pour les deux CD41+ et CD42a+ (quadrant supérieur droit). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : MK coloration, ploïdie et formation proplaquettes in vitro. (A) les images fluorescentes du jour 11 MK colorées avec des anticorps de CD42b-APC et anti-CD41-PE. Les noyaux ont été colorés au DAPI. Pointe de flèche jaune indique plusieurs nucléaire MKs. Barème bar, 30 µm. (B) Fluorescent images du jour 14 MK colorées avec anti vWf (vert), anti-CD62p (rouge) et les anticorps anti-CD42b-APC (magenta). Les noyaux ont été colorés au DAPI. Barre d’échelle, de la stratégie de blocage représentant 15 µm (C) montrant la répartition de la ploïdie des CD41+ événements. Le graphique (panneau inférieur) montre la distribution des classes de ploïdie (n = 4), barres d’erreur, SD. (D) la morphologie caractéristique des proplaquettes-roulement MK est montrée. Le corps de MK est indiqué par la flèche. Les processus long cytoplasmiques s’étendant de la MK (proplaquettes) sont indiqués par les flèches. Il peut être difficile dans certains secteurs/domaines de vue si un ou deux MK produisent ces extensions proplaquettes. Cela devrait être considéré comme un portant des proplaquettes Marc Images prises avec un microscope inversé, objectif 10 X. Echelle, 50 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
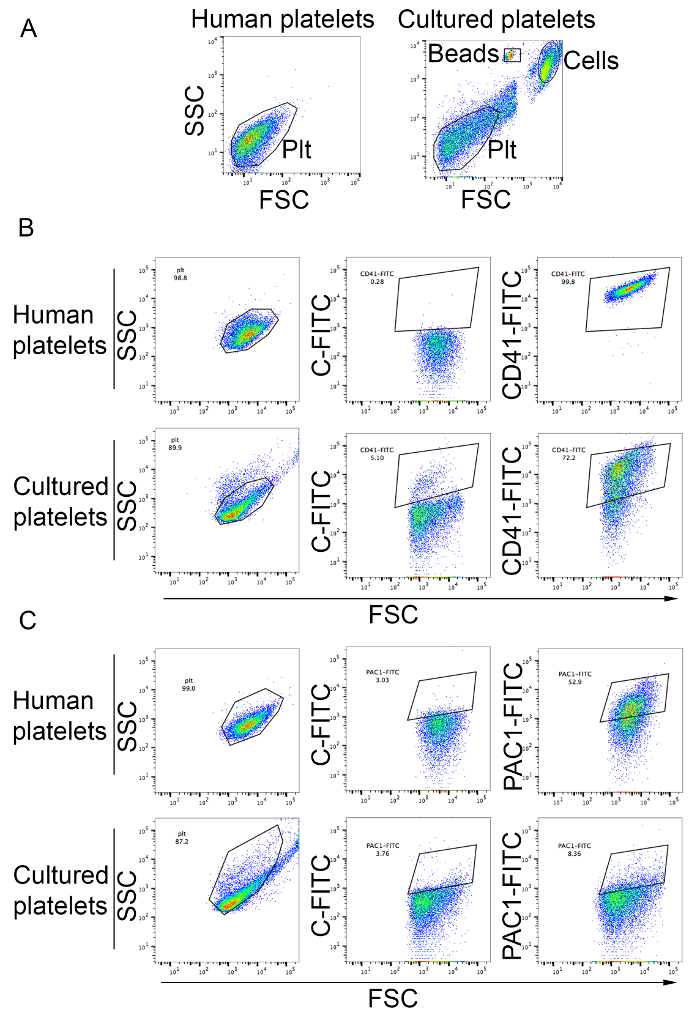
Figure 3 : Abondance des plaquettes produites in vitro et plaquettes activation. (A) les plaquettes humaines de plasma riche en plaquettes servaient à établir la grille analytique avec échelle logarithmique pour dispersion vers l’avant et latérale (gauche). Le panneau de droite montre des cellules provenant de cultures de MK. Plaquettes produits in vitro sont observées dans la grille analytique définie pour les plaquettes humaines. Cellules et perles de comptage sont indiqués sur la figure. PLT, plaquettes (B) plaquettes produites in vitro ont été colorées avec les anticorps anti-CD41. Les plaquettes humaines de plasma riche en plaquettes ont été utilisées pour définir la grille analytique en utilisant l’échelle logarithmique pour la marche avant et la diffusion latérale et de comparer le profil dans le portail CD41-FITC. C-FITC, FITC isotype contrôler plaquettaire (C) activation après un traitement par ADP à une concentration finale de 20 µM. les plaquettes humaines de plasma riche en plaquettes ont été utilisée comme contrôle (panneaux supérieurs). Plaquettes produits en culture sont affichés dans le panneau du bas. La liaison de PAC1 anticorps indique l’activation des plaquettes. C-FITC, contrôle d’isotype FITC. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Le protocole décrit ici est adapté pour une production constante de MK et de plaquettes dans la culture du sang de cordon ombilical. Ces cellules peuvent servir à étudier les divers processus tels que l’effet de drogues ou d’activités biologiques sur MK prolifération, différenciation, proplaquettes formation et production de plaquettes.
Une variété de combinaisons de cytokines et de milieux de culture ont été présentés dans la littérature. Addition de cytokines telles que le facteur des cellules souches, Flt-3 ligand, IL-3 et IL-6 supports CD34+ la prolifération cellulaire. Cependant, cette expansion entraîne réduite pureté MK dans la culture14. La méthode présentée ici, à l’aide de sérum et rhTPO seul, ne permet pas de nette augmentation du nombre des cellules progénitrices, mais permet unilineage megakaryocytic prolifération et la différenciation et une production constante de MK (CD41 90-99 %+ Les cellules positives doubles CD42a+ ) sans contamination des autres lignées. La période de culture pour la formation de MK est 10 à 12 jours sans avoir besoin pour supporter stromales ou cellules nourricières. Cela se compare favorablement à d’autres méthodes nécessitant une plus grande culture périodes (plus de 20 jours)17,18. Le rendement plaquettaire le présent protocole est 19-42 plaquettes par MK ou jusqu'à 420 plaquettes par CD34 d’entrée+ cellulaire. La plupart résultat protocoles en plaquettes inférieur donne18,19.
Bien que le rendement est élevé par rapport aux autres méthodes, les grandes sources de cellules CD34 sont nécessaires pour produire un nombre suffisant de plaquettes pour un usage thérapeutique. MK de sang de cordon arrivent à maturité à un taux plus bas, sont généralement plus petite (des classes inférieures de ploïdie) et ont réduit la capacité de production de plaquettes20. Néanmoins, UCB frais est généralement une ressource plus accessible, et cela représente un avantage important pour les chercheurs. Autres méthodes qui peuvent produire des rendements supérieurs de MK et de plaquettes avec des objectifs thérapeutiques ont été également décrites13,17.
Il y a certaines sources de variabilité à examiner : A) qualité de l’unité de sang de cordon. Seulement le sang ombilical recueilli dans les 24 heures doit être utilisé comme source de CD34+ cellules. Unités de sang de cordon contenant des caillots devraient aussi être éliminées. B) pourcentage de CD34+ des cellules dans la fraction de cellules mononucléées (étape 1.8) : en utilisant des fractions de cellules mononucléées contenant moins de 0,3 % CD34+ cellules peuvent entraîner des rendements faibles de relativement faible pureté CD34+ cellules. Ces cellules ne sont pas recommandés pour la différenciation de MK. Il est essentiel de laisser le drain liquide par la seule force de gravité (par exemple, les étapes 1.13, 1.14, 1,16). En cas de blocage de la colonne, il est recommandé de supprimer la colonne de l’aimant, pousser les cellules doucement avec le piston de la seringue dans un nouveau tube et recharger sur une nouvelle colonne équilibrée.
Un certain nombre de conditions affecte la fonction et le nombre de plaquettes. La thrombopénie se réfère à une baisse marquée du nombre de plaquettes qui peut conduire à des saignements internes et externes. Auto immune orageux de la thrombocytopénie immune (ITP) et thrombocytopénie induite par le médicament (DITP) est des causes bien connues de thrombocytopénie21,22. Autres maladies auto-immunes comme le lupus érythémateux disséminé et l’arthrite rhumatoïde peuvent également avoir des effets néfastes sur les plaquettes. Causes de non immuns de thrombocytopénie comprennent le traitement du cancer, traumatisme grave, infections, insuffisance médullaire et la chirurgie. En raison de la forte utilisation des plaquettes par des patients sous chimiothérapie ou recevant des transplantations de cellules souches, la transfusion plaquettaire a cessé d’augmenter ces dernières décennies. Recherche MK et plaquettes aidera sans aucun doute dans le développement de la production de plaquettes à grande échelle pour des applications cliniques. Disponibilité de in vitro produit fonctionnel plaquettes préviendrait les pénuries de plaquettes et permettre aux patients réfractaires, les transfusions de plaquettes. Différenciation de MK et plaquettes production in vitro sont des outils essentiels pour l’étude et la compréhension des états pathologiques et les mécanismes physiologiques qui conduisent à la formation de plaquettes.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs tiennent à souligner le soutien de l’Australian Health and Medical Research Council (projet subvention 1012409 liée au BHC).
matériels
| Name | Company | Catalog Number | Comments |
| Cell Culture Reagents | |||
| Recombinant Human TPO | Miltenyi Biotec | 130-094-013 | |
| StemSpan SFEM II | Stem Cell Technologies | 9605 | Serum-free media for CD34+ cells |
| Name | Company | Catalog Number | Comments |
| CD34 Isolation Reagents | |||
| CD34 MicroBead kit ultrapure | Miltenyi Biotec | 130-100-453 | This kit includes the FcR human IgG blocking reagent and CD34 microbeads. These beads contain the anti-CD34 antibody clone QBEND/10. Use a different anti-CD34 clone for purity check (e.g. clone 8G12). |
| Lymphoprep | Alere Technologies | 1114545 | Lymphocyte separation media (density 1.077 g/mL) |
| Sterile separation buffer (SB) | Miltenyi Biotec | 130-091-221 | This buffer contains phosphate buffered saline (PBS), pH 7.2 containing 0.5% bovine serum albumin and 2 mM EDTA. It can be prepared using sterile, cell culture grade components. De-gas before use because air bubbles can block the column. |
| Name | Company | Catalog Number | Comments |
| Flow Cytometry and Cell Staining Reagents | |||
| PE Mouse anti-Human CD34 | BD Biosciences | 340669 | Clone 8G12. This can be used for CD34 purity check. Final antibody concentration 1:10 dilution. |
| PerCP mouse anti-human CD45 | BD Biosciences | 347464 | 1:10 dilution |
| PerCP isotype control | BD Biosciences | 349044 | 1:10 dilution |
| FITC Mouse anti-Human CD41a | BD Biosciences | 340929 | Final antibody concentration 1:5 dilution. |
| APC Mouse anti-Human CD42b | BD Biosciences | 551061 | This antibody can also be used to detect mature MK (the percentage of positive cells in usually lower than with anti CD42a). Final antibody concentration 1:10 dilution. |
| Alexa Fluor 647 Mouse anti-Human CD42a | AbD Serotec | MCA1227A647T | Currently distributed by Bio-Rad. Final antibody concentration 1:10 dilution. |
| Alexa Fluor 647 Mouse Negative Control | AbD Serotec | MCA928A647 | Currently distributed by Bio-Rad. Isotype control antibody |
| Anti von Willebrand factor rabbit polyclonal | Abcam | AB6994 | 1:200 dilution |
| V450 mouse anti-humna CD41a | BD Biosciences | 58425 | 1: 20 dilution |
| V450 isotype control | BD Biosciences | 580373 | 1:20 dilution |
| PAC1-FITC antibody | BD Biosciences | 340507 | 1:10 dilution |
| Anti CD62p mouse monoclonal | Abcam | AB6632 | 1:200 dilution |
| Alexa Fluor 488 goat anti rabbit IgG | Invitrogen | A11008 | 1:100 dilution |
| Alexa Fluor 594 goat anti mouse IgG | Invitrogen | A11020 | 1:100 dilution |
| Ig Isotype Control cocktail-C | BD Biosciences | 558659 | Isotype control antibody |
| Propidium iodide | Sigma Aldrich | P4864 | |
| CountBright Absolute Counting Beads | Molecular Probes, Invitrogen | C36950 | Counting beads |
| Name | Company | Catalog Number | Comments |
| Materials | |||
| LS columns | Miltenyi Biotec | 130-042-401 | Smaller and larger columns are also commercially available |
| MidiMACS Separator magnet | Miltenyi Biotec | 130-042-302 | |
| MACS MultiStand | Miltenyi Biotec | 130-042-303 | |
| Falcon 5mL round bottom polypropylene FACS tubes, with Snap Cap, Sterile | In Vitro technologies | 352063 | |
| Glass slides | Menzel-Glaser | J3800AMNZ | |
| Mounting media with DAPI | Vector Laboratories | H-1200 | Antifade mounting medium with DAPI |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Inverted microscope | Leica | DMIRB inverted microscope | |
| Fluorescent microscope | Zeiss | Vert.A1 | |
| Cell analyser | BD Biosciences | FACS Canto II | |
| Cytospin centrifuge | ThermoScientific | Cytospin 4 | |
| Name | Company | Catalog Number | Comments |
| Software | |||
| Cell analyser software | BD Biosciences | FACS Diva Software | |
| Single cell analysis software | Tree Star | FlowJo | |
| Fluorescent microscope software | Zeiss | Zen 2 blue edition |
Références
- Nakeff, A., Maat, B. Separation of megakaryocytes from mouse bone marrow by velocity sedimentation. Blood. 43 (4), 591-595 (1974).
- Zeigler, F. C., et al. In vitro megakaryocytopoietic and thrombopoietic activity of c-mpl ligand (TPO) on purified murine hematopoietic stem cells. Blood. 84 (12), 4045-4052 (1994).
- Reems, J. -. A., Pineault, N., Sun, S. In Vitro Megakaryocyte Production and Platelet Biogenesis: State of the Art. Transfus. Med. Rev. 24 (1), 33-43 (2010).
- Choi, E., Nichol, J. L., Hokom, M. M., Hornkohl, A. C., Hunt, P. Platelets generated in vitro from proplatelet-displaying human megakaryocytes are functional. Blood. 85 (2), 402-413 (1995).
- Perdomo, J., et al. A monopartite sequence is essential for p45 NF-E2 nuclear translocation, transcriptional activity and platelet production. J Thromb Haemost. 8 (11), 2542-2553 (2010).
- Shim, M. H., Hoover, A., Blake, N., Drachman, J. G., Reems, J. A. Gene expression profile of primary human CD34+CD38lo cells differentiating along the megakaryocyte lineage. Exp Hematol. 32 (7), 638-648 (2004).
- Feng, Q., et al. Scalable generation of universal platelets from human induced pluripotent stem cells. Stem cell reports. 3 (5), 817-831 (2014).
- Bruno, S., et al. In vitro and in vivo megakaryocyte differentiation of fresh and ex-vivo expanded cord blood cells: rapid and transient megakaryocyte reconstitution. Haematologica. 88 (4), 379-387 (2003).
- Iraqi, M., Perdomo, J., Yan, F., Choi, P. Y. I., Chong, B. H. Immune thrombocytopenia: antiplatelet autoantibodies inhibit proplatelet formation by megakaryocytes and impair platelet production in vitro. Haematologica. 100 (5), 623-632 (2015).
- Lev, P. R., et al. Impaired proplatelet formation in immune thrombocytopenia: a novel mechanism contributing to decreased platelet count. Br. J. Haematol. 165 (6), 854-864 (2014).
- Gandhi, M. J., Drachman, J. G., Reems, J. A., Thorning, D., Lannutti, B. J. A novel strategy for generating platelet-like fragments from megakaryocytic cell lines and human progenitor cells. Blood Cells Mol. Dis. 35 (1), 70-73 (2005).
- Lu, S. -. J., et al. Platelets generated from human embryonic stem cells are functional in vitro and in the microcirculation of living mice. Cell Res. 21 (3), 530-545 (2011).
- Moreau, T., et al. Large-scale production of megakaryocytes from human pluripotent stem cells by chemically defined forward programming. Nature Commun. 7, 11208 (2016).
- De Bruyn, C., Delforge, A., Martiat, P., Bron, D. Ex vivo expansion of megakaryocyte progenitor cells: cord blood versus mobilized peripheral blood. Stem Cells Dev. 14 (4), 415-424 (2005).
- Nimgaonkar, M. T., et al. A unique population of CD34+ cells in cord blood. Stem cells. 13 (2), 158-166 (1995).
- Italiano, J. E., Patel-Hett, S., Hartwig, J. H. Mechanics of proplatelet elaboration. J Thromb Haemost. 5, 18-23 (2007).
- Matsunaga, T., et al. Ex vivo large-scale generation of human platelets from cord blood CD34+ cells. Stem cells. 24 (12), 2877-2887 (2006).
- Sullenbarger, B., Bahng, J. H., Gruner, R., Kotov, N., Lasky, L. C. Prolonged continuous in vitro human platelet production using three-dimensional scaffolds. Exp Hematol. 37 (1), 101-110 (2009).
- Proulx, C., Boyer, L., Hurnanen, D. R., Lemieux, R. Preferential ex vivo expansion of megakaryocytes from human cord blood CD34+-enriched cells in the presence of thrombopoietin and limiting amounts of stem cell factor and Flt-3 ligand. J. Hematother. Stem Cell Res. 12 (2), 179-188 (2003).
- Bornstein, R., Garcia-Vela, J., Gilsanz, F., Auray, C., Cales, C. Cord blood megakaryocytes do not complete maturation, as indicated by impaired establishment of endomitosis and low expression of G1/S cyclins upon thrombopoietin-induced differentiation. Br. J. Haematol. 114 (2), 458-465 (2001).
- Chong, B. H., Choi, P. Y. I., Khachigian, L., Perdomo, J. Drug-induced Immune Thrombocytopenia. Hematol Oncol Clin North Am. 27 (3), (2013).
- Stasi, R., et al. Idiopathic thrombocytopenic purpura: Current concepts in pathophysiology and management. Thromb Haemost. 99 (1), 4-13 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon