Method Article
La differenziazione dei megacariociti e formazione delle piastrine da umani cavo emoderivati CD34 cellule+
In questo articolo
Riepilogo
Una popolazione altamente pura dei megacariociti sono ottenibili dal midollo derivate dal sangue CD34+ cellule. Un metodo per CD34+ differenziazione megacariocita e isolamento delle cellule è descritto qui.
Abstract
La produzione della piastrina si verifica principalmente nel midollo osseo in un processo noto come thrombopoiesis. Durante thrombopoiesis, cellule progenitrici ematopoietiche differenziano ai precursori delle piastrine forma chiamati megacariociti, che differenziano terminalmente per rilasciare le piastrine da processi citoplasmici lungo definiti associato. I megacariociti sono confinate al midollo osseo le cellule rare e sono quindi difficili da raccogliere in numero sufficiente per uso di laboratorio. Produzione efficiente di megacariociti umani può essere raggiunto in vitro coltivando CD34+ cellule nelle circostanze adatte. Il protocollo dettagliato qui descrive l'isolamento di CD34 cellule di+ da magnetico cella ordinamento da campioni di sangue del cordone ombelicale. Sono descritti i passi necessari per la produzione di megacariociti altamente puri, maturi nelle circostanze senza siero. Dettagli di analisi fenotipica di differenziamento megacariocitico e determinazione della produzione della piastrina e di formazione a disposizione. Gli effettori che influenzano la differenziazione dei megacariociti e/o a formazione, quali gli anticorpi anti-piastrine o mimetics della trombopoietina, possono essere aggiunti alle cellule coltivate per esaminare la funzione biologica.
Introduzione
Isolamento di un numero adeguato di megacariociti umani primari (MK) per uso di laboratorio regolari non è fattibile a causa della loro bassa frequenza nel midollo osseo, dove rappresentano ~0.01% di cellule nucleate1. Una comoda alternativa è l'espansione ex vivo e la differenziazione delle staminali ematopoietiche e cellule progenitrici in presenza di specifici fattori di crescita. Una serie di citochine, compreso il fattore di cellula formativa (SCF; c-kit ligando) e interleuchina (IL) -3 e IL-11 è stati impiegati in sistemi di coltura per produrre MKs. Thrombopoietin (TPO) è il fattore più efficace di crescita e differenziazione megakaryocytic culture ed è efficace da solo o con altre citochine, quali SCF e IL-32. TPO può agire su popolazioni di cellule staminali per provocare la proliferazione e la maturazione di MKs2.
Le piastrine di produrre MK da protrusioni citoplasmatiche chiamati associato e, in vivo, circa 1 x 1011 piastrine sono formate ogni giorno per sostenere la conta piastrinica di 150-400 x 109produzione /L. piastrinica in vitro è fino a 1000 -piegare inferiori lo in vivo stima3, e ciò ha dato luogo a numerose condizioni di coltura utilizzando CD34+ cellule progenitrici ematopoietiche per migliorare della piastrina e MK produzione in vitro. La fonte iniziale di CD34+ celle utilizzate per il differenziamento di MK era sangue periferico umano4. Includono altre fonti di cellule del midollo osseo5,6, cellule staminali embrionali/induced pluripotent cellule staminali (ESC/iPSC)7e cordone ombelicale sangue (UCB)8,9,10 . Midollo osseo umano CD34+ 11 e mouse lignaggio negativo del midollo osseo cellule5 prodotti MK e piastrine in vitro; Tuttavia, la mancanza di disponibilità del midollo osseo umano limita il suo uso come fonte di CD34+ cellule. Al contrario, ESC e iPSC rappresentano una fonte illimitata di cellule per la produzione della piastrina in vitro . La produzione della piastrina da queste cellule richiede le cellule di alimentatore come cellule murine OP9 e periodi più lunghi di cultura. Le piastrine derivate in condizioni prive di alimentatore sembrano essere meno funzionale12. iPSC-derivato piastrine rischiano di essere di uso nelle regolazioni cliniche, dal momento che può essere espansa a larga scala. Questo processo richiede trasduzione lentivirale-mediata di fattori di trascrizione e a lungo termine delle cellule cultura13.
UCB è una fonte accessibile di CD34+ cellule che possono essere facilmente utilizzate in impostazioni di ricerca. TPO da solo può promuovere la differenziazione del midollo derivate dal sangue CD34+ cellule e questo dà luogo ad elevata purezza, maturo MKs senza l'esigenza del completamento del siero o co-coltura con le cellule di alimentatore. Altre citochine come SCF può diminuire la differenziazione da UCB CD34 cellule+ , mentre ligando Flt-3 e IL-11 promuovere la produzione di megacariociti acerbi14. Questo protocollo descrive la produzione di colture altamente pure MK cordonali CD34+ cellule nelle circostanze senza siero.
Protocollo
Questo protocollo è stato approvato dal sud orientale Sydney umana ricerca comitato etico e ratificato dal comitato di etica umana ricerca l'Università del New South Wales. Sangue del cordone ombelicale ottenuto da donatori sani è stato fornito da Sydney Cord Blood Bank (Sydney, NSW, Australia). Volumi di circa 100 mL sono stati utilizzati per questa procedura.
Nota: Lavorare in una classe II biosicurezza utilizzando una tecnica asettica. Decontaminare l'esterno della sacca del sangue con etanolo al 70%. Per questa procedura, usare strumenti sterili (forbici, pinzette).
1. cavo di preparazione delle cellule del sangue e l'isolamento di CD34 cellule+
- Preparare il tampone di separazione sterile (SB) con tamponato fosfato salino (PBS), a pH 7,2 e contenente 0.5% bovino dell'albumina di siero e 2 mM EDTA.
- Versare 10 mL di SB in una provetta conica da 50 mL (una provetta per 10 mL di sangue è necessaria). Utilizzando un ago smussato G18 montato su una siringa da 10 mL, disegnare 10 mL di sangue dal sacchetto e dispensare nelle provette da 50 mL contenente 10 mL di SB.
- Aggiungere 15 mL di media di separazione del linfocita (Vedi Tabella materiali) alla parte inferiore del tubo contenente il sangue diluito, creando due strati.
Nota: Dispensare media lentamente nella parte inferiore del tubo per evitare di miscelare i diversi strati. - Centrifugare provette a 1.200 × g per 30 min a temperatura ambiente (TA) con senza pausa e senza accelerazione.
- Trasferire lo strato vicino al centro del tubo contenente cellule mononucleari (circa 5-10 mL da ciascuna provetta) in una nuova provetta da 50 mL utilizzando una pipetta Pasteur. Aggiungere SB ogni tubo per un volume totale di 50 mL.
- Centrifugare a 400 × g per 10 min a RT. scartare il surnatante.
- Risospendere il pellet cellulare accuratamente con una pipetta Pasteur in 5-10 mL di SB. Combine le cellule sospese e portare il volume a 50 mL con SB.
- Numero di celle utilizzando la macchiatura blu di Trypan e un emocitometro o automatizzata delle cellule contatore (Vedi Tabella materiali). Per determinare la percentuale di CD34+ cellule nel campione, risospendere 2,5 × 105 cellule in 100 µ l di SB e macchia aggiungendo 10 µ l di anticorpo anti-CD34-PE per 15-30 min a 4 ° C. Analizzare mediante citometria a flusso (Figura 1A).
- Provette per centrifuga a 400 × g per 10 min a 4 ° C. Gettare il surnatante.
Nota: se non richiesto immediatamente, cellule mononucleari possono essere congelate in questa fase. - Risospendere le cellule in 300 µ l di SB per 108 cellule. Aggiungere 100 µ l di IgG umane FcR (reagente, bloccante Vedi Tabella materiali) e 100 µ l di CD34 biglie magnetiche per 108 cellule. Mescolare delicatamente e incubare a 4 ° C per 30-40 min.
Nota: Una sospensione singola cella è necessaria (se necessario, passare le cellule però un filtro 30 µm prima di aggiungere i reagenti). Utilizzare i volumi di reagente descritti qui per 108 celle o meno. Per più di 108 celle, scalabilità di conseguenza i reagenti (SB, bloccando la soluzione e sfere magnetiche CD34). - Preparare la colonna di separazione LS durante il periodo di incubazione posizionando la colonna LS in un supporto magnetico e lavaggio con 3 mL di SB. Discard effluente.
Nota: Colonne di separazione LS possono essere caricate con fino a 2 × 108 cellule totali. Colonne più piccole e più grandi sono disponibili. - Aggiungere 5-10 mL di SB per la miscela di cella e centrifugare a 400 × g per 10 min. scartare il surnatante.
- Risospendere le cellule in 1,5 mL di SB e caricare la sospensione cellulare (1,5 mL) sulla colonna di LS. Raccogliere il flusso attraverso contenente le celle senza etichetta in un tubo di raccolta di 15 mL (frazione negativo #1). Lasciate che il liquido svuotare e lavare la colonna con 1,5 mL di SB.
- Caricare il flusso raccolto attraverso (3 mL) nuovamente dentro la colonna e raccogliere il flusso attraverso nello stesso tubo di raccolta 15 mL (frazione negativo #1). Lavare la colonna LS 3 volte con 3 mL di SB.
Nota: Se necessario, le cellule nella frazione negativa (12 mL) possono essere macchiate con l'anticorpo anti-CD34 per accertare la cattura di CD34+ cellule tramite la colonna di LS. - Togliere colonna dal separatore magnetico e lavare le cellule lentamente con lo stantuffo della siringa in una nuova provetta da 15 mL con 2 mL di SB.
- Riposizionare colonna sul separatore magnetico e carico da 2 mL di celle nella colonna. Raccogliere il flusso attraverso e lavare con 2ml SB. Questa è la frazione negativa #2 (4 mL).
- Rimuovere la colonna LS da separatore magnetico e aggiungere 2 mL di Flush SB. cellule costantemente e saldamente con un pistone della siringa per raccogliere il CD34+ frazione delle cellule. Contare le celle usando la macchiatura blu di trypan e un emocitometro o contatore di cellule automatizzato.
- Provetta da centrifuga con la frazione positiva a 400 × g per 15 min a 4 ° C. Scartare il surnatante. Risospendere le cellule in terreni privi di siero per CD34+ cellule (SFM, Vedi Tabella materiali).
Nota: se non richiesto immediatamente, le cellule possono essere congelate in azoto liquido in questa fase.
2. purezza Check di CD34 isolato cellule+
- 2 x 104 cellule dalla frazione positiva con 10 µ l l'anticorpo anti-CD34-PE e anticorpo anti-CD45-PerCP 20 µ l per 15 min a 4 ° C (uso un separato del tubo per i controlli dell'isotipo) (Figura 1B).
- Aggiungere 1 mL di SB per lavare. Centrifugare a 400 × g per 10 min. Risospendere il pellet in 200 µ l di SB.
- Eseguire l'analisi cytometric di flusso e cancello la popolazione di cellule vive per escludere detriti (Figura 1B). Impostare la porta per le popolazioni positivi PE e PerCP utilizzando i controlli di isotipo PE e PerCP (Figura 1B) e determinare la percentuale di CD34+/CD45+ cellule.
3. differenziamento megacariocitico
- Seme 5 × 105 cellule/mL CD34+ cellule in 2 mL di SFM completati con 50 ng/mL trombopoietina umana ricombinante (terapeutici) per pozzetto in un piatto di 12-pozzetti. Incubare le cellule a 37 ° C, 5% CO2 in atmosfera umidificata. Se le cellule sono confluenti prima che sono necessari per l'analisi, raccogliere le cellule e dividere in pozzi multipli con media fresco e terapeutici.
Nota: Due o tre pozzetti devono essere preparati specificamente per controllare la differenziazione in diversi momenti (ad esempio, giorni 7, 9 e 10). - Raccogliere le cellule dai pozzetti accantonati per controllare la differenziazione senza disturbare le cellule in altri pozzi.
- Cellule di macchia con l'anticorpo anti-GPIIb/CD41-FITC di 20 µ l e 10 µ l anti-GPIX/CD42a-Alexa Fluor 647 anticorpo in un volume finale di 100 µ l. impostare un controllo tubo usando gli anticorpi di controllo rispettivi isotype. Incubare per 15-30 min a 4 ° C.
- Aggiungere 1 mL di SB per lavare.
- Aggiungere 1 mL di SB per lavare. Centrifuga a 400 × g per 10 min. Risospendere il pellet in 100 µ l di SB e spin su una lastra di vetro a 1.000 x g per 5 min. Fix cellule sul vetrino mediante immersione in metanolo per 30 s. aria secca, aggiungere 20 µ l di montaggio supporti contenenti DAPI (Vedi Tabella materiali) , coprire con un vetrino coprioggetto e visualizzare utilizzando un microscopio a fluorescenza (Figura 2A).
- Lavare con 2 mL PBS/0.1% triton-X100 e centrifugare a 400 × g per 10 min, risospendere in 100 µ l di buffer stesso e aggiungere anti-mouse IgG-Alexa 594 e anti-coniglio IgG-Alexa 488 (1: 100). Incubare per 30 min a temperatura ambiente, lavare con 2 mL PBS/0.1% triton-X100, risospendere in 100 µ l di buffer stesso e aggiungere 20 µ l di anti CD42b-APC. Poi girare le cellule su vetrini come descritto al punto 3.6.1 e preparare i campioni per visualizzazione microscopica come descritto al punto 3.6.1.
- Lavare una volta con 1 mL di SB e risospendere il pellet in 300 µ l di citrato ipotonico buffer (citrato di sodio di 1,25 mM, 2,5 mM di cloruro di sodio, destrosio di 3,5 mM) contenenti 20 µ g/ml ioduro di propidio e 0,05% Triton-X100. Incubare per 15 min a 4 ° C al riparo dalla luce.
- Aggiungere RNasi a una concentrazione finale di 20 µ g/mL ed incubare per 30 min a 4 ° C al riparo dalla luce. Determinare l'intensità di ioduro di propidio tramite flusso cytometry raccogliendo 30.000 a 50.000 eventi della popolazione CD41-FITC+ (Figura 2).
4. a conteggio, enumerazione della piastrina e l'attivazione piastrinica
- Raccogliere le cellule (dal punto 3.1) a giorni 8 o 9 di differenziazione e di sementi a 1 × 104 cellule/pozzetto in piastre 48 pozzetti in 200 µ l di fresco SFM completati con 50 ng/mL terapeutici. Cultura per 5 giorni a 37 ° C, 5% CO2.
Nota: Ai fini della quantificazione, seme pozzi in triplice copia. Questa bassa densità è necessaria per la visualizzazione e contiamo di a-cuscinetto Mk. associato solitamente iniziano ad apparire dopo 2 giorni di cultura. Il picco è tra i giorni 4 e 5. - Contare il numero di a-cuscinetto MK nel pozzo tutto su un microscopio invertito luce utilizzando 10 X o 20 X obiettivi.
Nota: Una fase di microscopio riscaldata (37 ° C) è preferibile, dato che la conservazione delle cellule a temperatura ambiente per periodi prolungati provoca restringimento delle estensioni a. Associato è osservati come lunghe estensioni dal corpo MK. Ogni MK può avere diversi a sporgenze. Come sviluppa associato, il corpo della MK diminuisce nel formato. - Raccogliere le cellule e centrifugare a 400 x g per 10 min a temperatura ambiente. Macchia le cellule con l'anticorpo di anti-umani CD41-FITC 20 µ l, come descritto ai punti 3.3 e 3.4. Calcolare la percentuale di MK a cuscinetto (pbMK): pbMK (%) = [(MKs propiastrine-cuscinetto/bene) / (Totale CD41+ cellule / bene)] x 100
- Per contare le piastrine rilasciate nel terreno di coltura, delicatamente mescolare le cellule con una pipetta Pasteur e raccogliere 100 µ l a giorni 14 e 15 della cultura.
- Macchiare con 20 µ l anticorpo anti-umane CD41-FITC per 20-30 min a 4 ° C. Impostare una provetta di controllo utilizzando l'anticorpo di controllo rispettivi isotype.
- Aggiungere 150 µ l di SB e 50 µ l di contare le perline.
- Per l'analisi cytometric di flusso, impostato il FSC e SSC scala logaritmica. Piastrine del sangue umane normale uso da plasma ricco di piastrine colorati con CD41-FITC come descritto in sezione 4.4.1 per impostare il gating per le piastrine (Figura 3A).
- Analizzare le piastrine macchiate con perline di conteggio tramite flusso cytometry. Raccogliere 1.000 eventi di conteggio perline utilizzando il FSC rispetto al grafico a dispersione SSC (Figura 3A). Calcolare il numero delle piastrine in base agli eventi positivi CD41-FITC (Figura 3B) utilizzando la formula:
Piastrine per µ l = [(numero di eventi positivi CD41-FITC)/1,000 beads)] x [(number of beads in 50 µL)/volume del campione)]
- Per analizzare l'attivazione della piastrina, delicatamente mescolare le cellule con una pipetta Pasteur e raccogliere 100 µ l a giorni 14 e 15 della cultura. Aggiungere 1 mL di tampone (137 mM NaCl, 2.7 mM KCl, 1 mM MgCl2, 1,8 mM CaCl2, 0,2 mM Na2HPO4, 12mm NaHCO3, 5,5 mM D-glucosio, pH 6.5) e centrifugare di Tyrode a 200 x g per 5 min agglomerare le cellule.
- Raccogliere il surnatante e centrifuga a 800 x g per 10 min a particelle di dimensioni della piastrina di pellet.
- Eliminare il surnatante e risospendere in 100 µ l di tampone di Tyrode. Aggiungere 20 µ l di anticorpo PAC1-FITC e adenosina difosfato (ADP) ad una concentrazione finale di 20 µM. Incubare a temperatura ambiente per 20 min. analisi di citometria a flusso per determinare la percentuale di eventi positivi FITC. Uso delle piastrine umane fresche trattate nello stesso modo come controllo positivo (Figura 3).
Risultati
Questo protocollo permette la preparazione di colture di MK altamente pure dal cordone derivate dal sangue CD34+ cellule. La percentuale di CD34+ cellule nel midollo sangue è di circa 1,3%15 (Figura 1A) e il numero totale di cellule mononucleari (passo 1,8) intervalli da 90-300 x 106 per unità UCB. La purezza di CD34 + cellule CD45 + dopo intervalli di isolamento da 90 a 99% (Figura 1B). MK (definito come CD41+ cellule) sono osservate all'inizio del CD34 privo di siero+ cell culture in presenza di terapeutici. Il giorno 7, la percentuale di coppie MK (CD41+ e CD42a+ cellule) è di solito 30-40% (Figura 1). I livelli elevati di CD41+ e CD42a+ doppie cellule positive (90-99%) si osservano tra i giorni 10 e 12 di differenziazione (Figura 1). La variabilità osservata dipende principalmente la fonte di sangue del cordone e la purezza del CD34+/CD45+ cellule isolate nel passaggio 1.17. La resa di MK maturo sugli intervalli di giorno 10 da 5-10 per ogni ingresso CD34+ cell. Maturo MK (CD41+/CD42b+) osservato sotto fluorescenti microscopia sono mostrati nella Figura 2A. MK coltivate appaiono come grandi, solitamente multinucleated le cellule (Figura 2A, punte di freccia). Contenuto granulare di MK era risoluto di vWf (verde) e CD62p (p-selectin, rosso) colorazione (Figura 2B). La distribuzione di ploidia osservata in coltura MKs è mostrata in Figura 2.
Associato è fibre lunghe, perline o filamenti che si estendono dal corpo MK. Associato possa essere diverse centinaia di micrometri lungo16 e contenere rami e regioni dilatate. Una caratteristica a-cuscinetto MK è illustrata nella Figura 2D. La percentuale di MK a cuscinetto (pbMK) era 1,3 ± 0,17%.
Le piastrine possono essere analizzate e considerate come descritto nel protocollo. Come illustrato in Figura 3B, la maggior parte delle piastrine nel surnatante della cultura cellulare rientrano il cancello analitico di piastrine nel sangue periferiche e sono positivo per il marcatore della piastrina CD41 (Figura 3B). La resa della piastrina da questo va di metodo da 19 a 42 piastrine per MK. piastrine prodotte nella cultura può essere attivata da agonisti piastrinici come ADP come determinato dal grippaggio aumentato dell'anticorpo monoclonale PAC1 attivazione specifiche (Figura 3) .

Figura 1: Flusso cytometry appezzamenti di CD34+ cella di isolamento e la differenziazione di MK nella cultura. (A) cellule mononucleari (gated come mostrato nel pannello di sinistra) purificate dal sangue del cordone ombelicale umano (passo 1,8) sono state macchiate con l'anticorpo anti-CD34-PE per determinare la percentuale del CD34+ cellule nel campione (1,3%, pannello di destra). (B) dopo la separazione, la frazione positiva (passo 1,17) era macchiata con gli anticorpi anti-CD34-PE e anti-CD45 PerCP. Il CD34 arricchito+ popolazione è indicata nella figura (98,1%, pannello di destra, quadrante superiore destro). (C) analisi fenotipica di MK differenziate in vitro da cellule CD34 + per 7 giorni o 10 giorni erano macchiati con gli anticorpi anti-CD41 e anti-CD42a. MK maturo sono positivi per entrambi CD41+ e CD42a+ (quadrante superiore destro). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: MK macchiatura, ploidia e a formazione in vitro. (A) le immagini fluorescenti di giorno 11 MK macchiato con gli anticorpi CD42b-APC e anti-CD41-PE. I nuclei sono stati macchiati con DAPI. Freccia gialla indica multi-nucleare MKs. barra della scala, 30 µm. (B) immagini fluorescenti di giorno 14 MK macchiato con anti-vWf (verde), anti CD62p (rosso) e gli anticorpi anti-CD42b-APC (magenta). I nuclei sono stati macchiati con DAPI. Barra della scala, 15 µm (C) strategia di gating rappresentante mostrano la distribuzione di ploidia di CD41+ eventi. Il grafico (pannello inferiore) Mostra la distribuzione osservata delle classi di ploidia (n = 4), barre di errore, SD. (D) la morfologia caratteristica di a-cuscinetto MK è mostrata. Il corpo di MK è indicato dalla freccia. I processi citoplasmici lunghe che si estende da MK (associato) sono indicati da frecce. Può essere poco chiaro in alcuni settori della vista se uno o due MK producono queste estensioni a. Questo dovrebbe essere considerato come un cuscinetto a MK. immagini scattate con un microscopio invertito, obiettivo 10x. Barra della scala, 50 µm. Clicca qui per visualizzare una versione più grande di questa figura.
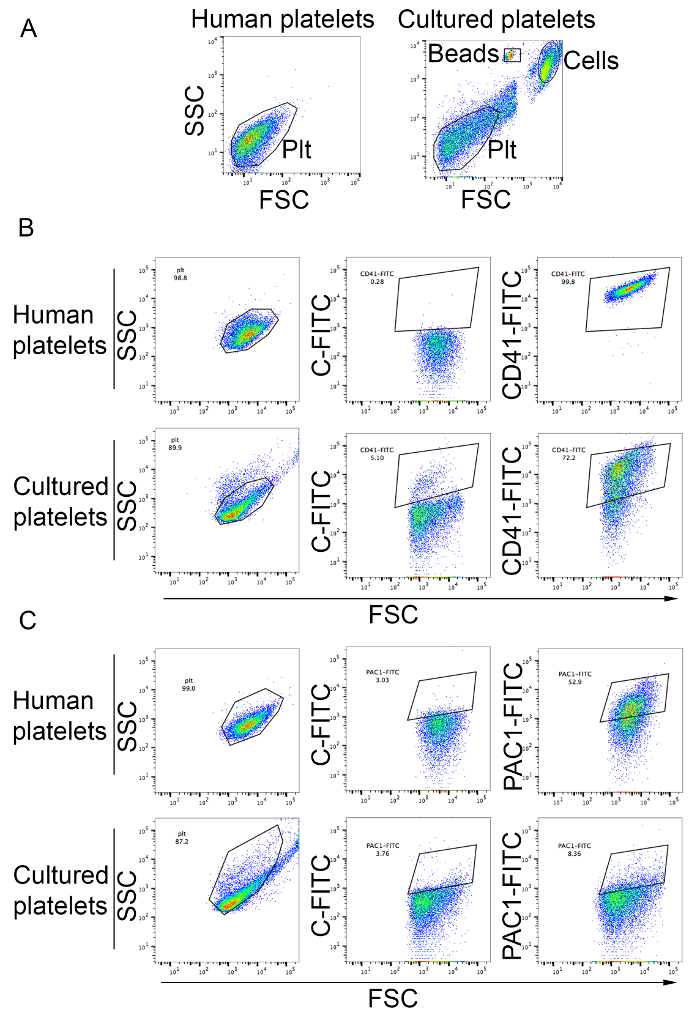
Figura 3: Abbondanza delle piastrine ha prodotto l'attivazione della piastrina in vitro e. (A) piastrine umane da plasma ricco di piastrine erano utilizzate per regolare il cancello analitico utilizzando la scala logaritmica per dispersione in avanti e laterale (pannello di sinistra). Il pannello di destra mostra le cellule provenienti da culture di MK. Piastrine prodotte in vitro sono osservati nel cancello analitico definito per piastrine umane. Cellule e conteggio perline sono indicate nella figura. PLT, piastrine piastrina (B) prodotte in vitro sono stati macchiati con l'anticorpo anti-CD41. Piastrine umane da plasma ricco di piastrine sono state utilizzate per impostare il cancello analitico utilizzando la scala logaritmica per l'avanzamento e dispersione laterale e per confrontare il profilo all'interno del cancello di CD41-FITC. C-FITC, FITC isotipo controllo della piastrina (C) attivazione seguente trattamento dall'ADP a una concentrazione finale di 20 µM. piastrine umane dal plasma ricco di piastrine sono stato usato come controllo (pannelli superiori). Le piastrine prodotte nella cultura sono mostrate in pannelli inferiori. Associazione di PAC1 anticorpo indica l'attivazione della piastrina. C-FITC, controllo di isotipo FITC. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Il protocollo descritto qui è adatto a produzione costante MK e piastrine in coltura dal sangue del cordone ombelicale. Queste cellule possono essere utilizzate per studiare i vari processi come l'effetto di droghe o di attività biologiche su MK proliferazione, differenziazione, a formazione e produzione della piastrina.
Una varietà di terreni di coltura e combinazioni di citochina sono stati presentati nella letteratura. Addizione di citochine come il fattore di cellula formativa, ligando Flt-3, IL-3 e IL-6 supporta CD34+ proliferazione delle cellule. Tuttavia, questa espansione provoca ridotta purezza MK nella cultura14. Il metodo presentato qui, utilizzando i media privo di siero e terapeutici da solo, non consente l'espansione significativa delle cellule progenitrici, ma permette unilineage megakaryocytic proliferazione e la differenziazione e la produzione costante di MK (90-99% CD41+ CD42a+ di cellule positive per doppia) senza contaminazione da altri lignaggi. Il periodo di coltura per la formazione di MK è 10-12 giorni senza la necessità di sostenere stromal o le cellule di alimentatore. Questo confronto con altri metodi che richiedono maggiore cultura periodi (più di 20 giorni)17,18. La resa della piastrina del presente protocollo è 19-42 piastrine per MK o fino a 420 piastrine per CD34 ingresso+ cell. La maggior parte risultato di protocolli in piastrina inferiore produce18,19.
Anche se il rendimento è elevato rispetto all'altri metodi, grandi fonti di cellule CD34 sono necessari per produrre un numero sufficiente di piastrine per uso terapeutico. Cavo sangue MK maturo ad un tasso inferiore, sono generalmente più piccoli (delle classi più basse di ploidia) e hanno ridotto la produzione delle piastrine capacità20. Tuttavia, UCB fresco è generalmente una risorsa più accessibile e questo rappresenta un vantaggio significativo per i ricercatori. Altri metodi che possono produrre rendimenti più elevati di MK e piastrine con obiettivi terapeutici sono stati anche descritti13,17.
Ci sono alcune fonti di variabilità da considerare: A) qualità di unità di sangue cordonale. Solo sangue cordonale raccolto entro 24 h deve essere utilizzato come fonte di CD34+ cellule. Unità cordonali contenente coaguli anche dovrebbero essere scartati. B) percentuale di CD34+ cellule della frazione di cellule mononucleate (passo 1.8): utilizza le frazioni delle cellule mononucleari con meno di 0.3% CD34+ cellule potrebbero verificarsi basse rese di purezza relativamente basso CD34+ cellule. Queste cellule non sono raccomandate per il differenziamento di MK. È essenziale per consentire il drenaggio di liquido dalla forza di gravità solo (per esempio, passi 1.13, 1.14, 1.16). In caso di blocco di colonna, è consigliabile rimuovere la colonna dal magnete, spingere le cellule delicatamente con lo stantuffo della siringa in un nuovo tubo e ricaricare in una nuova colonna equilibrata.
Una serie di condizioni influenza la funzione e il numero delle piastrine. La trombocitopenia si riferisce a un profondo declino nei numeri della piastrina che possono portare ad emorragie interne ed esterne. Condizioni di auto-immuni come trombocitopenia immune (ITP) e trombocitopenia farmaco-indotta (DITP) sono ben note cause di trombocitopenia21,22. Altre malattie immuni come il lupus eritematoso sistemico e l'artrite reumatoide possono anche avere effetti nocivi sulle piastrine. Cause non-immune della trompocitopenia comprendono il trattamento del cancro, gravi traumi, infezioni, insufficienza del midollo osseo e la chirurgia. A causa di un utilizzo elevato delle piastrine di pazienti sottoposti a chemioterapia o che ricevono i trapianti di cellule staminali, la trasfusione della piastrina è aumentato costantemente negli ultimi decenni. Ricerca della piastrina e MK senza dubbio aiuterà nello sviluppo della produzione delle piastrine su larga scala per applicazioni cliniche. Disponibilità di in vitro prodotto funzionale piastrine sarebbe prevenire carenze della piastrina e consentire le trasfusioni della piastrina in pazienti refrattari. Differenziazione di MK e produzione della piastrina in vitro sono strumenti fondamentali per lo studio e la comprensione delle condizioni patologiche sia i meccanismi fisiologici che portano alla formazione delle piastrine.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Gli autori riconoscono il supporto del Australian Health and Medical Research Council (progetto grant 1012409 collegato a BHC).
Materiali
| Name | Company | Catalog Number | Comments |
| Cell Culture Reagents | |||
| Recombinant Human TPO | Miltenyi Biotec | 130-094-013 | |
| StemSpan SFEM II | Stem Cell Technologies | 9605 | Serum-free media for CD34+ cells |
| Name | Company | Catalog Number | Comments |
| CD34 Isolation Reagents | |||
| CD34 MicroBead kit ultrapure | Miltenyi Biotec | 130-100-453 | This kit includes the FcR human IgG blocking reagent and CD34 microbeads. These beads contain the anti-CD34 antibody clone QBEND/10. Use a different anti-CD34 clone for purity check (e.g. clone 8G12). |
| Lymphoprep | Alere Technologies | 1114545 | Lymphocyte separation media (density 1.077 g/mL) |
| Sterile separation buffer (SB) | Miltenyi Biotec | 130-091-221 | This buffer contains phosphate buffered saline (PBS), pH 7.2 containing 0.5% bovine serum albumin and 2 mM EDTA. It can be prepared using sterile, cell culture grade components. De-gas before use because air bubbles can block the column. |
| Name | Company | Catalog Number | Comments |
| Flow Cytometry and Cell Staining Reagents | |||
| PE Mouse anti-Human CD34 | BD Biosciences | 340669 | Clone 8G12. This can be used for CD34 purity check. Final antibody concentration 1:10 dilution. |
| PerCP mouse anti-human CD45 | BD Biosciences | 347464 | 1:10 dilution |
| PerCP isotype control | BD Biosciences | 349044 | 1:10 dilution |
| FITC Mouse anti-Human CD41a | BD Biosciences | 340929 | Final antibody concentration 1:5 dilution. |
| APC Mouse anti-Human CD42b | BD Biosciences | 551061 | This antibody can also be used to detect mature MK (the percentage of positive cells in usually lower than with anti CD42a). Final antibody concentration 1:10 dilution. |
| Alexa Fluor 647 Mouse anti-Human CD42a | AbD Serotec | MCA1227A647T | Currently distributed by Bio-Rad. Final antibody concentration 1:10 dilution. |
| Alexa Fluor 647 Mouse Negative Control | AbD Serotec | MCA928A647 | Currently distributed by Bio-Rad. Isotype control antibody |
| Anti von Willebrand factor rabbit polyclonal | Abcam | AB6994 | 1:200 dilution |
| V450 mouse anti-humna CD41a | BD Biosciences | 58425 | 1: 20 dilution |
| V450 isotype control | BD Biosciences | 580373 | 1:20 dilution |
| PAC1-FITC antibody | BD Biosciences | 340507 | 1:10 dilution |
| Anti CD62p mouse monoclonal | Abcam | AB6632 | 1:200 dilution |
| Alexa Fluor 488 goat anti rabbit IgG | Invitrogen | A11008 | 1:100 dilution |
| Alexa Fluor 594 goat anti mouse IgG | Invitrogen | A11020 | 1:100 dilution |
| Ig Isotype Control cocktail-C | BD Biosciences | 558659 | Isotype control antibody |
| Propidium iodide | Sigma Aldrich | P4864 | |
| CountBright Absolute Counting Beads | Molecular Probes, Invitrogen | C36950 | Counting beads |
| Name | Company | Catalog Number | Comments |
| Materials | |||
| LS columns | Miltenyi Biotec | 130-042-401 | Smaller and larger columns are also commercially available |
| MidiMACS Separator magnet | Miltenyi Biotec | 130-042-302 | |
| MACS MultiStand | Miltenyi Biotec | 130-042-303 | |
| Falcon 5mL round bottom polypropylene FACS tubes, with Snap Cap, Sterile | In Vitro technologies | 352063 | |
| Glass slides | Menzel-Glaser | J3800AMNZ | |
| Mounting media with DAPI | Vector Laboratories | H-1200 | Antifade mounting medium with DAPI |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Inverted microscope | Leica | DMIRB inverted microscope | |
| Fluorescent microscope | Zeiss | Vert.A1 | |
| Cell analyser | BD Biosciences | FACS Canto II | |
| Cytospin centrifuge | ThermoScientific | Cytospin 4 | |
| Name | Company | Catalog Number | Comments |
| Software | |||
| Cell analyser software | BD Biosciences | FACS Diva Software | |
| Single cell analysis software | Tree Star | FlowJo | |
| Fluorescent microscope software | Zeiss | Zen 2 blue edition |
Riferimenti
- Nakeff, A., Maat, B. Separation of megakaryocytes from mouse bone marrow by velocity sedimentation. Blood. 43 (4), 591-595 (1974).
- Zeigler, F. C., et al. In vitro megakaryocytopoietic and thrombopoietic activity of c-mpl ligand (TPO) on purified murine hematopoietic stem cells. Blood. 84 (12), 4045-4052 (1994).
- Reems, J. -. A., Pineault, N., Sun, S. In Vitro Megakaryocyte Production and Platelet Biogenesis: State of the Art. Transfus. Med. Rev. 24 (1), 33-43 (2010).
- Choi, E., Nichol, J. L., Hokom, M. M., Hornkohl, A. C., Hunt, P. Platelets generated in vitro from proplatelet-displaying human megakaryocytes are functional. Blood. 85 (2), 402-413 (1995).
- Perdomo, J., et al. A monopartite sequence is essential for p45 NF-E2 nuclear translocation, transcriptional activity and platelet production. J Thromb Haemost. 8 (11), 2542-2553 (2010).
- Shim, M. H., Hoover, A., Blake, N., Drachman, J. G., Reems, J. A. Gene expression profile of primary human CD34+CD38lo cells differentiating along the megakaryocyte lineage. Exp Hematol. 32 (7), 638-648 (2004).
- Feng, Q., et al. Scalable generation of universal platelets from human induced pluripotent stem cells. Stem cell reports. 3 (5), 817-831 (2014).
- Bruno, S., et al. In vitro and in vivo megakaryocyte differentiation of fresh and ex-vivo expanded cord blood cells: rapid and transient megakaryocyte reconstitution. Haematologica. 88 (4), 379-387 (2003).
- Iraqi, M., Perdomo, J., Yan, F., Choi, P. Y. I., Chong, B. H. Immune thrombocytopenia: antiplatelet autoantibodies inhibit proplatelet formation by megakaryocytes and impair platelet production in vitro. Haematologica. 100 (5), 623-632 (2015).
- Lev, P. R., et al. Impaired proplatelet formation in immune thrombocytopenia: a novel mechanism contributing to decreased platelet count. Br. J. Haematol. 165 (6), 854-864 (2014).
- Gandhi, M. J., Drachman, J. G., Reems, J. A., Thorning, D., Lannutti, B. J. A novel strategy for generating platelet-like fragments from megakaryocytic cell lines and human progenitor cells. Blood Cells Mol. Dis. 35 (1), 70-73 (2005).
- Lu, S. -. J., et al. Platelets generated from human embryonic stem cells are functional in vitro and in the microcirculation of living mice. Cell Res. 21 (3), 530-545 (2011).
- Moreau, T., et al. Large-scale production of megakaryocytes from human pluripotent stem cells by chemically defined forward programming. Nature Commun. 7, 11208 (2016).
- De Bruyn, C., Delforge, A., Martiat, P., Bron, D. Ex vivo expansion of megakaryocyte progenitor cells: cord blood versus mobilized peripheral blood. Stem Cells Dev. 14 (4), 415-424 (2005).
- Nimgaonkar, M. T., et al. A unique population of CD34+ cells in cord blood. Stem cells. 13 (2), 158-166 (1995).
- Italiano, J. E., Patel-Hett, S., Hartwig, J. H. Mechanics of proplatelet elaboration. J Thromb Haemost. 5, 18-23 (2007).
- Matsunaga, T., et al. Ex vivo large-scale generation of human platelets from cord blood CD34+ cells. Stem cells. 24 (12), 2877-2887 (2006).
- Sullenbarger, B., Bahng, J. H., Gruner, R., Kotov, N., Lasky, L. C. Prolonged continuous in vitro human platelet production using three-dimensional scaffolds. Exp Hematol. 37 (1), 101-110 (2009).
- Proulx, C., Boyer, L., Hurnanen, D. R., Lemieux, R. Preferential ex vivo expansion of megakaryocytes from human cord blood CD34+-enriched cells in the presence of thrombopoietin and limiting amounts of stem cell factor and Flt-3 ligand. J. Hematother. Stem Cell Res. 12 (2), 179-188 (2003).
- Bornstein, R., Garcia-Vela, J., Gilsanz, F., Auray, C., Cales, C. Cord blood megakaryocytes do not complete maturation, as indicated by impaired establishment of endomitosis and low expression of G1/S cyclins upon thrombopoietin-induced differentiation. Br. J. Haematol. 114 (2), 458-465 (2001).
- Chong, B. H., Choi, P. Y. I., Khachigian, L., Perdomo, J. Drug-induced Immune Thrombocytopenia. Hematol Oncol Clin North Am. 27 (3), (2013).
- Stasi, R., et al. Idiopathic thrombocytopenic purpura: Current concepts in pathophysiology and management. Thromb Haemost. 99 (1), 4-13 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon