Method Article
Megakaryocyte Differenzierung und Thrombozyten-Formation von Human Cord Blood abgeleitet CD34 Zellen+
In diesem Artikel
Zusammenfassung
Eine hochreine Bevölkerung von Megakaryozyten erhalten Sie bei Kabel Blut stammenden CD34+ Zellen. Eine Methode für die CD34+ Isolation und Megakaryocyte Zelldifferenzierung wird hier beschrieben.
Zusammenfassung
Thrombozyten-Produktion erfolgt hauptsächlich im Knochenmark in einem Prozeß bekannt als Thrombopoiesis. Während Thrombopoiesis differenzieren hämatopoetischen Vorläuferzellen zu Form Thrombozyten Vorläufern genannt Megakaryozyten, die unheilbar unterscheiden, Thrombozyten aus langen zytoplasmatischen Prozesse bezeichnet Proplatelets freizugeben. Megakaryozyten sind seltene Zellen beschränkt sich auf das Knochenmark und sind daher schwer zu ernten, in ausreichender Zahl für den Laboreinsatz. Effiziente Produktion von menschlichen Megakaryozyten kann erreicht in Vitro durch Kultivierung CD34+ Zellen unter geeigneten Bedingungen. Das Protokoll hier detailliert beschreibt Isolierung von CD34+ Zellen durch magnetische Zellen aus Nabelschnurblut Blutproben sortieren. Die notwendigen Schritte um hochreines, Reifen Megakaryozyten serumfreien Bedingungen zu produzieren sind beschrieben. Details der phänotypische Analyse der Megakaryocyte Differenzierung und Bestimmung der proplatelet Bildung und Thrombozyten sind ebenfalls vorhanden. Effektoren, die Megakaryocyte Differenzierung und/oder proplatelet Bildung, wie z. B. Anti-Thrombozyten-Antikörper oder Thrombopoietin Mimetika beeinflussen können hinzugefügt werden kultivierten Zellen, biologische Funktion zu prüfen.
Einleitung
Isolierung von ausreichender Anzahl der primären menschlichen Megakaryozyten (MK) für regelmäßige Laboreinsatz ist nicht möglich aufgrund ihrer niedrigen Frequenz im Knochenmark, wo sie ~0.01% von kernhaltigen Zellen1entfallen. Eine bequeme Alternative ist die ex-Vivo -Erweiterung und Differenzierung von hämatopoetischen Stammzellen und Vorläuferzellen in Anwesenheit von bestimmten Wachstumsfaktoren. Eine Reihe von Zytokinen einschließlich Stammzell-Faktor (SCF; c-Kit-Ligand) und Interleukin (IL)-3 und IL-11 wurden ist in Kultur-Systeme eingesetzt, um MKs Thrombopoietin (TPO) produzieren der effektivste Wachstum und Differenzierung Faktor für Megakaryopoese Kulturen und ist effektiv, allein oder mit anderen Zytokinen, z. B. SCF und IL-3-2. TPO wirken auf Stammzell-Populationen, die Verbreitung und die Reifung der MKs2führen.
MK produzieren Thrombozyten aus zytoplasmatischen Vorsprünge genannt Proplatelets und in-vivo, ca. 1 x 1011 Thrombozyten sind entsteht täglich um Thrombozytenwerte von 150-400 x 109/L. Thrombozyten Produktion in Vitro aufrecht zu erhalten bis zu 1000 -Falten Sie niedriger als die in Vivo 3 schätzt, und dies hat Anlass zu zahlreichen Kulturbedingungen CD34 mit+ hämatopoetischen Vorläuferzellen, MK und Thrombozyten Produktion in Vitrozu verbessern. Die ursprüngliche Quelle der CD34+ für MK Differenzierung verwendete Zellen war menschlichen peripheren Blut4. Andere Zelle Quellen schließen Knochenmark5,6, embryonale Stammzellen/induzierte pluripotente Stammzellen (ESC/iPSC)7und Nabelschnur Blut (UCB)8,9,10 . Menschlichen Knochenmark CD34+ 11 und Maus Linie negative Knochenmark Zellen5 produzieren MK und Blutplättchen in Vitro; Dennoch, die mangelnde Verfügbarkeit von menschlichen Knochenmark schränkt seine Verwendung als eine Quelle von CD34+ Zellen. Im Gegensatz dazu stehen für ESC und iPSC eine unbegrenzte Quelle von Zellen für in-vitro- Thrombozyten-Produktion. Thrombozyten-Produktion aus diesen Zellen erfordert Feeder-Zellen wie murinen OP9 Zellen und längere Kultur. Thrombozyten im Feeder-freien Bedingungen abgeleitet scheinen weniger funktional12sein. iPSC-abgeleitete Plättchen werden voraussichtlich von Einsatz in klinischen Einrichtungen sein, da sie auf einer großen Skala erweitert werden können. Dieser Prozess erfordert Lentivirale vermittelte Transduktion von Transkriptionsfaktoren und langfristige Zelle Kultur13.
UCB ist eine zugängliche Quelle von CD34+ Zellen, die leicht einsetzbare Forschung Einstellungen. TPO allein kann Förderung der Differenzierung der Schnur Blut stammenden CD34+ Zellen, und dies gibt Anlass zu hochreinen, Reife MKs ohne die Notwendigkeit für Serum-Supplementierung oder Kokultur mit Feeder-Zellen. Andere Zytokine wie z. B. SCF Differenzierung von UCB CD34 verringern kann+ Zellen, während Flt-3 Ligand und IL-11 die Produktion von unreifen Megakaryozyten14 fördern. Dieses Protokoll beschreibt die Herstellung von hochreinen MK Kulturen aus Nabelschnurblut CD34+ Zellen in serumfreien Bedingungen.
Protokoll
Dieses Protokoll wurde von der South Eastern Sydney menschliche Forschungsethikkommission genehmigt und von der University of New South.Wales menschliche Forschungsethikkommission ratifiziert. Nabelschnurblut aus gesunden Spendern gewonnen wurde durch die Sydney Nabelschnurblutbank (Sydney, New South Wales, Australien) zur Verfügung gestellt. Volumen von ca. 100 mL wurden für dieses Verfahren verwendet.
Hinweis: In einer Klasse II Biosicherheit Schrank mit aseptischen Technik arbeiten. Das äußere des Kabel-Blutbeutel mit 70 % Ethanol zu dekontaminieren. Sterile Instrumente (Schere, Pinzette) für dieses Verfahren zu verwenden.
1. Schnur Blutkörperchen Vorbereitung und Isolierung von CD34 Zellen+
- Bereiten Sie sterile Trennung Puffer (SB) mit Phosphat gepufferte Kochsalzlösung (PBS), bei pH 7,2 und mit 0,5 % bovine Serum Albumin und 2 mM EDTA.
- 10 mL SB in ein 50 mL konische Röhrchen (eine Röhre pro 10 mL Blut ist erforderlich) zu verzichten. Mit Hilfe einer G18 stumpfen Nadel montiert auf einer 10 mL Spritze, 10 mL Blut aus der Tasche ziehen und in der 50 mL Röhrchen mit 10 mL SB zu verzichten.
- Hinzugeben Sie 15 mL Lymphozyten Trennung Medien (siehe Tabelle der Materialien) an der Unterseite des Rohres, enthält das verdünnte Blut, zwei Schichten.
Hinweis: Verzichten Sie Medien langsam an der Unterseite des Rohres zu vermeiden, mischen die verschiedenen Schichten. - Zentrifugieren Sie Rohre bei 1.200 × g für 30 min bei Raumtemperatur (RT) mit keinen Bruch und keine Beschleunigung.
- Übertragen Sie die Schicht nahe der Mitte des Rohres mit mononukleären Zellen (ca. 5-10 mL aus jeder Tube) in eine neue 50 mL-Tube mit einer Pasteurpipette. Jedes Rohr auf ein Gesamtvolumen von 50 mL SB hinzufügen.
- Zentrifugieren Sie bei 400 × g für 10 min bei RT. verwerfen des Überstands.
- Aufschwemmen Sie Zelle Pellets sorgfältig mit einer Pasteurpipette in 5-10 mL GBL kombinieren die suspendierten Zellen und bringen Sie Volumen 50 mL mit SB.
- Anzahl Zellen verwenden Trypan blau Färbung und eine Hemocytometer oder automatisierte Zelle entgegen (siehe Tabelle der Materialien). Den Anteil der CD34 bestimmen Zellen+ in der Probe, Aufschwemmen 2,5 × 105 Zellen in 100 µL der SB und Fleck durch Zugabe von 10 µL Anti-CD34-PE Antikörper für 15-30 min bei 4 ° C. Analysieren von Durchflusszytometrie (Abbildung 1A).
- Zentrifuge Rohre bei 400 × g für 10 min bei 4 ° C. Verwerfen Sie überstand.
Hinweis: Wenn Sie nicht sofort benötigt, können Mononukleäre Zellen zu diesem Zeitpunkt eingefroren werden. - Aufschwemmen Sie Zellen in 300 µL der SB pro 108 Zellen. Hinzufügen von 100 µL der FcR menschliche IgG (blocking Reagenz, siehe Tabelle of Materials) und 100 µL CD34 magnetische Beads pro 108 Zellen. Vorsichtig mischen und bei 4 ° C für 30-40 min inkubieren.
Hinweis: Eine einzelne Zelle Suspension ist erforderlich (wenn notwendig, übergeben den Zellen aber 30 µm Filter vor der Zugabe von Reagenzien). Verwenden Sie die Reagenz Bände hier beschrieben für 108 Zellen oder weniger. Für mehr als 108 Zellen, die Reagenzien (SB, blockiert Lösung und CD34 magnetische Beads) werden entsprechend skaliert. - Bereiten Sie LS-Trennsäule während der Inkubationszeit, indem man die LS-Spalte in einem Magnethalter und waschen mit 3 mL GBL verwerfen das Abwasser.
Hinweis: LS Trennsäulen können mit bis zu 2 × 108 total Zellen geladen werden. Kleinere und größere Spalten stehen zur Verfügung. - Die Zelle Mischung 5-10 mL SB hinzu und Zentrifuge bei 400 × g für 10 min. Überstands verwerfen.
- Aufschwemmen Sie Zellen in 1,5 mL SB und laden Sie die Zellsuspension (1,5 mL) auf die LS-Säule. Sammeln Sie die Strömung durch die unbeschriftete Zellen in einem 15 mL Sammelrohr (negative Bruch #1). Lassen Sie die Flüssigkeit abtropfen und waschen Sie die Spalte mit 1,5 mL SB.
- Die gesammelten Lastfluss durch (3 mL) wieder in die Spalte und die Durchströmung in dem gleichen 15 mL Sammelrohr (negative Bruch #1) sammeln. Waschen Sie die LS-Spalte 3 Mal mit 3 mL SB.
Hinweis: Bei Bedarf Zellen in den negativen Anteil (12 mL) können auch gebeizt mit Anti-CD34-Antikörper zu prüfen, Erfassung von CD34+ Zellen, die Spalte "LS". - Entfernen Sie Spalte aus der Magnetabscheider und leeren Sie Zellen mit einem Spritzenkolben langsam in ein neues 15 mL Röhrchen mit 2 mL SB.
- Setzen Sie Spalte wieder auf Magnetabscheider und laden die 2 mL der Zellen in der Spalte. Die Durchströmung zu sammeln und mit 2 mL SB waschen. Dies ist der negative Teil #2 (4 mL).
- Magnetabscheider LS Spalte entfernen und 2 mL SB Flush Zellen stetig und fest mit einem Spritzenkolben die CD34 sammeln+ Zelle Bruchteil. Zählen Sie die Zellen mit Trypan blau Färbung und einem Hemocytometer oder automatisierte Zelle Zähler.
- Zentrifugenröhrchen mit dem positiven Bruch bei 400 × g für 15 min bei 4 ° C. Verwerfen Sie den überstand. Zellen in serumfreien Medien für CD34 Aufschwemmen+ Zellen (SFM, siehe Tabelle der Materialien).
Hinweis: Wenn Sie nicht sofort benötigt, können Zellen in flüssigem Stickstoff zu diesem Zeitpunkt eingefroren werden.
(2) Reinheit Check von isolierten CD34 Zellen+
- 2 x 104 Zellen aus der positiven Fraktion mit 10 µL Anti-CD34-PE Antikörper und 20 µL Anti-CD45-PerCP Antikörper für 15 min bei 4 ° C (Verwendung eine separaten tube für Isotype Steuerelemente) färben (Abbildung 1 b).
- Fügen Sie 1 mL SB zu waschen. Zentrifugieren Sie bei 400 × g für 10 min. Aufschwemmen Pellet in 200 µL des SB.
- Durchflusszytometrischen Analyse durchführen und Tor live Zellpopulation Schutt (Abbildung 1 b) auszuschließen. Das Tor für PE und PerCP positive Populationen mit Steuerelementen für PE und PerCP Isotype (Abbildung 1 b) und bestimmen den Prozentsatz der CD34+/CD45+ Zellen.
(3) Megakaryocyte Differenzierung
- Samen 5 × 105 Zellen/mL CD34+ Zellen in 2 mL SFM pro Bohrloch in einer 12-Well-Platte mit 50 ng/mL rekombinanten menschlichen Thrombopoetin (RhTPO) ergänzt. Inkubieren Sie Zellen bei 37 ° C, 5 % CO2 in eine feuchte Atmosphäre. Wenn Zellen konfluierende sind, bevor sie für die Analyse erforderlich sind, die Zellen zu ernten und in mehrere Brunnen mit frischem Medien- und RhTPO aufgeteilt.
Hinweis: Zwei oder drei Brunnen sollte bereit sein, speziell, Differenzierung zu verschiedenen Zeitpunkten (z.B. Tage 7, 9 und 10) zu überwachen. - Ernten Sie Zellen aus den Brunnen beiseite stellen und Differenzierung zu überwachen, ohne die Zellen in den anderen Brunnen zu stören.
- Fleck-Zellen mit 20 µL Anti-GPIIb/CD41-FITC Antikörper und 10 µL Anti-GPIX/CD42a-Alexa Fluor 647 Antikörper in einem Endvolumen von 100 µL. richten Sie ein Steuerelement Rohr mit den jeweiligen Isotype Kontrolle Antikörper. 15-30 min bei 4 ° c inkubieren
- Fügen Sie 1 mL SB zu waschen.
- Fügen Sie 1 mL SB zu waschen. Zentrifuge bei 400 × g für 10 min. Aufschwemmen das Pellet in 100 µL der SB und Spin auf einem Objektträger bei 1.000 x g für 5 min. Fix Zellen auf der Folie durch Eintauchen in Methanol für 30 S. lufttrocknen hinzufügen 20 µL Medium mit DAPI zu montieren (siehe Tabelle der Materialien) , mit einem Deckglas abdecken und visualisieren mit einem fluoreszierenden Mikroskop (Abb. 2A).
- Waschen mit 2 mL PBS/0.1% Triton-X 100 und 400 × g für 10 min Zentrifugieren, in 100 µL des gleichen Puffers Aufschwemmen und Anti-Maus IgG-Alexa 594 und Anti-Kaninchen IgG-Alexa 488 (1: 100) hinzufügen. 30 min bei Raumtemperatur inkubieren, waschen mit 2 mL PBS/0.1% Triton-X 100 in 100 µL des gleichen Puffers Aufschwemmen und fügen Sie 20 µL anti-CD42b-APC. Dann drehen Sie die Zellen auf Glas-Objektträger zu, wie in Schritt 3.6.1 beschrieben und bereiten Sie Proben für mikroskopische Visualisierung vor, wie in Schritt 3.6.1 beschrieben.
- Einmal mit 1 mL SB waschen und Aufschwemmen Pellet in 300 µL hypotone Citrat-Puffer (1,25 mM Natriumcitrat, Natriumchlorid 2,5 mM, 3,5 mM Traubenzucker) mit 20 µg/ml Propidium Jodid und 0,05 % Triton X-100. Inkubieren Sie für 15 min bei 4 ° C, vor Licht geschützt werden.
- Hinzu kommt eine Endkonzentration von 20 µg/mL RNase und inkubieren Sie für 30 min bei 4 ° C, vor Licht geschützt. Bestimmen Sie die Intensität der Propidium Jodid durch Durchflusszytometrie, durch das Sammeln von 30.000 bis 50.000 Veranstaltungen der Bevölkerung CD41-FITC+ (Abbildung 2).
4. proplatelet zählen, Thrombozyten-Enumeration und Thrombozyten Aktivierung
- Ernten Sie Zellen (aus Schritt 3.1) Tage 8 oder 9 von Differenzierung und Saatgut an 1 × 104 Zellen/Brunnen in 48-Well-Platten in 200 µL des frischen SFM mit 50 ng/mL RhTPO ergänzt. Kultur für 5 Tage bei 37 ° C, 5 % CO2.
Hinweis: Quantifizierung Zwecken Samen Sie Brunnen in dreifacher Ausfertigung. Diese geringe Dichte ist erforderlich für die Visualisierung und Zählung des proplatelet-Lagers MK Proplatelets in der Regel starten, erscheinen nach 2 Tagen der Kultur. Der Höhepunkt ist zwischen 4 und 5 Tage. - Die Anzahl der proplatelet tragenden MK in der ganze Brunnen auf einem inversen Licht Mikroskop mit 10 X oder 20 X Ziele.
Hinweis: Ein beheiztes (37 ° C) Mikroskoptisch ist vorzuziehen, da halten die Zellen bei Raumtemperatur über einen längeren Zeitraum bewirkt, Schrumpfung der proplatelet Erweiterungen dass. Proplatelets sind als lange Erweiterungen aus dem MK-Körper beobachtet. Jeder MK möglicherweise mehrere proplatelet Vorsprünge. Als Proplatelets zu entwickeln, sinkt der Körper des MK in der Größe. - Zellen zu ernten und Zentrifugieren bei 400 X g für 10 min bei Raumtemperatur. Färben Sie Zellen mit 20 µL Anti-Human CD41-FITC Antikörper, wie in 3.3 und 3.4 beschrieben. Berechnung des Prozentsatzes der proplatelet tragenden MK (PbMK): PbMK (%) = [(Proplatelet-Lager MKs/gut) / (Total CD41+ Zellen / gut)] X 100
- Plättchen in das Kulturmedium abgegeben zu zählen, sanft mischen Sie die Zellen mit einer Pasteurpipette und sammeln Sie 100 µL Tage 14 oder 15 Kultur.
- Färben Sie mit 20 µL Anti-Human CD41-FITC Antikörper für 20-30 min bei 4 ° C. Richten Sie ein Steuerrohr mit der jeweiligen Isotype Kontrolle Antikörper.
- Fügen Sie SB 150 µL und 50 µL Perlen zu zählen.
- Stellen Sie für durchflusszytometrischen Analyse FSC und SSC Skala anmelden. Einsatz normaler menschlicher Blutplättchen von Platelet-Rich Plasma mit CD41-FITC befleckt, wie beschrieben in Abschnitt 4.4.1 festzulegende gating für Thrombozyten (Abb. 3A).
- Analysieren Sie die gefärbten Plättchen mit Perlen von Durchflusszytometrie zählen. Sammeln Sie 1.000 Veranstaltungen zählen Perlen mit der FSC gegen SSC Streudiagramm (Abb. 3A). Berechnen Sie die Anzahl der Thrombozyten basierend auf CD41-FITC positive Ereignisse (Abb. 3 b) mit der Formel:
Thrombozyten pro Mikroliter = [(Anzahl positiver Ereignisse CD41-FITC)/1,000 beads)] x [(number of beads in 50 µL)/sample Volume)]
- Um Thrombozyten Aktivierung zu analysieren, vorsichtig mischen Sie die Zellen mit einer Pasteurpipette und sammeln Sie 100 µL Tage 14 oder 15 Kultur. Fügen Sie 1 mL Tyrode Puffer (137 mM NaCl, 2,7 mM KCl, 1 mM MgCl2, 1,8 mM CaCl2, 0,2 mM Na2HPO4, 12 mM Nahco33, 5,5 mM D-Glucose, pH 6,5) und Zentrifuge bei 200 X g für 5 min zum pellet-Zellen.
- Sammeln Sie die überstand und Zentrifuge bei 800 X g für 10 min bis zum pellet-Thrombozyten-Partikel.
- Überstand verwerfen und in 100 µL Tyrode Puffer aufzuwirbeln. Hinzufügen einer Endkonzentration von 20 µM. 20 µL PAC1-FITC Antikörper und Adenosin-diphosphat (ADP) Inkubation bei Raumtemperatur für 20 min. Analyze durch Durchflusszytometrie den Anteil positiver Ereignisse FITC bestimmen. Verwenden Sie frische menschlichen Thrombozyten auf die gleiche Weise als Positivkontrolle (Abbildung 3) behandelt.
Ergebnisse
Dieses Protokoll ermöglicht die Zubereitung von MK hoch Reinkulturen von Schnur Blut stammenden CD34+ Zellen. Der Anteil der CD34+ Zellen in Schnur Blut ist etwa 1,3 %15 (Abbildung 1A) und die Gesamtzahl der mononukleären Zellen (Schritt 1,8) reicht von 90-300 x 106 Stück UCB. Die Reinheit von CD34 + / CD45 + Zellen nach Isolierung reicht von 90 bis 99 % (Abbildung 1 b). MK (definiert als CD41+ Zellen) werden früh in serumfreien CD34 beobachtet+ Zellkulturen in Anwesenheit von RhTPO. Am 7. Tag, der Anteil der Reifen MK (CD41+ und CD42a+ Zellen) ist in der Regel 30-40 % (Abbildung 1). Höchstmaß an CD41+ und CD42a+ doppelte positive Zellen (90-99 %) zwischen 10 und 12 der Differenzierung (Abbildung 1) Tagen eingehalten werden. Die Variabilität beobachtet hängt vor allem die Schnur Blut Quelle und die Reinheit der CD34+/CD45+ Zellen, die in Schritt 1.17 isoliert. Die Ausbeute an Reife MK am 10. Tag reicht von 5 bis 10 pro Eingang CD34+ Zelle. MK Reifen (CD41+/CD42b+) beobachtet unter Leuchtstofflampenlicht Mikroskopie sind in Abbildung 2Adargestellt. Kultivierte MK erscheinen als große, in der Regel mehrkernigen Zellen (Abb. 2A, Pfeilspitzen). MK körnigen Inhalt wurde durch vWf (grün) und CD62p (p-Selektin, rot) Färbung (Abb. 2 b) bestimmt. Die Diploidie Verteilung beobachtet in kultivierten MKs ist in Abbildung 2dargestellt.
Proplatelets sind lange, wulstige Fasern oder Fäden, die sich aus dem MK-Körper erstrecken. Proplatelets können mehrere hundert Mikrometer lange16 und Zweige und aufgeblähten Regionen enthalten. Ein Merkmal proplatelet tragenden MK ist in Abb. 2Ddargestellt. Der Anteil der proplatelet tragenden MK (PbMK) betrug 1,3 ± 0,17 %.
Thrombozyten können analysiert und wie beschrieben im Protokoll gezählt. Wie in Abbildung 3 bgezeigt, fallen die meisten Plättchen in der Zellkultur Überstand in das analytische Tor des peripheren Blutplättchen und sind positiv für die Thrombozyten-Markierung CD41 (Abb. 3 b). Der Thrombozyten-Ertrag aus dieser Methode reicht von 19 bis 42 Thrombozyten pro MK Blutplättchen produziert in der Kultur von Thrombozyten-Agonisten wie ADP durch erhöhte Bindung von der Aktivierung-spezifische PAC1 monoklonale Antikörper (Abbildung 3) aktivierbar .

Abbildung 1: Flow Cytometry Grundstücke CD34+ Zell-Isolation und MK-Differenzierung in der Kultur. (A) mononukleären Zellen (gated wie gezeigt in der linken Leiste) von menschlichen Nabelschnurblut (Schritt 1,8) gereinigt waren voller Flecken, mit Anti-CD34-PE Antikörper zu bestimmen, den Prozentsatz der die CD34+ Zellen in der Probe (1,3 %, rechts). (B) nach der Trennung war der positive Teil (Schritt 1.17) mit Anti-CD34-PE und Anti-CD45 PerCP Antikörpern gefärbt. Die angereicherten CD34+ Bevölkerung ist in der Abbildung (98,1 %, rechten, oberen rechten Quadranten) angegeben. (C) phänotypische Analyse der MK differenziert in Vitro von CD34 + Zellen für 7 Tage oder 11 Tage waren voller Flecken, mit Anti-CD41 und Anti-CD42a Antikörper. Reife MK sind positiv für beide CD41+ und CD42a+ (oberen rechten Quadranten). Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: MK Färbung, Diploidie und proplatelet Bildung in-vitro-. (A) fluoreszierende Bilder von Tag 11 MK gebeizt mit Anti-CD41-PE und CD42b-APC-Antikörper. Kerne wurden mit DAPI gefärbt. Gelbe Pfeilspitze zeigt Multi-nuklearen MKs. Waage bar 30 µm. (B) fluoreszierende Bilder von Tag 14 MK gebeizt mit anti-vWf (grün), anti-CD62p (rot) und Anti-CD42b-APC (Magenta) Antikörper. Kerne wurden mit DAPI gefärbt. Maßstabsleiste, 15 µm (C) repräsentative gating-Strategie zeigt die Diploidie Verteilung von CD41+ Veranstaltungen. Die Grafik (unten) zeigt die beobachtete Verteilung der Diploidie Klassen (n = 4), Fehlerbalken, SD (D) die charakteristische Morphologie der proplatelet tragenden MK wird angezeigt. Die MK-Körper ist durch den Pfeil angedeutet. Die langen zytoplasmatischen Prozesse erstreckt sich von der MK (Proplatelets) werden durch Pfeilspitzen angezeigt. Es kann in einige Bereiche/Felder der Sicht unklar, ob ein oder zwei MK produzieren diese proplatelet Erweiterungen sein. Dies sollte als ein proplatelet-Lager MK Aufnahmen mit einem inversen Mikroskop, 10 X-Objektiv gezählt werden. Maßstabsleiste, 50 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
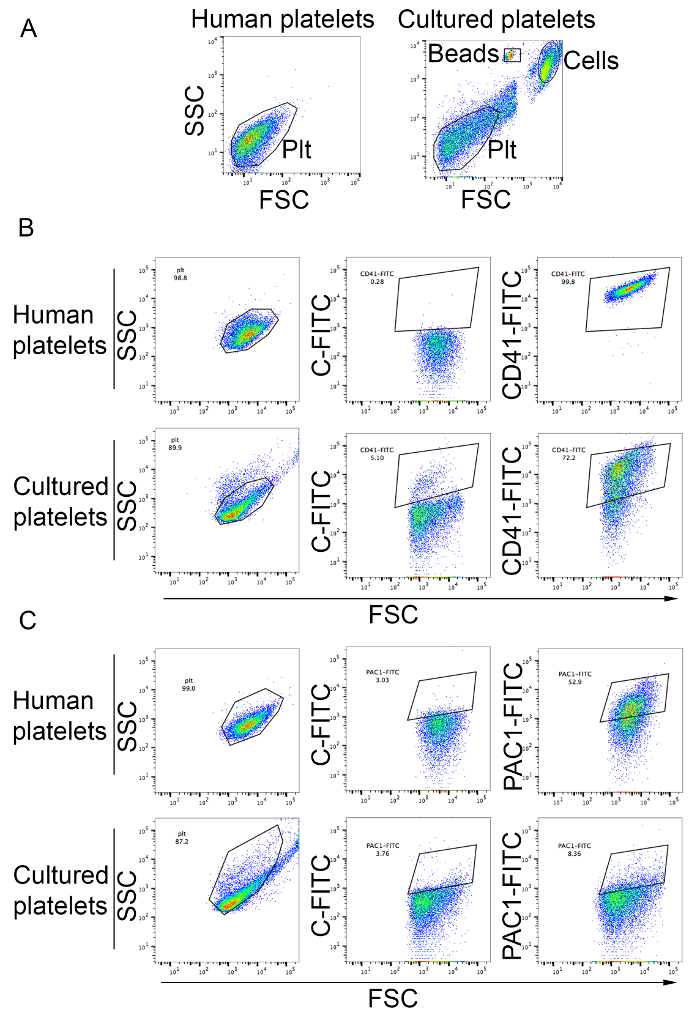
Abbildung 3: Fülle von Blutplättchen produziert in Vitro und Thrombozyten Aktivierung. (A) menschlichen Thrombozyten aus Platelet-Rich Plasma wurden verwendet, um die analytische Tor mit logarithmischer Skalierung für vorwärts- und seitliche Streuung (linken). Im Rechte Bereich zeigt Zellen aus MK Kulturen. Blutplättchen produziert in Vitro werden in das analytische Tor für menschlichen Thrombozyten definiert beobachtet. Zellen und Zählung Perlen sind in der Abbildung angedeutet. PLT, Thrombozyten (B) Thrombozyten produziert in Vitro waren voller Flecken mit Anti-CD41 Antikörper. Menschlichen Thrombozyten aus Platelet-Rich Plasma dienten, das analytische Tor mit logarithmischer Skalierung für Forward und Side Scatter und das Profil innerhalb des CD41-FITC-Gates zu vergleichen. C-FITC, FITC Isotype Steuern (C) Thrombozyten Aktivierung nach Behandlung durch ADP, eine Endkonzentration von 20 µM. menschlichen Thrombozyten aus Platelet-Rich Plasma als Kontrolle (oberen Platten) verwendet wurden. Blutplättchen produziert in Kultur entnehmen Sie bitte den unteren Platten. Bindung von PAC1 zeigt Antikörper Thrombozyten Aktivierung. C-FITC, FITC Isotype Kontrolle. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Das hier beschriebene Protokoll eignet sich für konsequente Produktion von MK und Thrombozyten in Kultur aus Nabelschnurblut. Diese Zellen können verwendet werden, um verschiedene Prozesse wie die Wirkung von Drogen oder biologischen Aktivitäten auf MK-Proliferation, Differenzierung, proplatelet Bildung und Produktion der Thrombozyten zu studieren.
Eine Vielzahl von Kultur, Medien und Zytokin-Kombinationen sind in der Literatur vorgestellt worden. Addition von Zytokinen wie Stammzellen Faktor, Flt-3 Liganden, IL-3 und IL-6 unterstützt CD34+ Zell-Proliferation. Diese Erweiterung führt jedoch reduzierte MK Reinheit in der Kultur-14. Die Methode, die hier vorgestellte serumfreie Medien mit RhTPO allein, erlaubt keine deutliche Ausweitung der Vorläuferzellen, aber erlaubt Unilineage Megakaryopoese Proliferation und Differenzierung und konsequente Produktion von MK (90-99 % CD41+ CD42a+ doppelt positive Zellen) ohne Kontamination aus anderen Linien. Die Kultur MK Bildung beträgt 10 bis 12 Tage ohne die Notwendigkeit einer Unterstützung von Stromazellen oder Feeder-Zellen. Günstig im Vergleich mit anderen Methoden, die größere Kultur Perioden (mehr als 20 Tage)17,18. Die Thrombozyten-Ausbeute aus diesem Protokoll ist 19-42 Thrombozyten pro MK oder bis zu 420 Thrombozyten pro Eingang CD34+ Zelle. Die meisten Protokolle führen zu niedrigeren Thrombozyten ergibt18,19.
Obwohl Ertrag hoch im Vergleich zu anderen Methoden ist, sind große Quellen von CD34-Zellen zur benötigt ausreichende Zahl von Thrombozyten für den therapeutischen Einsatz. Cord Blood MK Reifen mit einer niedrigeren Rate, sind im Allgemeinen kleiner (der unteren Klassen der Diploidie) und Thrombozyten Produktion Kapazität20reduziert haben. Dennoch frische UCB ist in der Regel eine leichter zugängliche Ressource, und dies bietet erhebliche Vorteile für Forscher. Andere Methoden, die höhere Erträge der MK und der Blutplättchen mit therapeutischen Ziele zu produzieren wurden ebenfalls beschrieben13,17.
Es gibt einige Quellen der Variabilität zu berücksichtigen: A) Qualität des Referats Schnur Blut. Nur Nabelschnurblut gesammelt innerhalb von 24 h sollte verwendet werden, als eine Quelle von CD34+ Zellen. Cord Blood Einheiten mit Klumpen müssen auch entsorgt werden. (B) Anteil der CD34+ Zellen in mononukleären Zellen Bruchteil (Schritt 1,8): mit mononukleären Zellen Brüche mit weniger als 0,3 % CD34+ Zellen verursachen niedrige Erträge relativ geringe Reinheit CD34+ Zellen. Diese Zellen sind für MK Differenzierung nicht empfohlen. Es ist wichtig, den flüssigen Ablauf durch Schwerkraft nur zu lassen (z. B.Schritte, 1.13, 1.14, 1.16). Im Falle einer Spalte Blockade empfiehlt es sich, entfernen die Spalte vom Magneten, die Zellen sanft mit den Spritzenkolben in einen neuen Schlauch schieben und laden Sie auf eine neue äquilibriert Spalte.
Eine Reihe von Bedingungen beeinflussen Thrombozyten-Anzahl und Funktion. Thrombozytopenie bezieht sich auf einen deutlichen Rückgang der Thrombozyten-zahlen, die äußeren und inneren Blutungen führen kann. Autoimmun-Erkrankungen wie immun-Thrombozytopenie (ITP) und Arzneimittel-induzierte Thrombozytopenie (DITP) sind bekannte Ursachen der Thrombozytopenie21,22. Anderen Immunerkrankungen wie systemischer Lupus erythematodes und rheumatoide Arthritis können auch nachteilige Auswirkungen auf die Blutplättchen haben. Non-immun-Ursachen der Thrombozytopenie sind Krebsbehandlung, schwere Traumata, Infektionen, Knochenmarkdepression und Chirurgie. Thrombozyten-Transfusion ist wegen der hohen Auslastung der Thrombozyten durch Patienten Chemotherapie oder Stammzellentransplantation erhalten stetig in den letzten Jahrzehnten gestiegen. MK und Thrombozyten Forschung wird zweifellos in die Entwicklung der Thrombozyten Produktion in großem Maßstab für klinische Anwendungen unterstützen. Verfügbarkeit von in-Vitro produziert funktionelle Blutplättchen Thrombozyten Engpässe verhindert und Thrombozytentransfusionen in refraktären Patienten zu ermöglichen. MK-Differenzierung und Thrombozyten Produktion in Vitro sind wichtige Werkzeuge für das Studium und Verständnis der pathologischen Zuständen und die physiologischen Mechanismen, die zur Bildung von Thrombozyten führen.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Die Autoren erkennen die Unterstützung des australischen Gesundheits- und Medical Research Council (Projekt Grant 1012409 verbunden mit BHC).
Materialien
| Name | Company | Catalog Number | Comments |
| Cell Culture Reagents | |||
| Recombinant Human TPO | Miltenyi Biotec | 130-094-013 | |
| StemSpan SFEM II | Stem Cell Technologies | 9605 | Serum-free media for CD34+ cells |
| Name | Company | Catalog Number | Comments |
| CD34 Isolation Reagents | |||
| CD34 MicroBead kit ultrapure | Miltenyi Biotec | 130-100-453 | This kit includes the FcR human IgG blocking reagent and CD34 microbeads. These beads contain the anti-CD34 antibody clone QBEND/10. Use a different anti-CD34 clone for purity check (e.g. clone 8G12). |
| Lymphoprep | Alere Technologies | 1114545 | Lymphocyte separation media (density 1.077 g/mL) |
| Sterile separation buffer (SB) | Miltenyi Biotec | 130-091-221 | This buffer contains phosphate buffered saline (PBS), pH 7.2 containing 0.5% bovine serum albumin and 2 mM EDTA. It can be prepared using sterile, cell culture grade components. De-gas before use because air bubbles can block the column. |
| Name | Company | Catalog Number | Comments |
| Flow Cytometry and Cell Staining Reagents | |||
| PE Mouse anti-Human CD34 | BD Biosciences | 340669 | Clone 8G12. This can be used for CD34 purity check. Final antibody concentration 1:10 dilution. |
| PerCP mouse anti-human CD45 | BD Biosciences | 347464 | 1:10 dilution |
| PerCP isotype control | BD Biosciences | 349044 | 1:10 dilution |
| FITC Mouse anti-Human CD41a | BD Biosciences | 340929 | Final antibody concentration 1:5 dilution. |
| APC Mouse anti-Human CD42b | BD Biosciences | 551061 | This antibody can also be used to detect mature MK (the percentage of positive cells in usually lower than with anti CD42a). Final antibody concentration 1:10 dilution. |
| Alexa Fluor 647 Mouse anti-Human CD42a | AbD Serotec | MCA1227A647T | Currently distributed by Bio-Rad. Final antibody concentration 1:10 dilution. |
| Alexa Fluor 647 Mouse Negative Control | AbD Serotec | MCA928A647 | Currently distributed by Bio-Rad. Isotype control antibody |
| Anti von Willebrand factor rabbit polyclonal | Abcam | AB6994 | 1:200 dilution |
| V450 mouse anti-humna CD41a | BD Biosciences | 58425 | 1: 20 dilution |
| V450 isotype control | BD Biosciences | 580373 | 1:20 dilution |
| PAC1-FITC antibody | BD Biosciences | 340507 | 1:10 dilution |
| Anti CD62p mouse monoclonal | Abcam | AB6632 | 1:200 dilution |
| Alexa Fluor 488 goat anti rabbit IgG | Invitrogen | A11008 | 1:100 dilution |
| Alexa Fluor 594 goat anti mouse IgG | Invitrogen | A11020 | 1:100 dilution |
| Ig Isotype Control cocktail-C | BD Biosciences | 558659 | Isotype control antibody |
| Propidium iodide | Sigma Aldrich | P4864 | |
| CountBright Absolute Counting Beads | Molecular Probes, Invitrogen | C36950 | Counting beads |
| Name | Company | Catalog Number | Comments |
| Materials | |||
| LS columns | Miltenyi Biotec | 130-042-401 | Smaller and larger columns are also commercially available |
| MidiMACS Separator magnet | Miltenyi Biotec | 130-042-302 | |
| MACS MultiStand | Miltenyi Biotec | 130-042-303 | |
| Falcon 5mL round bottom polypropylene FACS tubes, with Snap Cap, Sterile | In Vitro technologies | 352063 | |
| Glass slides | Menzel-Glaser | J3800AMNZ | |
| Mounting media with DAPI | Vector Laboratories | H-1200 | Antifade mounting medium with DAPI |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Inverted microscope | Leica | DMIRB inverted microscope | |
| Fluorescent microscope | Zeiss | Vert.A1 | |
| Cell analyser | BD Biosciences | FACS Canto II | |
| Cytospin centrifuge | ThermoScientific | Cytospin 4 | |
| Name | Company | Catalog Number | Comments |
| Software | |||
| Cell analyser software | BD Biosciences | FACS Diva Software | |
| Single cell analysis software | Tree Star | FlowJo | |
| Fluorescent microscope software | Zeiss | Zen 2 blue edition |
Referenzen
- Nakeff, A., Maat, B. Separation of megakaryocytes from mouse bone marrow by velocity sedimentation. Blood. 43 (4), 591-595 (1974).
- Zeigler, F. C., et al. In vitro megakaryocytopoietic and thrombopoietic activity of c-mpl ligand (TPO) on purified murine hematopoietic stem cells. Blood. 84 (12), 4045-4052 (1994).
- Reems, J. -. A., Pineault, N., Sun, S. In Vitro Megakaryocyte Production and Platelet Biogenesis: State of the Art. Transfus. Med. Rev. 24 (1), 33-43 (2010).
- Choi, E., Nichol, J. L., Hokom, M. M., Hornkohl, A. C., Hunt, P. Platelets generated in vitro from proplatelet-displaying human megakaryocytes are functional. Blood. 85 (2), 402-413 (1995).
- Perdomo, J., et al. A monopartite sequence is essential for p45 NF-E2 nuclear translocation, transcriptional activity and platelet production. J Thromb Haemost. 8 (11), 2542-2553 (2010).
- Shim, M. H., Hoover, A., Blake, N., Drachman, J. G., Reems, J. A. Gene expression profile of primary human CD34+CD38lo cells differentiating along the megakaryocyte lineage. Exp Hematol. 32 (7), 638-648 (2004).
- Feng, Q., et al. Scalable generation of universal platelets from human induced pluripotent stem cells. Stem cell reports. 3 (5), 817-831 (2014).
- Bruno, S., et al. In vitro and in vivo megakaryocyte differentiation of fresh and ex-vivo expanded cord blood cells: rapid and transient megakaryocyte reconstitution. Haematologica. 88 (4), 379-387 (2003).
- Iraqi, M., Perdomo, J., Yan, F., Choi, P. Y. I., Chong, B. H. Immune thrombocytopenia: antiplatelet autoantibodies inhibit proplatelet formation by megakaryocytes and impair platelet production in vitro. Haematologica. 100 (5), 623-632 (2015).
- Lev, P. R., et al. Impaired proplatelet formation in immune thrombocytopenia: a novel mechanism contributing to decreased platelet count. Br. J. Haematol. 165 (6), 854-864 (2014).
- Gandhi, M. J., Drachman, J. G., Reems, J. A., Thorning, D., Lannutti, B. J. A novel strategy for generating platelet-like fragments from megakaryocytic cell lines and human progenitor cells. Blood Cells Mol. Dis. 35 (1), 70-73 (2005).
- Lu, S. -. J., et al. Platelets generated from human embryonic stem cells are functional in vitro and in the microcirculation of living mice. Cell Res. 21 (3), 530-545 (2011).
- Moreau, T., et al. Large-scale production of megakaryocytes from human pluripotent stem cells by chemically defined forward programming. Nature Commun. 7, 11208 (2016).
- De Bruyn, C., Delforge, A., Martiat, P., Bron, D. Ex vivo expansion of megakaryocyte progenitor cells: cord blood versus mobilized peripheral blood. Stem Cells Dev. 14 (4), 415-424 (2005).
- Nimgaonkar, M. T., et al. A unique population of CD34+ cells in cord blood. Stem cells. 13 (2), 158-166 (1995).
- Italiano, J. E., Patel-Hett, S., Hartwig, J. H. Mechanics of proplatelet elaboration. J Thromb Haemost. 5, 18-23 (2007).
- Matsunaga, T., et al. Ex vivo large-scale generation of human platelets from cord blood CD34+ cells. Stem cells. 24 (12), 2877-2887 (2006).
- Sullenbarger, B., Bahng, J. H., Gruner, R., Kotov, N., Lasky, L. C. Prolonged continuous in vitro human platelet production using three-dimensional scaffolds. Exp Hematol. 37 (1), 101-110 (2009).
- Proulx, C., Boyer, L., Hurnanen, D. R., Lemieux, R. Preferential ex vivo expansion of megakaryocytes from human cord blood CD34+-enriched cells in the presence of thrombopoietin and limiting amounts of stem cell factor and Flt-3 ligand. J. Hematother. Stem Cell Res. 12 (2), 179-188 (2003).
- Bornstein, R., Garcia-Vela, J., Gilsanz, F., Auray, C., Cales, C. Cord blood megakaryocytes do not complete maturation, as indicated by impaired establishment of endomitosis and low expression of G1/S cyclins upon thrombopoietin-induced differentiation. Br. J. Haematol. 114 (2), 458-465 (2001).
- Chong, B. H., Choi, P. Y. I., Khachigian, L., Perdomo, J. Drug-induced Immune Thrombocytopenia. Hematol Oncol Clin North Am. 27 (3), (2013).
- Stasi, R., et al. Idiopathic thrombocytopenic purpura: Current concepts in pathophysiology and management. Thromb Haemost. 99 (1), 4-13 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten