Method Article
Перенос способности формирования молочной железы между базальными эпителиальными клетками молочной железы и люминальными клетками молочной железы через внеклеточные везикулы / экзосомы
В этой статье
Резюме
В этом протоколе описаны способы очистки, количественного определения и характеризации внеклеточных везикул (EV) / экзосомы из неадгезивных / мезенхимальных эпителиальных клеток молочной железы и для их использования для передачи способности формирования молочной железы к эпителиальным клеткам просвета молочной железы. EVs / экзосомы, полученные из стволовых эпителиальных клеток молочной железы, могут передавать это свойство клеток клеткам, которые поглощают EV / экзосомы.
Аннотация
Клетки могут взаимодействовать через экзосомы, внеклеточные везикулы (ЭП) ~ 100 нм, содержащие белки, липиды и нуклеиновые кислоты. Внеклеточные везикулы из неадгезивных / мезенхимальных эпителиальных клеток молочной железы (NAMEC) могут быть выделены из среды NAMEC с помощью дифференциального ультрацентрифугирования. Основываясь на их плотности, EVs можно очистить ультрацентрифугированием при 110 000 x g. Препарат EV из ультрацентрифугирования может быть дополнительно отделен с использованием непрерывного градиента плотности для предотвращения загрязнения растворимыми белками. Затем очищенные EV могут быть дополнительно оценены с использованием анализа отслеживания наночастиц, который измеряет размер и количество везикул в препарате. Внеклеточные везикулы размером от 50 до 150 нм являются экзосомами. Выведенные NAMEC EVs / экзосомы могут проникать в эпителиальные клетки молочной железы, которые могут быть измерены с помощью проточной цитометрии и конфокальной микроскопии. Некоторые свойства стволовых клеток молочной железы ( например, способность к образованию молочной железы) могутПереносится из стеблеподобных NAMEC в клетки эпителия молочной железы через EVs / экзосомы, полученные из NAMEC. Отдельные первичные эпикатеральные эпителиальные клетки эритроцитарного эпителия EpCAM hi / CD49f не могут образовывать молочные железы после трансплантации в жировые подушки мыши, тогда как EpcAM lo / CD49f hi базальные эпителиальные клетки молочной железы образуют молочные железы после трансплантации. Приобретение EVM / экзосомы, полученных из NAMEC, EpcAM hi / CD49f lo, эпителиальные клетки просвета молочной железы позволяют им генерировать молочные железы после трансплантации в жировые подушки. EVs / экзосомы, полученные из стволовых эпителиальных клеток молочной железы, переносят способность образования молочной железы к EpCAM hi / CD49f ломовым эпителиальным клеткам молочной железы.
Введение
Экзосомы могут опосредовать клеточную связь путем переноса мембранных и цитозольных белков, липидов и РНК между клетками 1 . Было показано, что опосредованная экзосомами связь связана со многими физиологическими и патологическими процессами ( т. Е. С представлением антигена, развитием толерантности 2 и прогрессированием опухоли 3 ). Экзосомы часто имеют содержание, сходное с содержимым исходных клеток, высвобождающих их. Таким образом, экзосомы могут переносить определенные клеточные свойства из исходных клеток и переносить эти свойства на клетки, поглощающие их 4 .
Экзосомы представляют собой двухслойные мембранные везикулы от 50 до 150 нм и представляют собой специфические маркеры ( например, CD9, CD81, CD63, HSP70, Alix и TSG101). Таким образом, экзосомы должны характеризоваться различными методами для разных аспектов. Прозрачная электронная микроскопия может быть использована для визуализации мембранных везикулТаких как экзосомы 4 , 5 . Анализ Nanoparticle tracking (NTA) и динамический анализ рассеяния света (DLS) используются для измерения размера и количества очищенных экзосом 4 . Содержание липидной мембраны в экзосомах может быть проверено градиентом плотности. Экзосомальные маркеры, такие как CD9, CD81, CD63, HSP70, Alix и TSG101 6 , 7 , могут быть измерены с помощью Вестерн-блоттинга.
Базальные клетки молочной железы обладают способностью генерировать молочные железы при имплантации в жировые подушечки, тогда как просветные клетки не могут 8 , 9 , 10 . Таким образом, базальные клетки молочной железы также упоминаются как единицы репопуляции молочной железы. Используя модель базальных и просветных клеток молочной железы, можно исследовать способность EVs / экзосомы передавать характеристики клеток между различными популяциями клеток. Эта работаДемонстрирует способ передачи железистообразующей способности из базальных эпителиальных клеток молочной железы в просветные эпителиальные клетки молочной железы с использованием EVs / экзосом, полученных из базальных эпителиальных клеток молочной железы. Лицевые эпителиальные клетки молочной железы приобретали свойства базальных клеток после приема ЭВ / экзосомы, секретируемых из базальных клеток, и затем могут образовывать молочные железы 4 .
протокол
Все исследования, связанные с животными, соответствовали протоколам, утвержденным Институциональным комитетом по уходу за животными.
1. Внеклеточное везикул / экзосомальная изоляция и валидация
- Культуральные эпителиальные базальные клетки молочной железы, NAMECs 4 , со свежей, бессывороточной средой, состоящей из 500 мл MCDB 170, pH 7,4 + 500 мл DMEM / F12 с бикарбонатом натрия (0,2438%); EGF (5 нг / мл); Гидрокортизон (0,5 мкг / мл); Инсулин (5 мкг / мл); Экстракт крупного рогатого скота (BPE, 35 мкг / мл); И GW627368X (1 мкг / мл) в чашках по 15 см.
- После подсчета клеток с гемоцитометром высевают 1,2 × 10 6 клеток в 12 мл среды на 15-сантиметровую чашку в день 0 в течение 4 дней 4 .
- Через 4 дня в культуре центрифугируют культуральную среду при 300 × g в течение 5 мин, используя настольную центрифугу. Перенесите супернатант в коническую трубку ( рис. 1 ).
- Центрифугируют супернатантПри 2000 мкг в течение 20 мин в настольной центрифуге. Перенесите супернатант в ультрацентрифужную пробирку и оставите мертвые клетки и клеточный мусор ( рис. 1 ).
- Центрифугируют супернатант при 10000 мкг в течение 30 мин при 4 ° С. Перенесите супернатант в новую ультрацентрифужную пробирку ( рис. 1 ).
- Центрифугируют супернатант при 110 000 мкг в течение 60 мин при 4 ° С. Удалите супернатант и повторно суспендируйте гранулу EV / экзосомы в PBS ( рисунок 1 ).
- Центрифугируют супернатант при 110 000 мкг в течение 60 мин при 4 ° С. Удалите супернатант. Ресуспендируют гранулу EV / экзосомы в PBS ( рисунок 1 ). Ресуспендируют гранулу, выделенную из 240-480 мл среды, кондиционированной NAMEC, в 100 мкл.
- Измерьте концентрацию белка в суспензии EV с помощью анализа белка BCA. Убедитесь, что концентрация составляет около 20-40 мкг / 100 мкл. Хранить при -20 ° C длядальнейший анализ.
- Измерьте концентрацию и размер EVs / экзосомы с помощью анализа отслеживания наночастиц (NTA), как описано ранее Gardiner et al. 11 . Разбавьте EVs / экзосомы (20 мкг / 100 мкл) с PBS до 10000 раз для анализа NTA.
ПРИМЕЧАНИЕ. Результат анализа NTA отражает количество и размер анализируемых везикул. - Изобразите EVs / экзосомы с помощью электронной микроскопии (TEM), как описано ранее Lin et al . 4 .
2. Очистка экзосомы с использованием градиента плотности
- Ресуспендируют таблетку 110 000 г с этапа 1,7 в 40% (мас. / Об.) Йодиксаноле в PBS (2 мл). Оверлейьте смесь последовательно аликвотами 30%, 20%, 10% и 5% (мас. / Об.) Йодиксанола в PBS (по 2 мл каждый) с образованием градиента плотности в ультрацентрифужной пробирке.
- Центрифугируют смесь при 200000 × g в течение 8 ч при 4 ° С.
- Соберите каждую градиентную фракцию (10 фракцийдополнения; 1 мл / фракция) пипеткой с верхней части трубки.
- Проанализируйте присутствие маркеров экзосомы ( например, CD81, CD9, CD63 и Tsg101) в каждой фракции с помощью SDS-PAGE 12 и Вестерн-блоттинга. Загрузите 50 мкл суспензий каждой фракции на 10% гель, содержащий 0,1% (мас. / Об.) SDS, и выделите белки в фракциях с помощью гель-электрофореза.
- Перенесите белки из геля в PVDF-мембрану и инкубируйте мембрану с антителами против маркеров экзосомы ( например, CD81, CD9, CD63 и Tsg101) и белком GAPDH для домашнего хозяйства в течение ночи ( таблица материалов ) при 4 ° C.
ПРИМЕЧАНИЕ. Результат идентифицирует фракцию, содержащую экзосомы.
3. Внеклеточное везикул / маркировка экзосомы
- Приостанавливают EV / экзосомы, полученные на стадии 1.7, в 10 мкМ карбоксифлуоресцеинового сукцинимидилдиацетатного эфира (CFSE) при 20 мкг экзосомального белка / 100 мкл. Подготовьте параллельный образец coПоддерживая только CFSE и PBS, обрабатываемые таким же образом, как отрицательный контроль для последующих анализов поглощения EV / экзосом. Оставьте смеси при 37 ° C в течение 30 минут.
- Приостановить EVs / экзосомы в 50x объемах PBS и центрифугировать суспензию при 110 000 xg в течение 60 минут при 4 ° C. Удалите супернатант и повторно суспендируйте гранулу EV / экзосомы в PBS. Повторите шаг 3.2 один раз.
- Приостановить EVs / экзосомы в PBS в концентрации 20 мкг экзосомального белка / 100 мкл, а затем фильтровать EVs / экзосомы через мембраны 0,22 мкм, прежде чем добавлять EVs / экзосомы в клетки.
4. Анализ внеклеточного пузырька / экзосом.
- Для приготовления культуральной среды смешать 500 мл MCDB 170, pH 7,4 + 500 мл DMEM / F12 с бикарбонатом натрия (0,2438%); EGF (5 нг / мл); Гидрокортизон (0,5 мкг / мл); Инсулин (5 мкг / мл); И BPE (35 мкг / мл) 4 . Пластируйте эпителиальные клетки HMLE молочной железы человека в 6-луночных чашках (1 x 10 6 </ Sup> cell / well) за один день до лечения EV / exosome. Добавить 2 мкг / мл CFSE флуоресценции меченых EVs / экзосом, полученных на стадии 3.3, в культуральную среду клеток HMLE в течение 2-6 часов. Обработать клетки HMLE отрицательной контрольной группы с помощью параллельного препарата, описанного на этапе 3.1.
- После инкубации от 2 до 6 часов промывайте клетки дважды 4 мл PBS при комнатной температуре.
- Отсоедините клетки с 0,25% трипсином в течение 10 мин и повторно суспендируйте клетки в PBS, содержащие 0,2% FBS. Измерьте поглощение EV / exosome от интенсивности флуоресценции в клетках с помощью анализатора флуоресцентных клеток 4 . Изобразите клетки, обработанные EVs / экзосомами, или отрицательный контроль, используя конфокальную микроскопию.
ПРИМЕЧАНИЕ. Зеленая флуоресценция в клетках вызвана поглощением EV / exosome. См. Легенду на рисунке 6 для настроек микроскопа.
5. Выделение первичных мышечных эпителиальных клеток молочной железы
- Приготовьте таблетки, покрытые желатином, добавив 12 мл 0,1% раствора желатина в 10 см. Поместите пластины в инкубатор с температурой 37 ° C в течение 30 мин. Удалите раствор желатина и оставьте крышки с посуды в ламинарном вытяжном шкафу в течение 4 часов, пока не высохнет желатиновая оболочка.
- Вырезать 2, 3, 4 и 5 молочных желез ( рис. 2 ) из 12-недельных девственных самцов C57BL / 6 с использованием ножниц и разрезать железы на мелкие кусочки (2 мм 2 ) с помощью бритвы.
- Далее диссоциация суспензии молочных желез (от 10 мышей) в течение 60 мин при 37 ° С, перемешивание 120 об / мин с 50 мл DMEM / F12, содержащего 0,2% коллагеназы типа IV, 0,2% трипсина, 5% FBS, 5 мкг / мл гентамицина , И 1x pen-strep.
- Гранулируйте эпителиальные органоиды из смеси центрифугированием при 350 × g в течение 10 мин.
- Приостановить эпителиальные органоиды в 4 мл DMEM / F12 0,1 мг / мл ДНКазы I в течение 5 мин при комнатной температуре. Добавить 6 мл DMEM / F12 в конечныйОбъем 10 мл.
- Центрифугируют суспензию при 400 мкг в течение 10 мин при комнатной температуре и отбрасывают супернатант.
- Ресуспендируют таблетку в 10 мл DMEM / F12. Центрифугируйте подвеску, но нажмите на тормоз, когда скорость достигает 400 x g. Отбросьте супернатант.
ПРИМЕЧАНИЕ. При попадании на тормоз эпителиальные органоиды быстро оседают, а фибробласты, как отдельные клетки, все еще остаются в супернатанте. - Повторите шаг 5.6 и 5.7 5-7 раз. Добавьте каплю суспензии в гемоцитометр, а затем проверьте зазор фибробластов из органоидной смеси под микроскопом после каждого раунда центрифугирования ( рисунок 3 ).
- Пластину органоидов в покрытой желатином чашке, полученной на этапе 5.1, в течение 48 часов с DMEM / F12, содержащей 1x ITS, 5% FBS, 50 мкг / мл гентамицина, 10 нг / мл EGF и 1x перо-стрептококка.
- Через 48 часов удалите плавающие клетки в культуре, заменив среду свежей культуральной средой без FBS (DMEM / F12, содержащий 1x ITS, 50 мкг / мл гентамицина, 10 нг / мл EGF и 1x pen-strep).
- Убедитесь, что монослой клеток эпителия молочной железы мигрирует и вырастает из прикрепленных эпителиальных органоидов через 3 дня.
6. Отделение первичных мышей базальных / люминальных эпителиальных клеток молочной железы
- После 3-дневной культуры отделяйте первичные клетки молочной железы мыши с природной ферментной смесью с протеолитической и коллагенолитической ферментативной активностью в течение 20 мин. Нейтрализуйте активность фермента с 5% FBS в PBS.
- Центрифугируют суспензию при 450 × g в течение 10 мин при комнатной температуре и отбрасывают супернатант. Ресуспендируют осадок клеток в дозе 5 мг / мл в течение 20 мин. Нейтрализуйте активность фермента с 5% FBS в PBS.
- Центрифугируют суспензию при 450 × g в течение 10 мин при комнатной температуре и отбрасывают супернатант.
- Повторно суспендировали клетки в 100 мкл PBS с 0,2% FBS в концентрации 10 7 клеток / мл с разбавленнымАнти-CD49f и анти-EpCAM антитела на льду в течение 1 часа в темноте.
- Промывают клетки с PBS и затем инкубируют клетки с конъюгированным с флуорофором вторичным антителом на льду в течение 30 мин в темноте.
- Мойте и повторно суспендируйте клетки в PBS с 0,2% FBS.
- Сортируйте эпителиальные клетки млекопитающих EpCAM hi / CD49f lo на сортировщике клеток 4 .
7. Внеклеточное везикул / экзосомальное лечение
- Выселили отсортированные эпителиальные клетки эпикальтера эпителия EpCAM hi / CD49f lo на стадии 6,7 на 6-луночных планшетах с желатиновым покрытием (2 × 10 5 клеток / лунку), а затем обработали их PBS или 2 мкг / мл NAMEC-полученных EVs / экзосомами Полученного на этапе 1.7.
- Чтобы обеспечить биологическую эффективность EVs / экзосом в долгосрочной культуральной обработке, замените среду для культивирования клеток свежей средой, содержащей PBS или 2 мкг / мл EVM / экзосомы, полученные NAMEC каждые два дня. Не разделяйте мышь primaВо время 10-дневного лечения.
8. Инъекция жировых клеток в эпителиальных клетках молочной железы
- Анестезируйте 3-недельную самку C57BL / 6 мышей с изофлуораном, 2-3% -ным ингалятором.
- Поместите анестезированную мышь на спину. Удалите мех на середине живота с помощью бритвы / крема для волос и очистите участок операции тремя чередующимися циклами 70% спирта и повидон-йода.
- Сделайте вертикальный разрез 1,5 см через кожу вдоль брюшной грудно-паховой области с помощью ножниц, а затем поочередно выставляйте правые и левые 4 -я молочные жировые подушки.
- Очистите каждую жировую прокладку, удалив паренхиму железы с помощью ножниц. Найдите лимфатический узел в жировой подушечке, а затем удалите паренхиму всей железы ниже лимфатического узла.
ПРИМЕЧАНИЕ. Две трети жировой прокладки должны оставаться на месте. - Отсоедините клетки, полученные на стадии 7.2, с помощью природной смеси ферментов (см. Таблицу материалов ) с протеолитическим аЙ активности коллагенолитического фермента в течение 10 мин. Нейтрализуйте активность фермента с 5% FBS в PBS.
- Центрифугируют суспензию при 450 × g в течение 10 мин при комнатной температуре и отбрасывают супернатант. Подсчитайте клетки гемоцитометром и суспендируйте клетки в PBS с такой концентрацией, чтобы 15 мкл содержал желаемую дозу клетки (10 4 -10 2 клетки / пэд).
- Вложить 15 мкл суспензии клеток эпителия молочной железы в жировую подушку, используя 100 мкл стеклянного шприца, прикрепленного к иглам 27G.
- Повторите шаги 8.4-8.7 для жировой прокладки с другой стороны.
- Закройте кожу раневыми зажимами.
9. Целая гора молочной железы
- Эвтаназия мыши с СО 2 плюс дислокация шейки матки через 8 недель после инъекции клеток (этап 8.7).
- Сделайте вертикальный разрез через слой кожи от грудной области до паховой области с помощью ножниц, а затем выведите как правый, так и левый 4 -й мАммиачные жировые подушки. Удалите 4 грудные железы ( рис. 2 ).
- Распределите жировые подушечки на стеклянных подлокотках микроскопа и закрепите жировые накладки фиксатором Kahle (4% формальдегида, 30% EtOH и 2% ледяной уксусной кислоты) при комнатной температуре в течение ночи.
Осторожно: фиксатор Kahle является раздражителем. Выполните этот шаг в химическом колпаке. - Промыть жировые прокладки в 250 мл 70% EtOH в течение 15 мин, а затем в 250 мл dH 2 O в течение 5 мин. Вытрите жирные прокладки из карминового квасца (1 г кармина и 2,5 г сульфата алюминия в 500 мл dH 2 O) при комнатной температуре в течение ночи.
- Промойте жировые прокладки 250 мл 70% EtOH в течение 15 мин, 250 мл 95% EtOH в течение 15 мин и 250 мл 100% EtOH в течение 15 мин.
- Очищайте жировые прокладки в ксилоле в течение нескольких дней и прекратите инкубацию ксилола, когда жировые прокладки станут прозрачными.
Осторожно: Ксилол является раздражающим. Выполните этот шаг в химическом колпаке. - Смонтируйте слайды wiГо монтажа и снимать изображения (2,400 dpi) жировых прокладок с помощью цифрового слайдового сканера.
Результаты
Поскольку было показано, что блокирование передачи сигналов PGE 2 / EP 4 инициирует высвобождение EV / экзосомы из базальноподобных стволовых клеток 4 молочной железы, эта работа представляет собой метод выделения индуцированных EVs / экзосом из культуры базальных клеток (NAMEC) молочной эпителии. Поскольку NAMEC культивируют в бессывороточной среде, ранее не существовало EVs / экзосомы, полученных из сыворотки 13 . Для клеток, культивируемых в среде, содержащей сыворотку, ранее существовавшие экзосомы в среде должны быть предварительно очищены ультрацентрифугированием при 110 000 мкг до того, как среда будет использована для культивирования исходных клеток для сбора EV / экзосом 5 . EVs / экзосомы из 4-дневной индуцированной NAMEC среды могут быть выделены из осадка 110 000 xg дифференциальным ультрацентрифугированием, как показано на рисунке 1 . Число и размер изолированных везикул в 110 000 xg pellEt может быть измерена с помощью анализа отслеживания наночастиц (NTA). Фракция осадка 110 000 г, выделенная дифференциальным ультрацентрифугированием, в основном содержит ~ 100 нм везикулы ( фиг. 4А ); Это соответствует размеру экзосом (50-150 нм), о котором сообщается в литературе. Кроме того, анализ ТЕА показал, что 110 000 г фракций среды, кондиционированной NAMEC, содержат обильные мембранные везикулы ( рисунок 4B ). Хотя дифференциальное ультрацентрифугирование может генерировать достаточно чистые экзосомы, следующая стадия очистки с использованием градиента плотности дополнительно устраняет загрязняющие вещества ( например, белковые агрегаты) 5 . В градиенте плотности экзосомы плавают в градиенте из-за содержания липидов в везикуле, в то время как белковые агрегаты, если они есть, остаются в нижней части градиента. Каждая фракция градиента собирается для обнаружения производителей экзосомы ( например, CD81, CD63, CD9 и TSG101 6 , 7 ) путем вестерн-блоттинга. Маркеры экзосомы могут быть обнаружены во фракции с ~ 20% иодиксанола ( рис. 5 ). Фракцию, содержащую экзосомы, можно разбавить PBS и подвергнуть ультрацентрифугированию 200 000 × g для выделения экзосом. Выделенный осадок экзосомы промывают один раз в PBS и затем повторно суспендируют в PBS и хранят при -20 ° C для дальнейшего анализа.
Перед измерением поглощения EVs / экзосом, полученных NAMEC, с помощью нестебельного аналога клеток эпителия молочной железы - клеток HMLE - EVs / экзосомы должны быть помечены флуоресцентным красителем ( например, карбоксифлуоресцеинсукцинимидиловый эфир (CFSE)). Параллельный образец, содержащий только CFSE, но не EV / exosome, обрабатывается в той же процедуре маркировки. Этот образец является отрицательным контролем, используемым в следующем анализе поглощения EV / экзосомы, чтобы отразить эффект следового количества остаточного свободного CFSE краситель. Клетки HMLE культивируют с CFSE-мечеными, полученными из NAMEC EVs / экзосомами или отрицательным контролем в течение 2-6 ч и затем подвергают проточной цитометрии. По сравнению с необработанными клетками HMLE клетки HMLE, культивируемые с отрицательным контролем, выражают несколько более высокий уровень сигнала CFSE ( рисунок 6A , красная линия по сравнению с оранжевой линией), что отражает фоновый уровень сигнализации CFSE, вызванный остаточным свободным CFSE, оставленным от EV / экзосомы. Кроме того, по сравнению с клетками HMLE, обработанными отрицательным контролем, клетки HMLE, культивированные мечеными CFSE, экзосомами, полученными из NAMEC, экспрессируют 10-кратный более высокий сигнал CFSE ( фиг. 6A , синяя линия по сравнению с красной линией), что является следствием специфического поглощения CFSE-меченых EVs / экзосомы. Поглощение CFSE-меченых, полученных NAMEC EVs / экзосомами клетками HMLE также можно наблюдать с помощью конфокальной микроскопии. В то время как отрицательные контрольные клетки HMLE не имеют CFSE-сигнала, поглощение NAПолученные из MEC EVs / экзосомы клетками HMLE можно наблюдать с помощью CFSE-сигнала под конфокальным микроскопом в клетках, обработанных CFSE-меченными клетками EV / exosome ( рисунок 6B ).
Для оценки того, могут ли полученные EVE / экзосомы, полученные из NAMEC, переносить способность к образованию молочной железы из стволовых клеток базальных клеток молочной железы в просветные клетки молочной железы, мышиные мышиные просветные клетки сначала выделяют, чтобы можно было провести анализ образования молочной железы у мышей. Эпителиальные клетки мышей молочной железы изолированы от 12-недельных мышей. Молочные железы разрезают на мелкие кусочки и далее диссоциируют с коллагеназой и трипсином. Диссоциированные эпителиальные органоиды и фибробласты могут быть разделены дифференциальным центрифугированием, как описано в шагах 5.7 и 5.8. В каждом раунде центрифугирования осадок на дне пробирки должен содержать главным образом эпителиальные органоиды, а фибробласты и отдельные клетки должны плавать в супернатантет. По сравнению с смесью, содержащей как эпителиальные органоиды, так и фибробласты перед дифференциальным центрифугированием ( рис. 3 , верхние панели), шесть раундов центрифугирования очищают большинство фибробластов и отдельных клеток в смеси ( рис. 3 , нижняя панель).
Эпителиальные клетки молочной железы ( фиг. 7 ) эпителиальных органоидов далее диссоциируют с использованием природной ферментной смеси с протеолитической и коллагенолитической ферментативной активностью и осуществляют выделение отдельных клеток в суспензии. Сортировка одноклеточной суспензии с помощью экспрессии клеточной поверхности CD49f и EpCAM может разделять люминальные клетки молочной железы (EpCAM hi / CD49f lo ), базальные клетки молочной железы (EpCAM lo / CD49f hi ) и неэпителиальные клетки (EpCAM - ) ( рисунок 8 ).
Выделенные эпителиальные клетки эритроцитарной эпикардии EpCAM hi / CD49f lo культивируют с помощью EV / exosomes, полученных из NAMEC, в течение 10 дней, а свежие EV / экзосомы и среду заменяются каждые два дня. После обработки EV / exosome, просвечивающие клетки молочной железы имплантируют в 4 -й слой молочных жиров ( рис. 2 ) мышей. Через 8 недель жировые подушки выделяют и окрашивают для анализа образования молочной железы ( рис. 9 ). Обработка индуцированными NAMEC-полученными EVs / экзосомами позволяет люминесцентным клеткам приобретать способность к образованию молочной железы 4 . Обработанные NAMEC, обработанные EV / exosome клетки молочной железы молочной железы образуют молочные железы в жировых подушечках мыши ( рис. 9 ).

Рисунок 1: Иллюстрация экстрацеллюлыR Везикул / экзосомальный метод пуритизации из среды клеточной культуры путем дифференциального ультрацентрифугирования. Указаны скорость и длина каждого центрифугирования. После каждого из первых трех центрифугирования супернатант выдерживают для следующей стадии. После центрифугирования 110 000 × g гранулы сохраняют и супернатанты отбрасывают. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
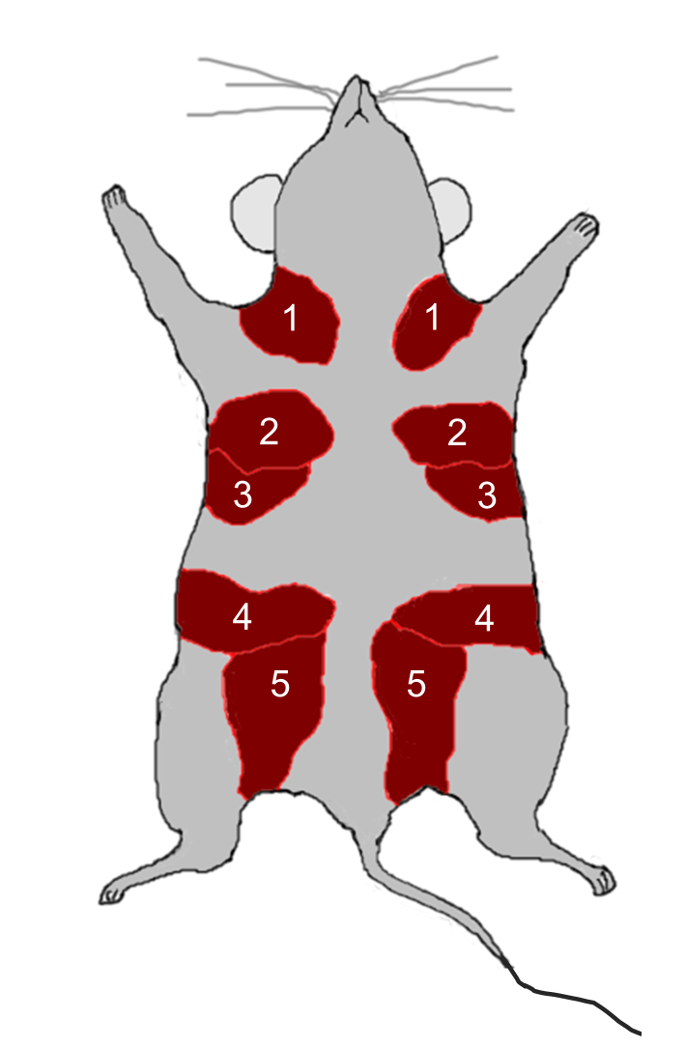
Рисунок 2: Анатомия мышей молочной железы. У мышей есть пять пар молочных желез, обозначенные цифрами 1-5, расположенные в жировых подушечках (красных) непосредственно под кожей. Нажмите здесь, чтобы просмотреть увеличенную версиюЭто цифра.

Рисунок 3: Изображения смеси эпителиальных органоидов и клеток жировых подушек до и после дифференциального центрифугирования. Яркие снимки изолированных жировых смесей клеток до и после дифференциального центрифугирования, взятые из гемоцитометра. Arrowhead: эпителиальные органоиды. Стрелка: фибробласты и отдельные клетки. Шкала шкалы = 0,5 мм. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
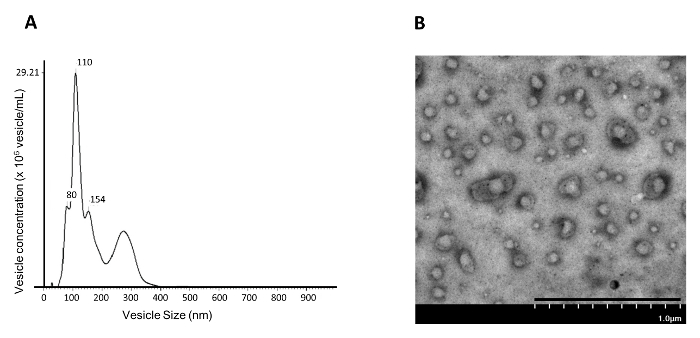
Рисунок 4: Величина размера и концентрационный анализ NAMEC110,000 xg Доля гранул. Доля осадка 110 000 г среды NAMEC составляет (N) и ( B ) трансмиссионную электронную микроскопию (TEM). Шкала шкалы = 1 мкм. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Обнаружение экзосом в фракциях градиента плотности. Вестерн-блот-анализ маркеров экзосомы CD81, CD9, CD63 и Tsg101 и ген домашнего хозяйства GAPDH показывает 20% иодиксанольную фракцию, содержащую экзосомы. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
55736fig6.jpg "/>
Рисунок 6: Обнаружение внеклеточного пузырька / поглощение экзосом методом проточной цитометрии и конфокальной микроскопии. Поглощение EV / exosome измерялось в клетках HMLE. CFSE-меченые, NAMEC-полученные EVs / экзосомы и отрицательный контроль добавляют к указанным культурам в течение 6 часов. После инкубации клетки подвергают ( A ) проточной цитометрии и ( B ) конфокальной микроскопии. CFSE (зеленый, возбуждение / излучение (нм): 492/517, лазерная линия микроскопа: 488). Интенсивность флуоресценции отражает поглощение EV / exosome. Ядра клеток окрашиваются DAPI (синий, возбуждение / излучение (нм): 358/461, лазерная линия микроскопа: 405), а плазменные мембраны окрашиваются пятно плазматической мембраны (красный, возбуждение / излучение (нм): 649/666; Лазерная линия микроскопа: 633, см. Таблицу материалов ). Конфокальная линза объектива: HCX PL APO 63x / 1.40-0.60 Масло. Шкала шкалы = 20 мкм.Ad / 55736 / 55736fig6large.jpg "target =" _ blank "> Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
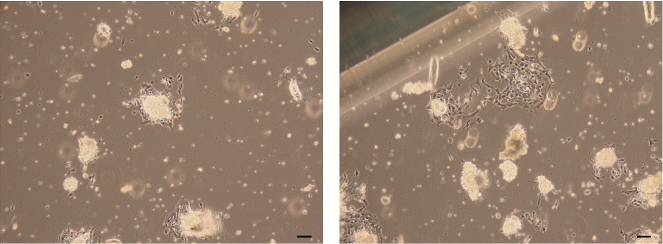
Рисунок 7: Изображения прикрепленных эпителиальных органоидов. Яркие снимки эпителиальных клеток молочной железы, образованные клетками, мигрирующими и растущими из прикрепленных эпителиальных органоидов. Шкала шкалы = 100 мкм. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 8: Сортировка первичных мышечных эпителиальных клеток мыши по поверхности EpCAM и CD49f. Эпителиальные клетки мышиной молочной железы, выделенные из жировых подушек 12-недельных мышей, подвергаются клеточной сортировкеING. Прозрачные клетки мышиной молочной железы обогащены популяцией EpCAM hi / CD49f lo, отмеченной синим кружком; Базальные клетки были обогащены популяцией EpCAM lo / CD49f hi, отмеченной красным кружком. Неэпителиальные клетки отмечены черным ящиком на участке. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 9: Формирование молочной железы первичными мышечными молочными клетками. Первичные мышиные клетки EpCAM hi / CD49f lo просвечивают PBS или полученными NAMEC EVs / экзосомами в культуре клеток в течение 10 дней и имплантируют в очищенные жировые подушки 3-недельных мышей. Мышей подвергают эвтаназии и вскрывают через 8 недель для анализа формы молочной железыция. Шкала шкалы = 0,75 см. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| процент | MFI EpCAM | MFI CD49f | |
| Светящаяся клетка молочной железы | 0,437 | 4,57 × 10 4 | 8183 |
| (EpCAM hi / CD49f lo ) | |||
| Базальная клетка молочной железы | 0,09 | 5452 | 2,23 × 10 4 |
| (EpCAM lo / CD49f hi ) | |||
| Non-эпителиальнойЯчейка (EpCAM - ) | 0,309 | 53 | 4619 |
Таблица 1: Процентная и средняя интенсивность флуоресценции (MFI) популяций, описанных на рисунке 8.
Обсуждение
Экзосомы часто несут характеристики клеток, которые их высвобождают, а количество высвобожденных экзосом может индуцироваться стимулами 4 . Культуральную среду клеток можно собирать и подвергать дифференциальному ультрацентрифугированию для сбора EV / экзосомы ( рисунок 1 ). В настоящее время нет общего соглашения об идеальном методе выделения EVs / экзосом. Оптимальный способ, используемый здесь, был определен приложением 14 ниже по потоку. Ультрацентрифугирование является относительно быстрым методом выделения EVs / экзосом, который может сохранить биологическую активность EVs / экзосом. Однако везикулы, выделенные ультрацентрифугированием, обычно содержат смесь EVs, которые содержат экзосомы, продуцируемые эндосомальными отделениями и / или везикулами, продуцируемыми посредством почкования из клеточной мембраны.
Анализируя размеры везикул с помощью NTA ( рисунок 4A ), везикулы, обнаруженные для очистки при 110 000 xg во время дифференциального ультрацентрифугирования, были в основном 50-150 нм, что соответствует размеру экзосомы. Данные NTA показывают, что экзосомы, полученные из NAMEC, могут быть выделены из культуральной среды при 110 000 × g при дифференциальном ультрацентрифугировании. Однако введенные здесь NTA и TEM допускают только визуализацию везикул или измерение размера и количества всей совокупности EV. Эти методы не могут измерять гетерогенность популяций EV или даже сортировать гетерогенные популяции EV. Ученые начали разрабатывать методы использования проточных цитометров для анализа и сортировки популяций EV 15 .
Хотя дифференциальное ультрацентрифугирование можно использовать для очистки экзосом, необходимо использовать градиент плотности для дальнейшего удаления загрязнений белковых агрегатов из экзосомных везикул в 110 000 xg выделенной фракции 5 . Экзосомы содержат липидные мембраны. Липид в экзосомных мембранах заставляет экзосомы плавать в градиенте плотности, в то время как белковые агрегаты падают на дно градиента плотности. Экзосомы экспрессируют специфические маркеры ( например, CD81, CD63, CD9 и TSG101 6 , 7 ). Анализируя присутствие маркеров экзосомы во фракциях градиента плотности, можно идентифицировать экзосомы во фракции с ~ 20% йодиксанола ( рис. 5 ). Следует определить множественные маркеры экзосомы, чтобы идентифицировать экзосомы в градиенте плотности, поскольку каждая популяция экзосом может выражать различные маркеры экзосомы 16 .
Поглощение EVs / экзосомами клетками можно измерить с использованием флуоресцентных меченых красителями EVs / экзосомами. Количество клеток, поглощающих меченые EVs / экзосомы, можно измерить с помощью проточной цитометрии ( рисунок 6A ). Чтобы подтвердить, что флюоИз-за поглощения меченых EVs / экзосом, но не от свободного красителя, картина флуоресценции была исследована в клетках с использованием микроскопии. Конфокальная микроскопия показывает, что картина флуоресценции в клетках, обработанных EV / exosome, является точечной ( рис. 6B справа). Точечные сигналы, вероятно, являются результатом меченых EVs / экзосом, а не от свободной флуоресценции. Точечные сигналы в клетках могут быть дополнительно проанализированы с помощью микроскопии с суперразрешением с структурированной освещенностью, которая имеет самое высокое разрешение при 85 нм 4 , 17 . Микроскопия с высоким разрешением может подтвердить, что точечные сигналы имеют полые пузырьки ~ 100 нм, которые напоминают экзосомы 4 . Эти результаты свидетельствуют о том, что экзомомы, полученные из NAMEC, могут проникать в эпителиальные клетки молочной железы в культуре.
Выведенные NAMEC EVs / экзосомы часто несут молекулы ( например, белки и miРНК), необходимых для характеристик определенных клеток 1 . Это говорит о том, что EVs / экзосомы, полученные из NAMEC, могут передавать свойства NAMEC ( например, способность формирования молочной железы) к их аналогам эпителиальных клеток. Поскольку эпителиальные клетки молочной железы человека не могут образовывать молочные железы ксеногенно в жировых подушечках мыши 18 , 19 , перенос способности формирования железы можно исследовать с использованием мышиных первичных эпителиальных клеток молочной железы. Мышцы первичной молочной железы EpCAM hi / CD49f lo люминальные клетки, которые не образуют молочные железы, могут быть выделены у 6-недельных мышей ( рис. 7 и рис. 8 ). Выделенные клетки из мышечных жировых подушечек можно разделить на три группы ( например, EpCAM hi / CD49f lo luminal cells, EpCAM lo / CD49f hi базальные клетки и EpCAM - неэпителиальные клетки) путем изученияВельоны поверхности EpCAM и CD49f ( рисунок 8 ). EpcAM lo / CD49f hi базальные клетки могут образовывать молочные железы в жирных причудах при трансплантации в жировые подушечки, но EpcAM hi / CD49f lo люминальные клетки не могут 4 . Таким образом, популяция клеток EpCAM hi / CD49f lo может использоваться для изучения способности индуцированных NAMEC-зависимых EV / экзосом для передачи способности к формированию молочной железы. Выделенные клетки ЕРКАМ hi / CD49f lo могут быть сохранены в культуре в течение 7-10 дней для лечения EV / экзосом. Следует отметить, что сохранение первичных эпителиальных клеток молочной железы in vitro дольше может ослаблять жизнеспособность клеток.
Обработанные EV / экзосомные люминесцентные клетки молочной железы могут быть имплантированы в очищенные жировые подушечки для анализа способности к образованию молочной железы. Жировые подушки мышей, используемых для имплантации, должны быть очищены в возрасте 3 недель.Т 3-недельного возраста, эпителиальные клетки молочной железы ограничиваются областью между соском и лимфой жировой прокладки. Эпителий молочной железы в жировой подушке можно очистить, удалив область между соском и лимфой в возрасте 3 недель. Ляминальные клетки молочной железы имплантируются сразу после очистки жировой прокладки, а образование железы с помощью имплантированных клеток можно анализировать через 8 недель после имплантации. Эффект EVs / экзосомы, полученных из NAMEC, на перенос способности формирования молочной железы к просветным клеткам молочной железы может быть оценен образованием железистых просветных клеток и просвечиваемыми EV / экзосомой люминовыми клетками ( рис. 9 ). Индуцированные EVs / экзосомы из NAMEC несут свойство базальных эпителиальных клеток молочной железы - способность к образованию железы, и люминесцентные клетки, которые поглощают индуцированные EV / экзосомы из NAMEC, могут получить свойство от NAMEC через EVs / экзосомы. Эта работа демонстрирует доказательства того, что молекулы, ответственные за EV / экзосомовые средыTid перенос способности формирования молочной железы присутствуют в липидных плотах EVs / экзосомы 4 .
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана грантами Национальных научно-исследовательских институтов здравоохранения (05A1-CSPP16-014, HJL) и Министерства науки и технологий (MOST 103-2320-B-400-015-MY3, HJL).
Материалы
| Name | Company | Catalog Number | Comments |
| MCDB 170 | USBiological | M2162 | |
| DMEM/F12 | Thermo | 1250062 | |
| Optima L-100K ultracentrifuge | Beckman | 393253 | |
| SW28 Ti Rotor | Beckman | 342204 | |
| SW41 Rotor | Beckman | 331306 | |
| NANOSIGHT LM10 | Malvern | NANOSIGHT LM10 | for nanoparticle tracking analysis (NTA) |
| Optiprep | Sigma-Aldrich | D1556 | 60% (w/v) solution of iodixanol in water (sterile). |
| CD81 antibody | GeneTex | GTX101766 | 1:1,000 in 5% w/v nonfat dry milk, 1x TBS, 0.1% Tween 20 at 4 °C, overnight |
| CD9 antibody | GeneTex | GTX100912 | 1:1,000 in 5% w/v nonfat dry milk, 1x TBS, 0.1% Tween 20 at 4 °C, overnight |
| CD63 antibody | Abcam | Ab59479 | 1:1,000 in 5% w/v nonfat dry milk, 1x TBS, 0.1% Tween 20 at 4 °C, overnight |
| TSG101 antibody | GeneTex | GTX118736 | 1:1,000 in 5% w/v nonfat dry milk, 1x TBS, 0.1% Tween 20 at 4 °C, overnight |
| GAPDH | GeneTex | GTX100118 | 1:6,000 in 5% w/v nonfat dry milk, 1x TBS, 0.1% Tween 20 at 4 °C, overnight |
| CFSE (carboxyfluorescein succinimidyl diacetate ester) | Thermo | V12883 | |
| FACSCalibur | BD Biosciences | fluorescence cell analyzer | |
| collagenase Type IV | Thermo | 17104019 | |
| trypsin | Thermo | 27250018 | |
| ITS | Sigma-Aldrich | I3146 | a mixture of recombinant human insulin, human transferrin, and sodium selenite |
| accutase | ebioscience | 00-4555-56 | a natural enzyme mixture with proteolytic and collagenolytic enzyme activity |
| dispase | STEMCELL | 7913 | 5 mg/mL = 5 U/mL |
| anti-CD49f antibody | Biolegend | 313611 | 1:50 |
| anti-EpCAM antibody | Biolegend | 118213 | 1:200 |
| FACSAria | BD Biosciences | cell sorter | |
| carmine alum | Sigma-Aldrich | C1022 | |
| human mammary epithelial cells (HMLE cells, NAMECs) | gifts from Dr. Robert Weinberg | ||
| permount | Thermo Fisher Scientific | SP15-500 | |
| sodium bicarbonate | Zymeset | BSB101 | |
| EGF | Peprotech | AF-100-015 | |
| Hydrocoritisone | Sigma-Aldrich | SI-H0888 | |
| Insulin | Sigma-Aldrich | SI-I9278 | |
| BPE (bovine pituitary extract) | Hammod Cell Tech | 1078-NZ | |
| GW627368X | Cayman | 10009162 | |
| 15 cm culture dish | Falcon | 353025 | |
| table-top centrifuge | Eppendrof | Centrifuge 3415R | |
| ultracentrifuge tube | Beckman | 344058 | |
| PBS (Phosphate-buffered saline) | Corning | 46-013-CM | |
| BCA Protein Assay | Thermo Fisher Scientific | 23228 | |
| Transmission Electron Microscopy | Hitachi | HT7700 | |
| gelatin | STEMCELL | 7903 | |
| 10 cm culture dish | Falcon | 353003 | |
| 6-well culture dish | Corning | 3516 | |
| female C57BL/6 mice | NLAC (National Laboratory Animal Center | ||
| FBS (Fetal Bovine Serum) | BioWest | S01520 | |
| gentamycin | Thermo Fisher Scientific | 15710072 | |
| Pen/Strep | Corning | 30-002-Cl | |
| DNase I | 5PRIMER | 2500120 | |
| isofluorane | Halocarbon | NPC12164-002-25 | |
| formaldehyde | MACRON | H121-08 | |
| EtOH (Ethanol) | J.T. Baker | 800605 | |
| glacial acetic acid | Panreac | 131008.1611 | |
| aluminum potassium sulfate | Sigma-Aldrich | 12625 | |
| Xylene | Leica | 3803665 | |
| 0.22 μm membranes | Merck Millipore | Millex-GP | |
| AUTOCLIP Wound Clips, 9 mm | BD Biosciences | 427631 | |
| AUTOCLIP Wound Clip Applier | BD Biosciences | 427630 | |
| CellMask™ Deep Red | Thermo Fisher Scientific | C10046 | plasma membrane stain |
Ссылки
- Simons, M., Raposo, G. Exosomes--vesicular carriers for intercellular communication. Curr Opin Cell Biol. 21 (4), 575-581 (2009).
- Théry, C., Ostrowski, M., Segura, E. Membrane vesicles as conveyors of immune responses. Nat Rev Immunol. 9 (8), 581-593 (2009).
- Boelens, M., et al. Exosome Transfer from Stromal to Breast Cancer Cells Regulates Therapy Resistance Pathways. Cell. 159 (3), 499-507 (2014).
- Lin, M. C., et al. PGE2 /EP4 Signaling Controls the Transfer of the Mammary Stem Cell State by Lipid Rafts in Extracellular Vesicles. Stem Cells. , (2016).
- Théry, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Curr Protoc Cell Biol. , (2006).
- György, B., et al. Membrane vesicles, current state-of-the-art: emerging role of extracellular vesicles. Cell Mol Life Sci. 68 (16), 2667-2688 (2011).
- Olver, C., Vidal, M. Proteomic analysis of secreted exosomes. Subcell Biochem. 43, 99-131 (2007).
- Shackleton, M., et al. Generation of a functional mammary gland from a single stem cell. Nature. 439 (7072), 84-88 (2006).
- Prater, M. D., et al. Mammary stem cells have myoepithelial cell properties. Nat Cell Biol. 16 (10), 942-950 (2014).
- Stingl, J., et al. Purification and unique properties of mammary epithelial stem cells. Nature. 439 (7079), 993-997 (2006).
- Gardiner, C., Ferreira, Y. J., Dragovic, R. A., Redman, C. W., Sargent, I. L. Extracellular vesicle sizing and enumeration by nanoparticle tracking analysis. J Extracell Vesicles. 2, (2013).
- Shapiro, A. L., Viñuela, E., Maizel, J. V. Molecular weight estimation of polypeptide chains by electrophoresis in SDS-polyacrylamide gels. Biochem Biophys Res Commun. 28 (5), 815-820 (1967).
- Riches, A., Campbell, E., Borger, E., Powis, S. Regulation of exosome release from mammary epithelial and breast cancer cells - a new regulatory pathway. Eur J Cancer. 50 (5), 1025-1034 (2014).
- Witwer, K. W., et al. Standardization of sample collection, isolation and analysis methods in extracellular vesicle research. J Extracell Vesicles. 2, (2013).
- van der Vlist, E. J., Nolte-'t Hoen, E. N., Stoorvogel, W., Arkesteijn, G. J., Wauben, M. H. Fluorescent labeling of nano-sized vesicles released by cells and subsequent quantitative and qualitative analysis by high-resolution flow cytometry. Nat Protoc. 7 (7), 1311-1326 (2012).
- Kowal, J., et al. Proteomic comparison defines novel markers to characterize heterogeneous populations of extracellular vesicle subtypes. Proc Natl Acad Sci U S A. 113 (8), E968-E977 (2016).
- Li, D., et al. ADVANCED IMAGING. Extended-resolution structured illumination imaging of endocytic and cytoskeletal dynamics. Science. 349 (6251), (2015).
- Outzen, H. C., Custer, R. P. Growth of human normal and neoplastic mammary tissues in the cleared mammary fat pad of the nude mouse. J Natl Cancer Inst. 55 (6), 1461-1466 (1975).
- Sheffield, L. G., Welsch, C. W. Transplantation of human breast epithelia to mammary-gland-free fat-pads of athymic nude mice: influence of mammotrophic hormones on growth of breast epithelia. Int J Cancer. 41 (5), 713-719 (1988).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены