Method Article
Trasferimento di abilità di formazione del ghiandale mammario tra le cellule epiteliali basali del mammifero e le cellule luminescenti mammarie attraverso le vescicole / esosomi extracellulari
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo descrive metodi per purificare, quantificare e caratterizzare vescicole extracellulari (EVs) / esosomi da cellule epiteliali mammarie non aderenti / mesenchimali e per usarle per trasferire la capacità di formazione delle ghiandole mammarie alle cellule epiteliali mammarie luminali. EVs / esosomi derivati da cellule epiteliali mammarie simili a stelo possono trasferire questa proprietà cellulare alle cellule che ingeriscono gli EV / esosomi.
Abstract
Le cellule possono comunicare attraverso esosomi, vescicole extracellulari di ~ 100 nm (EVs) che contengono proteine, lipidi e acidi nucleici. Le vescicole extracellulari ottenute dalle cellule epiteliali mammarie non mescolate (NAMEC) possono essere isolate dal mezzo NAMEC tramite ultracentrifugazione differenziale. Sulla base della loro densità, gli EV possono essere purificati mediante ultracentrifugazione a 110.000 x g. La preparazione EV da ultracentrifugazione può essere ulteriormente separata usando un gradiente continuo di densità per impedire la contaminazione con proteine solubili. Gli EVs purificati possono quindi essere ulteriormente valutati usando un'analisi di tracking nanoparticolare, che misura la dimensione e il numero di vescicole nel preparato. Le vescicole extracellulari con una dimensione variabile da 50 a 150 nm sono esosomi. Gli EVs / esosomi derivati dal NAMEC possono essere ingeriti da cellule epiteliali mammarie, che possono essere misurate mediante citometria a flusso e microscopia confocale. Alcune proprietà delle cellule staminali del mammario ( ad esempio, la capacità di formare la ghiandola mammaria) possonoEssere trasferito da NAMEC-simili a gambo alle cellule epiteliali mammarie attraverso i EV / esosomi derivati da NAMEC. Le cellule epiteliali mammarie luminose luminescenti epCAM hi / CD49f non possono formare ghiandole mammarie dopo essere state trapiantate nei rilievi di grasso del mouse, mentre le cellule epiteliali mammarie EpCAM lo / CD49f hi basali formano ghiandole mammarie dopo il trapianto. L'assorbimento di EV / esosomi derivati da NAMEC da EpCAM hi / CD49f lo luminal cellule epiteliali mammarie permette loro di generare ghiandole mammarie dopo essere stati trapiantati in pastiglie grasse. Gli EVs / esosomi derivati da cellule epiteliali mammarie simili al gambo trasferiscono la capacità di formare la ghiandola mammaria alle cellule epiteliali mammarie luminose EpCAM hi / CD49f.
Introduzione
Gli esosomi possono mediare la comunicazione cellulare trasferendo membrane e proteine citosoliche, lipidi e RNA tra le cellule 1 . La comunicazione esosomiale è stata dimostrata coinvolta in molti processi fisiologici e patologici ( es. Presentazione di antigene, sviluppo della tolleranza 2 e progressione tumorale 3 ). Gli esosomi spesso hanno contenuti simili a quelli delle cellule di origine che li rilasciano. Così, gli esosomi possono trasportare proprietà cellulari specifiche dalle cellule sorgenti e trasferire queste proprietà alle cellule che ingeriscono 4 .
Gli esosomi sono vescicole a doppio strato da 50 a 150 nm e presentano marcatori specifici ( es. CD9, CD81, CD63, HSP70, Alix e TSG101). Così, gli esosomi devono essere caratterizzati da vari metodi per diversi aspetti. La microscopia elettronica di trasmissione può essere usata per visualizzare le vescicole a membranaQuali esosomi 4 , 5 . L'analisi di nanoparticle tracking (NTA) e l'analisi della diffusione della luce dinamica (DLS) vengono utilizzati per misurare la dimensione e il numero di esosomi purificati 4 . Il contenuto di membrana lipidica degli esosomi può essere verificato mediante gradiente di densità. Marcatori esosomali, come CD9, CD81, CD63, HSP70, Alix e TSG101 6,7, possono essere misurati mediante blottatura Western.
Le cellule basali del mammario hanno la capacità di generare ghiandole mammarie quando vengono impiantati in pastiglie grasse, mentre le cellule luminali non possono essere 8 , 9 , 10 . Così, le cellule basali del mammario sono anche definite come unità ripopolanti mammarie. Utilizzando il modello delle cellule mammarie basali e luminali, è possibile esaminare la capacità di EVs / esosomi di trasferire le caratteristiche delle cellule tra diverse popolazioni cellulari. Questo lavoroDimostra il metodo di trasferire la capacità di formazione delle ghiandole dalle cellule epiteliali basali del mammario alle cellule epiteliali luminescenti mammarie usando EVs / esosomi derivanti da cellule epiteliali basali mammarie. Le cellule epiteliali mammarie luminescenti hanno acquisito proprietà cellulari basali dopo l'ingestione di EV / esosomi secretati dalle cellule basali e quindi possono formare ghiandole mammarie 4 .
Protocollo
Tutte le ricerche relative agli animali sono conformi ai protocolli approvati dal Comitato istituzionale per la cura degli animali.
1. Isolamento e validazione di vescica extracellulare / esosomi
- Le cellule basali dell'epitelio mammario della cultura, NAMECs 4 , con mezzo fresco e privo di siero costituito da 500 mL di MCDB 170, pH 7.4 + 500 mL di DMEM / F12 con bicarbonato di sodio (0,2438%); EGF (5 ng / mL); Idrocortisone (0,5 μg / mL); Insulina (5 μg / mL); Estratto di ipofisaro bovino (BPE; 35 μg / mL); E GW627368X (1 μg / mL) nei piatti da 15 cm.
- Dopo il conteggio delle cellule con un emocitometro, le sementi 1,2 x 106 cellule in 12 ml di media per piatto da 15 cm nel giorno 0 per 4 giorni 4 .
- Dopo 4 giorni di coltura, centrifugare il mezzo di coltura a 300 xg per 5 minuti utilizzando una centrifuga a tavola. Trasferire il surnatante in un tubo conico ( Figura 1 ).
- Centrifugare il surnatanteA 2.000 xg per 20 minuti in una centrifuga a tavola. Trasferire il surnatante in un tubo di ultracentrifuga e lasciare le cellule morte e detriti cellulari ( Figura 1 ).
- Centrifugare il supernatante a 10.000 xg per 30 minuti a 4 ° C. Trasferire il supernatante ad un nuovo tubo ultracentrifugo ( Figura 1 ).
- Centrifugare il surnatante a 110.000 xg per 60 min a 4 ° C. Rimuovere il surnatante e risospendere il pellet EV / esosoma in PBS ( Figura 1 ).
- Centrifugare il surnatante a 110.000 xg per 60 min a 4 ° C. Rimuovere il surnatante. Resuspendere il pellet EV / exosome in PBS ( Figura 1 ). Resuspendere il pellet isolato da 240-480 ml di mezzo NAMEC-condizionato in 100 μL.
- Misurare la concentrazione proteica della sospensione EV con il saggio della proteina BCA. Assicurarsi che la concentrazione sia di circa 20-40 μg / 100 μL. Conservare a -20 ° C perUlteriori analisi.
- Misurare la concentrazione e la dimensione degli EVs / esosomi mediante l'analisi del tracking nanoparticolare (NTA), come descritto precedentemente da Gardiner et al. 11 . Diluire i EV / esosomi (20 μg / 100 μL) con PBS a 10.000 volte per l'analisi NTA.
NOTA: Il risultato dell'analisi NTA riflette il numero e la dimensione delle vescicole analizzate. - Immagini EVs / esosomi con microscopia trasmissione elettronica (TEM), come descritto precedentemente da Lin et al 4 .
2. Purificazione Exosome utilizzando una gradiente di densità
- Resuspendere il pellet da 110.000 g dal punto 1.7 in 40% (w / v) iodossanolo in PBS (2 mL). Sovrapporre la miscela in sequenza con aliquote di 30%, 20%, 10% e 5% (w / v) iodossanolo in PBS (2 mL ciascuno) per formare un gradiente di densità in un tubo di ultracentrifuga.
- Centrifugare la miscela a 200.000 xg per 8 h a 4 ° C.
- Raccogliere ogni frazione di gradiente (10 fractions; 1 mL / frazione) con una pipetta dalla parte superiore del tubo.
- Analizzare la presenza di marcatori esosomi ( ad es. CD81, CD9, CD63 e Tsg101) in ciascuna frazione mediante SDS-PAGE 12 e Western blot. Caricare 50 μl di sospensioni di ciascuna frazione su un gel di 10% contenente SDS 0,1% (w / v) e separare le proteine in frazioni con elettroforesi a gel.
- Trasferire le proteine da un gel in una membrana PVDF e incubare la membrana con anticorpi contro i marcatori esosomi ( p. Es., CD81, CD9, CD63 e Tsg101) e la proteina GAPDH per la pulizia durante la notte ( Tabella dei materiali ) a 4 ° C.
NOTA: Il risultato identifica la frazione contenente esosomi.
3. Vescicole extracellulari / etichettatura esotica
- Sospendere gli EV / esosomi, ottenuti nel punto 1.7, in 10 μM di carbossfluoresceina succinimidil diacetato estere (CFSE) a 20 μg di proteina esosomale / 100 μL. Preparare un co-campione paralleloContenente solo CFSE e PBS, trattati allo stesso modo, come un controllo negativo per i successivi esami EV / esosomi. Lasciare le miscele a 37 ° C per 30 min.
- Sospendere EVs / esosomi in volume 50x di PBS e centrifugare la sospensione a 110.000 xg per 60 min a 4 ° C. Rimuovere il surnatante e risospendere il pellame EV / esosoma in PBS. Ripetere la fase 3.2 una volta.
- Sospendere EVs / esosomi in PBS ad una concentrazione di 20 μg di proteina esosomale / 100 μL e quindi filtrare gli EVs / esosomi attraverso membrane di 0,22 μm prima di aggiungere EVs / esosomi alle cellule.
4. Esame extracellulare della vescica / Exosome Uptake
- Per ottenere una coltura media, mescolare 500 mL di MCDB 170, pH 7.4 + 500 mL di DMEM / F12 con bicarbonato di sodio (0,2438%); EGF (5 ng / mL); Idrocortisone (0,5 μg / mL); Insulina (5 μg / mL); E BPE (35 μg / mL) 4 . Piattare le cellule HMLE epiteliali mammarie umane in piatti a 6 pozzetti (1 x 10 6 </ Sup> cellule / pozzo) un giorno prima del trattamento EV / exosome. Aggiungere 2 μg / mL CFSE EVS / exosome etichettato con fluorescenza, ottenuto nel passo 3.3, al terreno di coltura delle cellule HMLE per 2-6 h. Trattare le cellule HMLE del gruppo di controllo negativo con la preparazione parallela, descritta nel punto 3.1.
- Dopo l'incubazione da 2 a 6 h, lavare le cellule due volte con 4 mL di PBS a temperatura ambiente.
- Staccare le cellule con 0,25% di trysina per 10 min e ri-sospendere le cellule in PBS contenente 0,2% di FBS. Misurare l'assorbimento di EV / esosomi dall'intensità di fluorescenza nelle cellule utilizzando un analizzatore di celle di fluorescenza 4 . Immagini le cellule trattate con EVs / esosomi o il controllo negativo usando la microscopia confocale.
NOTA: La fluorescenza verde nelle cellule è causata dall'assorbimento EV / esosomi. Vedere la leggenda della Figura 6 per le impostazioni del microscopio.
5. Isolamento delle cellule epiteliali del mammario primario
- Preparare piatti rivestiti in gelatina aggiungendo 12 ml di soluzione gelatina 0,1% a piatti da 10 cm. Posizionare le piastre in un incubatore a 37 ° C per 30 min. Rimuovere la soluzione di gelatina e lasciare i coperchi dai piatti in un cappuccio di flusso laminare per 4 h finché il rivestimento di gelatina si è asciugato.
- Sfogliare le ghiandole mammarie numero 2, 3, 4 e 5 ( Figura 2 ) dai maschi C57BL / 6 vergini di 12 settimane usando le forbici e tagliare le ghiandole in piccoli pezzi (2 mm 2 ) usando un rasoio.
- Far dissociare ulteriormente la slurry delle ghiandole mammarie (da 10 topi) per 60 minuti a 37 ° C, agitazione a 120 giri / min con 50 ml di DMEM / F12 contenente 0,2% di collageno tipo IV, 0,2% di tripsina, 5% FBS, 5 μg / ml di gentamicina , E 1x pen-strep.
- Pellet giù gli organoidi epiteliali dalla miscela per centrifugazione a 350 xg per 10 minuti.
- Sospendere gli organoidi epiteliali in 4 mL di DMEM / F12 con 0,1 mg / mL DNasi I per 5 minuti a temperatura ambiente. Aggiungere 6 ml di DMEM / F12 in una finaleVolume di 10 mL.
- Centrifugare la sospensione a 400 xg per 10 minuti a temperatura ambiente e scartare il surnatante.
- Resuspendere il pellet in 10 ml di DMEM / F12. Centrifugare la sospensione ma colpire il freno quando la velocità raggiunge 400 x g. Scartare il surnatante.
NOTA: Colpendo il freno, gli organoidi epiteliali vengono rapidamente abbassati, mentre i fibroblasti, come singole cellule, rimangono ancora nel surnatante. - Ripetere la fase 5.6 e 5.7 5-7 volte. Aggiungere una goccia della sospensione ad un emocitometro e controllare la clearance dei fibroblasti dalla miscela organoide sotto microscopia dopo ogni ciclo di centrifugazione ( Figura 3 ).
- Piastra gli organoidi nel piatto rivestito di gelatina, ottenuto nel passaggio 5.1, per 48 ore con DMEM / F12 contenente 1x ITS, 5% FBS, 50 μg / mL gentamicina, 10 ng / mL EGF e 1x pen-strep.
- Dopo 48 h, rimuovere le cellule galleggianti nella coltura sostituendo il mezzo con terreno di coltura fresco senza FBS (DMEM / F12 contenente 1x ITS, 50 μg / mL gentamicina, 10 ng / mL EGF e 1x pen-strep).
- Confermare che un monostrato di cellule epiteliali mammarie migra e cresce dagli organoidi epiteliali collegati in 3 giorni.
6. Separazione delle cellule epiteliali mammarie basali / luminescenti primarie
- Dopo la cultura di 3 giorni, staccare le cellule mammarie primarie del mouse con una miscela enzimatica naturale con attività enzimatica proteolitica e collagenolitica per 20 min. Neutralizzare l'attività enzimatica con il 5% di FBS in PBS.
- Centrifugare la sospensione a 450 xg per 10 minuti a temperatura ambiente e scartare il surnatante. Resuspendere il pellet cellulare in 5 mg / mL dispasi per 20 min. Neutralizzare l'attività enzimatica con il 5% di FBS in PBS.
- Centrifugare la sospensione a 450 xg per 10 minuti a temperatura ambiente e scartare il surnatante.
- Riassemblare le cellule in 100 μl di PBS con 0,2% di FBS ad una concentrazione di 10 7 cellule / ml con il diluitoAnticorpi anti-CD49f e anti-EpCAM sul ghiaccio per 1 ora nel buio.
- Lavare le cellule con PBS e incubare le cellule con anticorpo secondario coniugato fluoroforo sul ghiaccio per 30 minuti al buio.
- Lavare e ri-sospendere le cellule in PBS con 0,2% di FBS.
- Ordinate le cellule epiteliali mammarie EpCAM hi / CD49f luminal su un cellulare 4 .
7. Vescicola extracellulare / trattamento esotico
- Sezionare le cellule epiteliali mammarie luminose EpCAM hi / CD49f dal punto 6.7 sui piatti a 6 pozzetti rivestiti in gelatina (2 x 10 5 cellule / pozzetto) e quindi trattarli con PBS o con EVS / esosomi derivanti da NAMEC da 2 μg / mL Ottenuto nel punto 1.7.
- Per assicurare l'efficacia biologica dei EV / esosomi nel trattamento di coltura a lungo termine, sostituire ogni due giorni il mezzo di coltura cellulare con un mezzo fresco contenente PBS o 2 μg / mL di EV / esosomi derivati dal NAMEC. Non dividere prima il mouseDurante le 10 giorni di trattamento.
8. Iniezione del grasso di cellule epiteliali del mammario
- Anestetizzare un 3 settimane di sesso femminile C57BL / 6 con isofluorano 2-3% inalante.
- Posizionare il mouse anestetizzato sulla schiena. Togliere la pelliccia sul mid-abdomen con una crema di rasoio / capelli e pulire il sito di chirurgia con tre cicli alternati di alcol al 70% e povidone-iodio.
- Effettuare un'incisione verticale da 1,5 cm attraverso la pelle lungo la regione ventricolare toracica-inguinale con le forbici e poi alternare in modo alternato i tamponi di grasso a destra e sinistra del 4 ° mammario.
- Cancella ogni pastiglia grassa rimuovendo la parenchima delle ghiandole con forbici. Individuare il linfonodo nel tampone di grasso e poi rimuovere l'intera parenchima della ghiandola sotto il linfonodo.
NOTA: Due terzi del blocco grasso devono rimanere in posizione. - Staccare le cellule ottenute dalla fase 7.2 con una miscela enzimatica naturale (vedi tabella dei materiali ) con proteolytic aNd attività enzimatica collagenolytica per 10 min. Neutralizzare l'attività enzimatica con il 5% di FBS in PBS.
- Centrifugare la sospensione a 450 xg per 10 minuti a temperatura ambiente e scartare il surnatante. Conte le cellule con un emocitometro e sospendere le cellule in PBS ad una concentrazione tale che 15 μL contiene la dose cellulare desiderata (10 4 -10 2 cellule / pad).
- Iniettare 15 μL di sospensione delle cellule epiteliali mammarie in un tampone di grasso usando una siringa di vetro da 100 μl attaccata ad un ago 27G.
- Ripetere i passaggi 8.4-8.7 per il tampone di grasso dall'altro lato.
- Chiudere la pelle con le clip della ferita.
9. Ghiandola mammaria
- Eutanizzare il topo con CO 2 e dislocazione cervicale a 8 settimane dopo l'iniezione cellulare (punto 8.7).
- Effettuare un'incisione verticale attraverso lo strato della pelle dalla regione toracica alla regione inguinale usando le forbici e quindi esporre sia la destra che la sinistra 4 mCuscinetti ammalici di grasso. Rimuovere le 4 gamme mammarie ( Figura 2 ).
- Diffondere le pastiglie di grasso sulle vetrini del microscopio di vetro e fissare le pastiglie di grasso con il fissativo di Kahle (4% di formaldeide, 30% di EtOH e 2% di acido acetico glaciale) a temperatura ambiente durante la notte.
Attenzione: il fissativo di Kahle è irritante. Eseguire questo passaggio in un cappuccio chimico. - Lavare i pastiglie grassi in 250 mL di EtOH 70% per 15 minuti e poi in 250 mL di dH 2 O per 5 min. Stain le pastiglie grassi con allume di carminio (1 g di carmina e 2,5 g di solfato di potassio di alluminio in 500 mL di dH 2 O) a temperatura ambiente durante la notte.
- Lavare i cuscinetti grassi con 250 mL di EtOH 70% per 15 minuti, 250 mL di EtOH 95% per 15 minuti e 250 mL di 100% EtOH per 15 minuti.
- Pulire i pastiglie grassi in xilene per giorni e fermare l'incubazione di xilene quando i pastiglie grassi diventano trasparenti.
Attenzione: Xilene è un irritante. Eseguire questo passaggio in un cappuccio chimico. - Montare le diapositive wiIl mezzo di montaggio e fotografare (2.400 dpi) dei pasticci per grassi utilizzando un diapositario digitale.
Risultati
Dal momento che è stato dimostrato che bloccando la segnalazione di PGE 2 / EP 4 provoca il rilascio di EV / esosomi da cellule staminali simili al basale mammario 4 , questo lavoro presenta un metodo di isolamento degli EV / esosomi indotti dalla coltura cellulare basale epiteliale mammaria (NAMEC). Dal momento che NAMECs sono coltivati in un mezzo senza siero, non esistono EVs / esosomi preesistenti derivati dal siero 13 . Per le cellule coltivate in un mezzo contenente siero, gli esosomi preesistenti nel mezzo devono essere pre-puliti mediante ultracentrifugazione a 110.000 xg prima che il mezzo venga utilizzato per coltivare le cellule sorgenti per la raccolta di EV / esosomi 5 . EVs / esosomi del 4 giorno indotto dal mezzo NAMEC-condizionato possono essere isolati dal pellet di 110.000 xg mediante ultracentrifugazione differenziale, come illustrato nella figura 1 . Il numero e la dimensione delle vescicole isolate nelle 110.000 xg di pellE può essere misurato usando l'analisi del tracking nanoparticolare (NTA). La frazione di pellet di 110.000 g isolata mediante ultracentrifugazione differenziale contiene principalmente vescicole ~ 100 nm ( Figura 4A ); Ciò corrisponde alla dimensione degli esosomi (50 - 150 nm) riportati in letteratura. Inoltre, l'analisi TEM ha mostrato che 110.000 g di frazioni di NAMEC-condizionato mezzo contengono abbondanti membrane vescicole ( Figura 4B ). Sebbene l'ultracentrifugazione differenziale possa generare esosomi ragionevolmente pura, la seguente fase di purificazione usando un gradiente di densità elimina ulteriormente le contaminanti ( ad esempio, aggregati di proteine) 5 . Nel gradiente di densità, gli esosomi galleggiano nel gradiente a causa del contenuto di lipidi nella vescicola, mentre gli aggregati di proteine, se del caso, rimangono al fondo del gradiente. Ogni frazione del gradiente viene raccolta per la rilevazione di creatori di esosomi ( ad es. CD81, CD63, CD9 e TSG101 6 , 7 ) da Western blotting. I marcatori esogeni possono essere rilevati nella frazione con ~ 20% di iodicosanolo ( Figura 5 ). La frazione contenente esosomi può essere diluita con PBS e sottoposta a 200.000 xg ultracentrifugazione per isolare gli esosomi. Il pellet esosomo isolato viene lavato una volta in PBS e poi viene risospeso in PBS e conservato a -20 ° C per ulteriori analisi.
Prima di misurare l'assorbimento di EV / esosomi derivati da NAMEC dalla controparte non stelo delle cellule epiteliali mammarie-HMLE-EVs / esosomi devono essere etichettati con un colorante fluorescente ( ad esempio, carbossiofluoresceina succinimidil estere (CFSE)). Un campione parallelo contenente solo CFSE ma non EV / esosoma viene elaborato nella stessa procedura di etichettatura. Questo campione è un controllo negativo utilizzato nel seguente esame di assorbimento EV / esosomi per riflettere l'effetto di una quantità traccia di CFS residuo liberoE tintura. Le cellule HMLE vengono coltivate con CFSE-etichettati EVS / esosomi derivati da NAMEC o il controllo negativo per 2-6 h e quindi sottoposti a citometria a flusso. Rispetto alle cellule HMLE non trattate, le cellule HMLE colte con il controllo negativo esprimono un livello leggermente superiore del segnale CFSE ( Figura 6A , linea rossa rispetto alla linea arancione), che riflette il livello di sfondo della segnalazione CFSE causato da CFSE residuo libero lasciato dalla EV / processo di etichettatura dell'esosoma. Inoltre, rispetto alle cellule HMLE trattate con controllo negativo, le cellule HMLE colte col marchio CFSE, esosomi derivati da NAMEC esprimono un segnale CFSE superiore di 10 volte ( Figura 6A , linea blu rispetto alla linea rossa), che risulta dall'accettazione specifica Di EVs / exosomi etichettati con CFSE. L'assunzione di CFS-etichettati, NAMEC derivato EVs / esosomi da cellule HMLE può essere osservata anche mediante microscopia confocale. Mentre le cellule HMLE trattate con controllo negativo non presentano un segnale CFSE, l'assorbimento di NAGli EVs / esosomi derivati da MEC da parte delle cellule HMLE possono essere osservati con il segnale CFSE sotto il microscopio confocale nelle cellule trattate con CFSE con EV / esosomi ( Figura 6B ).
Per valutare se i EVs / esosomi derivati dal NAMEC possono trasferire la capacità di formare la ghiandola mammaria da cellule basali del mammario come mammarie alle cellule luminescenti mammarie, le cellule luminescenti del mammario vengono prima isolate per consentire l'analisi della formazione di ghiandole mammarie nei topi. Le cellule epiteliali del mammario del mouse sono isolate da topi di 12 settimane. Le ghiandole mammarie vengono tagliate in piccoli pezzi e sono ulteriormente dissociate con collagenasi e tripsina. Gli organoidi epiteliali dissociati ei fibroblasti possono essere separati mediante centrifugazione differenziale, come descritto nei passaggi 5.7 e 5.8. In ogni ciclo di centrifugazione, il pellet nella parte inferiore dei tubi dovrebbe contenere principalmente organoidi epiteliali e i fibroblasti e le singole cellule dovrebbero galleggiare nel soprannatanot. Rispetto alla miscela contenente entrambi organoidi epiteliali e fibroblasti prima della centrifugazione differenziale ( figura 3 , pannelli superiori), i sei cicli di centrifugazione eliminano gran parte dei fibroblasti e singole cellule nella miscela ( Figura 3 , pannello inferiore).
Le cellule epiteliali mammarie ( Figura 7 ) degli organoidi epiteliali vengono ulteriormente dissociate usando una miscela enzimatica naturale con attività enzimatica proteolitica e collagenolitica e dispersa per generare singole cellule in sospensione. La sequenza della sospensione di una singola cellula mediante l'espressione della superficie cellulare CD49f e EpCAM può separare cellule luminescenti mammarie (EpCAM hi / CD49f lo ), cellule basali mammarie (EpCAM lo / CD49f hi ) e cellule non epiteliali (EpCAM) ( Figura 8 ).
hi / CD49f vengono coltivate con EVs / esosomi derivate da NAMEC per 10 giorni e i nuovi EVs / esosomi e mezzi freschi vengono sostituiti ogni due giorni. Dopo il trattamento EV / esosomi, le cellule luminesche mammarie vengono impiantate nei 4 padi grassi mammari ( Figura 2 ) dei topi. Dopo 8 settimane, i tamponi di grasso vengono isolati e macchiati per l'analisi della formazione delle ghiandole mammarie ( Figura 9 ). Il trattamento con EV / esosomi derivati dal NAMEC indotto consente alle cellule luminali di acquisire la capacità di formare la ghiandola mammaria 4 . Le cellule luminescenti mammarie trattate con EV / esosomi derivate da NAMEC formano ghiandole mammarie in pastiglie grasse del grasso ( Figura 9 ).

Figura 1: Illustrazione dell'estracellulaR Vesicle / metodo di purazione esosoma da Medium di cultura cellulare mediante ultracentrifugazione differenziale. Sono indicati la velocità e la lunghezza di ogni centrifugazione. Dopo ciascuna delle prime tre centrifugazioni, il supernatante viene mantenuto per il passo successivo. Dopo le centrifugazioni di 110.000 × g, i pellet vengono conservati e i supernatanti scartati. Clicca qui per visualizzare una versione più grande di questa figura.
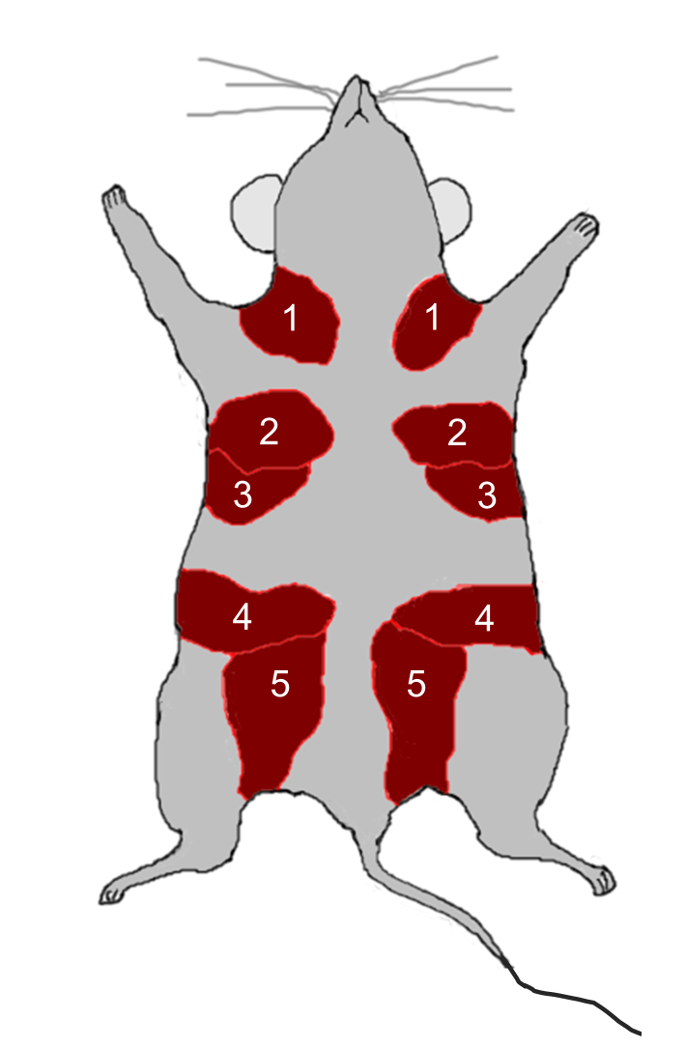
Figura 2: Anatomia del ghiandolo del mammella. I topi hanno cinque coppie di ghiandole mammarie, indicate dai numeri 1-5, situati nelle pastiglie grigi (rosse) direttamente sotto la pelle. Clicca qui per visualizzare una versione più grande di thÈ figura.

Figura 3: Immagini di una miscela di organoidi epiteliali e cellule di pastiglie grasse prima e dopo centrifugazione differenziale. Immagini di Bright- fi eld delle miscele cellulari isolate prima e dopo centrifugazione differenziale, prelevate dall'emocitometro. Arrowhead: organoidi epiteliali. Freccia: fibroblasti e singole cellule. Barra di scala = 0,5 mm. Clicca qui per visualizzare una versione più grande di questa figura.
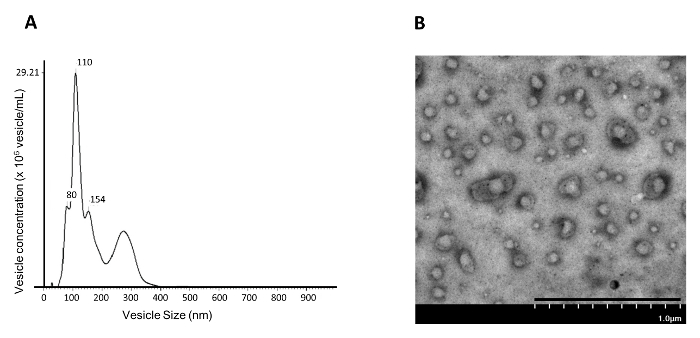
Figura 4: Dimensione vescicale e analisi di concentrazione di NAMEC110.000 xg Pellet Fraction. La frazione di pellet di 110.000 g del mezzo NAMEC è col (ATA) e ( B ) la microscopia di trasmissione elettronica (TEM). Barra di scala = 1 μm. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: Individuazione di esosomi nelle frazioni del gradiente di densità. L'analisi Western blot di marcatori esogeno CD81, CD9, CD63 e Tsg101 e il gene di mantenimento GAPDH rivela la frazione iodixanolo del 20% contenente gli esosomi. Clicca qui per visualizzare una versione più grande di questa figura.
55736fig6.jpg "/>
Figura 6: Individuazione di vescicole extracellulari / assorbimento esosomico mediante citometria di flusso e microscopia confocale. L'assorbimento di EV / esosomi è stato misurato in cellule HMLE. CFs etichettati, NAMEC derivati / esosomi e controllo negativo vengono aggiunti alle colture indicate per 6 h. Dopo l'incubazione, le cellule sono sottoposte ( A ) citometria di flusso e ( B ) microscopia confocale. Il CFSE (verde, eccitazione / emissione (nm): 492/517, microscopio linea laser: 488) intensità fl uorescenza riflette l'assorbimento EV / esosomi. I nuclei cellulari sono macchiati con DAPI (blu, eccitazione / emissione (nm): 358/461, linea laser microscopico: 405) e le membrane plasmatiche sono macchiate con macchia di membrana plasmatica (rosso, eccitazione / emissione): 649/666; Linea laser microscopio: 633, vedi tabella dei materiali ). Obiettivo obiettivo confocale: HCX PL APO 63x / 1.40-0.60 Olio. Barra di scala = 20 μm.Ad / 55736 / 55736fig6large.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.
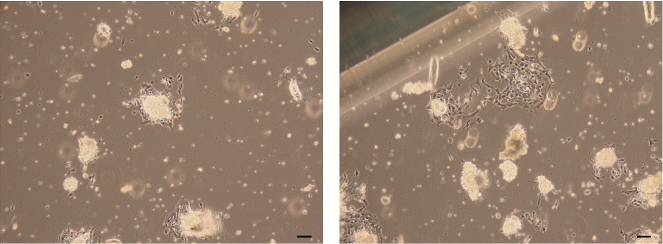
Figura 7: Immagini degli organiidi epiteliali allegati. Immagini luminose di cellule epiteliali mammarie formate dalle cellule che migrano e crescono dagli organoidi epiteliali allegati. Barra di scala = 100 μm. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 8: Ordinamento delle cellule epiteliali del mammario primario del mouse per superficie EpCAM e CD49f. Le cellule epiteliali dei mammiferi del mouse isolate dai pastelli grassi di topi di 12 settimane vengono sottoposti a tipo di celluleing. Le cellule luminescenti del mammario vengono arricchite nella popolazione epCAM hi / CD49f lo, contrassegnata dal cerchio blu; Le cellule basali furono arricchite nella popolazione di EpCAM lo / CD49f hi, contrassegnate dal cerchio rosso. Le cellule non epiteliali sono contrassegnate con la scatola nera nella trama. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 9: Formazione della ghiandola mammaria mediante cellule mammarie luminescenti primarie. Le cellule luminal di primari mouse EpCAM hi / CD49f sono trattate con PBS o gli EVs / esosomi derivati da NAMEC nella coltura cellulare per 10 giorni e impiantati nei pastelli grassi depurati di topi di tre settimane. I topi vengono eutanizzati e necropsiati dopo 8 settimane per analizzare la ghiandola mammariazione. Barra di scala = 0,75 cm. Clicca qui per visualizzare una versione più grande di questa figura.
| Percentuale | MFI di EpCAM | MFI di CD49f | |
| Cellula lumina mammaria | 0,437 | 4,57 x 10 4 | 8183 |
| (EpCAM hi / CD49f lo ) | |||
| Cellula mammaria basale | 0,09 | 5452 | 2,23 x 10 4 |
| (EpCAM lo / CD49f hi ) | |||
| Non epitelialeCellula (EpCAM - ) | 0.309 | 53 | 4619 |
Tabella 1: Percentuale e intensità media di fluorescenza (MFI) delle popolazioni descritte in Figura 8.
Discussione
Gli esosomi spesso trasportano caratteristiche delle cellule che li hanno liberati e la quantità di esosomi rilasciati può essere indotta da stimoli 4 . Il mezzo di coltura delle cellule può essere raccolto e sottoposto ad ultracentrifugazione differenziale per la raccolta di EV / esosomi ( Figura 1 ). Attualmente non esiste un accordo generale su un metodo ideale per isolare EV / esosomi. Il metodo ottimale utilizzato qui è stato determinato dall'applicazione a valle 14 . L'ultracentrifugazione è un metodo relativamente veloce per l'isolamento di EV / esosomi, che possono preservare l'attività biologica dei EV / esosomi. Tuttavia, le vescicole isolate per ultracentrifugazione generalmente contengono una miscela di EV, che contengono esosomi prodotti tramite compartimenti endosomici e / o vescicole prodotte emanando dalla membrana cellulare.
Analizzando le dimensioni delle vescicole con NTA ( Figura 4A ), le vescicole trovate per purificare a 110.000 xg durante l'ultracentrifugazione differenziale erano principalmente 50-150 nm, corrispondenti alla dimensione degli esosomi. I dati NTA suggeriscono che gli esosomi derivati dal NAMEC possono essere isolati dal mezzo di coltura a 110.000 xg durante l'ultracentrifugazione differenziale. Tuttavia, l'introduzione di NTA e TEM consente solo la visualizzazione di vescicole o la misurazione della dimensione e del numero di tutta la popolazione di EV. Queste tecniche non possono misurare l'eterogeneità delle popolazioni EV o addirittura ordinare le popolazioni EV eterogenee. Gli scienziati hanno iniziato a sviluppare metodi di utilizzo dei citometri di flusso per analizzare e ordinare le popolazioni EV 15 .
Sebbene l'ultracentrifugazione differenziale possa essere usata per purificare gli esosomi, è necessario utilizzare un gradiente di densità per rimuovere ulteriormente la contaminazione degli aggregati proteici dalle vescicole esosomane nella frazione isolata di 110.000 xg . Gli esosomi contengono membrane lipidiche. Il lipido nelle membrane di esosoma rende gli esosomi galleggianti in un gradiente di densità, mentre gli aggregati di proteine cadono fino al fondo del gradiente di densità. Gli esosomi esprimono marcatori specifici ( es. CD81, CD63, CD9 e TSG101 6,7). Analizzando la presenza di marcatori esosomi nelle frazioni del gradiente di densità, è possibile identificare esosomi nella frazione con ~ 20% iodossanolo ( Figura 5 ). Si devono esaminare più marcatori esosomi per identificare esosomi nel gradiente di densità, poiché ogni popolazione di esosomi può esprimere diversi marcatori esosomi 16 .
L'assorbimento di EV / esosomi da parte delle cellule può essere misurato utilizzando EVs / esosomi etichettati con fluorescenza. Il numero di cellule che ingeriscono EVs / esosomi etichettati può essere misurato mediante citometria a flusso ( Figura 6A ). Per confermare che il fluoLa rescissione dalle cellule risulta dall'assorbimento di EVs / esosomi etichettati ma non da colorante libero, lo schema di fluorescenza è stato esaminato nelle cellule utilizzando microscopia. La microscopia confocale mostra che il pattern di fluorescenza nelle cellule trattate con EV / esosomi è punctato (pannello destro della Figura 6B ). I segnali di punctata probabilmente derivano da EVs / esosomi etichettati, non dalla fluorescenza libera. I segnali punctati nelle cellule possono essere ulteriormente analizzati con microscopia di super-risoluzione illuminazione strutturata, che ha la massima risoluzione a 85 nm 4 , 17 . La microscopia a super-risoluzione può confermare che i segnali di punctate sono da vesicles cave a ~ 100 nm, che assomigliano agli esosomi 4 . Questi risultati suggeriscono che gli esosomi derivati dal NAMEC possono essere ingeriti da cellule epiteliali mammarie nella cultura.
Gli EVs / esosomi derivati da NAMEC portano spesso molecole ( ad esempio, proteine e miRNA) essenziali per le caratteristiche di alcune cellule 1 . Ciò suggerisce che i EV / esosomi derivati da NAMEC possono trasferire le proprietà dei NAMEC ( ad esempio la capacità di formare la ghiandola mammaria) alle loro controparti di cellule epiteliali. Poiché le cellule epiteliali umane del mammario non possono formare glandole mammarie xenogeneicamente nei pastelli grasse del mouse 18 , 19 , il trasferimento della capacità formante delle ghiandole può essere esaminato utilizzando le cellule epiteliali primarie del mammario primario. Le cellule luminescenti primarie mammarie EpCAM hi / CD49f, che non formano ghiandole mammarie, possono essere isolate da topi di 6 settimane ( Figura 7 e Figura 8 ). Le cellule isolate dai pad di grasso del mouse possono essere suddivise in tre gruppi ( cioè le cellule luminal di EpCAM hi / CD49f, le cellule basali EpCAM lo / CD49f hi e le cellule EpCAM - non epiteliali) esaminando leValli di superficie EpCAM e CD49f ( Figura 8 ). EpCAM lo / CD49f le cellule basali basali possono formare ghiandole mammarie in faglie grasse quando trapiantate in pastiglie grasse, ma le cellule luminal di EpCAM hi / CD49f non possono 4 . Pertanto, la popolazione di cellule luminose di EpCAM hi / CD49f può essere usata per esaminare la capacità dei EV / esosomi derivati NAMEC indotti per trasferire la capacità di formare la ghiandola mammaria. Le cellule isolate EpCAM hi / CD49f luminal possono essere mantenute in coltura per 7-10 giorni per il trattamento EV / esosomi 4 . Va osservato che mantenere le cellule epiteliali primarie mammarie in vitro per più tempo può attenuare la vitalità delle cellule.
Le cellule luminose mammarie trattate con EV / esosoma possono essere impiantate in pastiglie grasse depurate per analizzare la capacità di formare la ghiandola mammaria. Le pastiglie grasse di topi utilizzati per l'impianto devono essere eliminati a 3 settimane di età. UNT 3 settimane di età, le cellule epiteliali mammarie sono limitate alla regione tra il capezzolo e la linfa di un tampone di grasso. L'epitelio mammario in un tampone di grasso può essere eliminato rimuovendo la regione tra il capezzolo e la linfa a 3 settimane di età. Le cellule luminarie mammarie vengono impiantate subito dopo aver eliminato il tampone di grasso e la formazione delle ghiandole dalle cellule impiantate può essere analizzata a 8 settimane dopo l'impianto. L'effetto degli EVs / esosomi derivati dal NAMEC sul trasferimento della capacità di formazione delle ghiandole mammarie nelle cellule luminescenti mammarie può essere valutato mediante la formazione di ghiandole di cellule luminali e di cellule luminose trattate con EV / esosomi ( Figura 9 ). Gli EVs / esosomi indotti da NAMEC portano la proprietà di cellule epiteliali basali del mammifero - capacità di formatura delle ghiandole - e le cellule luminali che ingeriscono EV / esosomi indotti da NAMEC possono acquisire la proprietà da NAMECs tramite EVs / esosomi. Questo lavoro dimostra che le molecole sono responsabili del EV / esosoma-mediaIl trasferimento della capacità di formazione della ghiandola mammaria è presente nelle zattere lipidiche di EV / esosomi 4 .
Divulgazioni
Gli autori non hanno niente da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto da sovvenzioni degli Istituti Nazionali di Ricerca Sanitaria (05A1-CSPP16-014, HJL) e dal Ministero della Scienza e della Tecnologia (MOST 103-2320-B-400-015-MY3, HJL).
Materiali
| Name | Company | Catalog Number | Comments |
| MCDB 170 | USBiological | M2162 | |
| DMEM/F12 | Thermo | 1250062 | |
| Optima L-100K ultracentrifuge | Beckman | 393253 | |
| SW28 Ti Rotor | Beckman | 342204 | |
| SW41 Rotor | Beckman | 331306 | |
| NANOSIGHT LM10 | Malvern | NANOSIGHT LM10 | for nanoparticle tracking analysis (NTA) |
| Optiprep | Sigma-Aldrich | D1556 | 60% (w/v) solution of iodixanol in water (sterile). |
| CD81 antibody | GeneTex | GTX101766 | 1:1,000 in 5% w/v nonfat dry milk, 1x TBS, 0.1% Tween 20 at 4 °C, overnight |
| CD9 antibody | GeneTex | GTX100912 | 1:1,000 in 5% w/v nonfat dry milk, 1x TBS, 0.1% Tween 20 at 4 °C, overnight |
| CD63 antibody | Abcam | Ab59479 | 1:1,000 in 5% w/v nonfat dry milk, 1x TBS, 0.1% Tween 20 at 4 °C, overnight |
| TSG101 antibody | GeneTex | GTX118736 | 1:1,000 in 5% w/v nonfat dry milk, 1x TBS, 0.1% Tween 20 at 4 °C, overnight |
| GAPDH | GeneTex | GTX100118 | 1:6,000 in 5% w/v nonfat dry milk, 1x TBS, 0.1% Tween 20 at 4 °C, overnight |
| CFSE (carboxyfluorescein succinimidyl diacetate ester) | Thermo | V12883 | |
| FACSCalibur | BD Biosciences | fluorescence cell analyzer | |
| collagenase Type IV | Thermo | 17104019 | |
| trypsin | Thermo | 27250018 | |
| ITS | Sigma-Aldrich | I3146 | a mixture of recombinant human insulin, human transferrin, and sodium selenite |
| accutase | ebioscience | 00-4555-56 | a natural enzyme mixture with proteolytic and collagenolytic enzyme activity |
| dispase | STEMCELL | 7913 | 5 mg/mL = 5 U/mL |
| anti-CD49f antibody | Biolegend | 313611 | 1:50 |
| anti-EpCAM antibody | Biolegend | 118213 | 1:200 |
| FACSAria | BD Biosciences | cell sorter | |
| carmine alum | Sigma-Aldrich | C1022 | |
| human mammary epithelial cells (HMLE cells, NAMECs) | gifts from Dr. Robert Weinberg | ||
| permount | Thermo Fisher Scientific | SP15-500 | |
| sodium bicarbonate | Zymeset | BSB101 | |
| EGF | Peprotech | AF-100-015 | |
| Hydrocoritisone | Sigma-Aldrich | SI-H0888 | |
| Insulin | Sigma-Aldrich | SI-I9278 | |
| BPE (bovine pituitary extract) | Hammod Cell Tech | 1078-NZ | |
| GW627368X | Cayman | 10009162 | |
| 15 cm culture dish | Falcon | 353025 | |
| table-top centrifuge | Eppendrof | Centrifuge 3415R | |
| ultracentrifuge tube | Beckman | 344058 | |
| PBS (Phosphate-buffered saline) | Corning | 46-013-CM | |
| BCA Protein Assay | Thermo Fisher Scientific | 23228 | |
| Transmission Electron Microscopy | Hitachi | HT7700 | |
| gelatin | STEMCELL | 7903 | |
| 10 cm culture dish | Falcon | 353003 | |
| 6-well culture dish | Corning | 3516 | |
| female C57BL/6 mice | NLAC (National Laboratory Animal Center | ||
| FBS (Fetal Bovine Serum) | BioWest | S01520 | |
| gentamycin | Thermo Fisher Scientific | 15710072 | |
| Pen/Strep | Corning | 30-002-Cl | |
| DNase I | 5PRIMER | 2500120 | |
| isofluorane | Halocarbon | NPC12164-002-25 | |
| formaldehyde | MACRON | H121-08 | |
| EtOH (Ethanol) | J.T. Baker | 800605 | |
| glacial acetic acid | Panreac | 131008.1611 | |
| aluminum potassium sulfate | Sigma-Aldrich | 12625 | |
| Xylene | Leica | 3803665 | |
| 0.22 μm membranes | Merck Millipore | Millex-GP | |
| AUTOCLIP Wound Clips, 9 mm | BD Biosciences | 427631 | |
| AUTOCLIP Wound Clip Applier | BD Biosciences | 427630 | |
| CellMask™ Deep Red | Thermo Fisher Scientific | C10046 | plasma membrane stain |
Riferimenti
- Simons, M., Raposo, G. Exosomes--vesicular carriers for intercellular communication. Curr Opin Cell Biol. 21 (4), 575-581 (2009).
- Théry, C., Ostrowski, M., Segura, E. Membrane vesicles as conveyors of immune responses. Nat Rev Immunol. 9 (8), 581-593 (2009).
- Boelens, M., et al. Exosome Transfer from Stromal to Breast Cancer Cells Regulates Therapy Resistance Pathways. Cell. 159 (3), 499-507 (2014).
- Lin, M. C., et al. PGE2 /EP4 Signaling Controls the Transfer of the Mammary Stem Cell State by Lipid Rafts in Extracellular Vesicles. Stem Cells. , (2016).
- Théry, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Curr Protoc Cell Biol. , (2006).
- György, B., et al. Membrane vesicles, current state-of-the-art: emerging role of extracellular vesicles. Cell Mol Life Sci. 68 (16), 2667-2688 (2011).
- Olver, C., Vidal, M. Proteomic analysis of secreted exosomes. Subcell Biochem. 43, 99-131 (2007).
- Shackleton, M., et al. Generation of a functional mammary gland from a single stem cell. Nature. 439 (7072), 84-88 (2006).
- Prater, M. D., et al. Mammary stem cells have myoepithelial cell properties. Nat Cell Biol. 16 (10), 942-950 (2014).
- Stingl, J., et al. Purification and unique properties of mammary epithelial stem cells. Nature. 439 (7079), 993-997 (2006).
- Gardiner, C., Ferreira, Y. J., Dragovic, R. A., Redman, C. W., Sargent, I. L. Extracellular vesicle sizing and enumeration by nanoparticle tracking analysis. J Extracell Vesicles. 2, (2013).
- Shapiro, A. L., Viñuela, E., Maizel, J. V. Molecular weight estimation of polypeptide chains by electrophoresis in SDS-polyacrylamide gels. Biochem Biophys Res Commun. 28 (5), 815-820 (1967).
- Riches, A., Campbell, E., Borger, E., Powis, S. Regulation of exosome release from mammary epithelial and breast cancer cells - a new regulatory pathway. Eur J Cancer. 50 (5), 1025-1034 (2014).
- Witwer, K. W., et al. Standardization of sample collection, isolation and analysis methods in extracellular vesicle research. J Extracell Vesicles. 2, (2013).
- van der Vlist, E. J., Nolte-'t Hoen, E. N., Stoorvogel, W., Arkesteijn, G. J., Wauben, M. H. Fluorescent labeling of nano-sized vesicles released by cells and subsequent quantitative and qualitative analysis by high-resolution flow cytometry. Nat Protoc. 7 (7), 1311-1326 (2012).
- Kowal, J., et al. Proteomic comparison defines novel markers to characterize heterogeneous populations of extracellular vesicle subtypes. Proc Natl Acad Sci U S A. 113 (8), E968-E977 (2016).
- Li, D., et al. ADVANCED IMAGING. Extended-resolution structured illumination imaging of endocytic and cytoskeletal dynamics. Science. 349 (6251), (2015).
- Outzen, H. C., Custer, R. P. Growth of human normal and neoplastic mammary tissues in the cleared mammary fat pad of the nude mouse. J Natl Cancer Inst. 55 (6), 1461-1466 (1975).
- Sheffield, L. G., Welsch, C. W. Transplantation of human breast epithelia to mammary-gland-free fat-pads of athymic nude mice: influence of mammotrophic hormones on growth of breast epithelia. Int J Cancer. 41 (5), 713-719 (1988).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon