Method Article
העברת בלוטת החלב ביצירת יכולת בין תאי אפיתל בסל החלב תאים לומיני החלב באמצעות שלפוחיות תאיים / אקסוסומות
* These authors contributed equally
In This Article
Summary
פרוטוקול זה מתאר שיטות לטיהור, quantitating, אפיון שלפוחית תאיים (EVs) / exosomes מ שאינם חסיד / mesenchymal תאים אפיתל החלב ועל השימוש בהם כדי להעביר את בלוטת החלב יוצרי היכולת לתאי אפיתל החלב לומינל. EVS / exosomes נגזר גזע כמו תאי אפיתל החלב יכול להעביר תכונה זו התא לתאים לבלוע EVs / exosomes.
Abstract
תאים יכולים לתקשר באמצעות אקסוסומים, ~ 100 ננומטר שלפוחית תאיים (EVs) המכילים חלבונים, שומנים וחומצות גרעין. Non-חסיד / mesenchymal תא אפיתל החלב (NAMEC), שודד שלפוחית תאיים יכול להיות מבודדים בינוני NAMEC באמצעות ultracentrifugation דיפרנציאלי. בהתבסס על הצפיפות שלהם, EVs ניתן לטהר באמצעות ultracentrifugation ב 110,000 x גרם. ההכנה EV מן ultracentrifugation ניתן להפריד עוד באמצעות שיפוע צפיפות מתמשכת כדי למנוע זיהום עם חלבונים מסיסים. EVs מטוהרים לאחר מכן ניתן להעריך עוד באמצעות ניתוח nanoparticle מעקב, אשר מודד את הגודל ואת מספר שלפוחית בהכנה. שלפוחית תאיים עם גודל הנעים בין 50 ל 150 ננומטר הם exosomes. NAMEC הנגזרות EVs / exosomes ניתן לבלוע על ידי תאים אפיתל החלב, אשר ניתן למדוד על ידי cytometry הזרימה מיקרוסקופיה confocal. כמה תכונות תא גזע החלב ( למשל, יכולת בלוטת החלב יוצרת) יכוליועברו מן NAMECs דמויי גזע לתאי אפיתל החלב באמצעות NAMEC הנגזרות EV / exosomes. מבודד EpCAM היי / CD49f לו תאים luminal החלב epithelial לא יכול ליצור בלוטות החלב לאחר השתלתם לתוך רפידות שומן העכבר, בעוד EpCAM lo / CD49f היי תאים אפיתל החלב הבסיס החלב טופס בלוטות החלב לאחר ההשתלה. ספיגה של NAMEC הנגזרות EV / exosomes על ידי EpCAM היי / CD49f Lo לומינאלי תאים אפיתל החלב מאפשר להם לייצר בלוטות החלב לאחר השתלת לתוך רפידות שומן. ה- EVS / exosomes נגזר כמו תאי גזע כמו אפיתל החלב העברת בלוטת החלב יוצרת יכולת APCAM היי / CD49f lo לומינלית תאים אפיתל החלב.
Introduction
Exosomes יכול לתווך תקשורת סלולרית על ידי העברת חלבונים ממברנה cytosolic, שומנים, ו RNAs בין התאים 1 . תקשורת Exosome בתיווך הוכח להיות מעורב בתהליכים פיזיולוגיים ופתולוגיים רבים ( כלומר, מצגת אנטיגן, התפתחות סובלנות 2 , התקדמות הגידול 3 ). Exosomes לעתים קרובות יש תוכן דומה לאלה של תאים המקור לשחרר אותם. לפיכך, exosomes יכול לשאת מאפייני תאים ספציפיים מתאי המקור ולהעביר תכונות אלה לתאים לבלוע אותם 4 .
Exosomes הם 50 עד 150 ננומטר כפול שכבת קרום שלפוחית ו הנוכחי סמנים ספציפיים ( למשל, CD9, CD81, CD63, HSP70, Alix, ו TSG101). לפיכך, אקסוסומים חייבים להיות מאופיינים בשיטות שונות להיבטים שונים. מיקרוסקופ אלקטרונים הילוכים ניתן להשתמש כדי לדמיין את שלפוחית הממברנהכגון exosomes 4 , 5 . ניתוח מעקף ננו-חלקיקים (NTA) וניתוח פיזור אור דינמי (DLS) משמשים למדידת גודל ומספר אקוסומות מטוהרות 4 . תוכן קרום השומנים של exosomes ניתן לאמת על ידי שיפוע צפיפות. סמנים Exosomal, כגון CD9, CD81, CD63, HSP70, Alix, ו TSG101 6 , 7 , ניתן למדוד על ידי סופג המערבי.
תאי הבסיס החלב יש את היכולת לייצר בלוטות החלב כאשר מושתלים לתוך רפידות שומן, בעוד תאים לומינליים לא יכול 8 , 9 , 10 . לפיכך, תאי הבסיס החלב מכונים גם יחידות repopulating החלב. על ידי שימוש במודל של תאי הבסיס ותאי לומיני החלב, ניתן לבחון את היכולת של EV / exosomes להעביר מאפייני התא בין אוכלוסיות תאים שונות. העבודה הזומדגים את השיטה של העברת יכולת יצירת בלוטות מן תאים אפיתל הבסיס החלב לתאי אפיתל לומינלי החלב באמצעות EVS / exosomes נגזר תאי אפיתל הבסיס החלב. תאים אפיתל החלב לומיני רכשה תכונות תא הבסיס לאחר בליעה של EVs / exosomes מופרשים מתאי הבסיס ולאחר מכן ניתן ליצור בלוטות החלב 4 .
Protocol
כל המחקרים העוסקים בבעלי חיים עמדו בפרוטוקולים שאושרו על ידי הוועדה המוסדית לטיפול בבעלי חיים.
1. שלפוחית תאיים / בידוד exosome ו Validation
- תאים NAMECs 4 , עם מדיום טרי, ללא סרום, עשוי 500 מ"ל של MCDB 170, pH 7.4 + 500 מ"ל של DMEM / F12 עם סודיום ביקרבונט (0.2438%); EGF (5 ng / mL); Hydrocoritisone (0.5 מיקרוגרם / מ"ל); אינסולין (5 מיקרוגרם / מ"ל); תמצית יותרת המוח (BPE, 35 מיקרוגרם / מ"ל); ו GW627368X (1 מיקרוגרם / מ"ל) ב 15 ס"מ מנות.
- לאחר ספירת התאים עם hemocytometer, זרע 1.2 x 10 6 תאים 12 מ"ל של מדיום לכל צלחת 15 ס"מ ביום 0 במשך 4 ימים 4 .
- לאחר 4 ימים בתרבות, צנטריפוגה בינוני תרבות ב XG 300 במשך 5 דקות באמצעות צנטריפוגה שולחן השולחן. מעבירים את supernatant לצינור חרוטי ( איור 1 ).
- צנטריפוגה supernatantב 2000 xg במשך 20 דקות בצנטריפוגה שולחן למעלה. מעבירים את supernatant לצינור ultracentrifuge ולהשאיר את התאים המתים ואת פסולת התא ( איור 1 ).
- צנטריפוגה supernatant ב XG 10,000 במשך 30 דקות ב 4 ° C. מעבירים את supernatant לצינור ultracentrifuge חדש ( איור 1 ).
- צנטריפוגה supernatant ב XG 110,000 עבור 60 דקות ב 4 ° C. הסר את supernatant ו resuspend EV / גלולה exosome ב PBS ( איור 1 ).
- צנטריפוגה supernatant ב XG 110,000 עבור 60 דקות ב 4 ° C. הסר את supernatant. Resuspend EV / גלולה exosome ב PBS ( איור 1 ). Resuspend גלולה מבודד 240-480 מ"ל של המדיום NAMEC מותנה μL 100.
- למדוד את ריכוז החלבון של ההשעיה EV עם assay חלבון BCA. ודא כי הריכוז הוא סביב 20-40 מיקרוגרם / 100 μL. חנות ב -20 מעלות צלזיוס עבורניתוח נוסף.
- למדוד את הריכוז והגודל של EV / exosomes ידי ניתוח nanoparticle מעקב (NTA), כפי שתואר קודם על ידי Gardiner et al. 11 . לדלל את EVs / exosomes (20 מיקרוגרם / 100 μL) עם PBS ל -10,000 לקפל לניתוח NTA.
הערה: תוצאה של ניתוח NTA משקף את מספר וגודל שלפוחית ניתח. - תמונה EVs / exosomes עם מיקרוסקופיה הילוכים אלקטרונית (TEM), כפי שתואר קודם לכן על ידי Lin et al 4 .
2. Exosome טיהור באמצעות שיפוע צפיפות
- Resuspend את גלולה 110,000 גרם משלב 1.7 ב 40% (w / v) iodixanol ב PBS (2 מ"ל). שכבת התערובת ברצף עם aliquots של 30%, 20%, 10%, ו 5% (w / v) iodixanol ב PBS (2 מ"ל כל אחד) כדי ליצור שיפוע צפיפות בצינור ultracentrifuge.
- צנטריפוגה התערובת ב XG 200,000 עבור 8 שעות ב 4 ° C.
- אסוף כל שברי הדרגתי (10 fractiOns; 1 מ"ל / חלק) עם פיפטה מהחלק העליון של הצינור.
- ניתוח נוכחות של סמנים exosome ( למשל, CD81, CD9, CD63, ו Tsg101) בכל חלק על ידי SDS-PAGE 12 כתם המערבי. טען 50-μL השעיות של כל חלק על גבי ג'ל 10% המכיל 0.1% (w / V) SDS ולהפריד את החלבונים שברים עם ג'ל אלקטרופורזה.
- מעבירים את החלבונים מ ג 'ל לקרום PVDF ו דגירה של קרום עם נוגדנים נגד סמנים exosome ( למשל, CD81, CD9, CD63, ו Tsg101) וחלבון GAPDH חלבון לילה ( טבלה של חומרים ) ב 4 ° C.
הערה: התוצאה מזהה את החלק המכיל אקסוסומות.
3. שלפוחית תאיים / Exosome תיוג
- להשעות את EVs / exosomes, שהושג בשלב 1.7, ב 10 מיקרומטר carboxyfluorescein succinimidyl diacetate אסתר (CFSE) ב 20 מיקרוגרם של חלבון אקסוסומלי / 100 μL. הכן משותף מדגם מקבילNene רק CFSE ו PBS, מעובד באותו אופן, כמו שליטה שלילית עבור מבחני EV / evosake מאוחר יותר. השאירו את תערובות ב 37 מעלות צלזיוס למשך 30 דקות.
- להשעות את EVs / exosomes בנפח 50x של PBS ו צנטריפוגה ההשעיה ב XG 110,000 עבור 60 דקות ב 4 ° C. הסר את supernatant ו resuspend גלולה EV / exosome ב PBS. חזור על שלב 3.2 פעם אחת.
- להשעות את EVs / exosomes ב PBS בריכוז של 20 מיקרוגרם של חלבון אקסוסומלי / 100 μL ולאחר מכן לסנן את EVs / exosomes דרך 0.22 מיקרומטר קרום לפני הוספת EVs / exosomes לתאים.
4. שלפוחית תאיים / Exosome Uptake Assay
- כדי להפוך בינוני תרבות, מערבבים 500 מ"ל של MCDB 170, pH 7.4 + 500 מ"ל של DMEM / F12 עם סודיום ביקרבונט (0.2438%); EGF (5 ng / mL); Hydrocoritisone (0.5 מיקרוגרם / מ"ל); אינסולין (5 מיקרוגרם / מ"ל); ו BPE (35 מיקרוגרם / מ"ל) 4 . פלייט בתאי HMLE אפיתל החלב האנושי במנות 6-היטב (1 x 10 6 </ Sup> תאים / טוב) יום לפני טיפול EV / exosome. הוסף 2 מיקרוגרם / מ"ל CFSE הקרינה שכותרתו EVs / exosome, שהושג בשלב 3.3, בינוני התרבות של תאים HMLE עבור 2-6 שעות. טפל בתאי HMLE של קבוצת הביקורת השלילית עם ההכנה המקבילה, המתואר בשלב 3.1.
- לאחר הדגירה 2-6 שעות, לשטוף את התאים פעמיים עם 4 מ"ל של PBS בטמפרטורת החדר.
- לנתק את התאים עם טריפסין 0.25% למשך 10 דקות מחדש להשעות את התאים PBS המכיל 0.2% FBS. למדוד את ספיגה EV / exosome מן עוצמת הקרינה בתאים באמצעות מנתח תא פלואורסצנטי 4 . תמונה התאים שטופלו EVs / exosomes או שליטה שלילית באמצעות מיקרוסקופיה confocal.
הערה: הקרינה הירוקה בתאים נגרמת על ידי ספיגת EV / exosome. ראה את האגדה של איור 6 עבור הגדרות מיקרוסקופ.
בידוד של תאים עכבר ראשי אפיתל החלב
- הכינו מנות מצופות ג'לטין על ידי הוספת 12 מ"ל של פתרון ג'לטין 0.1% ל 10 מנות ס"מ. מניחים את הצלחות 37 ° C חממה למשך 30 דקות. הסר את הפתרון ג'לטין ולהשאיר את המכסים את הכלים במכסה המנוע זרימה למינרית במשך 4 שעות עד ציפוי ג'לטין התייבש.
- לנתח את מספר 2, 3, 4, ו 5 בלוטות החלב ( איור 2 ) מ 12 שבועות בת נקבה C57BL נקבה / 6 עכברים באמצעות מספריים לחתוך את הבלוטות לחתיכות קטנות (2 מ"מ 2 ) באמצעות סכין גילוח.
- עוד לנתק את slurry של בלוטות החלב (במשך 10 דקות) ב 60 דקות ב 37 ° C, 120 תסיסה סל"ד עם 50 מ"ל של DMEM / F12 המכיל 0.2% collagenase סוג IV, 0.2% טריפסין, 5% FBS, 5 מיקרוגרם / מ"ל gentamycin , ו 1x עט סטרפט.
- גלולה את האורגנים אפיתל מן התערובת על ידי צנטריפוגה ב XG 350 במשך 10 דקות.
- להשעות את האורגנים אפיתל ב 4 מ"ל של DMEM / F12 עם 0.1 מ"ג / מ"ל DNase אני 5 דקות בטמפרטורת החדר. הוסף 6 מ"ל של DMEM / F12 לגמרנפח של 10 מ"ל.
- צנטריפוגה ההשעיה ב XG 400 במשך 10 דקות בטמפרטורת החדר להשליך supernatant.
- Resuspend גלולה ב 10 מ"ל של DMEM / F12. צנטריפוגה ההשעיה אבל להכות את הבלם כאשר המהירות מגיעה 400 x גרם. מחק את supernatant.
הערה: על ידי להכות את הבלם, אורגנואידים אפיתל במהירות pelleted למטה, בעוד fibroblasts, כמו תאים בודדים, עדיין להישאר supernatant. - חזור על שלב 5.6 ו -5.7 5-7 פעמים. הוסף ירידה של ההשעיה כדי hemocytometer ולאחר מכן לבדוק את פינוי fibroblasts מן התערובת האורגנואידים תחת מיקרוסקופיה לאחר כל סיבוב של צנטריפוגה ( איור 3 ).
- צלחת את האורגנונים בצלחת ג'לטין מצופה, שהושג בשלב 5.1, במשך 48 שעות עם DMEM / F12 המכיל 1x ITS, 5% FBS, 50 מיקרוגרם / מ"ל gentamycin, 10 ng / מ"ל EGF, ו 1x עט סטרפט.
- לאחר 48 שעות, להסיר את התאים הצפים בתרבות על ידי החלפת המדיום בינוני בינוני טרי ללא FBS (DMEM / F12 המכיל 1x ITS, 50 מיקרוגרם / מ"ל gentamycin, 10 NG / מ"ל EGF, ו 1x עט סטרפט).
- ודא כי monolayer של תאים אפיתל החלב נודדת וצומח מתוך אורגנואידים epithelial המצורפת ב 3 ימים.
6. ההפרדה של ראשי בזלת העכבר / תאים אפיתל לומינל החלב
- לאחר 3 ימים התרבות, לנתק את תאי החלב העיקרי העכבר עם תערובת אנזים טבעי עם פעילות אנזים proteolytic ו collagenolytic במשך 20 דקות. לנטרל את פעילות האנזים עם 5% FBS ב PBS.
- צנטריפוגה ההשעיה ב XG 450 במשך 10 דקות בטמפרטורת החדר להשליך supernatant. Resuspend גלולה התא ב dispes 5 מ"ג / מ"ל במשך 20 דקות. לנטרל את פעילות האנזים עם 5% FBS ב PBS.
- צנטריפוגה ההשעיה ב XG 450 במשך 10 דקות בטמפרטורת החדר להשליך supernatant.
- Re- מושעה התאים μL 100 μL עם 0.2% FBS בריכוז של 10 7 תאים / מ"ל עם מדוללנוגדן אנטי-CD49f ואנטי-APCAM על קרח במשך שעה אחת בחושך.
- לשטוף את התאים עם PBS ולאחר מכן דגירה התאים עם נוגדן משני fluorophore מצומדות על הקרח במשך 30 דקות בחושך.
- לשטוף מחדש להשעות את התאים PBS עם 0.2% FBS.
- מיין את epcam היי / CD49f lo לומינלית תאים אפיתל החלב על סדרן התא 4 .
7. שלפוחית שלפוחיתית / Exosome טיפול
- זרעים ממוינים epCAM היי / CD49f לו לומינל החלב תאים אפיתל משלב 6.7 על ג 'לטין מצופה 6-גם מנות (2 x 10 5 תאים / טוב) ולאחר מכן לטפל בהם עם PBS או 2 מיקרוגרם / מ"ל NAMEC הנגזרות EV / exosomes שהתקבלו בשלב 1.7.
- כדי להבטיח את היעילות הביולוגית של EVs / exosomes בטיפול תרבות לטווח ארוך, להחליף את המדיום תרבות התא בינוני טרי המכיל PBS או 2 מיקרוגרם / מ"ל NAMEC הנגזרות EV / exosomes כל יומיים. אין לפצל את פרימה העכברתאים luminal ry במהלך הטיפול 10 יום.
8. שומן Pad הזרקת תאים אפיתל החלב
- להרדים נקבה C37BL נקבה בת 3 שבועות עם 6 עכברים עם שאיפה 2-3% isofluorane.
- מניחים את העכבר הרדים על גבו. הסר את הפרווה על הבטן באמצע עם קרם גילוח / שיער לנקות את אתר הניתוח עם שלושה מחזורים לסירוגין של אלכוהול 70% פובידון יוד.
- לעשות חתך אנכי 1.5 ס"מ דרך העור לאורך אזור החזה-המעי הגחון במספריים ולאחר מכן לחילופין לחשוף את ימין ושמאל 4 pads שומן החלב.
- נקה כל כרית שומן על ידי הסרת parenchyma בלוטת עם מספריים. אתר את הלימפה הצומת פנקס השומן ולאחר מכן להסיר את פרנכימה הבלוטה כולה מתחת הצומת הלימפה.
הערה: שני שלישים של משטח שומן צריך להישאר במקום. - לנתק את התאים המתקבלים משלב 7.2 עם תערובת אנזים טבעי (ראה טבלה של חומרים ) עם proteolytic אפעילות אנזים קולגניוליטי במשך 10 דקות. לנטרל את פעילות האנזים עם 5% FBS ב PBS.
- צנטריפוגה ההשעיה ב XG 450 במשך 10 דקות בטמפרטורת החדר להשליך supernatant. לספור את התאים עם hemocytometer ולהשעות את התאים PBS בריכוז כזה μL 15 מכיל את המינון התא הרצוי (10 4 -10 2 תא / כרית).
- להזריק 15 μL של ההשעיה תא אפיתל החלב לתוך משטח שומן באמצעות מזרק זכוכית 100 μL המצורפת מחט 27G.
- חזור על שלבים 8.4-8.7 עבור משטח שומן בצד השני.
- סגור את העור עם קליפים הפצע.
9. בלוטת החלב הר שלם
- להרדים את העכבר עם CO 2 פלוס צוואר הרחם ב 8 שבועות לאחר הזרקת התא (שלב 8.7).
- ביצוע חתך אנכי דרך שכבת העור מאזור החזה לאזור המפשעה באמצעות מספריים ולאחר מכן לחשוף את ימין ושמאל 4 מ 'רפידות שומן אמריות. הסר את בלוטות החלב 4 ( איור 2 ).
- מורחים את רפידות שומן על שקופיות מיקרוסקופ זכוכית לתקן את רפידות שומן עם מקבע של Kahle (פורמלדהיד 4%, EtOH 30%, ו 2% חומצה אצטית קרח) בטמפרטורת החדר לילה.
זהירות: מקבע של Kahle הוא מגרה. בצע שלב זה ברדס כימי. - לשטוף את כריות שומן 250 מ"ל של EtOH 70% במשך 15 דקות ולאחר מכן ב 250 מ"ל של DH 2 O במשך 5 דקות. כתם את רפידות שומן עם alum carmine (1 גרם של carmine ו -2.5 גרם של אלומיניום גופרתי אשלגן 500 מ"ל של DH 2 O) בטמפרטורת החדר לילה.
- לשטוף את כריות שומן עם 250 מ"ל של EtOH 70% במשך 15 דקות, 250 מ"ל של EtOH 95% במשך 15 דקות, ו 250 מ"ל של EtOH 100% במשך 15 דקות.
- נקו את כריות השומן בקסילן במשך ימים ועצרו את דגירה של קסילן כאשר רפידות השומן הופכות שקופות.
זהירות: קסילן הוא מגרה. בצע שלב זה ברדס כימי. - הר שקופיות wiבינוני גובר ולקחת תמונות (2,400 dpi) של רפידות שומן באמצעות סורק שקופיות דיגיטלי.
תוצאות
מאז הוכח כי חסימת PGE 2 / EP 4 איתות מפעילה EV / שחרור exosome מתאי גזע דמויי הבסיס החלבני 4 , עבודה זו מציגה שיטה לבידוד EVs המושרה / exosomes מתרבות תא אפיתל החלב (NAMEC) החלב. מאז NAMECs הם מתורבת בינוני ללא סרום, אין קיימים EV / exosomes נגזר 13 בסרום. עבור תאים מתורבת בינוני המכיל בסרום, exosomes מראש קיים במדיום יש לנקות מראש על ידי ultracentrifugation ב 110,000 xg לפני המדיום משמש לתרבות תאים המקור עבור אוסף של EVs / exosomes 5 . EVs / exosomes מ 4 ימים המושרה NAMEC בינוני מותנה יכול להיות מבודד מן גלולה 110,000 XG ידי ultracentrifugation דיפרנציאלי, כפי שמוצג באיור 1 . מספר וגודל של שלפוחית בודדת של 110,000 xg גלEt ניתן למדוד באמצעות ניתוח מעקב nanoparticle (NTA). החלק 110,000-g גלולה מבודד על ידי ultracentrifugation דיפרנציאלי מכיל בעיקר ~ 100 ננומטר נמק ( איור 4 א ); זה מתאים לגודל של exosomes (50-150 ננומטר) שדווחו בספרות. בנוסף, ניתוח TEM הראה כי 110,000 גרם שברים של המדיום NAMEC מותנה מכילים שפע של קרום שלפוחית ( איור 4 ב ). למרות ultracentrifugation דיפרנציאלי יכול ליצור exosomes טהור סביר, שלב ההטיה הבאה באמצעות שיפוע צפיפות נוספת מבטלת מזהמים ( למשל, אגרגטים חלבון) 5 . ב שיפוע צפיפות, exosomes לצוף ב שיפוע בגלל התוכן השומנים שלפוחית, בעוד אגרגטים חלבון, אם בכלל, להישאר בתחתית שיפוע. כל חלק של שיפוע נאסף על גילוי של יצרני exosome ( למשל, CD81, CD63, CD9, ו TSG101 6 , 7 ) על ידי המערבי סופג. סמנים Exosome ניתן לאתר את השבר עם ~ 20% iodixanol ( איור 5 ). השבר המכיל exosomes יכול להיות מדולל עם PBS ונתונה 200,000 xg ultracentrifugation לבודד את exosomes. גלולה exosome מבודד נשטף פעם PBS ולאחר מכן הוא resuspended ב PBS ומאוחסנים ב -20 מעלות צלזיוס לניתוח נוסף.
לפני מדידה של ספיגה של NAMEC הנגזרות EV / exosomes על ידי הלא גזע גזע של תאים אפיתל החלב, תאים HMLE- EVs / exosomes חייב להיות מתויג עם צבע ניאון ( למשל, carboxyfluorescein succinimidyl אסתר (CFSE)). מדגם מקביל המכיל רק CFSE אבל לא EV / exosome מעובד באותו הליך תיוג. מדגם זה הוא שליטה שלילית המשמשים את assay EV / exosome ספיגה הבאה כדי לשקף את ההשפעה של כמות עקבות של CFS חינם שיוריתצבע. תאים HMLE הם מתורבת עם CFSE שכותרתו, NAMEC הנגזרות EVs / exosomes או שליטה שלילית עבור 2-6 שעות ולאחר מכן נתון cytometry הזרימה. בהשוואה לתאי HMLE שלא טופלו, תאים HMLE מתורבת עם שליטה שלילית להביע רמה גבוהה מעט יותר של האות CFSE ( איור 6A , קו אדום לעומת קו כתום), אשר משקף את רמת הרקע של איתות CFSE שנגרם על ידי CFSE חינם שיורית שנותרה EV / תיוג exosome התהליך. יתר על כן, בהשוואה לתאים שלילי HMLE שליטה שלילי, תאים HMLE מתורבת עם CFSE שכותרתו, NAMEC הנגזרות exosomes להביע 10 פי גבוה יותר CFSE האות ( איור 6A , קו כחול לעומת קו אדום), אשר נובע ספיגה ספציפית של CFSE שכותרתו EVs / exosomes. ספיגה של CFSE שכותרתו, NAMEC הנגזרות EVs / exosomes על ידי תאים HMLE יכול גם להיות שנצפה על ידי מיקרוסקופיה confocal. בעוד תאים שליליים שטופלו בשליטה HMLE אינם מציגים אות CFSE, ספיגה של NAMEC- נגזר EVS / exosomes על ידי תאים HMLE ניתן לראות עם האות CFSE תחת מיקרוסקופ confocal ב CFSE שכותרתו EV / exosome שטופלו תאים ( איור 6 ב ).
כדי להעריך אם NAMEC הנגזרות EVs / exosomes יכול להעביר את בלוטת החלב יוצרי יכולת גזע כמו תאי גזע החלב לתאי לומיני החלב, תאים luminal החלב עכבר מבודדים הראשון כדי לאפשר ניתוח של היווצרות בלוטת החלב בעכברים. תאים עכבר אפיתל החלב מבודדים 12 עכברים בן שבוע. בלוטות החלב נחתכים לחתיכות קטנות יותר מנותקים עם collagenase ו טריפסין. את האורגניזמים ניתוק פיברובלסטים ניתק ניתן להפריד על ידי צנטריפוגה ההפרש, כמתואר צעדים 5.7 ו 5.8. בכל סיבוב של צנטריפוגה, גלולה בחלק התחתון של הצינורות צריך להכיל בעיקר אורגנואידים אפיתל, fibroblasts ותאים בודדים צריך לצוף supernatan T. בהשוואה לתערובת המכילה הן אורגנואידים אפיתל fibroblasts לפני צנטריפוגה ההפרש ( איור 3 , לוחות העליונים), שישה סיבובים של צנטריפוגה לנקות את רוב fibroblasts ותאים בודדים בתערובת ( איור 3 , הלוח התחתון).
תאים אפיתל החלב ( איור 7 ) של האורגנים אפיתל הם ניתק עוד יותר באמצעות תערובת אנזים טבעי עם פעילות אנזים proteolytic ו collagenolytic ו dispase לייצר תאים בודדים ההשעיה. מיון ההשעיה החד תאית על ידי הביטוי של משטח CD49f ואפיקם יכולים להפריד בין תאים לומינליים החלבניים (EpCAM היי / CD49f lo ), תאי הבסיס החלביים (EpCAM lo / CD49f hi ), ותאים לא אפיתליים (EpCAM - ) ( איור 8 ).
N-page = "1"> תאי אפיתל מבודדים של EpCAM Hi / CD49f luminal luminal הם מתורבתים עם NAMEC- נגזרות EV / exosomes במשך 10 ימים, ואת EVs טרי / exosomes ואת המדיום מוחלפים כל יומיים. לאחר טיפול EV / exosome, תאים luminal החלב הם implanted לתוך 4 pads שומן החלב ( איור 2 ) של עכברים. לאחר 8 שבועות, רפידות שומן מבודדים ומוכתמים לניתוח של היווצרות בלוטת החלב ( איור 9 ). הטיפול עם המושרה NAMEC הנגזרות EVs / exosomes מאפשר תאים לומינל לרכוש בלוטת החלב יוצרת יכולת 4 . NAMEC הנגזרות, EV / exosome שטופלו תאים luminal החלב טופס בלוטות החלב רפידות שומן העכבר ( איור 9 ).

איור 1: איור של אקסטרהR שלפוחית / Exosome Puriation שיטה שיטה מתרבות תאים בינוני על ידי Ultracentrifugation דיפרנציאלי. מהירות ואורך של צנטריפוגה כל מסומנים. לאחר כל שלוש צנטריפוגות ראשונות, סופרנטאנט נשמר לשלב הבא. לאחר 110,000 × גרם צנטריפוגות, כדורי נשמרים supernatants מושלך. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
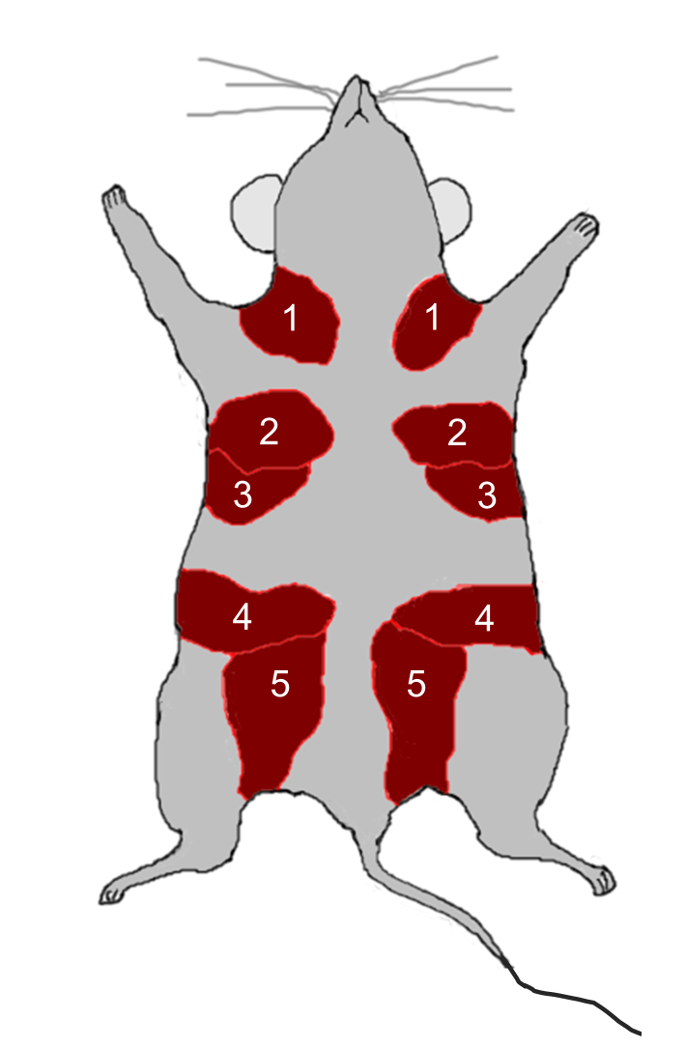
איור 2: עכבר בלוטת החלב אנטומיה. עכברים יש חמישה זוגות של בלוטות החלב, מסומן על ידי המספרים 1-5, הממוקם כריות שומן (אדום) ישירות מתחת לעור. אנא לחץ כאן כדי להציג גרסה גדולה יותר של ההוא דמות.

איור 3: תמונות של תערובת של אפרואידים אפיתל ותאי כריות שומן לפני ואחרי צנטריפוגה ההפרש. תמונות מבריקות של תערובות תאי השומן המבודדות לפני ואחרי הצנטריפוגה הדיפרנציאלית, שנלקחו מהמומוציטומטר. חץ: אורגנואידים אפיתל. חץ: fibroblasts ותאים בודדים. קנה מידה בר = 0.5 מ"מ. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
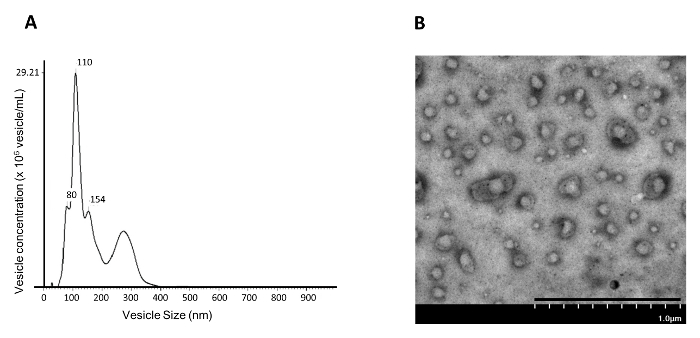
איור 4: גודל שלפוחית ניתוח ריכוז של NAMEC110,000 xg גלולה חלק. 110,000 גרם חלק גלולה של המדיום NAMEC הוא קול הרצאה ונתונה ( A ) ננו מעקב חלקיקים ניתוח (NTA) ו ( ב ) מיקרוסקופית שידור electronlectron (TEM). סולם בר = 1 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.

איור 5: גילוי Exosomes שברים של צפיפות הדרגתיות. ניתוח כתם המערבי של סמנים exosome CD81, CD9, CD63, ו Tsg101 ו GkeepingD משק הבית מגלה את החלק 20 iodixanol המכיל את exosomes. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
55736fig6.jpg "/>
איור 6: זיהוי שלפוחית שלפוחיתית / Exosome ספיגת ידי cytometry זרימה מיקרוסקופיה confocal. EV / exosome ספיגה נמדדה בתאי HMLE. CFSE שכותרתו, NAMEC הנגזרות EVs / exosomes ושליטה שלילית מתווספים התרבויות שצוינו עבור 6 שעות. לאחר הדגירה, התאים נתונים ( א ) cytometry זרימה ו ( B ) מיקרוסקופיה confocal. ה- CFSE (ירוק, עירור / פליטה (ננומטר): 492/517, קו לייזר מיקרוסקופ: 488) עוצמות פלואורסצנציה מחדש את ספיגה EV / exosome. גרעיני תאים מוכתמים ב- DAPI (כחול: עירור / פליטה (nm): 358/461, קו לייזר מיקרוסקופ: 405) וקרום הפלזמה מוכתמים בכתם קרום פלסמה (אדום, עירור / פליטה): 649/666; לייזר קו מיקרוסקופ: 633, לראות את לוח החומרים ). עדשה אובייקטיבית confocal: HCX PL APO 63x / 1.40-0.60 שמן. סולם בר = 20 מיקרומטר.Ad / 55736 / 55736fig6large.jpg "target =" _ blank "> לחץ כאן כדי לראות גרסה גדולה יותר של דמות זו.
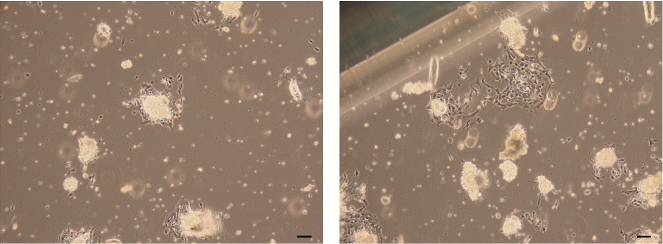
איור 7: תמונות של מצבים אפיתל מצורף. תמונות מוארות של תאי אפיתל החלב שנוצרו על ידי התאים נודדים וצומחים מתוך האורגנים הצמודים לאפיתל. סולם בר = 100 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.

איור 8: מיון של תאים עכבר ראשי אפיתל החלב על ידי משטח EpCAM ו CD49f. תאים עכבר אפיתל החלב מבודדים רפידות שומן של 12 שבועות עכברים ישנים נתונים למיון התא. תאים luminal עכבר החלב מועשרים באוכלוסייה APCAM היי / CD49f lo , המסומנים במעגל כחול; התאים הבזליים הועשרו באוכלוסיית APCAM lo / CD49f, המסומנים במעגל האדום. תאים שאינם אפיתל מסומנים בקופסה השחורה בחלקה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.

איור 9: היווצרות בלוטת החלב על ידי תאים ראשיים של תא לומינל לומינל. העכבר הראשי EpCAM היי / CD49f תאים לומינליים Lo מטופלים עם PBS או NAMEC הנגזרות EV / exosomes בתרבות תאים במשך 10 ימים ו מושתלים לתוך כריות שומן משוחרר של עכברים בן שלושה שבועות. עכברים מורדמים ו necropsied לאחר 8 שבועות כדי לנתח את צורת בלוטת החלבAtion. סרגל קנה מידה = 0.75 ס"מ. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
| אֲחוּזִים | MFI של EpCAM | MFI של CD49f | |
| תא לומינלי החלב | 0.437 | 4.57 x 10 4 | 8183 |
| (EpCAM היי / CD49f lo ) | |||
| תא הבסיס הבסיסי | 0.09 | 5452 | 2.23 x 10 4 |
| (EpCAM lo / CD49f היי ) | |||
| לא אפיתלתא (EpCAM - ) | 0.309 | 53 | 4619 |
טבלה 1: אחוז ועוצמת הקרינה הממוצעת (MFI) של האוכלוסיות המתוארות באיור 8.
Discussion
Exosomes לעתים קרובות לשאת מאפיינים של התאים ששחררו אותם, ואת כמות exosomes שוחרר יכול להיגרם על ידי גירויים 4 . המדיום התרבות של תאים ניתן לאסוף ונתונה ultracentrifugation דיפרנציאלי עבור EV / אוסף exosome ( איור 1 ). אין כרגע הסכמה כללית על שיטה אידיאלית לבודד EVS / exosomes. השיטה האופטימלית הנהוגה כאן נקבעה על ידי היישום במורד הזרם 14 . Ultracentrifugation היא שיטה מהירה יחסית לבידוד EV / exosomes, אשר יכול לשמר את הפעילות הביולוגית של EVs / exosomes. עם זאת, שלפוחית מבודד על ידי ultracentrifugation בדרך כלל מכילים תערובת של EVS, אשר מכילים exosomes המיוצרים באמצעות תאים endosomal ו / או שלפוחית המיוצר באמצעות ניצני מקרום התא.
על ידי ניתוח הגדלים של שלפוחית עם NTA ( איור 4 א ), את שלפוחית נמצא לטהר ב 110,000 XG במהלך ultracentrifugation ההפרש היו בעיקר 50-150 ננומטר, אשר מתאים לגודל של exosomes. נתוני NTA עולה כי exosomes הנגזרות NAMEC יכול להיות מבודד מן המדיום תרבות ב 110,000 XG במהלך ultracentrifugation דיפרנציאלי. עם זאת, NTA ו TEM הציג כאן רק לאפשר הדמיה של שלפוחית או מדידה של גודל ומספר של כל האוכלוסייה EV. טכניקות אלה אינן יכולות למדוד את ההטרוגניות של אוכלוסיות EV או אפילו למיין את אוכלוסיות EV הטרוגניות. מדענים החלו לפתח שיטות לשימוש cytometers זרימה לנתח ומיון אוכלוסיות EV 15 .
למרות ultracentrifugation דיפרנציאלי ניתן להשתמש כדי לטהר exosomes, שיפוע צפיפות יש להשתמש כדי להסיר עוד את הזיהום של אגרגטים חלבון מן שלפוחית exosome ב 110,000 xg מבודד חלק 5 למשל, CD81, CD63, CD9, ו TSG101 6 , 7 ). על ידי ניתוח נוכחות של סמנים exosome בשברים של שיפוע צפיפות, ניתן לזהות exosomes בשבר עם ~ 20% iodixanol ( איור 5 ). יש לבדוק סמנים אקוסומיים מרובים על מנת לזהות אקסוסומים בצפיפות הצפיפות, שכן כל אוכלוסיית אקסוסומים יכולה להביע סמני אקסוסום שונים 16 .
ספיגה של EVs / exosomes על ידי תאים ניתן למדוד באמצעות צבעי פלורסנט שכותרתו EVS / exosomes. מספר תאים לבלוע שכותרתו EVs / exosomes ניתן למדוד cytometry הזרימה ( איור 6 א ). כדי לאשר כי fluoהתעוררות מן התאים תוצאה של ספיגה של EVs שכותרתו / exosomes אבל לא מתוך צבע חינם, דפוס של הקרינה נבדקה בתאים באמצעות מיקרוסקופ. מיקרוסקופיה confocal מראה כי דפוס של הקרינה בתאים EV / exosome שטופלו הוא לדקלם ( איור 6B הפאנל הימני). האותות לנקב סביר תוצאה של EVs שכותרתו / exosomes, לא מן הקרינה חינם. האותות לדקלם בתאים ניתן לנתח עוד יותר עם תאורה מובנית מיקרוסקופ ברזולוציה סופר, אשר יש את הרזולוציה הגבוהה ביותר ב 85 ננומטר 4 , 17 . מיקרוסקופ ברזולוציה גבוהה יכול לאשר כי האותות לנקב הם מ ~ 100 ננומטר שלפוחית חלולה, אשר דומים exosomes 4 . תוצאות אלו מראות כי אקסוסומים הנגזרות מ- NAMEC ניתן לבלוע על ידי תאי אפיתל החלב בתרבות.
NAMEC הנגזרות EV / exosomes לעתים קרובות לשאת מולקולות ( למשל, חלבונים ו miRNAs) חיוני למאפיינים של תאים מסוימים 1 . זה מצביע על כך NAMEC הנגזרות EVs / exosomes יכול להעביר את המאפיינים של NAMECs ( למשל בלוטת החלב יוצרי היכולת) אל עמיתיהם תא אפיתל. מאז תאים אנושיים אפיתל החלב לא יכול ליצור בלוטות החלב xenogeneically בשעורי שומן העכבר 18 , 19 , את העברת יכולת בלוטת להרכיב ניתן לבדוק באמצעות תאים עכבר העיקרי אפיתל החלב. עכבר העיקרי חלבון EpCAM היי / CD49f לו תאים luminal, אשר אינם מהווים בלוטות החלב, ניתן לבודד עכברים בן 6 שבועות ( איור 7 ו איור 8 ). תאים מבודדים של כריות שומן העכבר ניתן לחלק לשלוש קבוצות ( כלומר, EpCAM היי / CD49f תאים luminal lo , EpCAM lo / CD49f תאים הבסיסיים היי , ו EpCAM - תאים שאינם אפיתל) על ידי בחינת leולס של משטח EpCAM ו CD49f ( איור 8 ). EpCAM lo / CD49f היי תאים הבסיאלי יכול ליצור בלוטות החלב שומן fads כאשר המושתלים לתוך רפידות שומן, אבל EpCAM היי / CD49f תאים לומינל לא יכול 4 . לפיכך, APCAM היי / CD49f Lo האוכלוסייה luminal התא ניתן להשתמש כדי לבחון את היכולת של NAMEC הנגזרות EVs / אקסוסומות להעביר יכולת בלוטת החלב להרכיב. את מבודד epcam היי / CD49f תאים luminal יכול להישמר בתרבות במשך 7-10 ימים עבור EV / exosome טיפול 4 . יש לציין כי שמירה על תאים אפיתל החלב העיקרי במבחנה למשך זמן ארוך יותר יכול להחליש את הכדאיות של התאים.
תאי ה- luminal החלביים שטופלו ב- EV / exosome יכולים להיות מושתלים לתוך כריות שומן משוחררות כדי לנתח את יכולת יצירת החלב. כריות שומן של עכברים המשמשים להשתלה יש לנקות בגיל 3 שבועות. אT 3 שבועות של גיל, תאי אפיתל החלב מוגבלים באזור בין הפטמה ואת הלימפה של כרית שומן. אפיתל החלב בפנקס שומן ניתן לנקות על ידי הסרת האזור בין הפטמה הלימפה בגיל 3 שבועות. תאים luminal החלב מושתלים מיד לאחר ניקוי כרית שומן, ואת היווצרות הבלוטה על ידי תאים מושתלים ניתן לנתח ב 8 שבועות לאחר ההשתלה. ההשפעה של NAMEC הנגזרות EVs / exosomes על העברת בלוטת החלב יוצרי יכולת תאים luminal החלב ניתן להעריך על ידי היווצרות בלוטות של תאים לומינליים ו EV / exosome שטופלו תאים לומינל ( איור 9 ). ה- EVS המושרה / Exosomes מ NAMECs לשאת את המאפיין של תאים אפיתל הבסיס החלב - בלוטת ויוצרים היכולת - ואת התאים luminal כי לבלוע EVs המושרה / exosomes מ NAMECs יכול לרכוש את הנכס מ NAMECs דרך EVs / exosomes. עבודה זו ממחישה ראיות המראות כי מולקולות האחראים EV / exosome-mediaTed העברה של בלוטת החלב יוצרות היכולת נמצאים רפסודות שומנים של EVS / exosomes 4 .
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי מענקים מהמכון הלאומי לחקר הבריאות (05A1-CSPP16-014, HJL) וממשרד המדע והטכנולוגיה (MOST 103-2320-B-400-015-MY3, HJL).
Materials
| Name | Company | Catalog Number | Comments |
| MCDB 170 | USBiological | M2162 | |
| DMEM/F12 | Thermo | 1250062 | |
| Optima L-100K ultracentrifuge | Beckman | 393253 | |
| SW28 Ti Rotor | Beckman | 342204 | |
| SW41 Rotor | Beckman | 331306 | |
| NANOSIGHT LM10 | Malvern | NANOSIGHT LM10 | for nanoparticle tracking analysis (NTA) |
| Optiprep | Sigma-Aldrich | D1556 | 60% (w/v) solution of iodixanol in water (sterile). |
| CD81 antibody | GeneTex | GTX101766 | 1:1,000 in 5% w/v nonfat dry milk, 1x TBS, 0.1% Tween 20 at 4 °C, overnight |
| CD9 antibody | GeneTex | GTX100912 | 1:1,000 in 5% w/v nonfat dry milk, 1x TBS, 0.1% Tween 20 at 4 °C, overnight |
| CD63 antibody | Abcam | Ab59479 | 1:1,000 in 5% w/v nonfat dry milk, 1x TBS, 0.1% Tween 20 at 4 °C, overnight |
| TSG101 antibody | GeneTex | GTX118736 | 1:1,000 in 5% w/v nonfat dry milk, 1x TBS, 0.1% Tween 20 at 4 °C, overnight |
| GAPDH | GeneTex | GTX100118 | 1:6,000 in 5% w/v nonfat dry milk, 1x TBS, 0.1% Tween 20 at 4 °C, overnight |
| CFSE (carboxyfluorescein succinimidyl diacetate ester) | Thermo | V12883 | |
| FACSCalibur | BD Biosciences | fluorescence cell analyzer | |
| collagenase Type IV | Thermo | 17104019 | |
| trypsin | Thermo | 27250018 | |
| ITS | Sigma-Aldrich | I3146 | a mixture of recombinant human insulin, human transferrin, and sodium selenite |
| accutase | ebioscience | 00-4555-56 | a natural enzyme mixture with proteolytic and collagenolytic enzyme activity |
| dispase | STEMCELL | 7913 | 5 mg/mL = 5 U/mL |
| anti-CD49f antibody | Biolegend | 313611 | 1:50 |
| anti-EpCAM antibody | Biolegend | 118213 | 1:200 |
| FACSAria | BD Biosciences | cell sorter | |
| carmine alum | Sigma-Aldrich | C1022 | |
| human mammary epithelial cells (HMLE cells, NAMECs) | gifts from Dr. Robert Weinberg | ||
| permount | Thermo Fisher Scientific | SP15-500 | |
| sodium bicarbonate | Zymeset | BSB101 | |
| EGF | Peprotech | AF-100-015 | |
| Hydrocoritisone | Sigma-Aldrich | SI-H0888 | |
| Insulin | Sigma-Aldrich | SI-I9278 | |
| BPE (bovine pituitary extract) | Hammod Cell Tech | 1078-NZ | |
| GW627368X | Cayman | 10009162 | |
| 15 cm culture dish | Falcon | 353025 | |
| table-top centrifuge | Eppendrof | Centrifuge 3415R | |
| ultracentrifuge tube | Beckman | 344058 | |
| PBS (Phosphate-buffered saline) | Corning | 46-013-CM | |
| BCA Protein Assay | Thermo Fisher Scientific | 23228 | |
| Transmission Electron Microscopy | Hitachi | HT7700 | |
| gelatin | STEMCELL | 7903 | |
| 10 cm culture dish | Falcon | 353003 | |
| 6-well culture dish | Corning | 3516 | |
| female C57BL/6 mice | NLAC (National Laboratory Animal Center | ||
| FBS (Fetal Bovine Serum) | BioWest | S01520 | |
| gentamycin | Thermo Fisher Scientific | 15710072 | |
| Pen/Strep | Corning | 30-002-Cl | |
| DNase I | 5PRIMER | 2500120 | |
| isofluorane | Halocarbon | NPC12164-002-25 | |
| formaldehyde | MACRON | H121-08 | |
| EtOH (Ethanol) | J.T. Baker | 800605 | |
| glacial acetic acid | Panreac | 131008.1611 | |
| aluminum potassium sulfate | Sigma-Aldrich | 12625 | |
| Xylene | Leica | 3803665 | |
| 0.22 μm membranes | Merck Millipore | Millex-GP | |
| AUTOCLIP Wound Clips, 9 mm | BD Biosciences | 427631 | |
| AUTOCLIP Wound Clip Applier | BD Biosciences | 427630 | |
| CellMask™ Deep Red | Thermo Fisher Scientific | C10046 | plasma membrane stain |
References
- Simons, M., Raposo, G. Exosomes--vesicular carriers for intercellular communication. Curr Opin Cell Biol. 21 (4), 575-581 (2009).
- Théry, C., Ostrowski, M., Segura, E. Membrane vesicles as conveyors of immune responses. Nat Rev Immunol. 9 (8), 581-593 (2009).
- Boelens, M., et al. Exosome Transfer from Stromal to Breast Cancer Cells Regulates Therapy Resistance Pathways. Cell. 159 (3), 499-507 (2014).
- Lin, M. C., et al. PGE2 /EP4 Signaling Controls the Transfer of the Mammary Stem Cell State by Lipid Rafts in Extracellular Vesicles. Stem Cells. , (2016).
- Théry, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Curr Protoc Cell Biol. , (2006).
- György, B., et al. Membrane vesicles, current state-of-the-art: emerging role of extracellular vesicles. Cell Mol Life Sci. 68 (16), 2667-2688 (2011).
- Olver, C., Vidal, M. Proteomic analysis of secreted exosomes. Subcell Biochem. 43, 99-131 (2007).
- Shackleton, M., et al. Generation of a functional mammary gland from a single stem cell. Nature. 439 (7072), 84-88 (2006).
- Prater, M. D., et al. Mammary stem cells have myoepithelial cell properties. Nat Cell Biol. 16 (10), 942-950 (2014).
- Stingl, J., et al. Purification and unique properties of mammary epithelial stem cells. Nature. 439 (7079), 993-997 (2006).
- Gardiner, C., Ferreira, Y. J., Dragovic, R. A., Redman, C. W., Sargent, I. L. Extracellular vesicle sizing and enumeration by nanoparticle tracking analysis. J Extracell Vesicles. 2, (2013).
- Shapiro, A. L., Viñuela, E., Maizel, J. V. Molecular weight estimation of polypeptide chains by electrophoresis in SDS-polyacrylamide gels. Biochem Biophys Res Commun. 28 (5), 815-820 (1967).
- Riches, A., Campbell, E., Borger, E., Powis, S. Regulation of exosome release from mammary epithelial and breast cancer cells - a new regulatory pathway. Eur J Cancer. 50 (5), 1025-1034 (2014).
- Witwer, K. W., et al. Standardization of sample collection, isolation and analysis methods in extracellular vesicle research. J Extracell Vesicles. 2, (2013).
- van der Vlist, E. J., Nolte-'t Hoen, E. N., Stoorvogel, W., Arkesteijn, G. J., Wauben, M. H. Fluorescent labeling of nano-sized vesicles released by cells and subsequent quantitative and qualitative analysis by high-resolution flow cytometry. Nat Protoc. 7 (7), 1311-1326 (2012).
- Kowal, J., et al. Proteomic comparison defines novel markers to characterize heterogeneous populations of extracellular vesicle subtypes. Proc Natl Acad Sci U S A. 113 (8), E968-E977 (2016).
- Li, D., et al. ADVANCED IMAGING. Extended-resolution structured illumination imaging of endocytic and cytoskeletal dynamics. Science. 349 (6251), (2015).
- Outzen, H. C., Custer, R. P. Growth of human normal and neoplastic mammary tissues in the cleared mammary fat pad of the nude mouse. J Natl Cancer Inst. 55 (6), 1461-1466 (1975).
- Sheffield, L. G., Welsch, C. W. Transplantation of human breast epithelia to mammary-gland-free fat-pads of athymic nude mice: influence of mammotrophic hormones on growth of breast epithelia. Int J Cancer. 41 (5), 713-719 (1988).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved