Method Article
Übertragung der Mamma-Drüsen-bildenden Fähigkeit zwischen Mamma-Basal-Epithelzellen und Mamma-Luminalzellen über extrazelluläre Vesikel / Exosomen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt Verfahren zur Reinigung, Quantifizierung und Charakterisierung von extrazellulären Vesikeln (EVs) / Exosomen aus nicht adhärenten / mesenchymalen Mamma-Epithelzellen und zur Verwendung derselben zur Übertragung der Brustdrüsen-bildenden Fähigkeit zu luminalen Mamma-Epithelzellen. EVs / Exosomen, die aus Stamm-ähnlichen Mamma-Epithelzellen gewonnen werden, können diese Zell-Eigenschaft in Zellen übertragen, die die EVs / Exosomen einnehmen.
Zusammenfassung
Zellen können über Exosomen, ~ 100-nm extrazelluläre Vesikel (EVs), die Proteine, Lipide und Nukleinsäuren enthalten, kommunizieren. Nicht adhärierende / mesenchymale Mamma-Epithelzellen (NAMEC) -gesteuerte extrazelluläre Vesikel können aus NAMEC-Medium durch differentielle Ultrazentrifugation isoliert werden. Basierend auf ihrer Dichte können EVs durch Ultrazentrifugation bei 110.000 x g gereinigt werden. Die EV-Präparation aus der Ultrazentrifugation kann unter Verwendung eines kontinuierlichen Dichtegradienten weiter getrennt werden, um eine Kontamination mit löslichen Proteinen zu verhindern. Die gereinigten EVs können dann mit Hilfe der Nanopartikel-Tracking-Analyse weiter ausgewertet werden, die die Größe und Anzahl der Vesikel in der Präparation misst. Die extrazellulären Vesikel mit einer Größe von 50 bis 150 nm sind Exosomen. Die NAMEC-abgeleiteten EVs / Exosomen können von Mamma-Epithelzellen aufgenommen werden, die durch Durchflusszytometrie und konfokale Mikroskopie gemessen werden können. Einige Mamma-Stammzellen-Eigenschaften ( z. B. Brustdrüsen-bildende Fähigkeit) könnenVon den Stamm-ähnlichen NAMECs zu den Mamma-Epithelzellen über die NAMEC-abgeleiteten EVs / Exosomen übertragen werden. Isolierte primäre EpCAM hi / CD49f lo luminalen Mamma Epithelzellen können keine Mammadrüsen bilden, nachdem sie in Mausfettkissen transplantiert wurden, während EpCAM lo / CD49f hi basale Mammaepithelzellen nach der Transplantation Mamidrüsen bilden. Aufnahme von NAMEC-abgeleiteten EVs / Exosomen durch EpCAM hi / CD49f lo luminalen Mamma-Epithelzellen ermöglicht es ihnen, Brustdrüsen zu erzeugen, nachdem sie in Fettpolster verpflanzt wurden. Die aus stammähnlichen Mamma-Epithelzellen gewonnenen EVs / Exosomen übertragen die Brustdrüsen-bildende Fähigkeit zu EpCAM hi / CD49f-luminalen Mamma-Epithelzellen.
Einleitung
Exosomen können die zelluläre Kommunikation durch Übertragung von Membran und zytosolischen Proteinen, Lipiden und RNAs zwischen den Zellen vermitteln. Es wurde gezeigt, dass die Exosomen-vermittelte Kommunikation in viele physiologische und pathologische Prozesse involviert ist ( dh die Antigenpräsentation, die Entwicklung der Toleranz 2 und die Tumorprogression 3 ). Exosomen haben oft ähnliche Inhalte wie die Quellzellen, die sie freisetzen. So können die Exosomen spezifische Zelleigenschaften aus den Quellzellen tragen und diese Eigenschaften an die Zellen übertragen, die sie einnehmen 4 .
Exosomen sind 50- bis 150-nm-Doppelschicht-Membran-Vesikel und präsentieren spezifische Marker ( zB CD9, CD81, CD63, HSP70, Alix und TSG101). So müssen Exosomen durch verschiedene Methoden für verschiedene Aspekte charakterisiert werden. Die Transmissionselektronenmikroskopie kann zur Visualisierung von Membranblasen verwendet werdenWie Exosomen 4 , 5 . Nanopartikel-Tracking-Analyse (NTA) und dynamische Lichtstreuungsanalyse (DLS) dienen zur Messung der Größe und Anzahl der gereinigten Exosomen 4 . Der Lipidmembrangehalt von Exosomen kann durch Dichtegradient verifiziert werden. Exosomale Marker wie CD9, CD81, CD63, HSP70, Alix und TSG101 6 , 7 können durch Western Blotting gemessen werden.
Mamma-Basalzellen haben die Fähigkeit, Milchdrüsen zu erzeugen, wenn sie in fette Pads implantiert werden, während Luminalzellen nicht 8 , 9 , 10 sein können . So werden Mamma-Basalzellen auch als Mamma-Repopulationseinheiten bezeichnet. Durch die Verwendung des Modells der Mamma-Basal- und Luminalzellen kann die Fähigkeit von EVs / Exosomen, Zellcharakteristiken zwischen verschiedenen Zellpopulationen zu übertragen, untersucht werden. Diese ArbeitZeigt die Methode der Übertragung von Drüsenbildungsfähigkeit von Mamma-Basal-Epithelzellen zu Mamma-Lumen-Epithelzellen unter Verwendung von EVs / Exosomen, die aus Mamma-Basal-Epithelzellen stammen. Luminale Mammaepithelzellen erhielten Basalzelleneigenschaften nach der Einnahme von aus Basalzellen abgesonderten EVs / Exosomen und können dann Milchdrüsen bilden 4 .
Protokoll
Alle Forschungen, die Tiere betreffen, erfüllten Protokolle, die vom Institutionellen Ausschuss für Tierpflege genehmigt wurden.
1. Extrazelluläre Vesikel / Exosom Isolierung und Validierung
- Kultur-Mamma-Epithel-Basalzellen, NAMECs 4 , mit frischem, serumfreiem Medium aus 500 ml MCDB 170, pH 7,4 + 500 ml DMEM / F12 mit Natriumbicarbonat (0,2438%); EGF (5 ng / ml); Hydrocoritison (0,5 & mgr; g / ml); Insulin (5 & mgr; g / ml); Rinder-Hypophysenextrakt (BPE, 35 μg / ml); Und GW627368X (1 μg / ml) in 15 cm Schalen.
- Nach dem Zählen der Zellen mit einem Hämocytometer, Saatgut 1,2 x 10 6 Zellen in 12 ml Medium pro 15-cm-Schale am Tag 0 für 4 Tage 4 .
- Nach 4 Tagen in Kultur wird das Kulturmedium bei 300 xg für 5 min unter Verwendung einer Tischzentrifuge zentrifugiert. Übertragen Sie den Überstand auf ein konisches Rohr (Abbildung 1 ).
- Zentrifugieren Sie den ÜberstandBei 2.000 xg für 20 min in einer Tischzentrifuge. Übertragen Sie den Überstand in ein Ultrazentrifugenröhrchen und lassen Sie die toten Zellen und Zelltrümmer (Abbildung 1 ).
- Zentrifugieren Sie den Überstand bei 10.000 xg für 30 min bei 4 ° C. Übertragen Sie den Überstand in ein neues Ultrazentrifugenröhrchen (Abbildung 1 ).
- Zentrifugieren Sie den Überstand bei 110.000 xg für 60 min bei 4 ° C. Den Überstand entfernen und das EV / Exosom-Pellet in PBS resuspendieren (Abbildung 1 ).
- Zentrifugieren Sie den Überstand bei 110.000 xg für 60 min bei 4 ° C. Den Überstand entfernen. Das EV / Exosom-Pellet in PBS resuspendieren (Abbildung 1 ). Das Pellet, das aus 240-480 ml NAMEC-konditioniertem Medium in 100 & mgr; l isoliert wurde, resuspendieren.
- Messen Sie die Proteinkonzentration der EV-Suspension mit dem BCA-Protein-Assay. Stellen Sie sicher, dass die Konzentration etwa 20-40 μg / 100 μL beträgt. Bei -20 ° C aufbewahrenweitere Analyse.
- Messen Sie die Konzentration und Größe der EVs / Exosomen durch Nanopartikel-Tracking-Analyse (NTA), wie zuvor von Gardiner et al. 11 Verdünnen Sie die EVs / Exosomen (20 μg / 100 μL) mit PBS auf 10.000-fach für die NTA-Analyse.
HINWEIS: Das Ergebnis der NTA-Analyse spiegelt die Anzahl und Größe der untersuchten Vesikel wider. - Bild der EVs / Exosomen mit Transmissionselektronenmikroskopie (TEM), wie zuvor von Lin et al. 4 beschrieben.
2. Exosome Reinigung mit einem Dichtegradienten
- Das 110.000 g Pellet aus Schritt 1.7 in 40% (w / v) Iodixanol in PBS (2 ml) resuspendieren. Übertragen Sie die Mischung in Sequenz mit Aliquots von 30%, 20%, 10% und 5% (w / v) Iodixanol in PBS (jeweils 2 ml), um einen Dichtegradienten in einem Ultrazentrifugenröhrchen zu bilden.
- Die Mischung bei 200.000 xg für 8 h bei 4 ° C zentrifugieren.
- Sammle jede Gradientenfraktion (10 FraktaleOns; 1 ml / Fraktion) mit einer Pipette von der Oberseite des Röhrchens.
- Analysieren Sie das Vorhandensein von Exosommarkern ( z. B. CD81, CD9, CD63 und Tsg101) in jeder Fraktion durch SDS-PAGE 12 und Western Blot. 50 μl Suspensionen jeder Fraktion auf ein 10% Gel mit 0,1% (w / v) SDS geben und die Proteine in Fraktionen mit Gelelektrophorese trennen.
- Übertragen Sie die Proteine von einem Gel auf eine PVDF-Membran und inkubieren Sie die Membran mit Antikörpern gegen die Exosommarker ( z. B. CD81, CD9, CD63 und Tsg101) und Housekeeping Protein GAPDH über Nacht ( Table of Materials ) bei 4 ° C.
HINWEIS: Das Ergebnis identifiziert die Fraktion, die Exosomen enthält.
3. Extrazelluläre Vesikel / Exosom-Kennzeichnung
- Suspendieren Sie die in Schritt 1.7 erhaltenen EVs / Exosomen in 10 μM Carboxyfluorescein-Succinimidyldiacetatester (CFSE) bei 20 μg exosomalen Protein / 100 μl. Vorbereitung einer parallelen Probe coNur CFSE und PBS, die in gleicher Weise verarbeitet wurden, als Negativkontrolle für die späteren EV / Exosom-Aufnahme-Assays. Lassen Sie die Mischungen bei 37 ° C für 30 min.
- Suspendieren Sie die EVs / Exosomen in 50x Volumen PBS und zentrifugieren Sie die Suspension bei 110.000 xg für 60 min bei 4 ° C. Den Überstand entfernen und das EV / Exosom-Pellet in PBS resuspendieren. Wiederholen Sie Schritt 3.2 einmal.
- Die EVs / Exosomen in PBS in einer Konzentration von 20 μg exosomalen Protein / 100 μl suspendieren und dann die EVs / Exosomen durch 0,22 μm Membranen filtrieren, bevor die EVs / Exosomen den Zellen zugesetzt werden.
4. Extrazellulärer Vesikel / Exosom-Aufnahme-Assay
- Zur Herstellung von Kulturmedium werden 500 ml MCDB 170, pH 7,4 + 500 ml DMEM / F12 mit Natriumbicarbonat (0,2438%) vermischt; EGF (5 ng / ml); Hydrocoritison (0,5 & mgr; g / ml); Insulin (5 & mgr; g / ml); Und BPE (35 & mgr; g / ml) 4 Tafeln Sie die menschlichen Mamma-Epithel-HMLE-Zellen in 6-Well-Schalen (1 x 10 6 <)/ Sup> Zellen / gut) einen Tag vor EV / Exosom Behandlung. Addieren Sie 2 μg / ml CFSE fluoreszenzmarkiertes EVs / Exosom, erhalten in Schritt 3.3, zum Kulturmedium der HMLE-Zellen für 2-6 h. Behandeln Sie die HMLE-Zellen der negativen Kontrollgruppe mit der in Schritt 3.1 beschriebenen Parallelpräparation.
- Nach der 2- bis 6-h-Inkubation die Zellen zweimal mit 4 ml PBS bei Raumtemperatur waschen.
- Die Zellen mit 0,25% Trypsin für 10 min abtrennen und die Zellen in PBS, die 0,2% FBS enthalten, erneut suspendieren. Messen Sie die EV / Exosom-Aufnahme von der Fluoreszenzintensität in den Zellen mit einem Fluoreszenzzellenanalysator 4 . Bild die mit EVs / Exosomen behandelten Zellen oder die Negativkontrolle mit konfokaler Mikroskopie.
HINWEIS: Die grüne Fluoreszenz in den Zellen wird durch die EV / Exosom-Aufnahme verursacht. Siehe die Legende von Abbildung 6 für die Mikroskopeinstellungen.
5. Isolierung der primären Maus Mamma Epithelzellen
- Gelatine-beschichtete Schalen vorbereiten, indem man 12 ml 0,1% ige Gelatinelösung auf 10 cm Schalen zugibt. Legen Sie die Platten in einen 37 ° C Inkubator für 30 min. Entfernen Sie die Gelatinelösung und lassen Sie den Deckel 4 Stunden lang in einer laminaren Fließhaube aus dem Geschirr, bis die Gelatinebeschichtung getrocknet ist.
- Die Zahl 2, 3, 4 und 5 Milchdrüsen ( Abbildung 2 ) von 12 Wochen alten weiblichen C57BL / 6 Mäusen unter Verwendung von Scheren zerlegen und die Drüsen in kleine Stücke (2 mm 2 ) mit einem Rasiermesser schneiden.
- Weiterhin dissoziieren Sie die Aufschlämmung von Milchdrüsen (von 10 Mäusen) für 60 min bei 37 ° C, 120 U / min Rühren mit 50 ml DMEM / F12, enthaltend 0,2% Kollagenase Typ IV, 0,2% Trypsin, 5% FBS, 5 μg / ml Gentamycin , Und 1x Pen-Strep.
- Die Epithelorganoide aus der Mischung durch Zentrifugation bei 350 xg für 10 min abtupfen.
- Die Epithelorganoide in 4 ml DMEM / F12 mit 0,1 mg / ml DNase I für 5 min bei Raumtemperatur suspendieren. Füge 6 mL DMEM / F12 zu einem Finale hinzuVolumen von 10 ml.
- Die Suspension bei 400 xg für 10 min bei Raumtemperatur zentrifugieren und den Überstand verwerfen.
- Das Pellet in 10 ml DMEM / F12 resuspendieren. Zentrifugieren Sie die Aufhängung, aber schlagen Sie die Bremse, wenn die Geschwindigkeit 400 x g erreicht. Den Überstand verwerfen.
HINWEIS: Beim Schlagen der Bremse werden die Epithelorganoide schnell heruntergekrampft, während Fibroblasten als Einzelzellen noch im Überstand bleiben. - Wiederholen Sie Schritt 5.6 und 5.7 5-7 mal. Fügen Sie einen Tropfen der Suspension zu einem Hämocytometer hinzu und überprüfen Sie dann den Abstand der Fibroblasten aus der Organoidmischung unter Mikroskopie nach jeder Zentrifugationsrunde (Abbildung 3 ).
- Die in Schritt 5,1 erhaltenen Organoide in der mit Gelatine beschichteten Schale mit DMEM / F12, enthaltend 1x ITS, 5% FBS, 50 μg / mL Gentamycin, 10 ng / mL EGF und 1x Pen-Strep.
- Nach 48 h entfernen Sie die schwimmenden Zellen in der Kultur, indem Sie das Medium durch frisches Kulturmedium ohne FBS (DMEM / F12, enthaltend 1x ITS, 50 μg / ml Gentamycin, 10 ng / ml EGF und 1x Pen-Strep).
- Vergewissern Sie sich, dass eine Monoschicht von Mamma-Epithelzellen in 3 Tagen aus den angehängten Epithelorganoiden wandert und wächst.
6. Trennung der primären Maus Basal / Luminal Mamma Epithelzellen
- Nach der 3-tägigen Kultur lösen Sie die Maus-Primär-Mamma-Zellen mit einer natürlichen Enzymmischung mit proteolytischer und kollagenolytischer Enzymaktivität für 20 min. Neutralisieren der Enzymaktivität mit 5% FBS in PBS.
- Die Suspension bei 450 xg für 10 min bei Raumtemperatur zentrifugieren und den Überstand verwerfen. Das Zellpellet wird in 5 mg / ml Dispos für 20 min resuspendiert. Neutralisieren der Enzymaktivität mit 5% FBS in PBS.
- Die Suspension bei 450 xg für 10 min bei Raumtemperatur zentrifugieren und den Überstand verwerfen.
- Die Zellen in 100 μl PBS mit 0,2% FBS in einer Konzentration von 10 7 Zellen / ml mit dem verdünnten erneut suspendiertAnti-CD49f und anti-EpCAM-Antikörper auf Eis für 1 h im Dunkeln.
- Die Zellen mit PBS waschen und dann die Zellen mit Fluorophor-konjugiertem Sekundärantikörper auf Eis für 30 min im Dunkeln inkubieren.
- Die Zellen in PBS mit 0,2% FBS waschen und erneut suspendieren.
- Sortieren Sie die EpCAM hi / CD49f lo luminal Mamma Epithelzellen auf einem Zellsortierer 4 .
7. Extrazelluläre Vesikel / Exosomenbehandlung
- Die sortierten EpCAM- hi / CD49f-luminalen Mamma-Epithelzellen aus Schritt 6.7 auf mit Gelatine beschichteten 6-Well-Schalen (2 x 10 & sup5; Zelle / Vertiefung) und behandeln sie dann mit PBS oder den 2 & mgr; g / ml NAMEC-abgeleiteten EVs / Exosomen Erhalten in Schritt 1.7.
- Um die biologische Wirksamkeit der EVs / Exosomen in der Langzeitkulturbehandlung zu gewährleisten, ersetzen Sie das Zellkulturmedium mit frischem Medium, das PBS oder 2 μg / mL NAMEC-abgeleitete EVs / Exosomen enthält, alle zwei Tage. Spalte nicht die Maus primaRum-luminalen Zellen während der 10-tägigen Behandlung.
8. Fat Pad Injektion von Mamma Epithelzellen
- Betäubung eines 3 Wochen alten weiblichen C57BL / 6 Mäusen mit Isofluoran 2-3% Inhalationsmittel.
- Lege die betäubte Maus auf den Rücken. Entfernen Sie das Fell auf dem Mittelabdomen mit einem Rasiermesser / Haarcreme und reinigen Sie die Chirurgie mit drei wechselnden Zyklen von 70% Alkohol und Povidon-Jod.
- Machen Sie einen 1,5 cm vertikalen Schnitt durch die Haut entlang der ventralen thoracic-inguinal Region mit Schere und dann abwechselnd aussetzen die rechten und linken 4th Mamma Fett Pads.
- Löschen Sie jeden Fett-Pad durch Entfernen von Drüsen-Parenchym mit Schere. Lokalisieren Sie den Lymphknoten in der Fett-Pad und entfernen Sie dann die ganze Drüsen-Parenchym unter dem Lymphknoten.
HINWEIS: Zwei Drittel des Fettkissens sollten an Ort und Stelle bleiben. - Die aus Schritt 7.2 erhaltenen Zellen mit einer natürlichen Enzymmischung (siehe Tabelle der Materialien ) mit proteolytischem a abziehenKollagenolytische Enzymaktivität für 10 min. Neutralisieren der Enzymaktivität mit 5% FBS in PBS.
- Die Suspension bei 450 xg für 10 min bei Raumtemperatur zentrifugieren und den Überstand verwerfen. Zählen Sie die Zellen mit einem Hämocytometer und suspendieren Sie die Zellen in PBS in einer Konzentration, so dass 15 μl die gewünschte Zelldosis (10 4 -10 2 Zelle / Pad) enthält.
- Injektion von 15 & mgr; l Mamma-Epithelzellsuspension in ein Fettkissen unter Verwendung einer 100 & mgr; l Glasspritze, die an einer 27G-Nadel befestigt ist.
- Wiederholen Sie die Schritte 8.4-8.7 für das Fett-Pad auf der anderen Seite.
- Schließen Sie die Haut mit Wundclips.
9. Mammary Gland Whole Mount
- Euthanasiere die Maus mit CO 2 plus Zervixversetzung nach 8 Wochen nach der Zellinjektion (Schritt 8.7).
- Machen Sie einen vertikalen Schnitt durch die Hautschicht vom Thoraxbereich zum Leistenbereich mit Schere und setzen Sie dann sowohl die rechte als auch die linke 4. m ausAmmary Fett Pads. Entfernen Sie die 4. Brustdrüsen ( Abbildung 2 ).
- Verbreiten Sie die Fettpolster auf Glasmikroskop-Objektträger und fixieren Sie die Fettpolster mit Kahle-Fixiermittel (4% Formaldehyd, 30% EtOH und 2% Eisessig) bei Raumtemperatur über Nacht.
Achtung: Kahles Fixativ ist ein Reizmittel. Führen Sie diesen Schritt in einer Chemikalienhaube durch. - Waschen Sie die Fettpolster in 250 ml 70% EtOH für 15 min und dann in 250 ml dH 2 O für 5 min. Färben Sie die Fettpolster mit Carmin Alaun (1 g Karmin und 2,5 g Aluminium Kaliumsulfat in 500 ml dH 2 O) bei Raumtemperatur über Nacht.
- Waschen Sie die Fettpolster mit 250 ml 70% EtOH für 15 min, 250 ml 95% EtOH für 15 min und 250 ml 100% EtOH für 15 min.
- Reinigen Sie die Fett-Pads in Xylol für Tage und stoppen Sie die Xylol-Inkubation, wenn die Fett-Pads transparent werden.
Achtung: Xylol ist ein Reizmittel. Führen Sie diesen Schritt in einer Chemikalienhaube durch. - Montiere die Slides wiTen Aufnahmemedium und fotografieren (2.400 dpi) der Fettkissen mit einem digitalen Dia-Scanner.
Ergebnisse
Da sich gezeigt hat, dass die Blockierung der PGE 2 / EP 4- Signalisierung die EV / Exosomen-Freisetzung von mamma-basalartigen Stammzellen 4 auslöst, stellt diese Arbeit ein Verfahren zur Isolierung der induzierten EVs / Exosomen aus der Mamma-Epithel-Basalzellen (NAMEC) -Kultur dar. Da NAMECs im serumfreien Medium kultiviert werden, gibt es keine bereits vorhandenen EVs / Exosomen aus Serum 13 . Für Zellen, die in serumhaltigem Medium kultiviert werden, müssen bereits vorhandene Exosomen im Medium durch Ultrazentrifugation bei 110.000 xg vorgereinigt werden, bevor das Medium zur Kultur der Quellzellen für die Sammlung von EVs / Exosomen 5 verwendet wird. EVs / Exosomen aus dem 4-tägig induzierten NAMEC-konditionierten Medium können aus dem 110.000 xg Pellet durch differentielle Ultrazentrifugation isoliert werden, wie in Abbildung 1 dargestellt. Die Anzahl und Größe der isolierten Vesikel in der 110.000 xg pellEt kann mit Hilfe der Nanopartikel-Tracking-Analyse (NTA) gemessen werden. Die durch Differential-Ultrazentrifugation isolierte 110.000-g-Pelletfraktion enthält hauptsächlich ~ 100 nm Vesikel (Abbildung 4A ); Dies entspricht der in der Literatur berichteten Größe der Exosomen (50 - 150 nm). Darüber hinaus zeigte die TEM-Analyse, dass 110.000 g-Fraktionen des NAMEC-konditionierten Mediums reichlich Membran-Vesikel enthalten (Abbildung 4B ). Obwohl die differentielle Ultrazentrifugation vernünftig reine Exosomen erzeugen kann, eliminiert der folgende Reinigungsschritt unter Verwendung eines Dichtegradienten weiterhin Verunreinigungen ( z. B. Proteinaggregate) 5 . Im Dichtegradienten schwimmen Exosomen im Gradienten aufgrund des Lipidgehalts im Vesikel, während Proteinaggregate, falls vorhanden, am Boden des Gradienten bleiben. Jeder Bruchteil des Gradienten wird für den Nachweis von Exosomenherstellern ( z. B. CD81, CD63, CD9 und TSG101) gesammelt 6 , 7 ) durch Western Blotting. Exosommarker können in der Fraktion mit ~ 20% Iodixanol nachgewiesen werden (Abbildung 5 ). Die Exsomen enthaltende Fraktion kann mit PBS verdünnt und 200.000 xg Ultrazentrifugation unterworfen werden, um die Exosomen zu isolieren. Das isolierte Exosomenpellet wird einmal in PBS gewaschen und dann in PBS resuspendiert und bei -20 ° C zur weiteren Analyse gelagert.
Vor der Messung der Aufnahme von NAMEC-abgeleiteten EVs / Exosomen durch das Nicht-Stamm-Gegenstück von Mamma-Epithelzellen - HMLE-Zellen - müssen die EVs / Exosomen mit einem Fluoreszenzfarbstoff ( z. B. Carboxyfluorescein-Succinimidylester (CFSE)) markiert werden. Eine parallele Probe, die nur CFSE, aber kein EV / Exosom enthält, wird im selben Markierungsverfahren verarbeitet. Diese Probe ist eine negative Kontrolle, die in dem folgenden EV / Exosom-Aufnahme-Assay verwendet wird, um die Wirkung einer Spurenmenge von restlichen freien CFS zu reflektierenE-Farbstoff HMLE-Zellen werden mit CFSE-markierten, NAMEC-abgeleiteten EVs / Exosomen oder der Negativkontrolle für 2-6 h kultiviert und dann einer Durchflusszytometrie unterworfen. Im Vergleich zu den unbehandelten HMLE-Zellen exprimieren die mit der Negativkontrolle kultivierten HMLE-Zellen einen etwas höheren Pegel des CFSE-Signals (Abbildung 6A , rote Linie gegen orange Linie), was den Hintergrundpegel der CFSE-Signalisierung widerspiegelt, der durch restliches freies CFSE verursacht wird EV / Exosom-Etikettierung. Im Vergleich zu den negativ kontrollierten HMLE-Zellen exprimieren die mit CFSE-markierten NAMEC-abgeleiteten Exosomen kultivierten HMLE-Zellen ein 10-fach höheres CFSE-Signal (Abbildung 6A , blaue Linie gegenüber roter Linie), die sich aus der spezifischen Aufnahme ergibt Von CFSE-markierten EVs / Exosomen. Die Aufnahme von CFSE-markierten, von NAMEC abgeleiteten EVs / Exosomen durch HMLE-Zellen kann auch durch konfokale Mikroskopie beobachtet werden. Während die negativ kontrollierten HMLE-Zellen kein CFSE-Signal aufweisen, ist die Aufnahme von NAMEC-abgeleitete EVs / Exosomen durch HMLE-Zellen können mit dem CFSE-Signal unter dem konfokalen Mikroskop in CFSE-markierten EV / exosom-behandelten Zellen beobachtet werden (Abbildung 6B ).
Um zu beurteilen, ob NAMEC-abgeleitete EVs / Exosomen die Mamma-Drüsen-bildende Fähigkeit von Stamm-ähnlichen Mamma-Basalzellen zu Mamma-Luminalzellen übertragen können, werden die Maus-Mamma-Luminalzellen zuerst isoliert, um die Analyse der Brustdrüsenbildung bei Mäusen zu ermöglichen. Maus-Mamma-Epithelzellen werden von 12 Wochen alten Mäusen isoliert. Die Milchdrüsen werden in kleine Stücke geschnitten und weiter mit Kollagenase und Trypsin dissoziiert. Die dissoziierten epithelialen Organoide und Fibroblasten können durch Differentialzentrifugation, wie in den Schritten 5.7 und 5.8 beschrieben, getrennt werden. In jeder Runde der Zentrifugation sollte das Pellet an der Unterseite der Röhrchen hauptsächlich epitheliale Organoide enthalten, und die Fibroblasten und einzelne Zellen sollten im Überstand schwimmenT Verglichen mit der Mischung, die sowohl epitheliale Organoide als auch Fibroblasten enthält, vor der Differentialzentrifugation (Abbildung 3 , obere Tafeln), entfernen die sechs Runden der Zentrifugation die meisten Fibroblasten und einzelne Zellen in der Mischung (Abbildung 3 , Bodenplatte).
Die Mamma-Epithelzellen ( Fig. 7 ) der Epithelorganoide werden ferner unter Verwendung einer natürlichen Enzymmischung mit proteolytischer und kollagenolytischer Enzymaktivität dissoziiert und disponiert, um einzelne Zellen in Suspension zu erzeugen. Die Sortierung der Einzelzell-Suspension durch die Expression der Zelloberfläche CD49f und EpCAM kann die Brust-Luminalzellen (EpCAM hi / CD49f lo ), Mamma-Basalzellen (EpCAM lo / CD49f hi ) und Nicht-Epithelzellen (EpCAM-) trennen ( Abb 8 ).
Die isolierten EpCAM- hi / CD49f-luminalen Mamma-Epithelzellen werden mit NAMEC-abgeleiteten EVs / Exosomen für 10 Tage kultiviert und die frischen EVs / Exosomen und das Medium werden alle zwei Tage ersetzt. Nach der EV / Exosom-Behandlung werden die Mamma-Luminalzellen in die 4. Mamma-Fett-Pads ( Fig. 2 ) von Mäusen implantiert. Nach 8 Wochen werden die Fettpolster isoliert und für die Analyse der Milchdrüsenbildung gefärbt (Abbildung 9 ). Die Behandlung mit induzierten NAMEC-abgeleiteten EVs / Exosomen ermöglicht es luminalen Zellen, eine Mamma-Drüsenbildung zu erlangen 4 . Die NAMEC-abgeleiteten, EV / exosom-behandelten Mamma-Luminalzellen bilden Mammadrüsen in Mausfettkissen (Abbildung 9 ).

Abbildung 1: Darstellung der ExtracellulaR Vesikel / Exosomen-Reinigungsverfahren aus Zellkulturmedium durch Differential-Ultrazentrifugation. Die Geschwindigkeit und Länge jeder Zentrifugation sind angegeben. Nach jeder der ersten drei Zentrifugationen wird der Überstand für den nächsten Schritt gehalten. Nach den 110.000 × g Zentrifugen werden die Pellets gehalten und die Überstände verworfen. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
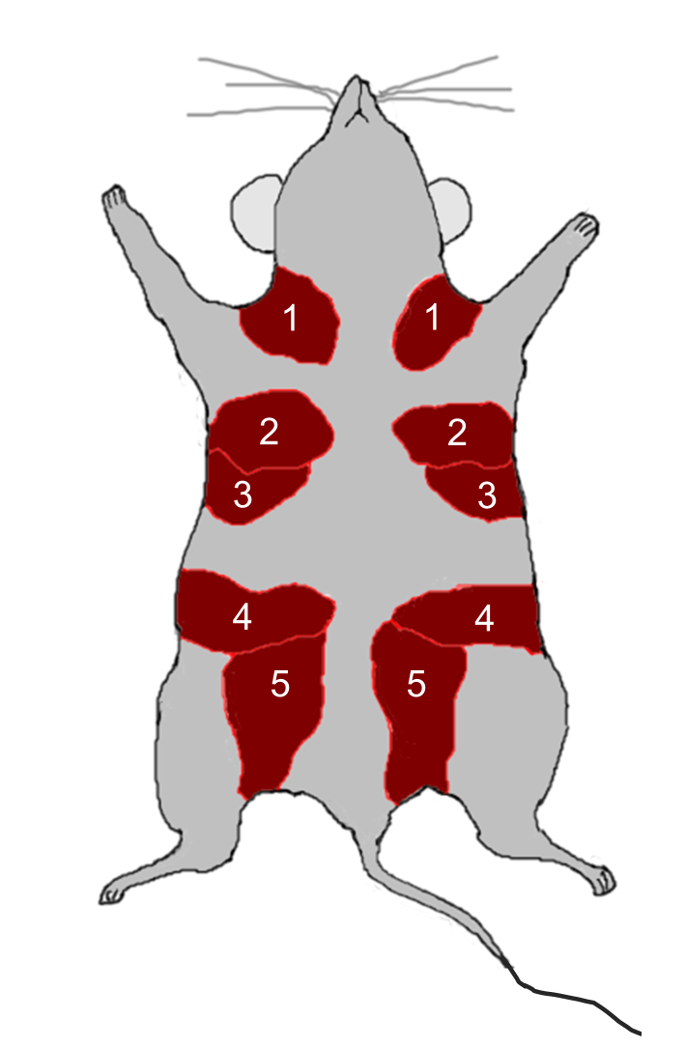
Abbildung 2: Maus Mamma Gland Anatomy. Die Mäuse haben fünf Paare von Milchdrüsen, die durch die Zahlen 1-5 angegeben sind und sich in den fetten Pads (rot) direkt unter der Haut befinden. Bitte klicken Sie hier, um eine größere Version von th anzuzeigenIst Figur.

Abbildung 3: Bilder einer Mischung aus Epithelorganoiden und Zellen von Fettpolstern vor und nach Differentialzentrifugation. Helle Bilder der isolierten Fett-Pad-Zellmischungen vor und nach der Differentialzentrifugation aus dem Hämocytometer. Pfeilspitze: Epithelorganoide. Pfeil: Fibroblasten und Einzelzellen. Maßstab = 0,5 mm. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
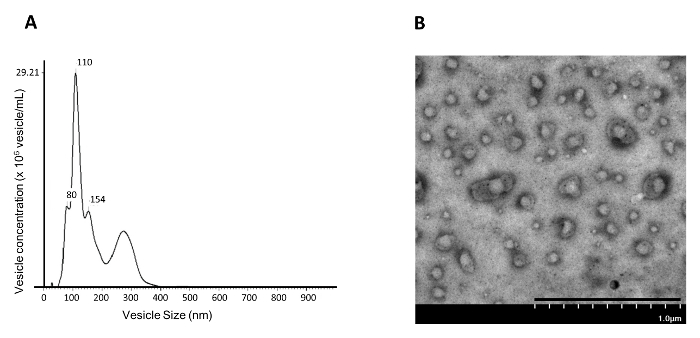
Abbildung 4: Vesikelgröße und Konzentrationsanalyse von NAMEC110.000 xg Pelletfraktion. Die 110.000 g Pelletfraktion des NAMEC-Mediums ist col Gelehrt und einer ( A ) Nano-Partikel-Tracking-Analyse (NTA) und ( B ) Transmissionselektronenmikroskopie (TEM) unterworfen. Maßstab = 1 μm. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 5: Erkennung von Exosomen in Fraktionen des Dichtegradienten. Western-Blot-Analyse der Exosomenmarker CD81, CD9, CD63 und Tsg101 und Housekeeping Gen GAPDH zeigt die 20% Iodixanol-Fraktion, die die Exosomen enthält. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
55736fig6.jpg "/>
Abbildung 6: Nachweis der extrazellulären Vesikel- / Exosomenaufnahme durch Durchflusszytometrie und konfokale Mikroskopie. Die EV / Exosom-Aufnahme wurde in HMLE-Zellen gemessen. CFSE-markierten, NAMEC-abgeleiteten EVs / Exosomen und Negativkontrolle werden den angegebenen Kulturen für 6 h zugesetzt. Nach der Inkubation werden die Zellen unterworfen ( A ) Durchflusszytometrie und ( B ) konfokale Mikroskopie. Die CFSE (grün, Anregung / Emission (nm): 492/517, Mikroskop-Laserlinie: 488) Fluoreszenzintensitäten reflektieren die EV / Exosom-Aufnahme. Zellkerne werden mit DAPI gefärbt (blau, Anregung / Emission (nm): 358/461, Mikroskop-Laserlinie: 405) und die Plasmamembranen sind mit Plasmamembranfärbung gefärbt (rot, Anregung / Emission (nm): 649/666; Mikroskop-Laserlinie: 633, siehe Tabelle der Materialien ). Konfokale Objektivlinse: HCX PL APO 63x / 1.40-0.60 Öl. Maßstab = 20 μm.Ad / 55736 / 55736fig6large.jpg "target =" _ blank "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
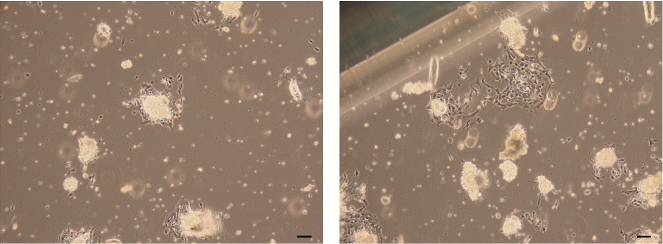
Abbildung 7: Bilder von angehängten Epithel-Organoiden. Helle Bilder von Mamma-Epithelzellen, die von den Zellen gebildet werden, die aus den angehängten Epithelorganoiden wandern und wachsen. Maßstab = 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 8: Sortierung der primären Maus Mamma Epithelzellen durch die Oberfläche EpCAM und CD49f. Maus-Mamma-Epithelzellen, die aus fetten Pads von 12-wöchigen Mäusen isoliert wurden, werden einer Zellsorte unterworfenIng. Maus-Brust-Luminalzellen sind angereichert in der EpCAM hi / CD49f lo Bevölkerung, markiert mit dem blauen Kreis; Basalzellen wurden in der EpCAM lo / CD49f hi Population angereichert, markiert mit dem roten Kreis. Nicht-Epithelzellen sind mit der Black Box in der Handlung markiert. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 9: Mamma-Drüsenbildung durch primäre Maus Luminal-Mamma-Zellen Die primären Maus EpCAM hi / CD49f lo luminalen Zellen werden mit PBS oder den NAMEC-abgeleiteten EVs / Exosomen in Zellkultur für 10 Tage behandelt und in die gereinigten Fettpolster von 3 Wochen alten Mäusen implantiert. Die Mäuse werden nach 8 Wochen euthanasiert und nekropsiert, um die Brustdrüsenform zu analysierenAtion Maßstab = 0,75 cm. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
| Prozentsatz | MFI von EpCAM | MFI von CD49f | |
| Mamma-Luminalzelle | 0.437 | 4,57 x 10 4 | 8183 |
| (EpCAM hi / CD49f lo ) | |||
| Mamma-Basalzelle | 0,09 | 5452 | 2,23 x 10 4 |
| (EpCAM lo / CD49f hi ) | |||
| Nicht epithelialZelle (EpCAM - ) | 0.309 | 53 | 4619 |
Tabelle 1: Prozentsatz und mittlere Fluoreszenzintensität (MFI) der in Abbildung 8 beschriebenen Populationen.
Diskussion
Exosomen tragen oft Eigenschaften der Zellen, die sie freisetzen, und die Menge der freigesetzten Exosomen kann durch Stimuli 4 induziert werden. Das Kulturmedium der Zellen kann gesammelt und einer differentiellen Ultrazentrifugation für die EV / Exosom-Sammlung unterzogen werden (Abbildung 1 ). Es gibt derzeit keine allgemeine Vereinbarung über eine ideale Methode, um EVs / Exosomen zu isolieren. Die hier verwendete optimale Methode wurde durch die nachgeschaltete Applikation 14 bestimmt . Ultrazentrifugation ist eine relativ schnelle Methode zur Isolierung von EVs / Exosomen, die die biologische Aktivität der EVs / Exosomen bewahren kann. Allerdings enthalten die durch Ultrazentrifugation isolierten Vesikelen im allgemeinen eine Mischung von EVs, die Exosomen enthalten, die über endosomale Kompartimente und / oder Vesikel produziert werden, die über Knospen aus der Zellmembran hergestellt werden.
Durch die Analyse der Größen der Vesikel mit NTA (Abbildung 4A ), die Vesikel, die bei 110.000 xg während der differentiellen Ultrazentrifugation zu reinigen waren, waren hauptsächlich 50-150 nm, was der Größe der Exosomen entspricht. Die NTA-Daten deuten darauf hin, dass die NAMEC-abgeleiteten Exosomen aus dem Kulturmedium bei 110.000 xg während der differentiellen Ultrazentrifugation isoliert werden können. Die hier eingeführte NTA und TEM erlauben jedoch nur die Visualisierung von Vesikeln oder die Messung der Größe und Anzahl der Gesamtbevölkerung von EVs. Diese Techniken können die Heterogenität der EV-Populationen nicht messen oder sogar die heterogenen EV-Populationen sortieren. Wissenschaftler haben begonnen, Methoden der Verwendung von Durchflusszytometern zu entwickeln und zu sortieren EV-Populationen 15 .
Obwohl eine differentielle Ultrazentrifugation verwendet werden kann, um Exosomen zu reinigen, sollte ein Dichtegradient verwendet werden, um die Kontamination von Proteinaggregaten aus den Exosomenvesikeln in der 110.000 xg isolierten Fraktion 5 weiter zu entfernen . Exosomen enthalten Lipidmembranen. Das Lipid in den Exosomenmembranen macht die Exosomen in einem Dichtegradienten schwimmen, während Proteinaggregate auf den Boden des Dichtegradienten fallen. Exosomen exprimieren spezifische Marker ( zB CD81, CD63, CD9 und TSG101 6 , 7 ). Durch die Analyse der Anwesenheit von Exosommarkern in den Fraktionen des Dichtegradienten ist es möglich, Exosomen in der Fraktion mit ~ 20% Iodixanol zu identifizieren (Abbildung 5 ). Es sollten mehrere Exosomenmarker untersucht werden, um Exosomen im Dichtegradienten zu identifizieren, da jede Population von Exosomen unterschiedliche Exosomenmarker ausdrücken kann.
Die Aufnahme von EVs / Exosomen durch Zellen kann mit fluoreszierenden Farbstoff-markierten EVs / Exosomen gemessen werden. Die Anzahl der Zellen, die markierte EVs / Exosomen aufnehmen, kann durch Durchflusszytometrie gemessen werden (Abbildung 6A ). Um zu bestätigen, dass die fluoReste von den Zellen resultieren aus der Aufnahme von markierten EVs / Exosomen, aber nicht aus freiem Farbstoff, das Muster der Fluoreszenz wurde in den Zellen mittels Mikroskopie untersucht. Die konfokale Mikroskopie zeigt, dass das Fluoreszenzmuster in den mit EV / Exosomen behandelten Zellen punktiert ist (Abbildung 6B rechts). Die punktförmigen Signale ergeben sich wahrscheinlich aus markierten EVs / Exosomen, nicht aus freier Fluoreszenz. Die punktförmigen Signale in den Zellen können mit einer strukturierten Beleuchtungs-Super-Auflösungsmikroskopie, die die höchste Auflösung bei 85 nm 4 , 17 aufweist , weiter analysiert werden. Die Super-Auflösungsmikroskopie kann bestätigen, dass die punktförmigen Signale aus ~ 100-nm-Hohlvesikeln bestehen, die den Exosomen 4 ähneln. Diese Ergebnisse deuten darauf hin, dass NAMEC-abgeleitete Exosomen von Mamma-Epithelzellen in Kultur aufgenommen werden können.
NAMEC-abgeleitete EVs / Exosomen tragen oft Moleküle ( zB Proteine und miRNAs), die für die Eigenschaften bestimmter Zellen essentiell sind 1 . Dies deutet darauf hin, dass NAMEC-abgeleitete EVs / Exosomen die Eigenschaften von NAMECs ( zB Mamma-Drüsen-bildende Fähigkeit) auf ihre Epithelzell-Pendants übertragen können. Da menschliche Mamma-Epithelzellen keine Mamma-Drüsen bilden können, die xenogen in den Maus-Fett-Pads 18 , 19 auftreten, kann die Übertragung der Drüsenbildungsfähigkeit unter Verwendung von primären Mamma-Epithelzellen der Maus untersucht werden. Maus primäre Mamma Epacam hi / CD49f lo luminalzellen, die keine Milchdrüsen bilden, können von 6 Wochen alten Mäusen isoliert werden (Abbildung 7 und Abbildung 8 ). Die isolierten Zellen aus Mausfettkissen können in drei Gruppen unterteilt werden ( dh EpCAM hi / CD49f lo luminalzellen, EpCAM lo / CD49f hi basale Zellen und EpCAM - nicht-epitheliale Zellen), indem sie die leVels der Oberfläche EpCAM und CD49f (Abbildung 8 ). EpCAM lo / CD49f hi Basalzellen können bei fettfarbenen Pads Mammdrüsen in fetten Titten bilden, aber EpCAM hi / CD49f lo luminalzellen können nicht 4 . Somit kann die EpCAM- hi / CD49f-luminalen Zellpopulation verwendet werden, um die Fähigkeit von induzierten NAMEC-abgeleiteten EVs / Exosomen zu untersuchen, um die Mami-Drüsen-bildende Fähigkeit zu übertragen. Die isolierten EpCAM hi / CD49f lo luminalen Zellen können für 7-10 Tage für die EV / Exosombehandlung 4 in Kultur gehalten werden. Es sollte darauf hingewiesen werden, dass die Aufrechterhaltung primärer Mamma-Epithelzellen in vitro länger dauern kann, um die Lebensfähigkeit der Zellen zu dämpfen.
Die EV / Exosom-behandelten Mamma-Luminalzellen können in gereinigte Fettpolster implantiert werden, um die Brustdrüsen-bildende Fähigkeit zu analysieren. Die für die Implantation verwendeten Fettkissen der Mäuse müssen im Alter von 3 Wochen geräumt werden. EINT 3 Wochen alt, Mamma Epithelzellen sind auf die Region zwischen der Brustwarze und der Lymphe eines Fett-Pad beschränkt. Mamma-Epithel in einem Fett-Pad kann durch Entfernen der Region zwischen der Brustwarze und der Lymphe im Alter von 3 Wochen gelöscht werden. Mamma-Luminalzellen werden unmittelbar nach dem Löschen des Fettkissens implantiert und die Drüsenbildung durch die implantierten Zellen kann nach 8 Wochen nach der Implantation analysiert werden. Die Wirkung von NAMEC-abgeleiteten EVs / Exosomen auf die Übertragung der Brustdrüsen-bildenden Fähigkeit auf Brust-Luminalzellen kann durch die Drüsenbildung von Luminalzellen und EV / exosom-behandelten Luminalzellen ausgewertet werden (Abbildung 9 ). Die induzierten EVs / Exosomen von NAMECs tragen die Eigenschaft von Mamma-Basal-Epithelzellen - Drüsenbildungsfähigkeit - und die Luminalzellen, die die induzierten EVs / Exosomen von NAMECs einnehmen, können die Eigenschaft von NAMECs über EVs / Exosomen erwerben. Diese Arbeit zeigt, dass Moleküle für das EV / Exosom-Medium verantwortlich sindIn den Lipidflößen der EVs / Exosomen 4 sind die Übertragung der Mami-Drüsenbildung möglich.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Diese Arbeit wurde durch Stipendien der Nationalen Gesundheitsforschungsinstitute (05A1-CSPP16-014, HJL) und des Ministeriums für Wissenschaft und Technologie (MOST 103-2320-B-400-015-MY3, HJL) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| MCDB 170 | USBiological | M2162 | |
| DMEM/F12 | Thermo | 1250062 | |
| Optima L-100K ultracentrifuge | Beckman | 393253 | |
| SW28 Ti Rotor | Beckman | 342204 | |
| SW41 Rotor | Beckman | 331306 | |
| NANOSIGHT LM10 | Malvern | NANOSIGHT LM10 | for nanoparticle tracking analysis (NTA) |
| Optiprep | Sigma-Aldrich | D1556 | 60% (w/v) solution of iodixanol in water (sterile). |
| CD81 antibody | GeneTex | GTX101766 | 1:1,000 in 5% w/v nonfat dry milk, 1x TBS, 0.1% Tween 20 at 4 °C, overnight |
| CD9 antibody | GeneTex | GTX100912 | 1:1,000 in 5% w/v nonfat dry milk, 1x TBS, 0.1% Tween 20 at 4 °C, overnight |
| CD63 antibody | Abcam | Ab59479 | 1:1,000 in 5% w/v nonfat dry milk, 1x TBS, 0.1% Tween 20 at 4 °C, overnight |
| TSG101 antibody | GeneTex | GTX118736 | 1:1,000 in 5% w/v nonfat dry milk, 1x TBS, 0.1% Tween 20 at 4 °C, overnight |
| GAPDH | GeneTex | GTX100118 | 1:6,000 in 5% w/v nonfat dry milk, 1x TBS, 0.1% Tween 20 at 4 °C, overnight |
| CFSE (carboxyfluorescein succinimidyl diacetate ester) | Thermo | V12883 | |
| FACSCalibur | BD Biosciences | fluorescence cell analyzer | |
| collagenase Type IV | Thermo | 17104019 | |
| trypsin | Thermo | 27250018 | |
| ITS | Sigma-Aldrich | I3146 | a mixture of recombinant human insulin, human transferrin, and sodium selenite |
| accutase | ebioscience | 00-4555-56 | a natural enzyme mixture with proteolytic and collagenolytic enzyme activity |
| dispase | STEMCELL | 7913 | 5 mg/mL = 5 U/mL |
| anti-CD49f antibody | Biolegend | 313611 | 1:50 |
| anti-EpCAM antibody | Biolegend | 118213 | 1:200 |
| FACSAria | BD Biosciences | cell sorter | |
| carmine alum | Sigma-Aldrich | C1022 | |
| human mammary epithelial cells (HMLE cells, NAMECs) | gifts from Dr. Robert Weinberg | ||
| permount | Thermo Fisher Scientific | SP15-500 | |
| sodium bicarbonate | Zymeset | BSB101 | |
| EGF | Peprotech | AF-100-015 | |
| Hydrocoritisone | Sigma-Aldrich | SI-H0888 | |
| Insulin | Sigma-Aldrich | SI-I9278 | |
| BPE (bovine pituitary extract) | Hammod Cell Tech | 1078-NZ | |
| GW627368X | Cayman | 10009162 | |
| 15 cm culture dish | Falcon | 353025 | |
| table-top centrifuge | Eppendrof | Centrifuge 3415R | |
| ultracentrifuge tube | Beckman | 344058 | |
| PBS (Phosphate-buffered saline) | Corning | 46-013-CM | |
| BCA Protein Assay | Thermo Fisher Scientific | 23228 | |
| Transmission Electron Microscopy | Hitachi | HT7700 | |
| gelatin | STEMCELL | 7903 | |
| 10 cm culture dish | Falcon | 353003 | |
| 6-well culture dish | Corning | 3516 | |
| female C57BL/6 mice | NLAC (National Laboratory Animal Center | ||
| FBS (Fetal Bovine Serum) | BioWest | S01520 | |
| gentamycin | Thermo Fisher Scientific | 15710072 | |
| Pen/Strep | Corning | 30-002-Cl | |
| DNase I | 5PRIMER | 2500120 | |
| isofluorane | Halocarbon | NPC12164-002-25 | |
| formaldehyde | MACRON | H121-08 | |
| EtOH (Ethanol) | J.T. Baker | 800605 | |
| glacial acetic acid | Panreac | 131008.1611 | |
| aluminum potassium sulfate | Sigma-Aldrich | 12625 | |
| Xylene | Leica | 3803665 | |
| 0.22 μm membranes | Merck Millipore | Millex-GP | |
| AUTOCLIP Wound Clips, 9 mm | BD Biosciences | 427631 | |
| AUTOCLIP Wound Clip Applier | BD Biosciences | 427630 | |
| CellMask™ Deep Red | Thermo Fisher Scientific | C10046 | plasma membrane stain |
Referenzen
- Simons, M., Raposo, G. Exosomes--vesicular carriers for intercellular communication. Curr Opin Cell Biol. 21 (4), 575-581 (2009).
- Théry, C., Ostrowski, M., Segura, E. Membrane vesicles as conveyors of immune responses. Nat Rev Immunol. 9 (8), 581-593 (2009).
- Boelens, M., et al. Exosome Transfer from Stromal to Breast Cancer Cells Regulates Therapy Resistance Pathways. Cell. 159 (3), 499-507 (2014).
- Lin, M. C., et al. PGE2 /EP4 Signaling Controls the Transfer of the Mammary Stem Cell State by Lipid Rafts in Extracellular Vesicles. Stem Cells. , (2016).
- Théry, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Curr Protoc Cell Biol. , (2006).
- György, B., et al. Membrane vesicles, current state-of-the-art: emerging role of extracellular vesicles. Cell Mol Life Sci. 68 (16), 2667-2688 (2011).
- Olver, C., Vidal, M. Proteomic analysis of secreted exosomes. Subcell Biochem. 43, 99-131 (2007).
- Shackleton, M., et al. Generation of a functional mammary gland from a single stem cell. Nature. 439 (7072), 84-88 (2006).
- Prater, M. D., et al. Mammary stem cells have myoepithelial cell properties. Nat Cell Biol. 16 (10), 942-950 (2014).
- Stingl, J., et al. Purification and unique properties of mammary epithelial stem cells. Nature. 439 (7079), 993-997 (2006).
- Gardiner, C., Ferreira, Y. J., Dragovic, R. A., Redman, C. W., Sargent, I. L. Extracellular vesicle sizing and enumeration by nanoparticle tracking analysis. J Extracell Vesicles. 2, (2013).
- Shapiro, A. L., Viñuela, E., Maizel, J. V. Molecular weight estimation of polypeptide chains by electrophoresis in SDS-polyacrylamide gels. Biochem Biophys Res Commun. 28 (5), 815-820 (1967).
- Riches, A., Campbell, E., Borger, E., Powis, S. Regulation of exosome release from mammary epithelial and breast cancer cells - a new regulatory pathway. Eur J Cancer. 50 (5), 1025-1034 (2014).
- Witwer, K. W., et al. Standardization of sample collection, isolation and analysis methods in extracellular vesicle research. J Extracell Vesicles. 2, (2013).
- van der Vlist, E. J., Nolte-'t Hoen, E. N., Stoorvogel, W., Arkesteijn, G. J., Wauben, M. H. Fluorescent labeling of nano-sized vesicles released by cells and subsequent quantitative and qualitative analysis by high-resolution flow cytometry. Nat Protoc. 7 (7), 1311-1326 (2012).
- Kowal, J., et al. Proteomic comparison defines novel markers to characterize heterogeneous populations of extracellular vesicle subtypes. Proc Natl Acad Sci U S A. 113 (8), E968-E977 (2016).
- Li, D., et al. ADVANCED IMAGING. Extended-resolution structured illumination imaging of endocytic and cytoskeletal dynamics. Science. 349 (6251), (2015).
- Outzen, H. C., Custer, R. P. Growth of human normal and neoplastic mammary tissues in the cleared mammary fat pad of the nude mouse. J Natl Cancer Inst. 55 (6), 1461-1466 (1975).
- Sheffield, L. G., Welsch, C. W. Transplantation of human breast epithelia to mammary-gland-free fat-pads of athymic nude mice: influence of mammotrophic hormones on growth of breast epithelia. Int J Cancer. 41 (5), 713-719 (1988).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten