Method Article
Transferencia de la capacidad de formación de glándulas mamarias entre las células epiteliales basales mamarias y las células lumminales mamarias mediante vesículas extracelulares / exosomas
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo describe métodos para purificar, cuantificar y caracterizar vesículas extracelulares (EVs) / exosomas de células epiteliales mamarias no adherentes / mesenquimales y para usarlas para transferir la capacidad de formación de glándulas mamarias a células epiteliales mamarias luminales. Los EVs / exosomas derivados de células epiteliales mamarias de tipo tallo pueden transferir esta propiedad celular a células que ingieren los EVs / exosomas.
Resumen
Las células pueden comunicarse a través de exosomas, ~ 100-nm vesículas extracelulares (VE) que contienen proteínas, lípidos y ácidos nucleicos. Las vesículas extracelulares derivadas de células epiteliales mamarias no adherentes / mesenquimales (NAMEC) pueden aislarse a partir del medio NAMEC mediante ultracentrifugación diferencial. Basándose en su densidad, los VE pueden purificarse mediante ultracentrifugación a 110.000 x g. La preparación EV de la ultracentrifugación puede separarse adicionalmente usando un gradiente de densidad continuo para evitar la contaminación con proteínas solubles. Los EV purificados pueden entonces ser evaluados adicionalmente usando un análisis de seguimiento de nanopartículas, que mide el tamaño y el número de vesículas en la preparación. Las vesículas extracelulares con un tamaño comprendido entre 50 y 150 nm son exosomas. Los EVs / exosomas derivados de NAMEC pueden ser ingeridos por células epiteliales mamarias, que pueden medirse mediante citometría de flujo y microscopía confocal. Algunas propiedades de las células madre mamarias ( por ejemplo, la capacidad de formación de glándulas mamarias) puedenSe transfiere desde el tallo-como NAMECs a las células epiteliales mamarias a través de la NAMEC derivados EVs / exosomes. Las células epiteliales mamarias primarias aisladas EpCAM hi / CD49f no pueden formar glándulas mamarias después de ser trasplantadas en almohadillas de grasa de ratón, mientras que las células epiteliales mamarias basales EpCAM lo / CD49f hi forman glándulas mamarias después del trasplante. La captación de EVs / exosomas derivados de NAMEC por EpCAM hi / CD49f para células epiteliales mamarias luminales les permite generar glándulas mamarias después de ser trasplantadas en almohadillas de grasa. Los EVs / exosomas derivados de las células epiteliales mamarias de tipo madre transmiten la capacidad de formación de glándulas mamarias a EpCAM hi / CD49f para las células epiteliales mamarias luminales.
Introducción
Los exosomas pueden mediar en la comunicación celular mediante la transferencia de membrana y proteínas citosólicas, lípidos y ARN entre las células 1 . Se ha demostrado que la comunicación mediada por exosomas está implicada en muchos procesos fisiológicos y patológicos ( es decir, presentación de antígenos, desarrollo de tolerancia 2 y progresión tumoral 3 ). Los exosomas a menudo tienen contenidos similares a los de las células de origen que los liberan. Por lo tanto, los exosomas pueden llevar a las propiedades celulares específicas de las células de origen y la transferencia de estas propiedades a las células de ingerirlos [ 4] .
Los exosomas son vesículas de membrana de doble capa de 50 a 150 nm y presentan marcadores específicos ( por ejemplo, CD9, CD81, CD63, HSP70, Alix y TSG101). Por lo tanto, los exosomas deben caracterizarse por diversos métodos para diferentes aspectos. La microscopía electrónica de transmisión puede usarse para visualizar vesículas de membranaTales como los exosomas 4 , 5 . El análisis de seguimiento de nanopartículas (NTA) y el análisis dinámico de dispersión de luz (DLS) se utilizan para medir el tamaño y el número de exosomas purificados 4 . El contenido de membrana lipídica de los exosomas puede ser verificado por gradiente de densidad. Los marcadores exosomales, tales como CD9, CD81, CD63, HSP70, Alix y TSG101 6 , 7 , pueden medirse mediante transferencia Western.
Las células basales mamarias tienen la capacidad de generar glándulas mamarias cuando se implantan en almohadillas de grasa, mientras que las células luminales no pueden 8 , 9 , 10 . Por lo tanto, las células basales mamarias también se denominan unidades de repoblación mamaria. Mediante el uso del modelo de células basales y lumínicas mamarias, se puede examinar la capacidad de EVs / exosomas para transferir características de células entre diferentes poblaciones celulares. Este trabajoDemuestra el método de transferencia de la capacidad de formación de glándulas de las células epiteliales basales mamarias a las células epiteliales lumínicas mamarias utilizando EVs / exosomas derivados de células epiteliales basales mamarias. Luminal células epiteliales mamarias adquirieron las propiedades basales de las células después de la ingestión de EVs / exosomas secretados a partir de células basales y, a continuación, pueden formar glándulas mamarias [ 4] .
Protocolo
Todas las investigaciones relacionadas con animales cumplieron con los protocolos aprobados por el Comité Institucional de Cuidado de Animales.
1. Aislamiento y validación de vesículas / exosomas extracelulares
- Cultivo de células basales epiteliales mamarias, NAMECs 4 , con medio libre de suero libre de 500 mL de MCDB 170, pH 7,4 + 500 mL de DMEM / F12 con bicarbonato sódico (0,2438%); EGF (5 ng / ml); Hidrocoritisona (0,5 mu g / ml); Insulina (5 mu g / ml); Extracto de pituitaria bovina (BPE; 35 μg / ml); Y GW627368X (1 μg / ml) en platos de 15 cm.
- Después de contar las células con un hemocitómetro, sembrar 1,2 x 106 células en 12 ml de medio por plato de 15 cm al día 0 durante 4 días 4 .
- Después de 4 días en cultivo, centrifugar el medio de cultivo a 300 xg durante 5 min utilizando una centrífuga de mesa. Transferir el sobrenadante a un tubo cónico ( Figura 1 ).
- Centrifugar el sobrenadanteA 2.000 xg durante 20 min en una centrífuga de mesa. Transferir el sobrenadante a un tubo de ultracentrífuga y dejar las células muertas y los residuos celulares ( Figura 1 ].
- Centrifugar el sobrenadante a 10.000 xg durante 30 min a 4 ° C. Transferir el sobrenadante a un nuevo tubo de ultracentrífuga ( Figura 1 ).
- Centrifugar el sobrenadante a 110.000 xg durante 60 min a 4 ° C. Se retira el sobrenadante y se resuspende el sedimento EV / exosoma en PBS ( Figura 1 ).
- Centrifugar el sobrenadante a 110.000 xg durante 60 min a 4 ° C. Retirar el sobrenadante. Resuspender el EV / exosoma pellet en PBS ( Figura 1 ]. Resuspender el gránulo aislado de 240-480 mL de medio acondicionado con NAMEC en 100 μl.
- Medir la concentración de proteína de la suspensión EV con el ensayo de proteínas BCA. Asegúrese de que la concentración es de alrededor de 20-40 μg / 100 μl. Almacenar a -20 ° C paraanálisis mas extenso.
- Medir la concentración y el tamaño de los EVs / exosomes por el análisis de seguimiento de nanopartículas (NTA), como se describe anteriormente por Gardiner et al. 11 . Diluir los EVs / exosomas (20 μg / 100 μl) con PBS hasta 10.000 veces para el análisis de NTA.
NOTA: El resultado del análisis de NTA refleja el número y tamaño de las vesículas analizadas. - Imagen EVs / exosomes con transmisión microscopía electrónica (TEM), como se describe anteriormente por Lin et al [ 4] .
2. Purificación de los exosomas utilizando un gradiente de densidad
- Resuspender el gránulo de 110.000 g de la etapa 1.7 en yodixanol al 40% (p / v) en PBS (2 ml). Superponer la mezcla en secuencia con alícuotas de yodixanol al 30%, 20%, 10% y 5% (p / v) en PBS (2 ml cada uno) para formar un gradiente de densidad en un tubo de ultracentrífuga.
- Centrifugar la mezcla a 200.000 xg durante 8 h a 4 ° C.
- Recoja cada fracción de gradiente (10 fractiOns 1 ml / fracción) con una pipeta de la parte superior del tubo.
- Analizar la presencia de marcadores de exosomas ( por ejemplo, CD81, CD9, CD63 y Tsg101) en cada fracción mediante SDS-PAGE 12 y Western blot. Cargar 50 μl de suspensiones de cada fracción en un gel al 10% que contenga SDS al 0,1% (p / v) y separar las proteínas en fracciones con electroforesis en gel.
- Transferir las proteínas de un gel a una membrana de PVDF e incubar la membrana con anticuerpos contra los marcadores de exosomas ( por ejemplo, CD81, CD9, CD63 y Tsg101) y la proteína doméstica GAPDH durante la noche ( Tabla de Materiales ) a 4ºC.
NOTA: El resultado identifica la fracción que contiene los exosomas.
3. Etiquetado de vesículas / exosomas extracelulares
- Suspender los EVs / exosomas, obtenidos en el paso 1.7, en 10 μM de éster de diacetato de succinimidilo de carboxifluoresceína (CFSE) a 20 μg de proteína exosomal / 100 μl. Preparar una muestra paralela coConservando sólo CFSE y PBS, procesados de la misma manera, como un control negativo para los ensayos de absorción de EV / exosoma más tarde. Dejar las mezclas a 37 ° C durante 30 min.
- Suspender los EVs / exosomas en 50 x volumen de PBS y centrifugar la suspensión a 110.000 xg durante 60 min a 4 ° C. Se retira el sobrenadante y se resuspende el pellet EV / exosoma en PBS. Repita el paso 3.2 una vez.
- Suspender los EVs / exosomas en PBS a una concentración de 20 μg de proteína exosomal / 100 μL y luego filtrar los EVs / exosomas a través de membranas de 0,22 μm antes de añadir los EVs / exosomas a las células.
4. Ensayo de Absorción de Vesículas / Exosomas Extracelulares
- Para preparar el medio de cultivo, mezclar 500 ml de MCDB 170, pH 7,4 + 500 ml de DMEM / F12 con bicarbonato sódico (0,2438%); EGF (5 ng / ml); Hidrocoritisona (0,5 mu g / ml); Insulina (5 mu g / ml); Y BPE (35 mu g / ml) 4 . Placa las células HMLE epitelial mamaria humana en placas de 6 pocillos (1 x 106 </ Sup> células / pocillo) un día antes del tratamiento EV / exosoma. Se a~nadieron EVs / exosoma marcados con fluorescencia CFSE de 2 μg / mL, obtenidos en el paso 3.3, al medio de cultivo de las células HMLE durante 2-6 h. Tratar las células HMLE del grupo de control negativo con la preparación paralela, descrita en el paso 3.1.
- Después de la incubación de 2 a 6 h, lavar las células dos veces con 4 ml de PBS a temperatura ambiente.
- Se separan las células con tripsina al 0,25% durante 10 min y se vuelven a suspender las células en PBS que contiene 0,2% de FBS. Mida la absorción EV / exosoma de la intensidad de fluorescencia en las células utilizando un analizador de células de fluorescencia [ 4] . Imagen de las células tratadas con EVs / exosomes o el control negativo mediante microscopía confocal.
NOTA: La fluorescencia verde en las células es causada por la absorción de EV / exosoma. Vea la leyenda de la Figura 6 para los ajustes del microscopio.
5. Aislamiento de células epiteliales mamarias de ratón primario
- Preparar platos recubiertos con gelatina añadiendo 12 ml de solución de gelatina al 0,1% a platos de 10 cm. Colocar las placas en una incubadora a 37 ° C durante 30 min. Quitar la solución de gelatina y dejar las tapas de los platos en una campana de flujo laminar durante 4 h hasta que el recubrimiento de gelatina se ha secado.
- Diseccionar las glándulas mamarias número 2, 3, 4 y 5 ( Figura 2 ) de ratones C57BL / 6 hembra virgen de 12 semanas usando tijeras y cortar las glándulas en pedazos pequeños (2 mm 2 ) usando una maquinilla de afeitar.
- Disociar aún más la suspensión de glándulas mamarias (de 10 ratones) durante 60 minutos a 37ºC, agitación de 120 rpm con 50 ml de DMEM / F12 que contiene 0,2% de colagenasa tipo IV, tripsina al 0,2%, FBS al 5%, gentamicina 5 μg / ml , Y 1x pen-strep.
- Recoger los organoides epiteliales de la mezcla por centrifugación a 350 xg durante 10 min.
- Suspender los organoides epiteliales en 4 mL de DMEM / F12 con 0,1 mg / ml de DNasa I durante 5 min a temperatura ambiente. Añadir 6 ml de DMEM / F12 a una solución finalVolumen de 10 ml.
- Centrifugar la suspensión a 400 xg durante 10 min a temperatura ambiente y descartar el sobrenadante.
- Resuspender el sedimento en 10 ml de DMEM / F12. Centrifugar la suspensión pero golpear el freno cuando la velocidad alcanza 400 x g. Deseche el sobrenadante.
NOTA: Al golpear el freno, los organoides epiteliales se precipitan rápidamente, mientras que los fibroblastos, como células individuales, permanecen en el sobrenadante. - Repita los pasos 5.6 y 5.7 5-7 veces. Añadir una gota de la suspensión a un hemocitómetro y luego comprobar el aclaramiento de fibroblastos de la mezcla de organoides bajo microscopía después de cada ronda de centrifugación ( Figura 3 ].
- Se cubren los organoides en el plato recubierto con gelatina, obtenidos en el paso 5.1, durante 48 h con DMEM / F12 que contiene 1x ITS, 5% de FBS, 50 μg / ml de gentamicina, 10 ng / ml de EGF y 1x pen-strep.
- Después de 48 h, eliminar las células flotantes en el cultivo mediante la sustitución del medio con medio de cultivo fresco sin FBS (DMEM / F12 que contiene 1x ITS, 50 μg / ml de gentamicina, 10 ng / ml de EGF y 1x pen-strep).
- Confirme que una monocapa de células epiteliales mamarias migra y crece a partir de los organoides epiteliales unidos en 3 días.
6. Separación de las células epiteliales mamarias basales / lumínicas del ratón primario
- Después del cultivo de 3 días, separar las células mamarias primarias de ratón con una mezcla enzimática natural con actividad enzimática proteolítica y colagenolítica durante 20 minutos. Neutralizar la actividad enzimática con FBS al 5% en PBS.
- Centrifugar la suspensión a 450 xg durante 10 min a temperatura ambiente y descartar el sobrenadante. Resuspender el sedimento celular en 5 mg / ml dispase durante 20 min. Neutralizar la actividad enzimática con FBS al 5% en PBS.
- Centrifugar la suspensión a 450 xg durante 10 min a temperatura ambiente y descartar el sobrenadante.
- Se volvieron a suspender las células en 100 μl de PBS con FBS al 0,2% a una concentración de 10 7 células / ml con el diluidoAnti-CD49f y anticuerpos anti-EpCAM en hielo durante 1 h en la oscuridad.
- Lavar las células con PBS y luego incubar las células con anticuerpo secundario conjugado con fluoróforo en hielo durante 30 minutos en la oscuridad.
- Lavar y volver a suspender las células en PBS con 0,2% de FBS.
- Clasificar el EpCAM hi / CD49f lo células epiteliales mamarias luminal en un clasificador de células [ 4] .
7. Tratamiento extracelular de vesículas / exosomas
- Seed las células epiteliales mamarias lumonales EpCAM hi / CD49f seleccionadas de la etapa 6,7 en placas de 6 pocillos recubiertas con gelatina (2 x 10 ^ { 5 } células / pocillo) y luego se tratan con PBS o EVs / exosomas derivados de NAMEC de 2 μg / mL Obtenido en el paso 1.7.
- Para asegurar la eficacia biológica de los VE / exosomas en el tratamiento de cultivo a largo plazo, reemplazar el medio de cultivo celular con medio fresco que contenga PBS o 2 μg / mL de EVs / exosomas derivados de NAMEC cada dos días. No divida el mouse primaDurante el tratamiento de 10 días.
8. Inyección de grasa de células epiteliales mamarias
- Anestesiar a una mujer de 3 semanas de edad C57BL / 6 ratones con isofluorano 2-3% inhalante.
- Coloque el ratón anestesiado en la espalda. Retire la piel del abdomen medio con una crema de afeitar / cabello y limpie el sitio de la cirugía con tres ciclos alternos de alcohol al 70% y yoduro de povidona.
- Hacer una incisión vertical de 1,5 cm a través de la piel a lo largo de la región ventral torácico-inguinal con tijeras y, alternativamente, exponer las almohadillas de grasa mamaria derecha e izquierda 4.
- Limpie cada almohadilla de grasa quitando el parénquima de las glándulas con unas tijeras. Localice el ganglio linfático en la almohadilla de grasa y luego retire el parénquima de la glándula entera debajo del ganglio linfático.
NOTA: Dos tercios de la almohadilla de grasa deben permanecer en su lugar. - Se separan las células obtenidas de la etapa 7.2 con una mezcla enzimática natural (véase la Tabla de Materiales ) con proteolítica aY la actividad enzimática colagenolítica durante 10 min. Neutralizar la actividad enzimática con FBS al 5% en PBS.
- Centrifugar la suspensión a 450 xg durante 10 min a temperatura ambiente y descartar el sobrenadante. Contar las células con un hemocitómetro y suspender las células en PBS a una concentración tal que 15 μL contengan la dosis celular deseada (10 4 -10 2 células / almohadilla).
- Inyectar 15 μL de suspensión de células epiteliales mamarias en una almohadilla grasa usando una jeringa de vidrio de 100 μL unida a una aguja 27G.
- Repita los pasos 8.4-8.7 para la almohadilla de grasa en el otro lado.
- Cierre la piel con clips de herida.
9. Suelo entero de la glándula mamaria
- Eutanasia el ratón con CO 2 más dislocación cervical a las 8 semanas después de la inyección celular (Paso 8.7).
- Hacer una incisión vertical a través de la capa de la piel de la región torácica a la región inguinal con tijeras y luego exponer tanto la derecha y la izquierda 4 thAlmohadillas de grasa amiga. Retire las glándulas mamarias cuarto ( Figura 2 ).
- Se separan las almohadillas de grasa en portaobjetos de microscopio de vidrio y se fijan las almohadillas de grasa con fijador de Kahle (formaldehído al 4%, EtOH al 30% y ácido acético glacial al 2%) a temperatura ambiente durante la noche.
Precaución: El fijador de Kahle es irritante. Realice este paso en un capó químico. - Lave las almohadillas de grasa en 250 ml de EtOH al 70% durante 15 minutos y luego en 250 ml de dH $ ₂ $ O durante 5 min. Mancha las almohadillas de grasa con alumbre de carmín (1 g de carmín y 2,5 g de sulfato de aluminio y potasio en 500 ml de dH $ ₂ $ O) a temperatura ambiente durante la noche.
- Lavar las almohadillas de grasa con 250 ml de EtOH al 70% durante 15 min, 250 ml de EtOH al 95% durante 15 min y 250 ml de EtOH al 100% durante 15 min.
- Limpie las almohadillas de grasa en xileno durante días y detenga la incubación de xileno cuando las almohadillas de grasa se vuelven transparentes.
Precaución: El xileno es irritante. Realice este paso en un capó químico. - Monte las diapositivas conTh y tomar imágenes (2.400 dpi) de las almohadillas de grasa utilizando un escáner digital de diapositivas.
Resultados
Debido a que se ha demostrado que el bloqueo de la señalización PGE2 / EP4 desencadena la liberación de EV / exosoma a partir de células madre mamarias basales 4 , este trabajo presenta un método para aislar los EVs / exosomas inducidos del cultivo de células basales epiteliales mamarias (NAMEC). Dado que NAMECs se cultivan en suero libre de medio, no hay pre-existentes EVs / exosomas derivados de suero [ 13] . Para las células cultivadas en medio que contiene suero, los exosomas preexistentes en el medio deben ser previamente limpiados por ultracentrifugación a 110.000 xg antes de que el medio se utilice para cultivar las células fuente para la recolección de EVs / exosomas 5 . Los EVs / exosomas del medio condicionado inducido por NAMEC de 4 días pueden aislarse a partir del gránulo de 110.000 xg por ultracentrifugación diferencial, como se ilustra en la Figura 1 . El número y el tamaño de las vesículas aisladas en el pell de 110.000 xgEt se puede medir mediante análisis de seguimiento de nanopartículas (NTA). La fracción de pellets de 110.000 g aislada por ultracentrifugación diferencial contiene principalmente vesículas de ~ 100 nm ( Figura 4A ); Esto corresponde con el tamaño de los exosomas (50 - 150 nm) reportados en la literatura. Además, el análisis TEM demostró que 110.000 g de fracciones de medio acondicionado con NAMEC contienen abundantes vesículas de membrana ( Figura 4B ). Aunque la ultracentrifugación diferencial puede generar exosomas razonablemente puros, la siguiente etapa de purificación usando un gradiente de densidad elimina adicionalmente contaminantes ( por ejemplo, agregados proteicos) 5 . En el gradiente de densidad, los exosomas flotan en el gradiente debido al contenido de lípidos en la vesícula, mientras que los agregados de proteínas, si los hay, permanecen en la parte inferior del gradiente. Cada fracción del gradiente se recoge para la detección de fabricantes de exosomas ( por ejemplo, CD81, CD63, CD9 y TSG101 6 , 7 ) por Western blot. Los marcadores de exosomas se pueden detectar en la fracción con ~ 20% de yodixanol ( Figura 5 ). La fracción que contiene los exosomas puede diluirse con PBS y someterse a una ultracentrifugación de 200.000 xg para aislar los exosomas. El sedimento de exosomas aislado se lava una vez en PBS y luego se resuspende en PBS y se almacena a -20ºC para un análisis posterior.
Antes de medir la absorción de EVs / exosomas derivados de NAMEC por la contraparte no tallo de las células epiteliales mamarias (células HMLE), los EVs / exosomas deben marcarse con un colorante fluorescente ( por ejemplo, éster succinimidílico de carboxifluoresceína (CFSE)). Una muestra paralela que contiene sólo CFSE pero no EV / exosoma se procesa en el mismo procedimiento de etiquetado. Esta muestra es un control negativo utilizado en el siguiente ensayo de absorción EV / exosoma para reflejar el efecto de una cantidad traza de CFS libre residualE tinte. Las células HMLE se cultivan con EVs / exosomas derivados de NAMEC marcados con CFSE o el control negativo durante 2-6 h y se someten entonces a citometría de flujo. En comparación con las células HMLE no tratadas, las células HMLE cultivadas con el control negativo expresan un nivel ligeramente más alto de señal CFSE ( Figura 6A , línea roja frente a línea naranja), que refleja el nivel de fondo de la señalización CFSE causada por CFSE libre residual de la EV / exosome proceso de etiquetado. Además, comparadas con las células HMLE tratadas con control negativo, las células HMLE cultivadas con exosomas derivados de NAMEC marcados con CFSE expresan una señal CFSE 10 veces superior ( Figura 6A , línea azul frente a línea roja), que resulta de la captación específica De EVs / exosomas marcados con CFSE. La captación de EVS / exosomas derivados de NEMEC marcados con CFSE por las células HMLE también se puede observar mediante microscopía confocal. Aunque las células HMLE tratadas con control negativo no exhiben una señal CFSE, la absorción de NAMEC derivados EVs / exosomes por HMLE células se pueden observar con la CFSE señal bajo el microscopio confocal en CFSE marcado EV / exosome tratados con células ( Figura 6B ].
Para evaluar si los EVs / exosomas derivados de NAMEC pueden transferir la capacidad de formación de glándulas mamarias a partir de células basales mamarias similares a vástagos a células luminales mamarias, las células luminales mamarias de ratón se aíslan primero para permitir el análisis de la formación de glándulas mamarias en ratones. Se aislan células epiteliales mamarias de ratones de ratones de 12 semanas de edad. Las glándulas mamarias se cortan en pedazos pequeños y se disocian además con colagenasa y tripsina. Los organoides y fibroblastos epiteliales disociados pueden separarse por centrifugación diferencial, como se describe en los pasos 5.7 y 5.8. En cada ciclo de centrifugación, el gránulo en la parte inferior de los tubos debe contener principalmente organoides epiteliales, y los fibroblastos y las células individuales deben flotar en el sobrenadanteT En comparación con la mezcla que contiene tanto organoides epiteliales como fibroblastos antes de la centrifugación diferencial ( Figura 3 , paneles superiores), las seis rondas de centrifugación eliminan la mayoría de los fibroblastos y células individuales de la mezcla ( Figura 3 , panel inferior).
Las células epiteliales mamarias ( Figura 7 ) de los organoides epiteliales se disocian adicionalmente utilizando una mezcla enzimática natural con actividad enzimática proteolítica y colagenolítica y se dispase para generar células individuales en suspensión. La clasificación de la suspensión de célula única por la expresión de la superficie celular CD49f y EpCAM puede separar células luminal mamarias (EpCAM hi / CD49f lo ), células basales mamarias (EpCAM lo / CD49f hi ) y células no epiteliales (EpCAM - 8 ).
Las células epiteliales mamarias lumonares EpCAM hi / CD49f localizadas se cultivan con EVs / exosomas derivados de NAMEC durante 10 días, y los EVs / exosomas y el medio fresco se reemplazan cada dos días. Después del tratamiento con EV / exosoma, las células lumínicas mamarias se implantan en las almohadillas de grasa mamaria 4 ( Figura 2 ) de ratones. Después de 8 semanas, las almohadillas de grasa se aíslan y se tiñen para el análisis de la formación de glándulas mamarias ( Figura 9 ). El tratamiento con EVS / exosomas inducidos derivados de NAMEC permite que las células luminales adquieran capacidad formadora de glándulas mamarias 4 . El NAMEC derivado, EV / exosome tratados con células luminales mamarias forman glándulas mamarias en almohadillas de grasa de ratón ( Figura 9 ].

Figura 1: Ilustración de la ExtracelulaMétodo de purificación de vesículas / exosomas a partir del medio de cultivo celular mediante ultracentrifugación diferencial. Se indica la velocidad y la longitud de cada centrifugación. Después de cada una de las tres primeras centrifugaciones, el sobrenadante se mantiene para la siguiente etapa. Después de las centrifugaciones de 110.000 xg, los gránulos se mantienen y los sobrenadantes se desechan. Haga clic aquí para ver una versión más grande de esta figura.
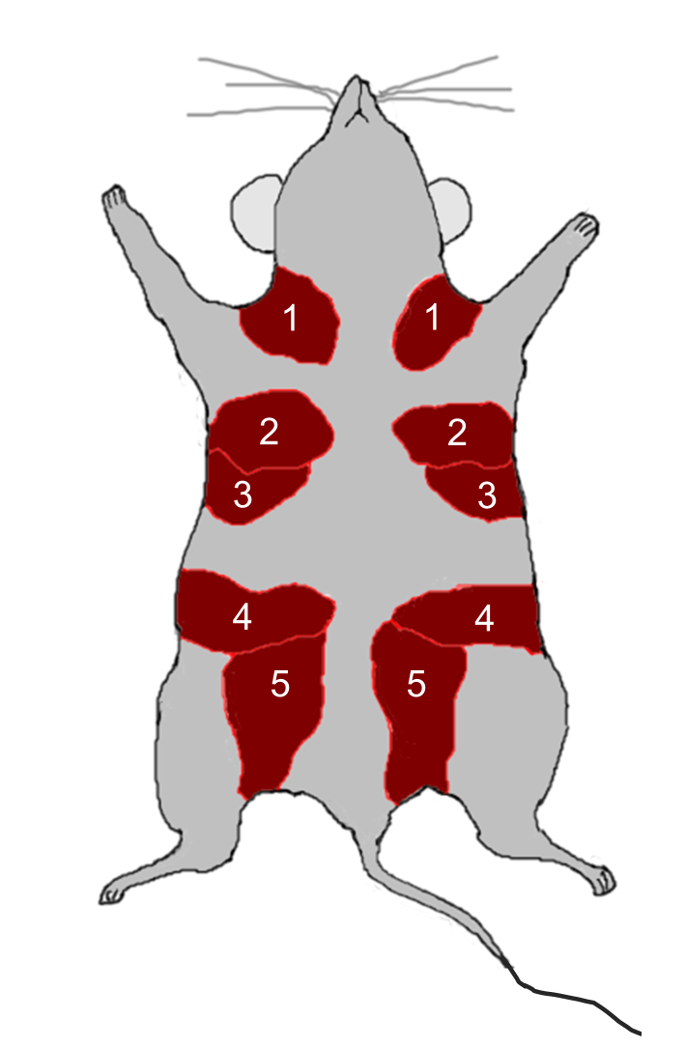
Figura 2: Anatomía de la glándula mamaria del ratón. Los ratones tienen cinco pares de glándulas mamarias, indicadas por los números 1-5, situadas en las almohadillas de grasa (rojo) directamente debajo de la piel. Haga clic aquí para ver una versión más grande deEs la cifra.

Figura 3: Imágenes de una mezcla de organoides epiteliales y células de almohadillas de grasa antes y después de la centrifugación diferencial. Imágenes de campo luminoso de las mezclas de células de grasa aisladas antes y después de la centrifugación diferencial, tomadas del hemocitómetro. Cabeza de flecha: organoides epiteliales. Flecha: fibroblastos y células individuales. Barra de escala = 0,5 mm. Haga clic aquí para ver una versión más grande de esta figura.
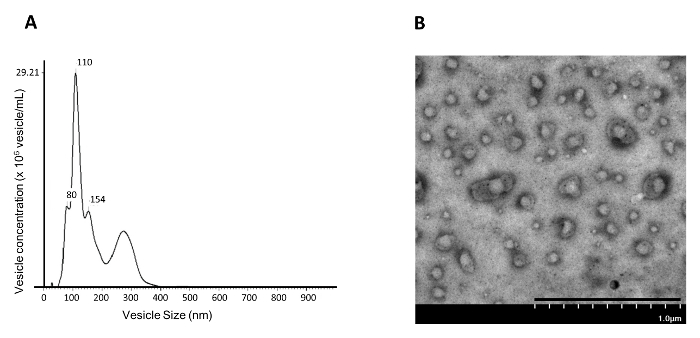
Figura 4: Tamaño de la Vesícula y Análisis de Concentración de NAMEC110.000 xg de Fracción de Pellet. La fracción de pellets de 110.000 g del medio NAMEC es col Y se somete a ( A ) análisis de seguimiento de nanopartículas (NTA) y ( B ) microscopía electrónica de transmisión (TEM). Barra de escala = 1 μm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Detección de exosomas en fracciones del gradiente de densidad. El análisis de transferencia Western de los marcadores de exosomas CD81, CD9, CD63 y Tsg101 y el gen de mantenimiento GAPDH revela la fracción de yodixanol al 20% que contiene los exosomas. Haga clic aquí para ver una versión más grande de esta figura.
55736fig6.jpg "/>
Figura 6: Detección de absorción de vesículas / exosomas extracelulares por citometría de flujo y microscopía confocal. La captación de EV / exosoma se midió en células HMLE. Los EVs / exosomas derivados de NAMEC, marcados con CFSE, y el control negativo se añaden a los cultivos indicados durante 6 h. Después de la incubación, las células se someten a ( A ) citometría de flujo y ( B ) microscopía confocal. Las intensidades de fluorescencia de CFSE (verde, excitación / emisión (nm): 492/517; microscopio láser: 488) reflejan la absorción de EV / exosoma. Los núcleos celulares se tiñen con DAPI (azul, excitación / emisión (nm): 358/461, línea láser de microscopio: 405) y las membranas plasmáticas se tiñen con tinción de membrana plasmática (rojo, excitación / emisión (nm): 649/666; Microscopio línea láser: 633, ver la Tabla de Materiales ). Objetivo de objetivo confocal: HCX PL APO 63x / 1.40-0.60 Aceite. Barra de escala = 20 μm.Ad / 55736 / 55736fig6large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
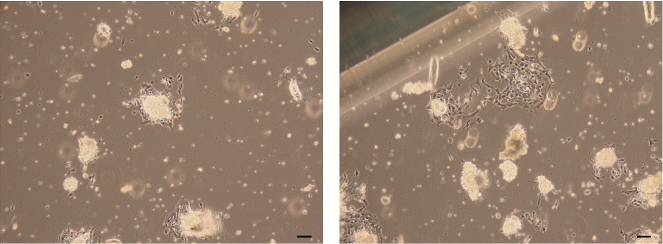
Figura 7: Imágenes de organoides epiteliales unidos. Imágenes de campo claro de células epiteliales mamarias formadas por las células que emigran y crecen fuera de los organoides epiteliales unidos. Barra de escala = 100 μm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8: Clasificación de células epiteliales mamarias de ratón primario por EpCAM de superficie y CD49f. Las células epiteliales mamarias de ratón aisladas de almohadillas grasas de ratones de 12 semanas de edad se someten a clasificación celularEn g. Las células lumínicas mamarias de ratón están enriquecidas en la población EpCAM hi / CD49f lo , marcada con el círculo azul; Las células basales se enriquecieron en la población EpCAM lo / CD49f hi , marcada con el círculo rojo. Las células no epiteliales están marcadas con la caja negra en la parcela. Haga clic aquí para ver una versión más grande de esta figura.

Figura 9: Formación de glándulas mamarias por células primarias de células lumínicas de ratón. Las células lumínicas epCAM hi / CD49f primarias de ratón se tratan con PBS o EVs / exosomas derivados de NAMEC en cultivo celular durante 10 días y se implantan en las almohadillas de grasa limpia de ratones de 3 semanas de edad. Los ratones son eutanasiados y necropsiados después de 8 semanas para analizar la forma de glándula mamariaCión. Barra de escala = 0.75 cm. Haga clic aquí para ver una versión más grande de esta figura.
| Porcentaje | MFI de EpCAM | MFI de CD49f | |
| Célula luminal mamaria | 0,437 | 4,57 x 10 4 | 8183 |
| (EpCAM hi / CD49f lo ) | |||
| Células basales mamarias | 0,09 | 5452. | 2,23 x 10 4 |
| (EpCAM lo / CD49f hi ) | |||
| No epiteliales(EpCAM - ) | 0,309 | 53 | 4619 |
Tabla 1: Porcentaje y Media Intensidad de Fluorescencia (MFI) de las Poblaciones Descritas en la Figura 8.
Discusión
Los exosomas a menudo llevan características de las células que las liberaron, y la cantidad de exosomas liberados puede ser inducida por los estímulos [ 4] . El medio de cultivo de células puede ser recogido y sometido a ultracentrifugación diferencial para EV / exosome colección ( Figura 1 ]. Actualmente no existe un acuerdo general sobre un método ideal para aislar EVs / exosomas. El método óptimo utilizado aquí ha sido determinado por la aplicación descendente 14 . La ultracentrifugación es un método relativamente rápido para el aislamiento de EVs / exosomas, que pueden preservar la actividad biológica de los EVs / exosomas. Sin embargo, las vesículas aisladas por ultracentrifugación contienen generalmente una mezcla de EVs, que contienen exosomas producidos a través de compartimentos endosómicos y / o vesículas producidas por brotación de la membrana celular.
Analizando los tamaños de vesículas con NTA ( Figura 4A 15 .
Aunque la ultracentrifugación diferencial puede usarse para purificar exosomas, se debería usar un gradiente de densidad para eliminar adicionalmente la contaminación de agregados de proteínas de las vesículas de exosomas en la fracción aislada de 110.000 xg 5 por ejemplo, CD81, CD63, CD9 y TSG101 6 , 7 ). Al analizar la presencia de marcadores de exosomas en las fracciones del gradiente de densidad, es posible identificar exosomas en la fracción con ~ 20% de yodixanol ( Figura 5 ). Múltiples marcadores de exosomas deben ser examinados para identificar los exosomas en el gradiente de densidad, ya que cada población de exosomas pueden expresar diferentes marcadores de exosomas [ 16] .
La captación de EVs / exosomas por las células se puede medir utilizando fluorescentes marcados con EV / exosomes. El número de células que ingerían EVs / exosomas marcados se puede medir por citometría de flujo ( Figura 6A ). Para confirmar que el fluoRescence de las células resultan de la captación de EVs / exosomes marcados pero no de colorante libre, el patrón de fluorescencia se examinó en las células utilizando microscopía. La microscopía confocal muestra que el patrón de fluorescencia en las células tratadas con EV / exosoma es punteado ( Figura 6B panel derecho). Es probable que las señales punteadas resulten de EVs / exosomas marcados, no de fluorescencia libre. Las señales punteadas en las células pueden analizarse con una microscopía de super-resolución de iluminación estructurada, que tiene la mayor resolución a 85 nm 4 , 17 . Super-resolución de microscopía puede confirmar que las señales punteadas son de ~ 100-nm vesículas huecas, que se asemejan a los exosomas [ 4] . Estos resultados sugieren que los exosomas derivados de NAMEC pueden ser ingeridos por células epiteliales mamarias en cultivo.
Los EVs / exosomas derivados de NAMEC llevan a menudo moléculas ( por ejemplo, proteínas y miRNAs) esenciales para las características de ciertas células 1 . Esto sugiere que los EVs / exosomas derivados de NAMEC pueden transferir las propiedades de NAMECs ( por ejemplo, la capacidad de formación de glándulas mamarias) a sus homólogos de células epiteliales. Debido a que las células epiteliales mamarias humanas no pueden formar glándulas mamarias de forma xenogénica en almohadillas de grasa de ratón 18 , 19 , la transferencia de la capacidad de formación de glándulas se puede examinar usando células epiteliales mamarias primarias de ratón. Se pueden aislar células mamarias primarias mamarias EpCAM hi / CD49f de ratón, que no forman glándulas mamarias, a partir de ratones de 6 semanas de edad ( Figura 7 y Figura 8 ). Las células aisladas de almohadillas de grasa de ratón se pueden dividir en tres grupos ( es decir, células lumínicas EpCAM hi / CD49f, células basales EpCAM lo / CD49f y epCAM - células no epiteliales) examinando elDe superficie EpCAM y CD49f ( Figura 8 ). Las células basales de EpCAM lo / CD49f hi pueden formar glándulas mamarias en modas gordas cuando se transplantan en almohadillas de grasa, pero las células lumínicas EpCAM hi / CD49f no pueden 4 . De este modo, la población de células luminales EpCAM hi / CD49f puede usarse para examinar la capacidad de EVs / exosomas derivados de NAMEC inducidos para transferir la capacidad de formación de glándulas mamarias. Las células luminal aisladas de EpCAM hi / CD49f pueden mantenerse en cultivo durante 7-10 días para el tratamiento EV / exosoma 4 . Debe observarse que el mantenimiento de las células epiteliales mamarias primarias in vitro durante más tiempo puede atenuar la viabilidad de las células.
Las células luminales mamarias tratadas con EV / exosoma pueden ser implantadas en almohadillas de grasa limpia para analizar la capacidad de formación de glándulas mamarias. Las almohadillas de grasa de los ratones utilizados para la implantación se debe limpiar a las 3 semanas de edad. UNT 3 semanas de edad, las células epiteliales mamarias se limitan a la región entre el pezón y la linfa de una almohadilla de grasa. El epitelio mamario en una almohadilla grasa puede eliminarse eliminando la región entre el pezón y la linfa a las 3 semanas de edad. Las células lumínicas mamarias se implantan justo después de limpiar la almohadilla de grasa, y la formación de glándulas por las células implantadas se puede analizar a las 8 semanas después de la implantación. El efecto de los EVs / exosomas derivados de NAMEC sobre la transferencia de la capacidad de formación de glándulas mamarias a células luminales mamarias puede evaluarse mediante la formación de glándulas de células luminales y células luminales tratadas con EV / exosoma ( Figura 9 ). Los EVs / exosomas inducidos de NAMECs llevan la propiedad de células epiteliales basales mamarias - capacidad de formación de glándulas - y las células luminales que ingieren los EVs / exosomas inducidos de NAMECs pueden adquirir la propiedad de NAMECs a través de EVs / exosomes. Este trabajo demuestra pruebas que demuestran que las moléculas responsables de la EV / exosome-mediaEn las balsas lipídicas de EVs / exosomas 4 .
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por subvenciones de los Institutos Nacionales de Investigación en Salud (05A1-CSPP16-014, HJL) y del Ministerio de Ciencia y Tecnología (MOST 103-2320-B-400-015-MY3, HJL).
Materiales
| Name | Company | Catalog Number | Comments |
| MCDB 170 | USBiological | M2162 | |
| DMEM/F12 | Thermo | 1250062 | |
| Optima L-100K ultracentrifuge | Beckman | 393253 | |
| SW28 Ti Rotor | Beckman | 342204 | |
| SW41 Rotor | Beckman | 331306 | |
| NANOSIGHT LM10 | Malvern | NANOSIGHT LM10 | for nanoparticle tracking analysis (NTA) |
| Optiprep | Sigma-Aldrich | D1556 | 60% (w/v) solution of iodixanol in water (sterile). |
| CD81 antibody | GeneTex | GTX101766 | 1:1,000 in 5% w/v nonfat dry milk, 1x TBS, 0.1% Tween 20 at 4 °C, overnight |
| CD9 antibody | GeneTex | GTX100912 | 1:1,000 in 5% w/v nonfat dry milk, 1x TBS, 0.1% Tween 20 at 4 °C, overnight |
| CD63 antibody | Abcam | Ab59479 | 1:1,000 in 5% w/v nonfat dry milk, 1x TBS, 0.1% Tween 20 at 4 °C, overnight |
| TSG101 antibody | GeneTex | GTX118736 | 1:1,000 in 5% w/v nonfat dry milk, 1x TBS, 0.1% Tween 20 at 4 °C, overnight |
| GAPDH | GeneTex | GTX100118 | 1:6,000 in 5% w/v nonfat dry milk, 1x TBS, 0.1% Tween 20 at 4 °C, overnight |
| CFSE (carboxyfluorescein succinimidyl diacetate ester) | Thermo | V12883 | |
| FACSCalibur | BD Biosciences | fluorescence cell analyzer | |
| collagenase Type IV | Thermo | 17104019 | |
| trypsin | Thermo | 27250018 | |
| ITS | Sigma-Aldrich | I3146 | a mixture of recombinant human insulin, human transferrin, and sodium selenite |
| accutase | ebioscience | 00-4555-56 | a natural enzyme mixture with proteolytic and collagenolytic enzyme activity |
| dispase | STEMCELL | 7913 | 5 mg/mL = 5 U/mL |
| anti-CD49f antibody | Biolegend | 313611 | 1:50 |
| anti-EpCAM antibody | Biolegend | 118213 | 1:200 |
| FACSAria | BD Biosciences | cell sorter | |
| carmine alum | Sigma-Aldrich | C1022 | |
| human mammary epithelial cells (HMLE cells, NAMECs) | gifts from Dr. Robert Weinberg | ||
| permount | Thermo Fisher Scientific | SP15-500 | |
| sodium bicarbonate | Zymeset | BSB101 | |
| EGF | Peprotech | AF-100-015 | |
| Hydrocoritisone | Sigma-Aldrich | SI-H0888 | |
| Insulin | Sigma-Aldrich | SI-I9278 | |
| BPE (bovine pituitary extract) | Hammod Cell Tech | 1078-NZ | |
| GW627368X | Cayman | 10009162 | |
| 15 cm culture dish | Falcon | 353025 | |
| table-top centrifuge | Eppendrof | Centrifuge 3415R | |
| ultracentrifuge tube | Beckman | 344058 | |
| PBS (Phosphate-buffered saline) | Corning | 46-013-CM | |
| BCA Protein Assay | Thermo Fisher Scientific | 23228 | |
| Transmission Electron Microscopy | Hitachi | HT7700 | |
| gelatin | STEMCELL | 7903 | |
| 10 cm culture dish | Falcon | 353003 | |
| 6-well culture dish | Corning | 3516 | |
| female C57BL/6 mice | NLAC (National Laboratory Animal Center | ||
| FBS (Fetal Bovine Serum) | BioWest | S01520 | |
| gentamycin | Thermo Fisher Scientific | 15710072 | |
| Pen/Strep | Corning | 30-002-Cl | |
| DNase I | 5PRIMER | 2500120 | |
| isofluorane | Halocarbon | NPC12164-002-25 | |
| formaldehyde | MACRON | H121-08 | |
| EtOH (Ethanol) | J.T. Baker | 800605 | |
| glacial acetic acid | Panreac | 131008.1611 | |
| aluminum potassium sulfate | Sigma-Aldrich | 12625 | |
| Xylene | Leica | 3803665 | |
| 0.22 μm membranes | Merck Millipore | Millex-GP | |
| AUTOCLIP Wound Clips, 9 mm | BD Biosciences | 427631 | |
| AUTOCLIP Wound Clip Applier | BD Biosciences | 427630 | |
| CellMask™ Deep Red | Thermo Fisher Scientific | C10046 | plasma membrane stain |
Referencias
- Simons, M., Raposo, G. Exosomes--vesicular carriers for intercellular communication. Curr Opin Cell Biol. 21 (4), 575-581 (2009).
- Théry, C., Ostrowski, M., Segura, E. Membrane vesicles as conveyors of immune responses. Nat Rev Immunol. 9 (8), 581-593 (2009).
- Boelens, M., et al. Exosome Transfer from Stromal to Breast Cancer Cells Regulates Therapy Resistance Pathways. Cell. 159 (3), 499-507 (2014).
- Lin, M. C., et al. PGE2 /EP4 Signaling Controls the Transfer of the Mammary Stem Cell State by Lipid Rafts in Extracellular Vesicles. Stem Cells. , (2016).
- Théry, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Curr Protoc Cell Biol. , (2006).
- György, B., et al. Membrane vesicles, current state-of-the-art: emerging role of extracellular vesicles. Cell Mol Life Sci. 68 (16), 2667-2688 (2011).
- Olver, C., Vidal, M. Proteomic analysis of secreted exosomes. Subcell Biochem. 43, 99-131 (2007).
- Shackleton, M., et al. Generation of a functional mammary gland from a single stem cell. Nature. 439 (7072), 84-88 (2006).
- Prater, M. D., et al. Mammary stem cells have myoepithelial cell properties. Nat Cell Biol. 16 (10), 942-950 (2014).
- Stingl, J., et al. Purification and unique properties of mammary epithelial stem cells. Nature. 439 (7079), 993-997 (2006).
- Gardiner, C., Ferreira, Y. J., Dragovic, R. A., Redman, C. W., Sargent, I. L. Extracellular vesicle sizing and enumeration by nanoparticle tracking analysis. J Extracell Vesicles. 2, (2013).
- Shapiro, A. L., Viñuela, E., Maizel, J. V. Molecular weight estimation of polypeptide chains by electrophoresis in SDS-polyacrylamide gels. Biochem Biophys Res Commun. 28 (5), 815-820 (1967).
- Riches, A., Campbell, E., Borger, E., Powis, S. Regulation of exosome release from mammary epithelial and breast cancer cells - a new regulatory pathway. Eur J Cancer. 50 (5), 1025-1034 (2014).
- Witwer, K. W., et al. Standardization of sample collection, isolation and analysis methods in extracellular vesicle research. J Extracell Vesicles. 2, (2013).
- van der Vlist, E. J., Nolte-'t Hoen, E. N., Stoorvogel, W., Arkesteijn, G. J., Wauben, M. H. Fluorescent labeling of nano-sized vesicles released by cells and subsequent quantitative and qualitative analysis by high-resolution flow cytometry. Nat Protoc. 7 (7), 1311-1326 (2012).
- Kowal, J., et al. Proteomic comparison defines novel markers to characterize heterogeneous populations of extracellular vesicle subtypes. Proc Natl Acad Sci U S A. 113 (8), E968-E977 (2016).
- Li, D., et al. ADVANCED IMAGING. Extended-resolution structured illumination imaging of endocytic and cytoskeletal dynamics. Science. 349 (6251), (2015).
- Outzen, H. C., Custer, R. P. Growth of human normal and neoplastic mammary tissues in the cleared mammary fat pad of the nude mouse. J Natl Cancer Inst. 55 (6), 1461-1466 (1975).
- Sheffield, L. G., Welsch, C. W. Transplantation of human breast epithelia to mammary-gland-free fat-pads of athymic nude mice: influence of mammotrophic hormones on growth of breast epithelia. Int J Cancer. 41 (5), 713-719 (1988).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados