Method Article
細胞外小胞/エキソソームを介した乳腺上皮細胞と乳房管腔細胞との間の乳腺形成能の伝達
要約
このプロトコルは、非接着性/間葉性乳房上皮細胞からの細胞外小胞(EVs)/エキソソームの精製、定量化および特徴づけ方法、ならびにこれらを用いて乳腺上皮細胞に乳腺形成能を転移させる方法を記載する。幹様乳腺上皮細胞に由来するEV /エキソソームは、この細胞特性をEV /エキソソームを摂取する細胞に移入することができる。
要約
細胞は、エキソソームを介して、タンパク質、脂質、および核酸を含む約100nmの細胞外小胞(EV)と通信することができる。非接着/間葉系乳房上皮細胞(NAMEC)由来の細胞外小胞は、示差的超遠心分離によってNAMEC培地から単離することができる。それらの密度に基づいて、EVは110,000×gでの超遠心分離によって精製することができる。超遠心分離からのEV調製物は、可溶性タンパク質の混入を防ぐために連続密度勾配を用いてさらに分離することができる。次いで精製されたEVを、調製物中の小胞のサイズおよび数を測定するナノ粒子追跡分析を用いてさらに評価することができる。 50〜150nmの範囲の細胞外小胞はエキソソームである。 NAMEC由来のEV /エキソソームは、乳腺上皮細胞によって摂取され得、これは、フローサイトメトリーおよび共焦点顕微鏡によって測定され得る。いくつかの乳腺幹細胞の特性( 例えば、乳腺形成能)は、NAMEC由来EVs /エキソソームを介して、幹様NAMECから乳房上皮細胞に移され得る。単離された一次EpCAM hi / CD49f lo管腔上乳腺細胞は、マウス脂肪パッドに移植された後、乳腺を形成することができず、EpCAM lo / CD49fは、移植後に乳腺を形成する。 EpCAM hi / CD49f lo管腔上乳腺上皮細胞によるNAMEC由来EVs /エキソソームの取り込みは、脂肪パッドに移植された後に乳腺を発生させる。幹様乳腺上皮細胞に由来するEV /エキソソームは、EpCAM hi / CD49f lo管腔上乳腺上皮細胞に乳腺形成能を伝達する。
概要
エキソソームは細胞間の膜とサイトゾルタンパク質、脂質、RNAを伝達することで細胞間の伝達を媒介することができます1 。エキソソーム媒介性の伝達は、多くの生理学的および病理学的プロセス( すなわち、抗原提示、寛容2の発生および腫瘍進行3 )に関与することが実証されている。エキソソームはしばしば、それらを放出するソース細胞のものと同様の内容を有する。したがって、エキソソームは、供給源細胞から特定の細胞特性を運び、それらを摂取する細胞にこれらの特性を伝達することができる4 。
エキソソームは、50〜150nmの二重層膜ベシクルであり、特異的マーカー( 例えば、 CD9、CD81、CD63、HSP70、Alix、およびTSG101)を提示する。したがって、エキソソームは、異なる側面のための様々な方法によって特徴付けられなければならない。透過電子顕微鏡法を用いて膜小胞を可視化することができる例えば、エキソソーム4,5 。精製されたエキソソームのサイズおよび数を測定するために、ナノ粒子追跡分析(NTA)および動的光散乱分析(DLS)が使用される。エキソソームの脂質膜含量は、密度勾配によって確認することができる。 CD9、CD81、CD63、HSP70、Alix、およびTSG101,6,7などのエキソソームマーカーは、ウェスタンブロッティングによって測定することができる。
乳房基底細胞は、脂肪パッドに移植されたとき乳腺を生成する能力を有するが、内腔細胞は8,9,10 であり得ない。従って、乳房基底細胞は、乳房再増殖単位とも呼ばれる。乳房基底および管腔細胞のモデルを用いることにより、EVs /エキソソームが異なる細胞集団間で細胞特性を伝達する能力を調べることができる。この作品乳房基底上皮細胞由来のEV /エキソソームを用いて乳腺上皮細胞から乳房内腔上皮細胞への腺形成能を伝達する方法を実証する。ルーメン乳房上皮細胞は、基底細胞から分泌されたEV /エキソソームの摂取後に基底細胞特性を獲得し、次に乳腺4を形成することができる。
プロトコル
動物を含むすべての研究は、動物管理機関委員会によって承認されたプロトコールを遵守した。
1.細胞外小胞/エキソソームの単離および検証
- 培養乳房上皮基底細胞、NAMEC 4、500mLのMCDB170、pH7.4 + 500mLの重炭酸ナトリウム(0.2438%)を含むDMEM / F12からなる新鮮な無血清培地; EGF(5ng / mL)。ヒドロコルチゾン(0.5μg/ mL);インスリン(5μg/ mL)。ウシ下垂体抽出物(BPE;35μg/ mL);およびGW627368X(1μg/ mL)を15cmディッシュに入れた。
- 血球計数器で細胞を計数した後、0日目に15cmディッシュあたり12mLの培地に1.2x10 6個の細胞を4日間播種する4 。
- 培養4日後、卓上遠心分離機を用いて300 xgで5分間遠心します。上清をコニカルチューブに移す( 図1 )。
- 上清を遠心分離する。卓上遠心分離機で2,000 xg、20分間。上清を超遠心分離チューブに移し、死んだ細胞と細胞破片を残す( 図1 )。
- 上清を10,000 xgで30分間4℃で遠心分離します。上清を新しい超遠心チューブに移す( 図1 )。
- 上清を110,000 xgで60分間4℃で遠心分離する。上清を除去し、EV /エキソソームペレットをPBS( 図1 )に再懸濁する。
- 上清を110,000 xgで60分間4℃で遠心分離する。上清を除去する。 EV /エキソソームペレットをPBSに再懸濁する( 図1 )。 NAMEC条件培地240〜480mLから単離したペレットを100μLで再懸濁する。
- BC懸濁液のタンパク質濃度をBCAタンパク質アッセイで測定する。濃度が約20〜40μg/ 100μLであることを確認してください。 -20℃での保存さらなる分析。
- 先にGardiner らによって記載されているように、ナノ粒子追跡分析(NTA)によってEV /エキソソームの濃度およびサイズを測定する。 11 。 NTA分析のために、EV /エキソソーム(20μg/100μL)をPBSで10,000倍に希釈する。
注:NTA分析の結果は、分析された小胞の数およびサイズを反映する。 - 以前にLin ら 4に記載されているように、透過電子顕微鏡(TEM)を用いてEV /エキソソームを画像化する。
2.密度勾配を用いたエキソソーム精製
- ステップ1.7の110,000gペレットをPBS(2mL)中の40%(w / v)イオジキサノールに再懸濁する。 PBS(それぞれ2mL)中の30%、20%、10%、および5%(w / v)のイオジキサノールのアリコートを順番に混合し、超遠心チューブに密度勾配を形成する。
- 混合物を200,000×gで4時間、8時間遠心分離する。
- 各グラジエントフラクションを収集する(10フラクションons; 1mL /画分)をピペットでチューブの上部から取り出します。
- SDS-PAGE 12およびウェスタンブロットによって、各画分のエキソソームマーカー( 例えば、 CD81、CD9、CD63およびTsg101)の存在を分析する。各画分の50μL懸濁液を0.1%(w / v)SDSを含む10%ゲルにロードし、タンパク質をゲル電気泳動で画分に分離する。
- タンパク質をゲルからPVDFメンブレンに移し、4℃で一晩エキソソームマーカー( 例えば CD81、CD9、CD63、およびTsg101)およびハウスキーピングタンパク質GAPDH( Table of Materials )に対する抗体と膜をインキュベートする。
注:結果は、エキソソームを含有する画分を同定する。
3.細胞外小胞/エキソソーム標識
- ステップ1.7で得られたEV /エキソソームを20μgのエキソソームタンパク質/100μLで10μMカルボキシフルオレセインスクシンイミジルジアセテートエステル(CFSE)に懸濁する。並列サンプルを準備する後のEV /エキソソーム取り込みアッセイのネガティブコントロールとして、同じ方法で処理されたCFSEおよびPBSのみを含む。混合物を37℃で30分間放置する。
- 50倍量のPBSにEV /エキソソームを懸濁し、4℃で60分間110,000×gで懸濁液を遠心分離する。上清を除去し、EV /エキソソームペレットをPBSで再懸濁する。ステップ3.2を1回繰り返します。
- EVs /エキソソームを20μgのエキソソームタンパク質/100μLの濃度でPBS中に懸濁させ、次にEVs /エキソソームを0.22μmの膜を通して濾過し、細胞にEV /エキソソームを添加する。
4.細胞外小胞/エキソソーム取り込みアッセイ
- 培養培地を作るために、500mLのMCDB170、pH7.4 + 500mLのDMEM / F12を重炭酸ナトリウム(0.2438%)と混合する。 EGF(5ng / mL)。ヒドロコルチゾン(0.5μg/ mL);インスリン(5μg/ mL)。およびBPE(35μg/ mL) 4 。ヒトの乳房上皮HMLE細胞を6ウェルディッシュ(1×10 6細胞//細胞> /ウェル)をEV /エキソソーム処理の1日前に投与する。ステップ3.3で得られた2μg/ mLのCFSE蛍光標識EV /エキソソームをHMLE細胞の培地に2〜6時間添加する。陰性対照群のHMLE細胞を、ステップ3.1で説明した平行調製物で処理する。
- 2〜6時間のインキュベーション後、室温で4mLのPBSで細胞を2回洗浄する。
- 0.25%トリプシンで10分間細胞を分離し、0.2%FBSを含むPBS中で細胞を再懸濁する。蛍光細胞分析装置4を使用して、細胞内の蛍光強度からのEV /エキソソーム取り込みを測定する。共焦点顕微鏡法を用いてEV /エキソソームまたはネガティブコントロールで処理した細胞を画像化する。
注:細胞の緑色の蛍光は、EV /エキソソームの取り込みによって引き起こされます。顕微鏡の設定については、 図6の凡例を参照してください。
原発性マウス乳腺上皮細胞の単離
- 0.1cmのゼラチン溶液12mlを10cmの皿に加えてゼラチン被覆皿を調製する。プレートを37℃のインキュベーターに30分間置く。ゼラチン溶液を除去し、ゼラチンコーティングが乾燥するまで4時間層流フード中で蓋を皿から離しておく。
- はさみを使用して12週齢の処女雌C57BL / 6マウスから2番、3番、4番、5番の乳腺( 図2 )を解剖し、剃刀を用いて小塊(2mm 2 )に切る。
- 0.2%コラゲナーゼIV型、0.2%トリプシン、5%FBS、5μg/ mLゲンタマイシンを含有する50mLのDMEM / F12を用いて、乳腺のスラリー(10匹のマウスから)を37℃で60分間、120rpmで攪拌しながらさらに解離させる。 、および1x pen-strep。
- 350×gで10分間遠心分離することにより、混合物から上皮オルガノイドをペレット状にペレット化する。
- 0.1mg / mL DNase Iを含む4mLのDMEM / F12に上皮オルガノイドを室温で5分間懸濁する。 6mLのDMEM / F12を最終10mLの容量。
- 懸濁液を室温で10分間400xgで遠心分離し、上清を捨てる。
- ペレットを10mLのDMEM / F12に再懸濁する。サスペンションを遠心分離機に乗せるが、速度が400 x gに達するとブレーキが掛かる。上清を捨てる。
注:ブレーキを叩くことによって、上皮オルガノイドは速やかにペレット化されますが、線維芽細胞は単細胞として上清中に残ります。 - 手順5.6と5.7を5〜7回繰り返します。血球計にサスペンションの一滴を加え、遠心分離の各ラウンド後に顕微鏡下でオルガノイド混合物から線維芽細胞のクリアランスをチェックする( 図3 )。
- 1x ITS、5%FBS、50μg/ mLゲンタマイシン、10ng / mL EGFおよび1xペン - ストレプを含有するDMEM / F12で、ステップ5.1で得られたゼラチンコートディッシュ中のオルガノイドを48時間培養する。
- 48時間後、FBSを含まない新鮮な培養培地で培地を置換することにより、培養中の浮遊細胞を除去する(1×ITS、50μg/ mLゲンタマイシン、10ng / mL EGF、および1×ペン - ストレプトマイシンを含むDMEM / F12)で洗浄した。
- 乳房上皮細胞の単層が、付着した上皮オルガノイドから3日間で移動し、成長することを確認する。
原発性マウス基礎/管腔上乳腺上皮細胞の分離
- 3日間の培養後、20分間、タンパク質分解酵素およびコラーゲン分解酵素活性を有する天然酵素混合物でマウス初代乳腺細胞を分離する。 PBS中の5%FBSで酵素活性を中和する。
- 懸濁液を室温で10分間450xgで遠心分離し、上清を捨てる。細胞ペレットを5mg / mLディスパーゼに20分間再懸濁する。 PBS中の5%FBSで酵素活性を中和する。
- 懸濁液を室温で10分間450xgで遠心分離し、上清を捨てる。
- 希釈して10 7細胞/ mLの濃度で0.2%FBSを含む100μLのPBSに細胞を再懸濁した抗CD49fおよび抗EpCAM抗体を氷上で暗所で1時間インキュベートした。
- PBSで細胞を洗浄し、暗所で30分間氷上でフルオロフォア結合二次抗体で細胞をインキュベートする。
- 0.2%FBSを含むPBS中で細胞を洗浄し、再懸濁する。
- EpCAM hi / CD49f lo管腔上乳腺上皮細胞を細胞選別機4で選別する。
7.細胞外小胞/エキソソーム処理
- ゼラチンでコートした6ウェルディッシュ(2×10 5細胞/ウェル)上に、ステップ6.7からの選別したEpCAM hi / CD49f lo管腔上乳腺細胞を播種し、PBSまたは2μg/ mL NAMEC由来EV /エキソソームで処理するステップ1.7で得られた。
- 長期培養処理におけるEV /エキソソームの生物学的有効性を確実にするために、PBSまたは2μg/ mLのNAMEC由来のEV /エキソソームを含む新鮮な培地で2日ごとに細胞培養培地を交換する。マウスプリマを分割しないでください10日間の処置の間に細胞内の細胞を除去する。
乳腺上皮細胞の脂肪パッド注入
- イソフルラン2〜3%吸入剤を含む3週齢の雌性C57BL / 6マウスを麻酔する。
- 麻酔したマウスをその背中に置く。中腹部の毛皮をカミソリ/ヘアクリームで取り除き、70%アルコールとポビドンヨードの3回の交互サイクルで手術部位をきれいにする。
- はさみで腹側胸骨 - 鼠径部に沿って皮膚を通して1.5cmの垂直切開を行い、次に右と左の第4乳房脂肪パッドを交互に露出させる。
- はさみで腺実質を取り除くことによって各脂肪パッドをきれいにする。リンパ節を脂肪パッドに置き、リンパ節の下の腺実質全体を除去する。
注記:脂肪パッドの3分の2はそのまま残してください。 - 工程7.2から得られた細胞を、天然の酵素混合物( 表の表を参照 )でタンパク質分解性aコラーゲン分解酵素活性を10分間測定した。 PBS中の5%FBSで酵素活性を中和する。
- 懸濁液を室温で10分間450xgで遠心分離し、上清を捨てる。血球計数器で細胞を計数し、15μLに所望の細胞用量(10 4 -10 2細胞/パッド)が含まれるような濃度のPBS中で細胞を懸濁させる。
- 乳腺上皮細胞浮遊液15μLを、27G針に取り付けられた100μLガラスシリンジを用いて脂肪パッドに注入する。
- もう片方の脂肪パッドについては、手順8.4-8.7を繰り返します。
- 創傷クリップで皮膚を閉じます。
9.乳腺完全マウント
- 細胞注入後8週間でCO 2 +頚部脱臼でマウスを安楽死させる(ステップ8.7)。
- はさみを使用して、胸骨領域から鼠径領域への皮膚層を垂直に切開し、次に右と左の両方を露出させる。大麻の脂肪パッド。第4乳腺を除去する( 図2 )。
- ガラス顕微鏡スライド上の脂肪パッドを広げ、室温で一晩、Kahle固定液(4%ホルムアルデヒド、30%EtOH、および2%氷酢酸)で脂肪パッドを固定する。
注意:Kahleの固定剤は刺激剤です。ケミカルフードでこの手順を実行します。 - ファットパッドを250mLの70%EtOHで15分間、次いで250mLのdH 2 Oで5分間洗浄する。ファットパッドをカルミンミョウバン(1gのカルミンおよび2.5gの硫酸アルミニウムカリウムを500mLのdH 2 O中に)で室温で一晩染色する。
- 脂肪パッドを250mLの70%EtOHで15分間、250mLの95%EtOHで15分間、および250mLの100%EtOHで15分間洗浄する。
- ファットパッドが透明になったら、キシレンの脂肪パッドを数日間清掃し、キシレンインキュベーションを停止します。
注意:キシレンは刺激剤です。ケミカルフードでこの手順を実行します。 - スライドをマウントするデジタルスライドスキャナを使用して脂肪パッドの画像(2,400dpi)を撮影する。
結果
PGE 2 / EP 4シグナル伝達を遮断することにより、乳房基底様幹細胞4からのEV /エキソソーム放出が誘発されることが示されているので、この研究は、誘発されたEV /エキソソームを乳房上皮基底細胞(NAMEC)培養から単離する方法を提示する。 NAMECは無血清培地で培養されるため、血清由来のEV /エキソソームは存在しない13 。血清含有培地で培養した細胞の場合、培地中の既存のエキソソームは、EV /エキソソーム5の収集のために培地を培養するために培地を使用する前に、110,000×gでの超遠心分離によって予め洗浄しなければならない。図1に示すように、4日間誘導したNAMEC条件培地からのEV /エキソソームを、示差的超遠心分離によって110,000×gペレットから単離することができる。単離された小胞の数およびサイズは110,000×gのペールナノ粒子追跡分析(NTA)を用いて測定することができる。示差的超遠心分離によって単離された110,000gのペレット画分は、主に約100nmの小胞を含む( 図4A )。このことは、文献に報告されているエキソソーム(50〜150nm)のサイズに対応する。さらに、TEM分析は、110,000g分画のNAMEC条件培地が豊富な膜小胞を含有することを示した( 図4B )。微分遠心分離法は、合理的に純粋なエキソソームを生成することができるが、密度勾配を用いた次の精製工程は、混入物( 例えば、タンパク質凝集体)をさらに排除する5 。密度勾配では、エキソソームは小胞の脂質含有量のために勾配内に浮遊し、タンパク質凝集体があればそれは勾配の底部にとどまる。勾配の各画分を、エキソソームメーカー( 例えば、 CD81、CD63、CD9およびTSG101)の検出のために収集する 6,7)をウェスタンブロッティングで分析した。エキソソームマーカーは、約20%のイオジキサノールを含む画分で検出することができる( 図5 )。エキソソームを含む画分をPBSで希釈し、200,000×gの超遠心分離に供してエキソソームを単離することができる。単離したエキソソームペレットをPBSで1回洗浄し、次いでPBSに再懸濁し、さらなる分析のために-20℃で保存する。
乳腺上皮細胞(HMLE細胞)の非幹細胞によるNAMEC由来のEV /エキソソームの取り込みを測定する前に、EV /エキソソームを蛍光色素( 例えば、カルボキシフルオレセインスクシンイミジルエステル(CFSE))で標識しなければならない。 CFSEのみを含むが、EV /エキソソームは含まない平行試料は、同じ標識手順で処理される。このサンプルは、微量の残留遊離CFSの影響を反映するために、以下のEV /エキソソーム取り込みアッセイで使用される陰性対照であるE色素。 HMLE細胞は、CFSE標識、NAMEC由来EV /エキソソームまたはネガティブコントロールと共に2〜6時間培養し、次いでフローサイトメトリーにかける。未処理のHMLE細胞と比較して、ネガティブコントロールで培養したHMLE細胞は、わずかに高いレベルのCFSEシグナルを示す( 図6A 、レッドライン対オレンジライン)。これは、残存フリーCFSEに起因するCFSEシグナル伝達のバックグラウンドレベルを反映するEV /エキソソーム標識プロセス。さらに、陰性対照処理したHMLE細胞と比較して、CFSE標識NAMEC由来エキソソームで培養されたHMLE細胞は、特異的取り込みに起因する10倍高いCFSEシグナルを示す( 図6A青色線対赤色線)のCFSE標識EVs /エキソソーム。 HMLE細胞によるCFSE標識NAMEC由来EV /エキソソームの取り込みは、共焦点顕微鏡法によっても観察することができる。陰性対照処理したHMLE細胞はCFSEシグナルを示さないが、NAの取り込みHMLE細胞によるMEC由来EVs /エキソソームは、CFSE標識EV /エキソソーム処理細胞( 図6B )における共焦点顕微鏡下でCFSEシグナルで観察することができる。
NAMEC由来のEV /エキソソームが乳腺形成能を幹様乳房基底細胞から乳房内腔細胞に転移できるかどうかを評価するために、マウス乳腺管腔細胞を最初に単離してマウスの乳腺形成を分析する。マウス乳腺上皮細胞を12週齢のマウスから単離する。乳腺は小片に切断され、さらにコラゲナーゼおよびトリプシンで解離される。解離した上皮オルガノイドおよび線維芽細胞は、工程5.7および5.8に記載されているように分画遠心分離によって分離することができる。遠心分離の各ラウンドでは、チューブの底にあるペレットは、主に上皮オルガノイドを含むべきであり、線維芽細胞および単細胞は、スーパーナタント中に浮遊すべきであるt。分画遠心分離( 図3 、上のパネル)の前に上皮オルガノイドおよび線維芽細胞の両方を含む混合物と比較して、6回の遠心分離により混合物中のほとんどの線維芽細胞および単一細胞が除去される( 図3 、下のパネル)。
上皮オルガノイドの乳房上皮細胞( 図7 )は、タンパク質分解酵素活性およびコラーゲン分解酵素活性を有する天然の酵素混合物を用いてさらに解離され、懸濁状態の単一細胞を生成するようにディスパーゼされる。細胞表面CD49fおよびEpCAMの発現による単一細胞懸濁液の選別は、乳房内腔細胞(EpCAM hi / CD49f lo )、乳房基底細胞(EpCAM lo / CD49f hi )および非上皮細胞(EpCAM - )を分離することができる( 図8 )。
hi / CD49f lo管腔内乳房上皮細胞を、NAMEC由来のEV /エキソソームで10日間培養し、新鮮なEV /エキソソームおよび培地を2日ごとに交換する。 EV /エキソソーム処理の後、乳房管腔細胞をマウスの第4乳房脂肪パッド( 図2 )に移植する。 8週間後、脂肪パッドを単離し、乳腺形成の分析のために染色する( 図9 )。誘導されたNAMEC由来のEV /エキソソームによる処理は、管腔細胞が乳腺形成能を獲得することを可能にする4 。 NAMEC由来のEV /エキソソームで処理された乳房管腔細胞は、マウス脂肪パッドに乳腺を形成する( 図9 )。

図1:Extracellulaの図示差的超遠心法による細胞培養培地からの小胞/エキソソーム精製法。各遠心分離の速度および長さが示されている。最初の3回の遠心分離のそれぞれの後、上清を次の工程のために保持する。 110,000×gの遠心分離の後、ペレットを保持し、上清を廃棄する。 この図の拡大版を見るには、ここをクリックしてください。
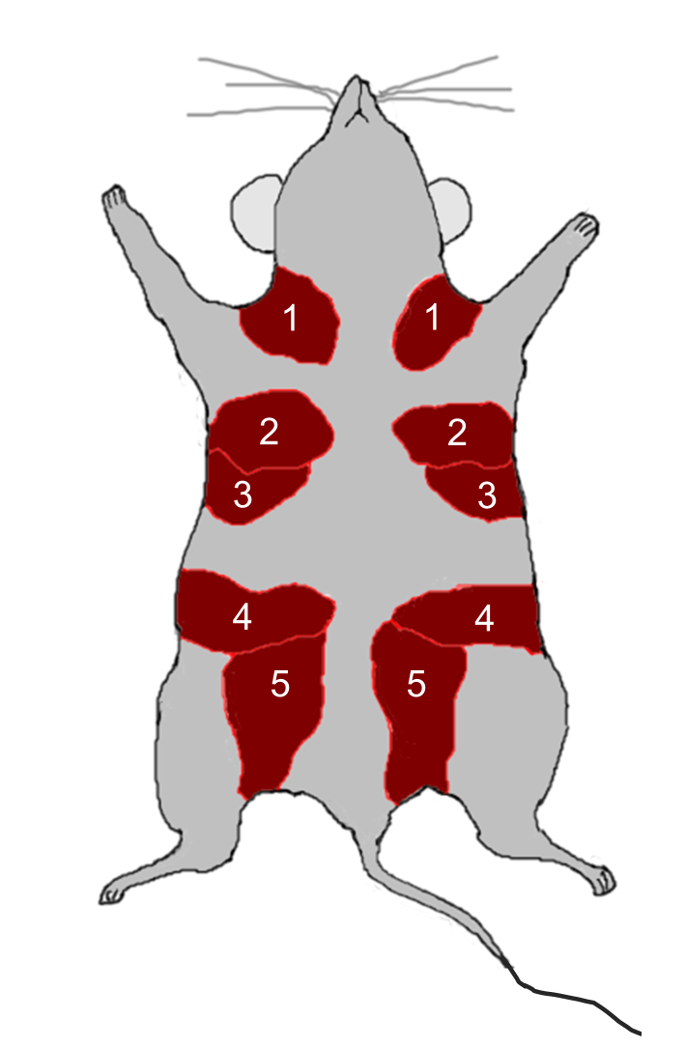
図2:マウス乳腺解剖図。マウスは、皮膚の真下の脂肪パッド(赤色)に位置する1〜5の数字で示される5対の乳腺を有する。 thのより大きなバージョンを表示するにはここをクリックしてください数字です。

図3:分化遠心分離前後の上皮オルガノイドと脂肪パッドの細胞の混合物の画像。血球計数器から採取した分画遠心分離前後の単離した脂肪パッド細胞混合物の明視野画像。矢頭:上皮オルガノイド。矢印:線維芽細胞および単細胞。スケールバー= 0.5mm。 この図の拡大版を見るには、ここをクリックしてください。
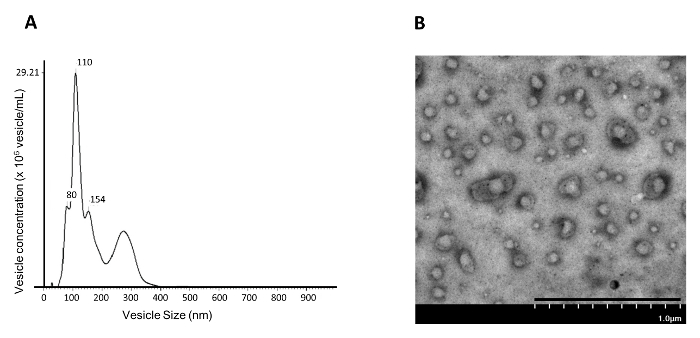
図4:NAMEC110,000×gペレット分率のベシクルサイズおよび濃度分析。 NAMEC培地の110,000gのペレット画分は、 ( A )ナノ粒子追跡分析(NTA)および( B )透過電子顕微鏡(TEM)を受けた。スケールバー=1μm。 この図の拡大版を見るには、ここをクリックしてください。

図5:密度勾配の画分におけるエキソソームの検出。エキソソームマーカーCD81、CD9、CD63、およびTsg101およびハウスキーピング遺伝子GAPDHのウエスタンブロット分析により、エキソソームを含む20%のイオジキサノール画分が明らかになる。 この図の拡大版を見るには、ここをクリックしてください。
55736fig6.jpg "/>
図6:フローサイトメトリーおよび共焦点顕微鏡による細胞外小胞/エキソソーム取り込みの検出。 EV /エキソソーム取り込みをHMLE細胞で測定した。示された培養物にCFSE標識NAMEC由来EV /エキソソームおよび陰性対照を6時間添加する。インキュベーション後、細胞を ( A )フローサイトメトリーおよび( B )共焦点顕微鏡法。 CFSE(緑;励起/発光(nm):492/517;顕微鏡レーザーライン:488)蛍光強度は、EV /エキソソーム取り込みを反映する。細胞核をDAPI(青;励起/発光(nm):358/461;顕微鏡レーザー線:405)で染色し、原形質膜を原形質膜染色(赤;励起/発光(nm):649/666;顕微鏡レーザーライン:633;材料の表参照)。共焦点対物レンズ:HCX PL APO 63x / 1.40-0.60オイル。スケールバー=20μm。広告/ 55736 / 55736fig6large.jpg "target =" _ blank ">この図の拡大版を表示するには、ここをクリックしてください。
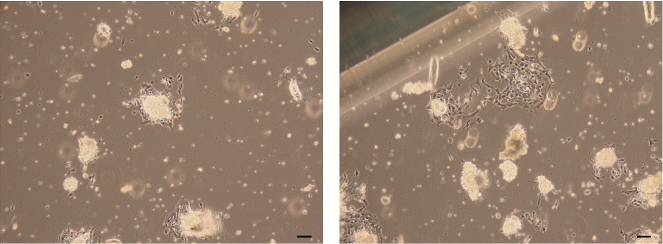
図7:添付の上皮オルガノイドの画像。付着した上皮オルガノイドから遊走し成長する細胞によって形成された乳房上皮細胞の明瞭な画像。スケールバー=100μm。 この図の拡大版を見るには、ここをクリックしてください。

図8:表面EpCAMおよびCD49fによる一次マウス乳腺上皮細胞の選別。 12週齢のマウスの脂肪パッドから単離されたマウス乳房上皮細胞を細胞選別ing。マウス乳房管腔細胞は、青色の円でマークされたEpCAM hi / CD49f lo集団において富化される;基底細胞は、赤丸でマークされたEpCAM lo / CD49f hi集団で富化された。非上皮細胞はプロットの黒いボックスでマークされています。 この図の拡大版を見るには、ここをクリックしてください。

図9:原発性マウス管腔内乳腺細胞による乳腺形成。一次マウスEpCAM hi / CD49f lo管腔細胞をPBSまたはNAMEC由来のEV /エキソソームで細胞培養で10日間処理し、3週齢マウスのクリア脂肪パッドに移植する。マウスを安楽死させ、乳腺形態を分析するために8週間後に剖検するation。スケールバー= 0.75cm。 この図の拡大版を見るには、ここをクリックしてください。
| パーセンテージ | EpCAMのMFI | CD49fのMFI | |
| 乳房管腔細胞 | 0.437 | 4.57×10 4 | 8183 |
| (EpCAM hi / CD49f lo ) | |||
| 乳房基底細胞 | 0.09 | 5452 | 2.23×10 4 |
| (EpCAM lo / CD49f hi ) | |||
| 非上皮細胞(EpCAM - ) | 0.309 | 53 | 4619 |
表1:図8に記載された集団のパーセンテージおよび平均蛍光強度(MFI)。
ディスカッション
エキソソームは、それらを放出した細胞の特徴を有することが多く、放出されたエキソソームの量は、刺激によって誘発され得る4 。細胞の培養培地を回収し、EV /エキソソーム収集のための示差的超遠心分離に供することができる( 図1 )。現在のところ、EV /エキソソームを単離する理想的な方法に関する一般的な合意はない。ここで使用される最適な方法は、下流アプリケーション14によって決定されている。超遠心分離は、EV /エキソソームの生物学的活性を保存することができるEV /エキソソームの単離のための比較的速い方法である。しかしながら、超遠心分離によって単離された小胞は、一般に、エンドソーム区画を介して産生されるエキソソームおよび/または細胞膜からの出芽を介して産生される小胞を含むEVの混合物を含む。
小胞のサイズをNTAで分析することにより( 図4A )では、示差的超遠心分離の間に110,000×gで精製される小胞は、主にエキソソームのサイズに対応する50-150nmであった。 NTAデータは、NAMEC由来のエキソソームが、示差的超遠心分離の間に110,000×gで培養培地から単離され得ることを示唆している。しかし、ここで紹介したNTAとTEMは、小胞の可視化や、EV全体のサイズと数の測定のみを可能にしています。これらの技術は、EV集団の異種性を測定することができず、異種EV集団を分類することさえできない。科学者は、フローサイトメーターを使用してEV集団を分析および分類する方法を開発し始めている15 。
微分遠心分離を用いてエキソソームを精製することができるが、密度勾配を用いて、110,000×gの単離画分5中のエキソソーム小胞からのタンパク質凝集体の汚染をさらに除去すべきである例えば、 CD81、CD63、CD9、およびTSG101,6,7)を発現する。密度勾配の画分におけるエキソソームマーカーの存在を分析することにより、約20%のヨジキサノールを含む画分中のエキソソームを同定することが可能である( 図5 )。エキソソームの各集団が異なるエキソソームマーカーを発現する可能性があるため、密度勾配におけるエキソソームを同定するために、複数のエキソソームマーカーを調べるべきである16 。
細胞によるEV /エキソソームの取り込みは、蛍光色素標識EV /エキソソームを用いて測定することができる。標識されたEV /エキソソームを摂取した細胞の数は、フローサイトメトリーによって測定することができる( 図6A )。フルオ細胞からのレセッションは、標識されたEV /エキソソームの取り込みに由来するが、遊離色素由来ではないことに起因し、蛍光のパターンは、顕微鏡で調べた。共焦点顕微鏡法は、EV /エキソソーム処理細胞における蛍光のパターンが点状であることを示す( 図6B右パネル)。点状シグナルは、標識されたEV /エキソソームの結果であり、自由蛍光ではない。細胞内の点状シグナルは、85 nm 4,17で最高の分解能を持つ構造化照明超解像顕微鏡法でさらに分析することができます。超解像顕微鏡検査は、点状信号がエキソソームに似ている約100nmの中空小胞からであることを確認することができる4 。これらの結果は、NAMEC由来のエキソソームが、培養中の乳房上皮細胞によって摂取され得ることを示唆している。
NAMEC由来のEV /エキソソームは、多くの場合、分子( 例えば、タンパク質およびmi特定の細胞の特性に不可欠なRNA(RNAs) 1 。これは、NAMEC由来EVs /エキソソームがNAMECの特性( 例えば、乳腺形成能力)をそれらの上皮細胞対応物に移すことができることを示唆している。ヒト乳房上皮細胞はマウス脂肪パッド18,19 において異種性に乳腺を形成することができないので、マウス初代乳房上皮細胞を用いて腺形成能の移行を調べることができる。マウス一次哺乳動物EpCAM hi / CD49f lo管腔内細胞(乳腺を形成しない)は、6週齢のマウスから単離することができる( 図7および図8 )。マウス脂肪パッドから単離された細胞は、3つの群( すなわち、 EpCAM hi / CD49f lo管腔細胞、EpCAM lo / CD49f hi基底細胞、およびEpCAM-非上皮細胞)に分けることができる表面EpCAMおよびCD49fの野生型( 図8 )。 EpCAM hi / CD49f hi基底細胞は、脂肪パッドに移植された場合、脂肪流入において乳腺を形成することができるが、EpCAM hi / CD49f lo管腔細胞は、 4 。したがって、EpCAM hi / CD49f lo管腔細胞集団を用いて、乳腺形成能を伝達する誘導NAMEC由来EV /エキソソームの能力を調べることができる。単離されたEpCAM hi / CD49f lo管腔細胞は、EV /エキソソーム処理のために7〜10日間培養液中に保存することができる4 。一次乳房上皮細胞をインビトロでより長く維持することにより、細胞の生存率を低下させることができることに留意すべきである。
EV /エキソソーム処理された乳房管腔細胞は、乳腺形成能を分析するためにクリア脂肪パッドに移植することができる。移植に使用したマウスの脂肪パッドは、3週齢でクリアしなければならない。 A3週齢の乳腺上皮細胞は、乳頭と脂肪パッドのリンパとの間の領域に閉じ込められている。脂肪パッドの乳房上皮は、3週齢で乳頭とリンパの間の領域を除去することによって除去することができる。乳房管腔細胞を脂肪パッドを除去した直後に移植し、移植後8週間で移植細胞による腺形成を分析することができる。 NAMEC由来のEV /エキソソームが乳腺管形成能を乳房内腔細胞に移行させる効果は、内腔細胞およびEV /エキソソーム処理管腔細胞の腺形成によって評価することができる( 図9 )。 NAMECから誘導されたEVs /エキソソームは、乳腺の基底上皮細胞の性質である腺形成能を有し、NAMECから誘導されたEV /エキソソームを摂取する内腔細胞は、EV /エキソソームを介してNAMECから特性を獲得することができる。この研究は、EV /エキソソーム培地乳腺形成能の伝達がEV /エキソソームの脂質ラフトに存在する4 。
開示事項
著者は何も開示することはない。
謝辞
この研究は、国立健康研究所(05A1-CSPP16-014、HJL)および科学技術省(MOST 103-2320-B-400-015-MY3、HJL)からの助成金によって支えられた。
資料
| Name | Company | Catalog Number | Comments |
| MCDB 170 | USBiological | M2162 | |
| DMEM/F12 | Thermo | 1250062 | |
| Optima L-100K ultracentrifuge | Beckman | 393253 | |
| SW28 Ti Rotor | Beckman | 342204 | |
| SW41 Rotor | Beckman | 331306 | |
| NANOSIGHT LM10 | Malvern | NANOSIGHT LM10 | for nanoparticle tracking analysis (NTA) |
| Optiprep | Sigma-Aldrich | D1556 | 60% (w/v) solution of iodixanol in water (sterile). |
| CD81 antibody | GeneTex | GTX101766 | 1:1,000 in 5% w/v nonfat dry milk, 1x TBS, 0.1% Tween 20 at 4 °C, overnight |
| CD9 antibody | GeneTex | GTX100912 | 1:1,000 in 5% w/v nonfat dry milk, 1x TBS, 0.1% Tween 20 at 4 °C, overnight |
| CD63 antibody | Abcam | Ab59479 | 1:1,000 in 5% w/v nonfat dry milk, 1x TBS, 0.1% Tween 20 at 4 °C, overnight |
| TSG101 antibody | GeneTex | GTX118736 | 1:1,000 in 5% w/v nonfat dry milk, 1x TBS, 0.1% Tween 20 at 4 °C, overnight |
| GAPDH | GeneTex | GTX100118 | 1:6,000 in 5% w/v nonfat dry milk, 1x TBS, 0.1% Tween 20 at 4 °C, overnight |
| CFSE (carboxyfluorescein succinimidyl diacetate ester) | Thermo | V12883 | |
| FACSCalibur | BD Biosciences | fluorescence cell analyzer | |
| collagenase Type IV | Thermo | 17104019 | |
| trypsin | Thermo | 27250018 | |
| ITS | Sigma-Aldrich | I3146 | a mixture of recombinant human insulin, human transferrin, and sodium selenite |
| accutase | ebioscience | 00-4555-56 | a natural enzyme mixture with proteolytic and collagenolytic enzyme activity |
| dispase | STEMCELL | 7913 | 5 mg/mL = 5 U/mL |
| anti-CD49f antibody | Biolegend | 313611 | 1:50 |
| anti-EpCAM antibody | Biolegend | 118213 | 1:200 |
| FACSAria | BD Biosciences | cell sorter | |
| carmine alum | Sigma-Aldrich | C1022 | |
| human mammary epithelial cells (HMLE cells, NAMECs) | gifts from Dr. Robert Weinberg | ||
| permount | Thermo Fisher Scientific | SP15-500 | |
| sodium bicarbonate | Zymeset | BSB101 | |
| EGF | Peprotech | AF-100-015 | |
| Hydrocoritisone | Sigma-Aldrich | SI-H0888 | |
| Insulin | Sigma-Aldrich | SI-I9278 | |
| BPE (bovine pituitary extract) | Hammod Cell Tech | 1078-NZ | |
| GW627368X | Cayman | 10009162 | |
| 15 cm culture dish | Falcon | 353025 | |
| table-top centrifuge | Eppendrof | Centrifuge 3415R | |
| ultracentrifuge tube | Beckman | 344058 | |
| PBS (Phosphate-buffered saline) | Corning | 46-013-CM | |
| BCA Protein Assay | Thermo Fisher Scientific | 23228 | |
| Transmission Electron Microscopy | Hitachi | HT7700 | |
| gelatin | STEMCELL | 7903 | |
| 10 cm culture dish | Falcon | 353003 | |
| 6-well culture dish | Corning | 3516 | |
| female C57BL/6 mice | NLAC (National Laboratory Animal Center | ||
| FBS (Fetal Bovine Serum) | BioWest | S01520 | |
| gentamycin | Thermo Fisher Scientific | 15710072 | |
| Pen/Strep | Corning | 30-002-Cl | |
| DNase I | 5PRIMER | 2500120 | |
| isofluorane | Halocarbon | NPC12164-002-25 | |
| formaldehyde | MACRON | H121-08 | |
| EtOH (Ethanol) | J.T. Baker | 800605 | |
| glacial acetic acid | Panreac | 131008.1611 | |
| aluminum potassium sulfate | Sigma-Aldrich | 12625 | |
| Xylene | Leica | 3803665 | |
| 0.22 μm membranes | Merck Millipore | Millex-GP | |
| AUTOCLIP Wound Clips, 9 mm | BD Biosciences | 427631 | |
| AUTOCLIP Wound Clip Applier | BD Biosciences | 427630 | |
| CellMask™ Deep Red | Thermo Fisher Scientific | C10046 | plasma membrane stain |
参考文献
- Simons, M., Raposo, G. Exosomes--vesicular carriers for intercellular communication. Curr Opin Cell Biol. 21 (4), 575-581 (2009).
- Théry, C., Ostrowski, M., Segura, E. Membrane vesicles as conveyors of immune responses. Nat Rev Immunol. 9 (8), 581-593 (2009).
- Boelens, M., et al. Exosome Transfer from Stromal to Breast Cancer Cells Regulates Therapy Resistance Pathways. Cell. 159 (3), 499-507 (2014).
- Lin, M. C., et al. PGE2 /EP4 Signaling Controls the Transfer of the Mammary Stem Cell State by Lipid Rafts in Extracellular Vesicles. Stem Cells. , (2016).
- Théry, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Curr Protoc Cell Biol. , (2006).
- György, B., et al. Membrane vesicles, current state-of-the-art: emerging role of extracellular vesicles. Cell Mol Life Sci. 68 (16), 2667-2688 (2011).
- Olver, C., Vidal, M. Proteomic analysis of secreted exosomes. Subcell Biochem. 43, 99-131 (2007).
- Shackleton, M., et al. Generation of a functional mammary gland from a single stem cell. Nature. 439 (7072), 84-88 (2006).
- Prater, M. D., et al. Mammary stem cells have myoepithelial cell properties. Nat Cell Biol. 16 (10), 942-950 (2014).
- Stingl, J., et al. Purification and unique properties of mammary epithelial stem cells. Nature. 439 (7079), 993-997 (2006).
- Gardiner, C., Ferreira, Y. J., Dragovic, R. A., Redman, C. W., Sargent, I. L. Extracellular vesicle sizing and enumeration by nanoparticle tracking analysis. J Extracell Vesicles. 2, (2013).
- Shapiro, A. L., Viñuela, E., Maizel, J. V. Molecular weight estimation of polypeptide chains by electrophoresis in SDS-polyacrylamide gels. Biochem Biophys Res Commun. 28 (5), 815-820 (1967).
- Riches, A., Campbell, E., Borger, E., Powis, S. Regulation of exosome release from mammary epithelial and breast cancer cells - a new regulatory pathway. Eur J Cancer. 50 (5), 1025-1034 (2014).
- Witwer, K. W., et al. Standardization of sample collection, isolation and analysis methods in extracellular vesicle research. J Extracell Vesicles. 2, (2013).
- van der Vlist, E. J., Nolte-'t Hoen, E. N., Stoorvogel, W., Arkesteijn, G. J., Wauben, M. H. Fluorescent labeling of nano-sized vesicles released by cells and subsequent quantitative and qualitative analysis by high-resolution flow cytometry. Nat Protoc. 7 (7), 1311-1326 (2012).
- Kowal, J., et al. Proteomic comparison defines novel markers to characterize heterogeneous populations of extracellular vesicle subtypes. Proc Natl Acad Sci U S A. 113 (8), E968-E977 (2016).
- Li, D., et al. ADVANCED IMAGING. Extended-resolution structured illumination imaging of endocytic and cytoskeletal dynamics. Science. 349 (6251), (2015).
- Outzen, H. C., Custer, R. P. Growth of human normal and neoplastic mammary tissues in the cleared mammary fat pad of the nude mouse. J Natl Cancer Inst. 55 (6), 1461-1466 (1975).
- Sheffield, L. G., Welsch, C. W. Transplantation of human breast epithelia to mammary-gland-free fat-pads of athymic nude mice: influence of mammotrophic hormones on growth of breast epithelia. Int J Cancer. 41 (5), 713-719 (1988).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved