Method Article
Хирургическая абляция Анализ для изучения Регенерации глаз в планарии
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол показывает, как последовательно акцизный планарии глаз (оптические чашки) без нарушения окружающих тканей. С помощью иглы и шприца инсулина, либо один или оба глаза могут быть абляции, чтобы облегчить расследование механизмов, регулирующих регенерацию глаз, эволюцию визуальной регенерации, а также нейронную основу светоиндуцированного поведения.
Аннотация
В исследовании взрослых стволовых клеток и регенеративных механизмов, планарии плоских черви являются одним из основных продуктов в естественных условиях модельной системы. Это связано в значительной степени с их обильной плюрипотентных популяции стволовых клеток и способность к регенерации всех типов клеток и тканей после травм, которые были бы катастрофическими для большинства животных. В последнее время планарий завоевал популярность в качестве модели для регенерации глаз. Их способность к регенерации всему глаза (состоит из двух типов тканей: пигментные клетки и фоторецепторов) позволяет рассечения механизмов, регулирующих визуальную регенерации системы. Глаз абляция имеет несколько преимуществ по сравнению с другими методами (такими как обезглавливание или перфорация) для изучения глазных конкретных путей и механизмов, наиболее важными из которых является то, что регенерация в основном ограничиваются только тканями глаза. Цель этого видео статьи является показать, как надежно удалить планарии оптической чашки, не нарушая мозг или окружающие ткани.Обработка червей и поддержания установленной колонии также описана. Эта методика использует 31 г, 5/16-дюймовый инсулина иглы хирургическим путем выкопать оптический чашку планарий, иммобилизованных на холодную пластину. Этот метод включает в себя как одиночный и двойной абляции глаза, с глазами регенерирующих в течение 1-2 недель, что позволяет в широком диапазоне применений. В частности, этот метод абляции можно легко сочетать с фармакологическими и генетическими (РНК-интерференции) экраны для лучшего понимания регенеративных механизмов и их эволюции, стволовых клеток глаза и их содержание, а также phototaxic поведенческих реакций и их неврологической основе.
Введение
Планарии являются мощным модельным организмом для изучения клеточной регенерации взрослых стволовых. Эти непаразитарных пресноводные плоские черви обладают способностью регенерировать любые и все недостающие ткани, в том числе их центральной нервной системы и головного мозга 1. Училась еще в 1700 - х годах 2, технологические достижения в области планарий в течение последних 10-15 лет (например, виртуализированного геном, гибридизация, иммуногистохимии, РНК - интерференции (иРНК), и транскриптомика в) обновили эту историческую модель организма , В частности, планарий недавно приобрел популярность в качестве новой модели для исследования глаза 3.
Планарии имеют прототипический глаз только с двумя типов тканей, фоторецепторы нейронами и пигментными клетками; это позволило охарактеризовать ее глаз стволовых клеток населения и показал, что многие из тех же генов, регулирующих позвоночный глаз деvelopment сохраняются в планарии 4, 5. Оптические чашки расположены дорсально и состоят из белых, окрашенных пигмента дендритов нейронов фоторецепторов и пол-лунным черного пигмента клеток, а глаза иннервируют мозг с помощью зрительного перекреста. Помимо того , что модель для выяснения регенеративных процессов 6, планарии глаз хорошо подходят для изучения эволюции зрительных механизмов 7, поведенческие реакции на свет (планарий отображать отрицательный фототаксис) 8, и неврологическую основу поведения 9.
Глаз в регенерации планарий была в значительной степени изучена в двух основных контекстах: в качестве части головки регенерации следуя обезглавливание 4, 10, и после иссечения только тканей глаза 11, 12 . Большинство планарий исследования по регенерации глаз использовали метод обезглавливание, как это просто и понятно. Наиболее распространенный метод планарии глаз иссечения до настоящего времени был через отверстие пуансон с тонким стеклянной капиллярной трубкой 13, 14, хотя некоторые исследования также проводили ампутации только позади глаз (частичная декапитации) 15. Тем не менее, все эти методы предполагают потерю многих других, чем просто глаз тканей (например, мозга, кишечника, и нефридиев), потенциально усложняет интерпретацию результатов. Протокол глаз абляции, представленный здесь ограничивает иссечение в ткани глаза (в частности, за исключением головного мозга), в результате чего данные, которые являются более специфическими для глаз. Кроме того, в отличие от обезглавленных червей , которые принимают 7-14 дней , чтобы начать кормление, глазные абляции черви будут кормить в течение 24 часов абляции 12, что позволяет RNAi эксперименты (там , где иРНК доставляется через пищу) , чтобы быть performed одновременно.
Хотя глаз абляция технически сложнее, чтобы успешно выполнить, чем обезглавливание, в настоящее время исследования с участием глаз иссечение не включены подробные инструкции по их процедур. Цель этого видео статьи позволит исследователям, чтобы последовательно удалить планарии оптической чашки, не нарушая основные ткани мозга и удаления, как несколько других тканей, как это возможно. Этот метод может быть использован как для одиночного и двойного абляции глаза и применимо к широкому кругу исследований. Как и большинство анализов регенерации, глаза абляция хорошо подходят для комбинации с обеими фармакологическими и генетическими (RNAi) экранами, а также поведенческими исследованиями. Здесь мы опишем методы для обработки червей, поддерживая планарии колонию, а сама техника глаз абляции.
протокол
1. Культура животных и регулировать
Примечание: Этот протокол использует Schmidtea Mediterranea, диплоидные планарии видов с виртуализированным геномом 16, 17 , который обычно используются для исследования регенерации. Тем не менее, этот анализ в равной степени успешный с другими видами, такие как Girardia Tigrina и Girardia dorotocephala (которые являются коммерчески доступными).
- Поддерживать червь в «червячной воде» , изготовленной из 0,5 г / л морской соли в сверхчистом (или фильтрованной) деионизированной воде. Используйте стерильные полипропиленовые или стеклянные контейнеры для хранения червя воды. См Дополнительный файл 1 для дополнительной информации о подготовке червяк воды.
Примечание: Никогда не используйте мыло для очистки контейнеров (или других материалов), как мыло является токсичным для червей; вместо того, чтобы уничтожить 70% -ным этанолом и дают высохнуть на воздухе. <ол> - Надевайте перчатки при работе с планарии, чтобы защитить их от загрязнения.
Примечание: Черви очень чувствительны к окружающей среде токсинов и химических веществ, включая мыло, дезинфицирующие, шампунь, кондиционер и лосьон для рук.
Примечание: Колонии должны иметь не более 500-1000 червей на литр воды червя. Для экспериментов, оставьте крышки полностью на месте, так как воздушный поток разработан в эти блюда.
ПРИМЕЧАНИЕ: Печень не должна содержать гормоны или антибиотики, и предпочтительно не быть предварительно заморожено. Центрифуга пюре перед замораживанием (или перед подачей), чтобы удалить воздух и предотвратить пищу из плавающих. Пища должна опуститься на дно контейнера. 1 мл пюре достаточно для 500-1000 червей.
- Backload пипетка с небольшим количеством воды до червячной сосать их.
- Попробуйте переместить воду вокруг червя, а не сам червя, чтобы помочь предотвратить разрывая мягкотелые червь, касаясь их с помощью пипетки.
- Храните экспериментальные блюда не распространяется, если передача червей или замены воды.
2. Подготовка
- Хватит кормить червей , по крайней мере за одну неделю до начала экспериментов.
- Выберите червей, которые не кормили в течение ≥1 недели и являются по крайней мере, 5-7 мм в длину. Передача червей на чашку Петри 2/3 полной червь воды, и подтвердить длину червячной сдвинув линейку под блюдо. Мера жORMs пока полностью выпрямлены и перемещение.
Примечание: В то время как меньше (5-7 мм) черви работают лучше при выполнении последующей иммунофлюоресценции и в гибридизация анализов, крупные червей (8-10 мм) , легче работать - особенно при обучении абляции. - Убедитесь, что черви целы, неповрежденные, а не в последнее время регенерации.
Примечание: Восстанавливающий черви будет иметь намного более легкий (или нет) пигмента в головке и / или хвостовой области по сравнению с нормальными червями. - При выполнении RNAi или фармакологических методов лечения червей, сделать это на данном этапе. Если черви подавались как часть лечения (как и для RNAi), подождите, по крайней мере 7 дней после последнего кормления, прежде чем перейти к шагу 2.2.
- Выберите червей, которые не кормили в течение ≥1 недели и являются по крайней мере, 5-7 мм в длину. Передача червей на чашку Петри 2/3 полной червь воды, и подтвердить длину червячной сдвинув линейку под блюдо. Мера жORMs пока полностью выпрямлены и перемещение.
- Очистите рабочее пространство и рассекает микроскоп базу с 70% этанолом и дайте ему полностью высохнуть. Поместите блюдо из выбранных червей в левой части области. Справа от сферы, разместить пару # 5 щипцов, 31 G 5/16-дюймового инсулин иглы с 1мл шприц, и чистые пипетки передачи.
- Убедитесь в том, что инструменты удерживаются от прикосновения к скамейке (который может ввести загрязняющие вещества). Используйте жесткий элемент (такие как палочки покой), чтобы держать щипцы, иглу и пипетки чистыми. В качестве альтернативы, место инструменты на верхней части свежего коричневого (небеленой) бумажным полотенцем.
Примечание: Эти и последующие инструкции написаны как они относятся к праворуким лицам. -Левша люди должны поменять местами правый / левый направления.
- Убедитесь в том, что инструменты удерживаются от прикосновения к скамейке (который может ввести загрязняющие вещества). Используйте жесткий элемент (такие как палочки покой), чтобы держать щипцы, иглу и пипетки чистыми. В качестве альтернативы, место инструменты на верхней части свежего коричневого (небеленой) бумажным полотенцем.
- Рядом с рабочим местом, поместите коробку безворсовых салфеток ткани, источник пресной воды червя, а также некоторые дополнительные пипетки передачи (защищенные от поверхности стола). Место червь воды в пластиковой бутылке мытья для облегчения дозирования. Кроме того, место меченого 12-луночного планшета (или 100 Мм Петри Петри) справа от объема для сбора ABLATED животных.
- При использовании на заказ Пельтье пластины для иммобилизации червей, поместите пластину Пельтье в углубление в тон основание рассекает микроскопа и корректировать выходной сигнал от источника питания постоянного тока, пока рабочая поверхность пластины Пельтье не достаточно круто (обычно ~ 5 В) .Alternatively, сделать холодную пластину, заполняя 100 Мм Петри Петри с половиной полный с водой и заморозить в течение по крайней мере 24 ч. Удалите крышку и поместите в нижней части 100 мм тарелки на основании рассекает объема, а затем поместить крышку тарелки 60 Мм Петри верхней стороной вниз непосредственно на поверхности льда (фиг.1А).
- После того, как вода замерзла в 100 мм блюдо, «Вулкан» льда может появиться в центре пластины. Если это происходит, используйте лезвие, чтобы скоблить ровный лед, чтобы удалить любые неровности с поверхности.
Примечание: Во время операции лед растает, что делает абляции гораздо сложнее. Приготовьте несколько ледяных блюд заранее, и заменить замороженные для плавления те, в процессе анализа, как только крышка 60 мм блюда начинается с плавающей.
- После того, как вода замерзла в 100 мм блюдо, «Вулкан» льда может появиться в центре пластины. Если это происходит, используйте лезвие, чтобы скоблить ровный лед, чтобы удалить любые неровности с поверхности.
- Подготовкахирургия поверхности. Вырезать 5 см х 10 см кусок пластиковой парафиновой пленки (4 см 2 при использовании Петри холодной пластины) и поместите его в центре иммобилизации устройства. Fold безворсовой ткани протереть в квадрат примерно-см 2 и поместить его в верхней части пленки. Вырезать кусок белой фильтровальной бумаги 1,5-2 см 2 и поместите его в верхней части салфетки. Смотрите рисунок 1В-1Е.
- Держите сложенный протирать место с пальцем в перчатке, и использовать червячный воду слегка смочить салфетку, чтобы убедиться, что она по-прежнему сложена. Используйте сторону переноса пипетки свернуть салфетку плоским.
Примечание: Холодная температура помогает держать червь двигаться. Работа «сухой» также помогает в иммобилизации. Ткани протереть акты впитывать воду через фильтровальную бумагу, держа червь влажным во время операции, не позволяя черви полностью высохнут (которая является летальным).
- Держите сложенный протирать место с пальцем в перчатке, и использовать червячный воду слегка смочить салфетку, чтобы убедиться, что она по-прежнему сложена. Используйте сторону переноса пипетки свернуть салфетку плоским.
3. Хирургическая аблации
- Использование передачи пипетки поместить нае червяк спинной стороной вверх на фильтровальную бумагу. Включите источник света, и направить Гуснекс так, что свет фокусируется на червя. Отрегулировать рассекает фокус области действия и увеличение таким образом, чтобы глаза четко видны (весь червь не должен быть в поле зрения); 5X увеличение является хорошей отправной точкой. Сориентируйте червь, вращая парафиновую пленку так, чтобы голова направлена в стороне исследователя (по направлению к передней части микроскопа), под углом 30-40 градусов вправо.
- Избегайте использование яркого света, чтобы предотвратить избыточное движение червя. Планарии отображение отрицательного фототаксиса и будут пытаться уклониться от яркого света.
- Если червяк установлен вентральная сторона вверх (с глоточным открытием видимыми), используйте тупую сторону пинцета аккуратно переставить червячные спинную сторону вверх (с глазами видимыми). Избегайте приближается животное с острым кончиком пинцета, чтобы свести к минимуму вероятность разрыва через мягкие ткани, когда репозиционирование животное.
- Отрегулируйте фокус микроскопа так, что глаза четко в фокусе. Кроме того, убедитесь, что оба глаза и окружающие ткани голов находятся в поле зрения.
- Удерживая свежую иглу / шприц в правой руке , как если бы это была ручка (между большим и указательным пальцами). Brace большой палец левой руки по отношению к пластине Пельтье (или чашки Петри холодной пластины), а также использовать большой палец левой руки в качестве опоры , на которой нижняя часть шприца будет покоя (рис 2A). Посмотрите через микроскоп, и убедитесь , что скос иглы виден.
Примечание: Иглы очень острые. Будьте осторожны при обращении с ними. Надев латексные или нитриловые перчатки может предложить некоторую защиту.- Используйте большой палец левой руки, чтобы помочь держать иглу / шприц устойчивый в течение всей процедуры и избегать рукопожатий.
- Сделайте угол около 40 ° с большим пальцем левой рукой и левым указательным пальцем (с указательным пальцем на поверхности хирургии), чтобы помочь провести операцию поверхность STABILE.
- Сскос иглы, обращенной вверх (как ложка), расположить иглу под прямым углом по отношению к глазу (фигура 2В). Используйте кончик иглы, чтобы мягко проникают в тонкий слой ткани, покрывающей зрительный чашку (белый, непигментированный область) глаза, черпая справа налево. Очень осторожно удалите пигментированные ткани , расположенные внутри глазного бокала, следя за тем, чтобы не проколоть дно или уничтожить границы глазного бокала.
- Если червь был на фильтровальную бумагу для> 1-2 мин в любой момент во время процедуры, добавьте одну каплю воды червя регидрировать червя.
Примечание: Обезвоживание увеличит восприимчивость червя до риппинга травм.
- Если червь был на фильтровальную бумагу для> 1-2 мин в любой момент во время процедуры, добавьте одну каплю воды червя регидрировать червя.
- Повторите шаг 3,3 до всех черных пигментированных тканей (пигментные клетки), а также всех белых тканей глазного бокала (дендриты фоторецепторных клеток), удаляются. Удалить вырезанные ткани застряли на конце иглы, осторожно обтирать с тканью салфеткой. Если двойной Abla глазции желательно, абляции второго глаза в этой точке.
Примечание: Для того, чтобы избежать травм, иглы могут быть очищены путем захвата иглы с чистой тканью протирать провел с большим и указательным пальцами, затем другой рукой, чтобы вытащить иглу через салфетку от большого пальца и указательного пальца. В качестве альтернативы, игла может быть стерт на поверхность влажной ткани вытереть и исследуют на чистоту. - Когда закончите, используйте пипетки передачи для перемещения червяка с меченым блюдом с пресной водой червя. При анализе данных группы, разместить до 20 червей в одном 100 Мм Петри Петри. Если отслеживание регенерации в тех же самых индивидуумов с течением времени, 1 место червя в каждую лунку 12-луночного планшета. После того, как все черви передаются, полоскание червей, удаляя всю червячную воду из чашек / скважин и замены с большим количеством свежей водой червя.
- Чтобы удалить червь из фильтра, backload пипетки с небольшим количеством воды и червячной выпустить воду на червь. Это должно поднять тон червяк от фильтровальной бумаги, чтобы немедленно всасывается в пипетку для переноса.
- Инкубируйте эксперименты при ~ 20 ° C (комнатная температура) в защищенном от света и следовать процесс регенерации.
Примечание: черви могут быть сохранены в инкубаторе с контролируемой температурой для поддержания постоянной температуры, но это не является строго необходимым. Большинство комнатная температура изменяются только при + 5 ° С, что не влияет на способность червя к регенерации. - При желании, исправить червь для иммуногистохимии (см рисунков 3-4) и / или в гибридизация анализ экспрессии генов. Существуют различные способы фиксации для планарии иммуногистохимии 18, 19, 20 и на месте гибридизации 21, 22, 23 протоколов.
- Когда эксперименты пришли к выводу, sacrifiсе червей живут путем удаления червя воду из чашки и замена 70% -ным этанолом. Выдержите червь в течение 3-5 мин, проверяя червь лизировать и превратить сероватый.
- Поместите необработанные червь в потоке обычных отходов, как только жертвенном. Избегайте введения живых червей в окружающую среду, особенно неместных видов.
Результаты
Для первой 1-2 ч после операции, животные могут обладать уменьшились движение по сравнению с интактными червями (однако, они все равно будут двигаться). При желании, черви будут есть в течение 24 часов после операции (например, для кормления RNAi). Когда после регенерации глаз в одних и тех же лиц, с течением времени, не забудьте взять с фотографией каждого червя и до операции (интактной) и через 1 ч после абляции (гПа). По 4 дня после абляции (DPA) регенерирующие пигментные клетки должны быть видны, и на 14 ДПВ весь глаз будет полностью регенерированного (рис 3A-B). Это включает в себя нейроны фоторецепторов и их иннервацию к мозгу (рис 3C), а также функционального восстановления зрительной системы (рис 4A-C). Успешные абляции не будут мешать прилежащие ткани головного мозга (Рисунок 4D-E), и ввести другие травмы животного (фиг.5А). Неудачные абляциивключают животное с: чрезмерно большим иссечением , которая соединяет два глаза (рис 5б), слезы латерального края животного (рис 5C), и / или раневые участки , которые протыкать вентральный эпидермис (рис 5D). Кроме того, неудачные абляции включают неполное удаление всей глазной чаши, состоящее из двух белых непигментированных тканей и черных пигментных клеток (рис 5E-F).

Рисунок 1: подготовка хирургии. (А) Схема конструкции холодной пластины, с помощью нижней части 100 Мм Петри Петри (заполненного лед) и крышку 60 Мм Петри Петри (перевернуто на поверхности льда). (В) Схема поверхности хирургии, изготовленные из стопки (сверху вниз) белой фильтровальной бумаги, сложенные влажной ткани для очистки, и кусок парафиновой пленки.(С) Операция установки (для правой руки). А: Объем рассечения, В: моноблочной освещение, C: хирургия поверхность, D: Пельтие пластина, Е: блюдо из 5-7 мм червей готовы к абляции, F мыть бутылку червячной воды, г: палочки остального держит чистые пипетки передачи, Н: палочки остального держит иглу / шприц, я: палочки остального держа пинцет, J: контейнер дополнительных пипеток передачи. (D) Пользовательские Пельтья конфигурация пластины. (Е) Петри конфигурация холодной пластины. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 2: Положение рук и иглы / шприца во время абляции. (A) Размещение рук (для правой руки). Обратите внимание, что левый палец используется для поддержки шприца (проводитсяв правой руке), чтобы минимизировать движение. (Б) Размещение иглы по отношению к глазу червя. Обратите внимание, что скошенная поверхность иглы обращена вверх. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
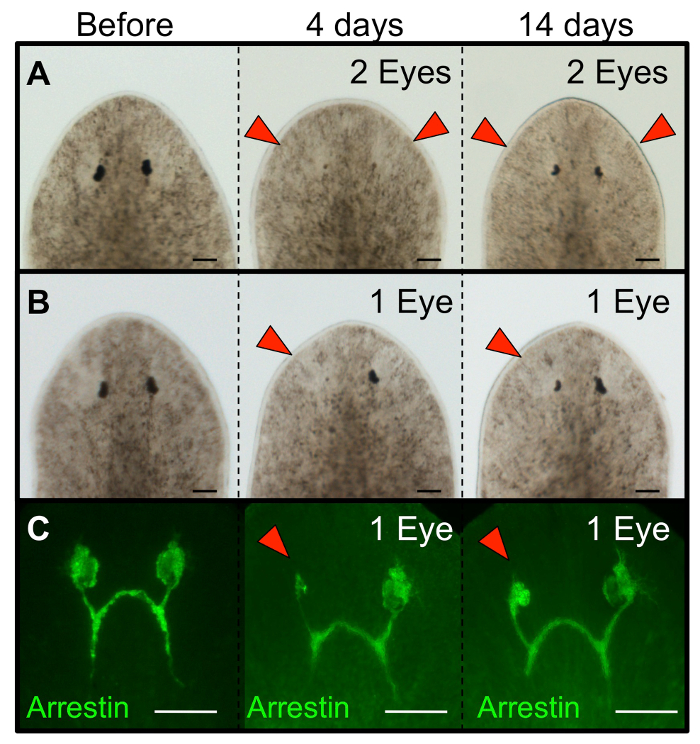
Рисунок 3: ABLATED планарии глаза регенерируют. Морфология Schmidtea Mediterranea планарий отрастут глаза следующие (A) абляции двойной глаз и (В) один глаз абляции. (С) Иммуногистохимии показывает регенерацию нейронов фоторецепторов (анти-arrestin) после одной абляции глаз. Интактные черви показаны перед операцией, и регенерирует показаны в дни 4 и 14 после абляции. Для одиночных глаз абляции, левый глаз былblated и правый глаз служит в качестве внутреннего (неповрежденного) контроля. Красные стрелки: ABLATED глаза. Шкала бар = 100 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
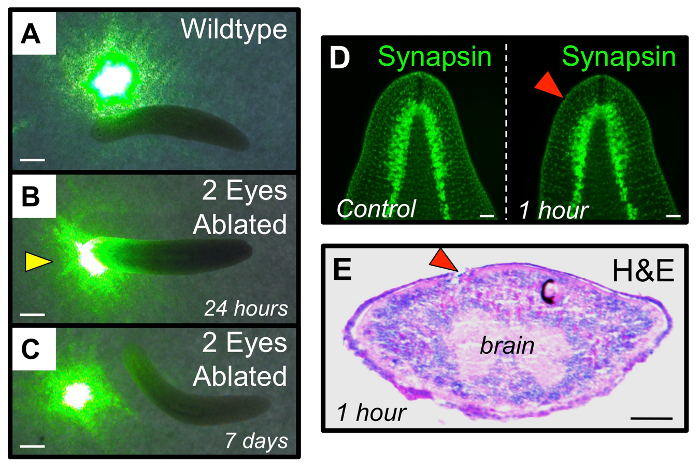
Рисунок 4: Функциональное восстановление зрительной системы после удаления. (А - С) Функциональный тест для проверки планарии светобоязнь. (А) интактные черви избежать поездок через районы света, такие как пятна от зеленого указателя лазера. (В) В 24 ч после абляции, «слепые» двойных глаза ABLATED червей проходят через световые пятна. (С) через 7 дней после абляции, двойные глаза абляции черви регенерируют их визуальную систему достаточно , чтобы восстановить свет избегания. Желтый стрелолист: аберрантное поведениеаль ответа. (Д - Е) абляция глаз ограничиваются тканями глазного бокала, и не мешает лежащей в основе ткани головного мозга. (D) Иммуногистохимия показывает архитектуру мозга (анти-синапсины) не изменяется от лица абляции до 1 ч после абляции. (Е) гематоксилин и эозин (Н & Е) окрашивание на 1 ч после абляции в поперечном сечении , показывающее повреждение в основном ограничиваются месте аблированного глазным бокалом. Правый глаз (с черными пигментными клетками) служит в качестве внутреннего контроля. Красные стрелки: ABLATED глаза. Масштабные полоски = 1 мм (AC) 1 мм, 100 мкм (DE). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
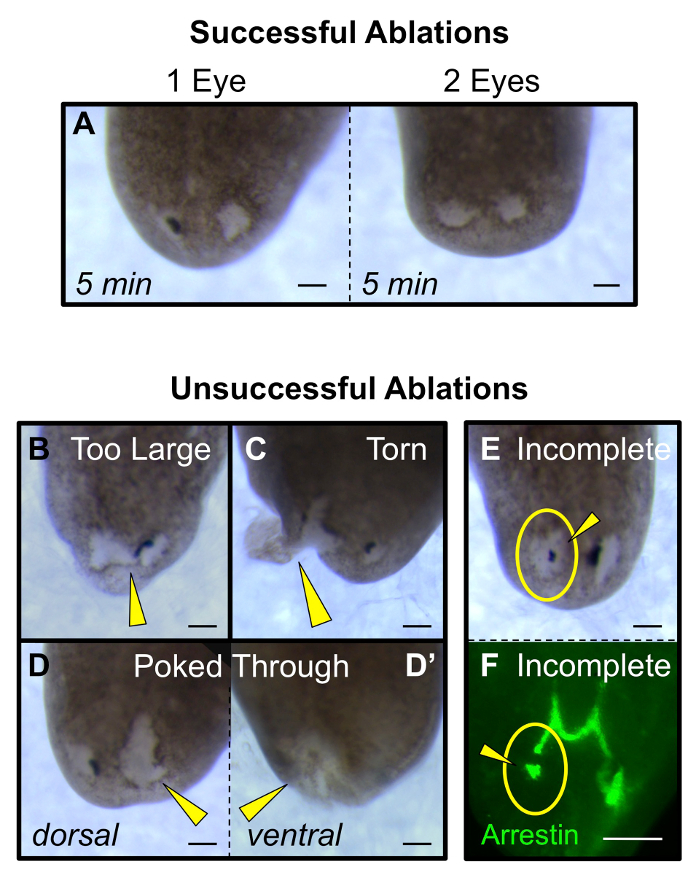
Рисунок 5: Клейма успешной и неуспешной абляция. (А) Успешные одиночные и двойные глаза абляции (при 5 мин после абляции) есть раны, которые примерно одинаковы по размеру первоначального глазного бокала. (B - E) Неудачные абляции: (B) слишком много ткани удаляются или рана соединяет два глаза, (С) слезами сайта раны и простирается до края, (D) рана слишком глубока и просовывает через от спинной (D) , на вентральный (D») со стороны, и (E - F) , не все из зрительных тканей чашек удалены, визуализируется как морфологический (Е) и анти-arrestin окрашивание нейронов фоторецепторов (F). Желтые стрелки: аномальная абляция. Желтые круги: абляция сайт. Шкала бар = 100 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
Эта техника глаза абляции улучшает современные методы (например, перфорация) путем исключения тканей мозга и ограничения иссечения в основном для тканей глаза. С практикой, эта техника может быть выполнена большинством людей, от опытных техников в микрохирургических для неопытных, но добросовестных студентов. Рекомендуется , чтобы эта техника быть осуществлено на практике много раз перед использованием абляции в экспериментах, в том числе (когда это возможно) подтверждение полного удаления всех тканей глаза с помощью иммуногистохимии или гибридизация для глаз маркера (ов) 4, 5, 13 в. Наиболее важным шагом в этом протоколе является выкапывание из тканей. Важно, чтобы не удалить или слишком много или слишком мало ткани. Этого можно избежать, если не выкопать слишком глубоко с иглой, чтобы избежать проникающего через брюшную сторону червя. Кончик девичествеDLE должен быть вставлен только глубиной около 0,4 мм, а скошенная часть иглы никогда не должна пройти весь путь через глаз. Особое внимание следует принимать, чтобы не повредить хрупкую ткань между двумя глазами (медиальный край черной пигментированной области каждого глаза представляет границу каждого глаза). Повреждение между глазом и дистальным краем червя также следует избегать. Меньшие черви, более вероятно, чтобы сорвать или непреднамеренное травму, поэтому рекомендуется использование больших червей (в частности, для практики). Основные недостатки этого метода является то, что она относительно больших затрат времени (и не подходит для экранов с высокой пропускной способностью), и это требует первоначальных инвестиций в практику для обеспечения точности результатов. Однако, с практикой 10 глаз может быть абляции в ~ 15 мин.
Одной из основных областей для поиска неисправностей в соответствии планарий еще во время процедуры. Две основные причины червей не иммобилизованные достаточно для выполнения абляцииявляются: (а) слишком много воды, и (б) потеря холодной температуры. (A) Превышение планарии воды, бассейны на поверхности хирургии в то время как передача черви позволят червям двигаться и усложняют операцию. Поверхность хирургии (безворсовая ткань вытереть и фильтровальная бумага) должна оставаться только во влажной состоянии. Если в любой момент во время процедуры вытирать насыщается червячного водой, она должна быть либо заменены или передачи пипетки можно использовать, чтобы аккуратно удалить лишнюю жидкость из ткани протереть (всегда извлечь из протирать, а не фильтровальную бумагу). Тканевые салфетки также могут быть использованы для удаления избытка воды пулы на поверхности хирургии. Этот процесс, возможно, придется повторить несколько раз, в зависимости от количества червей время абляции. (В) При использовании чашки Петри холодной пластины установить вверх, помните, как только заменить холодную пластину, как лед начинает плавления и 60 Мм Петри Петри крышка начинает плавать. Это позволит обеспечить как стабильную хирургии поверхность и соответственно холодную поверхность. В качестве альтернативы, при использовании пластины Пельтьеустановить, иметь в виду, что после 45 мин до 1 ч использования, тепло в наружных кольцах преодолеет холодную пластину в центре и все охлаждения будут потеряны. Если это произойдет, выключите плиту Пельтье в течение 5-10 мин, чтобы позволить ему нагреться до комнатной температуры перед возобновлением абляции.
Другая область поиска неисправностей во время передачи червячной между тарелкой и поверхностью хирургии и обратно. Если ABLATED червей трудно удалить из фильтровальной бумаги, поместите каплю червячной воды на черве, пока жидкость не пулы на верхней часть фильтровальной бумаги. Черви могут быть затем засасывается в пипетки передачи, как обычно. Если проблемы сохраняются, попробуйте листать червяк на вентральной сторону первым (с помощью тупой стороны пинцета). Если червь застревает внутри пипетки передачи, обычно это признак того, что слишком много воды не было принято до (черви должны быть втянуты в пипетки передачи не дальше, чем примерно на дюйм). Чтобы удалить червь застрял в пипетках передачи, составлять 1-2 мл червячного очистаэр в пипетку, так что червь покрыт водой. Твердо Флик стороны пипетки, пока червь не отрывается от стенки пипетки и плавает.
Если игла становится тусклой, замените новую иглу / шприц. Подумайте о замене иглы после ее использования для абляции ≥30 глаза. Чрезмерное удаление резецированных тканей путем протирки салфеткой протереть может также притупить иглы, что делает более трудным абляции. Это хорошо, если резекция ткани остановиться в скошенной части иглы в течение всей процедуры (даже на нескольких животных). Всегда используйте свежую иглу / шприц при переключении между червями различных условий (например , диким типом vs. RNAi червей), а также при начале новых сеансов абляции (т.е. в разные дни).
Эта хирургическая техника глаза абляции является мощным средством, чтобы исследовать Светоиндуцированное поведение (и их генетические и неврологические основы) в планарии, в частности,в сочетании с фармакологической терапии или РНК-интерференции. Глаз абляция также является отличным средство, чтобы выяснить механизмы , которые регулируют эндогенный планарии регенерация глаз (и стволовые клетки глаза обслуживания и дифференцировку) в естественных условиях. Поскольку большинство позвоночных животных имеют очень ограниченные способности регенерировать ткани глаза, понимая, как планарии способны регенерировать свои глаза будет иметь важное значение в определении возможных механизмов для перевода в будущие терапии.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Авторы хотели бы поблагодарить Мишел Деочанд для совершенствования этой глазной метод абляции, Тейлор Биркхольцем за помощью функционального анализа, Майкл Левин для анти-arrestin антитела и Junji Morokuma информации на пластинах Пельтье. Эта работа была поддержана грантом ГФНЫ из Университета Западного Мичигана в WSB.
Материалы
| Name | Company | Catalog Number | Comments |
| Instant Ocean sea salts | Spectrum Brands | SS15-10 | "10 Gallon" box (net weight 3 lbs) |
| Kimwipes EX-L lint-free tissue wipe | Kimberly-Clark | 34155 | 4.5 x 8.5 in |
| Whatman #2 filter paper | Sigma | WHA1002125 | Circles, 125 mm diameter, white |
| Easy Touch Insulin syringe (with needle) | Pet Health Market | 17175-04 | U-100 1 cc syringe, 31 G 5/16 in needle |
| 100 mm Petri dish | VWR | 25384-342 | 100 mm x 15 mm |
| 60 mm Petri dish | VWR | 25384-092 | 60 mm x 15 mm |
| Dumont #5 forceps | Fine Science Tools | 11254-20 | Inox, straight tip , 11 cm |
| Transfer pipettes | Samco Scientific | 225 | Graduated, large bulb, 7.5 mL, non sterile |
| Parafilm M paraffin film | Brand | 701606 | 4 in x 125 ft roll |
| 12-well untreated tissue culture plate | VWR | 15705-059 | Untreated, flat bottom, sterile, Falcon brand |
| Plastic food containers (for colony) | Ziploc | Large rectangle | 2.25 qt (2.12 L), 10" x 6 -3/4 " x 3 -3/16" |
| Planaria (Girardia tigrina) | Carolina Biological | 132954 | Sold as "Brown" Planaria; most often they are G. tigrina (aka Dugesia tigrina), but sometimes are G. dorotocephala (aka Dugesia dorotocephala); either will work. |
| Planaria (Schmidtea mediterranea) | n/a | n/a | S. mediterranea are not commercially available. At this time animals are only obtainable from laboratories that use them and have extra animals. |
| Brown paper towels | Grainger | 2U229 | 9-3/16 x 9-3/8" 1-Ply Multifold Paper Towel, UNBLEACHED |
| Wash bottle (for worm water), optional | VWR | 16650-275 | Wash Bottles, Low-Density Polyethylene, Wide Mouth, 500 mL |
| Anti-synapsin antibody, optional | Developmental Studies Hybridoma Bank | 3C11 | Supernatant |
| Anti-arrestin antibody, optional | n/a | n/a | Not commercially available. Kind gift from Michael Levin, Tufts University |
| Nalgene Lowboy carboy with spigot (for storing worm water), optional | Nalge Nunc International Corporation | 2324-0015 | 15 L, polypropylene, low profile makes it easier to fill plastic colony containers |
| Custom Peltier plate, optional | Williams Machine, Foxboro, MA | n/a | Design specifics courtesy of Junji Morokuma, Tufts University: Peltier plate is constructed of a standard thermoelectric heat pump (for example, All Electronics Corp Catalog # PJT-1, 30 mm2). The square heat pump is covered with a thin mirrored surface, then placed inside a 30 mm2 square hole in a circular plexiglass form (~50 mm in diameter). This form is of similar thickness to the heat pump, and fits flush into a well tooled in the center of a round heat sink (~115 mm in diameter). The form/heat pump is "anchored" to the sink with silicone base heat sink compound. The leads are threaded through holes drilled through both the form and the the heat sink. The bottom half of the heat sink is tooled into a "foot" that fits into the opening of your microscope's base plate. |
| DC power source (for Peltier plate), optional | B & K Precision | 1665 | Regulated Low Voltage DC Power Supply, 1-18 V (DC), 1-10 amps. |
| Other common supplies | |||
| Gloves | |||
| Razor blade | |||
| Scissors | |||
| Dissecting scope with gooseneck lighting | |||
| Chopstick rests, optional |
Ссылки
- Gentile, L., Cebria, F., Bartscherer, K. The planarian flatworm: an in vivo model for stem cell biology and nervous system regeneration. Dis Model Mech. 4 (1), 12-19 (2011).
- Elliott, S. A., Sanchez Alvarado, A. The history and enduring contributions of planarians to the study of animal regeneration. Wiley Interdiscip Rev Dev Biol. 2 (3), 301-326 (2013).
- Emili Saló, R. B., Tsonis, P. A. Chapter 3. Animal Models in Eye Research. , 15-26 (2008).
- Lapan, S. W., Reddien, P. W. dlx and sp6-9 Control optic cup regeneration in a prototypic eye. PLoS Genet. 7 (8), e1002226 (2011).
- Lapan, S. W., Reddien, P. W. Transcriptome analysis of the planarian eye identifies ovo as a specific regulator of eye regeneration. Cell Rep. 2 (2), 294-307 (2012).
- Inoue, T., et al. Morphological and functional recovery of the planarian photosensing system during head regeneration. Zoolog Sci. 21 (3), 275-283 (2004).
- Pineda, D., et al. The genetic network of prototypic planarian eye regeneration is Pax6 independent. Development. 129 (6), 1423-1434 (2002).
- Paskin, T. R., Jellies, J., Bacher, J., Beane, W. S. Planarian Phototactic Assay Reveals Differential Behavioral Responses Based on Wavelength. PLoS One. 9 (12), e114708 (2014).
- Raffa, R. B., Martley, A. F. Amphetamine-induced increase in planarian locomotor activity and block by UV light. Brain Res. 1031 (1), 138-140 (2005).
- Sandmann, T., Vogg, M. C., Owlarn, S., Boutros, M., Bartscherer, K. The head-regeneration transcriptome of the planarian Schmidtea mediterranea. Genome Biol. 12 (8), R76 (2011).
- Vasquez-Doorman, C., Petersen, C. P. The NuRD complex component p66 suppresses photoreceptor neuron regeneration in planarians. Regeneration (Oxf). 3 (3), 168-178 (2016).
- Deochand, M. E., Birkholz, T. R., Beane, W. S. Temporal regulation of planarian eye regeneration. Regeneration. 3 (4), 209-221 (2016).
- Sakai, F., Agata, K., Orii, H., Watanabe, K. Organization and regeneration ability of spontaneous supernumerary eyes in planarians -eye regeneration field and pathway selection by optic nerves. Zoolog Sci. 17 (3), 375-381 (2000).
- Asano, Y., Nakamura, S., Ishida, S., Azuma, K., Shinozawa, T. Rhodopsin-like proteins in planarian eye and auricle: detection and functional analysis. J Exp Biol. 201 (Pt 9), 1263-1271 (1998).
- Cross, S. D., et al. Control of Maintenance and Regeneration of Planarian Eyes by ovo. Invest Ophthalmol Vis Sci. 56 (12), 7604-7610 (2015).
- Robb, S. M., Gotting, K., Ross, E., Sanchez Alvarado, A. SmedGD 2.0: The Schmidtea mediterranea genome database. Genesis. 53 (8), 535-546 (2015).
- Robb, S. M., Ross, E., Sanchez Alvarado, ., A, SmedGD: the Schmidtea mediterranea genome database. Nucleic Acids Res. 36, D599-D606 (2008).
- Beane, W. S., Tseng, A. S., Morokuma, J., Lemire, J. M., Levin, M. Inhibition of planar cell polarity extends neural growth during regeneration, homeostasis, and development. Stem Cells Dev. 21 (12), 2085-2094 (2012).
- Forsthoefel, D. J., Waters, F. A., Newmark, P. A. Generation of cell type-specific monoclonal antibodies for the planarian and optimization of sample processing for immunolabeling. BMC Dev Biol. 14, 45 (2014).
- Ross, K. G., et al. Novel monoclonal antibodies to study tissue regeneration in planarians. BMC Dev Biol. 15, 2 (2015).
- Cardona, A., Fernandez, J., Solana, J., Romero, R. An in situ hybridization protocol for planarian embryos: monitoring myosin heavy chain gene expression. Dev Genes Evol. 215 (9), 482-488 (2005).
- King, R. S., Newmark, P. A. In situ hybridization protocol for enhanced detection of gene expression in the planarian Schmidtea mediterranea. BMC Dev Biol. 13, 8 (2013).
- Pearson, B. J., et al. Formaldehyde-based whole-mount in situ hybridization method for planarians. Dev Dyn. 238 (2), 443-450 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены