Method Article
Chirurgical Ablation Essai pour étude de la régénération des yeux dans planaires
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole montre comment exciser constamment les yeux planaires (tasses optiques) sans déranger les tissus environnants. En utilisant une aiguille d'insuline et d'une seringue, un ou les deux yeux peuvent être ablatée pour faciliter les enquêtes sur les mécanismes de régulation de la régénération des yeux, l'évolution de la régénération visuelle, et les bases neurales du comportement induite par la lumière.
Résumé
Dans l'étude des cellules souches adultes et les mécanismes de régénération, flatworms planaires sont un aliment de base dans le système modèle in vivo. Cela est dû en grande partie à leur population de cellules souches pluripotentes abondante et la capacité de régénérer tous les types de cellules et de tissus après des blessures qui seraient catastrophiques pour la plupart des animaux. Récemment, planaires ont gagné en popularité en tant que modèle pour la régénération des yeux. Leur capacité à régénérer l'œil entier (comprenant deux types de tissus: cellules de pigment et photorécepteurs) permet la dissection des mécanismes de régulation de la régénération du système visuel. L'ablation des yeux présente plusieurs avantages par rapport aux autres techniques (telles que la décapitation ou perforatrice) pour l'examen des voies spécifiques à l'oeil et les mécanismes, dont le plus important est que la régénération est en grande partie limitée aux tissus oculaires seuls. Le but de cet article vidéo est de montrer comment supprimer de manière fiable la coupe optique planaires sans perturber le cerveau ou les tissus environnants.La manipulation des vers et à l'entretien d'une colonie établie est également décrite. Cette technique utilise un 31 G, 5 / aiguille d'insuline de 16 pouces pour ramasser une intervention chirurgicale sur la coupe optique planaires de immobilisées sur une plaque froide. Cette méthode englobe à la fois l'ablation oculaire simple et double, avec les yeux régénérant dans les 1-2 semaines, ce qui permet un large éventail d'applications. cette technique d'ablation en particulier, peut être facilement combiné avec des écrans pharmacologiques et génétiques (interférence ARN) pour une meilleure compréhension des mécanismes de régénération et de leur évolution, les cellules souches des yeux et leur entretien, et les réponses comportementales phototaxic et leur base neurologique.
Introduction
Planaires sont un organisme modèle puissant pour étudier la régénération des cellules à médiation souches adultes. Ces planaires d'eau douce non parasites possèdent la capacité de régénérer les tissus et tous les disparus, y compris leur système nerveux central et le cerveau 1. Étudié dès les années 1700 2, les avancées technologiques dans le domaine planaire au cours des 10-15 dernières années ( par exemple un génome séquencé, l'hybridation in situ, l' immunohistochimie, l' interférence ARN (ARNi), et transcriptomique) ont mis à jour cet organisme modèle historique . Plus précisément, les planaires ont récemment gagné en popularité comme un nouveau modèle pour la recherche des yeux 3.
Planaires ont des yeux prototypiques avec seulement deux types de tissus, les neurones photorécepteurs et des cellules de pigment; ce qui a permis la caractérisation de la population oeil sur les cellules souches et a démontré que la plupart des mêmes gènes de régulation de l'oeil de vertébrésveloppement sont conservés dans planaires 4, 5. Les coupes optiques sont situés dorsalement et comprennent des dendrites blanches, non pigmentés des neurones photorécepteurs et les cellules de pigment noir semi-lunaires, et les yeux innervent le cerveau par l'intermédiaire d'un chiasma optique. En plus d'être un modèle pour élucider les processus de régénération 6, l'oeil planaire est bien adaptée à l' étude de l'évolution des mécanismes visuels 7, les réponses comportementales à la lumière (planaires afficher phototaxie négative) 8, et la base du comportement neurologique 9.
La régénération des yeux dans planaires a été largement étudié dans deux contextes principaux: dans le cadre de la régénération de la tête suivante 4 décapitation, 10, et après l' excision de seulement les tissus oculaires 11, 12 . La plupart des études planaires sur la régénération des yeux ont utilisé la méthode de la décapitation, car il est simple et direct. La méthode la plus courante de l' excision des yeux planarian à ce jour a été par perforatrice avec un beau tube capillaire en verre 13, 14, bien que certaines études ont également effectué des amputations juste derrière les yeux (décapitation partielle) 15. Cependant, toutes ces méthodes impliquent la perte de nombreux tissus autres que de l'œil (comme le cerveau, les intestins, et néphridies), ce qui complique l'interprétation des résultats potentiellement. Le protocole d'ablation oculaire présenté ici limite l'excision des tissus oculaires (en particulier à l'exclusion du cerveau), entraînant des données plus spécifiques à l'œil. De plus, à la différence des vers décapités qui prennent 7-14 jours pour commencer l' alimentation, les yeux vers ablatée alimenteront dans les 24 h d'ablation 12, ce qui permet des expériences ARNi (où l' ARNi est délivré par la nourriture) à performeD simultanément.
Bien que l'ablation de l'oeil est techniquement plus difficile à réaliser avec succès que la décapitation, les études en cours portant sur l'excision des yeux ne sont pas inclus des instructions détaillées sur leurs procédures. L'objectif de cet article vidéo est de permettre aux chercheurs d'enlever systématiquement la coupe optique planaires sans perturber les tissus cérébraux sous-jacents et la suppression de quelques autres tissus que possible. Cette méthode peut être utilisée à la fois l'ablation oculaire simple et double et est applicable à un large éventail d'enquêtes. Comme la plupart des essais de régénération, l'ablation de l'œil est bien adapté pour une combinaison avec les deux écrans (ARNi) pharmacologiques et génétiques, ainsi que des études comportementales. Nous décrivons ici les méthodes pour la manipulation des vers, en maintenant une colonie planaires, et la technique d'ablation de l'œil lui-même.
Protocole
1. Culture des animaux et la manipulation
NOTE: Ce protocole utilise mediterranea Schmidtea, une espèce planaires diploïdes avec un génome séquencé 16, 17 qui est couramment utilisé pour la recherche sur la régénération. Cependant, le dosage est le même succès avec d' autres espèces, telles que Girardia Tigrina et Girardia dorotocephala (qui sont disponibles dans le commerce).
- Maintenir vers dans « l' eau à vis sans fin » fabriqué à partir de 0,5 g de sels de mer / L dans ultrapure (ou déminéralisée filtrée) de l' eau. Utilisation polypropylène stériles ou des récipients en verre pour contenir l'eau à vis sans fin. Voir fichier supplémentaire 1 pour plus de détails sur la préparation de l' eau du ver.
REMARQUE: Ne jamais utiliser de savon pour nettoyer des récipients (ou d'autres fournitures) que le savon est toxique pour les vers; à la place essuyer avec 70% d'éthanol et laisser sécher à l'air.- Porter des gants tout en travaillant avec planaires pour les protéger de la contamination.
NOTE: Les vers sont très sensibles aux toxines environnementales et les produits chimiques, y compris du savon, eau de javel, du shampoing, revitalisant et lotion pour les mains.
- Porter des gants tout en travaillant avec planaires pour les protéger de la contamination.
- colonies de la maison dans des récipients alimentaires en polypropylène, avec le couvercle partiellement ouvert à gauche pour l'échange de l'air à environ 20 ° C (température ambiante). vers expérimentales du magasin dans les deux boîtes de Pétri (20 vers par boîte de 100 mm) ou de plaques de culture de tissus non traités (1 ver par puits pour les plaques à 12 puits). Pour réduire le stress, maintenir les colonies et expériences dans l'obscurité.
NOTE: Les colonies ne devraient pas avoir plus de 500-1.000 vers par litre d'eau de ver. Pour les expériences, laisser les paupières complètement en place, étant donné que le flux d'air est conçu dans ces plats. - Nourrir les vers non expérimentales une fois par semaine avec du bœuf biologique ou de purée de foie de volaille en laissant tomber la purée d'une pipette de transfert, en plaçant des gouttes de nourriture à travers le récipient. Laisser les vers 2 h à consommer de la nourriture dans laobscurité avant le nettoyage de conteneur (voir étape 1.4). Avant l'utilisation, la purée de conserver à -20 ° C pour le court terme (semaines) ou -80 ° C pour le long terme (mois); ne pas recongeler la purée pour la réutilisation (comme les bactéries peuvent fleurir et nuire aux vers).
NOTE: Le foie ne doit pas contenir des hormones ou des antibiotiques et de préférence être préalablement congelé. Centrifugeuse de purée avant la congélation (ou avant l'alimentation) pour éliminer l'air et éviter que les aliments flottant. La nourriture doit couler au fond du récipient. 1 ml de purée est suffisante pour les vers 500-1000. - l'eau d'échange une fois par semaine avec de l'eau de ver frais pour les colonies et expériences. Conteneurs de colonies doit également être essuyés avec une serviette en papier non blanchie (pour éliminer les résidus de mucus que les déchets de casiers) une fois par semaine pour les vers de faim, ou deux fois par semaine pour les vers d'alimentation (2 h après le repas et encore 2 jours plus tard). Afin de conserver le biofilm, ne pas essuyer plus de 80% du récipient.
- Déplacer vers entre les conteneurs (ou Setu de chirurgiep) à l'aide d'une pipette de transfert. Pour les vers libres adhèrent à la surface des récipients, injecter de l'eau sur / derrière la vis sans fin pour le libérer de la surface. Puis aspirer le ver dans la pipette, en essayant de garder le ver dans la partie inférieure pouces (plus mince) de la pipette.
- pipettes backloading avec une petite quantité d'eau de ver avant de les aspirer.
- Essayez de déplacer l'eau autour du ver, plutôt que le ver lui-même, pour aider à prévenir la déchirure vers corps mou en les touchant avec la pipette.
- Garder plats expérimentaux couverts à moins que le transfert vers ou en remplaçant l'eau.
2. Préparation
- Arrêtez vers l' alimentation au moins une semaine avant les expériences.
- Sélectionner des vers qui ont été pas été nourris pendant ≥1 semaine et sont au moins 5-7 mm de longueur. Transférer les vers à une boîte de Pétri 2/3 plein d'eau à vis sans fin, et confirmer la longueur de vis sans fin en faisant glisser une règle sous le plat. mesurer wORM en pleine extension et en mouvement.
REMARQUE: Bien que plus petit (5-7 mm) vers fonctionnent mieux lors de l' exécution ultérieure et immunofluorescence analyses hybridation in situ, les vers de plus grands (8-10 mm) sont plus faciles à travailler avec - en particulier lors de l' apprentissage à pratiquer l' ablation. - Assurez-vous que les vers sont entiers, en bon état, et non récemment régénération.
NOTE: les vers régénérant auront beaucoup plus léger pigment (ou pas) de la tête et / ou de la région de la queue par rapport à la normale vers. - Si vous effectuez ARNi ou traitements pharmacologiques sur les vers, le faire à ce stade. Si les vers ont été nourris dans le cadre du traitement (comme pour ARNi), attendez au moins 7 jours après la dernière alimentation avant de continuer à l'étape 2.2.
- Sélectionner des vers qui ont été pas été nourris pendant ≥1 semaine et sont au moins 5-7 mm de longueur. Transférer les vers à une boîte de Pétri 2/3 plein d'eau à vis sans fin, et confirmer la longueur de vis sans fin en faisant glisser une règle sous le plat. mesurer wORM en pleine extension et en mouvement.
- Nettoyer la base de microscope espace de travail et disséquant avec 70% d' éthanol et laisser sécher complètement. Placez le plat de vers sélectionnés sur la gauche de la portée. A droite de la portée, de placer une paire de forceps # 5, un 31 G 5/16-inch aiguille à l'insuline avec une 1ml seringue, et une pipette de transfert propre.
- Veiller à ce que les instruments sont gardés de toucher le banc (qui pourrait introduire des contaminants). Utiliser un élément rigide (par exemple un reste de baguettes) pour maintenir la pince, l'aiguille, et la pipette propre. Sinon, place des instruments sur le dessus d'un nouveau brun (écrue) serviette en papier.
REMARQUE: Ces instructions et suivantes sont écrites en ce qui a trait aux personnes droitiers. les individus gauchers doivent inverser les directions droite / gauche.
- Veiller à ce que les instruments sont gardés de toucher le banc (qui pourrait introduire des contaminants). Utiliser un élément rigide (par exemple un reste de baguettes) pour maintenir la pince, l'aiguille, et la pipette propre. Sinon, place des instruments sur le dessus d'un nouveau brun (écrue) serviette en papier.
- A côté de l'espace de travail, placer une boîte de lingettes de tissu sans peluches, une source d'eau de ver frais, et quelques pipettes de transfert supplémentaires (protégés par le haut du banc). Mettre l'eau ver dans une bouteille en plastique de lavage pour faciliter la distribution. Également placer une plaque de 12 puits marqué (ou boîte de Petri de 100 mm) à droite de la portée de la collecte des animaux ablation.
- Si vous utilisez une plaque à effet Peltier sur mesure pour immobiliser les vers, positionner la plaque Peltier dans la dépression en til base du microscope à dissection et ajuster la sortie de la source d'alimentation en courant continu jusqu'à ce que la surface de travail de la plaque Peltier est suffisamment froide (typiquement ~ 5 V) .Alternatively, faire une plaque froide en remplissant une boîte de Petri de 100 mm ½ avec de l'eau et congeler pendant au moins 24 h. Jeter le couvercle et placer le fond de la boîte de 100 mm sur la base du champ de dissection, puis placer le couvercle d'une boîte de Pétri à l'envers 60 mm vers le bas directement sur la surface de la glace (figure 1A).
- Après que l'eau a gelé dans le plat de 100 mm, un « volcan » de la glace peut apparaître dans le centre de la plaque. Si cela se produit, utilisez une lame de rasoir pour gratter le plat de glace, pour éliminer les irrégularités de la surface.
REMARQUE: lors de chirurgies de la glace va fondre, ce qui rend beaucoup plus difficile ablations. Préparer plusieurs plats à base de glace à l'avance, et remplacer les surgelés pour les faire fondre pendant l'essai dès que le couvercle de la boîte de 60 mm commence flottant.
- Après que l'eau a gelé dans le plat de 100 mm, un « volcan » de la glace peut apparaître dans le centre de la plaque. Si cela se produit, utilisez une lame de rasoir pour gratter le plat de glace, pour éliminer les irrégularités de la surface.
- Préparer lasurface de la chirurgie. Couper une 5 cm x 10 cm morceau de film de paraffine en matière plastique (4 cm 2 si l'on utilise la plaque froide boîte de Pétri) et le placer sur le centre du dispositif d'immobilisation. Plier un tissu non pelucheux essuyer dans un carré d' environ 2 cm 2 et le placer sur le dessus du film. Couper un morceau de papier filtre blanc de 1,5 à 2 cm 2 et le placer sur le dessus de la lingette. Voir Figure 1B-1E.
- Tenir le plié lingette en place avec un doigt ganté, et utiliser l'eau de ver pour amortir légèrement la lingette pour qu'il reste plié. Utiliser le côté d'une pipette de transfert pour rouler le chiffon plat.
REMARQUE: La température froide permet de garder les vers de se déplacer. Travailler « sec » contribue également à l'immobilisation. Le tissu essuyer agit pour évacuer l'eau à travers le papier filtre, en maintenant la vis sans fin humide pendant la chirurgie sans laisser les vers à sécher complètement (qui est létale).
- Tenir le plié lingette en place avec un doigt ganté, et utiliser l'eau de ver pour amortir légèrement la lingette pour qu'il reste plié. Utiliser le côté d'une pipette de transfert pour rouler le chiffon plat.
3. Ablation chirurgicale
- Utiliser une pipette de transfert pour placer surface dorsale de e à vis sans fin vers le haut sur le papier filtre. Tournez la source de lumière et de diriger les cols de cygne pour que la lumière se concentre sur le ver. Ajustez la mise au point de la portée à disséquer et à un grossissement de sorte que les yeux soient clairement visibles (l'ensemble du ver n'a pas besoin d'être en vue); grossissement 5X est un bon point de départ. Orienter la vis sans fin en faisant tourner le film de paraffine de sorte que la tête est pointée vers le chercheur (vers l'avant du microscope), en angle 30-40 degrés vers la droite.
- Évitez l'utilisation de la lumière vive pour empêcher le mouvement excès de ver. Planaires afficher phototaxie négatifs et tenteront d'échapper à la lumière vive.
- Si la vis sans fin est positionnée face ventrale vers le haut (avec ouverture pharyngée visible), utiliser le côté mat de la pince pour repositionner doucement la face dorsale de la vis sans fin vers le haut (avec les yeux visibles). Évitez de vous approcher l'animal avec la pointe acérée de la pince pour minimiser le risque de déchirer à travers les tissus mous lors du repositionnement de l'animal.
- Régler la mise au point du microscope afin que les yeux soient clairement mis au point. Assurez-vous également que les yeux et les tissus environnants tête sont en vue.
- Tenir une nouvelle aiguille / seringue dans la main droite comme si elle était un stylo (entre le pouce et l'index). Préparez le pouce gauche contre la plaque Peltier (ou boîte de Petri de la plaque froide), et en utilisant le pouce gauche comme un point d' appui sur lequel la partie inférieure de la seringue de repos (figure 2A). Regardez à travers le microscope, et assurez - vous que le biseau de l'aiguille est visible.
NOTE: Les aiguilles sont très pointues. Soyez prudent lors de la manipulation. Le port de gants en latex ou en nitrile peut offrir une certaine protection.- Utilisez le pouce gauche pour aider à maintenir la constante aiguille / seringue tout au long de la procédure et éviter de serrer la main.
- Faire un angle d'environ 40 ° avec le pouce gauche et l'index gauche (avec l'index sur la surface de la chirurgie) pour aider à maintenir la stabile de surface de la chirurgie.
- Avecle biseau de l'aiguille dirigée vers le haut (comme une cuillère), positionner l'aiguille à angle droit par rapport à l'oeil (figure 2B). Utilisez la pointe de l'aiguille pour pénétrer doucement la mince couche de tissu recouvrant la coupe optique (région blanche, non pigmenté) de l'oeil, l'excavation de droite à gauche. Très retirer doucement tout tissu pigmenté situé à l' intérieur de la cupule optique, en prenant soin de ne pas perforer le fond ou détruire les bords de la coupe optique.
- Si le ver a été mis sur le papier filtre pour> 1-2 min à tout moment au cours de la procédure, ajouter une goutte d'eau de ver pour réhydrater le ver.
NOTE: Déshydratation va augmenter la sensibilité du ver à des blessures ripping.
- Si le ver a été mis sur le papier filtre pour> 1-2 min à tout moment au cours de la procédure, ajouter une goutte d'eau de ver pour réhydrater le ver.
- Répétez l'étape 3.3 jusqu'à ce que tous les tissus pigmentés en noir (cellules pigmentaires), ainsi que tous les tissus blancs de la coupe optique (les dendrites des cellules photoréceptrices), sont supprimés. Retirer les tissus excisés collé à l'extrémité de l'aiguille en l'essuyant avec une lingette soigneusement le tissu. Si Abla double oeiltion est souhaitée, le second oeil ablater à ce stade.
REMARQUE: Pour éviter les blessures, les aiguilles peuvent être nettoyés en saisissant l'aiguille avec un tissu propre lingette tenue avec le pouce et l'index, puis en utilisant l'autre main pour tirer l'aiguille à travers la lingette loin du pouce et l'index. En variante, l'aiguille peut être effacée sur la surface d'une lingette humide et le tissu examiné pour la propreté. - Une fois terminé, en utilisant une pipette de transfert pour déplacer la vis sans fin à un plat marqué contenant de l' eau fraîche à vis sans fin. Si l' analyse des données de groupe, placer jusqu'à 20 vers dans une seule boîte de Petri de 100 mm. Si la régénération de suivi dans les mêmes personnes au fil du temps, placer 1 ver dans chaque puits d'une plaque de 12 puits. Une fois que tous les vers sont transférés, laver les vers en enlevant l' eau à vis sans fin à partir des plats / puits et le remplacement avec de l' eau à vis sans fin plus frais.
- Pour supprimer les vers du filtre, backloading la pipette avec une petite quantité d'eau sans fin et libérer l'eau sur le ver. Cela devrait soulever til ver le papier-filtre, pour être immédiatement aspiré dans la pipette de transfert.
- Incuber expériences à ~ 20 ° C (température ambiante) à l'abri de la lumière et de suivre le processus de régénération.
REMARQUE: Les vers peuvent être stockés dans un incubateur à température contrôlée pour maintenir une température constante, mais ce n'est pas strictement nécessaire. La plupart des températures ambiantes ne varient que de + 5 ° C, ce qui ne sera pas affecter la capacité du ver à se régénérer. - Si l'on désire fixer des vers pour l' immunohistochimie (voir les figures 3-4) et / ou l'hybridation in situ analyse de l' expression génique. Différentes méthodes de fixation existent pour l' immunohistochimie planaire 18, 19, 20 et l'hybridation in situ 21, 22, 23 protocoles.
- Lorsque les expériences sont terminées, sacrifiCE en direct vers en éliminant l'eau du ver de la capsule et le remplacement avec 70% d'éthanol. Incuber les vers pendant 3-5 min, pour les vers à vérifier lyser et tourner grisâtres.
- Placez les vers non traités dans le flux de déchets normaux une fois sacrifié. Éviter d'introduire des vers vivants dans l'environnement, en particulier les espèces non indigènes.
Résultats
Pour la première 1-2 h après la chirurgie, les animaux peuvent présenter un mouvement diminué par rapport aux vers intacts (mais ils se déplaceront encore). Si vous le souhaitez, les vers mangent dans les 24 h de la chirurgie (par exemple, pour l'alimentation ARNi). En suivant la régénération des yeux chez les mêmes personnes au fil du temps, assurez-vous de prendre une photo de chaque ver à la fois avant la chirurgie (intacte) et à 1 h ablation post (hpa). En 4 jours après l' ablation (dpa) la régénération des cellules de pigment doivent être visibles, et par 14 dpa l'œil entier aura complètement régénéré (figure 3A-B). Cela inclut les neurones photorécepteurs et leur innervation dans le cerveau (figure 3C), ainsi que la récupération fonctionnelle du système visuel (Figure 4A-C). Ablations Le succès ne dérangent pas les tissus sous - jacents du cerveau (figure 4D-E), ni introduire d' autres blessures à l'animal (figure 5A). ablations non retenusinclure les animaux avec: une excision trop grande qui relie les deux yeux (figure 5B), des larmes à la marge latérale de l'animal (figure 5C), et / ou des plaies qui émergent à travers l'épiderme ventral (Figure 5D). En outre, les ablations non retenus comprennent l' élimination incomplète de l'ensemble de coupe optique, composé de deux tissus non pigmentés blancs et les cellules pigmentaires noirs (Figure 5E-F).

Figure 1: Préparation de chirurgie. (A) Schéma de construction de plaque de refroidissement, en utilisant le fond d'une boîte de Petri de 100 mm (rempli de glace) et le couvercle d'une boîte de Petri de 60 mm (placé à l' envers sur la surface de la glace). (B) Schéma de la surface de la chirurgie, constitué d'un empilement de ( de haut en bas) du papier filtre blanc, une lingette humide mouchoir plié, et un morceau de film de paraffine.(C) La chirurgie mis en place (pour la main droite). A: microscope à dissection, B: l'éclairage du col de cygne, C: surface de la chirurgie, D: plaque Peltier, E: plat de 5-7 mm vers prêt pour l'ablation, F: bouteille de lavage de l'eau à vis sans fin, G: reste baguette de maintien pipette de transfert propre, H: reste baguette de maintien d'aiguille / seringue, I: reste baguette de maintien des pinces, J: conteneur de pipettes de transfert supplémentaires. (D) personnalisé configuration de plaque Peltier. (E) boîte de Petri configuration de la plaque froide. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.

Figure 2: Position des mains et l' aiguille / seringue pendant l' ablation. (A) Placement des mains (pour le droitier). Notez que le pouce gauche est utilisé pour soutenir la seringue (tenuedans la main droite) pour minimiser le mouvement. (B) Mise en place de l'aiguille par rapport à l'oeil de la vis sans fin. On notera que la surface biseautée de l'aiguille tournée vers le haut. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
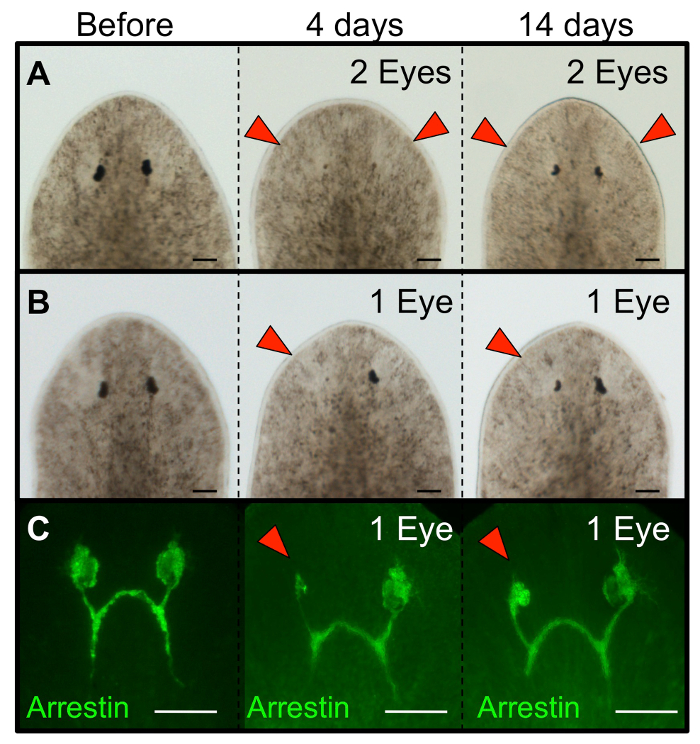
Figure 3: les yeux planaires ayant subi une ablation régénèrent. Morphology de Schmidtea mediterranea planaires régénératives yeux (A) suivant l' ablation double oeil et (B) d'ablation de l' œil unique. (C) Immunohistochimie montrant la régénération des neurones photorécepteurs (anti-arrestine) après ablation de l' œil unique. vers l'état intact sont présentés avant la chirurgie, et sont présentés à régénérées jours 4 et 14 après l'ablation. Pour ablations seul œil, l'œil gauche était unblated et l'œil droit sert de contrôle interne (indemne). rouge: yeux pointes de flèches. ablatée Les barres d'échelle = 100 um. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
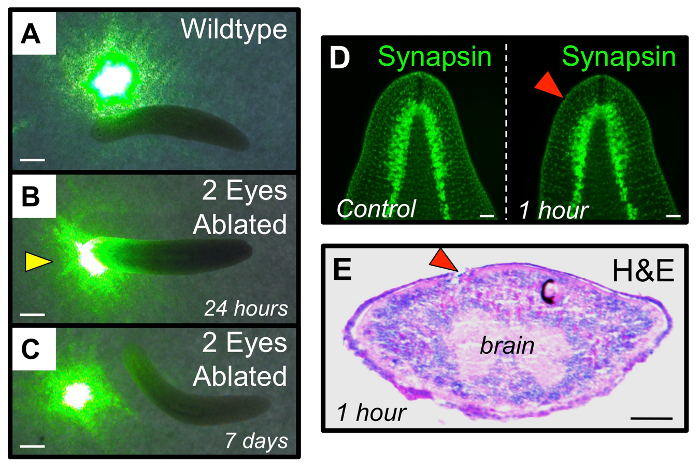
Figure 4: La récupération fonctionnelle du système visuel après l' ablation. (A - C) L' essai fonctionnel pour tester planarian photophobie. (A) vers l' état intact éviter de se déplacer à travers les zones de lumière, comme une tache à partir d' un pointeur laser vert. (B) à 24 h ablation post, double "aveugle" yeux vers ablatée voyagent à travers des points lumineux. (C) A 7 jours ablation post, double oeil vers leur ablatée ont régénéré système visuel suffisamment pour récupérer évitement de la lumière. Jaune arrowhead: comportement aberrantréponse al. (D - E) l' ablation des yeux est limitée aux tissus de la coupe optique, et ne perturbe pas les tissus cérébraux sous - jacents. (D) Immunohistochimie montrant l' architecture du cerveau (anti-synapsine) est inchangée par rapport à avant l' ablation de 1 h ablation de poste. (E) hématoxyline et coloration à l' éosine (H & E) à 1 h ablation de poste en coupe transversale montrant des dommages est largement restreinte à l'emplacement de la coupe optique ayant subi une ablation. œil droit (avec des cellules de pigment noir) sert de contrôle interne. rouge: yeux pointes de flèches. ablatée Les barres d'échelle = 1 mm (AC) 1 mm, 100 pm (DE). S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
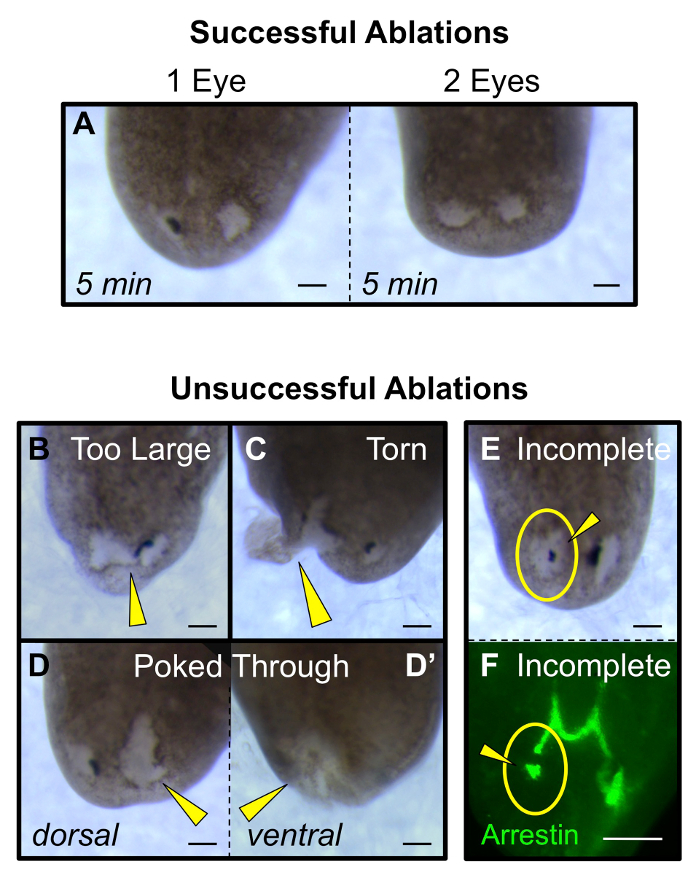
Figure 5: Poinçons de ablations réussies ou non. (A) oculaires simples et doubles avec succès ablations (à 5 min post - ablation) ont des blessures qui sont à peu près la même taille que la coupe optique originale. (B - E) non retenus ablations: (B) trop de tissu est enlevé ou la blessure relie les deux yeux, (C) les larmes du site de la plaie et étend à la marge, (D) la blessure est trop profonde et pokes à travers de la dorsal (D) à la ventrale (D ») côté, et (E - F) ne sont pas tous les tissus de la cupule optique sont éliminés, visualisées à la fois morphologiquement (E) et par coloration anti-arrestine des neurones photorécepteurs (F). Jaune: pointes de flèches ablations aberrantes. cercles jaunes: site d'ablation. Les barres d'échelle = 100 um. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Cette technique d'ablation de l'oeil améliore les méthodes actuelles (comme perforatrice) en excluant les tissus du cerveau et en limitant l'excision principalement aux tissus oculaires. Avec la pratique, cette technique peut être réalisée par la plupart des individus, des techniciens expérimentés dans microchirurgies aux étudiants de premier cycle inexpérimentés mais consciencieux. Il est recommandé que cette technique soit pratiquée plusieurs fois avant d'utiliser ablations dans des expériences, y compris (si possible) la confirmation de la suppression complète de tous les tissus oculaires par immunohistochimie ou hybridation in situ pour le marqueur oculaire (s) 4, 5, 13. L'étape la plus critique dans ce protocole est l'écopage de tissus. Il est important de ne pas enlever trop ou trop peu de tissu. Cela peut être évité en ne ramassant trop profondément avec l'aiguille, pour ne pas pénétrer jusqu'à la face ventrale du ver. La pointe de l'neeDLE ne doit être inséré environ 0,4 mm de profondeur, et la partie en biseau de l'aiguille ne doit jamais aller tout le chemin à travers l'œil. il faut prendre soin particulier à ne pas endommager le tissu fragile entre les deux yeux (le bord médian de la région pigmentée noire de chaque oeil représente les frontières de chaque œil). Les dommages entre l'œil et la marge distale du ver doit également être évité. Les petits vers sont plus susceptibles de se déchirer ou être involontairement blessé, donc l'utilisation de vers de plus grands (en particulier pour la pratique) est recommandée. Les principales limites de cette technique est qu'elle est relativement intensive du temps (et ne convient pas pour les écrans à haut débit), et il faut un investissement initial dans la pratique pour assurer l'exactitude des résultats. Cependant, avec la pratique 10 yeux peuvent être en ~ 15 ablater min.
Une zone importante pour le dépannage est conforme planaires toujours au cours de la procédure. Les deux principales raisons pour lesquelles les vers ne sont pas suffisamment immobilisés pour effectuer des ablationssont (a) trop d'eau et (b) la perte de la température froide. (A) L'excès d'eau planarian que piscines sur la surface de la chirurgie pendant le transfert vers vont permettre de se déplacer vers et compliquent l'intervention chirurgicale. La surface de la chirurgie (essuyer tissu sans peluches et du papier filtre) doit rester humide seulement. Si, à tout moment au cours de la procédure, la lingette devient saturé avec de l'eau à vis sans fin, il doit soit être remplacé ou d'une pipette de transfert peut être utilisé pour éliminer doucement le fluide en excès du tissu essuyer (toujours tirer la lingette et non le papier filtre). lingettes de tissus peuvent également être utilisés pour éliminer l'excès d'eau mise en commun sur la surface de la chirurgie. Ce processus peut être répété plusieurs fois, en fonction du nombre de vers étant ablatée. (B) Si vous utilisez la plaque froide de boîte de Pétri mis en place, rappelez-vous de remplacer la plaque froide dès que la glace commence à fondre et le couvercle de boîte de Pétri 60 mm commence à flotter. Cela permettra d'assurer à la fois une surface de chirurgie stable et une surface appropriée à froid. En variante, si l'on utilise la plaque Peltiermettre en place, sachez que, après 45 min à 1 h d'utilisation, la chaleur dans les anneaux extérieurs surmontera la plaque froide dans le centre et tout refroidissement sera perdu. Si cela se produit, éteignez la plaque Peltier pendant 5-10 minutes pour lui permettre de venir à la température ambiante avant de reprendre ablations.
Un autre domaine de dépannage est pendant le transfert sans fin entre le plat et la surface de la chirurgie et à nouveau. Si les vers sont difficiles à ablatée retirer du papier filtre, une goutte d'eau de ver sur le ver jusqu'à ce que les piscines de liquide sur le papier filtre. Les vers peuvent ensuite être aspirés dans la pipette de transfert comme d'habitude. Si le problème persiste, essayez basculer le ver sur sa face ventrale d'abord (en utilisant le côté mat de la pince). Si un ver est bloqué à l'intérieur de la pipette de transfert, ce qui est généralement un signe que trop d'eau a été repris (les vers doivent être dans la pipette de transfert pas plus loin que d'environ un pouce). Pour supprimer un ver coincé dans une pipette de transfert, élaborer 1-2 ml de ver water dans la pipette, de sorte que la vis sans fin est recouverte d'eau. feuilleter fermement le côté de la pipette jusqu'à ce que la vis sans fin se détache de la paroi de la pipette et est flottant.
Si l'aiguille devient terne, remplacer par une nouvelle aiguille / seringue. Envisager de remplacer l'aiguille après l'avoir utilisé pour effectuer l'ablation ≥30 yeux. élimination excessive des tissus réséqués en essuyant avec un tissu lingette peut aussi terne de l'aiguille, ce qui rend plus difficile ablations. Il est correct si les tissus réséqués restent dans la partie en biseau de l'aiguille tout au long de la procédure (même sur plusieurs animaux). Toujours utiliser une nouvelle aiguille / seringue lors du changement entre les vers des conditions différentes (par exemple , les vers de type sauvage par rapport aux ARNi), ainsi que lorsque l'on commence de nouvelles sessions d'ablation ( par exemple à des jours différents).
Cette technique d'ablation chirurgicale des yeux est un moyen puissant pour enquêter sur les comportements induits par la lumière (et leur base génétique et neurologique) dans planaires, en particulierlorsqu'il est combiné avec des traitements pharmacologiques ou l'interférence ARN. L' ablation des yeux est aussi un excellent moyen permettant de mieux comprendre les mécanismes qui régulent la régénération des yeux planarian endogène (et l' entretien des cellules souches de l' œil et la différenciation) in vivo. Comme la plupart des vertébrés ont des capacités très limitées pour régénérer les tissus oculaires, comprendre comment planaires sont capables de régénérer leurs yeux seront importants pour identifier les mécanismes possibles pour la traduction dans les thérapies futures.
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Les auteurs tiennent à remercier Michelle Deochand pour perfectionner cette technique d'ablation de l'oeil, Taylor Birkholz pour l'aide à l'analyse fonctionnelle, Michael Levin pour l'anticorps anti-arrestine et Junji Morokuma des informations sur les plaques à effet Peltier. Ce travail a été soutenu par une subvention SFSA de l'Université Western Michigan à WSB.
matériels
| Name | Company | Catalog Number | Comments |
| Instant Ocean sea salts | Spectrum Brands | SS15-10 | "10 Gallon" box (net weight 3 lbs) |
| Kimwipes EX-L lint-free tissue wipe | Kimberly-Clark | 34155 | 4.5 x 8.5 in |
| Whatman #2 filter paper | Sigma | WHA1002125 | Circles, 125 mm diameter, white |
| Easy Touch Insulin syringe (with needle) | Pet Health Market | 17175-04 | U-100 1 cc syringe, 31 G 5/16 in needle |
| 100 mm Petri dish | VWR | 25384-342 | 100 mm x 15 mm |
| 60 mm Petri dish | VWR | 25384-092 | 60 mm x 15 mm |
| Dumont #5 forceps | Fine Science Tools | 11254-20 | Inox, straight tip , 11 cm |
| Transfer pipettes | Samco Scientific | 225 | Graduated, large bulb, 7.5 mL, non sterile |
| Parafilm M paraffin film | Brand | 701606 | 4 in x 125 ft roll |
| 12-well untreated tissue culture plate | VWR | 15705-059 | Untreated, flat bottom, sterile, Falcon brand |
| Plastic food containers (for colony) | Ziploc | Large rectangle | 2.25 qt (2.12 L), 10" x 6 -3/4 " x 3 -3/16" |
| Planaria (Girardia tigrina) | Carolina Biological | 132954 | Sold as "Brown" Planaria; most often they are G. tigrina (aka Dugesia tigrina), but sometimes are G. dorotocephala (aka Dugesia dorotocephala); either will work. |
| Planaria (Schmidtea mediterranea) | n/a | n/a | S. mediterranea are not commercially available. At this time animals are only obtainable from laboratories that use them and have extra animals. |
| Brown paper towels | Grainger | 2U229 | 9-3/16 x 9-3/8" 1-Ply Multifold Paper Towel, UNBLEACHED |
| Wash bottle (for worm water), optional | VWR | 16650-275 | Wash Bottles, Low-Density Polyethylene, Wide Mouth, 500 mL |
| Anti-synapsin antibody, optional | Developmental Studies Hybridoma Bank | 3C11 | Supernatant |
| Anti-arrestin antibody, optional | n/a | n/a | Not commercially available. Kind gift from Michael Levin, Tufts University |
| Nalgene Lowboy carboy with spigot (for storing worm water), optional | Nalge Nunc International Corporation | 2324-0015 | 15 L, polypropylene, low profile makes it easier to fill plastic colony containers |
| Custom Peltier plate, optional | Williams Machine, Foxboro, MA | n/a | Design specifics courtesy of Junji Morokuma, Tufts University: Peltier plate is constructed of a standard thermoelectric heat pump (for example, All Electronics Corp Catalog # PJT-1, 30 mm2). The square heat pump is covered with a thin mirrored surface, then placed inside a 30 mm2 square hole in a circular plexiglass form (~50 mm in diameter). This form is of similar thickness to the heat pump, and fits flush into a well tooled in the center of a round heat sink (~115 mm in diameter). The form/heat pump is "anchored" to the sink with silicone base heat sink compound. The leads are threaded through holes drilled through both the form and the the heat sink. The bottom half of the heat sink is tooled into a "foot" that fits into the opening of your microscope's base plate. |
| DC power source (for Peltier plate), optional | B & K Precision | 1665 | Regulated Low Voltage DC Power Supply, 1-18 V (DC), 1-10 amps. |
| Other common supplies | |||
| Gloves | |||
| Razor blade | |||
| Scissors | |||
| Dissecting scope with gooseneck lighting | |||
| Chopstick rests, optional |
Références
- Gentile, L., Cebria, F., Bartscherer, K. The planarian flatworm: an in vivo model for stem cell biology and nervous system regeneration. Dis Model Mech. 4 (1), 12-19 (2011).
- Elliott, S. A., Sanchez Alvarado, A. The history and enduring contributions of planarians to the study of animal regeneration. Wiley Interdiscip Rev Dev Biol. 2 (3), 301-326 (2013).
- Emili Saló, R. B. Chapter 3. Animal Models in Eye Research. Tsonis, P. A. , Academic Press. 15-26 (2008).
- Lapan, S. W., Reddien, P. W. dlx and sp6-9 Control optic cup regeneration in a prototypic eye. PLoS Genet. 7 (8), e1002226(2011).
- Lapan, S. W., Reddien, P. W. Transcriptome analysis of the planarian eye identifies ovo as a specific regulator of eye regeneration. Cell Rep. 2 (2), 294-307 (2012).
- Inoue, T., et al. Morphological and functional recovery of the planarian photosensing system during head regeneration. Zoolog Sci. 21 (3), 275-283 (2004).
- Pineda, D., et al. The genetic network of prototypic planarian eye regeneration is Pax6 independent. Development. 129 (6), 1423-1434 (2002).
- Paskin, T. R., Jellies, J., Bacher, J., Beane, W. S. Planarian Phototactic Assay Reveals Differential Behavioral Responses Based on Wavelength. PLoS One. 9 (12), e114708(2014).
- Raffa, R. B., Martley, A. F. Amphetamine-induced increase in planarian locomotor activity and block by UV light. Brain Res. 1031 (1), 138-140 (2005).
- Sandmann, T., Vogg, M. C., Owlarn, S., Boutros, M., Bartscherer, K. The head-regeneration transcriptome of the planarian Schmidtea mediterranea. Genome Biol. 12 (8), R76(2011).
- Vasquez-Doorman, C., Petersen, C. P. The NuRD complex component p66 suppresses photoreceptor neuron regeneration in planarians. Regeneration (Oxf). 3 (3), 168-178 (2016).
- Deochand, M. E., Birkholz, T. R., Beane, W. S. Temporal regulation of planarian eye regeneration. Regeneration. 3 (4), 209-221 (2016).
- Sakai, F., Agata, K., Orii, H., Watanabe, K. Organization and regeneration ability of spontaneous supernumerary eyes in planarians -eye regeneration field and pathway selection by optic nerves. Zoolog Sci. 17 (3), 375-381 (2000).
- Asano, Y., Nakamura, S., Ishida, S., Azuma, K., Shinozawa, T. Rhodopsin-like proteins in planarian eye and auricle: detection and functional analysis. J Exp Biol. 201 (Pt 9), 1263-1271 (1998).
- Cross, S. D., et al. Control of Maintenance and Regeneration of Planarian Eyes by ovo. Invest Ophthalmol Vis Sci. 56 (12), 7604-7610 (2015).
- Robb, S. M., Gotting, K., Ross, E., Sanchez Alvarado, A. SmedGD 2.0: The Schmidtea mediterranea genome database. Genesis. 53 (8), 535-546 (2015).
- Robb, S. M., Ross, E., Sanchez Alvarado,, A, SmedGD: the Schmidtea mediterranea genome database. Nucleic Acids Res. 36, D599-D606 (2008).
- Beane, W. S., Tseng, A. S., Morokuma, J., Lemire, J. M., Levin, M. Inhibition of planar cell polarity extends neural growth during regeneration, homeostasis, and development. Stem Cells Dev. 21 (12), 2085-2094 (2012).
- Forsthoefel, D. J., Waters, F. A., Newmark, P. A. Generation of cell type-specific monoclonal antibodies for the planarian and optimization of sample processing for immunolabeling. BMC Dev Biol. 14, 45(2014).
- Ross, K. G., et al. Novel monoclonal antibodies to study tissue regeneration in planarians. BMC Dev Biol. 15, 2(2015).
- Cardona, A., Fernandez, J., Solana, J., Romero, R. An in situ hybridization protocol for planarian embryos: monitoring myosin heavy chain gene expression. Dev Genes Evol. 215 (9), 482-488 (2005).
- King, R. S., Newmark, P. A. In situ hybridization protocol for enhanced detection of gene expression in the planarian Schmidtea mediterranea. BMC Dev Biol. 13, 8(2013).
- Pearson, B. J., et al. Formaldehyde-based whole-mount in situ hybridization method for planarians. Dev Dyn. 238 (2), 443-450 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon