Method Article
Chirurgische Ablation Assay zur Untersuchung von Augen Regeneration in Planarien
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll zeigt, wie konsequent Planarien Augen (Augenbecher) ohne störende umgebende Gewebe auszuschneiden. Verwendung eine Insulin-Nadel und Spritze, entweder einen oder beiden Augen ablatiert werden können Untersuchungen über die Mechanismen der Regeneration regulierenden Auge, um die Entwicklung der visuellen Regeneration und die neuronalen Grundlage des lichtinduzierten Verhaltens zu erleichtern.
Zusammenfassung
In der Studie von adulten Stammzellen und Regenerationsmechanismen sind Planarienplattwürmer eine Heftklammer in vivo Modellsystem. Dies ist zum großen Teil auf ihre reichlich vorhandenen pluripotenten Stammzellpopulation und die Fähigkeit, alle Zell- und Gewebetypen nach Verletzungen zu regenerieren, die für die meisten Tiere katastrophal sein würde. Vor kurzem haben Planarien an Popularität gewinnen als Modell für die Augenregeneration. Ihre Fähigkeit, das gesamte Auge (bestehend aus zwei Gewebetypen: Pigmentzellen und Photorezeptoren) zu regenerieren ermöglicht die Präparation der Regulierungsmechanismen Sehsystem Regeneration. Eye Ablation hat mehrere Vorteile gegenüber anderen Techniken (wie Enthauptung oder Loch) für die Prüfung Augenspezifische Wege und Mechanismen, die wichtigsten davon ist, dass die Regeneration weitgehend Augengewebe allein beschränkt ist. Der Zweck dieses Video-Artikel ist zu zeigen, wie zuverlässig die Planarien Exkavation zu entfernen, ohne das Gehirn oder die umgebenden Gewebe zu stören.Der Umgang mit Würmern und Wartung einer etablierten Kolonie wird ebenfalls beschrieben. Diese Technik verwendet eine 31-G, 5/16-Zoll-Nadel Insulin chirurgisch die Exkavation von Planarien auf einer kalten Platte immobilisierte aushöhlen. Dieses Verfahren umfasst sowohl Einzel- und Doppel Auge Ablation, mit den Augen in 1-2 Wochen zu regenerieren, so dass für eine breite Palette von Anwendungen. Insbesondere kann diese Ablationstechnik leicht mit pharmakologischen und genetischen (RNA-Interferenz) Bildschirmen für ein besseres Verständnis von Regenerationsmechanismen und deren Entwicklung, Augen Stammzellen und deren Wartung und phototaxic Verhaltensreaktionen und deren neurologischen Basis kombiniert werden.
Einleitung
Planarien sind ein leistungsfähiger Modellorganismus für die adulte Stammzellvermittelte Regeneration zu studieren. Diese nichtparasitären Süßwasser Plattwürmer besitzen die Fähigkeit , jegliche und alle fehlenden Gewebe zu regenerieren, einschließlich ihrer zentralen Nervensystems und des Gehirns 1. Studium so weit zurück wie die 1700er Jahre 2, technologischen Fortschritte in den Planarien Feld in den letzten 10-15 Jahren (wie ein sequenzierten Genom, in - situ - Hybridisierung, Immunhistochemie, RNA - Interferenz (RNAi) und Transkriptomik) hat diesen historischen Modellorganismus aktualisiert . Insbesondere haben Planarien vor kurzer Popularität durchaus als ein Modell für die Augenforschung 3 gewonnen.
Planarien haben prototypischen Augen mit nur zwei Gewebetypen, die Photorezeptorneuronen und Pigmentzellen; dies hat die Charakterisierung seiner Augenstammzellpopulation und demonstriert ermöglicht, dass viele der gleichen Gene Wirbeltierauge de Regulierungwicklung ist in Planarien konservierte 4, 5. Die Augenbecher befinden sich dorsal und der weißen, nicht pigmentierten Dendriten der Photorezeptorneuronen und den Halbmond schwarzen Pigmentzellen enthalten, und die Augen, das Gehirn über eine Chiasma innervate. Zusätzlich ist ein Modell zur Erläuterung regenerative Prozesse 6 ist, wobei die Planarien Auge zu studieren , die Entwicklung der visuellen Mechanismen gut geeignet ist , 7, Verhaltensreaktionen auf Licht (Planarien anzuzeigen negativen Phototaxis) 8 und die neurologische Grundlage des Verhaltens 9.
Augenregeneration in Planarien wurde in zwei Kontexten weitgehend untersucht: als Teil des Regenerationskopfes Dekapitation folgenden 4, 10, und im Anschluss an der Exzision von nur die Augengeweben 11, 12 . Die meisten Planarien Studien zur Augen Regeneration haben die Enthauptung Methode verwendet, da es einfach und unkompliziert ist. Die gebräuchlichste Methode Planarien Auge Exzision hat bisher mit einem feinen Glaskapillare 13 über Locher gewesen, 14, obwohl einige Studien auch Amputationen durchgeführt sind gerade hinter den Augen (teilweise Enthauptung) 15. Jedoch beinhalten alle diese Methoden, um den Verlust von vielen anderen Geweben als nur das Auge (wie Gehirn, Darm und Nephridien), möglicherweise die Ergebnisse kompliziert Interpretation. Das Protokoll Auge Ablation präsentierte hier beschränkt Exzision auf die Augengewebe (insbesondere ohne Gehirn), in Daten entstehen, die spezifischen für das Auge sind. Außerdem, im Gegensatz zu geköpft Würmer , die 7-14 Tage , um Fütterung zu beginnen, Augen abgetragenen Würmer füttern innerhalb von 24 h von Ablation 12, so dass RNAi - Experimente (wo RNAi über die Nahrung zugeführt wird) werden performed gleichzeitig.
Obwohl technisch schwieriges Auge Ablation erfolgreich als Enthauptung durchzuführen, Exzision aktuelle Studien mit Auge haben keine detaillierten Anweisungen auf ihren Verfahren enthalten. Das Ziel dieses Video-Artikel ist Forscher zu ermöglichen, konsequent die Planarien Exkavation zu entfernen, ohne die zugrunde liegenden Hirngewebe zu stören und so einige anderen Gewebe wie möglich zu entfernen. Dieses Verfahren kann sowohl für die Einzel- und Doppel Auge Ablation verwendet werden und ist für eine Vielzahl von Untersuchungen. Wie die meisten Regenerations Assays wird Augen Ablation gut geeignet für die Kombination mit sowohl pharmakologischen und genetischen (RNAi) Bildschirme sowie Verhaltensstudien. Hier beschreiben wir Methoden für die Behandlung von Würmern, eine Planarien Kolonie Aufrechterhaltung und das Auge Ablationstechnik selbst.
Protokoll
1. Tier Kultur und Handhabung
Hinweis: Dieses Protokoll verwendet Schmidtea mediterranea, eine diploide Planarien Spezies mit einem sequenzierten Genom 16, 17 , die üblicherweise für die Regeneration Forschung verwendet wird. Jedoch ist der Test ebenso erfolgreich mit anderen Arten, wie Dugesia Tigrina und Girardia dorotocephala (die im Handel erhältlich).
- Pflegen Würmer in „worm Wasser“ aus 0,5 g / l Meersalz wird in Reinstwasser (oder gefiltertes entionisiertes) Wasser. Verwenden sterile Polypropylen oder Glasbehälter des Wurm , Wasser zu halten. Siehe Zusatzdatei 1 für Details über Wurm Wasseraufbereitung.
HINWEIS: Niemals Seife reinigen Behälter (oder andere Verbrauchsmaterialien), wie Seife ist giftig für Würmer; statt mit 70% Ethanol abwischen und an der Luft trocknen lassen.- Handschuhe tragen, während sie mit planaria arbeiten, um sie vor Verschmutzung zu schützen.
HINWEIS: Würmer sind sehr empfindlich gegenüber Umweltgiften und Chemikalien, einschließlich Seife, Bleichmittel, Shampoo, Conditioner, und Handcreme.
- Handschuhe tragen, während sie mit planaria arbeiten, um sie vor Verschmutzung zu schützen.
- Haus Kolonien in Polypropylen Nahrungsmittelbehältern, wobei der Deckel teilweise geöffnet gelassen zum Luftaustausch bei ~ 20 ° C (Raumtemperatur). Store experimentelle Würmer in entweder Petrischalen (20 Würmer pro 100 mm-Schale) oder nicht-behandelten Gewebe-Kulturplatten (1 worm pro Well für 12-Well-Platten). Um Stress abzubauen, halten beide Kolonien und Experimente im Dunkeln.
HINWEIS: Die Kolonien sollten nicht mehr als 500-1000 Würmer pro Liter Wurm Wasser. Für Experimente lassen Deckel vollständig an Ort und Stelle, da Luftstrom in diese Gerichte ausgelegt ist. - Feed-nicht-experimentelle Würmer einmal pro Woche mit püriertem Bio-Rindfleisch oder Hühnerleber mit Püree aus einer Transferpipette fallen, Platzierung Tropfen Nahrung in den Behälter. Lassen Sie Würmer 2 h Lebensmittel in die konsumierendunkel vor dem Behälter (siehe Schritt 1.4) Reinigung aus. Vor der Verwendung speichert Püree bei -20 ° C für kurzfristig (Wochen) oder -80 ° C für langfristige (Monate); nicht Püree zur erneuten Verwendung wieder einfrieren (als Bakterien blühen kann und die Würmer schaden).
HINWEIS: Leber keine Hormone oder Antibiotika und vorzugsweise nicht vorher eingefroren enthalten sollte. Centrifuge Püree vor der Anwendung (oder vor der Fütterung) zum Gefrieren Luft zu entfernen und verhindern, dass Lebensmittel aus schweben. Lebensmittel sollten auf den Boden des Behälters sinken. 1 ml Püree ist für 500-1.000 Würmer ausreichend. - Austauschwasser einmal pro Woche mit frischem Wasser Wurm für beide Kolonien und Experimente. Colony Behälter auch mit einem ungebleichten Papiertuch abgewischt werden (entfernen Schleim Reste, die Trap-Abfälle) einmal pro Woche für Würmer oder zweimal in der Woche für die Zufuhr Würmer (2 h nach der Fütterung und wieder 2 Tage später) am Verhungern. Um den Biofilm zu behalten, nicht wischen mehr als 80% des Behälters.
- Bewegen Würmer zwischen Containern (oder Operation setup) unter Verwendung einer Transferpipette. Um freie Würmer Behälteroberflächen anhaftet, spritzt Wasser über / hinter der Schnecke von der Oberfläche zu lösen. Dann saugen die Schnecke in die Pipette, bei dem Versuch, die Schnecke innerhalb des unteren inch (dünner) Teil der Pipette zu halten.
- Backload Pipetten mit einer kleinen Menge von Wurm Wasser vor ihnen zu saugen.
- Versuchen Sie, das Wasser um den Wurm zu bewegen, anstatt der Wurm selbst, um zu verhindern, weiche Körper Würmer zu reißen, indem sie mit der Pipette zu berühren.
- Halten Sie bedeckt experimentellen Gerichte, es sei denn Würmer übertragen oder Wasser zu ersetzen.
2. Vorbereitung
- Stoppen Sie Würmer mindestens eine Woche vor den Experimenten zugeführt wird .
- Wählen Sie Würmer, die für ≥1 Woche wurden nicht gefüttert worden und sind mindestens 5-7 mm in der Länge. Übertragen Sie die Würmer in eine Petrischale 2/3 voller Wurm Wasser und bestätigen Schneckenlänge von einem Lineal unterhalb der Schale gleiten. messen Sie worms während voll ausgefahren und bewegend.
HINWEIS: Während kleiner (5-7 mm) Würmer besser funktionieren , wenn nachfolgende Immunofluoreszenz durchführt und in situ - Hybridisierungsanalysen, größere Würmer (8-10 mm) sind leichter zu handhaben - vor allem , wenn das Lernen abzutragen. - Stellen Sie sicher, dass Würmer sind ganze, unversehrt, und in letzter Zeit nicht regenerieren.
HINWEIS: Regenerieren Würmer haben viel leichter (oder keine) Pigment im Kopf und / oder Schwanzbereich im Vergleich zu normalen Würmern. - Wenn RNAi oder pharmakologische Behandlungen von Würmern durchführen, tun Sie dies an dieser Stelle. Wenn Würmer als Teil der Behandlung (wie für RNAi) gefüttert wurden, wartet mindestens 7 Tage nach der letzten Fütterung vor dem Fortfahren zu Schritt 2.2.
- Wählen Sie Würmer, die für ≥1 Woche wurden nicht gefüttert worden und sind mindestens 5-7 mm in der Länge. Übertragen Sie die Würmer in eine Petrischale 2/3 voller Wurm Wasser und bestätigen Schneckenlänge von einem Lineal unterhalb der Schale gleiten. messen Sie worms während voll ausgefahren und bewegend.
- Reinigen der Arbeitsfläche und Präpariermikroskop Basis mit 70% igem Ethanol und lassen Sie ihn vollständig trocknen. Die Schale ausgewählter Würmer auf der linken Seite des Bereichs. Rechts von dem Umfang, Ort ein Paar von # 5 Zangen, a 31 G 5/16 Zoll Insulin Nadel mit einem 1ml-Spritze und eine saubere Transferpipette.
- Stellen Sie sicher, dass die Instrumente durch Berühren der Bank gehalten werden (die Verunreinigungen einführen könnte). Verwenden ein starres Element (wie ein Stäbchen Rest), um die Zange zu halten, Nadel, Pipette und sauber. Alternativ Ort Instrumente auf einem frischen braunen (roh) Papiertuch.
Hinweis: Diese und nachfolgende Befehle geschrieben werden, wie sie auf rechtshändige Personen betreffen. Linkshändig Personen sollten die rechts / links Richtung umkehren.
- Stellen Sie sicher, dass die Instrumente durch Berühren der Bank gehalten werden (die Verunreinigungen einführen könnte). Verwenden ein starres Element (wie ein Stäbchen Rest), um die Zange zu halten, Nadel, Pipette und sauber. Alternativ Ort Instrumente auf einem frischen braunen (roh) Papiertuch.
- Neben dem Arbeitsbereich, legen Sie eine Schachtel mit einem fusselfreien Tuch wischt, eine Quelle von frischem Wurm Wasser, und einige zusätzliche Transferpipetten (von der Tischplatte geschützt). Platz Wurm Wasser in einer Plastikwaschflasche für eine einfache Dosierung. stellen auch eine markierte 12-Well-Platte (oder 100 mm Petrischale) auf der rechten Seite des Umfangs für ablatiert Tiere zu sammeln.
- Bei Verwendung einer maßgefertigte Platte Peltier Würmer zu immobilisieren, positioniert die Peltier - Platte in die Vertiefung in ter Basis des Binokular und stellt den Ausgang auf der Gleichstromquelle, bis die Arbeitsfläche der Peltier-Platte ausreichend kühl ist (typischerweise ~ 5 V) .Alternatively, bildet eine Kühlplatte mit einer 100 mm Petrischale Füllung ½ voll mit Wasser und frieren für mindestens 24 Stunden. Verwerfen Sie den Deckel und legen den Boden der 100-mm-Schale auf der Basis des Binokular, anschießend den Deckel einer 60 mm Petrischale mit der Oberseite nach unten direkt auf der Oberfläche des Eises (1A).
- Nachdem das Wasser in der 100-mm-Schale gefroren ist, wird ein „Vulkan“ von Eis in der Mitte der Platte erscheinen. Wenn dies der Fall ist, verwenden Sie eine Rasierklinge das Eis flach zu kratzen, Unregelmäßigkeiten von der Oberfläche zu entfernen.
HINWEIS: Während der Operationen wird das Eis schmelzen, so dass Ablationen viel schwieriger. Bereiten mehr Eier Geschirr im Voraus, und gefrorene ersetzen für diejenigen während des Tests, sobald der Deckel der 60-mm-Schale beginnt floating schmelzen.
- Nachdem das Wasser in der 100-mm-Schale gefroren ist, wird ein „Vulkan“ von Eis in der Mitte der Platte erscheinen. Wenn dies der Fall ist, verwenden Sie eine Rasierklinge das Eis flach zu kratzen, Unregelmäßigkeiten von der Oberfläche zu entfernen.
- Bereite das ... VorChirurgie Oberfläche. Geschnitten , um ein 5 cm x 10 cm großes Stück aus Kunststoffparaffinfilm (4 cm 2 bei Verwendung der Petrischal kalte Platte) und es auf dem Zentrum der Fixiereinrichtung. Falten Sie ein fusselfreien Tuch abwischen in ein Quadrat etwa 2 cm 2 und legen Sie es auf der Folie. Schneiden Sie ein Stück weißes Filterpapier 1,5-2 cm 2 und legen Sie es auf des Tuchs. Siehe Abbildung 1B-1E.
- Halten Sie die gefaltete Wischtuch an der Stelle mit einem behandschuhten Finger, und verwendet Wurm Wasser leicht zu dämpfen das Wischtuch, um sicherzustellen, dass es gefaltet bleibt. Verwenden, um die Seite einer Transferpipette zu rollen die flache abzuwischen.
HINWEIS: Kälte hilft Würmer zu hindern. Die Arbeit „trocken“ hilft auch bei der Immobilisierung. Das Gewebe wirkt abzuwischen Wasser durch das Filterpapier Docht, die während der Operation worm feucht zu halten, ohne Würmer ermöglichen vollständig zu austrocknen (das letal ist).
- Halten Sie die gefaltete Wischtuch an der Stelle mit einem behandschuhten Finger, und verwendet Wurm Wasser leicht zu dämpfen das Wischtuch, um sicherzustellen, dass es gefaltet bleibt. Verwenden, um die Seite einer Transferpipette zu rollen die flache abzuwischen.
3. Chirurgische Ablation
- Verwenden einer Transferpipette Ort aufe worm dorsal auf das Filterpapier. Schalten Sie die Lichtquelle auf und leiten die Schwanenhälse, so dass das Licht auf der Wurm fokussiert ist. Stellen Sie den Binokular Fokus und Vergrößerung, so dass die Augen deutlich sichtbar sind (der gesamte Wurm muss nicht in Sicht sein); 5fache Vergrößerung ist ein guter Ausgangspunkt. Orientieren die Schnecke durch Drehen des Paraffinfilmes so dass der Kopf in Richtung der Forscher gerichtet ist (in Richtung der Vorderseite des Mikroskops), gewinkelt 30-40 Grad nach rechts.
- Vermeiden Sie den Einsatz von hellem Licht überschüssige Wurm Bewegung zu verhindern. Planarien Anzeige negativ Photo- und versuchen, helle Licht zu entziehen.
- Wenn der Wurm ventrale Seite positioniert ist, nach oben zeigt (mit Schlundöffnung sichtbar), verwendet, um die matte Seite der Pinzette vorsichtig auf die Schnecken Dorsalseite repositionieren (mit Augen sichtbar). Vermeiden Sie das Tier mit der scharfen Spitze der Zange Annäherung an die Möglichkeit des Reißens durch Weichgewebe zu minimieren, wenn das Tier Neupositionierung.
- Das Mikroskop Fokus so einstellen, dass die Augen klar im Fokus. Achten Sie auch darauf, dass sowohl die Augen und die umgebenden Gewebe Kopf in Sicht sind.
- Halt eine frische Nadel / Spritze in der rechten Hand , als ob es ein Stift (zwischen Daumen und Zeigefinger) war. Verspannen den linken Daumens gegen die Peltier - Platte (oder eine Petrischale kalte Platte) und mit dem linken Daumen als einen Drehpunkt , auf das der Bodenabschnitt der Spritze aufliegt (Abbildung 2A). Schauen Sie durch das Mikroskop, und stellen Sie sicher , dass die Abschrägung der Nadel sichtbar ist.
HINWEIS: Nadeln sind sehr scharf. Seien Sie vorsichtig beim Umgang mit ihnen. Das Tragen von Latex oder Nitril Handschuhe können einen gewissen Schutz bieten.- Mit dem linken Daumen, um die Nadel / Spritze stetig während des gesamten Verfahrens zu halten und zu vermeiden Hände schütteln.
- Bildet einen Winkel von etwa 40 ° mit dem linken Daumen und linken Zeigefingern (mit dem Zeigefinger auf der Oberfläche der Operation), um die Operation Oberfläche stabil zu halten.
- Mitdie Abschrägung der Nadel nach oben zeigt (wie ein Löffel) positioniert, um die Nadel im rechten Winkel zu dem Auge (2B). Verwenden, um die Spitze der Nadel vorsichtig auf die dünne Gewebeschicht durchdringt von rechts über den Augenbecher (weiß, unpigmentierten Region) des Auges, Ausschöpfen nach links. Sehr sanft jede pigmentierte Gewebe innerhalb des Augenbechers, wobei darauf geachtet befanden entfernen nicht den Boden zu durchstechen oder um die Grenzen der Exkavation zu zerstören.
- Wenn der Wurm auf dem Filterpapier für> 1-2 min an jedem Punkt während des Verfahrens gewesen ist, einen Tropfen Wurm Wasser, um den Wurm zu rehydrieren.
HINWEIS: Dehydration wird der Wurm Anfälligkeit Rippen Verletzungen erhöhen.
- Wenn der Wurm auf dem Filterpapier für> 1-2 min an jedem Punkt während des Verfahrens gewesen ist, einen Tropfen Wurm Wasser, um den Wurm zu rehydrieren.
- Wiederholen Sie Schritt 3.3, bis alle schwarzen pigmentierten Geweben (Pigmentzellen) sowie alle weißen Geweben des Augenbechers (Dendriten der Sehzellen), werden entfernt. Entfernen Sie nach dem Ende der Nadel stecken operativ entfernte Gewebe durch sorgfältig mit einem Tuch abwischen wischen. Wenn Doppel Auge Ablation ist, abzutragen das zweite Auge an dieser Stelle gewünscht.
HINWEIS: Um Verletzungen zu vermeiden, Nadeln können durch Greifen die Nadel mit einem sauberen Tuch wischt mit dem Daumen und Zeigefinger, dann mit der anderen Hand gehalten gereinigt werden, um die Nadel durch die wegzuwischen von Daumen und Zeigefinger zu ziehen. Alternativ kann die Nadel auf die Oberfläche eines feuchten Gewebes abzuwischen und untersucht Sauberkeits abgewischt werden. - Wenn Sie fertig ist , verwenden Sie eine Transferpipette den Wurm auf eine markierte Schale mit frischem Wurm Wasser zu bewegen. Wenn Gruppendaten zu analysieren, in einem einzigen 100 mm Petrischale bis 20 Würmer auf. Wenn die Regeneration in den gleichen Individuen über die Zeit - Tracking, lege 1 Wurm in jede Vertiefung einer 12-Well - Platte. Sobald alle Würmer übertragen werden, Würmer spülen , indem sie alle Würmer Wasser aus den Schalen / Brunnen entfernt und mit frischem Wurm Wasser zu ersetzen.
- Zum Entfernen von Würmern aus dem Filter, Backload die Pipette mit einer geringen Menge an Wasser worm und läßt das Wasser auf die Schnecke. Dies sollte heben ter Wurm aus dem Filterpapier, um sofort in die Pipette für die Übertragung angesaugt werden.
- Inkubieren Experimente bei ~ 20 ° C (Raumtemperatur) vor Licht geschützt und dem Regenerationsprozess folgen.
HINWEIS: Würmer können in einem temperaturgesteuerten Inkubator gelagert werden, um eine konstante Temperatur zu halten, aber das ist nicht unbedingt notwendig. Die meisten Raumtemperaturen variieren nur von + 5 ° C, was nicht den Wurm der Fähigkeit beeinflussen zu regenerieren. - Wenn es gewünscht wird , zu beheben Würmer für die Immunhistochemie (siehe Abbildungen 3-4) und / oder in situ - Hybridisierungsanalysen der Genexpression. Verschiedene Befestigungsverfahren gibt es für Planarien Immunhistochemie 18, 19, 20 und in situ - Hybridisierung 21, 22, 23 - Protokolle.
- Wenn Experimente abgeschlossen werden, sacrifice leben Würmer durch worm Wasser aus der Schale entfernt und mit 70% Ethanol zu ersetzen. Inkubieren Würmer für 3-5 min, für Würmer Kontrolle zu lysieren und drehen gräulich.
- Legen Sie nicht behandelten Würmer in den normalen Abfallstrom einmal geopfert. Vermeiden Sie Live-Würmer in die Umwelt einzuführen, insbesondere nicht-einheimische Arten.
Ergebnisse
Für die ersten 1-2 Stunden nach der Operation erhalten die Tiere Bewegung aufweisen können im Vergleich zu intakten Würmer verringert (aber sie werden immer noch bewegen). Falls gewünscht, werden essen Würmer innerhalb von 24 h nach der Operation (beispielsweise für RNAi Fütterung). Wenn folgendes Auge Regeneration in den gleichen Individuen im Laufe der Zeit, stellen Sie sicher, dass ein Foto von jedem Wurm sowohl vor der Operation (intakt) und bei 1 h nach der Ablation (hpa) zu nehmen. Durch die 4 Tage nach der Ablation (dpa) Regenerieren Pigmentzellen sollte sichtbar sein, und von 14 dpa das gesamte Auge vollständig regeneriert worden (3A-B). Dazu gehört auch die Photorezeptorneuronen und ihre Innervation an das Gehirn (3C), sowie die funktionelle Erholung des visuellen Systems (4A-C). Erfolgreiche Ablationen werden die darunter liegenden Gewebe des Gehirns (4D-E) nicht stören, noch andere Verletzungen einführen , um das Tier (5A). erfolglos Ablationenumfassen Tiere mit: eine übermäßig große Exzision, die die beiden Augen (5B) verbunden ist , reißen an den Seitenrand des Tieres (5C) und / oder Wundstellen , die durch die ventralen Poke Epidermis (5D). Weiterhin zählen zu erfolglos Ablationen unvollständiger Entfernung des gesamten Augenbechers, beide der weißen unpigmentierten Gewebe bestand und die schwarzen Pigmentzellen (5E-F).

Abbildung 1: OP - Vorbereitung. (A) Schematische Darstellung der Kaltplattenkonstruktion, mit der Boden einer 100 mm Petrischale (mit Eis gefüllt ist ) und den Deckel einer 60 mm Petrischale (platziert Oberseite nach unten auf der Eisoberfläche). (B) Schematische Darstellung der Operation Oberfläche, hergestellt aus einem Stapel ( von oben nach unten) weißen Filterpapier, ein feuchtes Abwischen gefaltete Gewebe, und ein Stück Paraffinfilm.(C) Die Operation eingerichtet (für den rechtshändigen). A: Binokular, B: Gooseneck Beleuchtung, C: Chirurgie Oberfläche, D: Peltier-Platte, E: Schal von 5-7 mm Würmern bereit für die Ablation, F: Waschflasche von worm Wasser, G: chopstick Rest saubere Übertragung Pipette, H: chopstick Rest Halt Nadel / Spritze, I: chopstick Rest Zange, J holding: Behälter mit zusätzlichen Transferpipetten. (D) Individuelle Peltier Plattenkonfiguration. (E) Petrischale kalte Platte - Konfiguration. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 2: Position der Hände und die Nadel / Spritze während der Ablation. (A) Platzierung der Hände (für Rechtshänder). Beachten Sie, dass der linke Daumen verwendet wird, um die Spritze zu unterstützen (gehaltenenin der rechten Hand) Bewegung zu minimieren. (B) Anordnen der Nadel in Bezug auf das Auge des Wurms. Man beachte, dass die abgeschrägte Oberfläche der Nadel nach oben zeigt. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
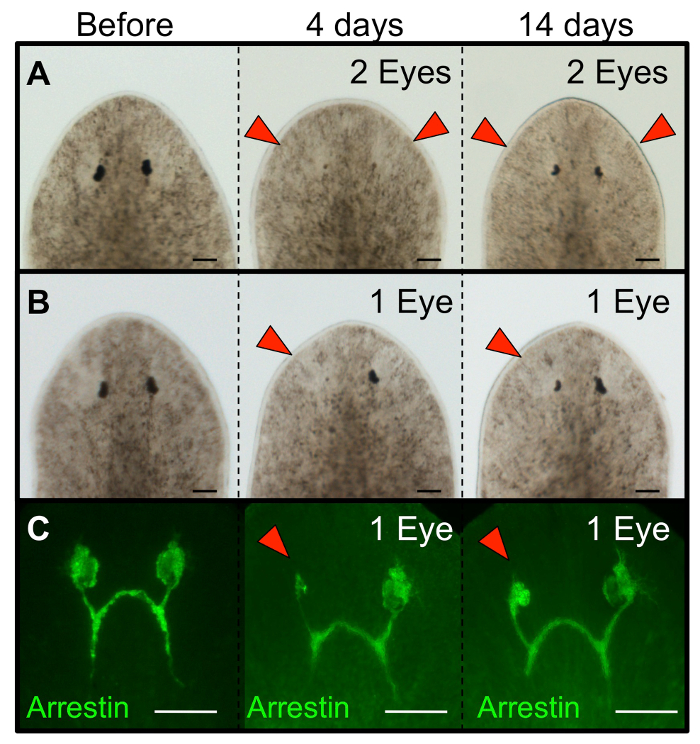
Abbildung 3: Die abgetragenen Planarien Augen regenerieren. Morphologie von Schmidtea mediterranea Planarien nachwachsende Augen folgenden (A) Doppelaugen Ablation und (B) monokularen Ablation. (C) Immunhistochemie zeigt Regeneration der Photorezeptorneuronen (anti-Arrestin) folgende Einzel Auge Ablation. Intakte Würmer werden vor der Operation gezeigt, und regeneriert werden an den Tagen 4 und 14 nach der Ablation gezeigt. Für einzelnes Auge Ablationen war das linke Auge einerblated und das rechte Auge dient als interne (heil) Kontrolle. Rote Pfeile: abgetragene Augen. Maßstabsbalken = 100 & mgr; m. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
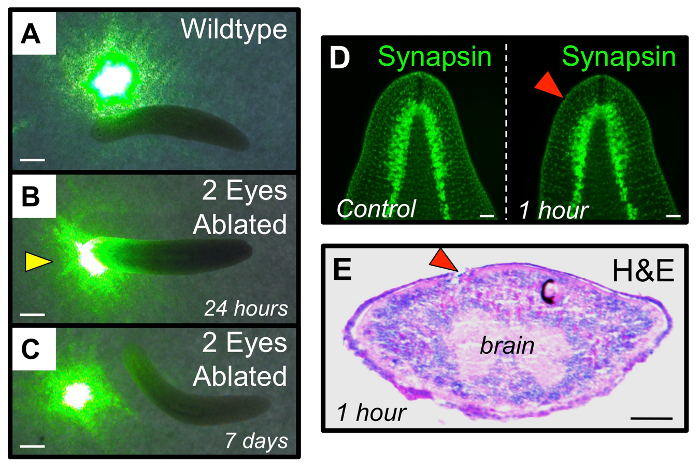
Abbildung 4: Funktionelle Erholung des visuellen Systems nach der Ablation. (A - C) Funktioneller Assay Planarienphotophobie zu testen. (A) Intact Würmer vermeiden durch Bereiche von Licht reisen, wie beispielsweise eine Stelle von einem grünen Laserpointer. (B) bei 24 h nach der Ablation „blind“ double Auge ablatiert Würmer reisen durch Lichtflecken. (C) bei 7 Tage nach der Ablation abgetragenen Doppelaugen Würmer haben ihre Sehsystem regenerierten ausreichend Licht Vermeidung zu erholen. Gelbe Pfeilspitze: abweichendes Verhaltenal Antwort. (D - E) Augen Ablation zu den Geweben des Augenbechers beschränkt und stört nicht die zugrundeliegenden Hirngewebe. (D) Immunhistochemie zeigt Hirn Architektur (anti-Synapsin) aus der Zeit vor der Ablation zu 1 h nach der Ablation unverändert ist. (E) Hämatoxylin und Eosin (H & E) Färbung bei 1 h nach der Ablation in einem Querschnitt zeigt , Beschädigungen weitgehend auf der Seite des abgetragenen Exkavation beschränkt. Die rechte Auge (mit schwarzen Pigmentzellen) dient als interne Kontrolle. Rote Pfeile: abgetragene Augen. Maßstabsbalken = 1 mm (AC) 1 mm, 100 & mgr; m (DE). Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
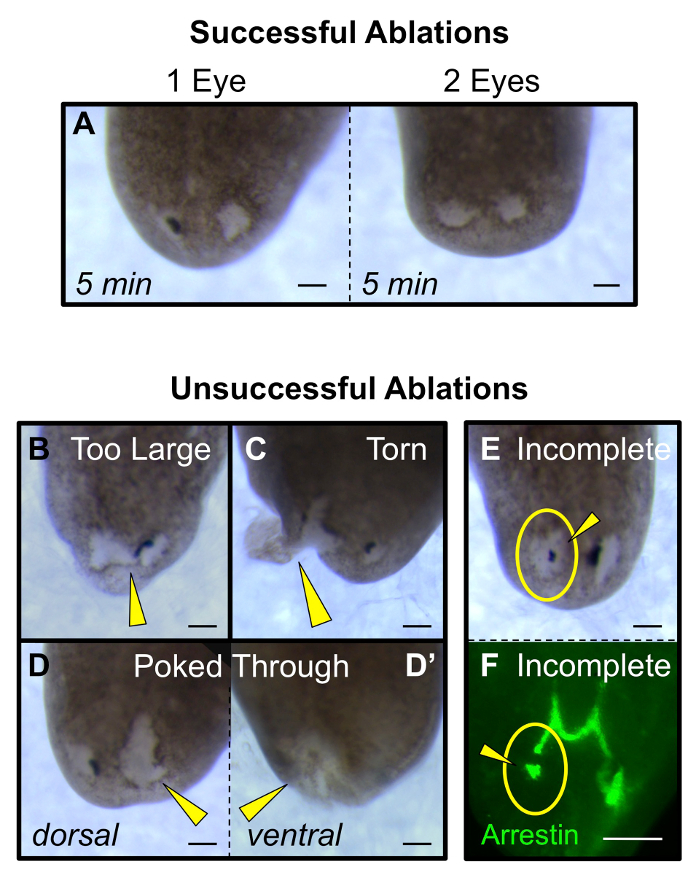
Abbildung 5: Kennzeichnend für erfolgreiche und erfolglose Ablationen. (A) Erfolgreiche Einzel- und Doppel Auge Ablationen (bei 5 min nach der Ablation) haben Wunden, die in etwa die gleiche Größe wie das Original Exkavation sind. (B - E) Erfolglos Ablationen: (B) zu viel Gewebe entfernt wird oder die Wunde verbindet die beiden Augen, (C) die Wundstelle reißt und erstreckt sich bis zum Rand, (D) die Wunde zu tief ist , und stößt von der Durch dorsale (D) an den ventralen (D‘) Seite und (E - F) nicht alle der Exkavation Gewebe entfernt werden, sichtbar gemacht sowohl morphologisch als (E) und durch anti-Arrestin - Färbung der Photorezeptorneuronen (F). Gelbe Pfeile: anomale Ablationen. Gelbe Kreise: Ablation Ort. Maßstabsbalken = 100 & mgr; m. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Diskussion
Dieses Auge Ablationstechnik verbessert die aktuellen Methoden (wie Lochung) von Hirngewebe mit Ausnahme von und Exzision hauptsächlich auf die Augengewebe zu beschränken. Mit etwas Übung kann diese Technik von den meisten Personen durchgeführt wird, von Technikern in microsurgeries zu unerfahren, aber gewissenhaft Studenten erlebt. Es wird empfohlen , dass diese Technik oft vor der Verwendung von Ablationen in Experimenten durchgeführt werden, einschließlich (wenn möglich) Bestätigung der vollständigen Entfernung aller Augengewebe durch Immunhistochemie oder in - situ - Hybridisierung für die Augen Marker (n) 4, 5, 13. Der wichtigste Schritt in diesem Protokoll ist das Schöpfen aus Geweben. Es ist wichtig, nicht zu viel oder zu wenig Gewebe zu entfernen. Dies kann durch nicht Schopf zu tief mit der Nadel vermieden werden, um zu verhindern bis zur ventralen Seite des Wurms durchdringt. Die Spitze des neeDLE sollte nur etwa 0,4 mm tief, und der abgeschrägte Teil der Nadel sollte nie den ganzen Weg durch das Auge eingeführt werden, gehen. Besondere Sorgfalt sollte das fragile Gewebe nicht beschädigt werden zwischen den beiden Augen (der mediale Rand der schwarzen pigmentierten Bereich jedes Auge repräsentiert die Grenzen jedes Auge) getroffen werden. Schaden zwischen dem Auge und dem distalen Rand des Wurms auch vermieden werden sollte. Kleinere Würmer sind eher zu reißen oder unabsichtlich verletzt werden, so dass die Verwendung von größeren Würmern (besonders für die Praxis) empfohlen. Die wichtigsten Einschränkungen dieser Technik sind, dass es relativ zeitintensiv ist (und nicht geeignet für Hochdurchsatz-Screenings), und es erfordert eine Investition bei der Durchführung der Genauigkeit der Ergebnisse zu gewährleisten. Doch mit der Praxis 10 Augen können in ~ 15 min abgetragen werden.
Ein wichtiger Bereich für die Fehlerbehebung ist Planarien noch während des Verfahrens zu halten. Die zwei Hauptgründe Würmer nicht ausreichend immobilisiert Ablationen durchzuführenzu viel ist (a) Wasser und (b) den Verlust der Kälte. (A) Überschüssiges Wasser, das Planarie Pool auf der Oberfläche, während der Operation der Übertragung Würmer Würmer können, um die Operation zu bewegen und komplizieren. Die Operation Oberfläche (fusselfreien Tuch abwischen und Filterpapier) sollte nur feucht bleiben. Wenn zu irgendeinem Zeitpunkt während des Verfahrens wird das Abwischen mit worm Wasser gesättigt ist, es entweder ersetzt oder kann eine Transferpipette verwendet werden soll, um sanft überschüssige Flüssigkeit aus dem Gewebetuch (immer aus dem Wischtuch ziehen und nicht das Filterpapier) zu entfernen. Gewebetücher können auch überschüssigen Wasser-Pooling auf der OP-Oberfläche entfernen verwendet werden. Dieser Prozess muss möglicherweise viele Male wiederholt werden, abhängig von der Anzahl der Würmer abgetragen wird. (B) Wenn die Petrischale unter Verwendung von kalten Platte aufgebaut, erinnern die kalte Platte zu ersetzen, sobald das Eis zu schmelzen beginnt, und die 60-mm-Petrischalendeckel beginnt zu schweben. Dadurch wird sichergestellt, sowohl eine stabile Operation Oberfläche und eine entsprechend kalte Oberfläche. wenn mit der Peltier-Platte Alternativeingerichtet, sich bewusst sein, dass die Wärme in den äußeren Ringen nach 45 min bis 1 h der Verwendung wird die Kühlplatte in der Mitte überwinden und alle Kühl verloren. Wenn dies der Fall ist, schalten Sie die Peltier-Platte für 5-10 min ab, damit sie vor der Wiederaufnahme Ablationen auf Raumtemperatur kommen.
Ein weiterer Bereich der Fehlersuche ist während des Wurms Übertragung zwischen dem Gericht und der Operation Oberfläche und wieder zurück. Wenn abgetragene Würmer schwer aus dem Filterpapier zu entfernen, bis die Flüssigkeit Pools auf das Filterpapier mit einem Tropfen Wurm Wasser auf dem Wurm platzieren. Worms kann dann in die Transferpipette wie üblich angesaugt werden. Wenn das Problem weiterhin besteht, versuchen Sie den Wurm auf seine Bauchseite Spiegeln ersten (die matte Seite der Zange verwenden). Wenn ein Wurm in der Transferpipette stecken bleibt, ist dies in der Regel ein Zeichen dafür, dass zu viel Wasser aufgenommen worden (Würmer sollten in die Transferpipette nicht weiter als etwa einen Zoll gezogen werden). eine Schnecke in einer Transferpipette stecken zu entfernen, aufzustellen 1-2 ml worm Water in die Pipette, so dass die Schnecke mit Wasser bedeckt ist. Flick fest auf der Seite der Pipette, bis die Schnecke von der Wand der Pipette löst und schwebend wird.
Wenn die Nadel stumpf wird, mit einer neuen Nadel / Spritze ersetzen. Betrachten Sie die Nadel ersetzen, nachdem es mit ≥30 Augen abzutragen. Übermäßige Entfernung von resezierten Geweben durch Abwischen mit einem Tuch abwischen kann auch stumpft die Nadel, so dass Ablationen erschwert. Es ist in Ordnung, wenn reseziert Gewebe innerhalb des abgeschrägten Teils der Nadel während des gesamten Verfahrens (auch über mehrere Tiere) bleiben. Verwenden Sie immer eine frische Nadel / Spritze , wenn zwischen Würmern unterschiedlichen Bedingungen (zB Wildtyp vs. RNAi Würmer), sowie bei Beginn neue Ablation Sitzungen (dh an verschiedenen Tagen) zu verändern.
Dieses chirurgische Auge Ablationstechnik ist ein mächtiges Mittel, lichtinduzierte Verhalten (und ihre genetische und neurologische Basis) in Planarien zu untersuchen, insbesonderewenn sie mit pharmakologischen Behandlungen oder RNA-Interferenz kombiniert. Eye - Ablation ist auch ein großes Mittel , mit denen die Mechanismen aufzuklären , die endogenen Planarienregeneration Auge (Auge und Stammzell Wartung und Differenzierung) in vivo reguliert. Da die meisten Wirbeltiere haben sehr begrenzte Fähigkeiten Augengewebe zu regenerieren, zu verstehen, wie Planarien der Lage sind, ihre Augen regenerieren wird bei der Identifizierung von möglichen Mechanismen für die Übersetzung in zukünftige Therapien von Bedeutung sein.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Die Autoren möchten sie Michelle Deochand für die Perfektionierung dieses Auge Ablationstechnik, Taylor Birkholz für die Unterstützung bei dem Funktionstest, Michael Levin für die Anti-Arrestin Antikörper und Junji Morokuma Informationen zu den Peltier-Platten danken. Diese Arbeit wurde durch einen SFSA Zuschuss von der Western Michigan University WSB unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Instant Ocean sea salts | Spectrum Brands | SS15-10 | "10 Gallon" box (net weight 3 lbs) |
| Kimwipes EX-L lint-free tissue wipe | Kimberly-Clark | 34155 | 4.5 x 8.5 in |
| Whatman #2 filter paper | Sigma | WHA1002125 | Circles, 125 mm diameter, white |
| Easy Touch Insulin syringe (with needle) | Pet Health Market | 17175-04 | U-100 1 cc syringe, 31 G 5/16 in needle |
| 100 mm Petri dish | VWR | 25384-342 | 100 mm x 15 mm |
| 60 mm Petri dish | VWR | 25384-092 | 60 mm x 15 mm |
| Dumont #5 forceps | Fine Science Tools | 11254-20 | Inox, straight tip , 11 cm |
| Transfer pipettes | Samco Scientific | 225 | Graduated, large bulb, 7.5 mL, non sterile |
| Parafilm M paraffin film | Brand | 701606 | 4 in x 125 ft roll |
| 12-well untreated tissue culture plate | VWR | 15705-059 | Untreated, flat bottom, sterile, Falcon brand |
| Plastic food containers (for colony) | Ziploc | Large rectangle | 2.25 qt (2.12 L), 10" x 6 -3/4 " x 3 -3/16" |
| Planaria (Girardia tigrina) | Carolina Biological | 132954 | Sold as "Brown" Planaria; most often they are G. tigrina (aka Dugesia tigrina), but sometimes are G. dorotocephala (aka Dugesia dorotocephala); either will work. |
| Planaria (Schmidtea mediterranea) | n/a | n/a | S. mediterranea are not commercially available. At this time animals are only obtainable from laboratories that use them and have extra animals. |
| Brown paper towels | Grainger | 2U229 | 9-3/16 x 9-3/8" 1-Ply Multifold Paper Towel, UNBLEACHED |
| Wash bottle (for worm water), optional | VWR | 16650-275 | Wash Bottles, Low-Density Polyethylene, Wide Mouth, 500 mL |
| Anti-synapsin antibody, optional | Developmental Studies Hybridoma Bank | 3C11 | Supernatant |
| Anti-arrestin antibody, optional | n/a | n/a | Not commercially available. Kind gift from Michael Levin, Tufts University |
| Nalgene Lowboy carboy with spigot (for storing worm water), optional | Nalge Nunc International Corporation | 2324-0015 | 15 L, polypropylene, low profile makes it easier to fill plastic colony containers |
| Custom Peltier plate, optional | Williams Machine, Foxboro, MA | n/a | Design specifics courtesy of Junji Morokuma, Tufts University: Peltier plate is constructed of a standard thermoelectric heat pump (for example, All Electronics Corp Catalog # PJT-1, 30 mm2). The square heat pump is covered with a thin mirrored surface, then placed inside a 30 mm2 square hole in a circular plexiglass form (~50 mm in diameter). This form is of similar thickness to the heat pump, and fits flush into a well tooled in the center of a round heat sink (~115 mm in diameter). The form/heat pump is "anchored" to the sink with silicone base heat sink compound. The leads are threaded through holes drilled through both the form and the the heat sink. The bottom half of the heat sink is tooled into a "foot" that fits into the opening of your microscope's base plate. |
| DC power source (for Peltier plate), optional | B & K Precision | 1665 | Regulated Low Voltage DC Power Supply, 1-18 V (DC), 1-10 amps. |
| Other common supplies | |||
| Gloves | |||
| Razor blade | |||
| Scissors | |||
| Dissecting scope with gooseneck lighting | |||
| Chopstick rests, optional |
Referenzen
- Gentile, L., Cebria, F., Bartscherer, K. The planarian flatworm: an in vivo model for stem cell biology and nervous system regeneration. Dis Model Mech. 4 (1), 12-19 (2011).
- Elliott, S. A., Sanchez Alvarado, A. The history and enduring contributions of planarians to the study of animal regeneration. Wiley Interdiscip Rev Dev Biol. 2 (3), 301-326 (2013).
- Emili Saló, R. B. Chapter 3. Animal Models in Eye Research. Tsonis, P. A. , Academic Press. 15-26 (2008).
- Lapan, S. W., Reddien, P. W. dlx and sp6-9 Control optic cup regeneration in a prototypic eye. PLoS Genet. 7 (8), e1002226(2011).
- Lapan, S. W., Reddien, P. W. Transcriptome analysis of the planarian eye identifies ovo as a specific regulator of eye regeneration. Cell Rep. 2 (2), 294-307 (2012).
- Inoue, T., et al. Morphological and functional recovery of the planarian photosensing system during head regeneration. Zoolog Sci. 21 (3), 275-283 (2004).
- Pineda, D., et al. The genetic network of prototypic planarian eye regeneration is Pax6 independent. Development. 129 (6), 1423-1434 (2002).
- Paskin, T. R., Jellies, J., Bacher, J., Beane, W. S. Planarian Phototactic Assay Reveals Differential Behavioral Responses Based on Wavelength. PLoS One. 9 (12), e114708(2014).
- Raffa, R. B., Martley, A. F. Amphetamine-induced increase in planarian locomotor activity and block by UV light. Brain Res. 1031 (1), 138-140 (2005).
- Sandmann, T., Vogg, M. C., Owlarn, S., Boutros, M., Bartscherer, K. The head-regeneration transcriptome of the planarian Schmidtea mediterranea. Genome Biol. 12 (8), R76(2011).
- Vasquez-Doorman, C., Petersen, C. P. The NuRD complex component p66 suppresses photoreceptor neuron regeneration in planarians. Regeneration (Oxf). 3 (3), 168-178 (2016).
- Deochand, M. E., Birkholz, T. R., Beane, W. S. Temporal regulation of planarian eye regeneration. Regeneration. 3 (4), 209-221 (2016).
- Sakai, F., Agata, K., Orii, H., Watanabe, K. Organization and regeneration ability of spontaneous supernumerary eyes in planarians -eye regeneration field and pathway selection by optic nerves. Zoolog Sci. 17 (3), 375-381 (2000).
- Asano, Y., Nakamura, S., Ishida, S., Azuma, K., Shinozawa, T. Rhodopsin-like proteins in planarian eye and auricle: detection and functional analysis. J Exp Biol. 201 (Pt 9), 1263-1271 (1998).
- Cross, S. D., et al. Control of Maintenance and Regeneration of Planarian Eyes by ovo. Invest Ophthalmol Vis Sci. 56 (12), 7604-7610 (2015).
- Robb, S. M., Gotting, K., Ross, E., Sanchez Alvarado, A. SmedGD 2.0: The Schmidtea mediterranea genome database. Genesis. 53 (8), 535-546 (2015).
- Robb, S. M., Ross, E., Sanchez Alvarado,, A, SmedGD: the Schmidtea mediterranea genome database. Nucleic Acids Res. 36, D599-D606 (2008).
- Beane, W. S., Tseng, A. S., Morokuma, J., Lemire, J. M., Levin, M. Inhibition of planar cell polarity extends neural growth during regeneration, homeostasis, and development. Stem Cells Dev. 21 (12), 2085-2094 (2012).
- Forsthoefel, D. J., Waters, F. A., Newmark, P. A. Generation of cell type-specific monoclonal antibodies for the planarian and optimization of sample processing for immunolabeling. BMC Dev Biol. 14, 45(2014).
- Ross, K. G., et al. Novel monoclonal antibodies to study tissue regeneration in planarians. BMC Dev Biol. 15, 2(2015).
- Cardona, A., Fernandez, J., Solana, J., Romero, R. An in situ hybridization protocol for planarian embryos: monitoring myosin heavy chain gene expression. Dev Genes Evol. 215 (9), 482-488 (2005).
- King, R. S., Newmark, P. A. In situ hybridization protocol for enhanced detection of gene expression in the planarian Schmidtea mediterranea. BMC Dev Biol. 13, 8(2013).
- Pearson, B. J., et al. Formaldehyde-based whole-mount in situ hybridization method for planarians. Dev Dyn. 238 (2), 443-450 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten