Method Article
La ablación quirúrgica de ensayo para estudio de la regeneración de los ojos en planarias
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo se muestra cómo extirpar consistentemente ojos planarias (tazas óptica) sin molestar a los tejidos circundantes. Usando una aguja de insulina y la jeringa, ya sea uno o ambos ojos pueden ser ablacionada para facilitar las investigaciones sobre los mecanismos que regulan la regeneración ojo, la evolución de la regeneración visual, y la base neural de la conducta inducida por la luz.
Resumen
En el estudio de células madre adultas y mecanismos regenerativos, gusanos planos planarian son un elemento básico en el sistema de modelo in vivo. Esto se debe en gran parte a su abundante población de células madre pluripotentes y capacidad de regenerar todos los tipos de células y tejidos después de las lesiones que serían catastróficas para la mayoría de los animales. Recientemente, las planarias han ganado popularidad como un modelo para la regeneración de los ojos. Su capacidad para regenerar todo el ojo (compuesto de dos tipos de tejidos: células de pigmento y fotorreceptores) permite la disección de los mecanismos que regulan la regeneración del sistema visual. ablación Eye tiene varias ventajas sobre otras técnicas (tales como la decapitación o perforadora) para examinar vías y mecanismos de ojo específico, el más importante de los cuales es que la regeneración se limita en gran parte a los tejidos del ojo solo. El propósito de este artículo de vídeo es demostrar cómo eliminar de forma fiable la copa óptica planaria sin perturbar el cerebro o en los tejidos circundantes.También se describe la manipulación de los gusanos y de mantenimiento de una colonia establecida. Esta técnica utiliza un 31 G, aguja de insulina 5/16 pulgadas para sacar quirúrgicamente a cabo la copa óptica de planarias inmovilizados en un plato frío. Este método abarca tanto la ablación simple y doble ojo, con los ojos en regeneración dentro de 1-2 semanas, lo que permite una amplia gama de aplicaciones. En particular, esta técnica de ablación se puede combinar fácilmente con pantallas farmacológicos y genéticos (ARN de interferencia) para una mejor comprensión de los mecanismos regenerativos y su evolución, las células madre del ojo y su mantenimiento, y las respuestas de comportamiento phototaxic y su base neurológica.
Introducción
Las planarias son una poderosa organismo modelo para el estudio de madre adultas regeneración mediada por células. Estos gusanos planos de agua dulce no parasitarias poseen la capacidad de regenerar cualquier y todos los tejidos perdidos, incluyendo su sistema nervioso central y el cerebro 1. Estudió tan atrás como la década de 1700 2, los avances tecnológicos en el campo planaria durante los últimos 10-15 años (como un genoma secuenciado, hibridación in situ, inmunohistoquímica, RNA de interferencia (RNAi), y transcriptómica) han actualizado este organismo modelo histórico . En concreto, las planarias recientemente han ganado popularidad como un modelo emergente para la investigación del ojo 3.
Planarias tienen ojos prototípicos con sólo dos tipos de tejido, las neuronas fotorreceptoras y las células de pigmento; esto ha permitido la caracterización de la población de células madre del ojo y demostrado que muchos de los mismos genes que regulan vertebrado ojo desarrollo se conservan en planarias 4, 5. Las copas óptica están situados dorsalmente y compuestas de los blancos, las dendritas no pigmentados de las neuronas fotorreceptoras y las células de pigmento negro semi-lunares, y los ojos inervan el cerebro a través de un quiasma óptico. Además de ser un modelo para elucidar los procesos regenerativos 6, el ojo planaria es muy adecuado para el estudio de la evolución de los mecanismos visuales 7, las respuestas de comportamiento a la luz (planarias muestran fototaxis negativo) 8, y las bases neurológicas del comportamiento 9.
La regeneración de los ojos en planarias se ha estudiado en gran parte en dos contextos principales: como parte de regeneración de la cabeza después de la decapitación 4, 10, y después de la escisión de sólo los tejidos del ojo 11, 12 . La mayoría de los estudios sobre la regeneración de las planarias ojos han utilizado el método de la decapitación, ya que es simple y directo. El método de escisión ojo planaria más común hasta la fecha ha sido a través de perforadora con un fino tubo capilar de vidrio 13, 14, aunque algunos estudios también han realizado amputaciones justo detrás de los ojos (decapitación parcial) 15. Sin embargo, todos estos métodos implican la pérdida de muchos tejidos que no sean sólo el ojo (tales como el cerebro, los intestinos y nefridios), complicando potencialmente la interpretación de los resultados. El protocolo de ablación ojo que aquí se presenta restringe la escisión de los tejidos del ojo (específicamente con exclusión de cerebro), resultando en datos que son más específicos para el ojo. Además, a diferencia de los gusanos decapitados que tienen 7-14 días para iniciar la alimentación, gusanos oculares ablación se alimentarán dentro de 24 h de ablación 12, lo que permite experimentos de RNAi (donde RNAi se entrega a través de los alimentos) para ser performed simultáneamente.
A pesar de que la ablación del ojo es técnicamente más difícil de realizar con éxito de la decapitación, los estudios actuales que implican la extirpación del ojo no han incluido instrucciones detalladas sobre sus procedimientos. El objetivo de este artículo de vídeo es permitir a los investigadores para eliminar sistemáticamente la copa óptica planaria sin molestar a los tejidos cerebrales subyacentes y eliminar la menor cantidad de otros tejidos como sea posible. Este método puede ser utilizado tanto para la ablación simple y doble ojo y es aplicable a una amplia gama de investigaciones. Como la mayoría de los ensayos de regeneración, la ablación del ojo es muy adecuado para la combinación con las dos pantallas farmacológicos y genéticos (RNAi), así como los estudios de comportamiento. Aquí se describen los métodos para la manipulación de los gusanos, el mantenimiento de una colonia planaria, y la técnica de ablación ojo mismo.
Protocolo
1. Cultura Animal y Manejo
NOTA: Este protocolo utiliza mediterranea Schmidtea, una especie planarian diploides con un genoma secuenciado 16, 17 que se utiliza comúnmente para la investigación de regeneración. Sin embargo, el ensayo es el mismo éxito con otras especies, tales como Girardia tigrina y dorotocephala Girardia (que están disponibles en el comercio).
- Mantener gusanos en "agua gusano" hecho a partir de sales / L de mar 0,5 g en ultrapura (o filtrada desionizada) agua. Utilice recipientes de polipropileno o de vidrio estériles para contener el agua gusano. Ver Archivo 1 para más detalles sobre la preparación de agua gusano.
NOTA: Nunca use jabón para limpiar los contenedores (u otros suministros) como jabón es tóxico para los gusanos; en lugar limpie con etanol al 70% y dejar secar al aire.- Use guantes cuando se trabaja con planaria para protegerlos de la contaminación.
NOTA: Los gusanos son muy sensibles a las toxinas y productos químicos ambientales, incluyendo el jabón, lejía, champú, acondicionador y crema para las manos.
- Use guantes cuando se trabaja con planaria para protegerlos de la contaminación.
- colonias Casa en contenedores de alimentos de polipropileno, con la tapa dejaron parcialmente abierta para el intercambio de aire a ~ 20 ° C (temperatura ambiente). Tiendas gusanos experimentales, ya sea en placas de Petri (20 gusanos por placa de 100 mm) o placas no tratadas de cultivo de tejidos (1 gusano por pocillo, para placas de 12 pocillos). Para reducir el estrés, mantener las dos colonias y experimentos en la oscuridad.
NOTA: Las colonias deben tener no más de 500-1.000 gusanos por litro de agua gusano. Para los experimentos, salir de tapas en pleno funcionamiento, ya que el flujo de aire se diseña en estos platos. - Alimentar a los gusanos no experimentales una vez a la semana con puré de carne orgánica o de hígado de pollo al dejar caer el puré de una pipeta de transferencia, colocando gotas de alimentos en todo el recipiente. Permitir gusanos 2 h a consumir alimentos en eloscuro antes de la limpieza de recipiente (véase el paso 1.4). Antes de su uso, el puré de almacenar a -20 ° C para corto plazo (semanas) o -80 ° C para el largo plazo (meses); no volver a congelar el puré para su reutilización (como las bacterias pueden florecer y dañar a los gusanos).
NOTA: Hígado no debe contener hormonas o antibióticos y preferiblemente no ser previamente congelado. Centrifugar puré antes de la congelación (o antes de la alimentación) para eliminar el aire y evitar que los alimentos flotante. La comida debe hundirse hasta el fondo del recipiente. 1 ml de puré es suficiente para 500-1.000 gusanos. - Cambio de agua una vez por semana con agua fresca para el gusano de ambas colonias y experimentos. contenedores de colonias también se deben limpiar con una toalla de papel sin blanquear (para eliminar los residuos de moco que los desechos TRAP) una vez a la semana para pasar hambre gusanos, o dos veces a la semana para los gusanos de alimentación (2 h después de la alimentación y de nuevo 2 días más tarde). Con el fin de conservar la biopelícula, no limpie más del 80% del depósito.
- Mueva gusanos entre contenedores (o setu cirugíap) utilizando una pipeta de transferencia. Para gusanos libres adheridas a superficies del recipiente, chorro de agua sobre / detrás del gusano para liberarla de la superficie. A continuación, aspirar el gusano en la pipeta, mientras trata de mantener el gusano dentro de la porción inferior pulgadas (más delgada) de la pipeta.
- pipetas de retrocarga con una pequeña cantidad de agua gusano antes de succión hacia arriba.
- Tratar de mover el agua alrededor del gusano, en lugar del propio gusano, para ayudar a evitar que se desgarre gusanos de cuerpo blando tocándolos con la pipeta.
- Mantenga platos experimentales cubiertos, salvo que la transferencia de gusanos o sustitución de agua.
2. Preparación
- Dejar de alimentar a los gusanos al menos una semana antes de los experimentos.
- Seleccionar gusanos que no han sido criados durante ≥1 semana y al menos 5-7 mm de longitud. La transferencia de los gusanos a una placa de Petri 2/3 lleno de agua gusano, y confirmar la longitud del gusano deslizando una regla debajo del plato. medir wORMS mientras completamente extendidos y en movimiento.
NOTA: Mientras más pequeño (5-7 mm) gusanos funcionan mejor cuando se realiza inmunofluorescencia posterior y en los análisis de hibridación in situ, gusanos más grandes (8-10 mm) son más fáciles de trabajar con - especialmente cuando aprender a realizar la ablación. - Asegúrese de que los gusanos son entera, sin daños, y no recientemente regeneración.
NOTA: La regeneración de los gusanos tendrán mucho más ligero pigmento (o no) en la cabeza y / o región de la cola en comparación con gusanos normales. - Si se realiza la ARNi o tratamientos farmacológicos en gusanos, hacerlo en este momento. Si gusanos fueron alimentados como parte del tratamiento (como por RNAi), esperar al menos 7 días después de la última alimentación antes de continuar con el paso 2.2.
- Seleccionar gusanos que no han sido criados durante ≥1 semana y al menos 5-7 mm de longitud. La transferencia de los gusanos a una placa de Petri 2/3 lleno de agua gusano, y confirmar la longitud del gusano deslizando una regla debajo del plato. medir wORMS mientras completamente extendidos y en movimiento.
- Limpiar la base del microscopio espacio de trabajo y de disección con 70% de etanol y permita que se seque por completo. Coloque el plato de gusanos seleccionados a la izquierda de la mira telescópica. A la derecha del alcance, colocar un par de # 5 fórceps, un 31 G 5 aguja de insulina / 16 pulgadas con una 1jeringa ml, y una pipeta de transferencia limpia.
- Asegúrese de que los instrumentos se mantienen de tocar el banco (que podría introducir contaminantes). Utilizar un elemento rígido (como por ejemplo un resto del palillo) para mantener el fórceps, agujas, y la pipeta limpia. Alternativamente, el lugar instrumentos en la parte superior de un color marrón (no blanqueada) toalla de papel limpia.
NOTA: Estos y posteriores instrucciones están escritas, ya que pertenecen a los individuos diestros. individuos zurdos deben invertir las direcciones derecha / izquierda.
- Asegúrese de que los instrumentos se mantienen de tocar el banco (que podría introducir contaminantes). Utilizar un elemento rígido (como por ejemplo un resto del palillo) para mantener el fórceps, agujas, y la pipeta limpia. Alternativamente, el lugar instrumentos en la parte superior de un color marrón (no blanqueada) toalla de papel limpia.
- Junto a la zona de trabajo, colocar una caja de toallitas paño libre de pelusa, una fuente de agua fresca del gusano, y algunas pipetas de transferencia adicionales (protegido de la mesa de trabajo). Abertura agua gusano en una botella de lavado de plástico para facilitar la dispensación. También colocar una placa de marcado de 12 pocillos (o 100 mm placa de Petri) a la derecha del alcance de recogida de animales ablación.
- Si se utiliza una placa Peltier hechos a medida para inmovilizar gusanos, coloque la placa Peltier en la depresión en tél base del microscopio de disección y ajustar la salida de la fuente de alimentación de CC hasta que la superficie de trabajo de la placa Peltier es lo suficientemente frío (normalmente ~ 5 V) .Alternatively, hacer una placa fría llenando un plato de 100 mm Petri ½ completo con agua y congelar durante al menos 24 h. Descartar la tapa y coloque la parte inferior de la placa de 100 mm en la base del microscopio de disección, a continuación, colocar la tapa de una placa de Petri de 60 mm al revés directamente en la superficie del hielo (Figura 1A).
- Después de que el agua ha congelado en el plato de 100 mm, un "volcán" de hielo puede aparecer en el centro de la placa. Si esto sucede, utilice una hoja de afeitar para raspar el hielo plana, para eliminar las irregularidades de la superficie.
NOTA: Durante las cirugías el hielo se derrite, haciendo ablaciones mucho más difícil. Preparar varios platos de hielo con antelación, y reemplazar los congelados para la fusión queridos durante el ensayo tan pronto como la tapa de la placa de 60 mm comienza flotante.
- Después de que el agua ha congelado en el plato de 100 mm, un "volcán" de hielo puede aparecer en el centro de la placa. Si esto sucede, utilice una hoja de afeitar para raspar el hielo plana, para eliminar las irregularidades de la superficie.
- Prepara lasuperficie de la cirugía. Cortar una pieza de 5 cm x 10 cm de película de parafina de plástico (4 cm 2 si se utiliza la placa de Petri placa fría) y colocarlo en el centro del dispositivo de inmovilización. Doble un paño libre de pelusa limpie en un cuadrado de aproximadamente 2 cm 2 y colocarlo en la parte superior de la película. Cortar una pieza de filtro de papel blanco 1,5-2 cm 2 y colocarlo en la parte superior de la toallita. Véase la Figura 1B-1E.
- Mantenga la toallita plegada en su lugar con un dedo enguantado, y el uso de agua para humedecer ligeramente gusano de la toallita para asegurarse de que permanece plegada. Utilice el lado de una pipeta de transferencia para rodar la toallita plana.
NOTA: La temperatura fría ayuda a mantener los gusanos se mueva. Trabajar "en seco" también ayuda en la inmovilización. El tejido limpie actos para absorber agua a través del papel de filtro, manteniendo el gusano húmedo durante la cirugía sin permitir que los gusanos se sequen por completo (que es letal).
- Mantenga la toallita plegada en su lugar con un dedo enguantado, y el uso de agua para humedecer ligeramente gusano de la toallita para asegurarse de que permanece plegada. Utilice el lado de una pipeta de transferencia para rodar la toallita plana.
3. La ablación quirúrgica
- Utilice una pipeta de transferencia para colocar enlado e gusano dorsal arriba sobre el papel de filtro. Encienda la fuente de luz y dirigir los cuellos de cisne para que la luz se centra en el gusano. Ajustar el enfoque disección alcance y la ampliación de manera que los ojos son claramente visibles (todo el gusano no tiene que estar a la vista); 5 aumentos es un buen punto de partida. Oriente el gusano mediante la rotación de la película de parafina de manera que la cabeza está orientado hacia el investigador (hacia la parte frontal del microscopio), en ángulo de 30-40 grados a la derecha.
- Evitar el uso de una luz brillante para evitar el exceso de movimiento de gusano. Las planarias muestran fototaxis negativos y tratarán de evadir la luz brillante.
- Si el gusano se coloca lado ventral hacia arriba (con la apertura visible faríngea), utilice el lado opaco del fórceps para volver a colocar suavemente el lado gusano dorsal hacia arriba (con los ojos visibles). Evitar acercarse al animal con la punta afilada de la pinza para minimizar la posibilidad de romper a través de los tejidos blandos cuando el reposicionamiento del animal.
- Ajuste el enfoque del microscopio de modo que los ojos son claramente en el centro. También aseguran que tanto los ojos y los tejidos que rodean la cabeza están a la vista.
- Mantenga una aguja / jeringa fresca en la mano derecha como si se tratara de una pluma (entre el pulgar y el dedo índice). Brace el pulgar izquierdo contra la placa Peltier (o placa de Petri placa fría), y utilizar el pulgar izquierdo como punto de apoyo sobre la que descansará la parte inferior de la jeringa (Figura 2A). Mire a través del microscopio, y asegúrese de que el bisel de la aguja es visible.
NOTA: Las agujas son muy afiladas. Tenga cuidado al manipularlos. El uso de guantes de látex o nitrilo puede ofrecer alguna protección.- Utilice el pulgar izquierdo para ayudar a mantener la aguja / jeringa constante durante todo el procedimiento y evitar dar la mano.
- Hacer un ángulo de aproximadamente 40 ° con el pulgar izquierdo y el dedo índice izquierdo (con el dedo índice en la superficie de la cirugía) para ayudar a mantener la stabile superficie de la cirugía.
- Conel bisel de la aguja orientada hacia arriba (como una cuchara), la posición de la aguja en ángulo recto con el ojo (Figura 2B). Utilice la punta de la aguja para penetrar suavemente la capa delgada de tejido que cubre la copa óptica (blanco, región sin pigmentar) del ojo, recogiendo de derecha a izquierda. Muy retire con cuidado el tejido pigmentado situado dentro de la copa óptica, teniendo cuidado de no perforar el fondo o destruir los bordes de la copa óptica.
- Si el gusano ha estado en el papel de filtro para> 1-2 min en cualquier punto durante el procedimiento, añadir una gota de agua gusano para rehidratar el gusano.
NOTA: La deshidratación aumenta la susceptibilidad del gusano de lesiones que rasga.
- Si el gusano ha estado en el papel de filtro para> 1-2 min en cualquier punto durante el procedimiento, añadir una gota de agua gusano para rehidratar el gusano.
- Repita el paso 3.3 hasta que todos los tejidos pigmentados de negro (células de pigmento), así como todos los tejidos blancos de la copa óptica (dendritas de las células fotorreceptoras), se eliminan. Eliminar tejidos extirpados pegados al extremo de la aguja limpiando cuidadosamente con un pañuelo de papel toallita. Si abla doble ojose desea ción, la ablación del segundo ojo en este punto.
NOTA: Para evitar lesiones, agujas puede ser limpiado sujetando la aguja con un pañuelo de papel limpio toallita celebrada con el pulgar y el índice, a continuación, utilizando la otra mano para tirar de la aguja a través de la toallita de distancia del pulgar y el índice. Alternativamente, la aguja se puede limpiar en la superficie de un tejido toallita húmeda y se examina para la limpieza. - Cuando haya terminado, utilizar una pipeta de transferencia para mover el gusano a un plato de marcado que contiene agua gusano fresco. Si el análisis de datos de grupo, colocar hasta 20 gusanos en un solo 100 mm placa de Petri. Si el seguimiento de la regeneración en los mismos individuos con el tiempo, colocar 1 gusano en cada pocillo de una placa de 12 pocillos. Una vez que todos los gusanos se transfieren, enjuague gusanos mediante la eliminación de toda el agua gusano de los platos / pozos y la sustitución con más agua dulce gusano.
- Para eliminar gusanos del filtro, recargues la pipeta con una pequeña cantidad de agua sin fin y liberar el agua sobre el gusano. Esto debe levantar tél gusano fuera el papel de filtro, para ser aspirado inmediatamente en la pipeta para la transferencia.
- Incubar experimentos a ~ 20 ° C (temperatura ambiente) protegidos de la luz y siga el proceso regenerativo.
NOTA: Los gusanos pueden ser almacenados en una incubadora de temperatura controlada para mantener una temperatura constante, pero esto no es estrictamente necesario. La mayoría de las temperaturas ambiente variando únicamente por la 5 ° C, lo cual no afectará la capacidad del gusano de regenerarse. - Si se desea, fijar gusanos para inmunohistoquímica (véase las figuras 3-4) y / o en los análisis de hibridación in situ de la expresión génica. Existen diferentes métodos de fijación para inmunohistoquímica planaria 18, 19, 20 y la hibridación in situ 21, 22, 23 protocolos.
- Cuando los experimentos se llegó a la conclusión, sacrifice viven gusanos mediante la eliminación de agua gusano de la cápsula y su sustitución con 70% de etanol. Incubar gusanos durante 3-5 min, la comprobación de los gusanos para lisar y gire grisáceo.
- Coloque gusanos no tratados en la corriente de residuos normal una vez sacrificado. Evitar la introducción de gusanos vivos en el medio ambiente, en particular las especies no autóctonas.
Resultados
Para el primero después de la cirugía 1-2 h, los animales pueden muestran una disminución de movimiento en comparación con gusanos intactos (sin embargo, todavía se moverán). Si se desea, los gusanos se comerán dentro de las 24 h de la cirugía (por ejemplo, para la alimentación de RNAi). Cuando después de la regeneración ojo en los mismos individuos en el tiempo, asegúrese de tomar una fotografía de cada gusano tanto antes de la cirugía (intacto) y en 1 h post ablación (hpa). A los 4 días después de la ablación (dpa) regenerar las células de pigmento deben ser visibles, y por 14 dpa todo el ojo se habrá completamente regenerado (Figura 3A-B). Esto incluye las neuronas fotorreceptoras y su inervación al cerebro (Figura 3C), así como la recuperación funcional del sistema visual (Figura 4A-C). Ablaciones de éxito no perturbarán los tejidos subyacentes del cerebro (Figura 4D-E), ni introducir otras lesiones al animal (Figura 5A). ablaciones fallidosincluir animales con: un excesivamente grande escisión que conecta los dos ojos (figura 5B), las lágrimas al margen lateral del animal (Figura 5C), sitios y / o una herida que asoman a través de la epidermis ventral (Figura 5D). Además, ablaciones sin éxito incluyen la eliminación incompleta de toda la cúpula óptica, compuesta tanto de los tejidos no pigmentadas blancas y las células de pigmento negro (Figura 5E-F).

Figura 1: Preparación de la cirugía. (A) Diagrama de construcción de la placa fría, utilizando la parte inferior de una placa de Petri de 100 mm (lleno de hielo) y la tapa de una placa de Petri de 60 mm (colocado boca abajo sobre la superficie de hielo). (B) Esquema de la superficie de la cirugía, a partir de una pila de (de arriba abajo) de papel de filtro blanco, un pañuelo de papel plegada húmedo limpie, y un trozo de película de parafina.(C) La cirugía configurado (por la derecha). A: microscopio de disección, B: iluminación de cuello de cisne, C: superficie de la cirugía, D: placa Peltier, E: plato de gusanos de 5-7 mm listo para la ablación, F: botella de lavado de agua gusano, G: palillo resto celebración de pipeta de transferencia limpia, H: palillo resto sustentador de la aguja / jeringa, I: palillo resto pinzas de sujeción, J: recipiente de pipetas de transferencia adicionales. Configuración de la placa (D) Peltier personalizado. Plato de configuración de la placa fría (E) Petri. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Posición de las manos y la aguja / jeringa durante la ablación. (A) La colocación de las manos (para los diestros). Tenga en cuenta que el pulgar izquierdo se utiliza para apoyar la jeringa (celebradaen la mano derecha) para minimizar el movimiento. (B) colocación de la aguja en relación con el ojo del gusano. Tenga en cuenta que la superficie biselada de la aguja orientada hacia arriba. Haga clic aquí para ver una versión más grande de esta figura.
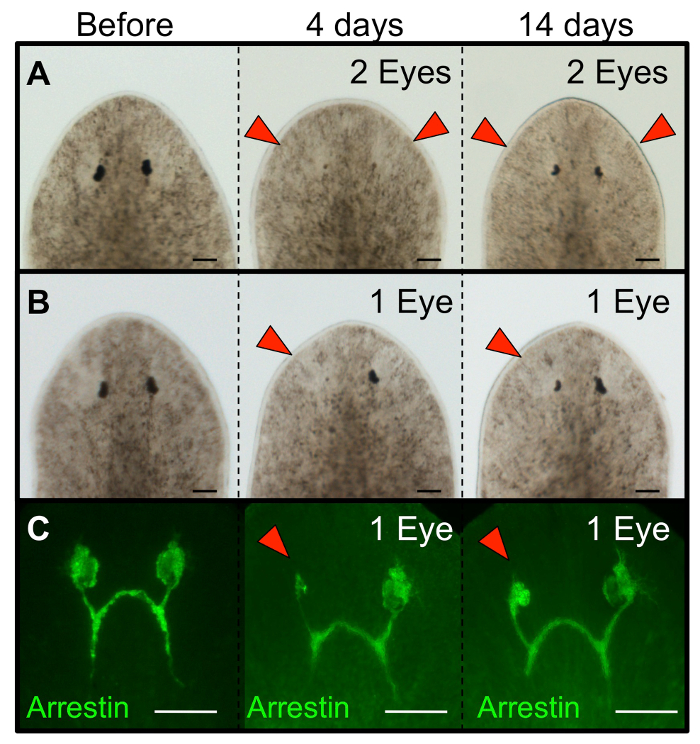
Figura 3: separada por ablación ojos planarian regeneran. Morfología de Schmidtea mediterranea planarias regrowing ojos siguiente (A) de ablación doble ojo y (B) solo ablación ojo. (C) La inmunohistoquímica que muestra la regeneración de las neuronas fotorreceptoras (anti-arrestina) siguientes ablación ojo individual. gusanos intactos se muestran antes de la cirugía, y regenera se muestran en los días 4 y 14 después de la ablación. Para ablaciones solo ojo, el ojo izquierdo era unablated y el ojo derecho sirve como un control interno (no lesionado). puntas de flechas rojas: ojos ablación. Barras de escala = 100 m. Haga clic aquí para ver una versión más grande de esta figura.
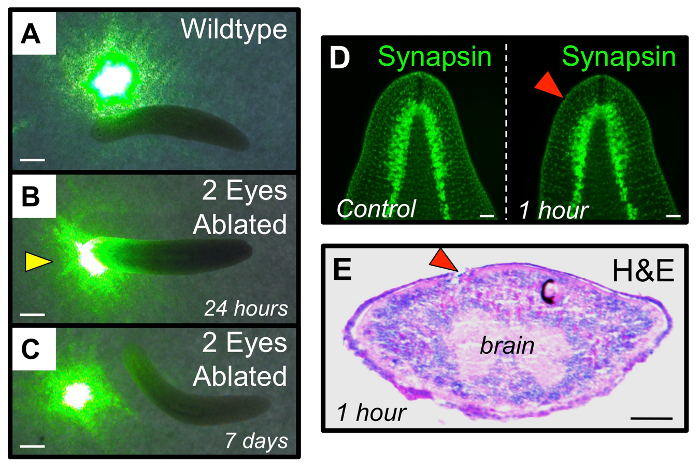
Figura 4: La recuperación funcional del sistema visual después de la ablación. (A - C) Ensayo funcional para poner a prueba fotofobia planaria. (A) gusanos intactos evitar viajar a través de zonas de luz, como un lugar de un puntero láser verde. (B) a las 24 h post ablación, "ciegos" gusanos ablación doble ojo viajan a través de puntos de luz. (C) A los 7 días después de la ablación, gusanos ojo doble ablación han regenerado su sistema visual suficientemente para recuperar evitación luz. punta de flecha amarilla: comportamiento aberranterespuesta al. (D - E) de ablación del ojo está restringida a los tejidos de la cúpula óptica, y no perturba los tejidos cerebrales subyacentes. (D) La inmunohistoquímica que muestra la arquitectura del cerebro (anti-sinapsina) es sin cambios desde antes de la ablación a 1 h después de la ablación. (E) con hematoxilina y eosina (H & E) tinción en 1 h post ablación en una sección transversal que muestra el daño se limita en gran medida al sitio de la copa óptica separada por ablación. ojo derecho (con células de pigmento negro) sirve como control interno. puntas de flechas rojas: ojos ablación. Barras de escala = 1 mm en (AC) 1 mm, 100 m de (DE). Haga clic aquí para ver una versión más grande de esta figura.
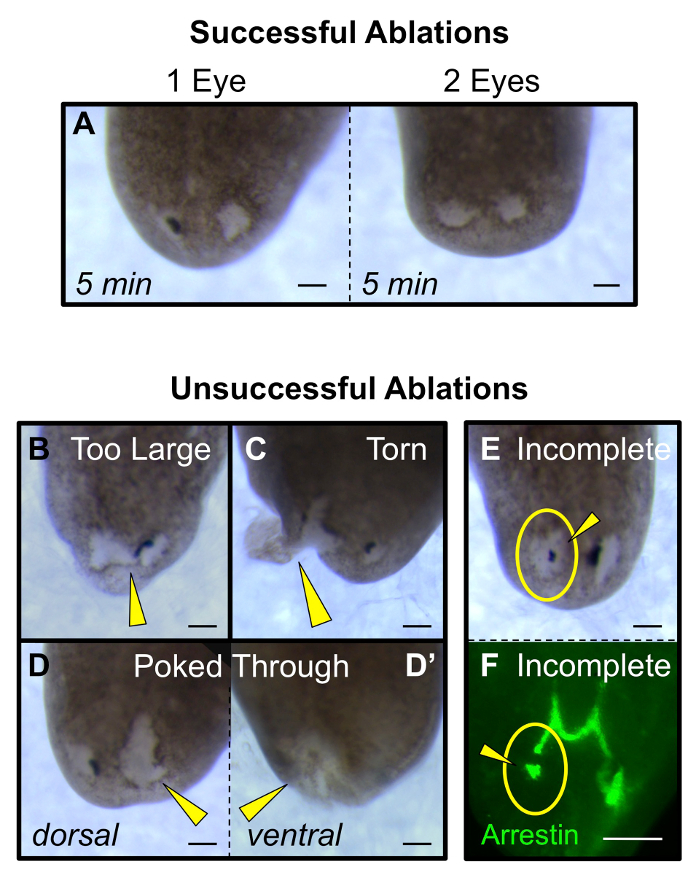
Figura 5: Los sellos de ablaciones exitosos y no exitosos. (A) ablaciones exitosos individuales y dobles oculares (en 5 minutos después de la ablación) tiene heridas que son más o menos similar en tamaño a la copa óptica originales. (B - E) ablaciones sin éxito: (b) un exceso de tejido se elimina o la herida conecta los dos ojos, (C) las lágrimas sitio de la herida y se extiende hasta el margen, (D) la herida es demasiado profunda y toques a través de la dorsal (D) a la ventral (D') lateral, y (e - F) no todos los tejidos copa óptica se eliminan, visualizado tanto morfológica (e) y por la tinción de anti-arrestina de las neuronas fotorreceptoras (F). puntas de flechas amarillas: ablaciones aberrantes. círculos de color amarillo: punto de ablación. Barras de escala = 100 m. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Esta técnica de ablación ojo mejora sobre los métodos actuales (tales como perforadora) por exclusión de los tejidos del cerebro y la restricción de escisión principalmente a los tejidos del ojo. Con la práctica, esta técnica puede ser realizada por la mayoría de los individuos, de los técnicos con experiencia en microcirugía a los estudiantes universitarios sin experiencia, sino de conciencia. Se recomienda que esta técnica puede practicar muchas veces antes de usar ablaciones en experimentos, incluyendo (cuando sea posible) la confirmación de la eliminación completa de todos los tejidos del ojo por inmunohistoquímica o hibridación in situ para el marcador del ojo (s) 4, 5, 13. El paso más crítico en este protocolo es el sacar con pala fuera de los tejidos. Es importante no eliminar el tejido sea demasiado o demasiado poco. Esto puede evitarse por no recogiendo demasiado profundamente con la aguja, para evitar que penetra a través de la parte ventral del gusano. La punta de la needle sólo debe ser insertado alrededor de 0,4 mm de profundidad, y la parte biselada de la aguja nunca debe ir todo el camino a través del ojo. Especial cuidado se debe tomar para no dañar el frágil tejido entre los dos ojos (el borde medial de la región pigmentado negro de cada ojo representa el territorio de un ojo). Daños entre el ojo y el margen distal del gusano también debe ser evitado. gusanos más pequeños son más propensos a sufrir lesiones rasgar o involuntariamente, por lo que se recomienda el uso de gusanos más grandes (particularmente para la práctica). Las principales limitaciones de esta técnica son que es relativamente intensiva en tiempo (y no es apropiado para pantallas de alto rendimiento), y requiere una inversión inicial en la práctica para asegurar la exactitud de los resultados. Sin embargo, con la práctica 10 ojos se pueden ablación en ~ 15 min.
Un área importante para la solución de problemas está en consonancia planarias inmóvil durante el procedimiento. Las dos principales razones gusanos no se inmovilizan suficientemente para realizar ablacionesson (a) (b) la pérdida de demasiada agua y de la temperatura fría. (A) El exceso de agua planaria que piscinas en la superficie de la cirugía, mientras gusanos transferencia permitirán gusanos para mover y complican la cirugía. La superficie de la cirugía (tejido sin pelusa limpie y papel de filtro) debe permanecer húmedo solamente. Si en cualquier momento durante el procedimiento de la toallita se satura con agua gusano, debe o bien ser reemplazada o una pipeta de transferencia se puede utilizar para eliminar suavemente exceso de líquido del tejido limpie (siempre sacar de la no el papel limpie y filtro). toallitas de tejido también se pueden utilizar para eliminar el exceso de acumulación de agua en la superficie de la cirugía. Este proceso puede ser necesario repetir muchas veces, dependiendo del número de gusanos que se realiza la ablación. (B) Si se utiliza el plato petri placa fría configurar, recordar para reemplazar la placa fría tan pronto como el hielo comienza la fusión y la tapa de la placa Petri 60 mm comienza a flotar. Esto asegurará tanto una superficie cirugía estable y una superficie apropiadamente frío. Alternativamente, si se utiliza la placa Peltierconfigurar, tenga en cuenta que después de 45 min a 1 h de uso, el calor en los anillos exteriores va a superar la placa fría en el centro y se perderán todos enfriamiento. Si esto sucede, apague la placa Peltier durante 5-10 minutos para permitir que se alcance la temperatura ambiente antes de reanudar ablaciones.
Otra área de solución de problemas es durante la transferencia de gusano entre el plato y la superficie de la cirugía y de regreso. Si gusanos ablación son difíciles de quitar del papel de filtro, colocar una gota de agua gusano en el gusano hasta que las piscinas de líquido en la parte superior del papel de filtro. Worms pueden entonces ser absorbidos en la pipeta de transferencia como de costumbre. Si el problema persiste, intente dar la vuelta al gusano en su cara ventral primero (usando el lado opaco de la pinza). Si un gusano se queda atascado en el interior de la pipeta de transferencia, esto suele ser una señal de que el exceso de agua se ha tomado (gusanos deben elaborarse en la pipeta de transferencia de no más de alrededor de una pulgada). Para eliminar un gusano atrapado en una pipeta de transferencia, elaboración de 1-2 ml de wat gusanoer en la pipeta, por lo que el gusano está cubierta de agua. Firmemente chasquear el lado de la pipeta hasta que el gusano se separa de la pared de la pipeta y está flotando.
Si la aguja está gastada, cámbiela por una nueva aguja / jeringa. Considere reemplazar la aguja después de usarla para realizar la ablación ≥30 ojos. eliminación excesiva de tejidos resecados frotando con un tejido de toallita puede también embotado la aguja, haciendo ablaciones más difícil. Está bien si los tejidos resecados se quedan dentro de la parte biselada de la aguja durante todo el procedimiento (incluso a través de múltiples animales). Siempre use una aguja / jeringa fresca cuando se cambia entre los gusanos de diferentes condiciones (por ejemplo, de tipo salvaje frente a gusanos RNAi), así como al comenzar nuevas sesiones de ablación (es decir, en diferentes días).
Esta técnica de ablación ojo quirúrgico es un poderoso medio para investigar los comportamientos inducidos por la luz (y su base genética y neurológica) en planarias, en particularcuando se combina con tratamientos farmacológicos o la interferencia de ARN. Ablación del ojo es también un gran medios por los que para elucidar los mecanismos que regulan endógeno regeneración ojo planaria (y el vástago de ojo de mantenimiento y diferenciación celular) in vivo. Como la mayoría de los vertebrados tienen capacidades muy limitadas para regenerar los tejidos del ojo, la comprensión de cómo las planarias son capaces de regenerar sus ojos será importante en la identificación de los posibles mecanismos de traducción a futuras terapias.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean agradecer a Michelle Deochand para perfeccionar esta técnica de ablación ocular, Taylor Birkholz para obtener ayuda con el ensayo funcional, Michael Levin para el anticuerpo anti-arrestina y Junji Morokuma para obtener información sobre las placas Peltier. Este trabajo fue apoyado por una beca SFSA de la Western Michigan University a WSB.
Materiales
| Name | Company | Catalog Number | Comments |
| Instant Ocean sea salts | Spectrum Brands | SS15-10 | "10 Gallon" box (net weight 3 lbs) |
| Kimwipes EX-L lint-free tissue wipe | Kimberly-Clark | 34155 | 4.5 x 8.5 in |
| Whatman #2 filter paper | Sigma | WHA1002125 | Circles, 125 mm diameter, white |
| Easy Touch Insulin syringe (with needle) | Pet Health Market | 17175-04 | U-100 1 cc syringe, 31 G 5/16 in needle |
| 100 mm Petri dish | VWR | 25384-342 | 100 mm x 15 mm |
| 60 mm Petri dish | VWR | 25384-092 | 60 mm x 15 mm |
| Dumont #5 forceps | Fine Science Tools | 11254-20 | Inox, straight tip , 11 cm |
| Transfer pipettes | Samco Scientific | 225 | Graduated, large bulb, 7.5 mL, non sterile |
| Parafilm M paraffin film | Brand | 701606 | 4 in x 125 ft roll |
| 12-well untreated tissue culture plate | VWR | 15705-059 | Untreated, flat bottom, sterile, Falcon brand |
| Plastic food containers (for colony) | Ziploc | Large rectangle | 2.25 qt (2.12 L), 10" x 6 -3/4 " x 3 -3/16" |
| Planaria (Girardia tigrina) | Carolina Biological | 132954 | Sold as "Brown" Planaria; most often they are G. tigrina (aka Dugesia tigrina), but sometimes are G. dorotocephala (aka Dugesia dorotocephala); either will work. |
| Planaria (Schmidtea mediterranea) | n/a | n/a | S. mediterranea are not commercially available. At this time animals are only obtainable from laboratories that use them and have extra animals. |
| Brown paper towels | Grainger | 2U229 | 9-3/16 x 9-3/8" 1-Ply Multifold Paper Towel, UNBLEACHED |
| Wash bottle (for worm water), optional | VWR | 16650-275 | Wash Bottles, Low-Density Polyethylene, Wide Mouth, 500 mL |
| Anti-synapsin antibody, optional | Developmental Studies Hybridoma Bank | 3C11 | Supernatant |
| Anti-arrestin antibody, optional | n/a | n/a | Not commercially available. Kind gift from Michael Levin, Tufts University |
| Nalgene Lowboy carboy with spigot (for storing worm water), optional | Nalge Nunc International Corporation | 2324-0015 | 15 L, polypropylene, low profile makes it easier to fill plastic colony containers |
| Custom Peltier plate, optional | Williams Machine, Foxboro, MA | n/a | Design specifics courtesy of Junji Morokuma, Tufts University: Peltier plate is constructed of a standard thermoelectric heat pump (for example, All Electronics Corp Catalog # PJT-1, 30 mm2). The square heat pump is covered with a thin mirrored surface, then placed inside a 30 mm2 square hole in a circular plexiglass form (~50 mm in diameter). This form is of similar thickness to the heat pump, and fits flush into a well tooled in the center of a round heat sink (~115 mm in diameter). The form/heat pump is "anchored" to the sink with silicone base heat sink compound. The leads are threaded through holes drilled through both the form and the the heat sink. The bottom half of the heat sink is tooled into a "foot" that fits into the opening of your microscope's base plate. |
| DC power source (for Peltier plate), optional | B & K Precision | 1665 | Regulated Low Voltage DC Power Supply, 1-18 V (DC), 1-10 amps. |
| Other common supplies | |||
| Gloves | |||
| Razor blade | |||
| Scissors | |||
| Dissecting scope with gooseneck lighting | |||
| Chopstick rests, optional |
Referencias
- Gentile, L., Cebria, F., Bartscherer, K. The planarian flatworm: an in vivo model for stem cell biology and nervous system regeneration. Dis Model Mech. 4 (1), 12-19 (2011).
- Elliott, S. A., Sanchez Alvarado, A. The history and enduring contributions of planarians to the study of animal regeneration. Wiley Interdiscip Rev Dev Biol. 2 (3), 301-326 (2013).
- Emili Saló, R. B. Chapter 3. Animal Models in Eye Research. Tsonis, P. A. , Academic Press. 15-26 (2008).
- Lapan, S. W., Reddien, P. W. dlx and sp6-9 Control optic cup regeneration in a prototypic eye. PLoS Genet. 7 (8), e1002226(2011).
- Lapan, S. W., Reddien, P. W. Transcriptome analysis of the planarian eye identifies ovo as a specific regulator of eye regeneration. Cell Rep. 2 (2), 294-307 (2012).
- Inoue, T., et al. Morphological and functional recovery of the planarian photosensing system during head regeneration. Zoolog Sci. 21 (3), 275-283 (2004).
- Pineda, D., et al. The genetic network of prototypic planarian eye regeneration is Pax6 independent. Development. 129 (6), 1423-1434 (2002).
- Paskin, T. R., Jellies, J., Bacher, J., Beane, W. S. Planarian Phototactic Assay Reveals Differential Behavioral Responses Based on Wavelength. PLoS One. 9 (12), e114708(2014).
- Raffa, R. B., Martley, A. F. Amphetamine-induced increase in planarian locomotor activity and block by UV light. Brain Res. 1031 (1), 138-140 (2005).
- Sandmann, T., Vogg, M. C., Owlarn, S., Boutros, M., Bartscherer, K. The head-regeneration transcriptome of the planarian Schmidtea mediterranea. Genome Biol. 12 (8), R76(2011).
- Vasquez-Doorman, C., Petersen, C. P. The NuRD complex component p66 suppresses photoreceptor neuron regeneration in planarians. Regeneration (Oxf). 3 (3), 168-178 (2016).
- Deochand, M. E., Birkholz, T. R., Beane, W. S. Temporal regulation of planarian eye regeneration. Regeneration. 3 (4), 209-221 (2016).
- Sakai, F., Agata, K., Orii, H., Watanabe, K. Organization and regeneration ability of spontaneous supernumerary eyes in planarians -eye regeneration field and pathway selection by optic nerves. Zoolog Sci. 17 (3), 375-381 (2000).
- Asano, Y., Nakamura, S., Ishida, S., Azuma, K., Shinozawa, T. Rhodopsin-like proteins in planarian eye and auricle: detection and functional analysis. J Exp Biol. 201 (Pt 9), 1263-1271 (1998).
- Cross, S. D., et al. Control of Maintenance and Regeneration of Planarian Eyes by ovo. Invest Ophthalmol Vis Sci. 56 (12), 7604-7610 (2015).
- Robb, S. M., Gotting, K., Ross, E., Sanchez Alvarado, A. SmedGD 2.0: The Schmidtea mediterranea genome database. Genesis. 53 (8), 535-546 (2015).
- Robb, S. M., Ross, E., Sanchez Alvarado,, A, SmedGD: the Schmidtea mediterranea genome database. Nucleic Acids Res. 36, D599-D606 (2008).
- Beane, W. S., Tseng, A. S., Morokuma, J., Lemire, J. M., Levin, M. Inhibition of planar cell polarity extends neural growth during regeneration, homeostasis, and development. Stem Cells Dev. 21 (12), 2085-2094 (2012).
- Forsthoefel, D. J., Waters, F. A., Newmark, P. A. Generation of cell type-specific monoclonal antibodies for the planarian and optimization of sample processing for immunolabeling. BMC Dev Biol. 14, 45(2014).
- Ross, K. G., et al. Novel monoclonal antibodies to study tissue regeneration in planarians. BMC Dev Biol. 15, 2(2015).
- Cardona, A., Fernandez, J., Solana, J., Romero, R. An in situ hybridization protocol for planarian embryos: monitoring myosin heavy chain gene expression. Dev Genes Evol. 215 (9), 482-488 (2005).
- King, R. S., Newmark, P. A. In situ hybridization protocol for enhanced detection of gene expression in the planarian Schmidtea mediterranea. BMC Dev Biol. 13, 8(2013).
- Pearson, B. J., et al. Formaldehyde-based whole-mount in situ hybridization method for planarians. Dev Dyn. 238 (2), 443-450 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados