Method Article
אבלציה כירורגית Assay עבור לימוד Regeneration Eye ב Planarians
* These authors contributed equally
In This Article
Summary
פרוטוקול זה מראה כיצד שיחתוך עיני planarian בעקביות (כוסות אופטיות) מבלי להפריע רקמות סובבות. באמצעות מחט אינסולין במזרק, או אחת או בשתי העיניים יכול להיות מלוטשים על מנת להקל על חקירת מנגנוני ויסות התחדשות העין, את האבולוציה של התחדשות ויזואלית, ואת הבסיס העצבי של התנהגות האור המושרה.
Abstract
במחקר של תאי גזע בוגרים ומנגנונים רגנרטיבית, תולעים שטוחות planarian הן מצרך במערכת מודל vivo. הדבר נובע במידה רבה האוכלוסייה ויכולת תאי גזע פלוריפוטנטיים בשפע שלהם כדי להתחדש כל סוגי תאים ורקמות לאחר פציעות כי יהיה קטסטרופלי עבור רוב החיות. לאחרונה, planarians זכה לפופולריות כמודל התחדשות עין. היכולת שלהם להתחדש העין כולה (המורכב משני סוגי רקמות: תאי פיגמנט קולטני האור) מאפשר דיסקציה של מנגנוני ויסות התחדשות מערכת הראייה. יש עיניים אבלציה מספר יתרונות על פני שיטות אחרות (כמו עריפת ראש או ניקוב חורים) לבחינת מסלולים ספציפיים העין ומנגנונים, שהחשוב בהם הוא התחדשות התאים היא מוגבלת בעיקר ברקמות העין לבד. מטרת מאמר זה וידאו היא להדגים כיצד להסיר את הכוס האופטית planarian מהימנה מבלי להפריע למוח או רקמות סובבות.טיפול תולעים והתחזוקה של מושבה הוקמה מתואר גם. טכניקה זו משתמשת 31 G, 5/16-inch מחט אינסולין כדי בניתוח לגרוף את הכוס האופטית של planarians משותקת על צלחת קרה. שיטה זו כוללת הן אבלציה עין אחת כפולה, בעיניים התחדשות בתוך 1-2 שבועות, המאפשר מגוון רחב של יישומים. בפרט, בטכניקה זו אבלציה ניתן לשלב בקלות עם מסך (התערבות RNA) תרופתי וגנטי עבור הבנה טובה יותר של מנגנון שיקום וההתפתחות שלהם, תאי גזע עין והתחזוקה שלהם, ותגובות התנהגותיות phototaxic ואת הבסיס הנוירולוגי שלהם.
Introduction
Planarians הם אורגניזם מודל עוצמה לחקר התחדשות גזע בוגרים בתיווך התא. Flatworms המתוק שאינו טפיל אלה להחזיק את היכולת להתחדש כל וכל רקמות חסרות, כוללים מערכת המוח 1 העצבים המרכזיים שלהם. למד לאחור ככל ה -1700 2, ההתקדמות הטכנולוגית בתחום planarian במהלך 10-15 השנים האחרונות (כגון הגנום רצף, הכלאה באתרו, אימונוהיסטוכימיה, התערבות RNA (RNAi), ו transcriptomics) עדכנת אורגניזם מודל היסטורי זה . באופן ספציפי, planarians צבר פופולריות לאחרונה כמודל המתעורר למחקר עין 3.
יש Planarians עיניים אב-טיפוס עם רק שני סוגי רקמות, הנוירונים קולטי האור ותאי הפיגמנט; זו אפשרה את האפיון של האוכלוסייה בתאי גזע העין שלו והוכיח כי רבים מן הגנים באותו ויסות דה העין החולייתניםvelopment שמורה ב planarians 4, 5. הכוסות האופטיות ממוקמות dorsally ובהשתתפות הדנדריטים הלבן, חסר הצבע של נוירונים קולטי האור ואת תאי הפיגמנט שחור למחצה ירחיים, והעיניים המעצבבות את המוח באמצעות תצלובת ראייה. בנוסף להיות מודל הבהרת תהליכי התחדשות 6, עין planarian היא גם מתאימה ללימוד האבולוציה של מנגנוני ויזואלית 7, תגובות התנהגותיות אור (planarians להציג phototaxis השלילית) 8, ואת הבסיס הנוירולוגי של התנהגות 9.
התחדשות Eye ב planarians נחקרה בעיקר בשני הקשרים עיקריים: כחלק התחדשות הראש בעקבות עריפת 4, 10, ובעקבות כריתה של ממש ברקמות העין 11, 12 . רוב מחקרי planarian על התחדשות עין השתמשו בשיטת עריפת הראש, כפי שהוא הוא פשוט וברור. שיטת כריתת עין planarian הנפוצה ביותר עד כה הייתה באמצעות ניקוב חורים עם צינור נימי זכוכית עדינה 13, 14, אם כי מחקרים מסוימים גם בצעו קטיעות ממש מאחורי העיניים (עריפה חלקית) 15. עם זאת, כל השיטות הללו כרוכות באובדן רב ברקמות אחרות מאשר רק את העין (כגון מוח, מעיים, ואת nephridia), פוטנציאל סיבוך פרשנות של תוצאות. פרוטוקול אבלציה העין המוצג כאן מגביל כריתה לרקמות העין (למעט במפורש המוח), וכתוצאה מכך נתונים ספציפיים יותר לעין. בנוסף, בניגוד תולעים ערופות כי לקחת 7-14 ימים כדי להתחיל האכלה, תולעי ablated עין יאכילו בתוך 24 שעות של אבלציה 12, המאפשרים ניסויי RNAi (שם RNAi מועבר באמצעות מזון) כדי להיות performed במקביל.
למרות אבלציה עין היא קשה מבחינה טכנית לבצע בהצלחה מ עריפת הראש, המחקרים נוכחיים המעורבים כריתת עין לא כללו הוראות מפורטות לגבי הנהלים שלהם. מטרת מאמר זה וידאו היא לאפשר לחוקרים להסיר את הכוס האופטית planarian בעקביות מבלי להפריע רקמות המוח הבסיסיות וסרים כמו כמה רקמות אחרות ככל האפשר. שיטה זו יכולה לשמש הן אבלציה עין אחת כפולה והוא ישים למגוון רחב של חקירות. כמו רוב מבחני התחדשות, אבלציה עין מתאימה גם עבור שילוב עם שתי תרופתי וגנטי (RNAi) מסך, כמו גם מחקרים התנהגותיים. כאן אנו מתארים שיטות לטיפול תולעים, שמירה על מושבת planarian, ואת טכניקת אבלציה העין עצם.
Protocol
1. התרבות טיפול בבעלי חיים
הערה: פרוטוקול זה משתמש Schmidtea Mediterranea, זן planarian דיפלואידי עם הגנום רצף 16, 17, כי הוא נפוץ למחקר התחדשות. עם זאת, assay הוא פחות מוצלח עם מינים אחרים, כגון Girardia tigrina ו Girardia dorotocephala (אשר זמינים מסחרית).
- לשמור תולעים "מי תולעת" עשויים מלחי ים 0.5 g / L ב ultrapure (או יונים מסוננים) מים. השתמש מכלות פוליפרופילן או זכוכית סטרילית כדי להחזיק את מי תולעת. ראה משלים קובץ 1 לפרטים על הכנת מי תולעת.
הערה: אין להשתמש בסבון לניקוי מכולות (או אספקה אחרת) כמו סבון רעילה תולעים; במקום לנגב עם 70% אתנול ו ולאפשר לאוויר יבש.- יש להשתמש בכפפות בעת עבודה עם planaria כדי להגן עליהם מפני זיהום.
הערה: תולעים רגישים מאוד רעלים סביבתיים כימיקלים, כולל סבון, אקונומיקה, שמפו, מרכך, קרם ביד.
- יש להשתמש בכפפות בעת עבודה עם planaria כדי להגן עליהם מפני זיהום.
- מושבות בית מכולות מזון פוליפרופילן, עם המכסה נותרות פתוחות חלקית לחילופי אוויר ב ~ 20 ° C (בטמפרטורת חדר). תולעים הניסיונות חנות או בצלחות פטרי (20 תולעים לכל 100 מ"מ צלחת) או שאינם מטופלי צלחות רקמות-תרבות (1 תולעת בכל טוב, צלחות 12-היטב). כדי להפחית את הלחץ, לשמור על שני המושבות וניסויים בחושך.
הערה: מושבות צריכות להיות לא יותר מ 500-1,000 תולעים לליטר מי תולעת. בניסויים, לעזוב עפעפיים באופן מלא במקום, שכן זרימת האוויר נועדה לתוך הכלים האלה. - Feed תולעים הלא ניסיוניים אחת לשבוע עם בשר בקר מחית אורגני או כבד עוף על ידי הטלת רסק מן טפטף העברה, הצבת טיפות של מזון לאורך כל המכל. אפשר תולעים 2 h לצרוך מזוןחשוך לפני הניקוי מתוך מיכל (ראה שלב 1.4). לפני השימוש, רסק ולאחסן ב -20 מעלות צלזיוס למשך לטווח קצר (שבועות) או -80 מעלות צלזיוס למשך לטווח ארוך (חודשים); אל תקפיאו רסק לשימוש חוזר (כמו חיידקים עלולים לפרוח ולפגוע תולעים).
הערה: הכבד יכיל שום הורמונים או אנטיביוטיקה ועדיפה לא יוקפא בעבר. פירה צנטריפוגה לפני ההקפאה (או לפני האכלה) להסיר אוויר ולמנוע מזון צף. מזון צריך לשקוע בתחתית המיכל. 1 המ"ל של מחיה מספיק 500-1,000 תולעים. - מי Exchange פעם בשבוע עם מי תולעת טריים הוא מושבות וניסויים. מכולות קולוני צריך גם להימחק למטה עם מגבת נייר מולבן (כדי להסיר שאריות הריר כי פסולת מלכודת) פעם בשבוע במשך הרעבה תולעים, או פעמיים בשבוע במשך תולעים האכלה (2 שעות לאחר האכלה ושוב 2 ימים לאחר מכן). על מנת לשמר את ביופילם, לא לנגב יותר מ -80% של מיכל.
- זז תולעים בין מכולות (או Setu ניתוחp) בעזרת פיפטה העברה. כדי תולעים חינם דבקו משטחים מיכל, להשפריץ מים על פני / מאחורי התולעת לשחרר אותו מפני השטח. בשלב הבא יש לשאוב את התולעת לתוך פיפטה, בעת שניסתה לשמור את התולעת בתוך אינץ התחתון (מדלל) החלק של פיפטה.
- טפטפות Backload עם כמות קטנה של מי תולעת לפני מתחנף אליהם.
- נסו להזיז את המים סביב התולעת, ולא את התולעת עצמה, כדי למנוע קריעה תולעים רכי-גוף ידי נגיעה בהם עם טפטפת.
- שמור מנות ניסיוני הכלולים אלא העברת תולעים או החלפת מים.
2. הכנה
- להפסיק להאכיל תולעים לפחות שבוע לפני ניסויים.
- בחר תולעים כי כבר לא הוזנו עבור ≥1 בשבוע לפחות 5-7 מ"מ אורך. העברת התולעים בצלחת פטרי 2/3 מלאת מי תולעת, ולאשר אורך תולעת ידי זזת שליט מתחת הצלחת. מדוד worms תוך פתוח לגמרי ומרגש.
הערה: בעוד שהם קטנים (5-7 מ"מ) תולעים לעבוד טוב יותר בעת ביצוע immunofluorescence עתידיים הכלאה באתרו מנתח, תולעים גדולים (8-10 מ"מ), קל יותר לעבוד עם - במיוחד כאשר לומדים לקטוע. - ודא כי תולעים הם שלמים, ללא פגע, ולא התחדשות לאחרונה.
הערה: יוצר מחדש תולעים יצטרכו הרבה יותר קל (או לא) הפיגמנט בראש ו / או באזור זנב לעומת תולעים נורמלים. - אם ביצוע RNAi או טיפולים תרופתיים על תולעים, לעשות זאת בשלב זה. אם תולעים הואכלו כחלק הטיפול (כמו עבור RNAi), להמתין לפחות 7 ימים לאחר ההאכלה האחרונה לפני שתמשיך לשלב 2.2.
- בחר תולעים כי כבר לא הוזנו עבור ≥1 בשבוע לפחות 5-7 מ"מ אורך. העברת התולעים בצלחת פטרי 2/3 מלאת מי תולעת, ולאשר אורך תולעת ידי זזת שליט מתחת הצלחת. מדוד worms תוך פתוח לגמרי ומרגש.
- נקה את בסיס מיקרוסקופ המרחב לנתח עבודה עם אתנול 70% ולאפשר לו להתייבש לחלוטין. מניח את הצלחת של תולעים הנבחרת לשמאל של ההיקף. בצד ימין של ההיקף, למקם זוג מלקחיים # 5, 31 G 5/16-inch מחט אינסולין עם 1מזרק מיליליטר, ו פיפטה העברה נקיה.
- ודא כי המכשירים נשמרים מפני נגיעת הספסל (אשר יכול להציג מזהמים). השתמש פריט נוקשה (כגון מנוחה צ'ופסטיק) כדי לשמור על מלקחיים, מחט, ועל פיפטה נקייה. לחלופין, מכשירי מקום על גבי מגבת נייר חומה (מולבן) טריה.
הערה: אלה ובעקבות הנחיות נכתבות כפי שהן נוגעות ליחידים ימניים. אנשים שמאליים צריכים להפוך את כיווני ימין / שמאל.
- ודא כי המכשירים נשמרים מפני נגיעת הספסל (אשר יכול להציג מזהמים). השתמש פריט נוקשה (כגון מנוחה צ'ופסטיק) כדי לשמור על מלקחיים, מחט, ועל פיפטה נקייה. לחלופין, מכשירי מקום על גבי מגבת נייר חומה (מולבן) טריה.
- ליד מקום העבודה, להציב קופסא מגבוני רקמת מוך ללא, מקור מי תולעת טריים, וכמה טפטפות העברה נוספים (מוגנים מלמעלה הספסל). מי תולעת מקום בבקבוק לשטוף פלסטיק כדי להקל על מחלק. כמו כן מניחים צלחת 12-היטב שכותרתו (או 100 מ"מ צלחת פטרי) בצד ימין של היקף לאיסוף חיות ablated.
- אם באמצעות צלחת מחוייט פלטייה לשתק תולעים, למקם את צלחת פלטייה לתוך דיכאון tהוא הבסיס של המיקרוסקופ לנתח ולהתאים את התפוקה על מקור מתח DC עד משטח העבודה של צלחת פלטייה הוא מגניב מספיק (בדרך כלל ~ 5 V) .Alternatively, להפוך צלחת קרה ידי מילוי צלחת 100 מ"מ פטרי ½ מלא במים ולהקפיא עבור h 24 לפחות. מחק את המכסה ומניחים את החלק התחתון של צלחת 100 מ"מ על בסיס של הביתור, ואז למקם את המכסה של צלחת 60 מ"מ פטרי במהופך ישירות על פני השטח של (איור 1 א) קרח.
- לאחר שהמים הקפיאה בצלחת 100 מ"מ, "הר געש" של קרח יכול להופיע במרכז הצלחת. אם זה יקר, להשתמש בסכין גילוח כדי לגרד את דירת הקרח, כדי להסיר כל אי סדרים מפני השטח.
הערה: במהלך ניתוחי הקרח תימס, מה שהופך כריתה הרבה יותר קשה. הכן מספר מנות קרח מראש, ולהחליף אלה מוקפאים להתכה אלה במהלך assay בהקדם את המכסה של צלחת 60 מ"מ מתחיל צף.
- לאחר שהמים הקפיאה בצלחת 100 מ"מ, "הר געש" של קרח יכול להופיע במרכז הצלחת. אם זה יקר, להשתמש בסכין גילוח כדי לגרד את דירת הקרח, כדי להסיר כל אי סדרים מפני השטח.
- הכן אתמשטח ניתוח. חותכים חתיכה 5 ס"מ x 10 ס"מ של הסרט פרפין פלסטיק (4 ס"מ 2 אם באמצעות צלחת פטרי צלחת קר) ולמקם אותו על מרכז המכשיר וקיבוע. מקפלים רקמה נטולת סיבים לנגב לתוך הכיכר בערך 2 ס"מ 2 ולמקם אותו על גבי הסרט. חותכים חתיכה של 1.5-2 נייר לבן מסנן ס"מ 2 ולמקם אותו על גבי לנגב. ראה איור 1B-1E.
- החזק את מקופל לנגב במקום באצבע בכפפות, ולהשתמש במים תולעת כדי לחלח לנגב כדי להבטיח שהוא נשאר מקופל. השתמש בצד של טפטפת העברה לגלגל את לנגב שטוח.
הערה: טמפרטורה קרה עוזרת לשמור תולעים לנוע. "יבש" עבודה גם מסייע וקיבוע. הרקמה לנגב מעשי פתיל מים דרך נייר הסינון, שמירה על התולעת לחה במהלך הניתוח מבלי לאפשר תולעים להתייבש לחלוטין (וזה קטלני).
- החזק את מקופל לנגב במקום באצבע בכפפות, ולהשתמש במים תולעת כדי לחלח לנגב כדי להבטיח שהוא נשאר מקופל. השתמש בצד של טפטפת העברה לגלגל את לנגב שטוח.
3. אבלציה כירורגית
- השתמש פיפטה העברת למקם עלדואר גב תולעת בצד למעלה על נייר הסינון. הפעל את מקור האור ולכוון את goosenecks כך שהאור מתמקד התולעת. התאם את מיקוד ביתור וגדל כך בעיני הם נראים בבירור (התולעת כולו אינה צריכה להיות נוכח); הגדלת 5X היא נקודת התחלה טובה. אוריינט התולעת ידי סיבוב סרט פרפין, כך שהראש הוא הצביע לעבר החוקר (לכיוון החלק הקדמי של מיקרוסקופ), זווית 30-40 מעלות ימינה.
- הימנע משימוש אור הבהיר כדי למנוע תנועת תולעת עודפת. Planarians להציג phototaxis שלילי ינסה להתחמק אור בהיר.
- אם את התולעת ממוקמת בצד גחון כלפי מעלה (עם בלוע הפתיחה גלוי), להשתמש בצד הקהה של המלקחיים כדי למקם את הצד הגבה תולעת בעדינות עד (בעיניים גלויות). הימנע מתקרבים החיה עם קצה חד של מלקחיים כדי למזער את הסיכוי לקרוע דרך רקמות רכות כאשר למקם מחדש את החיה.
- התאם את המיקוד מיקרוסקופ כך שהעיניים הן בבירור בפוקוס. כמו כן להבטיח כי הן בעיניים ורקמות ראש שמסביב נמצאות בתצוגה.
- החזק מחט / מזרק טרי ביד ימין כאילו היו עט (בין האגודל והאצבע המורה). Brace האגודל עזב נגד צלחת פלטייה (או צלחת פטרי צלחת קרה), ולהשתמש האגודל השמאלי כמנוף שעליה החלק התחתון של המזרק ינוח (איור 2 א). להסתכל דרך מיקרוסקופ, ולוודא השיפוע של המחט גלוי.
הערה: מחטים חדות ביותר. היה זהיר בעת טיפול בהם. לבישת כפפות לטקס או ניטריל יכול להציע הגנה מסוימת.- השתמש האגודל עזב כדי לעזור להחזיק את המחט / מזרק קבועה לאורך כל ההליך ולהימנע לוחצים ידיים.
- הפוך בזווית של כ 40 מעלות עם האגודל השמאלי באצבע מורה שמאלית (עם אצבע המורה על משטח הניתוח) כדי להחזיק את סטאבילה משטח ניתוח.
- עםשיפוע של המחט פונה כלפי מעלה (כמו כפית), למקם את המחט בזווית ישרה אל העין (איור 2B). השתמש קצה המחט לחדור השכבה הדקה של רקמה בעדינות שמעל הכוס האופטית (לבן, באזור חסר צבע) של העין, גורף מימין לשמאל. מאוד בעדינות להסיר את כל רקמת פיגמנט ממוקמת בתוך הכוס האופטית, נזהר שלא לנקב את התחתית או להרוס את הגבולות של הכוס האופטית.
- אם התולעת כבר על הנייר המסנן> 1-2 דקות בכל נקודה במהלך ההליך, להוסיף טיפה אחת של מי תולעת רעננותם את התולעת.
הערה: ההתייבשות תגביר את הרגישות של התולעת לפציעות קריעה.
- אם התולעת כבר על הנייר המסנן> 1-2 דקות בכל נקודה במהלך ההליך, להוסיף טיפה אחת של מי תולעת רעננותם את התולעת.
- חזור על שלב 3.3 עד שכל הרקמות פיגמנט השחורות (תאי הפיגמנט), כמו גם את כל הרקמות הלבנות של הכוס האופטית (דנדריטים של תאי קולטי האור), יוסר. הסר רקמות ניכרות תקועות עד הסוף של המחט על ידי מנגב בזהירות עם רקמות לנגב. אם עבלה עין כפולהtion הוא רצוי, לקטוע את העין השנייה בנקודה זו.
הערה: כדי למנוע פציעה, מחטים ניתן לנקות על-ידי אחיזת המחט עם טישו נקי לנגב שנערך עם האגודל לאצבע, ולאחר מכן באמצעות המצד השני למשוך את המחט דרך למחות מן האגודל לאצבע. לחלופין, את המחט יכולה להימחק על גבי המשטח של רקמות מגבון ובחנה לניקיון. - בסיום, השתמש פיפטה העבירה להזיז את התולעת לצלחת שכותרתו המכילה מי תולעת טריים. אם לנתח את נתוני קבוצות, למקם עד 20 תולעים בצלחת פטרי יחיד 100 מ"מ. אם מעקב התחדשות באותו אנשים לאורך זמן, מקום 1 תולעת לבאר כל צלחת 12-היטב. לאחר שכל התולעים מועברים, לשטוף תולעים על ידי הסרת כל מי התולעת מן המנות / בארות והחלפת מי תולעת טריים יותר.
- כדי להסיר תולעים מהמסנן, backload פיפטה עם כמות קטנה של מי תולעת ולשחרר את המים על התולעת. זה אמור להרים tהוא תולעת מהנייר המסנן, להישאב מייד אל פיפטה עבור העברה.
- דגירת ניסויים ב ~ 20 ° C (בטמפרטורת חדר) מוגן מפני אור ובצע את תהליך ההתחדשות.
הערה: ניתן לאחסן תולעי חממת טמפרטורה מבוקרת כדי לשמור על טמפרטורה קבועה, אבל זה לא הכרחי. רוב הטמפרטורות בחדר להשתנות רק על ידי 5 מעלות צלזיוס, אשר לא תשפיע על היכולת של התולעת כדי להתחדש. - אם תרצה, לתקן תולעים אימונוהיסטוכימיה (ראה איורים 3-4) ו / או הכלאה באתרו מנתח של ביטוי גנים. שיטות קיבוע שונות קיימות אימונוהיסטוכימיה planarian 18, 19, 20 ו כלאה באתרו 21, 22, 23 פרוטוקולים.
- כאשר הניסויים סיכם, sacrifiCE לחיות תולעים ידי הסרת מי תולעת מצלחת והחלפה עם 70% אתנול. דגירה תולעים במשך 3-5 דקות, בדיקת תולעים כדי lyse ולהפוך אפרפר.
- מניחים תולעים שאינם מטופלים בזרם הפסולת הרגילה הקריב פעם. הימנע מציגה תולעים חיות לסביבה, במיוחד מינים לא מקומיים.
תוצאות
עבור ניתוח 1-2 שעות לאחר הראשונה, חיות עשויות להפגין ירידה בתנועה לעומת תולעים שלמים (אולם הם עדיין יעברו). אם תרצה, תולעים יאכלו בתוך 24 שעות של ניתוח (למשל, עבור האכלת RNAi). כאשר בעקבות התחדשות עין באותו אנשים לאורך זמן, הקפד לצלם כל תולעת הן לפני הניתוח (שלמים) ובבית 1 שעות לאחר אבלציה (hPa). עד 4 ימים לאחר אבלציה (DPA) תאי הפיגמנט התחדשות צריכים להיות גלויים, ועל ידי 14 DPA העין כולו תהיה מחדש לחלוטין (איור 3A-B). זה כולל את הנוירונים קולטי האור ואת העצבוב שלהם למוח (איור 3 ג), כמו גם התאוששות תפקודית של מערכת הראייה (איור 4A-C). כריתה מוצלחת לא תפריע הרקמות הבסיסיות של המוח (איור 4D-E), ולא להציג פציעות שניות (איור 5 א) בעלי החיים. כריתה מוצלחתלכלול חיות עם: כריתה גדולה מדי שמחבר בין שתי העיניים (איור 5), קרעים בשולים לרוחב של החיה (איור 5 ג), ו / או אתרי פצע כי לתקוע דרך האפידרמיס הגחון (איור 5D). יתר על כן, כריתה לא מוצלחת כוללת הסרה שלמה של הכוס האופטית כולו, מורכבת הוא הרקמות חסרות צבע לבן והתאים פיגמנט השחורים (איור 5E-F).

איור 1: הכנת כירורגיה. (א) תרשים של בניית צלחת קרה, באמצעות חלק התחתון של צלחת 100 מ"מ פטרי (מלא קרח) ואת המכסה של צלחת 60 מ"מ פטרי (הודבקה במהופך על משטח הקרח). (ב) תרשים של משטח הניתוח, עשוי ערימה של (מלמעלה למטה) נייר מסנן לבן, דק מקופל לחה לנגב, ועל פיסת סרט פרפין.(ג) ניתוח להגדיר (עבור ימניים). ת: ביתור, B: תאורה מתכווננת, C: משטח ניתוח, D: צלחת פלטייה, E: צלחת של תולעי 5-7 מ"מ מוכנה אבלציה, F: לשטוף בקבוק תולעת מים, G: שאר מקל מחזיק פיפטה העברה נקיה, H: שאר מקל מחזיק מחט / מזרק, ואני: שאר מקל מחזיק מלקחיים, J: מכל של טפטפות העברה נוספת. (ד) תצורת צלחת Custom פלטייה. (E) פטרי צלחת תצורה קרה צלחת. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.

איור 2: תנוחת הידיים ואת מחט / מזרק במהלך אבלציה. (א) מיקום של הידיים (עבור ימניים). שים לב האגודל עזב משמש לתמיכת המזרק (שנערךביד ימין) כדי למזער את התנועה. (ב) המיקום של המחט ביחס העין של התולעת. שים לב השטח המשופע של המחט פונה כלפי מעלה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
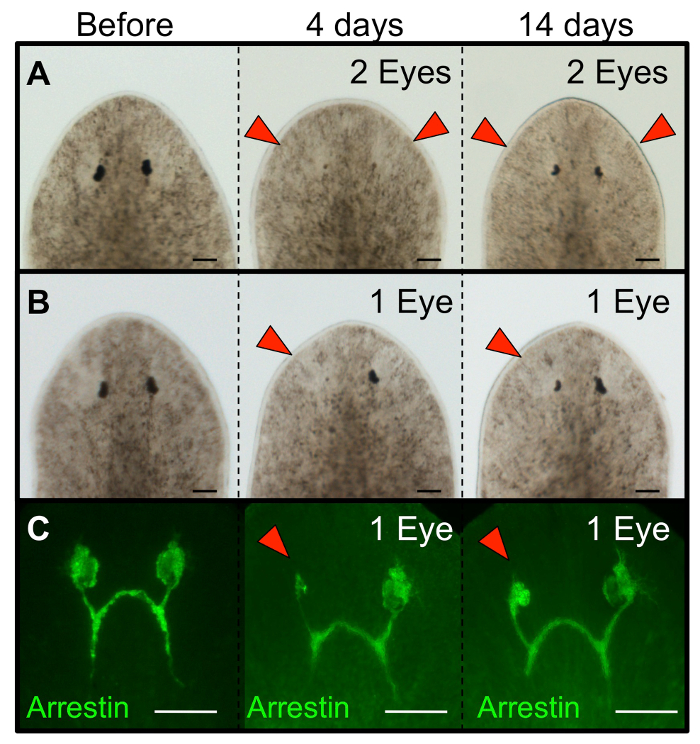
איור 3: ablated עיני planarian להתחדש. מורפולוגיה של Schmidtea Mediterranea planarians שחזר לגדול עיניים הבאות (א) אבלציה עין כפולה (B) אבלציה עין האחת. (ג) אימונוהיסטוכימיה מראה התחדשות של תאי עצב קולטי האור (-arrestin אנטי) בעקבות אבלציה עין אחת. תולעי Intact מוצגים לפני הניתוח, ומחדש מוצגים בימים 4 ו 14 לאחר אבלציה. עבור כריתת עין אחת, העין השמאלית הייתהblated ואת העין הימנית משמשת בקרה פנימית (ללא פגע). ראשי חץ אדום: עיני ablated. ברים בקנה מידה = 100 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
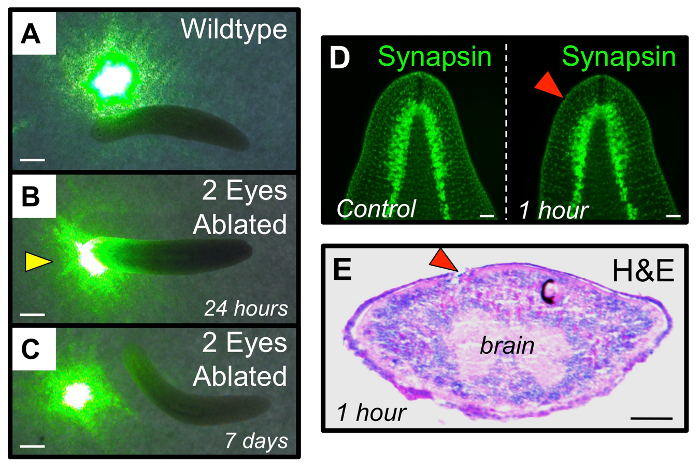
איור 4: התאוששות תפקודית של מערכת הראייה לאחר אבלציה. (A - C) assay פונקציונלית לבדוק פוטופוביה planarian. (א) תולעים Intact למנוע נסיעה דרך אזורים של אור, כמו כתם מן מצביע לייזר ירוק. (ב) אבלציה פוסט 24 h, "עיוורים" תולעי ablated עין כפולה לנסוע דרך כתמי אור. (ג) בשעה אבלציה 7 ימים פוסט, תולעים ablated העין זוגיים יש מחדש מערכת הראייה שלהם מספיק כדי להתאושש הימנעות אור. ראש חץ צהוב: התנהגות חריגהבתגובה אל. (D - E) אבלציה Eye מוגבלת הרקמות של הכוס האופטית, ואינו מפריעה ברקמות המוח הבסיסיות. (ד) אימונוהיסטוכימיה ארכיטקטורת המוח (אנטי synapsin) היא ללא שינוי מלפני אבלציה כדי 1 h אבלציה פוסט. (E) Hematoxylin ו eosin (H & E) מכתים אבלציה 1 h פוסט בקטע רוחבי מראה ניזק מוגבל במידה רבה לאתר של הכוס האופטית ablated. עין ימין (עם תאי הפיגמנט שחורים) משמשת בקרה פנימית. ראשי חץ אדום: עיני ablated. ברי סולם = 1 מ"מ (AC) 1 מ"מ, 100 מיקרומטר (DE). אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
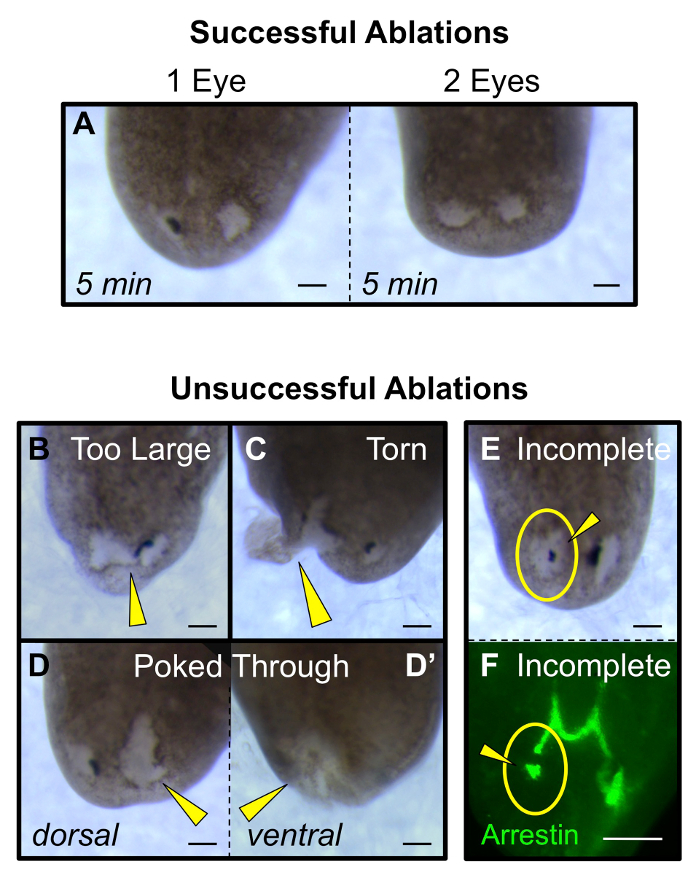
איור 5: מסימני היכר של כריתה מוצלחת ולא מוצלחת. (א) מוצלחת כריתת עין אחת כפולה (ב 5 אבלציה פוסט דקות) יש פצעים כי הם בערך בגודל דומה הכוס האופטית המקורית. (B - E) כריתה נכשלה: (B) מדי רקמה יוסר או הפצע שמחבר בין שתי העיניים, (ג) את הדמעות באתר הפצע והוא משתרע על השוליים, (ד) הפצע הוא עמוק מדי ודוקרת דרך מן הגבה (D) אל הגחון (ד") בצד, ואת (E - F) לא כל רקמות הכוס האופטיות מוסרים, דמיין שתי מורפולוגית (E) ועל ידי מכתים אנטי-arrestin של נוירונים קולטי האור (F). ראשי חץ צהוב: כריתה סוטה. עיגולים צהובים: אתר אבלציה. ברים בקנה מידה = 100 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
Discussion
טכניקת עין אבלציה זה משפרת על השיטות הקיימות (כגון ניקוב חורים) על ידי לא כולל רקמות המוח הגבלה כריתה בעיקר ברקמות העין. בעזרת תרגול, טכניקה זו יכולה להתבצע על ידי רוב האנשים, מטכנאים מנוסים microsurgeries לסטודנטים לתואר ראשונים מנוסים אבל מצפון. מומלץ כי הטכניקה הזו להיות מתורגל הרבה פעמים לפני השימוש כריתה בניסויים, כולל (במידת האפשר) אישור של הסרה מלאה של כל רקמות העין על ידי אימונוהיסטוכימיה או הכלאה באתרו עבור סמן העין (ים) 4, 5, 13. השלב הקריטי ביותר בפרוטוקול זה הוא חופנים של רקמות. חשוב לא להסיר או יותר מדי או מעט מדי רקמות. זה יכול להימנע על ידי לא גורף עמוק מדי עם המחט, כדי למנוע חודר דרך לצד הגחון של התולעת. הטיפ של לביתDLE צריך להיות מוכנס רק על 0.4 מ"מ עמוק, והחלק מהשופע של המחט לא צריך ללכת כל הדרך דרך העין. זהירות מיוחדת יש לנקוט כדי לא לפגוע ברקמת שברירי בין שתי העיניים (בקצה המדיאלי של האזור פיגמנט שחור של כל עין מייצג את הגבולות של כל עין). נזק בין העין לבין השוליים דיסטלי של תולעת צריך גם להימנע. תולעים קטנות נוטות יותר לקרוע או להיפצע בכוונה, ולכן שימוש תולעים גדולים (במיוחד לאימון) מומלץ. המגבלות העיקריות של טכניקה זו הן שזה יחסית זמן אינטנסיבי (והוא אינו מתאים מסכי תפוקה גבוהה), וזה דורש השקעה ראשונית בתרגול כדי להבטיח את הדיוק של התוצאות. עם זאת, עם תרגול 10 עיניים ניתן ablated ב ~ 15 דקות.
אזור מרכזי לפתרון עולה בקנה planarians עדיין במהלך ההליך. שני תולעי הסיבות העיקריים לא משותק מספיק כדי לבצע כריתההם (א) מדי מים (ב) אובדן הטמפרטורה הקרה. (א) מי planarian עודפים כי ברכות על פני ניתוחים תוך תולעי העברה ייאפשרו תולעים להזיז לסבך את הניתוח. משטח הניתוח (נטול מוך הרקמות לנגב ולסנן נייר) צריך להישאר לח בלבד. אם בנקודה כלשהי במהלך ההליך לנגב הופך רווי מים תולעת, היא צריכה גם להיות מוחלף או טפטפת העברת שניתן להשתמש בהם כדי להסיר את עודפי הנוזלים בעדינות מרקמת לנגב (תמיד לצייר מן לנגב ולא נייר הסינון). מגבוני רקמות יכולים לשמש גם כדי להסיר הצטברות עודפי מים על פני שטח הניתוח. תהליך זה עשוי צורך לחזור פעמים רבות, תלוי במספר של תולעים להיות ablated. (ב) אם באמצעות צלחת פטרי הצלחת הקרה להגדיר, לזכור להחליף את הצלחת קרתה ברגע שהקרח נמס ומתחיל ואת מכסת צלחת 60 מ"מ פטרי מתחילה לצוף. פעולה זו תבטיח הן משטח ניתוח יציבה משטח קר כראוי. לחלופין, אם באמצעות צלחת פלטייהלהגדיר, להיות מודע לכך לאחר 45 דקות עד 1 שעה של שימוש, ושרב הטבעות החיצוניות יהיו להתגבר על צלחת קרה במרכז וכל הקירור ייאבד. אם זה יקרה, לכבות את צלחת פלטייה למשך 5-10 דקות כדי לאפשר לו להגיע לטמפרטורת החדר לפני חידוש כריתה.
תחום נוסף של פתרון בעיות הוא במהלך העברת תולעת בין המנה ואת משטח הניתוח וחזרתי שוב. אם תולעי ablated קשים להסיר את נייר הסינון, במקום ירידה של מי תולעת על התולעת עד הבריכות הנוזליות על גבי נייר הסינון. תולעים יכולים להישאב אז אל פיפטה העביר כרגיל. אם הבעיות נמשכות, נסה מרפרף את התולעת על הצד הגחון שלה הראשונה (באמצעות הצד הקהה של מלקחיים). אם תולעת נתקעה בתוך פיפטה ההעברה, זה בדרך כלל סימן לכך יותר מדי מים נלקחים למעלה (תולעים צריכים להיגרר העברת פיפטה רחוק יותר מאשר על אינץ). כדי להסיר תולעת התקועה טפטף העברה, להכין 1-2 מיליליטר של תולעת ואטאה אל פיפטה, כך התולעת מכוסית במים. היטב קפיצי בצד של פיפטה עד תולעת מנתק מהקיר של פיפטה והוא צף.
אם המחט הופכת משעממת, להחליף עם מחט / מזרק חדש. שקול להחליף את המחט לאחר השימוש בו כדי לקטוע ≥30 עיניים. הסרה מוגזמת של רקמות כריתה ידי מנגב עם רקמת לנגב יכול גם משעמם המחט, מה שהופך כריתה יותר קשה. זה בסדר אם רקמות כריתה להישאר בתוך החלק המעוגל של המחט לאורך ההליך (אפילו על פני בעלי חיים רבים). השתמש תמיד מחט / מזרק טרי בעת שינוי בין התולעים של תנאים שונים (למשל wildtype לעומת תולעי RNAi), כמו גם כאשר מתחיל הפעלות אבלציה חדשות (כלומר בימים שונים).
הטכניקה הכירורגית העין אבלציה זהו אמצעי רב עוצמה כדי לחקור התנהגויות אור המושרה (והבסיס הגנטי ונוירולוגיות שלהם) ב planarians, במיוחדכאשר הוא משולב עם טיפולים תרופתיים או התערבות RNA. אבלציה Eye היא גם אמצעי נהדר שבאמצעותו מנת להבהיר את המנגנונים מווסתים התחדשות עין planarian אנדוגני (ותחזוקת תא עין גזע והתמיינות) in vivo. כמו רוב בעלי החוליות יש יכולות מוגבלות מאוד כדי לחדש רקמות העין, ההבנה כיצד planarians מסוגלים להתחדש עיניהם יהיה חשוב בזיהוי מנגנונים אפשריים לתרגום טיפולים בעתיד.
Disclosures
החוקרים אין לחשוף.
Acknowledgements
המחברים מבקשים להודות למישל Deochand עבור ושכלול טכניקת אבלציה עין הזאת, טיילור Birkholz לסיוע עם assay התפקודית, מיכאל לוין עבור הנוגדן אנטי-arrestin, ו Junji Morokuma לקבלת מידע על צלחות פלטייה. עבודה זו נתמכה על ידי מענק SFSA מן המערב אוניברסיטת מישיגן WSB.
Materials
| Name | Company | Catalog Number | Comments |
| Instant Ocean sea salts | Spectrum Brands | SS15-10 | "10 Gallon" box (net weight 3 lbs) |
| Kimwipes EX-L lint-free tissue wipe | Kimberly-Clark | 34155 | 4.5 x 8.5 in |
| Whatman #2 filter paper | Sigma | WHA1002125 | Circles, 125 mm diameter, white |
| Easy Touch Insulin syringe (with needle) | Pet Health Market | 17175-04 | U-100 1 cc syringe, 31 G 5/16 in needle |
| 100 mm Petri dish | VWR | 25384-342 | 100 mm x 15 mm |
| 60 mm Petri dish | VWR | 25384-092 | 60 mm x 15 mm |
| Dumont #5 forceps | Fine Science Tools | 11254-20 | Inox, straight tip , 11 cm |
| Transfer pipettes | Samco Scientific | 225 | Graduated, large bulb, 7.5 mL, non sterile |
| Parafilm M paraffin film | Brand | 701606 | 4 in x 125 ft roll |
| 12-well untreated tissue culture plate | VWR | 15705-059 | Untreated, flat bottom, sterile, Falcon brand |
| Plastic food containers (for colony) | Ziploc | Large rectangle | 2.25 qt (2.12 L), 10" x 6 -3/4 " x 3 -3/16" |
| Planaria (Girardia tigrina) | Carolina Biological | 132954 | Sold as "Brown" Planaria; most often they are G. tigrina (aka Dugesia tigrina), but sometimes are G. dorotocephala (aka Dugesia dorotocephala); either will work. |
| Planaria (Schmidtea mediterranea) | n/a | n/a | S. mediterranea are not commercially available. At this time animals are only obtainable from laboratories that use them and have extra animals. |
| Brown paper towels | Grainger | 2U229 | 9-3/16 x 9-3/8" 1-Ply Multifold Paper Towel, UNBLEACHED |
| Wash bottle (for worm water), optional | VWR | 16650-275 | Wash Bottles, Low-Density Polyethylene, Wide Mouth, 500 mL |
| Anti-synapsin antibody, optional | Developmental Studies Hybridoma Bank | 3C11 | Supernatant |
| Anti-arrestin antibody, optional | n/a | n/a | Not commercially available. Kind gift from Michael Levin, Tufts University |
| Nalgene Lowboy carboy with spigot (for storing worm water), optional | Nalge Nunc International Corporation | 2324-0015 | 15 L, polypropylene, low profile makes it easier to fill plastic colony containers |
| Custom Peltier plate, optional | Williams Machine, Foxboro, MA | n/a | Design specifics courtesy of Junji Morokuma, Tufts University: Peltier plate is constructed of a standard thermoelectric heat pump (for example, All Electronics Corp Catalog # PJT-1, 30 mm2). The square heat pump is covered with a thin mirrored surface, then placed inside a 30 mm2 square hole in a circular plexiglass form (~50 mm in diameter). This form is of similar thickness to the heat pump, and fits flush into a well tooled in the center of a round heat sink (~115 mm in diameter). The form/heat pump is "anchored" to the sink with silicone base heat sink compound. The leads are threaded through holes drilled through both the form and the the heat sink. The bottom half of the heat sink is tooled into a "foot" that fits into the opening of your microscope's base plate. |
| DC power source (for Peltier plate), optional | B & K Precision | 1665 | Regulated Low Voltage DC Power Supply, 1-18 V (DC), 1-10 amps. |
| Other common supplies | |||
| Gloves | |||
| Razor blade | |||
| Scissors | |||
| Dissecting scope with gooseneck lighting | |||
| Chopstick rests, optional |
References
- Gentile, L., Cebria, F., Bartscherer, K. The planarian flatworm: an in vivo model for stem cell biology and nervous system regeneration. Dis Model Mech. 4 (1), 12-19 (2011).
- Elliott, S. A., Sanchez Alvarado, A. The history and enduring contributions of planarians to the study of animal regeneration. Wiley Interdiscip Rev Dev Biol. 2 (3), 301-326 (2013).
- Emili Saló, R. B., Tsonis, P. A. Chapter 3. Animal Models in Eye Research. , 15-26 (2008).
- Lapan, S. W., Reddien, P. W. dlx and sp6-9 Control optic cup regeneration in a prototypic eye. PLoS Genet. 7 (8), e1002226 (2011).
- Lapan, S. W., Reddien, P. W. Transcriptome analysis of the planarian eye identifies ovo as a specific regulator of eye regeneration. Cell Rep. 2 (2), 294-307 (2012).
- Inoue, T., et al. Morphological and functional recovery of the planarian photosensing system during head regeneration. Zoolog Sci. 21 (3), 275-283 (2004).
- Pineda, D., et al. The genetic network of prototypic planarian eye regeneration is Pax6 independent. Development. 129 (6), 1423-1434 (2002).
- Paskin, T. R., Jellies, J., Bacher, J., Beane, W. S. Planarian Phototactic Assay Reveals Differential Behavioral Responses Based on Wavelength. PLoS One. 9 (12), e114708 (2014).
- Raffa, R. B., Martley, A. F. Amphetamine-induced increase in planarian locomotor activity and block by UV light. Brain Res. 1031 (1), 138-140 (2005).
- Sandmann, T., Vogg, M. C., Owlarn, S., Boutros, M., Bartscherer, K. The head-regeneration transcriptome of the planarian Schmidtea mediterranea. Genome Biol. 12 (8), R76 (2011).
- Vasquez-Doorman, C., Petersen, C. P. The NuRD complex component p66 suppresses photoreceptor neuron regeneration in planarians. Regeneration (Oxf). 3 (3), 168-178 (2016).
- Deochand, M. E., Birkholz, T. R., Beane, W. S. Temporal regulation of planarian eye regeneration. Regeneration. 3 (4), 209-221 (2016).
- Sakai, F., Agata, K., Orii, H., Watanabe, K. Organization and regeneration ability of spontaneous supernumerary eyes in planarians -eye regeneration field and pathway selection by optic nerves. Zoolog Sci. 17 (3), 375-381 (2000).
- Asano, Y., Nakamura, S., Ishida, S., Azuma, K., Shinozawa, T. Rhodopsin-like proteins in planarian eye and auricle: detection and functional analysis. J Exp Biol. 201 (Pt 9), 1263-1271 (1998).
- Cross, S. D., et al. Control of Maintenance and Regeneration of Planarian Eyes by ovo. Invest Ophthalmol Vis Sci. 56 (12), 7604-7610 (2015).
- Robb, S. M., Gotting, K., Ross, E., Sanchez Alvarado, A. SmedGD 2.0: The Schmidtea mediterranea genome database. Genesis. 53 (8), 535-546 (2015).
- Robb, S. M., Ross, E., Sanchez Alvarado, ., A, SmedGD: the Schmidtea mediterranea genome database. Nucleic Acids Res. 36, D599-D606 (2008).
- Beane, W. S., Tseng, A. S., Morokuma, J., Lemire, J. M., Levin, M. Inhibition of planar cell polarity extends neural growth during regeneration, homeostasis, and development. Stem Cells Dev. 21 (12), 2085-2094 (2012).
- Forsthoefel, D. J., Waters, F. A., Newmark, P. A. Generation of cell type-specific monoclonal antibodies for the planarian and optimization of sample processing for immunolabeling. BMC Dev Biol. 14, 45 (2014).
- Ross, K. G., et al. Novel monoclonal antibodies to study tissue regeneration in planarians. BMC Dev Biol. 15, 2 (2015).
- Cardona, A., Fernandez, J., Solana, J., Romero, R. An in situ hybridization protocol for planarian embryos: monitoring myosin heavy chain gene expression. Dev Genes Evol. 215 (9), 482-488 (2005).
- King, R. S., Newmark, P. A. In situ hybridization protocol for enhanced detection of gene expression in the planarian Schmidtea mediterranea. BMC Dev Biol. 13, 8 (2013).
- Pearson, B. J., et al. Formaldehyde-based whole-mount in situ hybridization method for planarians. Dev Dyn. 238 (2), 443-450 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved