Method Article
수술 절제 분석 플라나리아에 아이 재생을 유학을위한
요약
이 프로토콜은 지속적으로 주변 조직을 방해하지 않고 플라나리아의 눈 (광학 컵)을 절제하는 방법을 보여줍니다. 어느 하나의 인슐린 바늘 및 주사기를 사용 또는 양쪽 눈은 눈의 재생, 영상 재생의 진화, 및 광 - 유도 행동 신경 기초 규제기구에 조사를 용이하게 절제 할 수있다.
초록
성체 줄기 세포 및 재생 메커니즘의 연구에서, 플라나리아 편형 동물은 생체 내 모델 시스템의 주식입니다. 이것은 그들의 풍부한 만능 줄기 세포 인구와 대부분의 동물에 대한 재앙이 될 것입니다 부상 후 모든 세포와 조직 유형을 재생하는 능력에 상당 부분 기인한다. 최근, 플라나리아는 눈 재생의 모델로 인기를 얻고있다. (두 조직 유형으로 구성 : 색소 세포 감광체) 전체에 눈을 재생하는 능력이 재생 시각 시스템을 조절 메커니즘의 절개 허용한다. 눈 박리는 재생 만 크게 눈 조직에 한정된다 가장 중요한있는 눈 특정 경로 및 메커니즘을 조사하는 (예 잘린 또는 펀치 구멍 등의) 다른 기술에 비해 몇 가지 장점이있다. 이 비디오 문서의 목적은 확실하게 뇌를 방해하거나 주변 조직없이 플라나리아 광학 컵을 제거하는 방법을 설명하는 것입니다.웜 확립 콜로니의 유지 보수 처리도 설명된다. 이 기술은 수술 콜드 플레이트에 고정화 플라나리아의 광학 컵을 특종 31 G, 16분의 5 인치 인슐린 바늘을 이용한다. 이 방법은 다양한 애플리케이션을 가능하게 1 ~ 2 주 이내에 재생 눈으로, 단일 및 이중 눈 절제를 포함한다. 특히,이 절제 기술은 쉽게 재생 메커니즘과 진화, 눈 줄기 세포와 그 유지 보수 및 phototaxic 행동 반응과 신경 학적 기초의 더 나은 이해를위한 약물 및 유전자 (RNA 간섭) 화면과 결합 될 수있다.
서문
플라나리아는 성체 줄기 세포 매개 재생 연구를위한 강력한 모델 생물이다. 이 비 기생 담수 편형 동물은 중추 신경계와 뇌의 1을 포함한 모든없는 조직을 재생하는 능력을 가지고있다. (계내 혼성화, 면역 조직 화학, RNA 간섭 (RNAi의) 및 transcriptomics, 이러한 시퀀스 게놈 등)까지 거슬러 과거 10-15 년간 플라나리아 필드 1700 2, 기술적 진보로서 전공이 과거 모델 생물을 업데이트 한 . 특히, 플라나리아는 최근 눈 연구 3에 대한 새로운 모델로 인기를 얻고있다.
플라나리아는 두 조직 유형, 광 수용체 신경 세포와 색소 세포의 전형 눈을 가지고; 이는 눈 줄기 세포 인구의 특성을 활성화하고 동일한 유전자의 많은 척추 동물의 눈 드를 조절 것을 보여 주었다velopment은 플라나리아 4, 5에 보존되어있다. 시신경 컵 등쪽에 위치하고 있으며 광 수용체 뉴런의 흰색, 착색 수상 돌기 및 반 달 검은 색소 세포 구성하고, 눈은 광학 chiasm 통해 뇌에 분포되어있다. 재생 공정 6을 해명하기위한 모델 것에 더하여, 플라나리아 눈 시각기구 (7)의 진화 연구에 적합하고, 행동 반응은 광 (8)과 동작 (9)의 신경 기초 (플라나리아 마이너스 phototaxis 표시).
플라나리아 안구 재생성은 크게 두 가지 상황에서 연구되었다 : 재생 헤드의 일부가 잘린 (4), (10) 아래, 바로 눈 조직의 적출 (11)는 다음과 같이 12 SUP. 이 단순하고 간단 그대로 눈의 재생에 대부분의 플라나리아 연구는 잘린 방법을 사용했다. 일부 연구는 단지 눈 (잘린 부분) (15) 뒤에 절단을 수행하고 있지만 현재까지 가장 흔한 플라나리아 눈 절단 방법은, 미세 유리 모세관 튜브 (13), (14)와 펀치 구멍을 통해왔다. 그러나, 이러한 방법의 모든 잠재적 결과의 해석을 복잡하게, (뇌, 내장, 그리고 nephridia 등) 만 눈이 아닌 다른 많은 조직의 손실을 포함한다. 여기에 제시된 눈 박리 프로토콜 눈에 더 구체적인 데이터의 결과 (특히 뇌 제외) 안구 조직에 절제를 제한한다. 또한, 공급 시작 7-14 일이 소요될 참수 웜 달리 눈 절제 웜 performe 될 (RNAi의 음식을 통해 제공되는)의 RNAi 실험을 가능하게 박리 (12)의 24 시간 이내에 사료 것d를 동시에.
눈 절제가 성공적으로 잘린 것보다 수행 할 기술적으로 어렵게하지만, 눈 절제술을 포함하는 현재의 연구는 그 절차에 대한 자세한 지침을 포함하지 않았습니다. 이 비디오 문서의 목적은 지속적으로 기본 뇌 조직을 방해하고 가능한 한 적은 수의 다른 조직을 제거하지 않고 플라나리아 광학 컵을 제거하기 위해 연구자 수 있도록하는 것입니다. 이 방법은 단일 및 이중 눈 제거에 사용 및 조사의 넓은 범위에 적용 할 수 있습니다. 가장 재생 분석처럼 눈 박리 잘 약리 유전 (RNAi의) 스크린뿐만 아니라 행동 연구 모두의 조합에 적합하다. 여기에서는, 웜의 취급 방법을 기술 플라나리아 콜로니를 유지하고, 눈 박리 법 자체.
프로토콜
1. 동물 문화와 처리
참고 :이 프로토콜은 Schmidtea의 MEDITERRANEA, 일반적으로 재생 연구에 사용되는 시퀀스 게놈 (16), (17)와 이배체 플라나리아 종을 사용합니다. 그러나, 분석은 Girardia의 tigrina 및 Girardia의 dorotocephala (이 상업적으로 사용할 수있는)와 같은 다른 종과 동등하게 성공적이다.
- 초순수 (또는 여과 탈) 물에 0.5 g / L의 바다 염으로 만든 "웜 물"웜을 유지한다. 웜 물을 유지하기 위해 멸균 폴리 프로필렌 또는 유리 용기를 사용합니다. 참조 보충 파일 1 웜 물 준비에 대한 자세한 내용을.
참고 : 비누와 같은 용기 (또는 기타 소모품) 청소 비누를 사용하지 마십시오 벌레에 독성; 대신 70 % 에탄올로 닦아 자연 건조 할 수 있습니다.- 오염으로부터 보호하기 위해 planaria와 함께 작업하는 동안 장갑을 착용 할 것.
참고 : 웜은 비누, 표백제, 샴푸, 컨디셔너, 핸드 로션을 포함한 환경 독소와 화학 물질에 매우 민감하다.
- 오염으로부터 보호하기 위해 planaria와 함께 작업하는 동안 장갑을 착용 할 것.
- 뚜껑 프로필렌 식품 용기 하우스 콜로니 ~ 20 ℃ (실온)에서의 공기 교환을 위해 부분적으로 열려. 페트리 접시에 보관하거나 실험 웜 (100mm의 접시 당 20 개 벌레) 또는 비 처리 된 조직 배양 플레이트 (12- 웰 플레이트 웰 당 1 개 웜). 스트레스를 줄일 어둠 속에서 모두 식민지와 실험을 계속합니다.
참고 : 식민지가 웜 물 리터 당 최대 500 ~ 1,000 이상의 웜이 있어야합니다. 공기 흐름이 이러한 요리로 설계되어 있기 때문에 실험을 위해, 완전히 자리에 뚜껑을 둡니다. - , 전송 피펫에서 퓌레를 삭제 컨테이너에 걸쳐 음식의 방울을 배치하여 퓌레 유기 쇠고기 또는 닭고기 간장과 일주일에 한 번이 아닌 실험 벌레 피드. 에서 음식을 소비하는 웜 2 시간 허용용기를 청소하기 전에 어두운 (단계 1.4 참조). 장기 (개월)에 대한 C °, 매장 단기 (주)에 대한 -20 ° C에서 퓌레 또는 -80 사용하기 전에; (박테리아가 꽃과 벌레에 문제를 야기 할 수 있습니다로) 다시 사용하기 위해 퓌레를 재 냉동하지 않습니다.
참고 : 간 더 호르몬이나 항생제를 포함되어야 바람직 이전에 냉동 수 없습니다. 원심 분리기로 이전 냉동 퓨레 (또는 이전에 공급)은 공기를 제거하고 유동에서 음식을 방지 할 수있다. 식품 용기의 바닥에 침몰한다. 퓌레 1 ㎖는 500-1,000 웜 충분하다. - 식민지와 실험을 모두 신선한 웜 물을 일주일에 한 번 교환. 콜로니 용기도 표백 종이 타월로 닦여한다 (점액 잔류 물을 제거하기 위해 포획 폐기물) (공급하고 다시 2 일 후 2 시간 후에) 공급 웜 회 주 웜 배고파 또는 일주일 번. 바이오 필름을 유지하기 위해, 컨테이너의 80 % 이상을 닦지 마십시오.
- 용기 (또는 수술 세투 사이에 벌레를 이동P) 반송 피펫을 사용. 용기 표면에 부착 된 무료 웜에, 표면에서 분리 웜 뒤에 /를 통해 물을 분출. 피펫의 바닥 인치 (얇은) 부분에서 벌레를 유지하는 동안 그런 다음, 피펫에 벌레를 빨아.
- 그들을 빨아 전에 웜 소량의 물과 Backload 피펫.
- 피펫으로 터치하여 부드러운 바디 웜을 찢어 방지하기 위해, 오히려 웜 자체보다, 웜 주위에 물을 이동하려고합니다.
- 웜을 전송하거나 물을 교체하지 않는 한 덮여 실험적인 요리를 유지합니다.
2. 준비
- 이전 실험에 벌레에게 최소 1 주일 공급 중지합니다.
- ≥1 주 동안 공급과 길이가 적어도 5-7mm입니다하지 된 웜을 선택합니다. 웜 물이 가득 페트리 접시 2/3로 웜을 전송하고, 접시 아래 통치자를 밀어 웜의 길이를 확인합니다. 승 측정ORMS는 동안 완전히 확장 및 이동.
참고 : 다음 면역 및 현장 하이브리드 분석에 큰 벌레 (8-10mm)를 수행하는 작업을 쉽게 할 때 작은 (5~7mm) 웜이 더 잘 작동하는 동안 - 특히 브레이션 학습. - 웜, 전체 손상되지 않은, 최근 재생하지 있는지 확인합니다.
참고 : 일반 웜에 비해 재생성 벌레는 머리와 / 또는 꼬리 지역에서 훨씬 가볍고 (또는) 안료를해야합니다. - 웜에 RNAi의 또는 약물 치료를 수행하는 경우,이 시점에서 그렇게. 벌레는 처리 (RNAi를위한 등)의 일부로서 공급 된 경우, 2.2 단계로 진행하기 전에 7 일 이상 지난 후에 공급 기다린다.
- ≥1 주 동안 공급과 길이가 적어도 5-7mm입니다하지 된 웜을 선택합니다. 웜 물이 가득 페트리 접시 2/3로 웜을 전송하고, 접시 아래 통치자를 밀어 웜의 길이를 확인합니다. 승 측정ORMS는 동안 완전히 확장 및 이동.
- 70 % 에탄올로 작업 공간 및 해부 현미경 기반을 청소하고 완전히 건조 할 수 있습니다. 범위의 좌측에있는 선택 벌레의 접시를 놓습니다. 범위의 오른쪽 16분의 5 인치 인슐린 바늘 1과 # 5 포셉 한 쌍의 31 G 배치ml 주사기, 깨끗한 전송 피펫.
- 악기가 벤치를 (오염 물질을 소개 할 수있는)에 접촉 유지되어 있는지 확인합니다. 깨끗한 포셉, 바늘과 피펫을 유지하기 위해 (예 : 젓가락 받침대로) 단단한 항목을 사용합니다. 또한, 신선한 브라운 (표백) 종이 타월 위에 자리 악기.
주 :이 오른 손잡이 개인과 관련된 이러한 후속 지침이 기록됩니다. 왼손잡이 개인은 좌 / 우 방향을 반대로한다.
- 악기가 벤치를 (오염 물질을 소개 할 수있는)에 접촉 유지되어 있는지 확인합니다. 깨끗한 포셉, 바늘과 피펫을 유지하기 위해 (예 : 젓가락 받침대로) 단단한 항목을 사용합니다. 또한, 신선한 브라운 (표백) 종이 타월 위에 자리 악기.
- 다음 작업 공간에 보풀이없는 조직 와이프의 상자, 신선한 웜 물 소스, 그리고 (벤치 위에서 보호) 몇 가지 추가 전송 피펫을 배치합니다. 분배의 편의를 위해 플라스틱 세척 병에 넣어 웜 물. 또한, 절제된 동물을 수집하는 범위의 오른쪽에 표지 된 12 웰 플레이트 (또는 100mm 배양 접시)를 배치했다.
- 주문품 펠티어 플레이트를 이용하여 웜을 고정하는 경우, t의 우울증에 펠티에 판 위치그는 해부 현미경의베이스와 펠티어 플레이트의 작업 표면이 충분히 냉각 될 때까지 DC 전원의 출력을 조정합니다 (일반적으로 5 ~ V) .Alternatively, ½ 물을 가득 100mm 배양 접시를 작성하여 냉각 판을 적어도 24 시간 동안 동결. 뚜껑을 폐기하고 해부의베이스에 100mm 접시의 바닥에 배치 한 다음 얼음 (도 1a)의 표면에 직접 거꾸로 60mm 페트리 접시에 뚜껑을 배치했다.
- 물이 100mm 접시에 냉동 후, 얼음의 "화산"판의 중심에 나타날 수 있습니다. 이 경우, 표면에서 어떤 부정을 제거하기 위해, 얼음 평면을 긁어 면도날을 사용합니다.
참고 : 수술 중 얼음이 녹아 훨씬 더 어려운 절제를 만드는 것입니다. 사전에 여러 얼음 요리를 준비하고, 즉시 60mm 접시의 뚜껑을 떠 시작으로 분석하는 동안 사람을 용해하기위한 냉동 사람을 대체합니다.
- 물이 100mm 접시에 냉동 후, 얼음의 "화산"판의 중심에 나타날 수 있습니다. 이 경우, 표면에서 어떤 부정을 제거하기 위해, 얼음 평면을 긁어 면도날을 사용합니다.
- 준비합니다수술면. 파라핀 플라스틱 필름의 5cm X 10cm 조각 컷 (4cm 2 경우 페트리 접시 콜드 플레이트를 사용) 및 고정 장치의 중앙에 배치. 보풀이없는 조직을 접어 사각형 약 2cm 2로 닦아 필름 위에 놓습니다. 백색 여과지의 1.5 cm (2)의 일부를 잘라 와이프의 위에 배치. 그림 1B-1E를 참조하십시오.
- 접힌 상태에서 장갑을 낀 손가락으로 장소에 닦아 가볍게 그것이 접힌 상태를 유지하도록 닦아 저해 할 웜 물을 사용합니다. (가) 평면 닦아 롤 전송 피펫의 측면을 사용합니다.
참고 : 차가운 온도는 움직이는 벌레를 유지하는 데 도움이됩니다. 작업 "건조"도 고정에 도움이됩니다. 티슈는 웜 (치명적이다)이 완전히 건조 될 수없는 수술 중에 습기 웜 유지 여과지를 통해 물을 빨아들이도록 작용 와이프.
- 접힌 상태에서 장갑을 낀 손가락으로 장소에 닦아 가볍게 그것이 접힌 상태를 유지하도록 닦아 저해 할 웜 물을 사용합니다. (가) 평면 닦아 롤 전송 피펫의 측면을 사용합니다.
3. 수술 절제
- 에 배치하는 전송 피펫을 사용하여여과지 상 E 웜 등쪽까지. 에 광원을 켜고 빛이 웜에 집중되도록 구즈넥을 지시. 눈 (전체 웜이보기에있을 필요가 없습니다) 명확하게 볼 수 있도록 해부 범위 초점 및 배율을 조정; 5 배 확대는 좋은 출발점이 될 것입니다. 헤드 (현미경의 전방) 연구자 향해 지적되도록 오른쪽으로 각진 30-40 도의 파라핀 필름을 회전시켜 방향을 웜.
- 초과 웜의 움직임을 방지하기 위해 밝은 빛의 사용을 피하십시오. 플라나리아는 부정 phototaxis를 표시하고 밝은 빛을 회피하려고 시도합니다.
- 이 웜 (인두 볼 개방으로) 위로 향하게 복부 측에 위치하는 경우, 부드럽게 (눈에 보이는) 웜 등쪽을 재배치 나이프의 무딘면을 사용한다. 동물을 재배치 할 때 부드러운 조직을 통해 찢어 가능성을 최소화하기 위해 포셉의 날카로운 팁 동물에 접근하지 마십시오.
- 눈의 초점이 명확하게되도록 현미경의 초점을 조정합니다. 또한 눈과 주변의 머리 조직 모두가보기에 있는지 확인합니다.
- 이 (엄지와 검지 손가락 사이) 펜 것처럼 오른손에 신선한 바늘 / 주사기를 잡습니다. 펠티어 플레이트 (또는 페트리 접시 냉각 판)에 대한 좌측 엄지 손가락을 꽉 및 주사기의 저부 쉬게되는 지점에서 (도 2a)로 왼쪽 엄지 손가락을 사용한다. 현미경을 통해 봐, 바늘의 베벨을 볼 수 있는지 확인합니다.
참고 : 바늘은 매우 날카로운입니다. 를 취급 할 때주의하십시오. 라텍스 또는 니트릴 장갑을 착용하는 것은 몇 가지 보호 기능을 제공 할 수 있습니다.- 절차 전반에 걸쳐 지속적으로 바늘 / 주사기를 유지하는 데 도움과 악수를 피하기 위해 왼쪽 엄지 손가락을 사용합니다.
- 수술 표면 안정된를 유지하기 위해 왼쪽 엄지와 (수술 표면에 검지 손가락으로) 왼쪽 검지 손가락으로 약 40 °의 각도를 확인합니다.
- 와(스푼처럼) 위로 향하게 바늘의 베벨 눈 (도 2B)에 직각으로 니들의 위치. 부드럽게 오른쪽에서 왼쪽으로 떠서, 눈의 광학 컵 (백색 착색 영역) 위에있는 조직의 얇은 층을 관통하는 바늘의 끝을 사용한다. 아주 조심스럽게 바닥에 구멍 또는 광학 컵의 경계를 파괴 않도록주의하면서, 광학 컵 내에있는 모든 착색 된 조직을 제거합니다.
- 웜이 절차를 수행하는 동안 어느 시점에서> 1-2 분 동안 필터 종이 된 경우, 웜을 재수하는 웜의 물 한 방울을 추가합니다.
참고 : 탈수 리핑 부상 웜의 감수성을 증가시킬 것이다.
- 웜이 절차를 수행하는 동안 어느 시점에서> 1-2 분 동안 필터 종이 된 경우, 웜을 재수하는 웜의 물 한 방울을 추가합니다.
- 반복 검은 색소 조직 (색소 세포)의 모든 때까지 단계 3.3뿐만 아니라, 광학 컵 (광 수용체 세포의 수상 돌기)의 흰색 조직의 모든 등이 제거된다. 주의 깊게 조직 닦아에게로 닦아 바늘의 끝 부분에 붙어 절제 조직을 제거합니다. 이중 눈 abla하는 경우능을 원하는 시점에서 상기 제 눈 브레이션된다.
참고 : 부상을 방지하려면, 바늘은 다음 닦아 멀리 엄지 손가락과 집게 손가락에서 통해 바늘을 끌어 다른 손을 사용하여 엄지 손가락과 집게 손가락 개최 닦아 깨끗한 티슈로 바늘을 잡고 세척 할 수 있습니다. 대안으로, 니들은 웨트 티슈 와이프의 표면에 와이 핑과 청결을 조사 할 수있다. - 완료되면, 신선한 웜 물을 포함하는 라벨이 접시에 벌레를 이동하는 전송 피펫을 사용합니다. 그룹 데이터를 분석하면, 하나의 100mm 배양 접시에 20 개 벌레까지 놓습니다. 시간이 지남에 따라 같은 개인의 재생을 추적하는 경우, 12 웰 플레이트의 각 웰에 1 개 웜을 배치합니다. 모든 벌레가 전송되면, 요리 / 우물에서 모든 웜 물을 제거하고 더 신선한 웜 물로 대체하여 벌레를 씻어.
- 필터로부터 웜을 제거하고, 웜 소량의 물로 피펫 backload 웜에 물을 방출. 이 t 올리한다여과지 오프 그는 웜은 즉시 전송 피펫에 흡입된다.
- 빛으로부터 보호 ~ 20 ℃ (실온)에서의 실험을 부화 회생 방법을 따른다.
주 : 웜 일정한 온도를 유지하는 온도 조절 배양기에 저장 될 수 있지만, 이것은 반드시 필요한 것은 아니다. 대부분의 실내 온도는 재생하는 웜의 기능에 영향을 미치지 않습니다 +5 ° C를 만 다릅니다. - 원한다면, 면역 용 웜 (도 3-4 참조) 및 / 또는 계내 혼성화는 유전자 발현 분석하여 고정한다. 다른 정착 방법은 면역 플라나리아 18, 19, 20 및 계내 혼성화 (21, 22), (23 개)의 프로토콜에 존재한다.
- 실험이 체결되어, sacrifiCE는 접시에서 웜 물을 제거하고 70 % 에탄올로 대체하여 웜을 살고 있습니다. 용균 및 칙칙한 우회전 웜 검사 3-5 분 동안 인큐베이션 웜.
- 한 번 희생 일반 폐기물의 처리하지 않은 벌레를 놓습니다. 환경, 특히 외래종에 살아있는 벌레를 도입하지 마십시오.
결과
처음 1 ~ 2 시간 후 수술을 위해, 동물은 그대로 웜 (그러나 그들은 여전히 이동합니다)에 비해 움직임을 감소 발생할 수 있습니다. 원하는 경우, 웜 (RNAi의 공급을 위해, 예를 들어) 수술 24 시간 이내에 먹을 것이다. 시간이 지남에 따라 같은 개인의 눈의 재생을 다음과 같은 경우 모두 수술 전에 (그대로)과 1 시간 후 절제 (고전력 증폭기)에서 각 웜의 사진을해야합니다. 사일 포스트 어블 (DPA)에 의해 재생 색소 세포를 표시하고, (14) 전체에 눈이 완전히 재생 된 것이다 DPA (도 3A-B)를 기준으로한다. 이것은 감광체 신경 및 뇌 (도 3c)에 그들의 신경 분포뿐만 아니라 시각 시스템 (도 4A-C)의 기능 회복을 포함한다. 성공적인 절제 뇌 (그림 4D-E)의 기본 조직을 방해,도 동물 (그림 5A)에 다른 부상을 소개하지 않습니다. 실패 절제상기 복부 표피 (도 5d)을 통하여 찌르기 및 / 또는 상처 부위를 두 눈 (도 5b)를 연결하는 동물 (도 5C)의 좌우 가장자리 눈물 지나치게 큰 절제 : 가진 동물을 포함한다. 또한, 실패 절제 흰색 착색 조직 및 흑색 색소 세포 (도 5E-F) 모두로 구성된 전체 광섬유 컵의 불완전한 제거를 포함한다.

그림 1 : 수술 준비. ICE (충전)이 100mm 배양 접시의 바닥 (얼음 상에 거꾸로 배치)가 60mm 페트리 접시 뚜껑을 사용하여 콜드 플레이트 구조의 (A) 다이어그램. (위에서 아래로)을 백색 여과지 젖은 절첩 티슈 와이프의 스택 파라핀 필름의 조각으로 된 수술면 (B) 다이어그램.(C) (오른쪽 손잡이의 경우) 설정 수술. A : 해부, B : 거위 조명, C : 수술면, D : 펠티에 판 E : 절제위한 준비 5-7 밀리미터 웜 접시, F : 웜 물 세척 병, G : 젓가락 나머지 깨끗한 전송 피펫 채 H : 젓가락 받침대 잡고 바늘 / 주사기, I : 젓가락 나머지 집게를 잡고, J : 추가 전송 피펫의 컨테이너입니다. (D) 사용자 펠티어 플레이트 구성. (E) 페트리 접시 콜드 플레이트 구성. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2 : 절제 동안 손 바늘 / 주사기의 위치. (오른쪽 손잡이에) 손 (A) 배치. 왼쪽 엄지 손가락이 주사기를 지원하는 데 사용되는 주 (보유오른쪽의) 움직임을 최소화합니다. 웜의 눈 관련 바늘의 (B) 배치. 바늘의 경사면 위쪽으로 향하도록 주. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
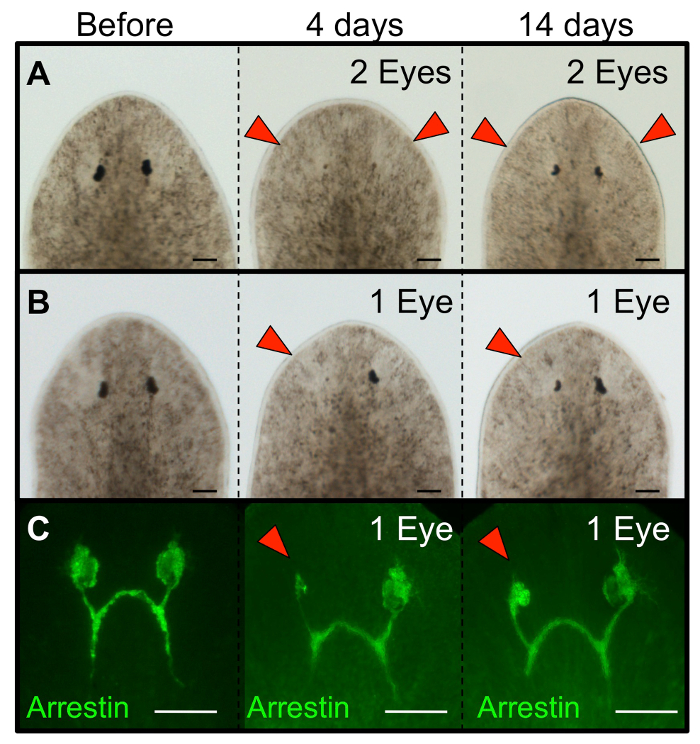
그림 3 : 절제된 플라나리아의 눈은 다시 생성합니다. Schmidtea의 MEDITERRANEA의 형태학 (A) 이중 눈 절제와 (B) 한 눈 절제 다음 눈을 재성장 플라나리아. (C)가 단일 면역 눈 박리 다음 감광체 뉴런 (안티 아레스)의 재생을 도시. 본래 웜은 수술 전에 표시됩니다, 다시 생성은 일 4와 절제 후 14에 표시됩니다. 하나의 눈 절제를 들어, 왼쪽 눈이었다blated 우안 내부 (손상되지 않은) 제어의 역할을한다. 레드 화살촉 : 절제가 눈. 스케일 바는 100 ㎛, =. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
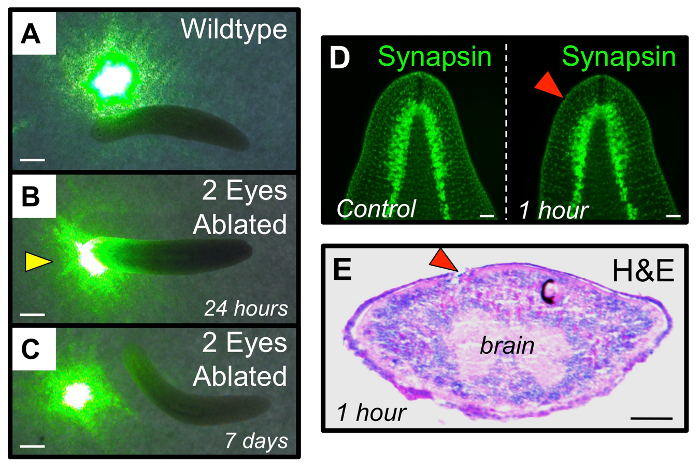
도 4 : 박리 후의 시각 시스템의 기능 회복. (A - C) 기능 분석은 플라나리아 수명을 테스트한다. (A) 본래 웜은 녹색 레이저 포인터의 스폿으로서 광 영역을 통해 여행 피한다. 24 시간 후 박리시 (B), "블라인드"두 눈 절제 웜 광 스폿을 통과. 7 일 후 박리시 (C)는 두 눈 절제 웜 빛 방지를 충분히 회복 시각적 체계를 재생했다. 노란색 화살표 : 이상한 행동알 응답. (D - E) 눈 제거는 광학 컵의 조직으로 제한되며, 기본 뇌 조직을 방해하지 않습니다. (D) 뇌 구조 (안티 synapsin)을 나타내는 면역 1 시간 후 박리하는 박리 전에 변함이다. 손상을 나타내는 횡단면의 1 시간 후 박리의 (E)은 Hematoxylin & Eosin 염색은 주로 절제된 광섬유 컵의 위치로 제한된다. (흑색 안료 세포) 우측 눈의 내부 대조군으로서 작용한다. 레드 화살촉 : 절제가 눈. 스케일 바 = (AC) 1mm에 1mm에서 100 μm의 (DE). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
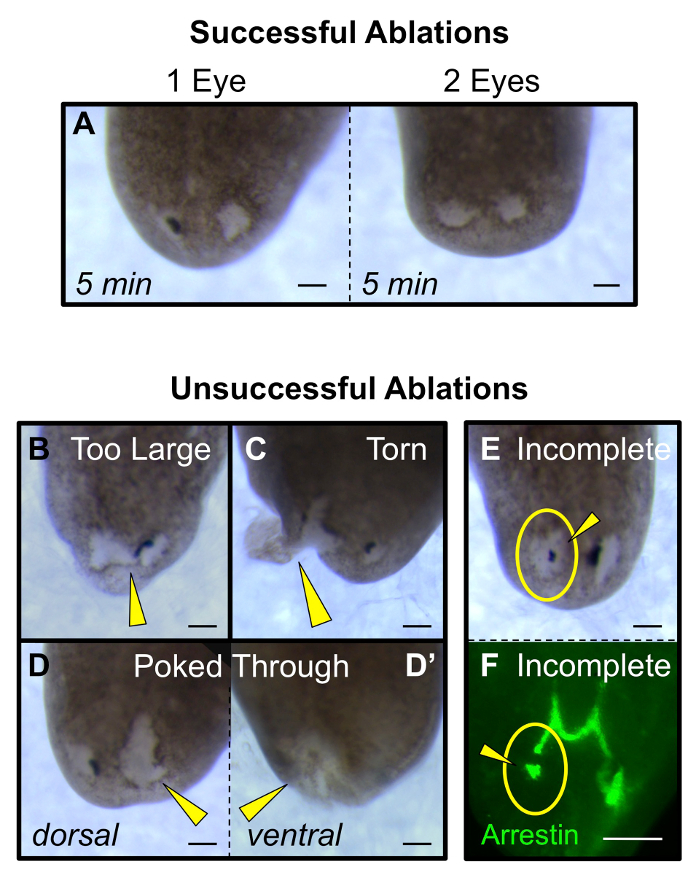
그림 5 : 성공 및 실패 절제의 특징. (A) 성공적인 단일 및 이중 눈 절제 (5 분 후 제거에서) 원래 광학 컵의 크기와 대략 비슷 상처가 있습니다. (B - E) 실패 절제 : (B) 너무 많은 조직을 제거하거나 상처가 두 눈, (C) 상처 사이트 눈물을 연결하고 여백으로 확장되고, 상처가 너무 깊고 (D)으로부터 솟아 오르 복부 (D ') 측 및 (E - F)에 지느러미 (D) 모든 광학 컵 조직이 제거 된 두 형태 학적 (E)를 가시화하고, 시각 신경 (F)의 반 아레스 염색하여. 노란 화살촉 : 비정상적인 절제. 노란색 원 : 절제 사이트. 스케일 바는 100 ㎛, =. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이것은 눈 박리 방법은 뇌 조직을 제외하고, 안구 조직에 주로 절단을 제한함으로써 (예컨대 펀치 구멍 등) 현재의 방법을 개선한다. 기술자 경험이 있지만 양심적 학부 학생들에게 microsurgeries 경험에서 연습으로,이 기술은, 대부분의 개인에 의해 수행 될 수있다. 이 기법은 이전에 면역하거나 눈 마커 (들) (4, 5), (13) 계내 혼성화 모든 눈 조직을 완전히 제거 (수)의 확인을 포함하여, 실험에 절제를 사용하여 여러 차례 실시하는 것이 권장된다. 이 프로토콜에서 가장 중요한 단계는 조직의 밖으로 떠 서입니다. 너무 많이 또는 너무 적게하거나 조직을 제거하지 않는 것이 중요하다. 이 웜의 복부 측면에 관통 방지하기 위해 바늘로 너무 깊게 떠서하지 않음으로써 피할 수 있습니다. 니의 끝DLE는 약 0.4 mm 깊이 삽입되어야하며, 바늘의 경 사진 부분은 끝까지 눈을 통과해서는 안됩니다. 특별한주의는 두 눈 사이의 연약한 조직 (각 눈의 검은 색소 지역의 내측 모서리가 각 눈의 경계를 나타냄) 손상하지 않도록주의해야한다. 눈 및 웜의 원심 마진과 피해도 피해야한다. 작은 벌레가 찢어 또는 실수로 부상 할 가능성이 높다, 이렇게 큰 벌레 (특히 연습)의 사용이 권장된다. 이 기술의 주요 한계는 상대적으로 시간이 많이 (그리고 높은 처리량 화면에 적합하지 않음)이라고하며,이 결과의 정확성을 보장하기 위해 연습에 초기 투자를 필요로한다. 그러나 실제로 10 눈 ~ 15 분에서 절제 할 수있다.
문제 해결을위한 주요 영역이 절차를 수행하는 동안 여전히 플라나리아를 유지합니다. 두 가지 주요 이유 웜은 절제를 수행하기 위해 충분히 고정되지 않습니다저온의 (a) 너무 많은 물 및 (b)의 손실이다. 수술 표면에 풀을 전송하는 웜은 웜이 이동하고 수술을 복잡하게 할 수있는 동안 (A) 초과 플라나리아 물. 수술 표면 (보풀이없는 조직은 닦아 여과지)에만 수분을 유지해야한다. (가) 웜 물로 포화 닦아 절차 중 어느 시점에,이 중 하나를 교체해야하거나 전송 피펫 부드럽게 닦아 조직에서 초과 액체를 제거하는 데 사용할 수있는 경우 (항상 닦아 아닌 여과지에서 그릴). 조직 와이프도 수술 표면에 물기 풀링을 제거하는 데 사용할 수 있습니다. 이 과정은 웜의 수는 절제되고에 따라 여러 번 반복해야 할 수도 있습니다. (B) 설정 한 배양 접시 냉각 판을 사용하는 경우, 얼음이 녹아 시작하고 60mm 페트리 접시의 뚜껑을 떠 시작하자마자 냉각 판을 교체해야합니다. 이는 안정적인 수술 표면과 적절하게 차가운면을 모두 보장합니다. 다르게는, 펠티에 판을 사용하는 경우셋업 사용을 45 분 내지 1 시간 후, 외부 링의 열은 중앙 냉각 판을 극복되고 모든 냉각 손실된다는 점에 유의. 이 경우는 절제를 다시 시작하기 전에 실온에 올 수 있도록 5 ~ 10 분 동안 펠티에 판을 끕니다.
문제 해결의 또 다른 영역은 다시 접시 및 수술 표면 사이 웜 전송 중입니다. 절제 웜이 여과지에서 제거하기 어려운 경우, 필터 종이 위에 액체 풀 때까지 웜에 웜 물 한 방울을 배치합니다. 웜은 평소와 같이 전송 피펫에 흡입 될 수있다. 문제가 지속되면, (포셉의 무딘면을 사용하여) 먼저 복부 측면에 벌레를 뒤집기 시도합니다. 웜이 전송 피펫 내부에 걸리면,이 물을 너무 많이 (벌레 약 인치보다 더 멀리 전송 피펫으로 그려야) 채택되지 않은 있다는 신호는 보통이다. 전송 피펫에 갇혀 웜을 제거하려면, 웜 와트의 1-2 mL로 작성어 피펫으로,되도록 웜은 물로 덮여있다. 웜 피펫의 벽으로부터 분리 및 유동까지 단단히 펫의면을 가볍게.
바늘이 둔하게되면, 새로운 바늘 / 주사기로 교체합니다. ≥30 눈을 브레이션 사용 후 바늘을 교체하는 것이 좋습니다. 티슈로 닦아 절제된 조직의 과도한 제거 절제가 더 어렵게, 또한 무딘 바늘 수 닦습니다. 절제된 조직은 (심지어 여러 동물에서) 절차를 통해 바늘의 경 사진 부분에서 머물 경우는 괜찮습니다. 항상 다른 조건의 웜 사이에 (예를 들어, 야생형 대 RNAi의 웜)을 변경할 때 신선한 바늘 / 주사기를 사용뿐만 아니라 (즉, 다른 날에) 새로운 절제 세션을 시작할 때.
이것은 눈 수술 절제 기술은 특히, 플라나리아 빛 - 유도 동작 (및 유전 적 신경 기초)을 조사 할 수있는 강력한 수단약물 치료 또는 RNA 간섭과 결합. 눈 박리는 생체 내에서 내인성 플라나리아 재생 눈 (눈의 줄기 세포의 유지와 분화)을 조절하는 메커니즘을 해명함으로써 좋은 수단이다. 대부분의 척추 동물은 플라나리아는 미래의 치료로 번역 가능한 메커니즘을 식별 중요 할 것이다 눈을 다시 생성 할 수있는 방법을 이해하는 눈의 조직을 재생시키는 매우 제한된 능력을 가지고있다.
공개
저자가 공개하는 게 없다.
감사의 말
저자는 기능 분석에 대한 지원이 눈 절제 기술, 테일러 Birkholz 완성을 위해 미셸 Deochand 감사의 말씀을, 펠티어 플레이트에 대한 자세한 내용은 안티 아레스 항체 마이클 레빈, 그리고 준지 Morokuma. 이 작품은 WSB에 웨스턴 미시간 대학에서 SFSA 교부금에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| Instant Ocean sea salts | Spectrum Brands | SS15-10 | "10 Gallon" box (net weight 3 lbs) |
| Kimwipes EX-L lint-free tissue wipe | Kimberly-Clark | 34155 | 4.5 x 8.5 in |
| Whatman #2 filter paper | Sigma | WHA1002125 | Circles, 125 mm diameter, white |
| Easy Touch Insulin syringe (with needle) | Pet Health Market | 17175-04 | U-100 1 cc syringe, 31 G 5/16 in needle |
| 100 mm Petri dish | VWR | 25384-342 | 100 mm x 15 mm |
| 60 mm Petri dish | VWR | 25384-092 | 60 mm x 15 mm |
| Dumont #5 forceps | Fine Science Tools | 11254-20 | Inox, straight tip , 11 cm |
| Transfer pipettes | Samco Scientific | 225 | Graduated, large bulb, 7.5 mL, non sterile |
| Parafilm M paraffin film | Brand | 701606 | 4 in x 125 ft roll |
| 12-well untreated tissue culture plate | VWR | 15705-059 | Untreated, flat bottom, sterile, Falcon brand |
| Plastic food containers (for colony) | Ziploc | Large rectangle | 2.25 qt (2.12 L), 10" x 6 -3/4 " x 3 -3/16" |
| Planaria (Girardia tigrina) | Carolina Biological | 132954 | Sold as "Brown" Planaria; most often they are G. tigrina (aka Dugesia tigrina), but sometimes are G. dorotocephala (aka Dugesia dorotocephala); either will work. |
| Planaria (Schmidtea mediterranea) | n/a | n/a | S. mediterranea are not commercially available. At this time animals are only obtainable from laboratories that use them and have extra animals. |
| Brown paper towels | Grainger | 2U229 | 9-3/16 x 9-3/8" 1-Ply Multifold Paper Towel, UNBLEACHED |
| Wash bottle (for worm water), optional | VWR | 16650-275 | Wash Bottles, Low-Density Polyethylene, Wide Mouth, 500 mL |
| Anti-synapsin antibody, optional | Developmental Studies Hybridoma Bank | 3C11 | Supernatant |
| Anti-arrestin antibody, optional | n/a | n/a | Not commercially available. Kind gift from Michael Levin, Tufts University |
| Nalgene Lowboy carboy with spigot (for storing worm water), optional | Nalge Nunc International Corporation | 2324-0015 | 15 L, polypropylene, low profile makes it easier to fill plastic colony containers |
| Custom Peltier plate, optional | Williams Machine, Foxboro, MA | n/a | Design specifics courtesy of Junji Morokuma, Tufts University: Peltier plate is constructed of a standard thermoelectric heat pump (for example, All Electronics Corp Catalog # PJT-1, 30 mm2). The square heat pump is covered with a thin mirrored surface, then placed inside a 30 mm2 square hole in a circular plexiglass form (~50 mm in diameter). This form is of similar thickness to the heat pump, and fits flush into a well tooled in the center of a round heat sink (~115 mm in diameter). The form/heat pump is "anchored" to the sink with silicone base heat sink compound. The leads are threaded through holes drilled through both the form and the the heat sink. The bottom half of the heat sink is tooled into a "foot" that fits into the opening of your microscope's base plate. |
| DC power source (for Peltier plate), optional | B & K Precision | 1665 | Regulated Low Voltage DC Power Supply, 1-18 V (DC), 1-10 amps. |
| Other common supplies | |||
| Gloves | |||
| Razor blade | |||
| Scissors | |||
| Dissecting scope with gooseneck lighting | |||
| Chopstick rests, optional |
참고문헌
- Gentile, L., Cebria, F., Bartscherer, K. The planarian flatworm: an in vivo model for stem cell biology and nervous system regeneration. Dis Model Mech. 4 (1), 12-19 (2011).
- Elliott, S. A., Sanchez Alvarado, A. The history and enduring contributions of planarians to the study of animal regeneration. Wiley Interdiscip Rev Dev Biol. 2 (3), 301-326 (2013).
- Emili Saló, R. B., Tsonis, P. A. Chapter 3. Animal Models in Eye Research. , 15-26 (2008).
- Lapan, S. W., Reddien, P. W. dlx and sp6-9 Control optic cup regeneration in a prototypic eye. PLoS Genet. 7 (8), e1002226 (2011).
- Lapan, S. W., Reddien, P. W. Transcriptome analysis of the planarian eye identifies ovo as a specific regulator of eye regeneration. Cell Rep. 2 (2), 294-307 (2012).
- Inoue, T., et al. Morphological and functional recovery of the planarian photosensing system during head regeneration. Zoolog Sci. 21 (3), 275-283 (2004).
- Pineda, D., et al. The genetic network of prototypic planarian eye regeneration is Pax6 independent. Development. 129 (6), 1423-1434 (2002).
- Paskin, T. R., Jellies, J., Bacher, J., Beane, W. S. Planarian Phototactic Assay Reveals Differential Behavioral Responses Based on Wavelength. PLoS One. 9 (12), e114708 (2014).
- Raffa, R. B., Martley, A. F. Amphetamine-induced increase in planarian locomotor activity and block by UV light. Brain Res. 1031 (1), 138-140 (2005).
- Sandmann, T., Vogg, M. C., Owlarn, S., Boutros, M., Bartscherer, K. The head-regeneration transcriptome of the planarian Schmidtea mediterranea. Genome Biol. 12 (8), R76 (2011).
- Vasquez-Doorman, C., Petersen, C. P. The NuRD complex component p66 suppresses photoreceptor neuron regeneration in planarians. Regeneration (Oxf). 3 (3), 168-178 (2016).
- Deochand, M. E., Birkholz, T. R., Beane, W. S. Temporal regulation of planarian eye regeneration. Regeneration. 3 (4), 209-221 (2016).
- Sakai, F., Agata, K., Orii, H., Watanabe, K. Organization and regeneration ability of spontaneous supernumerary eyes in planarians -eye regeneration field and pathway selection by optic nerves. Zoolog Sci. 17 (3), 375-381 (2000).
- Asano, Y., Nakamura, S., Ishida, S., Azuma, K., Shinozawa, T. Rhodopsin-like proteins in planarian eye and auricle: detection and functional analysis. J Exp Biol. 201 (Pt 9), 1263-1271 (1998).
- Cross, S. D., et al. Control of Maintenance and Regeneration of Planarian Eyes by ovo. Invest Ophthalmol Vis Sci. 56 (12), 7604-7610 (2015).
- Robb, S. M., Gotting, K., Ross, E., Sanchez Alvarado, A. SmedGD 2.0: The Schmidtea mediterranea genome database. Genesis. 53 (8), 535-546 (2015).
- Robb, S. M., Ross, E., Sanchez Alvarado, ., A, SmedGD: the Schmidtea mediterranea genome database. Nucleic Acids Res. 36, D599-D606 (2008).
- Beane, W. S., Tseng, A. S., Morokuma, J., Lemire, J. M., Levin, M. Inhibition of planar cell polarity extends neural growth during regeneration, homeostasis, and development. Stem Cells Dev. 21 (12), 2085-2094 (2012).
- Forsthoefel, D. J., Waters, F. A., Newmark, P. A. Generation of cell type-specific monoclonal antibodies for the planarian and optimization of sample processing for immunolabeling. BMC Dev Biol. 14, 45 (2014).
- Ross, K. G., et al. Novel monoclonal antibodies to study tissue regeneration in planarians. BMC Dev Biol. 15, 2 (2015).
- Cardona, A., Fernandez, J., Solana, J., Romero, R. An in situ hybridization protocol for planarian embryos: monitoring myosin heavy chain gene expression. Dev Genes Evol. 215 (9), 482-488 (2005).
- King, R. S., Newmark, P. A. In situ hybridization protocol for enhanced detection of gene expression in the planarian Schmidtea mediterranea. BMC Dev Biol. 13, 8 (2013).
- Pearson, B. J., et al. Formaldehyde-based whole-mount in situ hybridization method for planarians. Dev Dyn. 238 (2), 443-450 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유