Method Article
Интерференция РНК на основе Исследование функции белка теплового шока 27 во время роговичного эпителиального заживление ран
В этой статье
Резюме
Herein, we present a protocol to use heat shock protein 27 (HSP27)-specific small interfering RNA to assess the function of HSP27 during corneal epithelial wound healing. RNA interference is the best method for effectively knocking-down gene expression to investigate protein function in various cell types.
Аннотация
Small interfering RNA (siRNA) is among the most widely used RNA interference methods for the short-term silencing of protein-coding genes. siRNA is a synthetic RNA duplex created to specifically target a mRNA transcript to induce its degradation and it has been used to identify novel pathways in various cellular processes. Few reports exist regarding the role of phosphorylated heat shock protein 27 (HSP27) in corneal epithelial wound healing. Herein, cultured human corneal epithelial cells were divided into a scrambled control-siRNA transfected group and a HSP27-specific siRNA-transfected group. Scratch-induced directional wounding assays, and western blotting, and flow cytometry were then performed. We conclude that HSP27 has roles in corneal epithelial wound healing that may involve epithelial cell apoptosis and migration. Here, step-by-step descriptions of sample preparation and the study protocol are provided.
Введение
Роговичные эпителиальные клетки (CECS) непрерывно пролил в слезную пленку, в то время как они одновременно заменяются клетками из лимба и роговицы эпителиальных базальных слоев. 1 Различные внешние факторы стресса могут вызывать апоптоз и слущивание центральноевропейских стран. 2 В белки теплового шока (HSP) высоко консервативны и могут быть разделены на два семейства в соответствии с размером молекул. 3 Наибольший семейство HSP включает HSP90, HSP70 и HSP60, а меньшая семейство включает в себя Hsp27. 4 фосфорилирование HSP27 , как известно, играют важную роль в выживании клеток и необходима для миграции клеток из - за роли этого белка в актина ремоделирования. 5-7 Поэтому мы попытались проверить потенциальную роль Hsp27 фосфорилирования в миграции ЦИК и апоптоза в модели в пробирке эпителиального заживления раны.
РНК-интерференция (RNAi) с использованием либо небольших или коротких интерферирующих РНК (миРНК) имеет GEnerated интерес как фундаментальной и прикладной биологии, так как она потенциально позволяет получить выражение любого интересующего гена быть разобранной. 8 При этом мы использовали Hsp27 конкретных миРНК для оценки вклада HSP27 в ЦИК заживление ран и апоптоза. Традиционные методы RNAi для генной нокдаун в клетках используют синтетические дуплексы РНК, в том числе двух немодифицированных 21-мерными олигонуклеотидами, которые могут быть собраны для создания миРНК. RNAi миРНК, которые мы использовали в этом настоящем исследовании является простой и высокоэффективный метод для трансфекции клеток, и этот реагент работает с различными линии иммортализованных клеток. В этом настоящем исследовании мы демонстрируем методы, используемые для этого анализа, в том числе анализа нуля индуцированной направленной раны, вестерн-блоттинга, трансфекции миРНК анализа, иммунофлуоресценции и проточной цитометрии.
протокол
1. Клеточная линия
- Культура 10 6 теломеразы-увековечен эпителиальные клетки роговицы человека (HCECs) в 6-луночного планшета (плотность: 1039,9 клеток / мм 2) в 37 ° C инкубаторе с 5% CO 2 атмосферы с использованием бронхиальную среду для роста эпителий (BEGM) до они достигают 95% слияния.
2. Вестерн-блот-анализ после создания эпителиальной Скретч Раны
- Серия стерильный 200 мкл пипетки по всей поверхности скважины сливающихся культивируемых HCECs четыре раза в блюдо в кабинете биологической безопасности (класс II, тип А2) и инкубировать HCECs отдельно в 37 ° C инкубаторе с 5% атмосфере СО 2 в течение 1, 5, 10, 30, 60 и 120 мин.
- Используйте один 6-луночного планшета для шести различных образцов в зависимости от времени инкубации после роговичного эпителиального ранению.
- Промыть раненным HCEC монослоев три раза 1x PBS, а затем добавляют 2,0 мл BEGM в каждую лунку.
- Отделить HCECs с использованием 2мл 0,25% трипсина-этилендиаминтетрауксусной кислоты (ЭДТА) на лунку в течение 5 мин, центрифуге при 900 х г в течение 5 мин в 15 мл пробирку, и аспирата трипсин-ЭДТА с использованием 1 мл пипетки.
- Приостановка HCECs с 1 мл 1x PBS и передавать их в 1,5 мл трубки.
- Центрифуга HCECs при 10000 мкг в течение 15 секунд и аспирата 1x PBS с использованием 1 мл пипетки.
- Ресуспендируют HCECs в 100 мкл охлажденного льдом буфера для лизиса (10 мМ Трис, 10 мМ NaCl, 2 мМ ЭДТА, 25 мМ NaF, 2 мМ Na 3 VO 4, 1 мМ фенилметансульфонилфторид [ФМСФ], ингибиторы протеазы [1 мкМ пепстатина А, 1 мкМ лейпептина и 0,1 мкМ апротинина] и 0,5% Тритон Х-100 [рН 7]) и хорошо перемешать.
- Инкубируйте клетки в течение 30 мин на льду, чтобы вызвать лизис клеток.
- Центрифуга лизатов при 4 ° С при 10000 х г в течение 15 мин, а затем передать супернатанты на свежий 1,5 мл пробирки (90 мкл аликвоты) и хранить их при температуре -80 ° С.
- Определение общей концентрации белка клеточных лизатов с использованием пр Bradfordotein анализ. 9
- Нагрузка 30 мкг общего белка клеточные в акриламидном геле, 10% или 12% для электрофореза додецилсульфата натрия в полиакриламидном геле (SDS-PAGE), а затем электрофоретически перенос разделенных полос белка на нитроцеллюлозных фильтрах с током 200 мА в течение 1 ч при 4 ° с использовать в Вестерн-блот-анализах.
- Блок нитроцеллюлозный фильтр мембраны с 5% обезжиренным молоком в Трис-буферном солевом растворе с Tween 20 (TBST) в течение 1 часа, добавляют первичный кроличьи поликлональные антитела против нефосфорилированный HSP27 (1: 1000 разведение) или первичный кроличьи поликлональные антитела против фосфорилированного HSP27 (1 : 1000 разбавление) в 5% бычьего сывороточного альбумина (БСА) и инкубируют в течение ночи мембраны при 4 ° с на качалке.
- Обнаружение иммунореактивных полос с использованием конъюгированного с пероксидазой хрена козьих антител против кроличьего (1: 10000 разведение) в 5% бычьего сывороточного альбумина, после промывки в течение 10 мин 3 раза TBST.
- Инкубируйте мембраны в вестерн-блоттинга люминола реагентов (6-7 мл на 10 см × 5 см мембраны) в течение 1 мин при комнатной температуре.
- Удалить мембрану из раствора реагента, удалить лишнюю жидкость с абсорбирующим полотенцем, и место в защитном пластиковом листе.
- Работая в темной комнате с безопасным светом, поместите покрытый мембраной в кассете пленки с боковой белком лицевой стороной вверх.
- Поместите рентгеновскую пленку поверх мембраны и подвергают в течение 1 мин.
3. миРНК Трансфекция Анализ 10
- HCECs культуре 5 × 10 5 клеток / лунку в 6-луночный планшет в 37 ° C инкубаторе с 5% CO 2 атмосферы с использованием BEGM , пока они не достигнут 95% слияния.
- Развести трансфекции реагента (2,5 или 7,5 мкл) с 100 мкл уменьшенные сыворотки среды для трансфекции (коэффициент разбавления составлял 41 или 14.3) и растворения HSP27-специфических и вскарабкался управления миРНК в 100 мкл восстановленного сыворотки среды для создания 10 или 50 нМ HSP27 специфические и пополз управления миРНК.
- Смешайте 100 мкм; Л раствора киРНК с 100 мкл разбавленного реагента для трансфекции (соотношение 1: 1) и инкубировать смесь в течение 15 мин при комнатной температуре.
- Добавьте миРНК-липидных комплексов с клетками. Затем через 4 ч Смена носителя для завершения BEGM и инкубировать клетки в течение 2-х дней при 37 ° С.
- Анализ трансфектированных клеток с помощью вестерн-блоттинга, как описано в разделах 4.1 до 4.7.
4. Вестерн - блот - анализа для миРНК-трансфецированных клеток 11
- Экстракт HSP27-специфичны и вскарабкался управления миРНК-трансфицировали HCECs в кабинете биологической безопасности с использованием 100 мкл ледяной буфер для лизиса (10 мМ Трис, 10 мМ NaCl, 2 мМ этилендиаминтетрауксусной кислоты (ЭДТА), 25 мМ NaF, 2 мМ Na 3 VO 4, 1 мМ фенилметансульфонилфторид (ФМСФ), ингибиторы протеазы, и 0,5% Тритон Х-100, рН 7).
- Инкубируйте клетки в течение 30 мин на льду, чтобы вызвать лизис клеток.
- Гранул лизатов при 10000 х г в течение 15 мин, а затем передать супернатанты на свежую 1,5 мл ваннеэс (90 мкл аликвоты) и хранить их при температуре -80 ° C.
- Определение концентрации белка лизатов клеток с использованием анализа Брэдфорда. 9
- Загружают образцы с равным количеством суммарных белков клеток на акриламидном геле 10% или 12%, подвергают гель на SDS-PAGE, и электрофоретически передавать разделенные полосы белка на нитроцеллюлозные фильтры с током 200 мА в течение 1 часа при 4 ° С до используют в Вестерн-блот-анализах.
- Блок нитроцеллюлозный фильтр мембраны с 5% обезжиренным молоком в Трис-буферном солевом растворе с Tween 20 (TBST) в течение 1 ч, добавляют первичные антитела против фосфорилированного и нефосфорилированном HSP27 (1: 1000 разведение), фосфорилированного Akt (1: 1000 разведение), нефосфорилированный Akt (1: 1000 разведение, использовали в качестве маркера для выживания клеток), Bcl-2-ассоциированных Х белок (1: 1000 разведение, использовали в качестве про-апоптотических белков) и глицеральдегид-3-фосфат-дегидрогеназы (GAPDH; 1 : 200 разбавление, использовали в качестве контроля нагрузки) в 5% бычьего сывороточного альбумина (БСА), иинкубировать мембраны в течение ночи при 4 ° С на качалке.
- Обнаружение иммунореактивных полос с использованием конъюгированного с пероксидазой хрена козьих антител против кроличьего (1: 10000 разведение) в 5% бычьего сывороточного альбумина, после промывки 3 раза TBST, 10 мин каждой промывке.
- Инкубируйте мембраны в вестерн-блоттинга люминола реагентов (6-7 мл на 10 см × 5 см мембраны) в течение 1 мин при комнатной температуре.
- Удалить мембрану из раствора реагента, удалить лишнюю жидкость с абсорбирующим полотенцем, и место в защитном пластиковом листе.
- Работая в темной комнате с безопасного света, поместите покрытую мембрану в пленку кассеты стороной белка лицевой стороной вверх.
- Поместите рентгеновскую пленку на верхней стороне мембраны и выставить в течение 1 мин.
5. Скретч-индуцированной Направленная Ранение Анализ Оценка миграции клеток 12
- В кабинете биологической безопасности, сделать рану путем перетаскивания стерильной пипетки по всей поверхности скважины сливающихся культурHSP27 конкретных миРНК-трансфицировали или яичница управления миРНК-трансфицировали HCECs.
- Сразу после ранения, промыть клетки дважды с 1x фосфатным буферным раствором (PBS) и поддерживать их в BEGM культурах в 37 ° C инкубаторе с 5% атмосфере СО 2 в течение 24 ч после ранения.
- Сфотографировать HCEC изображений с использованием прямой микроскоп при увеличении 100X 24 ч после ранения и выполнить фоне уплощение с помощью фильтра Команда в области программного обеспечения для анализа изображений.
- С помощью команды Select измерения, определить область интереса (AOI) с тем же размером многоугольной формы, которые могут охватывать перпендикулярно от конца до конца начальной раны, и определить три различных AOI в раненой области каждого образца.
- Автоматически подсчитать количество ячеек в каждой области, используя Count / размер опции меню Measure.
6. Проточная цитометрия Анализ Апоптоз
- Культура HSP27 специфичные миРНК-трансфицировали и контIRNA трансфицируются HCECs , содержащие каждый 10 нМ миРНК в концентрации 5 × 10 5 клеток / лунку в 6-луночные планшеты , пока клетки не достигают 95% слияния в 37 ° C инкубаторе с 5% атмосфере СО 2 в BEGM.
- Отделить HCECs с использованием 2 мл 0,25% трипсин-ЭДТА на лунку в течение 5 мин, центрифугируют при 900 х г в течение 5 мин в 15 мл пробирку, и аспирата трипсин-ЭДТА с использованием 1 мл пипетки.
- Промыть клетки дважды холодным PBS , а затем клетки вновь суспендируют в 1X связывающем буфере (0,1 М HEPES / NaOH [рН 7,4], 1,4 М NaCl, и 25 мМ CaCl 2) при концентрации 10 6 клеток / мл.
- Передача 100 мкл суспензии клеток (1 × 10 5 клеток) в культуральную пробирку 5 мл.
- Добавить 5 мкл флуоресцеин изотиоцианат-конъюгированный аннексина V и йодид пропидий 5 мкл.
- Осторожно вихре клетки и инкубировать их в течение 15 мин при комнатной температуре в темноте.
- Добавить 200 мкл 1х буфера для связывания в каждую пробирку и анализируют клетки потоком Cytometer в течение 1 часа.
Результаты
Выражение фосфорилированного HSP27 значительно увеличилось в 5, 10, и 30 мин после того, как царапины телесных повреждений по сравнению с разматывать HCECs 13. Вестерн - блот - анализ показал , что экспрессия фосфорилированной HSP27 и фосфорилированного Akt оба были значительно снижены, тогда как экспрессия Bax была значительно увеличена в Hsp27 специфических киРНК-трансфецировали HCECs (рис 1A-E). Выражение фосфорилируется HSP27 был уменьшен на 30% и 40% в 10 нМ и 50 нМ HSP27 специфических миРНК-трансфицировали клетки, соответственно, по сравнению с контрольными миРНК-трансфецированных клеток, но выражение фосфорилированного Hsp27 не был уменьшенной (рис 1A-B ). Кроме того, выражение нефосфорилированный HSP27 была снижена на 20% и 30% в 10 нМ и 50 нМ HSP27 специфических миРНК трансфицированные клетки, соответственно, но выражение нефосфорилированный HSP27 была не снижена (Рисунок 1А и C </ Сильный>).
Направленный анализ ранении царапать-индуцированное показал , что через 24 часа после ранения, HSP27-специфических киРНК-трансфицированных клеток при 10 и 50 нМ отмечались уменьшение миграции (Рисунок 2). Кроме того, HSP27-специфичные миРНК-трансфицировали HCECs подверглись более апоптотической и некротической гибели клеток по сравнению с контрольными вскарабкался миРНК-трансфицированных клеток методом проточной цитометрии (рисунок 3).
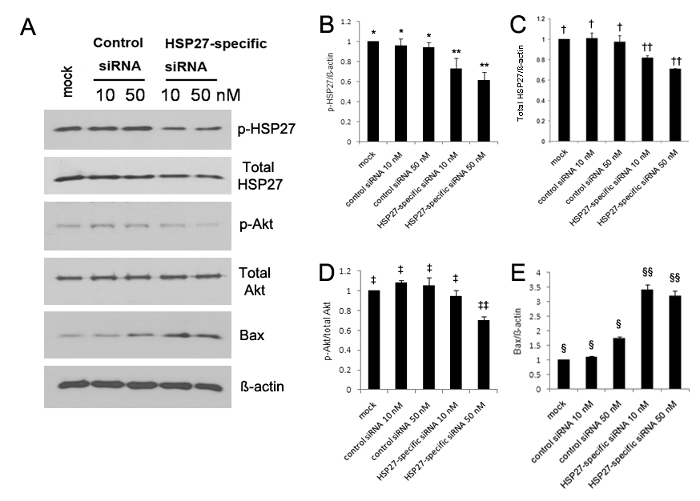
Рисунок 1. Анализ Вестерн - блот с использованием антител против фосфорилированного HSP27 (п-Hsp27), нефосфорилированный HSP27 (не-п-HSP27), фосфорилированного Akt (п-Akt) в качестве маркера клеточного выживания, не фосфорилируется Akt (не п-Akt), Bcl-X 2eassociated белок (Бакс) в качестве про-апоптотических белков, и GAPDH (а). Выражение фосфорилированного и nonphosphorylated HSP27 и фосфорилируется Akt значительно снизилась (В - D), тем не менее, экспрессия Bax значительно увеличилась в Hsp27 специфических киРНК-трансфецировали HCECs (Е), по сравнению с наблюдаемым в контрольной киРНК-трансфицированных клетках (все р <0,05). Выражение фосфорилируется HSP27 был уменьшен на 30% и 40% в 10 нМ и 50 нМ HSP27 специфических миРНК-трансфецированных клеток по сравнению с притворным контролем, соответственно, но выражение фосфорилируется HSP27 не была снижена в 10 нМ и 50 нМ управления миРНК -transfected клетки (B). **, *; †, ††; ‡, ‡‡; §, §§: статистически значимые различия между группами (р <0,05). Столбики ошибок обозначают стандартное отклонение (SD). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
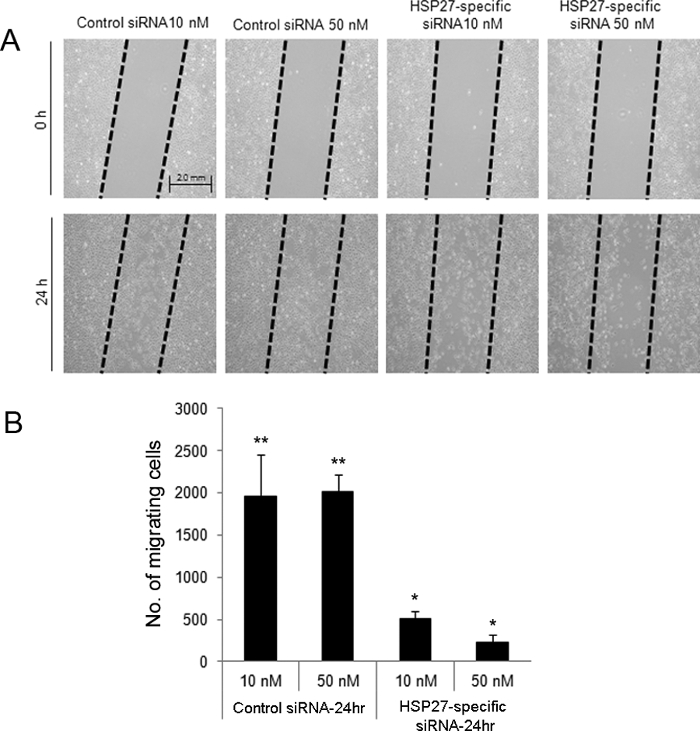
Рисунок 2. Царапина-индуцированное направленного анализа ранив для оценки миграции клеток после ранения в миРНК-трансфицировали HCECs. Рану царапина был создан в контроле и HSP27-специфических киРНК-трансфицированных клетках (А). Клетки были удалены из «вытаскивали» областей. Через 24 часа после ранения, 10 и 50 нМ Hsp27 специфических киРНК-трансфецированных клеток выставлены более низкие количества мигрирующих клеток по сравнению с 10 и 50 контрольных нМ миРНК-трансфицированных клетках (В). ** И * указывают на статистически значимые различия между группами (р <0,05). Данные представлены в виде средних значений ± стандартные отклонения. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
 <бр /> Рисунок 3. Проточная цитометрия 50 нМ вскарабкался управления миРНК и HSP27-специфических киРНК трансфицируются эпителиальных клеток роговицы человека (HCECs) , меченного аннексина V и PI (А и В). Процент от общего числа клеток в квадрантах соответствует ранних апоптотических клеток (аннексина V-положительные, так и ПИ-негативных клеток, В4, внизу справа), в конце апоптотических клеток (аннексина V-положительные и ПИ-положительных клеток, Q2, верхний правый), и отмершие клетки (аннексина V-отрицательных и PI-положительных клеток, Q1, верхний левый). Hsp27 конкретных миРНК-трансфекцию HCECs имели более апоптический и некротической гибели клеток , чем контроль миРНК-трансфецированных клеток. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
<бр /> Рисунок 3. Проточная цитометрия 50 нМ вскарабкался управления миРНК и HSP27-специфических киРНК трансфицируются эпителиальных клеток роговицы человека (HCECs) , меченного аннексина V и PI (А и В). Процент от общего числа клеток в квадрантах соответствует ранних апоптотических клеток (аннексина V-положительные, так и ПИ-негативных клеток, В4, внизу справа), в конце апоптотических клеток (аннексина V-положительные и ПИ-положительных клеток, Q2, верхний правый), и отмершие клетки (аннексина V-отрицательных и PI-положительных клеток, Q1, верхний левый). Hsp27 конкретных миРНК-трансфекцию HCECs имели более апоптический и некротической гибели клеток , чем контроль миРНК-трансфецированных клеток. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
In this present study, we evaluated the potential role of HSP27 in corneal epithelial wounding using in vitro approaches. The critical steps involved siRNA transfection for HSP27 knock-down to observe the function of HSP27 in cells subjected to stress. Notably, a role for HSP27 was revealed by these experiments in epithelial cell migration and apoptosis during corneal epithelial wound healing. Unlike previous studies10 that used rat HSP27-specific siRNA to transfect vascular smooth muscle cells, we used a siRNA transfection technique to modify gene expression in human CECs to effectively knock-down HSP27-specific gene expression and study HSP27 function. Although there were differences in the target sequence that we used as well as in the cell density, final siRNA concentration, and incubation time, the protocol recommended by the manufacturer was explicitly followed. In terms of alternative methods, HSP27 knock-out mouse may be used to show if HSP27 phosphorylation involves epithelial migration and cell apoptosis. However, it is difficult to monitor the change of HSP27 phosphorylation in mouse model, because its phosphorylation occurs in very short period during epithelial wound healing.
There were several limitations to the present study. First, the in vitro environment in which we cultured human CECs certainly differed from the in vivo environment for human CECs, especially regarding cell survival. Second, the siRNA used in this study was not specific to the phosphorylated form of HSP27 as it affected the overall expression levels of HSP27, including both phosphorylated and non-phosphorylated forms.
In the future, a clinical application of these procedures would be to apply HSP27 to live human wounded corneas. We hope that the current findings will help to advance treatments of corneal epithelial tissue damage.
Раскрытие информации
Авторы не имеют никаких финансовых или имущественных интересов, в каких-либо материалов или методов, упомянутых в данном исследовании.
Благодарности
Это исследование было поддержано Исследовательского Гранта Student (13-14) из Университета Ульсан колледжа медицины, Сеул, Корея и грант (2014-464) из Асан института наук о жизни, Сеул, Корея.
Материалы
| Name | Company | Catalog Number | Comments |
| Biological safety cabinet | CHC LAB Co.Ltd, Daejeon, Republic of Korea | CHC-777A2-06 | Class II, Type A2 |
| Stealth RNAi™ siRNA | Thermo Fisher Scientific, Inc., Waltham, MA | RNAi siRNA; scrambled control-siRNA and HSP27-specific siRNA | |
| BEGMTM | Lonza, Inc., Walkersville, MD | CC-3171, CC4175 | Bronchial epithelium growth medium |
| Protease inhibitor | Sigma-Aldrich, Inc., St. Louis, MO | P8340 ,P7626 | 1 μM Pepstatin A, 1 μM Leupeptin, 0.1 μM Aprotinin |
| Bradford protein assay | Bio-Rad Laboratories, Hercules, CA | #500-0001 | Bradford protein assay |
| Nitrocellulose filters | Amersham, Little Chalfont, UK | RPN3032D | Western blotting membrane |
| Non-phosphorylated HSP27 | Abcam Inc., Cambridge, MA | ab12351 | 1:1,000 dilution (Total HSP27) |
| Phosphorylated HSP27 (Ser85) | Abcam Inc., Cambridge, MA | ab5594 | 1:1,000 dilution HSP27 was phosphorylated at Ser85 |
| Lipofectamine® RNAiMAX reagent | Invitrogen, Carlsbad, CA | 13-778-075 | Transfection reagent |
| Phosphorylated Akt (Ser473) | Cell Signaling Technology, Danvers, MA | No. 4060 | 1:1,000 dilution Akt was phosphorylated at Ser473 (cell survival marker) |
| Non-phosphorylated Akt | Cell Signaling Technology, Danvers, MA | No. 4061 | 1:1,000 dilution (Total Akt) |
| Bcl-2-associated X protein | Cell Signaling Technology, Danvers, MA | No. 4062 | 1:1,000 (anti-apoptotic protein marker) |
| GAPDH | Santa Cruz Biotechnology, Santa Cruz, CA | No. 4063 | 1:1,000 loading control marker (house keeping gene) |
| Horseradish peroxidase-conjugated goat anti-rabbit antibodies | Thermo Fisher Scientific, Inc., Waltham, MA | NCI1460KR | 1:10,000 dilution |
| OPTI-MEM | Invitrogen, Carlsbad, CA | 31985 | reduced serum medium for transfection |
| Image analysis software | Olympus, Inc., Tokyo, Japan | Image-Pro Plus 5.0 | |
| Skimed milk powder | Carl Roth GmbH + Co. KG, Karlstruhe, Germany | T145.2 | |
| Tris | Amresco LCC, Inc. Solon, OH | No-0497 | |
| Sodium Chloride | Amresco LCC, Inc. Solon, OH | No-0241 | |
| Six well culture plate | Thermo Fisher Scientific, Inc., Waltham, MA | 140675 | 35.00 mm diameter / well |
| 24-well culuture dish | Thermo Fisher Scientific, Inc., Waltham, MA | 142475 | |
| Orbital shaker | N-Bioteck, Inc., Seoul, South Korea | NB1015 | |
| Bovine serum albumin | Santa Cruz Biotechnology, Santa Cruz, CA | sc-2323 | |
| BDFACSCantoTM II | BD Biosciences, Franklin Lakes, NJ | Flow cytometry | |
| X-Ray Film | Kodak, Rochester, NY | Medical X-Ray Cassette with Green 400 Screen | |
| western blotting luminol reagent | Santa Cruz Biotechnology, Santa Cruz, CA | sc-2048 | |
| FITC Annexin V Apoptosis Detection Kit I | BD Biosciences, Franklin Lakes, NJ | 556547 |
Ссылки
- Dua, H. S., Gomes, J. A., Singh, A. Corneal epithelial wound healing. Br. J. Ophthalmol. 78 (5), 401-408 (1994).
- Estil, S., Primo, E. J., Wilson, G. Apoptosis in shed human corneal cells. Invest. Ophthalmol. Vis. Sci. 41 (11), 3360-3364 (2000).
- Guay, J., et al. Regulation of actin filament dynamics by p38 map kinase-mediated phosphorylation of heat shock protein 27. J. cell. Sci. 110, 357-368 (1997).
- Park, J. W., et al. Differential expression of heat shock protein mRNAs under in vivo glutathione depletion in the mouse retina. Neurosci. Lett. 413 (3), 260-264 (2007).
- Rane, M. J., et al. Heat shock protein 27 controls apoptosis by regulating Akt activation. J. Biol. Chem. 278 (30), 27828-27835 (2003).
- Shin, K. D., et al. Blocking tumor cell migration and invasion with biphenyl isoxazole derivative KRIBB3, a synthetic molecule that inhibits Hsp27 phosphorylation. J. Biol. Chem. 280 (50), 41439-41448 (2005).
- Jain, S., et al. Expression of phosphorylated heat shock protein 27 during corneal epithelial wound healing. Cornea. 31 (7), 820-827 (2012).
- Alekseev, O. M., Richardson, R. T., Alekseev, O., O'Rand, M. G. Analysis of gene expression profiles in HeLa cells in response to overexpression or siRNA-mediated depletion of NASP. Reprod. Biol. Endocrinol. 7, 45 (2009).
- Park, H. Y., Kim, J. H., Lee, K. M., Park, C. K. Effect of prostaglandin analogues on tear proteomics and expression of cytokines and matrix metalloproteinases in the conjunctiva and corea. Exp. Eye. Res. 94 (1), 13-21 (2012).
- Voegeli, T. S., Currie, R. W. siRNA knocks down Hsp27 and increases angiotensin II-induced phosphorylated NF-kappaB p65 levels in aortic smooth muscle cells. Inflamm. Res. 58 (6), 336-343 (2009).
- Shi, B., Isseroff, R. R. Arsenite pre-conditioning reduces UVB-induced apoptosis in corneal epithelial cells through the anti-apoptotic activity of 27 kDa heat shock protein (HSP27). J. Cell. Physiol. 206 (2), 301-308 (2006).
- Shen, E. P., et al. Comparison of corneal epitheliotrophic capacity among different human blood-derived preparations. Cornea. 30 (2), 208-214 (2011).
- Song, I. S., et al. Heat shock protein 27 phosphorylation is involved in epithelial cell apoptosis as well as epithelial migration during corneal epithelial wound healing. Exp Eye Res. 118 (1), 36-41 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены