Method Article
Enquête basée sur l'interférence ARN de la fonction de la protéine de choc thermique 27 pendant la cicatrisation cornéenne épithéliale Wound
Dans cet article
Résumé
Herein, we present a protocol to use heat shock protein 27 (HSP27)-specific small interfering RNA to assess the function of HSP27 during corneal epithelial wound healing. RNA interference is the best method for effectively knocking-down gene expression to investigate protein function in various cell types.
Résumé
Small interfering RNA (siRNA) is among the most widely used RNA interference methods for the short-term silencing of protein-coding genes. siRNA is a synthetic RNA duplex created to specifically target a mRNA transcript to induce its degradation and it has been used to identify novel pathways in various cellular processes. Few reports exist regarding the role of phosphorylated heat shock protein 27 (HSP27) in corneal epithelial wound healing. Herein, cultured human corneal epithelial cells were divided into a scrambled control-siRNA transfected group and a HSP27-specific siRNA-transfected group. Scratch-induced directional wounding assays, and western blotting, and flow cytometry were then performed. We conclude that HSP27 has roles in corneal epithelial wound healing that may involve epithelial cell apoptosis and migration. Here, step-by-step descriptions of sample preparation and the study protocol are provided.
Introduction
Les cellules épithéliales de la cornée (CECS) tombent en continu dans le film lacrymal, alors qu'ils sont simultanément remplacées par des cellules du limbe et des couches basales épithéliales de la cornée. 1 Divers facteurs de stress extrinsèques peuvent induire l'apoptose et la desquamation de CECs. 2 Les protéines de choc thermique (HSP) sont hautement conservée et peut être divisé en deux familles selon la taille moléculaire. 3 la plus grande famille HSP comprend HSP90, HSP70 et HSP60, et la plus petite famille comprend HSP27. 4 la phosphorylation de HSP27 est connue pour jouer un rôle important dans la survie des cellules et est nécessaire pour la migration cellulaire en raison du rôle de cette protéine dans l' actine remodelage. 5-7 par conséquent, nous avons tenté de tester le rôle potentiel de HSP27 phosphorylation dans la migration de la CCE et de l' apoptose dans un modèle in vitro de cicatrisation épithéliale.
L'interférence ARN (ARNi) en utilisant soit des petites ou courtes ARN interférents (siRNA) a gel' intérêt à la fois la biologie également exonéré fondamentale et appliquée, car elle permet potentiellement l'expression d'un gène d'intérêt à être renversé vers le bas. 8 Ici, nous avons utilisé siRNA spécifiques HSP27 pour évaluer la contribution des HSP27 à la guérison de la plaie de la CCE et de l' apoptose. Les méthodes traditionnelles d'ARNi pour le gene knock-down dans les cellules utilisent des duplexes d'ARN synthétiques, comprenant deux oligonucléotides 21-mères non modifiés qui peuvent être assemblés pour créer des ARNsi. L'ARNi siRNA que nous avons utilisé dans cette étude est une méthode simple et très efficace pour transfecter des cellules, et ce réactif travaille avec diverses lignées cellulaires immortalisées. Dans la présente étude, nous démontrons les méthodes utilisées pour cette analyse, y compris un essai induit scratch-plaie directionnelle, western blot, siRNA essai de transfection, immunofluorescence et cytométrie en flux.
Protocole
1. Cell Line
- Culture 10 6 cellules télomérase immortalisées humaines de cornée épithéliale (HCECs) dans une plaque à 6 puits (densité: 1039,9 cellules / mm 2) dans un incubateur à 37 ° C avec une atmosphère de CO2 à 5% en utilisant un milieu de croissance de l' épithélium bronchique (BEGM) jusqu'à ce que ils atteignent 95% de confluence.
2. Analyse par Western Blot après Création épithéliales Wounds Scratch
- Streak une pointe stérile de 200 pi de pipette sur la surface d'un puits d'confluentes HCECs cultivées quatre fois par boîte dans une enceinte de sécurité biologique (classe II, type A2) et incuber HCECs séparément dans un incubateur à 37 ° avec une atmosphère de CO 2 de 5% pendant 1, 5, 10, 30, 60 et 120 min.
- Utiliser une plaque de 6 puits pour six échantillons différents en fonction de la durée d'incubation après la lésion de l'épithélium de la cornée.
- Laver les monocouches HCEC blessés trois fois avec PBS 1x, puis ajouter 2,0 ml BEGM à chaque puits.
- Détachez HCECs utilisant 2ml de 0,25% de trypsine-acide éthylènediaminetétra-acétique (EDTA) par puits pendant 5 minutes, centrifuger à 900 g pendant 5 min dans un tube de 15 ml et aspirât de trypsine-EDTA à l'aide d'une pipette de 1 ml.
- Suspendre HCECs avec 1 ml 1x PBS et les transférer dans un tube de 1,5 ml.
- Centrifugeuse HCECs à 10.000 xg pendant 15 sec et aspirée 1x PBS en utilisant une pipette de 1 ml.
- Remettre en suspension HCECs dans 100 de tampon de lyse glacé pl (Tris 10 mM, NaCl 10 mM, EDTA 2 mM mM , NaF 25, 2 mM de Na 3 VO 4, le fluorure de phénylméthanesulfonyle 1 mM [PMSF], les inhibiteurs de la protéase [1 pM de pepstatine A, 1 pM de leupeptine et 0,1 uM d'aprotinine] et 0,5% de Triton X-100 [pH 7]) et mélangez-les bien.
- Incuber les cellules pendant 30 min sur de la glace pour induire la lyse des cellules.
- lysats Centrifugeuse à 4 ° C à 10000 xg pendant 15 min, puis transférer surnageants frais tubes de 1,5 ml (90 aliquotes) et les stocker à -80 ° C.
- Déterminer la concentration totale en protéines des lysats cellulaires en utilisant la pr Bradfordtest otein. 9
- Charge de 30 ug de protéines cellulaires totales dans un gel d'acrylamide à 10% ou 12% pour le sodium dodécyl électrophorèse sur gel de polyacrylamide (SDS-PAGE), puis par électrophorèse transfert séparés des bandes de protéines sur des filtres de nitrocellulose avec un courant de 200 mA pendant 1 heure à 4 ° C C à utiliser dans des essais western blot.
- Bloc nitrocellulose filtres membranes avec 5% de lait écrémé dans une solution saline tamponnée au Tris avec du Tween 20 (TBST) pendant 1 heure, ajouter des anticorps polyclonaux de lapin primaire contre HSP27 non-phosphorylée (1: 1000 dilution) ou primaire d'anticorps polyclonaux de lapin contre phosphorylée HSP27 (1 : 1000 dilution) dans 5% d'albumine de sérum bovin (BSA), et on incube les membranes pendant une nuit à 4 ° C sur un agitateur.
- Détecter les bandes immunoréactives en utilisant des anticorps de chèvre anti-lapin conjugués à la peroxydase de raifort (dilution 1: 10000) dans 5% de BSA après lavage pendant 10 minutes, 3 fois avec du TBST.
- Incuber la membrane dans les réactifs de luminol Western Blot (6-7 ml par 10 cm x 5 cm de la membrane) pendant 1 min à température ambiante.
- Retirer la membrane de la solution de réactif, éliminer le liquide en excès avec une serviette absorbante, et placer dans un protecteur de feuille de plastique.
- Travailler dans une pièce sombre avec une lumière sûre, placer la membrane recouverte d'une cassette de film avec le côté de la protéine vers le haut.
- Placez le film X-ray sur le dessus de la membrane et exposer pendant 1 min.
3. Dosage de transfection de siRNA 10
- HCECs de culture à 5 x 10 5 cellules / puits dans une plaque à 6 puits dans un incubateur à 37 ° C avec une atmosphère de CO2 à 5% en utilisant BEGM jusqu'à ce qu'elles atteignent 95% de confluence.
- On dilue le réactif de transfection (2,5 ou 7,5 pi) avec 100 pi de réduction milieu sérique pour la transfection (le facteur de dilution est de 41 ou 14,3) et on dissout le HSP27 spécifique et brouillée siRNA contrôle dans 100 ul de milieu sérique réduit pour créer 10 ou 50 nM de spécifiques HSP27 et embrouillé siRNA contrôle.
- Mélanger 100 μ; La solution de siRNA l avec 100 ul de réactif de transfection dilué (1: 1 ratio) et on incube le mélange pendant 15 min à température ambiante.
- Ajouter les complexes ARNsi-lipide aux cellules. Puis, après 4 médias de changement h pour terminer BEGM et incuber les cellules pendant 2 jours à 37 ° C.
- Analyser les cellules transfectées par western blot, comme décrit des sections 4.1 à 4.7.
4. Analyse par transfert de Western pour les cellules transfectées 11 siARN
- Extrait spécifiques HSP27 et brouillés HCECs siRNA-transfectées contrôle dans une enceinte de sécurité biologique en utilisant 100 pi de tampon de lyse glacé (Tris 10 mM, NaCl 10 mM, acide éthylènediaminetétraacétique 2 mM (EDTA), mM NaF 25, 2 mM Na 3 VO 4, 1 mM de fluorure de phénylméthanesulfonyle (PMSF), les inhibiteurs de protéase, et 0,5% de Triton X-100, pH 7).
- Incuber les cellules pendant 30 min sur de la glace pour induire la lyse des cellules.
- lysats Pellet à 10.000 xg pendant 15 minutes, puis transférer surnageants frais 1,5 ml baignoirees (90 ul aliquotes) et les stocker à -80 ° C.
- Déterminer les concentrations protéiques des lysats cellulaires en utilisant le dosage des protéines de Bradford. 9
- Charger les échantillons avec des quantités égales de protéines cellulaires totales sur un gel d'acrylamide 10% ou 12%, sous réserve du gel à SDS-PAGE, et le transfert électrophorétique les bandes de protéines séparées à des filtres de nitrocellulose avec un courant de 200 mA pendant 1 h à 4 ° C à utiliser dans des essais western blot.
- Bloc filtre de nitrocellulose membranes avec 5% de lait écrémé dans une solution saline tamponnée au Tris avec du Tween 20 (TBST) pendant 1 heure, ajouter des anticorps primaires contre phosphorylée et non phosphorylée HSP27 (1: 1000 dilution), phosphorylée Akt (1: 1000 dilution), non phosphorylée Akt (1: 1000 dilution, utilisée comme marqueur de la survie cellulaire), Bcl-2-protéine associée à X (1: 1000 dilution utilisée comme une protéine pro-apoptotique), et glycéraldéhyde-3-phosphate déshydrogénase (GAPDH; 1 : 200 dilution utilisée comme témoin de charge) dans 5% d'albumine de sérum bovin (BSA), etincuber les membranes pendant une nuit à 4 ° C sur un agitateur.
- Détecter les bandes immunoréactives en utilisant des anticorps de chèvre anti-lapin conjugués à la peroxydase de raifort (dilution 1: 10000) dans 5% de BSA après lavage 3 fois avec du TBST, 10 min chaque lavage.
- Incuber la membrane dans les réactifs de luminol Western Blot (6-7 ml par 10 cm x 5 cm de la membrane) pendant 1 min à température ambiante.
- Retirer la membrane de la solution de réactif, éliminer le liquide en excès avec une serviette absorbante, et placer dans un protecteur de feuille de plastique.
- En travaillant dans une chambre noire avec une lumière inactinique, placer la membrane recouverte d'une cassette de film avec le côté de la protéine vers le haut.
- Placez le film X-ray sur le dessus de la membrane et exposer pendant 1 min.
5. Scratch induite Directional Blessant évaluation Dosage de migration cellulaire 12
- Dans une enceinte de sécurité biologique, faire une blessure en faisant glisser une pointe de pipette stérile sur la surface d'un puits de cultures confluentes despécifiques à l'HSP27 ARNsi-transfectée ou HCECs ARNsi transfectée contrôle brouillé.
- Immédiatement après la blessure, se laver les cellules deux fois avec du phosphate de 1x solution saline tamponnée (PBS) et les maintenir dans les cultures BEGM dans un incubateur à 37 ° C avec une atmosphère de CO2 à 5% pendant 24 heures après la blessure.
- Photographie images HCEC utilisant un microscope droit à grossissement 100X 24 heures après la blessure et d'effectuer l'aplatissement de fond en utilisant le filtre commande dans le logiciel d'analyse d'image.
- Utilisation de la commande Sélectionner des mesures, définir la zone d'intérêt (AOI) avec la même forme polygonale taille qui peut couvrir perpendiculairement de bout en bout de la blessure initiale, et de déterminer trois AOI différent dans la zone blessée de chaque échantillon.
- compter automatiquement le nombre de cellules dans chaque champ en utilisant les Count / Taille des options de menu Mesure.
6. cytométrie de flux Analyse de l'apoptose
- Culture siRNA-transfectées et HSP27 spécifique de contrôle sHCECs chacun contenant 10nM de siRNA ARNi transfecté à une concentration de 5 x 10 5 cellules / puits dans des plaques à 6 puits jusqu'à ce que les cellules atteignent 95% de confluence dans un incubateur à 37 ° C avec une atmosphère de CO2 à 5% dans BEGM.
- Détacher HCECs en utilisant 2 ml de 0,25% de trypsine-EDTA par puits pendant 5 minutes, centrifuger à 900 g pendant 5 min dans un tube de 15 ml et aspirât de trypsine-EDTA à l'aide d'une pipette de 1 ml.
- Laver les cellules deux fois avec du PBS froid puis remettre en suspension les cellules dans 1 x tampon (0,1 M HEPES / NaOH [pH 7,4], 1,4 M de NaCl et 25 mM de CaCl2) se liant à une concentration de 10 6 cellules / ml.
- Transférer 100 pl de suspension de cellules (1 x 10 5 cellules) dans un tube de culture de 5 ml.
- Ajouter 5 ul d'isothiocyanate de fluorescéine conjugué à l'annexine V et 5 pi d'iodure de propidium.
- vortexer doucement les cellules et les incuber pendant 15 min à température ambiante dans l'obscurité.
- Ajouter 200 pi de tampon de liaison 1x à chaque tube et on analyse les cellules par un flux cytometer à 1 h.
Résultats
L'expression de HSP27 phosphorylée significativement augmentée à 5, 10, et 30 minutes après zéro blessant comparé à HCECs 13 non blessés. L' analyse par transfert de Western a révélé que l'expression de HSP27 phosphorylée et la protéine Akt phosphorylée ont tous deux été significativement réduite, alors que l'expression de Bax était significativement augmentée dans HCECs d'ARNsi spécifique à une transfection HSP27 (figure 1A-E). L'expression de HSP27 phosphorylée a été réduite de 30% et 40% en 10 nM et 50 nM de HSP27-spécifique des cellules siARN transfectées, respectivement, par rapport aux cellules de siARN transfectées contrôle, mais l'expression de HSP27 phosphorylée n'a pas été réduite (figure 1A-B ). En outre, l'expression de HSP27 non phosphorylé a été réduite de 20% et 30% en 10 nM et 50 nM de HSP27 spécifique des cellules transfectées de siARN, respectivement, mais l'expression de HSP27 non phosphorylée n'a pas été réduite (figure 1A et C </ Strong>).
Le dosage de la blessure directionnelle induite aux rayures a indiqué que 24 h après blessantes cellules siARN transfectées HSP27-spécifiques, à 10 et 50 nM présentait une réduction des migrations (Figure 2). En outre, HCECs ARNsi transfectée HSP27 spécifiques ont subi une mort cellulaire apoptotique et nécrotique plus , comparé aux cellules transfectées siRNA contrôle brouillé par cytométrie de flux (Figure 3).
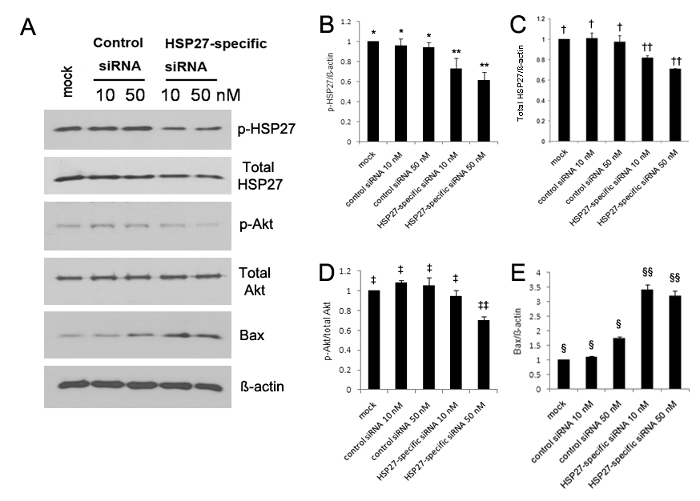
Figure 1. Analyse par transfert de Western en utilisant des anticorps contre HSP27 phosphorylée (p-HSP27), HSP27 non phosphorylée (non-p-HSP27), Akt phosphorylée (p-Akt) comme marqueur de survie cellulaire, non-Akt phosphorylée (non p-Akt), la protéine Bcl-2eassociated X (Bax) sous forme d' une protéine pro-apoptotique et de la GAPDH (a). L'expression de HSP27 phosphorylée et non phosphorylée et protéine Akt phosphorylée a diminué significativement (B - D), toutefois, l'expression de Bax significativement augmenté dans les HCECs ARNsi transfectée spécifiques à HSP27 (E), par rapport à celle observée dans les cellules siARN transfectées témoins (p <0,05). L'expression de HSP27 phosphorylée a été réduite de 30% et 40% en 10 nM et 50 nM de HSP27-spécifique des cellules siARN transfectées par rapport à un contrôle simulé, respectivement, mais l'expression de HSP27 phosphorylée n'a pas été réduite à 10 nM et 50 nM de siRNA contrôle les cellules transfectées (B). **, *; †, ††; ‡, ‡‡; §, §§: une différence statistiquement significative entre les groupes (p <0,05). Les barres d'erreur représentent l' écart - type (SD). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
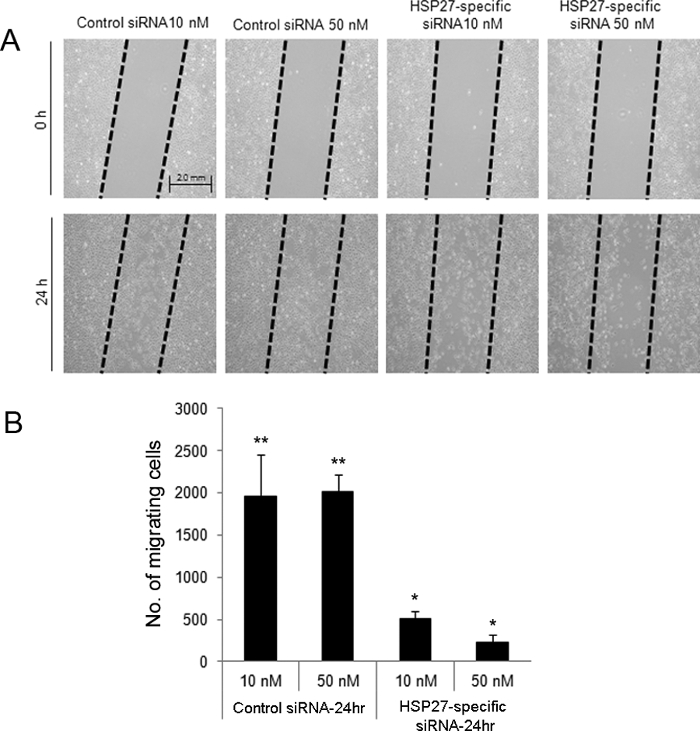
Figure 2. Scratch induite par dosage de blessure directionnelle pour évaluer la migration cellulaire après la blessure dans HCECs siRNA-transfectées. Une blessure à la rayure a été créée dans le contrôle et les cellules siARN transfectées HSP27 spécifiques (A). Les cellules ont été retirées des zones «traînés». À 24 h après la lésion, 10 et 50 nM d'ARNsi de cellules transfectées spécifiques à HSP27 présentait un nombre plus faible de cellules migrant par rapport aux cellules transfectées d'ARNsi 10 et 50 nM de commande (B). ** Et * indiquent une différence statistiquement significative entre les groupes (p <0,05). Les données sont présentées en moyenne ± écart - type. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.

Figure 3. cytométrie de flux de 50 nM de contrôle brouillé siRNA et les cellules HSP27 spécifiques siARN transfectées humaines cornéennes épithéliales (HCECs) marquées avec de l' annexine V et PI (A et B). Le pourcentage des cellules totales dans les quadrants correspond aux cellules précoces apoptotiques (cellules annexine V-positives et PI-négatives, Q4, en bas à droite), les cellules fin apoptotiques (annexine V-positif et PI-positifs cellules, Q2, en haut à droite), et les cellules nécrotiques (cellules V-négatives et PI-positif annexine, Q1, en haut à gauche). HCECs siRNA-transfecter spécifiques HSP27 avaient la mort cellulaire plus apoptotique et nécrotique que des cellules de contrôle de siARN transfectées. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
Discussion
In this present study, we evaluated the potential role of HSP27 in corneal epithelial wounding using in vitro approaches. The critical steps involved siRNA transfection for HSP27 knock-down to observe the function of HSP27 in cells subjected to stress. Notably, a role for HSP27 was revealed by these experiments in epithelial cell migration and apoptosis during corneal epithelial wound healing. Unlike previous studies10 that used rat HSP27-specific siRNA to transfect vascular smooth muscle cells, we used a siRNA transfection technique to modify gene expression in human CECs to effectively knock-down HSP27-specific gene expression and study HSP27 function. Although there were differences in the target sequence that we used as well as in the cell density, final siRNA concentration, and incubation time, the protocol recommended by the manufacturer was explicitly followed. In terms of alternative methods, HSP27 knock-out mouse may be used to show if HSP27 phosphorylation involves epithelial migration and cell apoptosis. However, it is difficult to monitor the change of HSP27 phosphorylation in mouse model, because its phosphorylation occurs in very short period during epithelial wound healing.
There were several limitations to the present study. First, the in vitro environment in which we cultured human CECs certainly differed from the in vivo environment for human CECs, especially regarding cell survival. Second, the siRNA used in this study was not specific to the phosphorylated form of HSP27 as it affected the overall expression levels of HSP27, including both phosphorylated and non-phosphorylated forms.
In the future, a clinical application of these procedures would be to apply HSP27 to live human wounded corneas. We hope that the current findings will help to advance treatments of corneal epithelial tissue damage.
Déclarations de divulgation
Les auteurs ont aucun intérêt financier ou de propriété dans tous les matériaux ou procédés mentionnés dans cette étude.
Remerciements
Cette étude a été soutenue par la subvention de recherche pour étudiants (13-14) de l'Université d'Ulsan College of Medicine, Seoul, Corée et une subvention (2014-464) de l'Institut Asan for Life Sciences, Séoul, Corée.
matériels
| Name | Company | Catalog Number | Comments |
| Biological safety cabinet | CHC LAB Co.Ltd, Daejeon, Republic of Korea | CHC-777A2-06 | Class II, Type A2 |
| Stealth RNAi™ siRNA | Thermo Fisher Scientific, Inc., Waltham, MA | RNAi siRNA; scrambled control-siRNA and HSP27-specific siRNA | |
| BEGMTM | Lonza, Inc., Walkersville, MD | CC-3171, CC4175 | Bronchial epithelium growth medium |
| Protease inhibitor | Sigma-Aldrich, Inc., St. Louis, MO | P8340 ,P7626 | 1 μM Pepstatin A, 1 μM Leupeptin, 0.1 μM Aprotinin |
| Bradford protein assay | Bio-Rad Laboratories, Hercules, CA | #500-0001 | Bradford protein assay |
| Nitrocellulose filters | Amersham, Little Chalfont, UK | RPN3032D | Western blotting membrane |
| Non-phosphorylated HSP27 | Abcam Inc., Cambridge, MA | ab12351 | 1:1,000 dilution (Total HSP27) |
| Phosphorylated HSP27 (Ser85) | Abcam Inc., Cambridge, MA | ab5594 | 1:1,000 dilution HSP27 was phosphorylated at Ser85 |
| Lipofectamine® RNAiMAX reagent | Invitrogen, Carlsbad, CA | 13-778-075 | Transfection reagent |
| Phosphorylated Akt (Ser473) | Cell Signaling Technology, Danvers, MA | No. 4060 | 1:1,000 dilution Akt was phosphorylated at Ser473 (cell survival marker) |
| Non-phosphorylated Akt | Cell Signaling Technology, Danvers, MA | No. 4061 | 1:1,000 dilution (Total Akt) |
| Bcl-2-associated X protein | Cell Signaling Technology, Danvers, MA | No. 4062 | 1:1,000 (anti-apoptotic protein marker) |
| GAPDH | Santa Cruz Biotechnology, Santa Cruz, CA | No. 4063 | 1:1,000 loading control marker (house keeping gene) |
| Horseradish peroxidase-conjugated goat anti-rabbit antibodies | Thermo Fisher Scientific, Inc., Waltham, MA | NCI1460KR | 1:10,000 dilution |
| OPTI-MEM | Invitrogen, Carlsbad, CA | 31985 | reduced serum medium for transfection |
| Image analysis software | Olympus, Inc., Tokyo, Japan | Image-Pro Plus 5.0 | |
| Skimed milk powder | Carl Roth GmbH + Co. KG, Karlstruhe, Germany | T145.2 | |
| Tris | Amresco LCC, Inc. Solon, OH | No-0497 | |
| Sodium Chloride | Amresco LCC, Inc. Solon, OH | No-0241 | |
| Six well culture plate | Thermo Fisher Scientific, Inc., Waltham, MA | 140675 | 35.00 mm diameter / well |
| 24-well culuture dish | Thermo Fisher Scientific, Inc., Waltham, MA | 142475 | |
| Orbital shaker | N-Bioteck, Inc., Seoul, South Korea | NB1015 | |
| Bovine serum albumin | Santa Cruz Biotechnology, Santa Cruz, CA | sc-2323 | |
| BDFACSCantoTM II | BD Biosciences, Franklin Lakes, NJ | Flow cytometry | |
| X-Ray Film | Kodak, Rochester, NY | Medical X-Ray Cassette with Green 400 Screen | |
| western blotting luminol reagent | Santa Cruz Biotechnology, Santa Cruz, CA | sc-2048 | |
| FITC Annexin V Apoptosis Detection Kit I | BD Biosciences, Franklin Lakes, NJ | 556547 |
Références
- Dua, H. S., Gomes, J. A., Singh, A. Corneal epithelial wound healing. Br. J. Ophthalmol. 78 (5), 401-408 (1994).
- Estil, S., Primo, E. J., Wilson, G. Apoptosis in shed human corneal cells. Invest. Ophthalmol. Vis. Sci. 41 (11), 3360-3364 (2000).
- Guay, J., et al. Regulation of actin filament dynamics by p38 map kinase-mediated phosphorylation of heat shock protein 27. J. cell. Sci. 110, 357-368 (1997).
- Park, J. W., et al. Differential expression of heat shock protein mRNAs under in vivo glutathione depletion in the mouse retina. Neurosci. Lett. 413 (3), 260-264 (2007).
- Rane, M. J., et al. Heat shock protein 27 controls apoptosis by regulating Akt activation. J. Biol. Chem. 278 (30), 27828-27835 (2003).
- Shin, K. D., et al. Blocking tumor cell migration and invasion with biphenyl isoxazole derivative KRIBB3, a synthetic molecule that inhibits Hsp27 phosphorylation. J. Biol. Chem. 280 (50), 41439-41448 (2005).
- Jain, S., et al. Expression of phosphorylated heat shock protein 27 during corneal epithelial wound healing. Cornea. 31 (7), 820-827 (2012).
- Alekseev, O. M., Richardson, R. T., Alekseev, O., O'Rand, M. G. Analysis of gene expression profiles in HeLa cells in response to overexpression or siRNA-mediated depletion of NASP. Reprod. Biol. Endocrinol. 7, 45 (2009).
- Park, H. Y., Kim, J. H., Lee, K. M., Park, C. K. Effect of prostaglandin analogues on tear proteomics and expression of cytokines and matrix metalloproteinases in the conjunctiva and corea. Exp. Eye. Res. 94 (1), 13-21 (2012).
- Voegeli, T. S., Currie, R. W. siRNA knocks down Hsp27 and increases angiotensin II-induced phosphorylated NF-kappaB p65 levels in aortic smooth muscle cells. Inflamm. Res. 58 (6), 336-343 (2009).
- Shi, B., Isseroff, R. R. Arsenite pre-conditioning reduces UVB-induced apoptosis in corneal epithelial cells through the anti-apoptotic activity of 27 kDa heat shock protein (HSP27). J. Cell. Physiol. 206 (2), 301-308 (2006).
- Shen, E. P., et al. Comparison of corneal epitheliotrophic capacity among different human blood-derived preparations. Cornea. 30 (2), 208-214 (2011).
- Song, I. S., et al. Heat shock protein 27 phosphorylation is involved in epithelial cell apoptosis as well as epithelial migration during corneal epithelial wound healing. Exp Eye Res. 118 (1), 36-41 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon