Method Article
角膜上皮伤口愈合过程中的热休克蛋白27的功能为基础的RNA干扰研究
摘要
Herein, we present a protocol to use heat shock protein 27 (HSP27)-specific small interfering RNA to assess the function of HSP27 during corneal epithelial wound healing. RNA interference is the best method for effectively knocking-down gene expression to investigate protein function in various cell types.
摘要
Small interfering RNA (siRNA) is among the most widely used RNA interference methods for the short-term silencing of protein-coding genes. siRNA is a synthetic RNA duplex created to specifically target a mRNA transcript to induce its degradation and it has been used to identify novel pathways in various cellular processes. Few reports exist regarding the role of phosphorylated heat shock protein 27 (HSP27) in corneal epithelial wound healing. Herein, cultured human corneal epithelial cells were divided into a scrambled control-siRNA transfected group and a HSP27-specific siRNA-transfected group. Scratch-induced directional wounding assays, and western blotting, and flow cytometry were then performed. We conclude that HSP27 has roles in corneal epithelial wound healing that may involve epithelial cell apoptosis and migration. Here, step-by-step descriptions of sample preparation and the study protocol are provided.
引言
角膜上皮细胞(CEC上)不断脱落到泪膜,而他们同时由角膜缘和角膜上皮基底层细胞所替代。1各种外在压力能促使中欧国家的凋亡和脱屑。2热休克蛋白(HSP)是高度保守的,并且可以根据分子大小被分为两个家族。3最大HSP家族包括HSP90,HSP70和HSP60,而较小的家族包括HSP27 4 HSP27的磷酸化是已知在细胞存活中起重要作用和所需的细胞迁移,因为这种蛋白在肌动蛋白重塑的作用。5-7。因此,我们试图测试上皮伤口愈合的体外模型HSP27磷酸化在CEC迁移和凋亡的潜在作用。
RNA干扰或者使用小或短干扰RNA(RNAi)技术(siRNA)的有GE在基础和应用生物学nerated兴趣,因为它可能允许击倒任何感兴趣的基因的表达。8在此,我们使用的特定HSP27-siRNA转以评估HSP27的给CEC伤口愈合和细胞凋亡的贡献。传统的RNAi方法在细胞中的基因敲除使用合成的RNA双链体,包括可组装到创建的siRNAs 2未修饰21聚体寡核苷酸。所述RNAi的siRNA,我们在此本研究中使用的是转染细胞的简单高效的方法,以及该试剂可与各种永生化细胞系。在此研究中,我们证明用于该分析的方法,包括一个刮诱导定向伤口测定法,western印迹,siRNA转染测定法,免疫荧光测定法,和流式细胞术。
研究方案
1.细胞系
- 培养10 6端粒酶永生化人角膜上皮在一个6孔板的细胞(HCECs):在37℃培养箱中使用支气管上皮细胞生长培养基(BEGM)于5%CO 2气氛(密度1039.9细胞/毫米2),直到他们达到95%汇合。
2. Western印迹分析创建上皮擦伤伤口后,
- 横跨汇合培养HCECs的阱的表面上的条纹无菌200μl的枪头每个培养皿四次在生物安全柜(II级,A2型)和在37℃培养箱用5% 的 CO 2气氛中分别孵育HCECs 1,5,10,30,60,和120分钟。
- 根据角膜上皮创伤后的孵育时间用一个6孔板为六个不同的样品。
- 洗负伤HCEC单层三次用1×PBS,然后加入2.0毫升的BEGM到每个孔中。
- 分离使用2 HCECs毫升0.25%胰蛋白酶 - 乙二胺四乙酸(EDTA),每孔5分钟,离心,在900×g离心在一个15毫升管5分钟,并吸出胰蛋白酶-EDTA使用1毫升吸移管。
- 暂停HCECs用1ml 1×PBS中,并将它们传送到1.5ml管中。
- 以10,000×g离心15秒离心机HCECs和吸出1×PBS中使用1毫升吸管。
- 悬浮HCECs在100μl冰冷的裂解缓冲液(10mM的Tris,10 mM氯化钠,2mM EDTA的,25毫氟化钠,2毫的Na 3 VO 4,1mM的苯甲基磺酰氟[PMSF],蛋白酶抑制剂[1μM的胃酶抑素A, 1μM的亮肽素,和0.1μM的抑肽酶]和0.5%的Triton X-100 [pH为7]),并将它们混合均匀。
- 孵育细胞30分钟,在冰上以诱导细胞裂解。
- 离心裂解物在10,000×g离心15分钟,4℃,然后上清液转移至新的1.5毫升管(90微升等份),并将它们存储在-80℃。
- 确定使用Bradford PR细胞裂解物的总蛋白浓度otein检测。9
- 负载30微克总细胞蛋白质成10%或12%丙烯酰胺凝胶进行十二烷基硫酸钠 - 聚丙烯酰胺凝胶电泳(SDS-PAGE),然后电泳转移分离蛋白带向硝酸纤维素滤膜用200毫安的电流1小时,在4℃ C到免疫印迹试验使用。
- 块硝酸纤维素滤膜,用5%脱脂在Tris缓冲盐水乳用吐温20(TBST)1小时后,添加初级兔多克隆抗体对非磷酸化的HSP27(1:1000稀释)或抗磷酸HSP27初级兔多克隆抗体(1 :1,000稀释度),在5%牛血清白蛋白(BSA),并在4℃在摇床上过夜孵育该膜。
- 用TBST洗涤后5%BSA的10分钟3次:检测用辣根过氧化物酶缀合的山羊抗 - 兔抗体免疫反应条带(10,000稀释1)。
- 在免疫印迹鲁米诺试剂孵化膜(6-7米升每10cm×5厘米膜),在室温下1分钟。
- 移除试剂溶液的膜,除去多余的液体,具有吸收巾,并将其放置在一个塑料片保护。
- 在黑暗的房间提供一个安全的工作灯,将覆盖膜在胶卷暗盒与蛋白质的一面朝上。
- 放置在膜顶部X射线胶片和暴露1分钟。
3. siRNA转染分析10
- 在5×10 5细胞培养HCECs /孔在37℃孵化用BEGM直到他们达到95%汇合于5%CO 2气氛中的6孔板中。
- 稀释转染试剂(2.5或7.5微升)与转(稀释倍数为41或14.3)100微升减少血清中和溶解HSP27特异性的,并在100微升炒对照siRNA降低血清中创建的10或50纳米HSP27特异性和炒对照siRNA。
- 混合100μ;用100μl稀释转染试剂升siRNA溶液(1:1的比例),并孵育混合物在室温下15分钟。
- 所述siRNA脂质复合物添加到细胞中。然后经过4小时改变介质在37℃下完成BEGM孵育细胞2天。
- 通过Western印迹分析转染细胞从4.1节所述4.7。
4. Western blot检测用于siRNA转染细胞11
- 提取HSP27特异性和使用100μl的冰冷的裂解缓冲液(10mM的Tris,10 mM氯化钠,2mM的乙二胺四乙酸(EDTA),25mM的氟化钠,2毫的Na 3 VO加扰对照siRNA转染HCECs在生物安全柜4,1mM的苯甲基磺酰氟(PMSF),蛋白酶抑制剂,和0.5%的Triton X-100,pH 7)中。
- 孵育细胞30分钟,在冰上以诱导细胞裂解。
- 以10,000 xg离心沉淀裂解物15分钟,然后上清转移至新的1.5mL桶ES(90微升等份),并将它们存储在-80℃。
- 确定使用Bradford蛋白测定的细胞裂解物的蛋白浓度。9
- 与在10%或12%丙烯酰胺凝胶等量总细胞蛋白的负荷样品,若使凝胶进行SDS-PAGE,并电泳以200毫安的电流,在4℃下传送所分离的蛋白带向硝酸纤维素滤膜1小时至在免疫印迹试验使用。
- 块硝酸纤维素滤膜,用5%脱脂在Tris缓冲盐水乳用吐温20(TBST)1小时后,添加抗磷酸和未磷酸化HSP27初级抗体(1:1000稀释度),磷酸化Akt(1:1,000稀释度),非磷酸化的Akt(1:1000稀释,用作细胞存活标记物),Bcl-2的相关X蛋白(1:1000稀释,用作促凋亡蛋白),和甘油醛-3-磷酸脱氢酶(GAPDH; 1 1:200稀释,用作上样对照)的5%牛血清白蛋白(BSA),并过夜孵育所述膜于4℃在振荡器上。
- 检测用辣根过氧化物酶缀合的山羊抗 - 兔抗体免疫反应条带(1:10,000稀释),在5%的BSA洗涤后用TBST 3次,每次10分钟洗涤。
- 在室温下1分钟孵育的印迹鲁米诺试剂膜(6-7毫升每10cm×5厘米膜)。
- 移除试剂溶液的膜,除去多余的液体,具有吸收巾,并将其放置在一个塑料片保护。
- 在黑暗的房间提供一个安全的工作灯,将覆盖膜与蛋白质面朝上胶片盒。
- 放置在膜的顶部X射线胶片和暴露1分钟。
5.划痕引起的定向伤人分析评估细胞迁移12
- 在生物安全柜,通过在表面上拖动的汇合培养物的孔中的一个无菌枪头使伤口HSP27特异性siRNA转染或炒对照siRNA转染HCECs。
- 伤人后立即,洗细胞两次用1×磷酸盐缓冲盐水(PBS),并保持它们在BEGM培养在37℃培养箱用5% 的 CO 2气氛中24小时伤人后。
- 照片使用正置显微镜放大100倍的图像HCEC伤后24小时,进行使用过滤背景压扁 在图像分析软件命令。
- 使用选择测量命令,确定利息(AOI)与同尺寸的多边形形状,可以从一端垂直覆盖,结束初期伤口的区域,并在每个样品的受伤面积确定三个不同的AOI。
- 自动计数使用计算/尺寸测量菜单选项在各个领域的手机号码。
凋亡6.流式细胞仪分析
- 文化HSP27特异性siRNA转染和CONTROL S的iRNA转染的含有各10nM的siRNA的HCECs在/孔在6孔板5×10 5个细胞的浓度,直到细胞达到在37℃培养箱中,在BEGM一个5%CO 2气氛中95%汇合。
- 使用1毫升吸管分离使用每孔2mL 0.25%胰蛋白酶-EDTA HCECs 5分钟,离心,在900×g离心在一个15毫升管5分钟,并吸出胰蛋白酶-EDTA。
- 用冷PBS洗涤细胞两次,然后以10 6个细胞/ ml的浓度重悬在1×细胞结合缓冲液(0.1M HEPES /氢氧化钠[pH为7.4],1.4 M氯化钠,和25mM 氯化钙 )。
- 转移100μl的细胞悬浮液(1×10 5个细胞)到5ml的培养管中。
- 添加5μl的异硫氰酸荧光素缀合的膜联蛋白V和5μl碘化丙啶。
- 轻轻涡旋细胞,并培育他们在黑暗中室温下15分钟。
- 通过流动Ç加入200μl1X结合缓冲液中向每个管和分析细胞1小时内ytometer。
结果
在5,10磷酸化HSP27的表达显著上升,划痕后30分钟,未受伤的HCECs 13伤人比较。免疫印迹分析表明,磷酸HSP27和磷酸化Akt的表达均被显著降低,而Bax的表达在特定HSP27-siRNA转染HCECs( 图1A-E)中的显著增加。减少了30%,在10nM的40%和HSP27特异性为50nM的siRNA转染的细胞,分别与对照siRNA转染的细胞,但磷酸化HSP27表达相比没有减少( 图1A-B中的磷酸化的HSP27表达)。此外,降低了非磷酸HSP27表达了20%和30%中为10nM和50nM HSP27特异性siRNA转染的细胞,分别,但非磷酸HSP27表达没有减少( 图1A和C的</ STRONG>)。
刮擦诱导定向伤人分析表明,在伤人,HSP27特异性siRNA转染细胞24小时后在10和50处具有降低的迁移( 图2)。此外,特定的HSP27-siRNA转染HCECs与通过流式细胞术( 图3)加扰对照siRNA转染的细胞相比,接受更多的凋亡和坏死性细胞死亡。
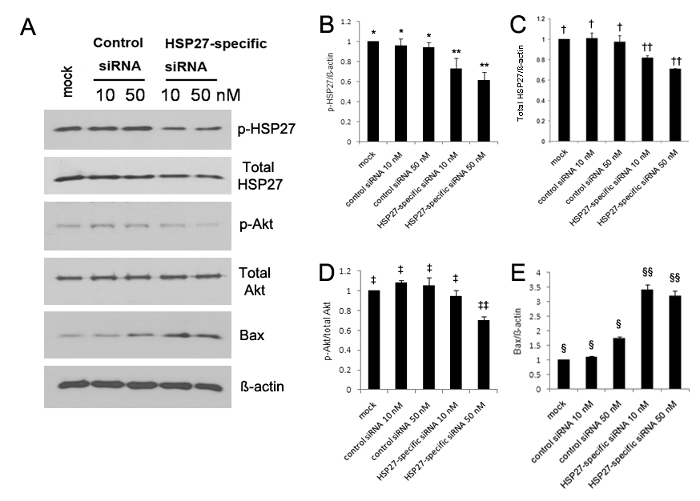
使用抗磷酸化的HSP27(对HSP27),非磷酸化HSP27(非对HSP27),磷酸化Akt(磷酸化Akt),为细胞存活标记,非磷酸化的Akt( 图1的Western印迹分析的非p-Akt蛋白),BCL-2eassociated X蛋白(BAX)作为促凋亡蛋白和GAPDH(A)。磷酸化和非磷酸化HSP27的表达磷酸化Akt显著下降(B - D)中 ,但是,Bax的表达在具体的HSP27-siRNA转染HCECs(E)的显著增加,与在对照siRNA转染的细胞中观察到相比(所有的p <0.05)。用30%和10nM的40%,与模拟控制,分别比较HSP27特异性为50nM的siRNA转染的细胞减少磷酸化的HSP27的表达,但磷酸化HSP27表达没有在10nM的减少和对照siRNA的50nM的-transfected细胞(B)。 **,*; †,††; ‡,‡‡; §,§§:组间有统计学显著差异(p <0.05)。误差条表示标准偏差(SD)。 请点击此处查看该图的放大版本。
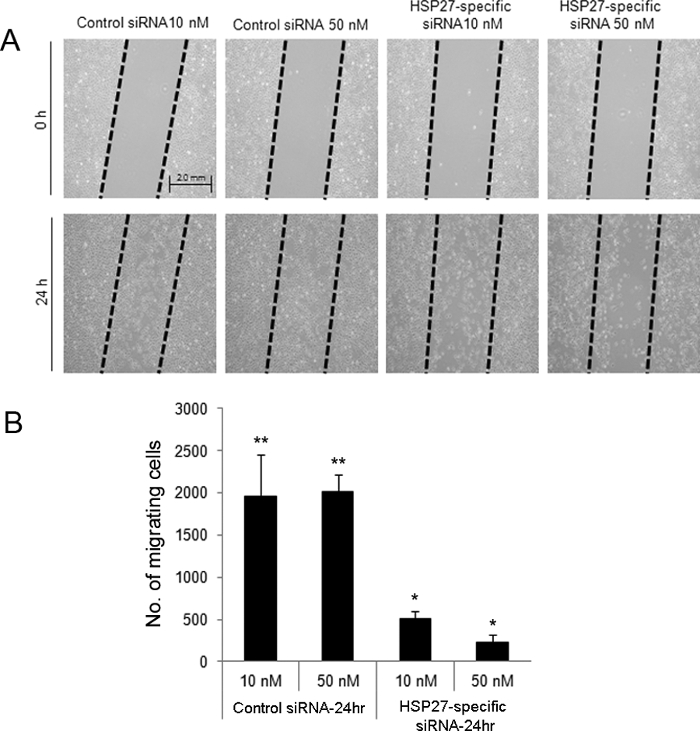
图2.划痕引起的定向伤人检测siRNA转染HCECs伤人后评估细胞迁移。划痕伤口是在控制和特定HSP27-siRNA转染细胞(A)创建的。细胞从"拖"区域移除。在受伤后24小时,具体HSP27-siRNA转染细胞的10和50处具有迁移细胞与10和50nM对照siRNA转染的细胞(B)相比的数字低。 ** *和指示组之间有统计学显著差异(p <0.05)。数据显示为平均值±标准差。 请点击此处查看该图的放大版本。
 <加扰控制siRNA和标记的膜联蛋白V和PI(A和B)特定HSP27-siRNA转染的人角膜上皮细胞(HCECs)的50纳米的登记/> 图3.流式细胞术。总细胞的象限的百分比对应于早期凋亡细胞(膜联蛋白V阳性和PI阴性细胞,Q4,右下),晚期凋亡细胞(膜联蛋白V阳性和PI阳性细胞,Q2,右上),和坏死细胞(膜联蛋白V-阴性和PI阳性细胞中,Q 1,左上)。具体HSP27-的siRNA转染HCECs具有比对照siRNA转染的细胞更凋亡和坏死的细胞死亡。 请点击此处查看该图的放大版本。
<加扰控制siRNA和标记的膜联蛋白V和PI(A和B)特定HSP27-siRNA转染的人角膜上皮细胞(HCECs)的50纳米的登记/> 图3.流式细胞术。总细胞的象限的百分比对应于早期凋亡细胞(膜联蛋白V阳性和PI阴性细胞,Q4,右下),晚期凋亡细胞(膜联蛋白V阳性和PI阳性细胞,Q2,右上),和坏死细胞(膜联蛋白V-阴性和PI阳性细胞中,Q 1,左上)。具体HSP27-的siRNA转染HCECs具有比对照siRNA转染的细胞更凋亡和坏死的细胞死亡。 请点击此处查看该图的放大版本。
讨论
In this present study, we evaluated the potential role of HSP27 in corneal epithelial wounding using in vitro approaches. The critical steps involved siRNA transfection for HSP27 knock-down to observe the function of HSP27 in cells subjected to stress. Notably, a role for HSP27 was revealed by these experiments in epithelial cell migration and apoptosis during corneal epithelial wound healing. Unlike previous studies10 that used rat HSP27-specific siRNA to transfect vascular smooth muscle cells, we used a siRNA transfection technique to modify gene expression in human CECs to effectively knock-down HSP27-specific gene expression and study HSP27 function. Although there were differences in the target sequence that we used as well as in the cell density, final siRNA concentration, and incubation time, the protocol recommended by the manufacturer was explicitly followed. In terms of alternative methods, HSP27 knock-out mouse may be used to show if HSP27 phosphorylation involves epithelial migration and cell apoptosis. However, it is difficult to monitor the change of HSP27 phosphorylation in mouse model, because its phosphorylation occurs in very short period during epithelial wound healing.
There were several limitations to the present study. First, the in vitro environment in which we cultured human CECs certainly differed from the in vivo environment for human CECs, especially regarding cell survival. Second, the siRNA used in this study was not specific to the phosphorylated form of HSP27 as it affected the overall expression levels of HSP27, including both phosphorylated and non-phosphorylated forms.
In the future, a clinical application of these procedures would be to apply HSP27 to live human wounded corneas. We hope that the current findings will help to advance treatments of corneal epithelial tissue damage.
披露声明
笔者在本研究中提及的任何材料或方法没有财务或专有权益。
致谢
这项研究是由医学,韩国首尔,蔚山大学学院的学生研究资助(13-14),并从峨山生命科学研究所,韩国首尔赠款(2014-464)的支持。
材料
| Name | Company | Catalog Number | Comments |
| Biological safety cabinet | CHC LAB Co.Ltd, Daejeon, Republic of Korea | CHC-777A2-06 | Class II, Type A2 |
| Stealth RNAi™ siRNA | Thermo Fisher Scientific, Inc., Waltham, MA | RNAi siRNA; scrambled control-siRNA and HSP27-specific siRNA | |
| BEGMTM | Lonza, Inc., Walkersville, MD | CC-3171, CC4175 | Bronchial epithelium growth medium |
| Protease inhibitor | Sigma-Aldrich, Inc., St. Louis, MO | P8340 ,P7626 | 1 μM Pepstatin A, 1 μM Leupeptin, 0.1 μM Aprotinin |
| Bradford protein assay | Bio-Rad Laboratories, Hercules, CA | #500-0001 | Bradford protein assay |
| Nitrocellulose filters | Amersham, Little Chalfont, UK | RPN3032D | Western blotting membrane |
| Non-phosphorylated HSP27 | Abcam Inc., Cambridge, MA | ab12351 | 1:1,000 dilution (Total HSP27) |
| Phosphorylated HSP27 (Ser85) | Abcam Inc., Cambridge, MA | ab5594 | 1:1,000 dilution HSP27 was phosphorylated at Ser85 |
| Lipofectamine® RNAiMAX reagent | Invitrogen, Carlsbad, CA | 13-778-075 | Transfection reagent |
| Phosphorylated Akt (Ser473) | Cell Signaling Technology, Danvers, MA | No. 4060 | 1:1,000 dilution Akt was phosphorylated at Ser473 (cell survival marker) |
| Non-phosphorylated Akt | Cell Signaling Technology, Danvers, MA | No. 4061 | 1:1,000 dilution (Total Akt) |
| Bcl-2-associated X protein | Cell Signaling Technology, Danvers, MA | No. 4062 | 1:1,000 (anti-apoptotic protein marker) |
| GAPDH | Santa Cruz Biotechnology, Santa Cruz, CA | No. 4063 | 1:1,000 loading control marker (house keeping gene) |
| Horseradish peroxidase-conjugated goat anti-rabbit antibodies | Thermo Fisher Scientific, Inc., Waltham, MA | NCI1460KR | 1:10,000 dilution |
| OPTI-MEM | Invitrogen, Carlsbad, CA | 31985 | reduced serum medium for transfection |
| Image analysis software | Olympus, Inc., Tokyo, Japan | Image-Pro Plus 5.0 | |
| Skimed milk powder | Carl Roth GmbH + Co. KG, Karlstruhe, Germany | T145.2 | |
| Tris | Amresco LCC, Inc. Solon, OH | No-0497 | |
| Sodium Chloride | Amresco LCC, Inc. Solon, OH | No-0241 | |
| Six well culture plate | Thermo Fisher Scientific, Inc., Waltham, MA | 140675 | 35.00 mm diameter / well |
| 24-well culuture dish | Thermo Fisher Scientific, Inc., Waltham, MA | 142475 | |
| Orbital shaker | N-Bioteck, Inc., Seoul, South Korea | NB1015 | |
| Bovine serum albumin | Santa Cruz Biotechnology, Santa Cruz, CA | sc-2323 | |
| BDFACSCantoTM II | BD Biosciences, Franklin Lakes, NJ | Flow cytometry | |
| X-Ray Film | Kodak, Rochester, NY | Medical X-Ray Cassette with Green 400 Screen | |
| western blotting luminol reagent | Santa Cruz Biotechnology, Santa Cruz, CA | sc-2048 | |
| FITC Annexin V Apoptosis Detection Kit I | BD Biosciences, Franklin Lakes, NJ | 556547 |
参考文献
- Dua, H. S., Gomes, J. A., Singh, A. Corneal epithelial wound healing. Br. J. Ophthalmol. 78 (5), 401-408 (1994).
- Estil, S., Primo, E. J., Wilson, G. Apoptosis in shed human corneal cells. Invest. Ophthalmol. Vis. Sci. 41 (11), 3360-3364 (2000).
- Guay, J., et al. Regulation of actin filament dynamics by p38 map kinase-mediated phosphorylation of heat shock protein 27. J. cell. Sci. 110, 357-368 (1997).
- Park, J. W., et al. Differential expression of heat shock protein mRNAs under in vivo glutathione depletion in the mouse retina. Neurosci. Lett. 413 (3), 260-264 (2007).
- Rane, M. J., et al. Heat shock protein 27 controls apoptosis by regulating Akt activation. J. Biol. Chem. 278 (30), 27828-27835 (2003).
- Shin, K. D., et al. Blocking tumor cell migration and invasion with biphenyl isoxazole derivative KRIBB3, a synthetic molecule that inhibits Hsp27 phosphorylation. J. Biol. Chem. 280 (50), 41439-41448 (2005).
- Jain, S., et al. Expression of phosphorylated heat shock protein 27 during corneal epithelial wound healing. Cornea. 31 (7), 820-827 (2012).
- Alekseev, O. M., Richardson, R. T., Alekseev, O., O'Rand, M. G. Analysis of gene expression profiles in HeLa cells in response to overexpression or siRNA-mediated depletion of NASP. Reprod. Biol. Endocrinol. 7, 45 (2009).
- Park, H. Y., Kim, J. H., Lee, K. M., Park, C. K. Effect of prostaglandin analogues on tear proteomics and expression of cytokines and matrix metalloproteinases in the conjunctiva and corea. Exp. Eye. Res. 94 (1), 13-21 (2012).
- Voegeli, T. S., Currie, R. W. siRNA knocks down Hsp27 and increases angiotensin II-induced phosphorylated NF-kappaB p65 levels in aortic smooth muscle cells. Inflamm. Res. 58 (6), 336-343 (2009).
- Shi, B., Isseroff, R. R. Arsenite pre-conditioning reduces UVB-induced apoptosis in corneal epithelial cells through the anti-apoptotic activity of 27 kDa heat shock protein (HSP27). J. Cell. Physiol. 206 (2), 301-308 (2006).
- Shen, E. P., et al. Comparison of corneal epitheliotrophic capacity among different human blood-derived preparations. Cornea. 30 (2), 208-214 (2011).
- Song, I. S., et al. Heat shock protein 27 phosphorylation is involved in epithelial cell apoptosis as well as epithelial migration during corneal epithelial wound healing. Exp Eye Res. 118 (1), 36-41 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。