Method Article
Investigação baseado no RNA de interferência da função da proteína de choque térmico 27 durante a cicatrização de feridas da córnea epitelial
Neste Artigo
Resumo
Herein, we present a protocol to use heat shock protein 27 (HSP27)-specific small interfering RNA to assess the function of HSP27 during corneal epithelial wound healing. RNA interference is the best method for effectively knocking-down gene expression to investigate protein function in various cell types.
Resumo
Small interfering RNA (siRNA) is among the most widely used RNA interference methods for the short-term silencing of protein-coding genes. siRNA is a synthetic RNA duplex created to specifically target a mRNA transcript to induce its degradation and it has been used to identify novel pathways in various cellular processes. Few reports exist regarding the role of phosphorylated heat shock protein 27 (HSP27) in corneal epithelial wound healing. Herein, cultured human corneal epithelial cells were divided into a scrambled control-siRNA transfected group and a HSP27-specific siRNA-transfected group. Scratch-induced directional wounding assays, and western blotting, and flow cytometry were then performed. We conclude that HSP27 has roles in corneal epithelial wound healing that may involve epithelial cell apoptosis and migration. Here, step-by-step descriptions of sample preparation and the study protocol are provided.
Introdução
Células epiteliais da córnea (PEC) são eliminados continuamente em filme lacrimal, enquanto eles são simultaneamente substituído por células do limbo e camadas basais do epitélio da córnea. 1 Vários factores de stress extrínsecos pode induzir a apoptose e descamação do PEC. 2 As proteínas de choque térmico (HSPs) são altamente conservados e podem ser divididos em duas famílias de acordo com o tamanho molecular. 3 a maior família HSP inclui HSP90, HSP70 e HSP60, e a família menor inclui HSP27. 4 a fosforilação de HSP27 é conhecida por desempenhar um papel importante na sobrevivência celular e é necessária para a migração de células devido ao papel desta proteína na remodelação da actina. 07/05 Portanto, uma tentativa para testar o potencial papel da fosforilação em HSP27 migração CEC e a apoptose em um modelo in vitro de reparação epitelial.
RNA de interferência (RNAi) utilizando quer ARN interferentes pequenos ou curtos (siARN) tem GEinteresse nerated tanto em biologia básica e aplicada, uma vez que potencialmente permite a expressão de qualquer gene de interesse a ser knocked-down. 8 Aqui, usamos siRNA específico do HSP27 para avaliar a contribuição de HSP27 para a cicatrização de feridas CEC e apoptose. ARNi métodos tradicionais para o gene knock-down em células utilizam duplexes de ARN sintéticos, incluindo dois oligonucleótidos 21-meros não modificados que podem ser montadas para criar ARNsi. O RNAi siRNA que usamos no presente estudo é um método simples e altamente eficiente para transfectar células, e este reagente trabalha com várias linhas de células imortalizadas. No presente estudo, demonstramos os métodos utilizados para esta análise, incluindo um ensaio de induzida por zero ferida direcional, western blot, ensaio de transfecção siRNA, imunofluorescência e citometria de fluxo.
Protocolo
Linha 1. celular
- Cultura de 10 6 culas imortalizadas-telomerase humana corneanas epiteliais (HCEC) em uma placa de 6 poços (densidade: 1039,9 células / mm 2) numa 37 ° C incubadora com uma atmosfera de CO2 a 5%, utilizando meio de crescimento do epitélio brônquico (BEGM) até atingirem 95% de confluência.
2. Western Blot Analysis após Criando Wounds raspadinhas epiteliais
- Streak uma ponta estéril 200 ul pipeta através da superfície de um poço de confluentes HCEC cultivadas quatro vezes por placa numa câmara de segurança biológica (Classe II, tipo A2) e incubar HCEC separadamente em um 37 ° C incubadora com uma atmosfera de 5% de CO 2 durante 1, 5, 10, 30, 60, e 120 min.
- Utilize uma placa de 6 poços para seis amostras diferentes de acordo com o tempo de incubação após a lesão do epitélio da córnea.
- Lavar feridos HCEC monocamadas três vezes com PBS 1x e, em seguida, adicionar 2,0 ml BEGM a cada poço.
- Retire HCEC usando 2ml de 0,25% de tripsina-ácido etilenodiaminotetracético (EDTA) por poço durante 5 minutos, centrifugar a 900 xg durante 5 min num tubo de 15 ml, e aspirado de tripsina-EDTA, utilizando uma pipeta de 1 ml.
- Suspender HCEC com 1 ml de PBS 1x e transferi-los para um tubo de 1,5 ml.
- Centrífuga HCEC a 10.000 xg durante 15 seg e aspirado de 1x PBS utilizando uma pipeta de 1 ml.
- Ressuspender HCEC em 100 de tampão de lise arrefecido com gelo ul (Tris 10 mM, NaCl 10 mM, EDTA 2 mM, NaF 25 mM, 2 mM Na 3 VO 4, fenilmetanossulfonil fluoreto de 1 mM [FPMS], inibidores de protease [1 uM de pepstatina A, 1 | iM de leupeptina, e 0,1 uM de aprotinina] e 0,5% de Triton X-100 [pH 7]) e misture bem.
- Incubar as células durante 30 min em gelo para induzir lise celular.
- Os lisados Centrifugar a 4 ° C a 10000 xg durante 15 min, e, em seguida, transferir os sobrenadantes para novos tubos de 1,5 ml (90 mL alíquotas) e armazená-las a -80 ° C.
- Determinar as concentrações de proteína total dos lisados celulares utilizando o pr Bradfordensaio otein 9.
- Carregar 30 ug de proteínas de células totais num gel de acrilamida a 10% ou 12% por electroforese em dodecilsulfato de sódio-poliacrilamida gel (SDS-PAGE), e depois por electroforese transferência separada bandas de proteínas a filtros de nitrocelulose com uma corrente de 200 mA durante 1 hora a 4 ° C para usar em ensaios de western blot.
- membranas de filtro em bloco de nitrocelulose com 5% de leite desnatado em solução salina tamponada com Tris com Tween 20 (TBST), durante 1 h, adicionar anticorpos policlonais de coelho primários contra a HSP27 não-fosforilada (diluição 1: 1000) ou anticorpo policlonal primário de coelho contra a HSP27 fosforilado (1 : 1000 de diluição) em 5% de albumina de soro bovino (BSA), e incuba-se as membranas durante a noite a 4 ° C num agitador.
- Detectar bandas imunorreactivas com anticorpos anti-coelho com peroxidase de rábano de cabra conjugado com (1: 10.000 de diluição) em BSA a 5% após a lavagem durante 10 minutos 3 vezes com TBST.
- Incubar a membrana nos reagentes de luminol de Western blotting (6-7 ml por 10 cm × membrana 5 cm) durante 1 min à temperatura ambiente.
- Remover a membrana da solução reagente, remover o excesso de líquido com uma toalha absorvente e coloque em um protetor de folha de plástico.
- Trabalhando em um quarto escuro com uma luz segura, coloque membrana coberta com uma cassete de filme com o lado proteína voltado para cima.
- Coloque um filme de raios-X em cima da membrana e expor durante 1 min.
3. Transfection siRNA Assay 10
- HCEC cultura a 5 x 10 5 células / poço numa placa de 6 cavidades em uma incubadora de 37 ° C com uma atmosfera de CO2 a 5%, utilizando BEGM até atingirem 95% de confluência.
- Dilui-se o reagente de transfecção (2,5 ou 7,5 ul) com 100 ul reduzidas meio de soro para a transfecção (o factor de diluição foi de 41 ou 14,3) e dissolve-se o específico do HSP27 e mexidos ARNsi de controlo em 100 ul de meio de soro reduzido para criar 10 ou 50 nM de -HSP27 específico e mexidos siRNA controle.
- Misturar 100 μ; L com solução de siRNA 100 ul de reagente de transfecção diluída (1: 1) e incuba-se a mistura durante 15 minutos à temperatura ambiente.
- Adicionar os complexos de siRNA-lípido às células. Em seguida, após 4 h mudanças de meios para completar BEGM e incubar as células durante 2 dias a 37 ° C.
- Analise as células transfectadas por transferência de Western, como descrito a partir de secções de 4,1 a 4,7.
4. Ensaio de Western Blot para células transfectadas com ARNsi 11
- Extrair específicos de HSP27 e mexidos controlo HCEC transfectadas com ARNsi numa câmara de segurança biológica usando 100 ul de tampão de lise gelado (Tris 10 mM, NaCl 10 mM, ácido etilenodiaminotetracético 2 mM (EDTA), NaF 25 mM, 2 mM Na 3 VO 4, 1 mM de fluoreto de fenilmetanossulfonilo (PMSF), inibidores de protease, e 0,5% de Triton X-100, pH 7).
- Incubar as células durante 30 min em gelo para induzir lise celular.
- Os lisados pelete a 10000 xg durante 15 min e depois transferir os sobrenadantes para banheira de 1,5 ml frescoes (90 ul Alíquotas) e armazená-los a -80 ° C.
- Determinar as concentrações de proteínas dos lisados celulares utilizando o ensaio de proteína de Bradford 9.
- amostras de carga com quantidades iguais de proteínas celulares totais sobre um gel de acrilamida a 10% ou 12%, submeter o gel de SDS-PAGE e electrof transferir as bandas de proteínas separadas para filtros de nitrocelulose com uma corrente de 200 mA durante 1 hora a 4 ° C a utilização em ensaios de western blot.
- Bloco de membranas de filtro de nitrocelulose com 5% de leite desnatado em solução salina tamponada com Tris com Tween 20 (TBST), durante 1 h, adicionar anticorpos primários contra fosforilada e não fosforilada HSP27 (diluição 1: 1000), Akt fosforilada (diluição 1: 1000), não fosforilada Akt (diluição de 1: 1000, utilizado como um marcador de sobrevivência celular), Bcl-2 associada proteína X (diluição de 1: 1000, usado como uma proteína pro-apoptótica), e gliceraldeído 3-fosfato desidrogenase (GAPDH; 1 : 200 de diluição, utilizados como um controlo de carga) em 5% de albumina de soro bovino (BSA), eincubar as membranas durante a noite a 4 ° C num agitador.
- Detectar bandas imunorreactivas com anticorpos anti-coelho com peroxidase de rábano de cabra conjugado com (1: 10.000 de diluição) em BSA a 5% após a lavagem 3 vezes com TBST, 10 minutos cada lavagem.
- Incubar a membrana nos reagentes de luminol de Western blotting (6-7 ml por 10 cm x 5 centímetros de membrana) durante 1 min à temperatura ambiente.
- Remover a membrana da solução reagente, remover o excesso de líquido com uma toalha absorvente e coloque em um protetor de folha de plástico.
- Trabalhando em um quarto escuro com uma luz segura, coloque a membrana coberta com uma cassete de filme com o lado da proteína voltado para cima.
- Coloque um filme de raios-X em cima da membrana e expor durante 1 min.
5. direcional ferindo Ensaio de Avaliação da migração celular 12 induzida por risco
- Numa câmara de segurança biológica, fazer uma ferida, arrastando uma ponta de pipeta estéril através da superfície de um poço de culturas confluentes deespecíficos do HSP27 transfectadas com ARNsi de controlo ou ARNsi HCEC transfectadas mexidos.
- Imediatamente após o ferimento, lavar as células duas vezes com solução salina tamponada com fosfato 1x (PBS) e mantê-las em culturas BEGM numa incubadora a 37 ° C com uma atmosfera de 5% de CO 2 durante 24 horas após o ferimento.
- Fotografar imagens HCEC usando um microscópio vertical em 100X 24 horas após o ferimento e executar fundo achatamento usando o Filtro comando no software de análise de imagem.
- Usando o comando Selecionar Medidas, definir a área de interesse (AOI) com a mesma forma poligonal tamanho que pode cobrir perpendicularmente a partir de uma extremidade à outra da ferida inicial, e determinar três AOI diferente na área ferida de cada amostra.
- contar automaticamente o número de células em cada campo usando as opções do menu Medida Contagem / Tamanho.
6. Fluxo de Análise de Citometria de apoptose
- Cultura transfectadas com siRNA e específicos de HSP27 controle sHCEC contendo cada 10 nM de ARNsi iARN-transfectado numa concentração de 5 x 10 5 células / poço em placas de 6 poços até as células atingirem 95% de confluência em uma temperatura de 37 ° C incubadora com uma atmosfera de CO2 a 5% em BEGM.
- Retire HCEC utilizando 2 ml de 0,25% de tripsina-EDTA por poço durante 5 minutos, centrifugar a 900 xg durante 5 min num tubo de 15 ml, e aspirado de tripsina-EDTA, utilizando uma pipeta de 1 ml.
- Lavar as células duas vezes com PBS frio e, em seguida, voltar a suspender as células em 1x tampão (HEPES 0,1 M / NaOH, [pH 7,4], NaCl a 1,4 M, e CaCl 2 25 mM) de ligação a uma concentração de 10 6 células / ml.
- Transferir 100 ul de suspensão de células (1 x 10 5 células) num tubo de cultura de 5 mL.
- Adicionam-se 5 ul de fluoresceína conjugado com isotiocianato de Anexina V e iodeto de propídio 5 ul.
- Suavemente Agitar as células e incubar durante 15 min à temperatura ambiente no escuro.
- Adicionar 200 ul de 1x tampão de ligação a cada tubo e analisar as células por um fluxo cytometer dentro de 1 hora.
Resultados
A expressão de HSP27 fosforilada aumentou significativamente a 5, 10, e 30 min após a lesão, em comparação com zero HCEC intacta 13. A análise por Western blot revelou que a expressão de HSP27 fosforilada e fosforilada de Akt foram ambas significativamente reduzida, enquanto que a expressão do Bax foi significativamente aumentada em HCEC transfectadas com ARNsi específico-Hsp27 (Figura 1A-E). A expressão de HSP27 fosforilado foi reduzido em 30% e 40% em 10 nM e 50 nM de específicos de HSP27 células transfectadas com ARNsi, respectivamente, em comparação com células transfectadas com ARNsi de controlo, mas a expressão HSP27 fosforilado não foi reduzida (Figura 1A-B ). Além disso, a expressão de HSP27 não-fosforilado foi reduzida em 20% e 30% em 10 nM e 50 nM de HSP27-específica células transfectadas siRNA, respectivamente, mas a expressão HSP27 não fosforilado não foi reduzida (Figura 1A e C </ Strong>).
O ensaio de ferimento direccional induzida por zero indicaram que às 24 horas após o ferimento, as células transfectadas com ARNsi de HSP27 específicos de a 10 e 50 nM apresentou diminuição da migração (Figura 2). Além disso, HCEC específicos HSP27-transfectadas com ARNsi foram submetidos a morte celular por apoptose e mais necrótica em comparação com o controlo scrambled células transfectadas com ARNsi por citometria de fluxo (Figura 3).
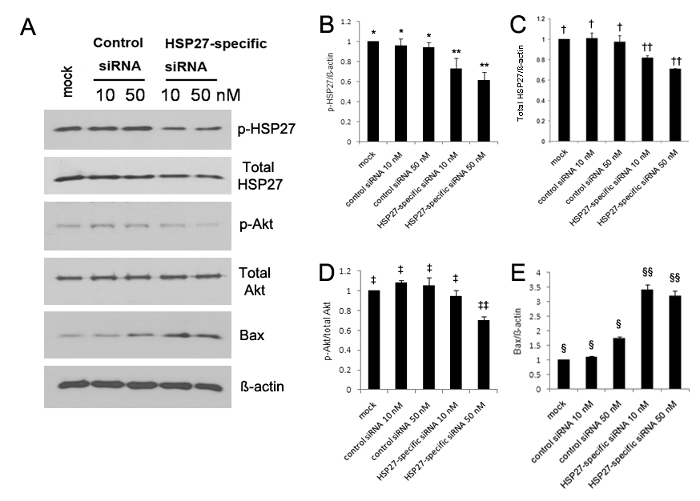
Figura 1. A análise de transferência de Western utilizando anticorpos contra a HSP27 fosforilado (p-HSP27), HSP27 não-fosforilada (não-p-HSP27), Akt fosforilada (P-Akt) como um marcador de sobrevivência celular, não fosforilada Akt (não- P-Akt), Bcl-2eassociated proteína X (Bax) como uma proteína pro-apoptótica, e GAPDH (a). A expressão de HSP27 fosforilado e não fosforilado e Akt fosforilada diminuiu significativamente (B - D), no entanto, a expressão do Bax aumentou significativamente nos HCEC transfectadas com ARNsi específico-Hsp27 (E), em comparação com a observada nas células transfectadas com ARNsi de controlo (todos p <0,05). A expressão de HSP27 fosforilado foi reduzido em 30% e 40% em 10 nM e 50 nM de específicos de HSP27 células transfectadas com ARNsi em comparação com o controlo simulado, respectivamente, mas a expressão de HSP27 fosforilado não foi reduzida em 10 nM e 50 nM de ARNsi de controlo células -transfected (B). **, *; †, ††; ‡, ‡‡; §, §§: uma diferença estatisticamente significativa entre os grupos (p <0,05). As barras de erro representam o desvio padrão (SD). Por favor clique aqui para ver uma versão maior desta figura.
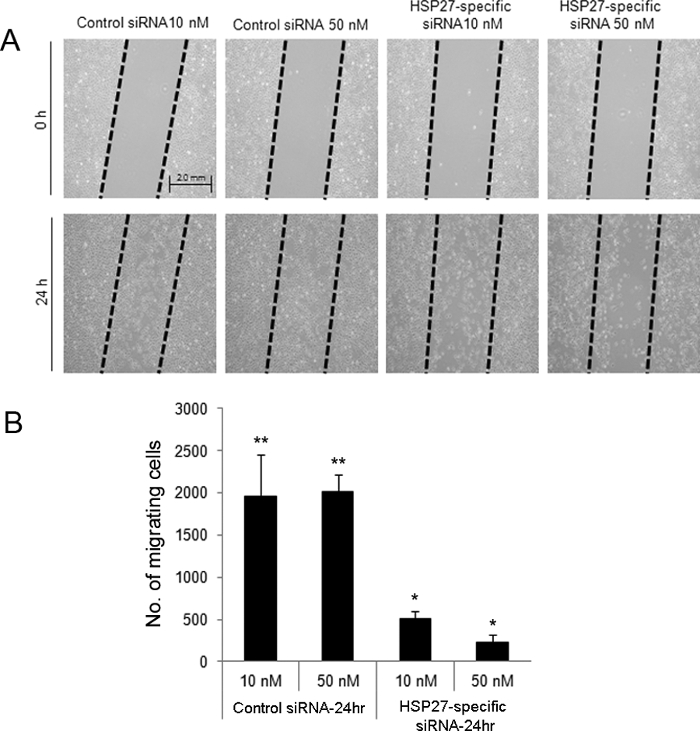
Figura 2. arranhões induzida por ensaio de ferimento direccional para avaliar a migração de células após o ferimento na HCEC transfectadas com ARNsi. Uma ferida zero foi criada em células de controlo e transfectadas com ARNsi específicos de HSP27 (A). As células foram removidas a partir das áreas "arrastados". Em 24 horas após o ferimento, 10 e 50 nM de células transfectadas com ARNsi específico Hsp27-exibiram menor número de células migrantes em comparação com as células transfectadas com ARNsi de controlo 10 e 50 nm (B). ** E * indicam uma diferença estatisticamente significativa entre os grupos (p <0,05). Os dados são apresentados como média ± desvio padrão. Por favor clique aqui para ver uma versão maior desta figura.

Figura 3. citometria de fluxo de 50 nM de ARNsi de controlo mexidos e células específicas HSP27-transfectadas com ARNsi humanos corneanas epiteliais (HCEC) marcado com anexina V e PI (A e B). A percentagem das células totais em quadrantes correspondeu primeiros células apoptóticas (células de anexina V-positivos e PI-negativas, Q4, inferior direito), células tarde apoptose (anexina V-positiva e PI-positivos células, Q2, superior direito), e as células necróticas (células de anexina V-negativo e PI-positivas, Q1, superior esquerdo). HCEC siRNA-transfectar específicos de Hsp27 teve morte celular por apoptose mais e necrótica do que controlar as células transfectadas com siRNA. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
In this present study, we evaluated the potential role of HSP27 in corneal epithelial wounding using in vitro approaches. The critical steps involved siRNA transfection for HSP27 knock-down to observe the function of HSP27 in cells subjected to stress. Notably, a role for HSP27 was revealed by these experiments in epithelial cell migration and apoptosis during corneal epithelial wound healing. Unlike previous studies10 that used rat HSP27-specific siRNA to transfect vascular smooth muscle cells, we used a siRNA transfection technique to modify gene expression in human CECs to effectively knock-down HSP27-specific gene expression and study HSP27 function. Although there were differences in the target sequence that we used as well as in the cell density, final siRNA concentration, and incubation time, the protocol recommended by the manufacturer was explicitly followed. In terms of alternative methods, HSP27 knock-out mouse may be used to show if HSP27 phosphorylation involves epithelial migration and cell apoptosis. However, it is difficult to monitor the change of HSP27 phosphorylation in mouse model, because its phosphorylation occurs in very short period during epithelial wound healing.
There were several limitations to the present study. First, the in vitro environment in which we cultured human CECs certainly differed from the in vivo environment for human CECs, especially regarding cell survival. Second, the siRNA used in this study was not specific to the phosphorylated form of HSP27 as it affected the overall expression levels of HSP27, including both phosphorylated and non-phosphorylated forms.
In the future, a clinical application of these procedures would be to apply HSP27 to live human wounded corneas. We hope that the current findings will help to advance treatments of corneal epithelial tissue damage.
Divulgações
Os autores não têm interesses financeiros ou de propriedade em quaisquer materiais ou métodos mencionados neste estudo.
Agradecimentos
Este estudo foi apoiado pela Research Grant Student (13-14) da Universidade de Ulsan College of Medicine, Seoul, Coreia do Sul e uma subvenção (2014-464) do Instituto Asan para as Ciências da Vida, Seoul, Coreia.
Materiais
| Name | Company | Catalog Number | Comments |
| Biological safety cabinet | CHC LAB Co.Ltd, Daejeon, Republic of Korea | CHC-777A2-06 | Class II, Type A2 |
| Stealth RNAi™ siRNA | Thermo Fisher Scientific, Inc., Waltham, MA | RNAi siRNA; scrambled control-siRNA and HSP27-specific siRNA | |
| BEGMTM | Lonza, Inc., Walkersville, MD | CC-3171, CC4175 | Bronchial epithelium growth medium |
| Protease inhibitor | Sigma-Aldrich, Inc., St. Louis, MO | P8340 ,P7626 | 1 μM Pepstatin A, 1 μM Leupeptin, 0.1 μM Aprotinin |
| Bradford protein assay | Bio-Rad Laboratories, Hercules, CA | #500-0001 | Bradford protein assay |
| Nitrocellulose filters | Amersham, Little Chalfont, UK | RPN3032D | Western blotting membrane |
| Non-phosphorylated HSP27 | Abcam Inc., Cambridge, MA | ab12351 | 1:1,000 dilution (Total HSP27) |
| Phosphorylated HSP27 (Ser85) | Abcam Inc., Cambridge, MA | ab5594 | 1:1,000 dilution HSP27 was phosphorylated at Ser85 |
| Lipofectamine® RNAiMAX reagent | Invitrogen, Carlsbad, CA | 13-778-075 | Transfection reagent |
| Phosphorylated Akt (Ser473) | Cell Signaling Technology, Danvers, MA | No. 4060 | 1:1,000 dilution Akt was phosphorylated at Ser473 (cell survival marker) |
| Non-phosphorylated Akt | Cell Signaling Technology, Danvers, MA | No. 4061 | 1:1,000 dilution (Total Akt) |
| Bcl-2-associated X protein | Cell Signaling Technology, Danvers, MA | No. 4062 | 1:1,000 (anti-apoptotic protein marker) |
| GAPDH | Santa Cruz Biotechnology, Santa Cruz, CA | No. 4063 | 1:1,000 loading control marker (house keeping gene) |
| Horseradish peroxidase-conjugated goat anti-rabbit antibodies | Thermo Fisher Scientific, Inc., Waltham, MA | NCI1460KR | 1:10,000 dilution |
| OPTI-MEM | Invitrogen, Carlsbad, CA | 31985 | reduced serum medium for transfection |
| Image analysis software | Olympus, Inc., Tokyo, Japan | Image-Pro Plus 5.0 | |
| Skimed milk powder | Carl Roth GmbH + Co. KG, Karlstruhe, Germany | T145.2 | |
| Tris | Amresco LCC, Inc. Solon, OH | No-0497 | |
| Sodium Chloride | Amresco LCC, Inc. Solon, OH | No-0241 | |
| Six well culture plate | Thermo Fisher Scientific, Inc., Waltham, MA | 140675 | 35.00 mm diameter / well |
| 24-well culuture dish | Thermo Fisher Scientific, Inc., Waltham, MA | 142475 | |
| Orbital shaker | N-Bioteck, Inc., Seoul, South Korea | NB1015 | |
| Bovine serum albumin | Santa Cruz Biotechnology, Santa Cruz, CA | sc-2323 | |
| BDFACSCantoTM II | BD Biosciences, Franklin Lakes, NJ | Flow cytometry | |
| X-Ray Film | Kodak, Rochester, NY | Medical X-Ray Cassette with Green 400 Screen | |
| western blotting luminol reagent | Santa Cruz Biotechnology, Santa Cruz, CA | sc-2048 | |
| FITC Annexin V Apoptosis Detection Kit I | BD Biosciences, Franklin Lakes, NJ | 556547 |
Referências
- Dua, H. S., Gomes, J. A., Singh, A. Corneal epithelial wound healing. Br. J. Ophthalmol. 78 (5), 401-408 (1994).
- Estil, S., Primo, E. J., Wilson, G. Apoptosis in shed human corneal cells. Invest. Ophthalmol. Vis. Sci. 41 (11), 3360-3364 (2000).
- Guay, J., et al. Regulation of actin filament dynamics by p38 map kinase-mediated phosphorylation of heat shock protein 27. J. cell. Sci. 110, 357-368 (1997).
- Park, J. W., et al. Differential expression of heat shock protein mRNAs under in vivo glutathione depletion in the mouse retina. Neurosci. Lett. 413 (3), 260-264 (2007).
- Rane, M. J., et al. Heat shock protein 27 controls apoptosis by regulating Akt activation. J. Biol. Chem. 278 (30), 27828-27835 (2003).
- Shin, K. D., et al. Blocking tumor cell migration and invasion with biphenyl isoxazole derivative KRIBB3, a synthetic molecule that inhibits Hsp27 phosphorylation. J. Biol. Chem. 280 (50), 41439-41448 (2005).
- Jain, S., et al. Expression of phosphorylated heat shock protein 27 during corneal epithelial wound healing. Cornea. 31 (7), 820-827 (2012).
- Alekseev, O. M., Richardson, R. T., Alekseev, O., O'Rand, M. G. Analysis of gene expression profiles in HeLa cells in response to overexpression or siRNA-mediated depletion of NASP. Reprod. Biol. Endocrinol. 7, 45 (2009).
- Park, H. Y., Kim, J. H., Lee, K. M., Park, C. K. Effect of prostaglandin analogues on tear proteomics and expression of cytokines and matrix metalloproteinases in the conjunctiva and corea. Exp. Eye. Res. 94 (1), 13-21 (2012).
- Voegeli, T. S., Currie, R. W. siRNA knocks down Hsp27 and increases angiotensin II-induced phosphorylated NF-kappaB p65 levels in aortic smooth muscle cells. Inflamm. Res. 58 (6), 336-343 (2009).
- Shi, B., Isseroff, R. R. Arsenite pre-conditioning reduces UVB-induced apoptosis in corneal epithelial cells through the anti-apoptotic activity of 27 kDa heat shock protein (HSP27). J. Cell. Physiol. 206 (2), 301-308 (2006).
- Shen, E. P., et al. Comparison of corneal epitheliotrophic capacity among different human blood-derived preparations. Cornea. 30 (2), 208-214 (2011).
- Song, I. S., et al. Heat shock protein 27 phosphorylation is involved in epithelial cell apoptosis as well as epithelial migration during corneal epithelial wound healing. Exp Eye Res. 118 (1), 36-41 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados