Method Article
basado en la interferencia de ARN Investigación de la Función de la proteína de choque térmico 27 durante la curación de la herida corneal epitelial
En este artículo
Resumen
Herein, we present a protocol to use heat shock protein 27 (HSP27)-specific small interfering RNA to assess the function of HSP27 during corneal epithelial wound healing. RNA interference is the best method for effectively knocking-down gene expression to investigate protein function in various cell types.
Resumen
Small interfering RNA (siRNA) is among the most widely used RNA interference methods for the short-term silencing of protein-coding genes. siRNA is a synthetic RNA duplex created to specifically target a mRNA transcript to induce its degradation and it has been used to identify novel pathways in various cellular processes. Few reports exist regarding the role of phosphorylated heat shock protein 27 (HSP27) in corneal epithelial wound healing. Herein, cultured human corneal epithelial cells were divided into a scrambled control-siRNA transfected group and a HSP27-specific siRNA-transfected group. Scratch-induced directional wounding assays, and western blotting, and flow cytometry were then performed. We conclude that HSP27 has roles in corneal epithelial wound healing that may involve epithelial cell apoptosis and migration. Here, step-by-step descriptions of sample preparation and the study protocol are provided.
Introducción
Las células epiteliales corneales (CEC) se desprenden continuamente en la película lagrimal, mientras que se sustituyen de forma simultánea por las células desde el limbo y capas basales epiteliales corneales. 1 Varios factores estresantes extrínsecos pueden inducir la apoptosis y la descamación de CECs. 2 Las proteínas de choque térmico (HSPs) están muy conservadas y se puede dividir en dos familias según su tamaño molecular. 3 la familia HSP más grande incluye HSP90, HSP70, y Hsp60, y la familia más pequeña incluye HSP27. 4 la fosforilación de HSP27 se sabe que juega un papel importante en la supervivencia celular y es necesario para la migración celular a causa del papel de esta proteína en la remodelación de la actina. 5-7 por lo tanto, hemos intentado probar el posible papel de la fosforilación de HSP27 en la migración de CEC y la apoptosis en un modelo in vitro de la curación de heridas epiteliales.
ARN de interferencia (RNAi), utilizando tanto las pequeñas o cortas ARN de interferencia (siRNA) tiene generated interés tanto en la biología básica y aplicada, ya que potencialmente permite la expresión de cualquier gen de interés para ser derribado. 8 En esto, hemos utilizado siRNA-HSP27 específico para evaluar la contribución de HSP27 para la cicatrización de heridas CCA y la apoptosis. Los métodos tradicionales de ARNi para genes knock-down en células utilizan dúplex de ARN sintéticos, incluyendo dos oligonucleótidos 21-mer no modificados que se pueden ensamblar para crear siRNAs. La RNAi siRNA que hemos utilizado en el presente estudio es un método simple y altamente eficaz para transfectar células, y este reactivo trabaja con diversas líneas de células inmortalizadas. En el presente estudio, se demuestra los métodos utilizados para este análisis, incluyendo un ensayo de cero inducida por la herida direccional, el Western Blot, ensayo de transfección siRNA, ensayo de inmunofluorescencia y citometría de flujo.
Protocolo
1. Línea celular
- Cultura 10 6 células telomerasa inmortalizado humanos corneales epiteliales (HCECs) en una placa de 6 pocillos (densidad: 1039,9 células / mm 2) en una incubadora a 37 ° con una atmósfera 5% de CO 2 utilizando medio de crecimiento epitelio bronquial (BEGM) hasta que alcanzan 95% de confluencia.
2. Análisis de Western Blot después de crear heridas epiteliales de Scratch
- Streak una punta estéril de 200 l pipeta sobre la superficie de un pozo de confluentes HCECs cultivadas cuatro veces al plato en una cabina de seguridad biológica (Clase II, Tipo A2) e incubar HCECs por separado en una incubadora a 37 ° con una atmósfera con 5% de CO 2 para 1, 5, 10, 30, 60, y 120 min.
- Utilice una placa de 6 pocillos para seis muestras diferentes de acuerdo con el tiempo de incubación después de la herida epitelial corneal.
- Lavar las monocapas HCEC heridos tres veces con 1 x PBS y luego añadir 2,0 ml BEGM a cada pocillo.
- Separar HCECs utilizando 2ácido ml 0,25% de tripsina-etilendiaminotetraacético (EDTA) por pocillo durante 5 min, centrifugar a 900 xg durante 5 min en un tubo de 15 ml, y aspirado de tripsina-EDTA usando una pipeta de 1 ml.
- Suspender HCECs con 1 ml de PBS 1x y transferirlos a un tubo de 1,5 ml.
- Centrifugar HCECs a 10.000 xg durante 15 seg y aspirado de 1x PBS utilizando una pipeta de 1 ml.
- Resuspender HCECs en 100 l de tampón de lisis enfriado en hielo (Tris 10 mM, NaCl 10 mM, EDTA 2 mM, NaF 25 mM, 2 mM Na 3 VO 4, 1 mM fluoruro de fenilmetanosulfonilo [PMSF], inhibidores de la proteasa [1 M de pepstatina A, 1 leupeptina mu M, y 0,1 M de aprotinina] y 0,5% de Triton X-100 [pH 7]) y mezclar bien.
- Se incuban las células durante 30 min en hielo para inducir la lisis celular.
- lisados centrifugar a 4ºC a 10.000 xg durante 15 min, y luego transferir los sobrenadantes a nuevos tubos de 1,5 ml (90 ml de alícuotas) y almacenar a -80 ° C.
- Determinar las concentraciones de proteína total de lisados celulares utilizando el pr BradfordOtein ensayo. 9
- Cargar 30 g de proteínas celulares totales en un gel de acrilamida al 10% o 12% para electroforesis de dodecilsulfato de sodio-gel de poliacrilamida (SDS-PAGE), y luego por electroforesis de transferencia separados bandas de proteínas a filtros de nitrocelulosa con una corriente de 200 mA durante 1 hora a 4 ° C para utilizar en ensayos de Western blot.
- membranas de filtro de bloque de nitrocelulosa con un 5% de leche desnatada en solución salina tamponada con Tris con Tween 20 (TBST) durante 1 hora, añadir anticuerpos policlonales de conejo primaria contra HSP27 no fosforilada (dilución 1: 1.000) o el anticuerpo policlonal de conejo primaria contra fosforilada HSP27 (1 : 1000 dilución) en 5% de albúmina de suero bovino (BSA), y se incuban las membranas durante la noche a 4 ° C en un agitador.
- Detectar bandas inmunorreactivas utilizando anticuerpos anti-conejo conjugado con peroxidasa de rábano picante de cabra (1: 10.000 de dilución) en BSA al 5% después del lavado durante 10 minutos 3 veces con TBST.
- Incubar la membrana en los reactivos de transferencia de Western de luminol (6-7 ml por cada 10 cm × 5 cm de membrana) durante 1 min a temperatura ambiente.
- Retire la membrana de la solución de reactivo, eliminar el exceso de líquido con una toalla absorbente, y coloque en un protector de hojas de plástico.
- Trabajar en un cuarto oscuro con una luz de seguridad, colocar la membrana cubierto en un casete de película con el lado de la proteína hacia arriba.
- Colocar una película de rayos X en la parte superior de la membrana y exponer durante 1 min.
3. Ensayo de transfección siRNA 10
- HCECs de cultivo a 5 x 10 5 células / pocillo en una placa de 6 pocillos en una incubadora a 37 ° con una atmósfera 5% de CO 2 usando BEGM hasta que alcanzan 95% de confluencia.
- Diluir el reactivo de transfección (2,5 o 7,5 l) con 100 l reducción de medio de suero para la transfección (el factor de dilución fue de 41 o 14.3) y disolver la HSP27-específica y revueltos siRNA control en 100 l medio con suero reducido a crear 10 o 50 nM de -HSP27 específico y revueltos siRNA control.
- Mezclar 100 μ; Solución siRNA l con 100 l de reactivo de transfección diluido (relación 1: 1) y se incuba la mezcla durante 15 min a temperatura ambiente.
- Añadir los complejos lípido-siRNA para las células. A continuación, después de 4 horas de cambio de los medios de comunicación para completar BEGM e incubar las células durante 2 días a 37 ° C.
- Analizar las células transfectadas por el Western Blot, como se describe a partir de las secciones 4.1 a 4.7.
4. Western Blot ensayo para células transfectadas con siRNA 11
- Extraer-HSP27 específico y revueltos de control HCECs siRNA-transfectadas en una cabina de seguridad biológica usando 100 l de tampón de lisis enfriado en hielo (Tris 10 mM, NaCl 10 mM, 2 mM de ácido etilendiaminotetraacético (EDTA), NaF 25 mM, 2 mM Na 3 VO 4, 1 mM de fluoruro de fenilmetanosulfonilo (PMSF), inhibidores de la proteasa, y 0,5% de Triton X-100, pH 7).
- Se incuban las células durante 30 min en hielo para inducir la lisis celular.
- lisados de pellets a 10.000 xg durante 15 min y luego transferir los sobrenadantes de bañera fresca 1,5 mlES (90 l alícuotas) y almacenar a -80 ° C.
- Determinar las concentraciones de proteína de los lisados celulares utilizando el ensayo de proteínas de Bradford. 9
- Cargar las muestras con cantidades iguales de proteínas totales de células en un gel de acrilamida al 10% o 12%, siempre que el gel SDS-PAGE y electroforesis transferir las bandas de proteínas separadas a filtros de nitrocelulosa con una corriente de 200 mA durante 1 hora a 4 ° C hasta utilizar en ensayos de Western blot.
- Bloque membranas de filtro de nitrocelulosa con 5% de leche desnatada en solución salina tamponada con Tris con Tween 20 (TBST) durante 1 hora, añadir anticuerpos primarios contra fosforilada y no fosforilada HSP27 (dilución 1: 1000), Akt fosforilada (dilución 1: 1000), no fosforilada Akt (dilución 1: 1000, que se utiliza como marcador de la supervivencia celular), asociada a Bcl-2 de proteínas X (dilución 1: 1000, que se utiliza como una proteína pro-apoptótica), y gliceraldehído 3-fosfato deshidrogenasa (GAPDH; 1 : dilución 200, que se utiliza como control de carga) en 5% de albúmina de suero bovino (BSA), yincubar las membranas durante la noche a 4 ° C en un agitador.
- Detectar bandas inmunorreactivas utilizando anticuerpos anti-conejo conjugado con peroxidasa de rábano picante de cabra (1: 10.000 de dilución) en BSA al 5% después de lavar 3 veces con TBST, 10 minutos cada lavado.
- Incubar la membrana en los reactivos de transferencia de Western de luminol (6-7 ml por 10 cm × 5 cm de membrana) durante 1 min a temperatura ambiente.
- Retire la membrana de la solución de reactivo, eliminar el exceso de líquido con una toalla absorbente, y coloque en un protector de hojas de plástico.
- Trabajar en un cuarto oscuro con una luz de seguridad, colocar la membrana de cubierta en una casete de película con el lado de la proteína hacia arriba.
- Coloque película de rayos X en la parte superior de la membrana y exponer para 1 min.
5. rasguño inducida direccional hiriente Ensayo de Evaluación de la migración celular 12
- En una cabina de seguridad biológica, hacer una herida arrastrando una punta de pipeta estéril a través de la superficie de un pozo de cultivos confluentes de-HSP27 siRNA transfectadas o HCECs siRNA transfectadas de control revueltos.
- Inmediatamente después de la herida, se lavan las células dos veces con solución salina tamponada con fosfato 1x (PBS) y mantenerlas en cultivos BEGM en una incubadora a 37 ° con una atmósfera 5% de CO 2 durante 24 horas después de la herida.
- Fotografiar imágenes HCEC utilizando un microscopio vertical con un aumento de 100X de 24 horas después de la lesión y realizar aplanamiento fondo usando el filtro comando en el software de análisis de imágenes.
- Usando el comando Seleccionar mediciones, definir el área de interés (AOI), con la misma forma poligonal tamaño que puede cubrir perpendicularmente desde un extremo al otro de la herida inicial, y determinar tres diferentes AOI en la zona de la herida de cada muestra.
- contar automáticamente el número de células en cada campo usando las opciones del menú de medida de recuento / Tamaño.
6. Análisis de Flujo Citometría de apoptosis
- Cultura HSP27-siRNA-transfectadas y control sHCECs que contienen cada uno 10 nM siRNA RNAi-transfectó a una concentración de 5 x 10 5 células / pocillo en placas de 6 pocillos hasta que las células alcanzan la confluencia 95% en una incubadora a 37 ° con una atmósfera 5% de CO 2 en BEGM.
- Separar HCECs utilizando 2 ml 0,25% de tripsina-EDTA por pocillo durante 5 min, centrifugar a 900 xg durante 5 min en un tubo de 15 ml, y aspirado de tripsina-EDTA usando una pipeta de 1 ml.
- Lavar las células dos veces con PBS frío y luego volver a suspender las células en 1x tampón (0,1 M de HEPES / NaOH [pH 7,4], 1,4 M NaCl, y CaCl 25 mM 2) de unión a una concentración de 10 6 células / ml.
- Transferencia de 100 l suspensión de células (1 x 10 5 células) en un tubo de cultivo de 5 ml.
- Añadir 5 l isotiocianato de fluoresceína conjugado de Anexina V y 5 l de yoduro de propidio.
- vórtice suavemente las células y se incuba durante 15 min a temperatura ambiente en la oscuridad.
- Añadir 200 l de tampón de unión 1X a cada tubo y analizar las células mediante un flujo cytometer dentro de 1 hora.
Resultados
La expresión de HSP27 fosforilada aumentó significativamente a los 5, 10, y 30 min después de cero hiriendo compara con HCECs ilesos 13. El análisis de transferencia Western reveló que la expresión de HSP27 fosforilada y fosforilada Akt se redujo significativamente tanto, mientras que la expresión de Bax fue significativamente mayor en HCECs siRNA transfectadas-HSP27 específica (Figura 1A-E). La expresión HSP27 fosforilada se redujo en un 30% y 40% en 10 nM y 50 nM de HSP27 específica células siRNA-transfectadas, respectivamente, en comparación con las células siRNA transfectadas de control, pero la expresión HSP27 fosforilada fue no reducida (Figura 1A-B ). Además, la expresión HSP27 no fosforilada se redujo en un 20% y 30% en 10 nM y 50 nM de HSP27 específica células transfectadas siRNA, respectivamente, pero la expresión HSP27 no fosforilada no se redujo (Figura 1A y C </ Strong>).
El ensayo heridas direccional cero inducida indicó que a las 24 horas después de la lesión, las células HSP27-siRNA-transfectadas a las 10 y 50 nM presentaron menor migración (Figura 2). Por otra parte, HCECs HSP27-siRNA transfectadas se sometieron a la muerte celular más apoptóticas y necróticas en comparación con control mezclado células siRNA transfectadas mediante citometría de flujo (Figura 3).
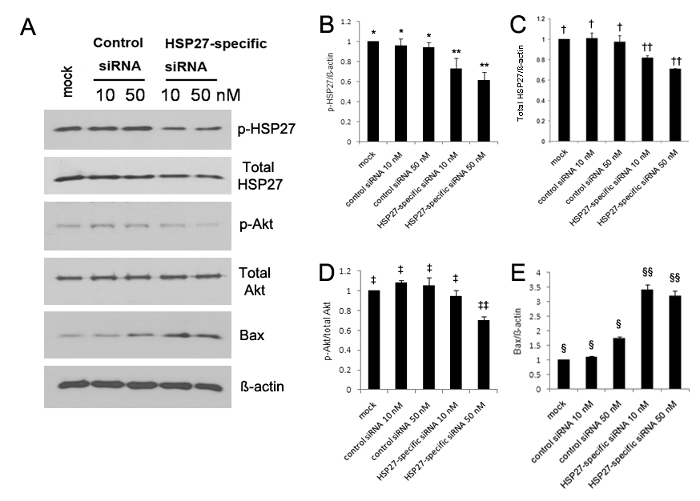
Figura 1. Análisis de transferencia de Western usando anticuerpos contra HSP27 fosforilada (p-HSP27), HSP27 no fosforilados (no-p-HSP27), Akt fosforilada (p-Akt) como marcador-supervivencia de la célula, no fosforilados Akt (no p-Akt), 2eassociated-Bcl proteína X (Bax) como una proteína pro-apoptótica, y GAPDH (a). La expresión de HSP27 fosforilada y no fosforilada y Akt fosforilada disminuyó significativamente (B - D), sin embargo, la expresión de Bax aumentó significativamente en los HCECs siRNA transfectadas-HSP27 específica (E), en comparación con la observada en las células transfectadas de control siRNA-(todos p <0,05). La expresión de HSP27 fosforilada se redujo en un 30% y un 40% en 10 nm y 50 nm de HSP27-específica células siRNA-transfectadas en comparación con el control de simulacro, respectivamente, pero la expresión de HSP27 fosforilada no se redujo en 10 nM y 50 nM de ARNsi de control células transfectadas (B). **, *; †, ††; ‡, ‡‡; §, §§: una diferencia estadísticamente significativa entre los grupos (p <0,05). Las barras de error representan la desviación estándar (DE). Por favor, haga clic aquí para ver una versión más grande de esta figura.
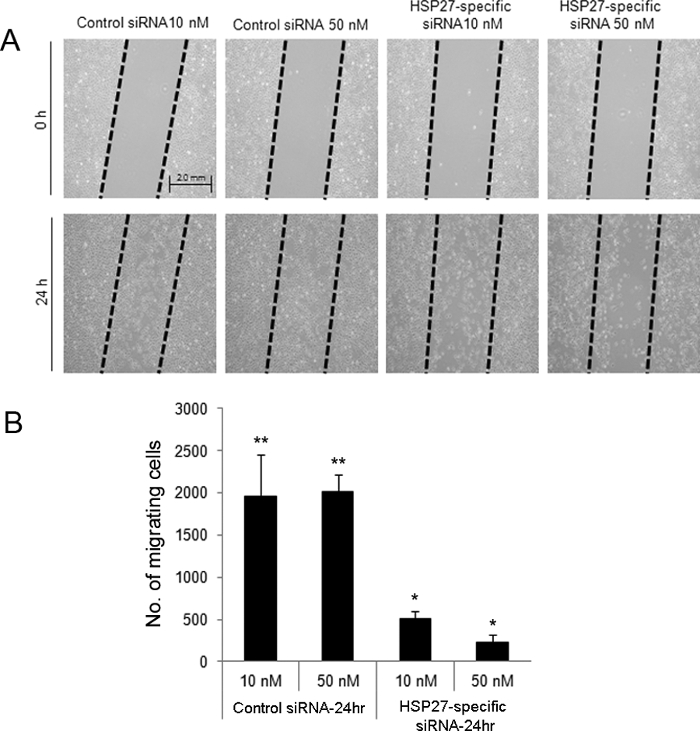
Figura 2. arañazos de ensayo induce lesiones direccional para evaluar la migración de células después de la herida en HCECs siRNA-transfectadas. Una herida cero fue creado en el control y las células transfectadas siRNA-HSP27-específicas (A). Las células se retiran de las áreas "arrastrados '. A las 24 h después de la herida, 10 y 50 nM de ARNsi células transfectadas-HSP27 específico exhibió los números más bajos de migración de las células en comparación con las células transfectadas siRNA-10 y 50 de control nM (B). ** Y * indican una diferencia estadísticamente significativa entre los grupos (p <0,05). Los datos se muestran como media ± desviación estándar. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 3. citometría de flujo de 50 nM de control mezclado siRNA y las células HSP27-siRNA transfectadas humanos corneales epiteliales (HCECs) marcadas con anexina V y PI (A y B). El porcentaje del total de células en los cuadrantes correspondió a principios de células apoptóticas (células anexina V-positivos y PI-negativas, Q4, parte inferior derecha), las células finales de apoptosis (anexina V-positivo y PI-positivo células, Q2, parte superior derecha), y células necróticas (células anexina V y PI-negativo-positivo, Q1, arriba a la izquierda). HCECs siRNA-transfectar-HSP27 específica tenían más la muerte celular apoptótica y necrótica de las células de control siRNA-transfectadas. Por favor, haga clic aquí para ver una versión más grande de esta figura.
Discusión
In this present study, we evaluated the potential role of HSP27 in corneal epithelial wounding using in vitro approaches. The critical steps involved siRNA transfection for HSP27 knock-down to observe the function of HSP27 in cells subjected to stress. Notably, a role for HSP27 was revealed by these experiments in epithelial cell migration and apoptosis during corneal epithelial wound healing. Unlike previous studies10 that used rat HSP27-specific siRNA to transfect vascular smooth muscle cells, we used a siRNA transfection technique to modify gene expression in human CECs to effectively knock-down HSP27-specific gene expression and study HSP27 function. Although there were differences in the target sequence that we used as well as in the cell density, final siRNA concentration, and incubation time, the protocol recommended by the manufacturer was explicitly followed. In terms of alternative methods, HSP27 knock-out mouse may be used to show if HSP27 phosphorylation involves epithelial migration and cell apoptosis. However, it is difficult to monitor the change of HSP27 phosphorylation in mouse model, because its phosphorylation occurs in very short period during epithelial wound healing.
There were several limitations to the present study. First, the in vitro environment in which we cultured human CECs certainly differed from the in vivo environment for human CECs, especially regarding cell survival. Second, the siRNA used in this study was not specific to the phosphorylated form of HSP27 as it affected the overall expression levels of HSP27, including both phosphorylated and non-phosphorylated forms.
In the future, a clinical application of these procedures would be to apply HSP27 to live human wounded corneas. We hope that the current findings will help to advance treatments of corneal epithelial tissue damage.
Divulgaciones
Los autores no tienen intereses financieros o de propiedad de cualquier material o métodos mencionados en este estudio.
Agradecimientos
Este estudio fue apoyado por la Beca de Investigación para Estudiantes (13-14) de la Universidad de Ulsan College of Medicine, Seúl, Corea y una subvención (2014-464) del Instituto Asan de Ciencias de la Vida, Seúl, Corea.
Materiales
| Name | Company | Catalog Number | Comments |
| Biological safety cabinet | CHC LAB Co.Ltd, Daejeon, Republic of Korea | CHC-777A2-06 | Class II, Type A2 |
| Stealth RNAi™ siRNA | Thermo Fisher Scientific, Inc., Waltham, MA | RNAi siRNA; scrambled control-siRNA and HSP27-specific siRNA | |
| BEGMTM | Lonza, Inc., Walkersville, MD | CC-3171, CC4175 | Bronchial epithelium growth medium |
| Protease inhibitor | Sigma-Aldrich, Inc., St. Louis, MO | P8340 ,P7626 | 1 μM Pepstatin A, 1 μM Leupeptin, 0.1 μM Aprotinin |
| Bradford protein assay | Bio-Rad Laboratories, Hercules, CA | #500-0001 | Bradford protein assay |
| Nitrocellulose filters | Amersham, Little Chalfont, UK | RPN3032D | Western blotting membrane |
| Non-phosphorylated HSP27 | Abcam Inc., Cambridge, MA | ab12351 | 1:1,000 dilution (Total HSP27) |
| Phosphorylated HSP27 (Ser85) | Abcam Inc., Cambridge, MA | ab5594 | 1:1,000 dilution HSP27 was phosphorylated at Ser85 |
| Lipofectamine® RNAiMAX reagent | Invitrogen, Carlsbad, CA | 13-778-075 | Transfection reagent |
| Phosphorylated Akt (Ser473) | Cell Signaling Technology, Danvers, MA | No. 4060 | 1:1,000 dilution Akt was phosphorylated at Ser473 (cell survival marker) |
| Non-phosphorylated Akt | Cell Signaling Technology, Danvers, MA | No. 4061 | 1:1,000 dilution (Total Akt) |
| Bcl-2-associated X protein | Cell Signaling Technology, Danvers, MA | No. 4062 | 1:1,000 (anti-apoptotic protein marker) |
| GAPDH | Santa Cruz Biotechnology, Santa Cruz, CA | No. 4063 | 1:1,000 loading control marker (house keeping gene) |
| Horseradish peroxidase-conjugated goat anti-rabbit antibodies | Thermo Fisher Scientific, Inc., Waltham, MA | NCI1460KR | 1:10,000 dilution |
| OPTI-MEM | Invitrogen, Carlsbad, CA | 31985 | reduced serum medium for transfection |
| Image analysis software | Olympus, Inc., Tokyo, Japan | Image-Pro Plus 5.0 | |
| Skimed milk powder | Carl Roth GmbH + Co. KG, Karlstruhe, Germany | T145.2 | |
| Tris | Amresco LCC, Inc. Solon, OH | No-0497 | |
| Sodium Chloride | Amresco LCC, Inc. Solon, OH | No-0241 | |
| Six well culture plate | Thermo Fisher Scientific, Inc., Waltham, MA | 140675 | 35.00 mm diameter / well |
| 24-well culuture dish | Thermo Fisher Scientific, Inc., Waltham, MA | 142475 | |
| Orbital shaker | N-Bioteck, Inc., Seoul, South Korea | NB1015 | |
| Bovine serum albumin | Santa Cruz Biotechnology, Santa Cruz, CA | sc-2323 | |
| BDFACSCantoTM II | BD Biosciences, Franklin Lakes, NJ | Flow cytometry | |
| X-Ray Film | Kodak, Rochester, NY | Medical X-Ray Cassette with Green 400 Screen | |
| western blotting luminol reagent | Santa Cruz Biotechnology, Santa Cruz, CA | sc-2048 | |
| FITC Annexin V Apoptosis Detection Kit I | BD Biosciences, Franklin Lakes, NJ | 556547 |
Referencias
- Dua, H. S., Gomes, J. A., Singh, A. Corneal epithelial wound healing. Br. J. Ophthalmol. 78 (5), 401-408 (1994).
- Estil, S., Primo, E. J., Wilson, G. Apoptosis in shed human corneal cells. Invest. Ophthalmol. Vis. Sci. 41 (11), 3360-3364 (2000).
- Guay, J., et al. Regulation of actin filament dynamics by p38 map kinase-mediated phosphorylation of heat shock protein 27. J. cell. Sci. 110, 357-368 (1997).
- Park, J. W., et al. Differential expression of heat shock protein mRNAs under in vivo glutathione depletion in the mouse retina. Neurosci. Lett. 413 (3), 260-264 (2007).
- Rane, M. J., et al. Heat shock protein 27 controls apoptosis by regulating Akt activation. J. Biol. Chem. 278 (30), 27828-27835 (2003).
- Shin, K. D., et al. Blocking tumor cell migration and invasion with biphenyl isoxazole derivative KRIBB3, a synthetic molecule that inhibits Hsp27 phosphorylation. J. Biol. Chem. 280 (50), 41439-41448 (2005).
- Jain, S., et al. Expression of phosphorylated heat shock protein 27 during corneal epithelial wound healing. Cornea. 31 (7), 820-827 (2012).
- Alekseev, O. M., Richardson, R. T., Alekseev, O., O'Rand, M. G. Analysis of gene expression profiles in HeLa cells in response to overexpression or siRNA-mediated depletion of NASP. Reprod. Biol. Endocrinol. 7, 45 (2009).
- Park, H. Y., Kim, J. H., Lee, K. M., Park, C. K. Effect of prostaglandin analogues on tear proteomics and expression of cytokines and matrix metalloproteinases in the conjunctiva and corea. Exp. Eye. Res. 94 (1), 13-21 (2012).
- Voegeli, T. S., Currie, R. W. siRNA knocks down Hsp27 and increases angiotensin II-induced phosphorylated NF-kappaB p65 levels in aortic smooth muscle cells. Inflamm. Res. 58 (6), 336-343 (2009).
- Shi, B., Isseroff, R. R. Arsenite pre-conditioning reduces UVB-induced apoptosis in corneal epithelial cells through the anti-apoptotic activity of 27 kDa heat shock protein (HSP27). J. Cell. Physiol. 206 (2), 301-308 (2006).
- Shen, E. P., et al. Comparison of corneal epitheliotrophic capacity among different human blood-derived preparations. Cornea. 30 (2), 208-214 (2011).
- Song, I. S., et al. Heat shock protein 27 phosphorylation is involved in epithelial cell apoptosis as well as epithelial migration during corneal epithelial wound healing. Exp Eye Res. 118 (1), 36-41 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados